|
(21), (22) Заявка: 2001118035/15, 30.11.1999
(24) Дата начала отсчета срока действия патента:
30.11.1999
(30) Конвенционный приоритет:
30.11.1998 US 60/110298
(43) Дата публикации заявки: 20.04.2003
(45) Опубликовано: 20.11.2004
(56) Список документов, цитированных в отчете о
поиске:
WO 89/00576 A1, 26.01.1989. RU 2066324 С1, 10.09.1996. RU 95106639 A1, 20.01.1997.
(85) Дата перевода заявки PCT на национальную фазу:
02.07.2001
(86) Заявка PCT:
US 99/28368 (30.11.1999)
(87) Публикация PCT:
WO 00/32203 (08.06.2000)
Адрес для переписки:
103062, Москва, ул.Покровка, 45, стр.1, агентство “ИНТЭЛС”, пат.пов. О.М.Дьяконовой
|
(72) Автор(ы):
Джудит АРОНХИМЕ (IL),
Клауди СИНГЕР (IL)
(73) Патентообладатель(и):
ТЕВА ФАРМАСЬЮТИКАЛ ИНДАСТРИЗ, ЛТД. (IL)
(74) Патентный поверенный:
Дьяконова Ольга Михайловна
|
(54) ЭТАНОЛЯТ АЗИТРОМИЦИНА, ПРОЦЕСС ПОЛУЧЕНИЯ И СОДЕРЖАЩИЕ ЕГО ФАРМАЦЕВТИЧЕСКИЕ СОСТАВЫ
(57) Реферат:
Изобретение относится к медицине. Описана новая негигроскопическая форма азитромицина, а также способ ее получения путем постепенной кристаллизации азитромицина из этанола при добавлении минимального количества воды с целью образования кристаллов. Раскрываются также фармацевтические составы, содержащие эту новую форму азитромицина. Этанолят азитромицина обладает меньшей гигроскопичностью, чем моногидрат азитромицина. 3 с. и 12 з.п. ф-лы, 1 табл., 2 ил.
Облаcть применения
Настоящее изобретение касается нового этанолята азитромицина, способов его получения и фармацевтических составов, содержащих указанный новый этанолят.
Предпосылки настоящего изобретения
Азитромицин, 9-деоксо-9а-аза-9а-метил-9а-гомоэритромицин А, имеющий формулу
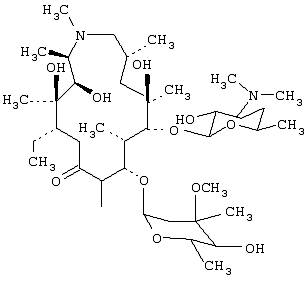
представляет собой полусинтетический макролидный антибиотик, относящийся к эритромицину А, полезному при лечении инфекций, вызванных чувствительными микроорганизмами. Настоящее изобретение обеспечивает новую негигроскопическую форму азитромицина, способ ее получения и фармацевтические составы, содержащие ее.
Азитромицин может быть получен способами, раскрытыми в патенте США N 4517359 и в патенте США No 4474768. Согласно описанию европейского патента ЕП 298650 азитромицин, полученный по этим методикам, представляет собой гигроскопичный моногидрат. Из-за присущей ему гигроскопичной природы этот моногидрат трудно получить, также трудно и сохранять его в форме, обладающей постоянным и воспроизводимым содержанием воды; особенно трудно иметь с ним дело при составлении лекарственных составов. Патент ЕП 298650 описывает дигидрат азитромицина, эта форма обладает меньшей гигроскопичностью, чем известный ранее моногидрат. Способ получения дигидратной формы, описанный в патенте ЕП 298650, представляет собой кристаллизацию из тетрагидрофурана, гексана и воды.
В патенте Китая CN 1093370 описывается кристаллический азитромицин, содержащий 4-6% воды. Утверждается, что эта форма азитромицина менее гигроскопична, чем описанный в патенте ЕП 298650 дигидрат. Способ получения описанной формы азитромицина, раскрытый в патенте CN 10933 70, состоит в кристаллизации из ацетона и воды.
Краткое содержание настоящего изобретения
Настоящее изобретение обеспечивает новый этанолят азитромицина, менее гигроскопичный, чем моногидрат азитромицина. Указанный новый этанолят содержит этанол в количестве от приблизительно 1,5% до приблизительно 3% и воду в количестве от приблизительно 2% до приблизительно 4%.
Настоящее изобретение обеспечивает также способ получения этанолята азитромицина, включающий стадии: растворения азитромицина в этаноле; добавления воды к полученному раствору азитромицина так, чтобы началась кристаллизация указанного азитромицина и чтобы образовалась суспензия, и выделения образовавшихся кристаллов азитромицина.
Настоящее изобретение обеспечивает также фармацевтический состав, содержащий терапевтическое количество этанолята азитромицина в соответствии с настоящим изобретением, а также фармацевтически приемлемый носитель.
Краткое описание чертежей
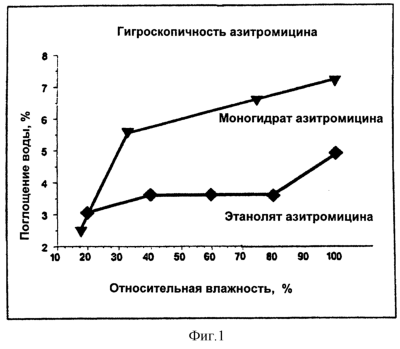
На фиг.1 приведено сравнение гигроскопичности этанолята азитромицина по настоящему изобретению и гигроскопичности моногидрата азитромицина в определенном диапазоне относительной влажности на основе данных из патента ЕП 298650.
Фиг.2 представляет собой порошковую дифракционную рентгенограмму, полученную с использованием характеристического рентгеновского излучения этанолята азитромицина по настоящему изобретению.
Подробное описание настоящего изобретения
Настоящее изобретение раскрывает новый этанолят азитромицина, обладающий меньшей гигроскопичностью, чем известный ранее моногидрат, и содержащий этанол в количестве от приблизительно 1,5% до приблизительно 3% и воду в количестве от приблизительно 2% до приблизительно 4%. Предпочтительно, чтобы содержание этанола составляло от приблизительно 1,5% до приблизительно 2,5%. Предпочтительно, чтобы содержание воды составляло от приблизительно 2,5% до приблизительно 3,5%. Сравнение гигроскопичности этанолята по настоящему изобретению и моногидрата азитромицина можно найти на фиг.1.
В процессе получения этанолята азитромицина по настоящему изобретению используется тот факт, что для азитромицина вода является более плохим растворителем, чем этанол, поэтому добавление воды к раствору азитромицина в этаноле вызывает кристаллизацию. К тому же кристаллизации способствует нагревание раствора азитромицина в этаноле, проводимое в присутствии воды.
В соответствии с особенностями процесса по настоящему изобретению азитромицин растворяют в абсолютном этаноле при весовом соотношении этанола и азитромицина, составляющем приблизительно 2,5:1. Процесс проводят в диапазоне температур от приблизительно 10°С до приблизительно 80°С, предпочтительно от приблизительно 20°С до приблизительно 30°С. Добавляется минимальное количество воды, а именно не меньше чем 20% по весу относительно этанола (предпочтительно от приблизительно 6% до приблизительно 16%). Этот раствор медленно нагревают при постоянном градиенте температур в течение времени от приблизительно 2 ч до приблизительно 18 ч (предпочтительно от приблизительно 3 ч до приблизительно 8 ч). При этом к концу этого первого интервала времени достигается максимальная температура, составляющая от приблизительно 30°С до приблизительно 80°С (предпочтительно от приблизительно 40°С до приблизительно 60°С). Кристаллизация начинается в температурном интервале, составляющем приблизительно 30-45°С. На протяжении всего первого интервала времени содержание воды в указанном растворе постепенно растет, но это происходит до концентрации не более чем приблизительно 50%.
К концу указанного первого интервала времени получают суспензию, которую выдерживают при максимальной температуре на протяжении второго промежутка времени, составляющего от приблизительно 1 ч до приблизительно 18 ч, предпочтительно от приблизительно 1 ч до приблизительно 4 ч. В течение этого второго промежутка времени добавляют дополнительное количество воды, чтобы завершить процесс кристаллизации.
Полученную к концу указанного второго промежутка времени суспензию охлаждают при постоянном градиенте температур в течение третьего интервала времени, составляющего от приблизительно 1 ч до приблизительно 18 ч, предпочтительно от приблизительно 2 ч до приблизительно 4 ч; при этом достигается конечная температура, равная приблизительно 20°С. Получившийся в результате осадок собирают фильтрованием и высушивают до постоянного веса. В таблице показано содержание в новом этаноляте азитромицина воды (по данным анализа по Карлу Фишеру) и этанола (по данным газовой хроматографии).

В соответствии с настоящим изобретением новый этанолят азитромицина можно получить в виде фармацевтических составов, особенно полезных при лечении инфекций, вызываемых чувствительными микроорганизмами. Такие составы содержат новый этанолят азитромицина с фармацевтически приемлемыми носителями и/или наполнителями.
Например, эти составы могут быть приготовлены в виде лекарственных средств, предназначенных для орального, парентерального, ректального, трансдермального, буккального или назального введения. Подходящие формы для орального введения включают: таблетки, прессованные пилюли или пилюли с покрытием, драже, маленькие пакеты для разбавления концентрата до первоначальной плотности, твердые или желатиновые капсулы, таблетки для подъязычного применения, сиропы и суспензии. Подходящие формы для парентерального введения включают водные или неводные растворы, эмульсии, а подходящие формы для ректального введения включают суппозитории с гидрофильным или гидрофобным наполнителем. Для местного применения настоящее изобретение обеспечивает известные в этой области мазевые или аэрозольные составы; для трансдермальной доставки обеспечены подходящие и известные в данной технологии системы доставки. Для назальной доставки обеспечиваются подходящие системы аэрозольной доставки, известные в данной технологии.
Подробности эксперимента
Профили гигроскопичности были получены путем выдержки образцов в течение 2 недель в камерах с контролируемой влажностью и последующего анализа образцов на содержания воды по методу Карла Фишера.
Хроматограммы получали с помощью газового хроматографа Hewlett-Packard 5890.
Порошковые дифракционные рентгенограммы были получены известным методом при использовании рентгеновского порошкового дифрактометра Philips с гониометром модели 1050/70 при скорости сканирования 2°/мин и использовании излучения Cu с длиной волны  =1,5418. =1,5418.
Настоящее изобретение будет более понятным из приведенных далее примеров. Однако эта примеры иллюстрируют, но не ограничивают настоящее изобретение. Квалифицированные в этой области люди с легкостью поймут, что обсуждаемые специфические методы и результаты для настоящего изобретения являются только иллюстративными, более полно оно будет описано в приведенной ниже формуле изобретения.
Пример 1
Получение этанолята азитромицина
10 г неочищенного азитромицина поместили в трехгорлую 0,25 л колбу с плоским фланцем и двойными стенками, снабженную механической мешалкой, холодильником и термометром и содержащую 30 мл абсолютного этанола при 20°С. Добавили 3 мл воды при 20°С и полученный раствор нагревали при постоянном градиенте температур так, чтобы спустя 4 ч достичь температуры в 55°С. При температуре от 35 до 55°С медленно через постоянные интервалы времени добавляли воду, общий объем которой составил 11 мл. По достижении 55°С полученную в результате суспензию выдерживали при указанной температуре 2 ч, в течение этого времени добавили еще 49 мл воды. Полученную суспензию затем в течение 2 ч охлаждали с 55 до 20°С. Осадок отфильтровали. После высушивания было получено 9 г этанолята азитромицина.
Хотя здесь описаны определенные предпочтительные в настоящее время воплощения настоящего изобретения, людям, квалифицированным в той области, которой принадлежит настоящее изобретение, будет очевидно, что можно осуществить изменения и модификации описанных воплощений, не отступая от сущности и границы настоящего изобретения. Следовательно, подразумевается, что настоящее изобретение ограничено только до той степени, которую требуют пункты приведенной формулы изобретения и применимые нормы права.
Формула изобретения
1. Этанолят азитромицина, содержащий этанол в количестве от 1,5 до 3%.
2. Этанолят по п.1, содержащий воду в количестве от 2 до 4%.
3. Этанолят по п.2, отличающийся тем, что содержание воды в нем составляет от 2,5 до 3,5%.
4. Этанолят по п.1, отличающийся тем, что содержание этанола в нем составляет от 1,5 до 2,5%.
5. Этанолят по п.4, отличающийся тем, что содержание воды в нем составляет от 2 до 4%.
6. Этанолят по п.5, отличающийся тем, что содержание воды в нем составляет от 2,5 до 3,5%.
7. Этанолят азитромицина по любому из пп.1-6, характеризующийся тем, что его порошковая дифракционная рентгенограмма в основном имеет вид, изображенный на фиг.2.
8. Способ получения этанолята азитромицина, включающий стадии получения раствора азитромицина путем растворения азитромицина в этаноле; добавления воды к раствору азитромицина так, чтобы началась кристаллизация азитромицина и образовалась суспензия; и выделения кристаллов азитромицина.
9. Способ по п.8, дополнительно включающий выдержку суспензии при температуре от 30 до 80°С в течение некоторого периода времени, следующую за стадией добавления воды к раствору азитромицина.
10. Способ по п.8, дополнительно включающий добавление дополнительной воды к суспензии, и выдержку суспензии при температуре от 30 до 80°С в течение от 1 до 18 ч, следующие за стадией добавления воды к раствору азитромицина.
11. Способ по п.8, дополнительно включающий охлаждение суспензии до 20°С перед стадией выделения кристаллов азитромицина.
12. Способ по п.8, в котором этанолят азитромицина имеет содержание этанола от 1,5 до 3%.
13. Способ по п.8, в котором этанолят азитромицина имеет содержание воды от 2 до 4%.
14. Способ по п.8, отличающийся тем, что порошковая дифракционная рентгенограмма указанного этанолята азитромицина в основном имеет вид, изображенный на фиг.2.
15. Фармацевтический состав, включающий терапевтически эффективное количество этанолята по п.1 и фармацевтически приемлемый носитель.
РИСУНКИ
MM4A Досрочное прекращение действия патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 01.12.2004
Извещение опубликовано: 27.03.2006 БИ: 09/2006
|