Патент на изобретение №2239639
|
||||||||||||||||||||||||||
(54) АХИРАЛЬНЫЕ P,N-БИДЕНТАТНЫЕ ЛИГАНДЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ
(57) Реферат:
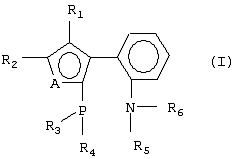
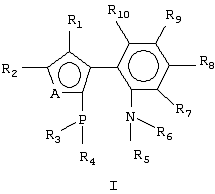
Изобретение относится к новым P,N-бидентатным лигандам формулы (I): где А представляет S или NR, где R представляет C1-C4 алкил, R1 и R2 представляют водород, C1-C4 алкил или R1 и R2 могут быть замкнуты в бензольное кольцо, R3 и R4 представляют C1-C4 алкил или фенил, R5 и R6 представляют C1-C4 алкил. Указанные соединения могут быть использованы в качестве компонентов катализаторов в реакциях аминирования, кросс-сочетания, гидроформилирования, аллильного алкилирования и др. 2 н.п. ф-лы, 1 табл.
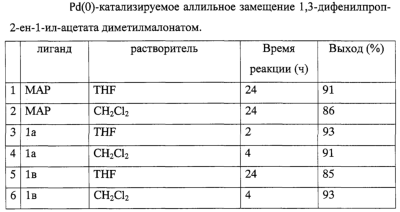
Изобретение относится к новым ахиральным Р,N-бидентатным лигандам гетероарил-арильного типа, способу их получения и области применения. Среди лигандов, используемых для получения комплексов переходных металлов, особое место занимают Р,N-системы. Процессы, катализируемые комплексами переходных металлов с Р,N-бидентатными лигандами, такие как аминирование, кросс-сочетание, аллильное алкилирование, гидроцианирование, гидроформилирование, гидрирование и другие, являются объектом повышенного интереса науки и индустрии. Однако стоит отметить, что эффективность комплексов в каталитических реакциях очень сильно зависит от выбранного процесса и используемого субстрата. Предложенные соединения не известны ни из технической, ни из патентной литературы. Предложены новые ахиральные Р,N-бидентатные лиганды гетероарил-арильного типа общей формулы I где А=S, N, О. R1, R2 – водород; линейный или разветвленный C1-C20 алкил; циклический С3-C8 алкил; фенил; замещенный арил или гетарил, где заместители – линейный или разветвленный C1-C20 алкил, галоген; OR11, где R11 – водород, линейный или разветвленный C1-C20 алкил, фенил, замещенный арил; NR12R13 (R12=R13 или R12 R3, R4 – линейный или разветвленный C1-C20 алкил; циклический С3-C8 алкил; фенил; замещенный арил или гетарил, где заместители – это линейный или разветвленный C1-C20 алкил, галоген; OR15, где R15 – водород, линейный или разветвленный C1-C20 алкил, фенил, замещенный арил; NR16R17 (R16=R17 или R16 R5, R6 – линейный или разветвленный C1-C20 алкил. R7=R8=R9=R10 или R7 Вариантами P,N-лигандов общей формулы I являются Предложен способ синтеза ахиральных Р,N-бидентатных лигандов общей формулы I, включающий две стадии: 1) действие BuLi в Et2O на исходные соединения при температуре -78°С, 2) обработка промежуточных литиевых солей (R3R4)РСl. Предложена область применения ахиральных Р,N-бидентатных лигандов общей формулы I в качестве компонентов катализаторов в реакциях аминирования, кросс-сочетания, гидроформилирования, гидроцианирования, гидрирования, аллильного алкилирования, полимеризации Пример 1. Синтез соединения 1а. К раствору N,N-диметил-2-(5-метил-3-тиенил)анилина (2 г, 0.0092 моль) в Et2O (20 мл) при охлаждении до -70° С в атмосфере аргона прибавили 1.6 М раствор BuLi в гексане (6.1 мл, 0.0097 моль). Реакционную смесь перемешивали при комнатной температуре в течение 4 часов, охладили до -40° С и прибавили раствор Ph2PCl (1.8 мл, 0.0099 моль) в Et2O (5 мл). Охлаждение сняли и оставили перемешиваться на 12 часов. Затем к реакционной смеси прибавили 10% раствор NH4Cl (20 мл), осадок отфильтровали, промыли водой и гексаном. Полученное вещество высушили в высоком вакууме и очистили колоночной хроматографией (силикагель 60, бензол). Растворитель удалили при пониженном давлении. Продукт: белое мелкокристаллическое вещество. Выход: 2.13 г (55%). ЯМР 1H (CDCl3, Пример 2. Синтез соединения Iб. К раствору N,N-диметил-2-(5-метил-3-тиенил)анилина (1 г, 0.0046 моль) в Et2O (10 мл) при охлаждении до -70° С в атмосфере аргона прибавили 1.6 М раствор BuLi в гексане (3 мл, 0.0048 моль). Реакционную смесь перемешивали при комнатной температуре в течение 4 часов, охладили до -40° С и прибавили раствор Вut2РСl (0.89 г, 0.0049 моль) в Et2O (3 мл). Охлаждение сняли и оставили перемешиваться на 12 часов. Затем к реакционной смеси прибавили воду (10 мл), органический слой отделили, водный экстрагировали Et2O. Объединенную органическую фракцию высушили над MgSO4, растворитель удалили при уменьшенном давлении. Остаток перекристаллизовали из пентана. Продукт: желтые кристаллы. Выход: 1 г (60%). ЯМР 1Н (C6D6, Пример 3. Синтез соединения Iв. Соединение получили аналогично соединению Iа, исходя из: N,N-диметил-2-(1-метил-1Н-индол-3-ил)анилина (1.42 г, 0.0057 моль), ТМЭДА (0.9 мл, 0.006 моль), 1.6 М раствора BuLi в гексане (3.8 мл, 0.006 моль), Ph2PCl (1.1 мл, 0.006 моль) и Et2O (20 мл). Полученное вещество очистили колоночной хроматографией (силикагель 60, бензол:EtOAc, 4:1). Продукт: белое мелкокристаллическое вещество. Выход: 1.17 г (47%). ЯМР 1Н (CDCl3, Использование соединений формулы I в качестве лигандов для получения палладиевых комплексов. Исследование каталитической активности палладиевых комплексов в реакции аллильного замещения. Для исследования активности и селективности палладиевых комплексов, полученных на основе Р,N-лигандов формулы I, в качестве модельной реакции была рассмотрена реакция аллильного замещения между 1,3-дифенилпроп-2-ен-1-ил-ацетатом и диметилмалонатом (схема 1). (схема 1). Реакция проводилась при комнатной температуре под аргоном в присутствии основания: гидрида натрия. Металлокомплексный катализатор получали in situ при взаимодействии Pd(dba)2 и P,N-лигандов формулы I в соотношении 1:1.5. В качестве катализатора сравнения был использован MAP: аналог BINAP, в котором вместо одной дифенилфосфиногруппы находится N,N-диметиламиногруппа. Степень превращения и выходы реакции определяли методом 1H ЯМР спектроскопии. Результаты каталитических превращений при взаимодействии 1,3-дифенилпроп-2-ен-1-ил-ацетата и диметилмалоната – в таблице 1. Условия реакции: 0.05 ммоль Pd(dba)2, 0.075 ммоль лиганда, 1 ммоль ацетата, 2 ммоль диметилмалоната, 2 ммоль гидрида натрия, 7 мл растворителя, комнатная температура. Таким образом, комплексы, полученные на основе Р,N-лигандов формулы I, по отношению к уже известным Р,N-лигандам демонстрируют новые свойства.
Формула изобретения
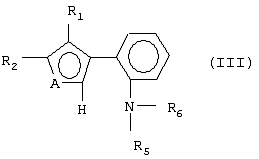
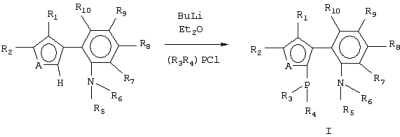
1. Ахиральные Р,N-бидентатные лиганды формулы (I) где А представляет S или NR, где R представляет C1-C4 алкил; R1 и R2 представляют водород, C1-C4 алкил или R1 и R2 могут быть замкнуты в бензольное кольцо; R3 и R4 представляют C1-C4 алкил или фенил; R5 и R6 представляют C1-C4 алкил. 2. Способ получения соединений формулы (I) по п.1, заключающийся в том, что соединение общей формулы (III) где A, R1, R2, R5 и R6 имеют указанные в п.1 значения, подвергают взаимодействию с бутиллитием с последующей обработкой образующегося продукта хлорфосфином формулы (IV) R3R4PCl (IV), где R3 и R4 имеют указанные в п.1 значения.
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 07.02.2005
Извещение опубликовано: 20.02.2007 БИ: 05/2007
|
||||||||||||||||||||||||||

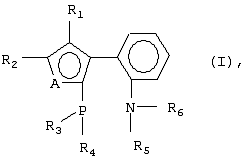
 R13), где R12 и R13 – линейный или разветвленный C1-C20 алкил, арил; SR14, где R14 – линейный или разветвленный C1-C20 алкил; R1 и R2 могут быть замкнуты в замещенное или незамещенное ароматическое кольцо.
R13), где R12 и R13 – линейный или разветвленный C1-C20 алкил, арил; SR14, где R14 – линейный или разветвленный C1-C20 алкил; R1 и R2 могут быть замкнуты в замещенное или незамещенное ароматическое кольцо.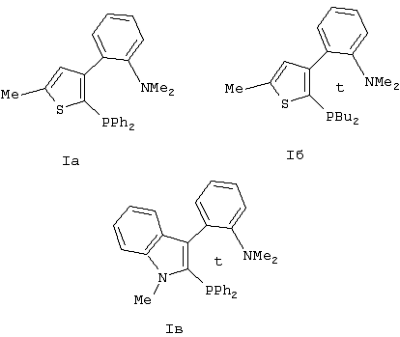
 -олефинов и других реакциях, приводящих к образованию С-С и C-N связей.
-олефинов и других реакциях, приводящих к образованию С-С и C-N связей. , м.д., J/Гц): 2.44 (с., 6Н, Me); 2.55 (с., 3Н, Me); 6.99-7.02 (м., 1Н, -СН=тиофенового кольца); 7.08 (д., 1Н, J=8.1), 7.20 (д., 1H, J=7.3), 7.32-7.51 (гр.м., 12Н) (-СН=, Аr). ЯМР 31Р (CDCl3,
, м.д., J/Гц): 2.44 (с., 6Н, Me); 2.55 (с., 3Н, Me); 6.99-7.02 (м., 1Н, -СН=тиофенового кольца); 7.08 (д., 1Н, J=8.1), 7.20 (д., 1H, J=7.3), 7.32-7.51 (гр.м., 12Н) (-СН=, Аr). ЯМР 31Р (CDCl3,