Патент на изобретение №2239418
|
||||||||||||||||||||||||||
(54) ТВЕРДАЯ ЛЕКАРСТВЕННАЯ ФОРМА НА ОСНОВЕ СУЛЬФАМЕТОКСАЗОЛА И ТРИМЕТОПРИМА
(57) Реферат:
Изобретение относится к медицине, в частности к твердой лекарственной форме на основе сульфаметоксазола и триметоприма, которая представляет собой спрессованные гранулы, покрытые опудривающим слоем из крахмала, стеарата магния и полипласдона. При этом гранулы содержат смесь названных действующих веществ, крахмала, целлюлозы микрокристаллической, подложку на основе поливинилпирролидона. Предложенная форма имеет более высокую прочность, лучшую распадаемость после приема внутрь. 2 з.п. ф-лы, 2 табл.
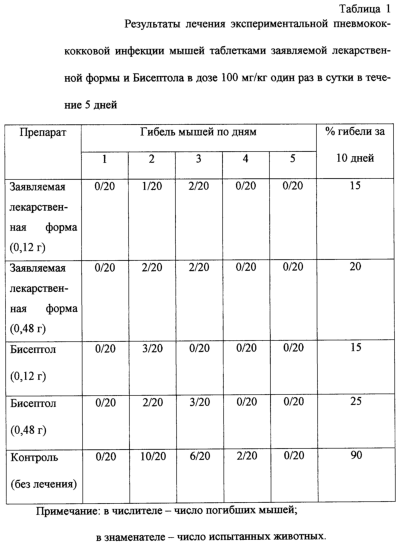
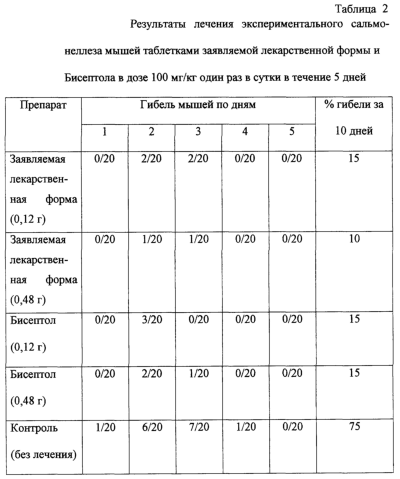
Заявляемое изобретение относится к фармацевтической промышленности, а точнее касается твердой лекарственной формы на основе сульфаметоксазола и триметоприма. Изобретение найдет применение при лечении путем приема лекарственной формы внутрь инфекций дыхательных путей (острые и хронические бронхиты, эпиемы, бронхоэктазия, абсцесс легкого, пневмония), мочевых путей (уретриты, циститы, пиелиты, хронический пиелонефрит, простатит, гонококковый уретрит), желудочно-кишечного тракта (включая тиф, паратиф и холеру), хирургической инфекции и других инфекционных заболеваний. Лекарственную форму на основе сульфаметоксазола и триметоприма, взятых в соотношении 5:1, относят к комбинированным антибактериальным препаратам, она оказывает бактериостатическое действие, обеспечивает высокую бактериоцидную активность в отношении грамположительных и грамотрицательных микроорганизмов, в том числе бактерий, устойчивых к сульфамидным препаратам. Сульфаметоксазол и триметоприм, которые в дальнейшем будем называть “действующее вещество”, как и большинство лекарственных средств, не обладают способностью к прямому таблетированию, поэтому для создания твердой лекарственной формы для перорального введения необходимо применять вспомогательные фармацевтически приемлемые вещества, которые позволяют создать стабильное в течение достаточно долгого времени лекарственное средство, удовлетворяющее фармакопейным требованиям. Известна твердая лекарственная форма на основе сульфаметоксазола и триметоприма для перорального введения, состоящая из опудренных смесью стеарата кальция (магния) и талька и спрессованных между собой гранул, содержащих названное действующее вещество, в смеси с вспомогательными веществами (маннитолом, лактозой, микрокристаллической целлюлозой, тальком) и матрицу из водного или спиртового раствора тилозы, с которой действующее вещество находится в тесном контакте. Общее количество вспомогательных веществ в этой лекарственной форме составляет не менее 40% от ее общей массы (FP, A1, 2321893, МКИ А 61 К 31/635, 1976). Лекарственные формы аналогичного состава выпускаются в Польше под торговым названием “Бисептол-480”, в Швейцарии фирмой Hofmann la Poche под торговым названием “Бактрим”. Однако названные лекарственные формы, равно как и вышеназванная, содержат значительное количество (более 40%) вспомогательных компонентов, часть из которых не разрешена к использованию Государственной Фармакопеей, а другая часть которых, а именно стеарат кальция/магния, тальк, превышает по содержащемуся количеству ограничения, установленные Государственной Фармакопеей СССР XI издания. Наиболее близкой к заявляемой является твердая лекарственная форма, описанная в патенте RU, C1, 2141823, МКИ А 61 К 9/20, 1999, на основе действующего вещества, выполненная в виде опудренных смесью крахмала и стеарата кальция или магния гранул, которые состоят из указанного действующего вещества в смеси с крахмалом и поливинилпирролидоном, и содержит матрицы, выполненные на основе гидролизата крахмала. Данная лекарственная форма содержит 18,82-19,93 мас.% вспомогательных фармацевтически приемлемых веществ от ее общей массы, причем она содержит крахмал в количестве 20,0-22,2% от массы действующих веществ, гидролизат крахмала в количестве 1,1-2,0% от массы действующих веществ, поливинилпирролидон в количестве 0,4-0,6% от массы действующих веществ, стеарат кальция или магния в количестве 0,8-1,0% от массы действующих веществ, гранулы заявляемой лекарственной формы имеют размер от примерно 1 мм до примерно 2 мм. В известной лекарственной форме опудривающий слой содержит крахмал в количестве 5,7-11,65% от массы действующих веществ и стеарат кальция или магния в количестве 0,80-1,0% от массы действующих веществ. Состав таблеток, описанный в прототипе, не обеспечивает быстрого высвобождения лекарственного вещества. Распадаемость составляет 12-14 мин. В основу заявляемого изобретения положена задача путем сочетания вспомогательных веществ, качественно и количественно соответствующих разрешению Государственной Фармакопеи СССР XI издания, создать твердую лекарственную форму на основе сульфаметоксазола и триметоприма, обладающую высокой прочностью, хорошей распадаемостью после приема и хорошим внешним видом. Эта цель достигается тем, что твердая лекарственная форма, включающая спрессованные гранулы, которые содержат сульфаметоксазол и триметаприм в смеси с крахмалом, и ПВП на подложке, и стеарат кальция или магния, дополнительно содержит в составе гранул целлюлозу мелкокристаллическую, подложку из ПВП и имеет в опудривающем слое полипласдон. Согласно заявляемому изобретению целесообразно, чтобы лекарственная форма содержала: крахмал в количестве 14,6% от массы действующего вещества, поливинилпирролидон в количестве 5,3% от массы действующего вещества, полипласдон в количестве 1,25% от массы действующего вещества, стеарат магния в количестве 1,25% от массы действующего вещества, целлюлозу микрокристаллическую в количестве 3,0% от массы действующего вещества. Согласно изобретению целесообразно, чтобы опудривание гранул осуществлялось смесью крахмала, стеарата магния и полипласдона при массовом соотношении компонентов смеси 1:0,22:0,22. Общее содержание вспомогательных веществ в заявляемой композиции составляет 20%, при этом крахмал содержится в количестве 11,33 мас.% (что составляет 14,16% от массы действующих веществ), поливинилпирролидон в количестве 4,27 мас.% (что составляет 5,3% от массы действующих веществ), стеарат магния в количестве 1,0 мас.% (что составляет 1,25% от массы действующих веществ), полипласдон в количестве 1,0 мас.% (что составляет 1,25% от массы действующих веществ), целлюлоза микрокристаллическая в количестве 2,4 мас.% (что составляет 3,0% от массы действующих веществ). Заявляемая твердая лекарственная форма структурно представляет собой спрессованные между собой гранулы, в основном, размером от 1 до 2 мм, содержащие смесь названного действующего вещества и разрыхлители: целлюлозу микрокристаллическую и крахмал, подложку из поливинилпирролидона, с которой названное действующее вещество находится в тесном контакте. Гранулы опудрены составом, способствующим скольжению – смесью крахмала, стеарата магния и полипласдона при массовом соотношении 1:0,22:0,22, а количество крахмала, взятого на опудривание, относится как 1:17,6 к количеству действующего вещества в опудриваемых гранулах. Указанные гранулы спрессованы между собой с образованием таблетки. При этом содержание сульфаметоксазола составляет 400 мг, содержание триметоприма составляет 80 мг. Заявляемая лекарственная форма, рассчитанная на детей, содержит 100 мг сульфаметоксазола и 20 мг триметоприма. Получение заявляемой лекарственной формы может быть осуществлено, в основном, в соответствии с известными приемами, а именно путем смешивания сухого действующего вещества с вспомогательными веществами, наполнителями; перемешивания порошков с гранулирующими жидкостями; собственно гранулирования (протирания влажных масс); сушки; сухого гранулирования, опудривания образованных гранул; спрессования гранул с образованием лекарственной формы заданной конфигурации и размера. Присутствие в гранулах заявляемой лекарственной формы поливинилпирролидона в виде подложки обусловлено анализом экспериментальных данных по техническим характеристикам и качеству заявляемой лекарственной формы. Его наличие обеспечивает ее прочность и увеличивает скорость высвобождения действующего вещества. Наличие в гранулах заявляемой лекарственной формы крахмала и целлюлозы микрокристаллической в значительной степени определяет скорость высвобождения, скорость и полноту всасывания действующего вещества, а также его стабильность. Сочетание названных веществ позволяет придать лекарственной форме, содержащей действующее вещество – сульфаметоксазол и триметоприм, высокую механическую прочность, хорошую распадаемость и фармацевтически безупречный внешний вид – поверхность таблетки ровная, гладкая, без видимых изъянов. Присутствие в заявляемой лекарственной форме стеарата магния обеспечивает эффект скольжения, необходимый на стадии прессования, так как именно достижение эффекта скольжения обуславливает однородность механических и физических свойств в объеме лекарственной формы. Однако, поскольку стеарат затрудняет проникновение пищеварительных жидкостей в пористую структуру лекарственной формы и ухудшает ее распадаемость, гранулы заявляемой лекарственной формы опудрены смесью стеарата магния, крахмала и полипласдона, причем экспериментальные исследования показали, что количество крахмала, взятого на опудривание, должно быть в соотношении 1:17,6 к количеству действующего вещества в составе сухого гранулята, что обеспечивает хорошую прочность и распадаемость лекарственного средства. Заявляемая лекарственная форма быстро распадается (в течение 1,5-5 минут) после приема внутрь на индивидуальные гранулы, которые правильно всасываются стенками желудка. Таким образом исключается переконцентрация действующего вещества на каком-либо участке желудочно-кишечного тракта и обеспечивается равномерное всасывание действующего вещества на обширной поверхности желудочно-кишечного тракта. Лекарственная форма согласно изобретению имеет высокую стабильность и механическую прочность при хранении (механически не разрушается при нагрузке в 6 кг). Кроме того, благодаря незначительному содержанию вспомогательных фармацевтически приемлемых веществ – менее 20% от общей массы лекарственной формы в организм при приеме заявляемой лекарственной формы вводится минимальное количество балластных веществ и значит не происходит засорения желудочно-кишечных путей. Химиотерапевтическая эффективность заявляемой лекарственной формы определялась при экспериментальной инфекции мышей, вызванной Str. Pneumoniae SDN. В опытах использовали белых мышей массой 20-22 г. Суточную культуру пневмококка однократно вводили внутрибрюшинно в 1%-ной пептонной воде в разведении 10-6. Объем заражающей взвеси составлял 0,5 мл. Лечение животных начинали одновременно с заражением путем внутрижелудочного введения заявленной лекарственной формы в дозе 100 мг/кг один раза в сутки в течение 5 дней. Активность препарата оценивали на основании выживаемости и продолжительности жизни животных в течение 10 дней. Исследования заявляемой лекарственной формы проводились в сравнении с таблетками Бисептол фирмы Polfa. Выживаемость инфицированных животных, леченных заявляемой формой, на 10 сутки наблюдения повысилась от 10% (нелеченные мыши) до 75-85%. Эффективность лечения экспериментальной пневмонии у мышей не зависела от вида таблеток. Гибель мышей от пневмонии происходила на 2 и 3 сутки от начала заражения. Эффективность лечения пневмококковой инфекции заявляемой лекарственной формой и таблетками Бисептол была равноценной. Химиотерапевтическая эффективность заявляемой лекарственной формы определялась также при экспериментальной сальмонеллезной инфекции мышей, вызванной однократным введением Salmonella enteritidis 64/39. В опытах использовали белых мышей массой 20-22 г. Заражающая доза микроорганизма составляла 108 микробных клеток на животное, содержащихся в 0,5 мл 0,25%-ного голодного агара. Заявляемую лекарственную форму вводили внутрижелудочно в 2%-ном крахмальном геле непосредственно перед заражением животных в 0,5 мл. Лечение мышей продолжали в течение 5 дней, однократно, в дозе 100 мг/кг. Активность препарата оценивали на основании выживаемости и продолжительности жизни животных в течение 10 дней. Исследования заявляемой лекарственной формы проводились в сравнении с таблетками Бисептол фирмы Polfa. Выживаемость инфицированных животных, леченных заявляемой формой, на 10 сутки наблюдения повысилась от 25% (нелеченные мыши) до 70-85%. Эффективность лечения экспериментального сальмонеллеза у мышей не зависила от вида таблеток. Гибель мышей от пневмонии происходила на 1-3 сутки от начала заражения. Эффективность лечения пневмококковой инфекции заявляемой лекарственной формой и таблетками Бисептол была равноценной. Таким образом, было установлено, что заявляемая лекарственная форма высокоэффективна при экспериментальной пневмококковой и сальмонеллезной инфекции и ее химиотерапевтическая эффективность не отличается от таблеток Бисептол фирмы Polfa (см. табл. 1 и 2). Кроме того, были проведены клинические испытания заявляемой лекарственной формы. Изучались фармакинетические параметры заявляемой лекарственной формы. В работу включены 12 здоровых добровольцев, разбитых на 2 группы (группа А и группа Б). Группы были рандомизированы по полу, возрасту, массе тела. Все испытуемые до включения в исследование были подвергнуты общему медицинскому осмотру и исследованиям. Испытуемые ранее (в течение 2-х недель) не получали аналогичные препараты и не принимали других лекарств во время исследования. Каждый доброволец утром натощак принимал 1 таблетку препарата, которую запивал 100 мл кипяченой воды комнатной температуры. Группа А получала по 1-й таблетке заявляемой лекарственной формы, а группа Б – по 1-й таблетке препарата Бисептол (фирма “POLFA”, Польша). Через 7 дней (период отмывки) группа А получала 1 таблетку Бисептол, а группа Б – 1 таблетку заявляемой лекарственной формы. Таким образом, был применен двойной перекрестный метод исследования. Критерии включения: в исследование включались здоровые добровольцы, возраст 20-50 лет, масса тела 45-85 кг, отсутствие хронических заболеваний и аллергии к препарату. Критерии исключения: в исследование не включались беременные женщины, лица с аллергическими заболеваниями, нарушениями функций почек и печени, желудочно-кишечного тракта, тучные и истощенные люди. Пробы крови в количестве 4-5 мл получали из локтевой вены методом венепункции или из установленного в локтевой вене катетера. Пробы отбирали в стерильные, герметично закрывающиеся одноразовые пластиковые пробирки. Из крови готовили сыворотку обычным способом (инкубация при комнатной температуре 30-45 мин, центрифугирование при 3500 об/мин, 10 мин) и замораживали полученную сыворотку при -18°С. Анализ сыворотки на содержание в ней триметоприма и сульфаметоксазола проводили не позже, чем через 3 суток. Пробы крови отбирали до и через 1,0; 2,0; 3,0; 4,0; 6,0; 8,0 и 24 часа после приема препарата. К 0,5 мл сыворотки крови, полученной обычным способом, приливали 0,05 мл 0,1 н НС1 и 3 мл хлороформа. Смесь энергично встряхивали на вибромиксере “Vortex” в течение 2-х минут, затем центрифугировали при 5500 об/мин 15 минут. Нижний органический слой количественно (2,4 мл) переносили в другую пробирку и упаривали досуха в токе азота при 40°С. Сухой остаток растворяли в 100 мкл подвижной фазы и 50 мкл полученного раствора вводили в хроматографическую колонку. Разделение проводили на колонке “Силасорб SPH-005” зернением 6 мк (2 мм внутреннего диаметра и 250 мм длины), фирма-изготовитель Биохим Мак (МГУ, Москва, Россия). В качестве элюента использовали смесь ацетонитрил: 0,015М раствор однозамещенного фосфата аммония в соотношении 15:85, рН доводили до 5,6 с помощью 84,9% ортофосфорной кислоты. Скорость элюирования составляла 0,3 мл/мин. Время удерживания пика триметоприма в этих условиях составляло примерно 3,5 мин, а сульфаметоксазола 7,5 мин. В качестве детектора был использован переменно-волновой спектрофотометр Шимадзу SPD-6AV (Япония) на оптимальной длине волны, определенной с помощью спектрофотометра Шимадзу УВ-160 271 нм. Концентрации препаратов рассчитывали по методу абсолютной калибровки. Калибровку проводили следующим образом: к 0,5 мл интактной сыворотки добавляли известное количество триметоприма и сульфаметоксазола. Для триметоприма получали концентрации 50, 100, 250, 500 и 1000 нг/мл, а для сульфаметоксазола 0,05; 0,1; 1,0; 5,0; 10,0; 20,0 и 40,0 мкг/мл. Далее обрабатывали и анализировали образцы описанным выше способом. Калибровочные графики в изученном интервале представляли собой прямые линии (гТ=0,9998, rS=0,996), порог чувствительности метода для триметоприма не ниже 20 нг/мл, для сульфаметоксазола 50 нг/мл. Результаты фармакокинетического исследования показали, что препарат из исследуемых форм быстро всасывается в организме. В обоих случаях к трем часам после введения содержание его в крови достигает максимального значения, затем концентрация сульфаметоксазола в крови монотонно убывает и составляет через сутки после приема заявляемой формы и Бисептола 1,6±0,4 и 2,1±0,5 мкг/мл соответственно. Содержание триметоприма в крови после приема заявляемой лекарственной формы и Бисептола также практически не отличается. Препарат также быстро всасывается и также к трем часам после приема препарата достигается его максимальное содержание в крови. Затем концентрация его в крови падает и составляет через сутки после приема исследуемых лекарственных форм 220±14,1 и 261±36,4 нг/мл соответственно. Наблюдаемые различия в концентрациях триметоприма и сульфаметоксазола в крови добровольцев после приема препаратов являются достоверными. Кинетика триметоприма и сульфаметоксазола после приема исследуемых лекарственных форм удовлетворительно описывается однокамерными моделями с внемодельным всасыванием и также одночастевыми моделями. Практически все параметры, характеризующие кинетику циркуляции триметоприма и сульфаметоксазола в организме, их распределение и элиминацию, при приеме изучаемых лекарственных форм достоверно не отличаются. Основные параметры, характеризующие биодоступность сравниваемых лекарственных форм, отличаются также незначительно, причем эти различия связаны с несколько более высокими концентрациями триметоприма в случае применения таблеток производства фирмы “Польфа”. Так, для триметоприма – величина максимальной концентрации (Сmах) при приеме заявляемой лекарственной формы и Бисептола – 1074,0±380,9 и 1260,7±534,9 нг/мл, при времени ее достижения в обоих случаях – 2,92±0,52 и 2,25±0,75 часа соответственно Однако эти значения достоверно не отличаются. Относительная биодоступность триметоприма при приеме заявляемой лекарственной формы и Бисептола составляет 96,7%. Для сульфаметоксазола величина максимальной концентрации (Сmах) при приеме заявляемой лекарственной формы и Бисептола составляет 19,8±4,2 и 18,1±3,4 мкг/мл сыворотки крови, соответственно при времени ее достижения в обоих случаях 2,92±0,5 часа. Относительная биодоступность сульфамтоксазола при приеме заявляемой лекарственной формы составляет 94,6%. Полученные результаты позволяют сделать вывод о хорошем совпадении основных фармакокинетических параметров исследуемых лекарственных форм. Пример 1 Лекарственная таблетка из спрессованных между собой гранул размером 1-2 мм. Каждая гранула содержит смесь сульфаметоксазола и триметоприма (общее количество в таблетке 400 мг и 80 мг соответственно), крахмала (общее количество в таблетке 41,2 мг), целлюлозы микрокристаллической (общее количество в таблетке 14,4 мг), а также каждая гранула содержит подложку из поливинилпирролидона (общее количество в таблетке 25,6 мг), с которыми действующие вещества находятся в тесном контакте. Каждая гранула на своей поверхности имеет опудривающий слой из крахмала (26,8 мг на таблетку), стеарата магния (6,0 мг на таблетку) и полипласдона (6,0 мг на таблетку). Распадаемость таблетки 2 минуты, растворение 101%. Пример 2 Лекарственная таблетка из спрессованных между собой гранул размером 1-2 мм. Каждая гранула содержит смесь сульфаметоксазола и триметоприма (общее количество в таблетке 100 мг и 20 мг соответственно), крахмала (общее количество в таблетке 10,3 мг), целлюлозы микрокристаллической (общее количество в таблетке 3,6 мг), а также каждая гранула содержит подложку из поливинилпирролидона (общее количество в таблетке 6,4 мг), с которыми действующие вещества находятся в тесном контакте. Каждая гранула на своей поверхности имеет опудривающий слой из крахмала (6,7 мг на таблетку), стеарата кальция (1,5 мг на таблетку) и полипласдона (1,5 мг на таблетку). Распадаемость таблетки 1,5 минуты, растворение 101%. Литература 1. Машковский М.Д. Лекарственные средства, Харьков, Торсинг, 1998, стр.305-306. 2. Видаль. Справочник “Лекарственные препараты в России”, 1998.
Формула изобретения
1. Твердая лекарственная форма, включающая спрессованные гранулы, содержащие смесь сульфаметоксазола и триметоприма, крахмал, отличающаяся тем, что в составе гранул дополнительно содержит целлюлозу микрокристаллическую и подложку из поливинилпирролидона и опудривающий слой, состоящий из смеси крахмала, стеарата кальция или магния и полипласдона, при содержании крахмала 14,6%, поливинилпирролидона 5,3%, полипласдона 1,25%, стеарата кальция или магния 1,25%, целлюлозы микрокристаллической 3,0%, взятых в количествах от массы действующих веществ. 2. Лекарственная форма по п.1, отличающаяся тем, что опудривание гранул осуществляется смесью крахмала, стеарата магния и полипласдона при массовом соотношении компонентов смеси 1:0,22:0,22. 3. Лекарственная форма по п.1, отличающаяся тем, что опудривание гранул осуществляется смесью крахмала, стеарата кальция и полипласдона при массовом соотношении компонентов смеси 1:0,22:0,22.
|
||||||||||||||||||||||||||