Патент на изобретение №2235779
|
||||||||||||||||||||||||||
(54) ПОСЛЕДОВАТЕЛЬНОСТЬ ДНК, КОДИРУЮЩАЯ ПОЛИПЕПТИД, КОТОРЫЙ СВЯЗЫВАЕТСЯ С MORT-1 (ВАРИАНТЫ), ПОЛИПЕПТИД (ВАРИАНТЫ) И СПОСОБ ЕГО ПОЛУЧЕНИЯ, ВЕКТОР, СПОСОБ МОДУЛИРОВАНИЯ ДЕЙСТВИЯ ЛИГАНДА FAS-R ИЛИ TNF НА КЛЕТКИ (ВАРИАНТЫ), СПОСОБ ОБРАБОТКИ КЛЕТОК, СПОСОБ ВЫДЕЛЕНИЯ И ИДЕНТИФИКАЦИИ БЕЛКОВ, СПОСОБ МОДУЛИРОВАНИЯ ИНДУЦИРУЕМОГО MORT-1 ДЕЙСТВИЯ ИЛИ ИНДУЦИРУЕМОГО MORT-1 СВЯЗЫВАЮЩИМ БЕЛКОМ ДЕЙСТВИЯ НА КЛЕТКИ
(57) Реферат:
Изобретение относится к биотехнологии, в частности к генной инженерии, и может быть использовано для модулирования действия лиганда FAS-R или TNF на клетки. Полипептид, способный связываться с MORT-1 и воздействовать на внутриклеточный процесс передачи сигнала, инициируемый связыванием FAS лиганда с его рецептором или связыванием TNF с р55-TNF-R, получают путем культивирования клеток, трансформированных вектором, содержащим ДНК, кодирующую полипептид. Модуляцию действия лиганда FAS-R или TNF на клетки или модуляцию индуцируемого MORT-1 действия осуществляют с помощью полипептида, связывающегося с MORT-1, или нуклеотидной последовательности, кодирующей его. Фармацевтическая композиция для модулирования действия лиганда FAS-R или TNF на клетки содержит полипептид, связывающийся с MORT-1. Изобретение позволяет разрабатывать средства для обработки опухолевых или ВИЧ-инфицированных клеток. 13 н. и 42 з.п. ф-лы, 37 ил., 4 табл. Область изобретения Данное изобретение относится в общем к области рецепторов, принадлежащих к суперсемейству рецепторов TNF/NGF, и регуляции их биологических функций. TNF/NGF-суперсемейство рецепторов включает в себя такие рецепторы, как р55- и р75-рецепторы фактора некроза опухолей (TNF-R, далее называемые p55-R и p75-R) и рецептор FAS-лиганда (также называемый FAS/APO1 или FAS-R и далее называемый FAS-R) и другие. Более конкретно, данное изобретение относится к новым белкам, которые связываются с белком MORT-1 (или FADD), и более конкретно, оно относится к одному такому MORT-1-связывающему белку, называемому здесь МАСН. Таким образом, данное изобретение относится, в общем, к новым белкам, которые способны модулировать или медиировать функцию MORT-1 или других белков, которые прямо или опосредованно связываются с MORT-1. В частности, данное изобретение относится к МАСН, его получению и его применениям, а также к различным новым изоформам МАСН, их получению и применениям. Предпосылки родственной области знаний Фактор некроза опухолей (TNF- Однако как TNF- Два различных, независимо экспрессируемых, рецептора, TNF-R р55 и р75, которые связывают специфически как TNF- Что касается вышеупомянутого вызывающего гибель клеток действия TNF, в большинстве исследованных до сих пор клеток этот эффект запускается в основном TNF-R р55. Антитела против внеклеточного домена (лигандсвязывающего домена) TNF-R р55 могут сами запускать вызывающее гибель клеток действие (см. ЕР 412486), которое коррелирует с эффективностью перекрестного связывания рецептора этими антителами, что считают первой стадией в генерировании внутриклеточного процесса передачи сигнала. Далее, мутационные исследования (Brakebusch et al., 1992; Tartaglia et al., 1993) показали, что биологическая функция TNF-R р55 зависит от целостности его внутриклеточного домена, и поэтому было сделано предположение, что инициация внутриклеточной передачи сигнала, приводящего к вызывающему гибель клеток действию TNF, происходит как следствие ассоциации двух или более внутриклеточных доменов TNF-R р55. Кроме того, TNF ( Другим членом суперсемейства TNF/NGF-рецепторов является FAS-рецептор (FAS-R), который называли также FAS-антигеном, белок клеточной поверхности, экспрессируемый в различных тканях и имеющий гомологию с рядом рецепторов клеточной поверхности, в том числе, с TNF-R и NGF-R. FAS-R медиирует гибель клетки в форме апоптоза (Itoh et al., 1991) и, по-видимому, служит в качестве негативного селектирующего агента аутореактивных Т-клеток, т.е. во время созревания Т-клеток FAS-R медиирует апоптопическую гибель Т-клеток, узнающих аутологичные антигены. Было также обнаружено, что мутации в гене FAS-R (lрr) вызывают нарушение лимфопролиферации у мышей, подобное аутоимунному заболеванию человека системной красной волчанке (SLE) (Watanabe-Fukunaga et al., 1992). Лиганд для FAS-R является, по-видимому, связанной с клеточной поверхностью молекулой, которую несут, среди прочих, киллерные Т-клетки (или цитотоксичные Т-лимфоциты – CTL), и, следовательно, когда такие CTL приходят в контакт с клетками, несущими FAS-R, они способны индуцировать апоптопическую гибель несущих FAS-R клеток. Далее, были получены антитела, которые являются специфическими для FAS-R, причем эти антитела способны индуцировать апоптопическую гибель несущих FAS-R клеток, в том числе, мышиных клеток, трансформированных кДНК, кодирующей FAS-R человека (Itoh et al., 1991). Хотя некоторые цитотоксические эффекты лимфоцитов медиируются взаимодействием продуцируемого лимфоцитами лиганда с широко встречающимся рецептором клеточной поверхности FAS-R (CD95), который обладает способностью запускать гибель клеток, было также обнаружено, что различные другие нормальные клетки, кроме Т-лимфоцитов, экспрессируют FAS-R на их поверхности и могут быть убитыми запуском этого рецептора. Есть подозрение, что неконтролируемая индукция такого процесса убивания клеток способствует разрушению тканей в некоторых заболеваниях, например, деструкции клеток печени в случае острого гепатита. Поэтому нахождение путей сдерживания цитотоксической активности FAS-R может иметь терапевтический потенциал. В противоположность этому, поскольку было также обнаружено, что некоторые злокачественные клетки и ВИЧ-инфицированные клетки несут на их поверхности FAS-R, антитела против FAS-R или лиганда FAS-R могут быть использованы для запуска медиируемых FAS-R цитотоксических эффектов в этих клетках и тем самым обеспечить средство борьбы с такими злокачественными клетками или ВИЧ-инфицированными клетками (см. Itoh et al., 1991). Нахождение других путей увеличения цитотоксической активности FAS-R может, следовательно, также иметь терапевтическую перспективу. Уже давно ощущалась необходимость обеспечения пути модулирования клеточного ответа на TNF ( Ряд подходов был предпринят лабораторией заявителей (см., например, European Application Nos. EP 186833, ЕР 308378, ЕР 398327 и ЕР 412486) для регуляции губительных эффектов TNF путем ингибирования связывания TNF с его рецепторами при помощи антител против TNF или при помощи растворимых рецепторов TNF (которые являются по существу растворимыми внеклеточными доменами этих рецепторов) для конкурирования за связывание TNF со связанными с клеточной поверхностью TNF-R. Далее, на основании того, что связывание TNF с его рецепторами является необходимым для индуцируемых TNF клеточных эффектов, лабораторией заявителей (см., например, ЕРО 568925) были предприняты подходы для модулирования этого эффекта TNF путем модулирования TNF-R. Вкратце, ЕРО 568925 описывает способ модулирования передачи сигнала и/или расщепления TNF-R, в результате чего пептиды или другие молекулы могут взаимодействовать либо с самим рецептором, либо с эффекторными белками, взаимодействующими с рецептором, модулируя таким образом нормальную функцию TNF-R. В ЕРО 568925 описаны конструирование и характеристика различных мутантов рецепторов TNF, имеющих мутации во внеклеточных, трансмембранных и внутриклеточных доменах TNF-R р55. Таким путем, районы в указанных выше доменах TNF-R р55 были идентифицированы как существенные для функционирования этого рецептора, т.е., связывания лиганда (TNF) и последующей передачи сигнала и внутриклеточной передачи сигнала, которая в конце концов приводит к наблюдаемому эффекту TNF на этих клетках. Далее, описан также ряд подходов для выделения и идентификации белков, пептидов или других факторов, которые способны связываться с различными районами в вышеуказанных доменах TNF-R, причем эти белки, пептиды и другие факторы могут участвовать в регуляции или модулировании активности TNF-R. Ряд подходов для выделения и клонирования последовательностей ДНК, кодирующих такие белки и пептиды; для конструирования экспрессирующих векторов для получения этих белков и пептидов; и для получения антител или их фрагментов, которые взаимодействуют с TNF-R или с указанными выше белками и пептидами, которые связывают различные районы TNF-R, также изложены в ЕРО 568925. Однако, ЕРО 568265 не дает характеристику фактических белков и пептидов, связывающихся с внутриклеточными доменами TNF-R (например, TNF-R р55) и не описывает дрожжевой двухгибридный подход для выделения и идентификации таких белков и пептидов, которые связываются с внутриклеточными доменами TNF-R. Подобным образом, до настоящего времени не были описаны белки или пептиды, способные связывать внутриклеточный домен FAS-R. Таким образом, в случае, когда желательно ингибирование эффекта TNF или лиганда FAS-R, было бы желательным уменьшение количества или активности рецепторов TNF или FAS-R на поверхности клеток, тогда как увеличение количества или активности рецепторов TNF или FAS-R было бы желательным, когда необходим усиленный эффект TNF или лиганда FAS-R. Для этой цели промоторы как TNF-R р55, так и TNF-R р75 были секвенированы, проанализированы, и был обнаружен ряд ключевых мотивов последовательности, которые являются специфическими для различных регулирующих транскрипцию факторов, и сама экспрессия этих рецепторов TNF может регулироваться на уровне их промоторов, т.е. ингибирования транскрипции от этих промоторов для уменьшения числа рецепторов и увеличения транскрипции от этих промоторов для увеличения числа этих рецепторов (ЕР 606869 и WO 9531206). Должны быть сообщены соответствующие исследования, касающиеся регуляции FAS-R на уровне промотора гена FAS-R. Хотя известно, что рецепторы фактора некроза опухолей (TNF) и структурно-родственный рецептор FAS-R запускают в клетках, при стимуляции продуцируемыми лейкоцитами лигандами, деструктивные активности, которые приводят к их собственной гибели, механизмы этого запуска все еще мало понятны. Мутационные исследования показывают, что в передаче сигнала FAS-R и TNF-R p55 (p55-R) для цитотоксичности участвуют различные районы в их внутриклеточных доменах (Brakebusch et al., 1992; Tartaglia et al., 1993; Itoh and Nagata, 1993). Эти районы (“домены гибели”) имеют сходство последовательности. “Домены гибели” обоих рецепторов FAS-R и p55-R имеют тенденцию к самоассоциации. Их самоассоциация, очевидно, усиливает ту агрегацию рецепторов, которая необходима для инициации передачи сигнала (см. Song et al., 1994; Wallach et al., 1994; Boldin et al., 1995) и при высоких уровнях экспрессии рецепторов может приводить к запуску лиганд-независимой передачи сигнала (Bolding et al., 1995). Таким образом, до WO 9531544 и данного изобретения не были обеспечены белки, которые могут регулировать действие лигандов, принадлежащих к суперсемейству TNF/NGF, такое как действие TNF или лиганда FAS-R на клетки, путем медиирования внутриклеточного процесса передачи сигнала, которая, как считают, управляется в большой степени внутриклеточными доменами (IC) рецепторов, принадлежащих к суперсемейству рецепторов TNF/NGF, такими как внутриклеточные домены рецепторов TNF, т.е. TNF-R р55 и р75 (р55IС и р75IС, соответственно), а также FAS-R. Некоторые цитотоксические эффекты лимфоцитов опосредованы взаимодействием продуцируемого лимфоцитами лиганда с FAS-R (CD95), широко встречающегося рецептора клеточной поверхности, который способен запускать гибель клеток (см. Nagata and Goldstein, 1995). В убивании клеток мононуклеарными фагоцитами участвует пара лиганд-рецептор, TNF и его рецептор p55-R (CD120), которая структурно родственная FAS-R и его лиганду (см. также Vandenabeele et al., 1995). Подобно другим индуцируемым рецепторами эффектам, индукция гибели клеток рецепторами TNF и FAS-R осуществляется через ряд белок-белковых взаимодействий, ведущих от связывания лиганда с рецептором до конечной активации функций ферментативного эффектора, что в случае этих конкретных рецепторов приводит к гибели клеток. Прежние исследования выяснили взаимодействия неферментативный белок-белок, которые инициируют передачу сигнала для гибели клеток: связывание молекул тримерного TNF или лиганда FAS-R с их рецепторами, полученные взаимодействия их внутриклеточных доменов (Brakebusch et al., 1992; Tartaglia et al., 1993; Itoh and Nagata, 1993), увеличивали предрасположение мотивов доменов гибели к самоассоциации (Boldin et al., 1995a) и индуцировали связывание двух цитоплазматических белков (которые могут также связываться друг с другом) с внутриклеточными доменами рецепторов – MORT-1 (или FADD) с FAS-R (Boldin et al., 1995b; Chinnaiyan et al., 1995; Kischkel et al., 1995) и TRADD с p55-R (Hsu et al., 1995; Hsu et al., 1996). Три белка, которые связываются с внутриклеточным доменом FAS-R и p55-R при районе “домена гибели”, которые участвуют в индукции гибели клеток рецепторами через гетероассоциацию гомологичных районов и которые независимо способны также к запуску гибели клеток, были идентифицированы при помощи способа дрожжевого двухгибридного скрининга. Одним из них является белок MORT-1 (Boldin et al., 1995b), также известный как FADD (Chinnaiyan et al., 1995), который связывается специфически с FAS-R. Второй, TRADD (см. также Hsu et al., 1996), связывается с p55-R и третий, RIP (см. также Stranger et al., 1995), связывается как с FAS-R, так и с p55-R. Кроме их связывания с FAS-R и p55-R, эти белки также способны связываться друг с другом, что обеспечивает функциональный “перекрестный разговор” между FAS-R и p55-R. Эти связывания осуществляются через консервативный мотив последовательности, “модуль домена гибели”, общий для этих рецепторов и их связываемых белков. Кроме того, хотя в дрожжевом двухгибридном тесте было показано, что MORT-1 связывается самопроизвольно с FAS-R, в клетках млекопитающих это связывание имеет место только после стимуляции рецептора, что заставляет предположить, что MORT-1 участвует в инициирующих событиях передачи сигнала FAS-R. MORT-1 не содержит какого-либо мотива последовательности, характерного для ферментативной активности, и, следовательно, его способность запускать гибель клеток, по-видимому, не связана с присущей MORT-1 собственной активностью, а скорее с активацией некоторых других белков (белка), которые связывают MORT-1 и действуют далее в каскаде передачи сигнала. Было показано, что клеточная экспрессия мутантов MORT-1, не имеющих N-концевой части молекулы, ингибирует индукцию цитотоксичности FAS/APO1 (FAS-R) или р55-R (Hsu et al., 1996; Chinnaiyan et al., 1996), что свидетельствует о том, что этот N-концевой район участвует в передаче сигнала о вызывающем гибель клеток действии обоих рецепторов через белок-белковые взаимодействия. Недавние исследования показали участие группы цитоплазматических тиоловых протеаз, которые структурно близки протеазе CED3 Caenorhabditis elegans и превращающему интерлейкин-1 Сущность изобретения Целью данного изобретения является обеспечение новых белков, в том числе, всех их изоформ, аналогов, фрагментов или производных, которые способны связываться с MORT-1, который сам связывается с внутриклеточным доменом FAS-R, причем эти новые белки влияют на процесс внутриклеточной передачи сигнала путем связывания лиганда FAS с его рецептором. Другой целью данного изобретения является обеспечение антагонистов (например, антител, пептидов, органических соединений или даже некоторых изоформ) вышеупомянутых новых белков, их аналогов, фрагментов и производных, которые могут использоваться для ингибирования процесса передачи сигнала или, более конкретно, клеточной цитотоксичности, когда это желательно. Дальнейшей целью данного изобретения является использование этих новых белков, их аналогов, фрагментов и производных для выделения и характеристики дополнительных белков или факторов, которые могут участвовать в регуляции активности рецепторов, например, других протеаз, которые расщепляют новые белки, делая их биологически активными, и/или для выделения и идентификации других рецепторов, находящихся выше по ходу передачи сигнала, с которыми эти новые белки, их аналоги, фрагменты и производные связываются (например, других рецепторов FAS или родственных им рецепторов) и, следовательно, в функционировании которых они также участвуют. Еще одной целью данного изобретения является обеспечение ингибиторов, которые могут быть введены в клетки для связывания или взаимодействия с протеазами МАСН и ингибирования их протеолитической активности. Кроме того, целью данного изобретения является использование вышеупоминаемых новых белков и их аналогов, фрагментов и производных в качестве антигенов для получения к ним поликлональных и/или моноклональных антител. Эти антитела, в свою очередь, могут быть использованы, например, для очистки новых белков из различных источников, таких как клеточные экстракты или трансформированные клеточные линии. Далее, эти антитела могут быть использованы для диагностических целей, например, для идентификации расстройств, связанных с аномальным функционированием клеточных эффектов, опосредованных FAS-R или другими родственными рецепторами. Дальнейшей целью данного изобретения является обеспечение фармацевтических композиций, содержащих вышеупомянутые новые белки или их аналоги, фрагменты или производные, а также фармацевтических композиций, содержащих вышеупомянутые антитела или другие антагонисты. В соответствии с данным изобретением, был обнаружен новый белок, МАСН, который способен связываться или взаимодействовать с MORT-1, который сам связывается с внутриклеточным доменом FAS-R. МАСН, возможно, функционирует как эффекторный компонент пути гибели клеток, инициируемого связыванием лиганда FAS с FAS-R на клеточной поверхности, и это происходит благодаря тому факту, что по меньшей мере некоторые изоформы МАСН, по-видимому, являются активными внутриклеточными протеазами. Высказывалось предположение, что протеазы семейства CED3/ICE причастны к процессу апоптоза, запускаемому FAS-R. MORT-1 (или FADD) связывается с внутриклеточным доменом FAS-R при активации этого рецептора, а новые белки МАСН данного изобретения связываются с MORT-1. Белок МАСН, клонированный и охарактеризованный в соответствии с данным изобретением, действительно существует в виде многочисленных изоформ, причем некоторые из изоформ имеют район гомологии CED3/ICE, который имеет протеолитическую активность (домен протеолитической активности), и вызывает гибель клеток при экспрессии в этих клетках. Таким образом, активация этого нового гомолога CED3/ICE (т.е. различных изоформ МАСН, имеющих протеолитический домен) FAS-R (через взаимодействие с MORT-1), по-видимому, составляет эффекторный компонент опосредованного FAS-R пути (каскада реакций) гибели клеток. Кроме того, МАСН, по-видимому, функционирует также как эффекторный компонент пути гибели клеток, инициируемого связыванием TNF с p55-R на клеточной поверхности, что происходит посредством непрямого механизма связывания MORT-1 с TRADD, белком, который связывается с внутриклеточным доменом p55-R (Hsu et al., 1995), с последующим (или одновременным) связыванием МАСН с MORT-1 с активацией МАСН до активной протеазы, участвующей в осуществлении гибели клеток. Следует также отметить, что, хотя МАСН, в частности, изоформа MACH MORT-1 (“Медиатор Токсичности Рецептора”, Boldin et al., 1995b), прежде называемый HF1, способен связываться с внутриклеточным доменом FAS-R. Этот FAS-IC-связывающий белок, по-видимому, действует как медиатор или модулятор действия лиганда FAS-R на клетки путем медиирования или модулирования процесса внутриклеточной передачи сигнала, который обычно имеет место после связывания лиганда FAS-R при клеточной поверхности. Было показано, что, кроме его FAS-IC-связывающей специфичности, MORT-1 имеет другие характеристики (см. Пример 1), например, он имеет район, гомологичный районам “домена смерти” (DD) TNF-R р55 и FAS-R (p55-DD и FAS-DD), и вследствие этого также способен к самоассоциации. MORT-1 способен также сам активировать клеточную цитотоксичность, причем эта его способность, возможно, связана с его способностью к самоассоциации. Также было обнаружено, что коэкспрессия этого района в MORT-1 (HF1), который содержит последовательность гомологии “домена гибели” (MORT-1-DD, присутствующий в С-концевой части MORT-1), сильно противодействует индуцируемой FAS гибели клеток, как и следовало ожидать на основании его способности связываться с “доменом гибели” FAS-IC. Далее, в некоторых экспериментальных условиях, было обнаружено, что коэкспрессия части MORT-1, которая не содержит района MORT-DD (N-концевой части MORT-1, аминокислот 1-117, “головки MORT-1”) приводила к отсутствию противодействия индуцируемой FAS гибели клеток и к несколько увеличенной индуцируемой FAS клеточной цитотоксичности (если она вообще была). Таким образом, вероятно, что MORT-1 связывается также с другими белками, участвующими в процессе внутриклеточной передачи сигнала. Следовательно, MORT-1-связывающие белки могут также действовать как непрямые медиаторы или модуляторы действия лиганда FAS-R на клетки посредством медиирования или модулирования активности MORT-1; или эти MORT-1-связывающие белки могут действовать непосредственно как медиаторы или модуляторы связанного с MORT-1 внутриклеточного процесса передачи сигнала посредством медиирования или модулирования активности MORT-1, который, как отмечалось выше, имеет, по-видимому, независимую способность активировать клеточную цитотоксичность. Эти MORT-1-связывающие белки могут быть также использованы в любом из стандартных способов скрининга для выделения, идентификации и характеристики дополнительных белков, пептидов, факторов, антител и т.д., которые могут участвовать в связанном с MORT-1 или связанном с FAS-R процессе передачи сигнала или могут быть элементами других внутриклеточных процессов передачи сигнала. Такие MORT-1-связывающие белки были выделены и описаны здесь (см. Пример 2 и Пример 3). Одни из этих MORT-1-связывающих белков, называемый здесь МАСН, был исходно клонирован, секвенирован и частично охарактеризован как имеющий следующие свойства: кДНК МАСН кодирует открытую рамку считывания ORF-B; МАСН связывается с MORT-1 сильно и специфически; сайт связывания МАСН в MORT-1 находится против хода транскрипции от мотива “домена гибели” MORT-1; район ORF-B MACH является его взаимодействующей с MORT-1 частью; и MACH способен к самоассоциации и к самостоятельной индукции клеточной цитотоксичности. В соответствии с данным изобретением, в настоящее время было показано (как упоминалось выше), что MACH действительно существует в виде ряда изоформ. Кроме того, ORF-B MACH, упомянутая выше, в самом деле является одной из изоформ MACH, названной здесь МАСН Таким образом, данное изобретение обеспечивает последовательность ДНК, кодирующую белок, его аналоги или фрагменты, способные связываться или взаимодействовать с MORT-1, причем этот белок, его аналоги или фрагменты способны медиировать внутриклеточный эффект, медиируемый FAS-R или p55-TNF-R. В частности, данное изобретение обеспечивает последовательность ДНК, выбранную из группы, состоящей из: (a) последовательности кДНК, происходящей из кодирующего района нативного MORT-1-связывающего белка; (b) последовательностей ДНК, способных гибридизоваться с последовательностью (а) при условиях умеренной строгости и кодирующих биологически активный MORT-1-связывающий белок; (c) последовательностей ДНК, которые являются вырожденными в результате вырожденности генетического кода, относительно последовательностей ДНК, определенных в (а) и (b), и которые кодируют биологически активный MORT-1-связывающий белок. Другим характерным вариантом упомянутой выше последовательности ДНК данного изобретения является последовательность ДНК, содержащая по меньшей мере часть последовательности, кодирующей одну изоформу белка МАСН, выбранную из изоформ МАСН, названных здесь MACH Другими характерными вариантами последовательности ДНК данного изобретения, как отмечалось выше, являются последовательности ДНК, кодирующие: (a) изоформу МАСН, выбранную из MACH (b) MACH (c) MACH (d) МАСН Данное изобретение обеспечивает MORT-1-связывающие белки и их аналоги, фрагменты или производные, кодируемые любой из указанных выше последовательностей изобретения, причем эти белки, аналоги, фрагменты и производные способны связываться или взаимодействовать с MORT-1 и медиировать внутриклеточный эффект, медиируемый FAS-R или р55 TNF-R. Характерным вариантом данного изобретения является MORT-1-связывающий белок, его аналоги, фрагменты и производные, которые выбраны из по меньшей мере одной изоформы МАСН группы, содержащей MACH Данное изобретение обеспечивает также векторы, кодирующие упомянутый выше MORT-1-связывающий белок и его аналоги, фрагменты или производные данного изобретения, которые содержат указанную выше последовательность ДНК данного изобретения, причем эти векторы способны экспрессироваться в подходящих эукариотических или прокариотических клетках-хозяевах; трансформированные эукариотические или прокариотические клетки-хозяева, содержащие такие вектора; и способ получения MORT-1-связывающего белка или аналогов, фрагментов или производных данного изобретения путем выращивания трансформированных клеток-хозяев при условиях, пригодных для экспрессии указанного белка, аналогов, фрагментов или производных, выполнения пост-трансляционных модификаций этого белка, как это необходимо для получения этого белка, и экстракции экспрессируемых белка, аналогов, фрагментов или производных из культуральной среды трансформированных клеток или клеточных экстрактов трансформированных клеток. Данные выше определения предназначены для включения всех изоформ белка МАСН. В другом аспекте, данное изобретение обеспечивает также антитела или их активные производные или фрагменты, специфические для MORT-1-связывающего белка и его аналогов, фрагментов и производных данного изобретения. Еще одним аспектом изобретения обеспечены различные применения описанных выше последовательностей ДНК или белков, которые они кодируют, в соответствии с данным изобретением, причем эти применения включают (среди прочих): (i) Способ модулирования действия лиганда FAS-R или TNF на клетки, несущие FAS-R или p55-R, предусматривающий обработку этих клеток одним или несколькими MORT-1-связывающими белками, аналогами, фрагментами или производными данного изобретения, способными связываться с MORT-1, который связывается с внутриклеточным доменом FAS-R, или способными связываться с MORT-1, который связывается с TRADD, который связывается с внутриклеточным доменом p55-R, и вследствие этого способными модулировать/медиировать активность FAS-R или р55 TNF-R, причем обработка этих клеток предусматривает введение в клетки одного или нескольких белков, аналогов, фрагментов или производных в форме, пригодной для внутриклеточного введения, или введение в клетки последовательности ДНК, кодирующей один или несколько белков, аналогов, фрагментов или производных, в форме подходящего вектора, несущего эту последовательность, причем этот вектор способен осуществлять введение этой последовательности в эти клетки таким образом, что эта последовательность экспрессируется в клетках. (ii) Способ модулирования действия лиганда FAS-R или TNF на клетки по (i) выше, в котором обработка клеток предусматривает введение в клетки MORT-1-связывающего белка или его аналогов, фрагментов или производных в форме, пригодной для внутриклеточного введения, или введение в клетки последовательности ДНК, кодирующей MORT-1-связывающий белок или аналоги, фрагменты или производные, в форме подходящего вектора, несущего эту последовательность, причем этот вектор способен осуществлять введение этой последовательности в эти клетки таким образом, что эта последовательность экспрессируется в клетках. (iii) Способ по (ii) выше, в котором обработку клеток выполняют посредством трансфекции клеток рекомбинантным вирусным вектором животного, включающей в себя стадии: (a) конструирования рекомбинантного вирусного вектора животного, несущего последовательность, кодирующую вирусный поверхностный белок (лиганд), который способен связываться со специфическим рецептором клеточной поверхности на поверхности несущей FAS-R или p55-R клетки, и вторую последовательность, кодирующую белок, выбранный из MORT-1-связывающего белка и его аналогов, фрагментов и производных, который при экспрессии в этих клетках способен модулировать/медиировать активность FAS-R или p55-R; и (b) инфицирования этих клеток вектором (а). (iv) Способ модулирования действия лиганда FAS-R или TNF на клетки, несущие FAS-R или p55-R, предусматривающий обработку этих клеток антителами или их активными фрагментами или производными, в соответствии с данным изобретением, причем эту обработку выполняют предоставлением подходящей композиции, содержащей эти антитела, их активные фрагменты или производные, этим клеткам, причем при экспонировании MORT-1-связывающего белка или его частей из этих клеток на внеклеточной поверхности указанную композицию готовят для внеклеточного применения, а когда MORT-1-связывающие белки являются внутриклеточными, указанную композицию готовят для внутриклеточного применения. (v) Способ модулирования действия лиганда FAS-R или TNF на клетки, несущие FAS-R или p55-R, предусматривающий обработку указанных клеток олигонуклеотидной последовательностью, кодирующей антисмысловую последовательность по меньшей мере части белковой последовательности MORT-1-связывающего белка данного изобретения, причем эта олигонуклеотидная последовательность способна ингибировать экспрессию MORT-1-связывающего белка. (vi) Способ по (ii) выше для обработки опухолевых клеток или ВИЧ-инфицированных клеток или других имеющих патологию клеток, предусматривающий: (a) конструирование рекомбинантного вирусного вектора животного, несущего последовательность, кодирующую вирусный поверхностный белок, способный связываться со специфическим рецептором поверхности опухолевых клеток или рецептором других имеющих патологию клеток, и последовательность, кодирующую белок, выбранный из MORT-1-связывающего белка, аналогов, фрагментов и производных данного изобретения, который при экспрессии в опухолевой, ВИЧ-инфицированной или иной имеющей патологию клетке способен убивать эту клетку; (b) инфицирование опухолевых или ВИЧ-инфицированных или иных имеющих патологию клеток вектором (а). (vii) Способ модулирования действия лиганда -FAS-R или TNF на клетки, предусматривающий применение рибозимного способа, в котором вектор, кодирующий последовательность рибозима, способен взаимодействовать с клеточной последовательностью мРНК, кодирующей MORT-1-связывающий белок согласно данному изобретению, вводят в указанные клетки в форме, которая позволяет экспрессию последовательности рибозима в этих клетках, причем, когда эта последовательность рибозима экспрессируется в клетках, она взаимодействует с клеточной последовательностью мРНК и расщепляет эту последовательность, что приводит к ингибированию экспрессии MORT-1-связывающего белка в этих клетках. (viii) Способ, выбранный из способа в соответствии с данным изобретением, в котором MORT-1-связывающий белок, кодирующий указанную последовательность, содержит по меньшей мере одну из изоформ МАСН, ее аналоги, фрагменты или производные согласно данному изобретению, которые способны специфически связываться с MORT-1, который, в свою очередь, специфически связывается с FAS-IC, или которые способны связывается с MORT-1, который, в свою очередь, связывается с TRADD, который, в свою очередь, связывается с р55-IС. (ix) Способ выделения и идентификации белков, в соответствии с данным изобретением, способных связываться с белком MORT-1, предусматривающий применение дрожжевого двухгибридного способа, в котором последовательность, кодирующая белок MORT-1, находится на одном гибридном векторе, а последовательность из библиотеки кДНК или геномной ДНК находится на втором гибридном векторе, причем эти векторы используют для трансформации дрожжевых клеток-хозяев, и позитивные трансформированные клетки выделяют с последующей экстракцией второго гибридного вектора для получения последовательности, кодирующей белок, который связывается с белком MORT-1 и представляет собой MORT-1-связывающие белки. (х) Способ по любому из пунктов (i)-(ix), в котором MORT-1-связывающий белок является изоформой МАСН, называемой здесь MACH (xi) Способ по любому из пунктов (i)-(ix), в котором MORT-1-связывающий белок является изоформой МАСН, называемой здесь MACH (xii) Способ по любому из пунктов (i)-(ix), в котором MORT-1-связывающий белок является изоформой МАСН, называемой здесь МАСН Данное изобретение обеспечивает также фармацевтическую композицию для модулирования действия лиганда FAS-R или TNF на клетки, содержащую в качестве активного ингредиента любой из следующих компонентов: (i) MORT-1-связывающий белок согласно данному изобретению и его биологически активные фрагменты, аналоги, производные или смеси; (ii) рекомбинантный вирусный вектор животного, кодирующий белок, способный связывать рецептор клеточной поверхности и кодирующий MORT-1-связывающий белок или биологически активные фрагменты или аналоги, в соответствии с изобретением; (iii) олигонуклеотидную последовательность, кодирующую антисмысловую последовательность последовательности MORT-1-связывающего белка данного изобретения, причем этот олигонуклеотид может быть второй последовательностью рекомбинантного вирусного вектора животного (ii) выше. Данное изобретение обеспечивает также: I. Способ модулирования индуцируемого MORT-1 действия или индуцируемого MORT-1-связывающим белком действия на клетки, предусматривающий обработку этих клеток, в соответствии со способом любого из пунктов (i)-(ix) выше, MORT-1-связывающими белками, их аналогами или фрагментами, причем эта обработка приводит к усилению или ингибированию медиируемого MORT-1 действия и вследствие этого также медиируемого FAS-R или p55-R действия. II. Способ, соответствующий описанному выше, в котором MORT-1-связывающий белок, его аналог, фрагмент или производное является той частью MORT-1-связывающего белка, которая специфически участвует в связывании с MORT-1 или с самим MORT-1-связывающим белком, или указанная последовательность MORT-1-связывающего белка кодирует ту часть MORT-1-связывающего белка, которая специфически участвует в связывании с MORT-1 или с самим MORT-1-связывающим белком. III. Способ, соответствующий описанному выше, в котором MORT-1-связывающий белок является одной из изоформ МАСН, выбранной из MACH Как видно из всего вышесказанного, а также из подробного описания ниже, МАСН может быть использован независимо от MORT-1-связывающих белков, их идентификацию и характеристику можно проводить любым из стандартных способов скрининга, используемых для выделения и идентификации белков, например, дрожжевым двухгибридным способом, способами аффинной хроматографии и любым из хорошо известных стандартных способов, используемых для этой цели. Обеспечены также другие аспекты и варианты данного изобретения, возникающие из следующего далее подробного описания изобретения. Следует отметить, что во всем описании следующие термины: “Модулирование действия лиганда FAS или TNF на клетки”; “Модулирование действия MORT-1 или MORT-1-связывающего белка на клетки”, следует понимать как включающие обработку как in vitro, так и in vivo. Краткое описание чертежей Фиг.1 показывает взаимодействие MORT-1 с FAS-IC и самоассоциацию MORT-1 в трансформированных дрожжах согласно оценке двухгибридным тестом экспрессии Фиг.2 изображает схематически предварительный нуклеотид (SEQ ID №1) и расшифрованную аминокислотную последовательность (SEQ ID №2) MORT-1 (HF1), в которой “домен гибели” подчеркнут, так же как и возможный стартовый сайт трансляции, т.е. подчеркнутый остаток метионина в положении 49 (жирный шрифт, подчеркнутый М). Звездочка указывает стоп-кодон трансляции (нуклеотиды 769-771). В начале и в середине каждой линии даны две цифры, указывающие относительные положения нуклеотидов и аминокислот последовательности относительно начала последовательности (5`-конца), где первая цифра обозначает нуклеотид, а вторая цифра обозначает аминокислоту. Фиг.3 – предварительная частичная нуклеотидная последовательность, кодирующая MORT-1-связывающий белок, полученная из клона кДНК. Фиг.4А-С изображает схематически кДНК МАСН и кодируемый ею белок, где на фиг.4А показана структура кДНК МАСН, которая кодирует две открытые рамки считывания МАСН (ORF-A и ORF-B), причем заштрихованная зона ORF-B показывает ее район, имеющий гомологию с белком MORT-1; на фиг.4В показана расшифрованная аминокислотная последовательность (SEQ ID №5) для района ORF-A МАСН, причем подчеркнутые аминокислотные остатки являются районом, имеющим гомологию с MORT-1 (соответствующим заштрихованному району фиг.4А); и на фиг.4С показана нуклеотидная последовательность (SEQ ID №4) всей молекулы кДНК МАСН (обозначенной MACH Фиг.5 изображает результаты, иллюстрирующие взаимодействие MORT-1 и МАСН в трансфицированных дрожжевых клетках. Фиг.6 изображает в виде диаграммы лиганд-независимый запуск вызывающих гибель клеток эффектов в клетках HeLa, трансфицированных тетрациклин-контролируемыми экспрессирующими векторами, кодирующими МАСН, в сравнении с этими эффектами в тех же клетках, трансфицированных такими векторами, кодирующими другие белки, такие как люцифераза (luc, негативный контроль), FA5-IC, MORT-1, и клетках, котрансфицированных векторами, кодирующими MORT-1 и МАСН. Фиг.7А и 7В показывают аминокислотную последовательность (SEQ ID №5) MACH Фиг.8 – представление в виде диаграммы взаимодействий рецептора и мишени, участвующих в индукции гибели клеток FAS/APO1 и р55, причем модуль домена гибели указан полосками, модуль MORT указан серым цветом и район CED3/ICE указан черным цветом. Фиг.9А-С изображает результаты, иллюстрирующие взаимодействие in vitro MACH Фиг.10 – представление в виде диаграммы различных изоформ МАСН. Фиг.11 – схематическое колинеарное выстраивание (анализ первичной структуры) аминокислотных последовательностей изоформ МАСН, MACH Фиг.12A-F изображают результаты, иллюстрирующие протеазную активность MACH Фиг.14A-D показывают гибель клеток, опосредованную MACH Фиг.15 графически изображает гибель клеток, опосредованную MACH Фиг.16A-D показывают морфологию клеток, в которых гибель клеток была индуцирована или блокирована. Фиг.17 показывает в виде диаграммы, что молекулы МАСН Фиг.18 показывает, что молекулы МАСН Фиг.19 показывает гибель клеток HeLa, которые временно экспрессируют FAS/APO1. Подробное описание изобретения Данное изобретение относится, в первом аспекте, к новым MORT-1-связывающим белкам, которые способны связываться или взаимодействовать с MORT-1 и тем самым связываться с внутриклеточным доменом рецептора FAS-R, с которым связывается MORT-1, или связываться с внутриклеточным доменом р55 TNF-R, с которым связывается белок TRADD (см. Пример 2 и описанное выше) и с которым белок TRADD связывает MORT-1. Таким образом, MORT-1-связывающие белки данного изобретения рассматриваются как медиаторы или модуляторы FAS-R, принимающие участие, например, в процессе передачи сигнала, который инициируется связыванием лиганда FAS с FAS-R, и подобным образом принимающие участие в процессе передачи сигнала, который инициируется связыванием TNF с p55-R. Из MORT-1-связывающих белков данного изобретения сюда включены вновь обнаруженные изоформы МАСН, аминокислотные и ДНК-последовательности которых являются новыми последовательностями, не встречающимися в банках данных ДНК-последовательностей или аминокислотных последовательностей “GENBANK” или “PROTEIN BANK”. Более конкретно, в соответствии с данным изобретением, были описаны несколько гомологов из млекопитающих протеазы нематод CED3. Они были обозначены как изоформы МАСН (изоформы МАСН Одно важное отличие может касаться способа, которым регулируется функция этой протеазы. Поскольку они участвуют в связанных с развитием процессах гибели клеток и в индуцируемом рецептором иммунном цитолизе, расщепление белков протеазами семейства CED3/ICE должно подчиняться регуляции как сигналами, которые образуются в клетке, так и сигналами, исходящими от рецепторов клеточной поверхности. В относящихся к развитию процессах гибели клеток активация таких протеаз включает в себя, по-видимому, механизмы, которые воздействуют на экспрессию генов, приводя к повышенному синтезу этих протеаз, а также к пониженному синтезу белков, подобных BCL-2, которые являются антагонистами их апоптопического действия. Однако, это не так для цитотоксичности, запускаемой FAS-R или рецепторами TNF. Клетки могут быть убиты TNF или лигандом FAS-R, даже когда их активность белкового синтеза полностью ингибирована (фактически в этом случае они погибают более эффективно), и остаются стимул-зависимыми при этих условиях. Таким образом, активация протеаз семейства CED3/ICE рецепторами TNF и FAS-R осуществляется посредством механизма, который не зависит от белкового синтеза. Уникальные свойства последовательности MACH Насколько известно заявителям, до настоящего времени не была обнаружена другая протеаза, связывающаяся непосредственно или через адапторный белок с внутриклеточным доменом рецептора поверхности клетки. Хотя на основании способа действия связанных с рецепторами белков, которые имеют другие ферментативные активности, кажется вероятным, что связывание MACH Было обнаружено, что другие члены семейства CED3/ICE проявляют полную активность только после протеолитического процессинга, который имеет место либо в результате саморасщепления, либо под действием других протеаз этого семейства (обзор Кumаr, 1995; Henkart, 1996). Цитотоксическое действие, происходящее в результате коэкспрессии двух основных потенциально саморасщепляющихся продуктов MACH В клетках, экспрессирующих MACH Благодаря уникальной способности FAS-R и TNF-R вызывать гибель клеток, а также способности рецепторов TNF запускать различные другие повреждающие ткань активности, отклонение от нормы функции этих рецепторов может быть особенно вредным для организма. Действительно, было показано, что как избыточная, так и недостаточная функция этих рецепторов приводит к патологическим проявлениям различных заболеваний. Идентификация молекул, которые участвуют в передаче сигнала для активности этих рецепторов, и нахождение способов модулирования функции этих молекул является потенциальным ключом для новых терапевтических подходов к этим заболеваниям. В связи с предполагаемой центральной ролью MACH Таким образом, данное изобретение относится также к последовательности ДНК, кодирующей MORT-1-связывающий белок, и MORT-1-связывающим белкам, кодируемым этой последовательностью ДНК. Кроме того, данное изобретение относится к последовательностям ДНК, кодирующим биологически активные аналоги, фрагменты и производные MORT-1-связывающего белка, и кодируемым ими аналогам, фрагментам и производным. Получение таких аналогов, фрагментов и производных выполняют стандартным способом (см., например, Sambrook et al., 1989), в котором в последовательностях ДНК, кодирующих MORT-1-связывающий белок, могут быть делетированы, присоединены или заменены другими один или несколько кодонов с образованием аналогов, имеющих по меньшей мере одну замену аминокислотного остатка в сравнении с нативным белком. Полипептид или белок, “в основном соответствующий” MORT-1-связывающему белку, включает не только MORT-1-связывающий белок, но также полипептиды или белки, которые являются аналогами MORT-1-связывающего белка. Аналоги, которые в основном соответствуют MORT-1-связывающему белку, являются полипептидами, в которых одна или несколько аминокислот аминокислотной последовательности MORT-1-связывающего белка заменены другой аминокислотой, делетированы или вставлены, при условии, что полученный белок проявляет в основном такую же или более высокую биологическую активность, какую имеет соответствующий MORT-1-связывающий белок. Для того чтобы “в основном соответствовать” MORT-1-связывающему белку изменения в последовательности MORT-1-связывающих белков, таких как изоформы МAСН, являются относительно малыми. Хотя число изменений может быть более 10, предпочтительно имеется не более 10 изменений, более предпочтительно, не более 5 и, наиболее предпочтительно, не более трех таких изменений. Хотя можно использовать любой способ для нахождения потенциально биологически активных белков, которые в основном соответствуют MORT-1-связывающим белкам, одним из таких способов является использование традиционных способов мутагенеза на ДНК, кодирующей этот белок, приводящих к небольшому числу модификаций. Затем белки, экспрессируемые такими клонами, могут быть подвергнуты скринингу на MORT-1-связывание и/или на медиирующую FAS-R и p55-R активность. “Консервативными” заменами являются замены, которые не должны предположительно изменять активность этого белка, и обычно должны сначала быть подвергнуты скринингу в качестве замен, которые предположительно не должны в основном изменять размер, заряд или конфигурацию этого белка, и, следовательно, предположительно не должны изменять его биологические свойства. Консервативные замены MORT-1-связывающих белков включают аналог, в котором по меньшей мере один аминокислотный остаток в полипептиде был консервативно заменен другой аминокислотой. Такие замены предпочтительно выполняют в соответствии со списком, представленным в Таблице IA, эти замены могут быть определены рутинным экспериментированием для обеспечения модифицированных структурных и функциональных свойств синтезированной молекулы полипептида с сохранением биологической активности, характерной для MORT-1-связывающего белка. Альтернативно, другой группой замен MORT-1-связывающего белка могут быть замены, при которых по меньшей мере один аминокислотный остаток в полипептиде был удален, и другой остаток был вставлен на его место в соответствии с Таблицей IB. Типы замен, которые могут быть сделаны в полипептиде, могут быть основаны на анализе частоты аминокислотных замен между гомологичными белками различных видов, таких, которые представлены в Таблице 1-2 Schulz et al., G.E. Principles of Protein Structure, Springer Verlag, New York, NY, 1798 и фиг.3-9 Creighton, Т.E., Proteins: Structure and Molecular Properties, W.H.Freeman and Co., San Francisco, CA 1983. На основании такого анализа альтернативные консервативные замены определены здесь в качестве обменов внутри одной из следующих пяти групп: Таблица IB 1. Небольшие алифатические неполярные или слабо полярные остатки: Ala, Ser, Thr (Pro, Gly). 2. Полярные отрицательно заряженные остатки и их амиды: Asp, Asn, Glu, Gln. 3. Полярные, положительно заряженные остатки: His, Arg, Lys. 4. Большие алифатические неполярные остатки: Met, Leu, Ile, Val (Cys). 5. Большие ароматические остатки: Phe, Туr, Тrр. Три аминокислотных остатка в скобках имеют специфическую роль в архитектуре белка. Gly является единственным остатком, не имеющим боковой цепи и, следовательно, придает гибкость цепи. Однако это имеет тенденцию усиления образования вторичной структуры, отличающейся от Консервативные аминокислотные замены по данному изобретению, например, представленные выше, известны в данной области знаний и, предположительно, должны сохранять биологические и структурные свойства полипептида после аминокислотных замен. Большинство делеций и замен в соответствии с данным изобретением являются такими, которые не производят радикальных изменений в характеристиках молекулы белка или полипептида. “Характеристики” касаются как изменений во вторичной структуре, например, Примеры получения аминокислотных замен в белках, которые могут быть использованы для получения аналогов MORT-1-связывающих белков для применения в данном изобретении, включают любые стадии известных способов, таких как представленные в U.S. patent RE 33653, 4959314, 4588585 и 4737462 Mark et al.; 5116943 Koths et al., 4965195 Namen et al. 487911 Chong et al.; и 5017691 Lee et al., представленные для лизин-замещенных белков в U.S. patent No.4904584 (Shaw et al.). Кроме консервативных замен, обсужденных выше, которые не должны существенно изменять активность MORT-1-связывающего белка, любые консервативные замены или менее консервативные и более случайные замены, которые приводят к увеличению биологической активности аналогов MORT-1-связывающих белков, находятся в объеме данного изобретения. Специалисту в данной области понятно, что, когда точное действие замены или делеции должно быть подтверждено, это действие замены (замен), делеции (делеций) и т.д. следует оценивать рутинными тестами связывания и гибели клеток. Скрининг при помощи такого стандартного теста не требует чрезмерного экспериментирования. Приемлемыми являются аналоги, которые сохраняют по меньшей мере способность связывания с MORT-1 и в результате, как отмечалось выше, медиируют активность FAS-R и p55-R (например, посредством протеазной активности по меньшей мере некоторых изоформ МАСН). Таким образом могут быть получены аналоги, которые имеют так называемое доминант-негативное действие, а именно, аналог, который дефектен либо в связывании с MORT-1, либо в последующей передаче сигнала или протеазной активности после такого связывания. Такие аналоги могут использоваться, например, для ингибирования действия FAS-лиганда посредством конкурирования с природными MORT-1-связывающими белками. Например, представляется вероятным, что изоформы МАСН, МАСН На генетическом уровне, эти аналоги обычно получают сайт-направленным мутагенезом нуклеотидов в ДНК, кодирующей MORT-1-связывающий белок, с получением в результате ДНК, кодирующей аналог, с последующим синтезом этой ДНК и экспрессией этого полипептида в культуре рекомбинантных клеток. Как правило, аналоги проявляют ту же самую или увеличенную качественную биологическую активность, какой обладает природно встречающийся белок, Ausubel et al.. Current Protocols in Molecular Biology, Greene Publications and Wiley Interscience. New York, NY, 1987-1995; Sambrook et al., Molecular Cloning: A Laboratory Manual, Col Spring Harbor Laboratory, Cold Spring Harbor, NY, 1989. Получение MORT-1-связывающего белка, в соответствии с этим, или другой нуклеотидной последовательности, кодирующей тот же самый полипептид, но отличающейся от природной последовательности вследствие изменений, разрешаемых известной вырожденностью генетического кода, может быть достигнуто сайт-направленным мутагенезом ДНК, которая кодирует полученный ранее аналог или нативную версию MORT-1-связывающего белка. Сайт-направленный мутагенез позволяет получить аналоги посредством использования специфических олигонуклеотидных последовательностей, кодирующих последовательность ДНК желательной мутации, а также значительное количество смежных нуклеотидов, для обеспечения праймерной последовательности достаточного размера и достаточной сложности последовательности для образования стабильного дуплекса на обеих сторонах пересекаемого делеционного сочленения. Как правило, предпочтителен праймер длиной приблизительно 20-25 нуклеотидов с приблизительно 5-10 комплементарными нуклеотидами на каждой стороне изменяемой последовательности. В общем, способ сайт-направленного мутаганеза хорошо известен в данной области, например, описанный в публикациях Adelman et al., DNA 2: 183 (1983), включенных здесь в качестве ссылки. Как будет понятно, способ сайт-направленного мутагенеза обычно использует фаговый вектор, который существует как в одноцепочечной форме, так и в двухцепочечной форме. Типичные векторы, применимые в сайт-направленном мутагенезе, включают векторы, такие как фаг М13, например, описанный Messing et al., Third Cleveland Symposium on Macromolecules and Recombinant DNA, Editor A. Walton, Elsevier, Amsterdam (1981), описание включено здесь в качестве ссылки. Эти фаги легко доступны коммерчески и их применение, как правило, хорошо известно специалистам в данной области. Альтернативно, для получения одноцепочечной ДНК можно использовать плазмидные векторы, содержащие одноцепочечное начало репликации фага (Veira et al., Meth. Emymol. 153:3, 1987). В общем, сайт-направленный мутагенез, в соответствии с данным изобретением, выполняют получением сначала одноцепочечного вектора, который содержит в его последовательности последовательность ДНК, кодирующую соответствующий тот или иной полипептид. Олигонуклеотидный праймер, несущий желаемую мутированную последовательность, получают синтетически при помощи автоматизированного ДНК/олигонуклеотидного синтеза. Затем этот праймер отжигают с одноцепочечным содержащим последовательность белка вектором и подвергают действию ДНК-полимеразных ферментов, таких как фрагмент Кленова ДНК-полимеразы I E. coli, для завершения синтеза несущей мутацию цепи. Таким образом, мутированная последовательность и вторая цепь несут желаемую мутацию. Этот гетеродуплексный вектор используют затем для трансформации подходящих клеток, таких как E. coli JM101, и отбирают клоны, которые включают рекомбинантные векторы, несущие аранжировку мутированной последовательности. После отбора такого клона последовательность мутированного MORT-1-связывающего белка может быть извлечена и помещена в подходящий вектор, обычно переносящий или экспрессирующий вектор типа, который может быть использован для трансфекции подходящего хозяина. Соответственно этому, ген или нуклеиновая кислота, кодирующая MORT-1-связывающий белок, могут быть также обнаружены, получены и/или модифицированы in vitro, in situ или in vivo с использованием известных способов амплификации ДНК или РНК, таких как ПЦР и химический синтез олигонуклеотидов. ПЦР позволяет амплификацию (увеличение в числе) специфических последовательностей ДНК посредством повторяющихся ДНК-полимеразных реакций. Эту реакцию можно использовать вместо клонирования; все, что требуется для этого, это знание последовательности нуклеиновой кислоты. Для проведения ПЦР конструируют праймеры, комплементарные целевой последовательности. Затем эти праймеры получают автоматизированным синтезом ДНК. Поскольку могут быть сконструированы праймеры для гибридизации с любой частью гена, могут быть созданы такие условия, в которых могут быть возможными (переносимыми) неправильные спаривания в комплементарном спаривании оснований. Амплификация этих неправильно спаренных районов может приводить к синтезу мутагенизированного продукта, приводящего к образованию пептида с новыми свойствами (т.е. может происходить сайт-направленный мутагенез). См. также, например, Ausubel, supra, Ch. 16. Также, путем соединения синтеза с использованием комплементарной ДНК (кДНК) с применением обратной транскриптазы с ПЦР полученную РНК можно использовать в качестве исходного материала для синтеза внеклеточного домена рецептора пролактина без клонирования. Кроме того, могут быть сконструированы ПЦР-праймеры для включения новых сайтов рестрикции или других признаков, таких как терминирующих кодонов на концах генного сегмента, который должен быть амплифицирован. Это помещение сайтов рестрикции на 5`- и 3`-концах амплифицированной генной последовательности позволяет получать сегменты генов, кодирующие MORT-1-связывающий белок или его фрагмент, специально предназначенный для лигирования других последовательностей и/или клонирующих сайтов в векторы. ПЦР и другие способы амплификации РНК и/или ДНК хорошо известны в данной области и могут использоваться в соответствии с данным изобретением без чрезмерного экспериментирования, на основе описания и руководства, представленных здесь. Известные способы амплификации ДНК или РНК включают (но не ограничены ими) полимеразную цепную реакцию (ПЦР) и родственные способы амплификации (см., например, U.S. patent Nos. 4683195, 4683202, 4800159, 4065188 Mullis et al.; 4795699 и 4921794 Tabor et al.; 5142033 Innis; 5122464 Wilson et al.; 5091310 Innis; 5066584 Gyllensten et al.; 4889818 Gelfand et al.; 4994370 Silver et al.; 4766067 Biswas; 4656134 Ringgold; и Innis et al., eds. Pcr Protocols: A Guide to Method and Applications) и медиируемую РНК амплификацию, использующую антисмысловую РНК к целевой последовательности в качестве матрицы для синтеза двухцепочечной ДНК (U.S. patent No. 5130238 Malek et al., с товарным знаком NASBA); и иммуно-ПЦР, объединяющую использование амплификации ДНК с мечением антител (Ruzicka et al., Science 260:487 (1993); Sano et al., Science 258:120 (1992); Sano et al., Biotechniques 9:1378 (1991)), полное содержимое этих патентов и публикаций включены здесь в качестве ссылок. Аналогичным образом, биологически активные фрагменты MORT-1-связывающих белков (например, активных фрагментов любой из изоформ МАСН) могут быть получены, как указано выше в отношении аналогов MORT-1-связывающих белков. Пригодные для этого фрагменты MORT-1-связывающих белков являются фрагментами, которые сохраняют MORT-1-связывающую способность и которые могут медиировать биологическую активность FAS-R и p55-R, как отмечалось выше. В соответствии с этим, могут быть получены фрагменты MORT-1-связывающих белков, которые имеют доминант-негативное или доминант-позитивное действие, как отмечалось выше в отношении аналогов. Следует отметить, что эти фрагменты представляют собой особый класс аналогов данного изобретения, а именно, они являются определенными частями MORT-1-связывающих белков, происходящих из полноразмерной последовательности MORT-1-связывающего белка (например, из любой последовательности одной из иэоформ МАСН), причем каждая из таких частей (или фрагментов) имеет любую из вышеописанных активностей. Такой фрагмент может быть, например, пептидом. Подобным образом, производные могут быть получены стандартными модификациями боковых групп одного или нескольких аминокислотных остатков MORT-1-связывающего белка, его аналогов или фрагментов, или сопряжением МОRТ-1-связывающего белка, его аналогов или фрагментов с другой молекулой, например, с антителом, ферментом, рецептором и т.д., как хорошо известно в данной области. Таким образом, термин “производные”, в применении здесь, охватывает производные, которые могут быть получены из функциональных групп, которые присутствуют в виде боковых цепей на остатках, или N- или С-концевых групп способами, известными в данной области, и производные также включены в данное изобретение. Производные могут иметь химические части, такие как углеводные или фосфатные остатки, при условии, что такая фракция имеет такую же или более высокую биологическую активность, чем активность MORT-1-связывающих белков. Например, производные могут включать алифатические эфиры карбоксильных групп, амиды карбоксильных групп, полученные реакцией с аммиаком или с первичными или вторичными аминами, N-ацильные производные свободных аминогрупп аминокислотных остатков, образованные с ацильной частью (например, алканоильной или карбоциклической ароильной группой), или O-ацильные производные свободной гидроксильной группы (например, гидроксильной группы серильного или треонильного остатка), образованные с ацильными частями молекулы. Термин “производные” подразумевает только те производные, которые не заменяют одну аминокислоту на другую из двадцати обычно встречающихся природных аминокислот. Хотя MORT-1-связывающий белок является белком или полипептидом, он представляет собой последовательность аминокислотных остатков. Полипептид, состоящий из большей последовательности, которая включает в себя всю последовательность MORT-1-связывающего белка, в соответствии с данными здесь определениями, также предназначен для включения в список таких полипептидов, при условии, что добавления не влияют на основные и новые характеристики данного изобретения, т.е., если они либо сохраняют, либо увеличивают биологическую активность MORT-1-связывающего белка или могут расщепляться с образованием белка или полипептида, имеющего биологическую активность MORT-1-связывающего белка. Таким образом, например, данное изобретение включает в себя слитые белки MORT-1-связывающего белка с другими аминокислотами или пептидами. Новый MORT-1-связывающий белок, его аналоги, фрагменты и производные имеют ряд применений, например: (i) MORT-1-связывающий белок, его аналоги, фрагменты и производные могут быть использованы для имитации или усиления функции MORT-1 и, следовательно, лиганда FAS-R или TNF, в ситуациях, где желательно действие лиганда FAS-R или TNF, таких как противоопухолевые, противовоспалительные, антивирусные применения, и т.д., где желательна индуцированная лигандом FAS-R или TNF цитотоксичность. В таком случае MORT-1-связывающий белок, его аналоги, фрагменты или производные, усиливающие действие лиганда FAS-R или TNF, т.е. цитотоксическое действие, могут быть введены в клетки стандартными способами, известными per se. Например, поскольку MORT-1-связывающие белки являются внутриклеточными и должны вводиться только в клетки, в которых желательно действие лиганда FAS-R или TNF, необходима система для специфического введения этого белка в клетки. Одним из способов для этого является создание рекомбинантного вируса животного, например, произведенного из Vaccinia, в ДНК которого должны быть введены следующие два гена: ген, кодирующий лиганд, который связывается с белками клеточной поверхности, специфически экспрессируемыми этими клетками, например, такими, как gр120-протеин вируса СПИДа (ВИЧ), который специфически связывается с некоторыми клетками (CD4-лимфоцитами и родственными лейкозами), или любой другой лиганд, который связывается специфически с клетками, несущими FAS-R или p55-R, так что рекомбинантный вирусный вектор будет способен связывать такие несущие FAS-R или p55-R клетки; и ген, кодирующий MORT-1-связывающий белок. Таким образом, экспрессия связывающего белка клеточной поверхности на поверхности вируса будет нацеливать этот вирус специфически на опухолевую клетку или другую несущую FAS-R или p55-R клетку, после чего кодирующая последовательность MORT-1-связывающего белка будет введена в клетки посредством этого вируса и при экспрессии в этих клетках будет приводить к усилению действия лиганда FAS-R или TNF, приводящего к гибели опухолевых клеток или других несущих FAS-R или p55-R клеток, которые желательно убить. Конструирование такого рекомбинантного вируса животного является стандартной процедурой (см., например, Sambrook et al., 1989). Другой возможностью является введение последовательностей MORT-1-связывающего белка (например, любой из изоформ МАСН) в форме олигонуклеотидов, которые могут адсорбироваться клетками и экспрессироваться в них. (ii) Они могут использоваться для ингибирования действия лиганда FAS-R или TNF, например, в таких случаях, как повреждение ткани при септическом шоке, отторжении трансплантата согласно реакции трансплантат-против-хозяина или остром гепатите, в которых желательно блокировать внутриклеточную реакцию индуцированную лигандом FAS-R или TNF передачу сигнала FAS-R или p55-R. В этой ситуации можно, например, ввести в клетки, стандартными способами, олигонуклеотиды, имеющие антисмысловую кодирующую последовательность для MORT-1-связывающего белка, которые будут эффективно блокировать трансляцию мРНК, кодирующую MORT-1 или MORT-1-связывающий белок, и тем самым блокировать ее экспрессию и приводить к ингибированию действия лиганда FAS-R или TNF. Такие олигонуклеотиды могут быть введены в клетки при помощи описанного выше подхода с рекомбинантным вирусом, причем второй последовательностью, переносимой этим вирусом, является олигонуклеотидная последовательность. Другой возможностью является использование антител, специфических для MORT-1-связывающего белка, для ингибирования его активности внутриклеточной передачи сигнала. Еще одним способом ингибирования действия лиганда FAS-R или TNF является недавно разработанный подход с использованием рибозима. Рибозимы являются каталитическими молекулами РНК, которые специфически расщепляют РНК. Рибозимы могут быть сконструированы для расщепления целевых РНК по выбору, например, мРНК, кодирующих MORT-1-связывающий белок данного изобретения. Такие рибозимы могут иметь последовательность, специфическую для мРНК MORT-1-связывающего белка, и быть способными к взаимодействию с ней (посредством комплементарного связывания) с последующим расщеплением этой мРНК, что приводит к уменьшению (полной утрате) экспрессии MORT-1-связывающего белка, причем уровень пониженной экспрессии зависит от уровня экспрессии рибозима в клетке-мишени. Для введения рибозимов в выбранные клетки (например, клетки, несущие FAS-R или p55-R) может быть использован любой подходящий вектор, например, плазмидный, вирусный (ретровирусный) векторы (вирус животного), которые обычно используют для этой цели (см. также (i) выше, причем этот вирус имеет в качестве второй последовательности кДНК, кодирующую выбранную последовательность рибозима). (Для знакомства с обзором, способами и т.д., касающимися рибозимов, см. Chen et al., 1992; Zhao and Pick, 1993; Shore et al., 1993; Joseph and Burke, 1993; Shimayama et al., 1993; Cantor et al., 1993; Barinaga, 1993; Crisel et al., 1993 и Koizumi et al., 1993). (iii) MORT-1-связывающий белок, его аналоги, фрагменты или производные могут быть также использованы для выделения, идентификации и клонирования других белков того же класса, т.е. белков, связывающихся с внутриклеточным доменом FAS-R или с функционально родственными рецепторами, или белков, связывающихся с MORT-1 и тем самым с функционально родственными рецепторами, такими как FAS-R и p55-R, и участвующих во внутриклеточной передаче сигнала. В этом случае применения может быть использована двухгибридная система дрожжей или может быть использована недавно разработанная система с использованием гибридизации по Саузерну в нестрогих условиях с последующим ПЦР-клонированием (Wilks et al., 1989). В публикации Wilks et al. описаны идентификация и клонирование двух предполагаемых протеинтирозинкиназ путем применения нестрогих условий гибридизации по Саузерну с последующим клонированием при помощи ПЦР на основе известной последовательности мотива киназы, представляемой последовательности киназы. Этот подход может быть использован в данном изобретении с использованием последовательности MORT-1-связывающего белка (например, любой из изоформ МАСН) для идентификации и клонирования изоформ МАСН, родственных MORT-1-связывающим белкам. (iv) Еще одним подходом для использования MORT-1-связывающего белка или его аналогов, фрагментов или производных данного изобретения является использование их в способах аффинной хроматографии для выделения и идентификации других белков или факторов, с которыми они способны связываться, например, MORT-1 или других белков или факторов, участвующих во внутриклеточной передаче сигнала. В этом применении MORT-1-связывающий белок, его аналоги, фрагменты или производные данного изобретения могут быть отдельно присоединены к матриксам аффинной хроматографии и затем приведены в контакт с клеточными экстрактами или выделенными белками или факторами, предполагаемыми участниками процесса внутриклеточной передачи сигнала. После процедуры аффинной хроматографии другие белки или факторы, которые связываются с MORT-1-связывающим белком или его аналогами, фрагментами или производными данного изобретения, могут быть элюированы, выделены и охарактеризованы. (v) Как отмечалось выше, MORT-1-связывающий белок или его аналоги, фрагменты или производные данного изобретения могут быть также использованы в качестве иммуногенов (антигенов) для получения специфических для них антител. Эти антитела также можно использовать для целей очистки MORT-1-связывающего белка (например, изоформ МАСН) либо из клеточных экстрактов, либо из линий трансформированных клеток, продуцирующих MORT-1-связывающий белок или его аналоги или фрагменты. Далее, эти антитела могут быть использованы для диагностических целей для идентификации расстройств, связанных с аномальным функционированием системы лиганда FAS-R или TNF, например, сверхактивных или малоактивных индуцируемых лигандом FAS-R или TNF клеточных эффектов. Так, если бы такие расстройства были связаны с нарушением функции системы внутриклеточной передачи сигнала с участием белка MORT-1 или MORT-1-связывающего белка, такие антитела могли бы служить важным диагностическим инструментом. Следует заметить, что выделение и характеристика MORT-1-связывающего белка (например, изоформ МАСН) данного изобретения могут выполняться с использованием хорошо известных стандартных способов скрининга. Например, один из этих способов скрининга, дрожжевой двухгибридный способ, изложенный здесь (Пример 1), использовали для идентификации белка MORT-1 и затем MORT-1-связывающих белков (Примеры 2-3) данного изобретения. Также, как отмечено выше и ниже, могут быть использованы другие способы, такие как аффинная хроматография, способы гибридизации ДНК и т.д., а также хорошо известные в данной области способы выделения, идентификации и характеристики MORT-1-связывающего белка данного изобретения или выделения, идентификации и характеристики дополнительных белков, факторов, рецепторов и т.д., которые способны связываться с белком MORT-1 или с MORT-1-связывающим белком данного изобретения. Как описано выше, MORT-1-связывающий белок может быть использован для получения антител, специфических для MORT-1-связывающий белок, например, изоформ МАСН. Эти антитела или их фрагменты могут быть использованы, как описано подробно ниже, причем понятно, что в этих применениях антитела или их фрагменты представляют собой антитела, специфические для MORT-1-связывающих белков. На основании открытий, описанных в данном изобретении, что по меньшей мере некоторые из изоформ МАСН (см. выше и Пример 3 ниже) являются протеазами, родственными протеазам семейства протеаз CED3/ICE, следующие специфические применения в медицине предполагаются для этих изоформ МАСН: было обнаружено, что уже существуют специфические ингибиторы других протеаз CED3/ICE, некоторые из которых могут проникать в клетки, которые могут эффективно блокировать процессы программируемой гибели клеток. Таким образом, в соответствии с данным изобретением можно сконструировать ингибиторы, которые могут предотвращать индуцируемую лигандом FAS-R или TNF гибель клеток, пути, в которых участвуют изоформы протеазы МАСН. Далее, в связи с уникальными признаками последовательности этих новых протеаз МАСН, представляется возможным конструирование ингибиторов, которые будут высокоспецифическими в отношении индуцируемых TNF и лигандом FAS-R эффектов. Открытия данного изобретения обеспечивают также способ исследования механизма, в котором “убивающая (киллерная) протеаза” активируется в ответ на лиганд FAS-R и TNF, что делает возможной последующую разработку лекарственных средств, которые могут контролировать степень этой активации. Существуют заболевания, в которых такие лекарственные средства могут оказывать большую помощь. Среди прочих, острый гепатит, в котором острое повреждение печени, по-видимому, отражает медиируемую лигандом FAS-R гибель клеток печени; аутоиммунно-индуцируемая гибель клеток, например гибель Как упомянуто здесь выше и ниже, по-видимому, две изоформы МАСН, МАСН Неограничивающий пример того, как могут быть сконструированы и подвергнуты скринингу пептидные ингибиторы протеаз МАСН, основан на предыдущих исследованиях пептидных ингибиторов протеаз ICE и ICE-подобных протеаз, субстратной специфичности ICE и стратегиях анализа эпитопов с использованием пептидного синтеза. Было обнаружено, что минимальным требованием для эффективного расщепления пептида ICE является наличие четырех аминокислот слева от сайта расщепления с сильным предпочтением в отношении аспарагиновой кислоты в положении 1 и с метиламином справа от положения P1 (Sleath et al., 1990; Howard et al., 1991; Thornberry et al., 1992). Кроме того, флуорогенный субстрат пептид (тетрапептид), ацетил-Asp-Glu-Val-Asp-a-(4-метилкумарил-7-амид), обозначаемый сокращенно Ac-DEVD-AMC, соответствует последовательности в поли-(АДФ-рибоза)-полимеразе (PARP), который, как было найдено, расщепляется в клетках вскоре после стимуляции FAS-R, а также в других апоптопических процессах (Kaufmann, 1989; Kaufmann et al., 1993; Lasebnik et al., 1994), и расщепляется эффективно СРР32 (членом семейства протеаз CED3/ICE) и протеазами МАСН. Поскольку Asp в положении P1 субстрата, по-видимому, является важным, тетрапептиды, имеющие Asp в качестве четвертого аминокислотного остатка и различные комбинации аминокислот в первых трех положениях, могут быть быстро скринированы на связывание с активным сайтом протеаз МАСН, например, при помощи способа, разработанного Гейсеном (Geysen et al., 1987), в котором большое количество пептидов на твердых подложках скринировали на специфическое взаимодействие с антителами. Связывание протеаз МАСН со специфическими пептидами может быть обнаружено различными хорошо известными способами детектирования в пределах квалификации специалистов в данной области, такими как радиоактивное мечение протеазы МАСН, и т.д. Было показано, что способ Гейсена позволяет тестировать по меньшей мере 4000 пептидов за каждый рабочий день. Поскольку может быть выгодным конструирование пептидных ингибиторов, которые избирательно ингибируют протеазы МАСН без вмешательства в процессы физиологической гибели клеток, в которых участвуют другие члены семейства протеаз CED3/ICE, можно синтезировать, далее, пул пептидов, связывающихся с протеазами МАСН в тесте, таком как описанный выше, в виде флуорогенных субстратных пептидов для тестирования на избирательное расщепление протеазами МАСН без расщепления другими протеазами CED3/ICE. Затем пептиды, которые были определены как избирательно расщепляемые протеазами МАСН, могут быть обратимо или необратимо модифицированы для облегчения их проникаемости в клетки и ингибирования активности гибели клеток МАСН. Thornberry et al. (1994) сообщили, что тетрапептид (ацилокси)-метилкетон Ac-Tyr-Val-Ala-Asp-CH2OC(О)-[2,6-(CF)2]Ph является сильным инактиватором ICE. Подобным образом, Milligan et al. (1995) сообщил, что тетрапептидные ингибиторы, имеющие хлорметилкетоновые (необратимо) или альдегидные (обратимо) группы, ингибировали ICE. Кроме того, было показано, что бензилоксикарбоксил-Аsр-СН2ОС(О)-2,6-дихлорбензол (DCB) ингибирует ICE (Mashima et al., 1995). Таким образом, тетрапептиды, которые избирательно связываются с протеазами МАСН, могут быть модифицированы, например, альдегидной группой, хлорметилкетоновой, (ацилокси)-метилкетоновой или СН2OС(О)-DCB-группой для получения пептидного ингибитора активности протеаз МАСН. Хотя некоторые специфические ингибиторы других протеаз CED3/ICE могут проникать в клетки, может быть необходимым увеличение проникаемости в клетки пептидных ингибиторов. Например, пептиды могут быть химически модифицированы или быть заменены их производными для увеличения их проникаемости через клеточную мембрану и облегчения транспорта таких пептидов через мембрану и в цитоплазму. Muranishi et al. (1991) сообщал о получении производного тиротропин-высвобождающего гормона с лауриновой кислотой, липофильного лауроилпроизводного, с хорошими характеристиками проникновения через клеточную мембрану. Zacharia et al. (1991) также сообщали об окислении метионина до сульфоксида и замене пептидной связи ее кетометиленовым изоэфиром (СОСН2) для облегчения транспорта пептидов через клеточную мембрану. Это лишь некоторые из известных модификаций и производных, которые хорошо известны специалистам в данной области. Кроме того, лекарственные или пептидные ингибиторы, способные ингибировать активность гибели клеток МАСН В U.S. Patent 5149782 описано конъюгирование молекулы, которая должна транспортироваться через клеточную мембрану, с мембраноуплотняющим агентом, таким как способные к слиянию полипептиды, образующие ионные каналы полипептиды, другие мембранные полипептиды, и с длинноцепочечными жирными кислотами, например, миристиновой кислотой, пальмитиновой кислотой. Эти мембраноуплотняющие агенты встраивают молекулярные конъюгаты в липидный бислой клеточных мембран и облегчают их вхождение в цитоплазму. Low et al., U.S. Patent 5108921, представляет обзор доступных способов трансмембранной доставки молекул, таких как (но не только) белки и нуклеиновые кислоты, с использованием механизма медиируемой рецептором эндоцитотической активности. Эти рецепторные системы включают системы, узнающие галактозу, маннозу, маннозо-6-фосфат, трансферрин, асиалогликопротеин, транскобаламин (витамин B12), Известно, что ICE обладает способностью переносить обильные замены в положении Р2 и эта толерантность в отношении замен используется для разработки сильной и высокоизбирательной аффинной метки, содержащей биотиновую метку (тег) (Thornberry et al., 1994). Следовательно, положение P2, а также, возможно, N-конец тетрапептидного ингибитора могут быть модифицированы или использованы для создания производного, например, путем присоединения молекулы биотина, для усиления проникаемости этих пептидных ингибиторов через клеточную мембрану. Кроме того, в данной области знаний известно, что слияние желаемой пептидной последовательности с последовательностью лидерного/сигнального пептида для создания “химерного пептида” позволит такому “химерному пептиду” транспортироваться через клеточную мембрану в цитоплазму. Как будет понятно специалистам в данной области, пептидные ингибиторы протеолитической активности МАСН данного изобретения включают также пептидомиметические лекарственные средства или ингибиторы, которые могут быть также подвергнуты быстрому скринингу на связывание с протеазой МАСН, для создания, возможно, более стабильных ингибиторов. Также должно быть понятно, что некоторые способы облегчения или усиления транспорта пептидных ингибиторов через клеточные мембраны, обсужденные выше, применимы также для самих изоформ МАСН, а также для других пептидов и белков, проявляющих их эффекты внутриклеточно. Что касается упоминаемых в данном описании антител, термин “антитело” включает поликлональные антитела, моноклональные антитела (mAb), химерные антитела, антиидиотипические (anti-Id) антитела к антителам, которые могут быть мечеными, в растворимой или связанной форме, а также их фрагменты, обеспечиваемые любым известным способом, таким как (но не только) ферментативное расщепление, пептидный синтез или рекомбинантные способы. Поликлональные антитела являются гетерогенными популяциями молекул антител, полученных из сывороток животных, иммунизированных антигеном. Моноклональные антитела содержат по существу гомогенную популяцию антител, специфических в отношении антигенов, популяции которых содержат по существу сходные сайты связывания эпитопа. Mab могут быть получены способами, известными специалистам в этой области. См., например, Kohler and Milstein, Nature, 256:495-497 (1975); U.S. Patent No. 4376110; Ausubel et al., eds., Harlow and Lane ANTIBODIES: A LABORATORY MANUAL, Cold Spring Harbor Laboratory (1988); и Colligan et al., eds., Current Protocols in Immunology, Greene Publishing Assoc. and Wiley Interscience N.Y., (1992-1996), содержание которых полностью включено в виде ссылки. Такие антитела могут принадлежать к любому из классов иммуноглобулинов, в том числе, IgG, IgM, IgE, IgA, GILD и к любому их подклассу. Гибридому, продуцирующую mAb данного изобретения, можно культивировать in vitro, in situ или in vivo. Получение высоких титров mAb in vivo или in situ делает этот способ предпочтительным в настоящее время способом их получения. Химерные антитела являются молекулами, различные части которых происходят из различных видов животных, такими как молекулы, имеющие вариабельную область, происходящую из мышиного mАb, и константную область из иммуноглобулина человека. Химерные антитела используют первично для снижения иммуногенности при их применении и для увеличения выходов, например, когда мышиные mАb имеют более высокие выходы при применении гибридом, но большую иммуногенность в человеке, так что используют химерные mAb человек/мышь. Химерные антитела и способы их получения известны в данной области (Cabilly et al., Proc. Nаtl. Асad. Sci. USA 81:3273-3277 (1984); Morrison et al., Proc. Natl. Acad. Sci. USA 81:6851-6855 (1984); Boulianne et al., Nature 312:643-646 (1984); Cabilly et al., European Patent Application 125023 (published November 14, 1984); Neuberger et al., Nature 314:268-270 (1985); Tanigushi et al., European Patent Application 171496 (published February 19, 1985); Morrison et al., European Patent Application 173494 (published March 5, 1986); Neuberger et al., PCT Application WO 8601533 (published March 13, 1986); Kudo et al., European Patent Application 184187 (published June 11, 1986); Sahagan et al., J. Immunol. 137:1066-1074 (1986); Robinson et al., International patent Application No. WO 8702671 (published May 7, 1987); Liu et al., Proc. Natl. Acad. Sci. USA 84:3439-3443 (1987); Better et al., Science 240:1041-1043 (1988); и Harlow and Lane, ANTIBODIES: A LABORATORY MANUAL, supra, (включены полностью в качестве ссылок). Антиидиотипическое (anti-Id) антитело представляет собой антитело, которое узнает уникальные детерминанты, в основном связанные с антигенсвязывающим сайтом антитела. Id-антитело может быть получено иммунизацией животного того же вида и генетического типа (например, штамма мышей), что и источник mAb, к которому получают anti-Id. Иммунизированное животное будет узнавать идиотипическую детерминанту иммунизирующего антитела и отвечать на нее продуцированием антитела к этим идиотипическим детерминантам (anti-Id-антитела). (См., например, U.S. Patent No. 4699880, включ. здесь полностью в качестве ссылки). Anti-Id может также использоваться в качестве “иммуногена” для индукции иммунного ответа в другом животном с получением так называемого анти-антиидиотипического антитела. Anti-anti-Id может быть эпитопно-идентичным исходному mAb, которое индуцировало anti-Id. Таким образом, при помощи антител к идиотипическим детерминантам mAb можно идентифицировать другие клоны, экспрессирующие антитела идентичной специфичности. В соответствии с этим, mAb, генерируемые против MORT-1-свяэывающих белков, их аналогов, фрагментов или производных данного изобретения, можно использовать для индукции anti-Id-антител в подходящих животных, таких как мыши BALB/c. Клетки селезенки из таких иммунизированных мышей используют для получения антиидиотипических гибридов, секретирующих антиидиотипические антитела (anti-Id mAb). Далее, эти антиидиотипические антитела могут быть связаны с носителем, таким как гемоцианин фиссуреллы (KLH), и использованы для иммунизации дополнительных мышей BALB/c. Сыворотки из этих мышей будут содержать анти-антиидиотипические антитела, которые могут иметь связывающую способность исходных mAb, специфических в отношении эпитопа MORT-1-связывающего белка или его аналогов, фрагментов и производных. Таким образом, anti-Id mAb имеют их собственные идиотипические эпитопы, или “идиотопы”, структурно одинаковые с оцениваемым эпитопом, таким как GRB-протеин-а. Термин “антитела” включает также как интактные молекулы, так и их фрагменты, такие как, например. Fab и F(ab`)2, которые способны связывать антиген, фрагменты Fab и F(ab`)2 лишены Fc-фрагмента интактного антитела, выводятся более быстро из кровотока и могут иметь меньшее неспецифическое связывание с тканью, чем интактное антитело (Wahl et al., J. Nucl. Med. 24:316-325 (1983)). Должно быть понятно, что фрагменты Fab и F(ab`)2 и другие фрагменты антител, применяемые в данном исследовании, могут быть использованы для обнаружения и количественного определения MORT-1-связывающего белка в соответствии с описанными здесь способами для интактных молекул антител. Такие фрагменты образуются, как правило, протеолитическим расщеплением с применением таких ферментов, как папаин (для получения Fab-фрагментов) или пепсин (для получения F(ab`)2-фрагментов). Антитело “способно связывать” молекулу, если оно способно специфически реагировать с этой молекулой для связывания этой молекулы с антителом. Термин “эпитоп” относится к части любой молекулы, способной быть связанной антителом, которая может также узнаваться этим антителом. Эпитопы или “антигенные детерминанты” обычно состоят из химически активных групп поверхности молекулы, таких как аминокислоты или сахарные боковые цепи, и имеют специфические трехмерные структурные характеристики, а также специфические характеристики заряда. “Антигеном” является молекула или часть молекулы, способная связываться антителом, которая дополнительно способна индуцировать животное для продуцирования антитела, способного связываться с эпитопом этого антигена. Антиген может иметь один или несколько эпитопов. Специфическая реакция означает, что антиген будет реагировать, с высокой избирательностью, с его соответствующим антителом, но не со множеством других антител, которые могут быть индуцированы другими антигенами. Антитела, в том числе, фрагменты антител, применимые в данном изобретении, можно использовать для количественного или качественного обнаружения MORT-1-связывающего белка в пробе или для обнаружения присутствия клеток, экспрессирующих MORT-1-связывающий белок данного изобретения. Это может быть выполнено иммунофлуоресцентными способами, использующими флуоресцентно меченое антитело (см. ниже), в сочетании с микроскопическими (с применением светового микроскопа), проточно-цитометрическими или флуорометрическими способами детектирования. Антитела (или их фрагменты), применимые в данном изобретении, можно использовать гистологически, как, например, в иммунофлуоресцентной или иммуноэлектронной микроскопии, для обнаружения in situ MORT-1-связывающего белка данного изобретения. Обнаружение in situ может выполняться посредством взятия гистологического образца из пациента и обеспечения меченого антитела данного изобретения к такому образцу. Антитело (или его фрагмент) предпочтительно обеспечивают путем нанесения или путем наслаивания меченого антитела (или его фрагмента) на биологическую пробу. Путем применения такой процедуры можно определить не только присутствие MORT-1-связывающего белка, но также его распределение на обследуемой ткани. При использовании данного изобретения специалисты с обычной квалификацией в данной области легко поймут, что большое разнообразие гистологических способов (таких как процедуры окрашивания) может быть модифицировано для достижения такого детектирования in situ. Такие тесты на MORT-1-связывающий белок данного изобретения обычно включают в себя инкубирование биологической пробы, такой как биологическая жидкость, экстракт ткани, свежесобранные клетки, такие как лимфоциты или лейкоциты, или клетки, которые были инкубированы в культуре ткани, в присутствии детектируемо меченого антитела, способного идентифицировать этот MORT-1-связывающий белок, и детектирование этого антитела любым из хорошо известных в данной области способов. Биологическая проба может быть обработана твердофазным суппортом или носителем, таким как нитроцеллюлоза, или другим суппортом или носителем, который способен иммобилизовать клетки, клеточные частицы или растворимые белки. Затем суппорт или носитель могут быть промыты подходящими буферами с последующей обработкой детектируемо меченым антителом в соответствии с данным изобретением, как описано выше. Твердофазный суппорт или носитель могут быть затем промыты второй раз буфером для удаления несвязавшегося антитела. Количество связанной метки на твердом суппорте или носителе может быть затем определено стандартными способами. Под “твердофазным суппортом”, “твердофазным носителем”, “твердым суппортом”, “твердым носителем”, “суппортом” или “носителем” подразумевают любой суппорт или носитель, способные связывать антиген или антитела. Хорошо известные суппорты или носители включают стекло, полистирол, полипропилен, полиэтилен, декстран, найлон, амилазы, природные и модифицированные целлюлозы, полиакриламиды, gabbros и магнетит. Для целей данного изобретения по своей природе носитель может быть растворимым в некоторой степени или нерастворимым. Материал суппорта может иметь фактически любую возможную структурную конфигурацию, при условии, что он способен связываться с антигеном или антителом. Так, конфигурация суппорта или носителя может быть сферической, в виде гранулы, цилиндрической, как в случае внутренней поверхности тест-пробирки или наружной поверхности стержня. Альтернативно эта поверхность может быть плоской, такой как пластинка, тест-полоска и т.д. Предпочтительные суппорты или носители включают гранулы из полистирола. Специалистам в данной области могут быть известны другие подходящие носители для связывания антитела или антигена или они могут подобрать их сами посредством рутинного экспериментирования. Связывающая активность конкретной партии антител данного изобретения, описанных выше, может быть определена хорошо известными способами. Специалисты в данной области смогут определить рабочие и оптимальные тест-условия для каждого определения посредством рутинного экспериментирования. Другие такие стадии, как промывка, перемешивание, встряхивание, фильтрование и т.п. могут быть добавлены к этим тестам, как это обычно и необходимо для конкретной ситуации. Одним из способов, в которых антитело данного изобретения может быть детектируемо помечено, является связывание его с ферментом и использование в иммуноанализе (EIA). Этот фермент, в свою очередь, при экспонировании затем с подходящим субстратом будет реагировать с субстратом с образованием химической молекулы, которая может быть детектирована, например, спектрофотометрическим, флуорометрическим способами или визуально. Ферменты, которые можно использовать для детектируемого мечения антител, включают (но не только) малатдегидрогеназу, стафилококковую нуклеазу, дельта-5-стероидизомеразу, алкогольдегидрогеназу дрожжей, альфа-глицерофосфатдегидрогеназу, триозофосфатизомеразу, пероксидазу хрена, щелочную фосфатазу, аспарагиназу, глюкозооксидазу, бета-галактозидазу, рибонуклеазу, уреазу, каталазу, глюкозо-6-фосфатдегидрогеназу, глюкоамилазу и ацетилхолинэстеразу. Детектирование может выполняться колориметрическими способами, в которых используют хромогенный субстрат для фермента. Детектирование может также выполняться визуальным сравнением степени ферментативной реакции субстрата в сравнении с так же приготовленными стандартами. Детектирование может выполняться с использованием любого из множества других иммуноанализов. Например, при помощи радиоактивного мечения антител или фрагментов антител можно детектировать R-PTP-азу с применением радиоиммуноанализа (RIA). Хорошее описание RIA можно найти в Laboratory Techniques and Biochemistry in Molecular Biology, by Work, T.S. et al., North Holland Publishing Company, NY (1978) с конкретной ссылкой на раздел, озаглавленный “An Introduction to Radioimmune Assay and Related Techniques” by Chard, T. (включ. здесь в качестве ссылки). Радиоактивный изотоп может детектироваться такими способами, как использование g-счетчика или сцинтилляционного счетчика или радиоавтографии. Согласно данному изобретению, можно также пометить антитело флуоресцентным соединением. При экспонировании флуоресцентно меченого антитела на свету подходящей длины волны его присутствие можно детектировать благодаря флуоресценции. Среди наиболее обычных применяемых для мечения соединений находятся изотиоцианат флуоресцеина, родамин, фикоэритрин, фикоцианин, аллофикоцианин, офталевый альдегид и флуорескамин. Антитело можно также детектируемо пометить с использованием испускающих флуоресценцию металлов, таких как 152E или другие металлы ряда лантанидов. Эти металлы могут быть присоединены к антителу при помощи таких хелатирующих металлы групп, как диэтилентриаминпентауксусная кислота (ЭТПА). Антитело может быть также детектируемо помечено соединением его с хемилюминесцентным соединением. Присутствие хемилюминесцентно-меченого антитела определяют затем детектированием присутствия люминесценции, возникающей в ходе химической реакции. Примерами особенно применимых хемилюминесцентно-метящих соединений являются люминол, theromatic сложный эфир акридиния, имидазол, соль акридиния и оксалатный эфир. Биолюминесцентное соединение также можно использовать для мечения антитела данного изобретения. Биолюминесценция представляет собой тип хемилюминесценции, обнаруженной в биологических системах, в которых каталитический белок увеличивает эффективность хемилюминесцентной реакции. Присутствие биолюминесцентного белка определяют детектированием присутствия люминесценции. Важными биолюминесцентными соединениями для целей мечения являются люциферин, люцифераза и экворин. Молекула антитела данного изобретения может быть приспособлена для использования в иммунометрическом анализе, так же известном как “двух-сайтный” или “сэндвич”-анализ. В типичном иммунометрическом анализе некоторое количество немеченого антитела (или фрагмента антитела) связывают с твердым суппортом или носителем и добавляют некоторое количество детектируемо меченого растворимого антитела для детектирования и/или количественного определения трехкомпонентного комплекса, образующегося между твердофазным антителом, антигеном и меченым антителом. Типичные или предпочтительные иммунометрические тесты включают в себя “прямые” тесты, в которых антитело, связанное с твердой фазой, сначала приводят в контакт с тестируемой пробой для экстракции антигена из этой пробы образованием двухкомпонентного комплекса твердофазное антитело-антиген. После подходящего периода инкубации твердый суппорт или носитель промывают для удаления оставшейся жидкой пробы, содержащей непрореагировавший антиген, если он присутствовал, и затем приводят в контакт с раствором, содержащим некоторое количество меченого антитела (которое функционирует в качестве “репортерной молекулы”). После второго периода инкубации для образования комплекса меченого антитела с антигеном, связанным с твердым суппортом или носителем через немеченое антитело, твердый суппорт или носитель промывают вторично для удаления непрореагировавшего меченого антитела. В “сэндвич”-анализе другого типа, который может быть также применим с антигенами данного изобретения, используют так называемые “одновременные” или “обратные” тесты. “Одновременный” тест включает в себя единственную стадию инкубации, когда антитело, связанное с твердым суппортом или носителем, и меченое антитело вместе и одновременно добавляют в тестируемую пробу. После завершения инкубации твердый суппорт или носитель промывают для удаления остатка жидкой пробы и некомплексированного меченого антитела. Присутствие меченого антитела, связанного с твердым суппортом или носителем, определяют затем, как в стандартном “прямом” сэндвич-анализе. В “обратном” тесте используют ступенчатое добавление сначала раствора меченого антитела к жидкой пробе, а затем добавление немеченого антитела, связанного с твердым суппортом или носителем после подходящего периода инкубации. После второй инкубации твердую фазу промывают стандартным способом для освобождения ее от остатка тестируемой пробы и раствора непрореагировавшего меченого антитела. Затем меченое антитело, связанное с твердым суппортом или носителем, определяют, как в “одновременном” и “прямом” анализах. MORT-1-связывающие белки данного изобретения могут быть получены любым стандартным способом рекомбинантных ДНК (см., например, Sambrook, et al., 1989 и Ansabel et al., 1987-1995, supra), в котором подходящие эукариотические или прокариотические клетки-хозяева, хорошо известные в данной области, трансформируют подходящими эукариотическими или прокариотическими векторами, содержащими последовательности, кодирующие эти белки. Поэтому, данное изобретение относится также к таким экспрессирующим векторам и трансформированным хозяевам, используемым для получения белков данного изобретения. Как упоминалось выше, эти белки включают также биологически активные аналоги, фрагменты и производные, и, следовательно, векторы, кодирующие их, также включают векторы, кодирующие аналоги и фрагменты этих белков, а трансформированные хозяева включают хозяев, продуцирующих такие аналоги и фрагменты. Производные этих белков, продуцируемые трансформированными хозяевами, представляют собой производные, полученные стандартной модификацией белков или их аналогов или фрагментов. Данное изобретение относится также к фармацевтическим композициям, содержащим рекомбинантные вирусные (происходящие из вирусов животных) векторы, кодирующие MORT-1-связывающие белки, причем такой вектор кодирует белок поверхности вируса, способный связывать поверхностные белки специфической клетки-мишени (например, раковых клеток), для направления вставленных последовательностей MORT-1-связывающего белка в эти клетки. Другие фармацевтические композиции данного изобретения содержат в качестве активного ингредиента (а) олигонуклеотидную последовательность, кодирующую антисмысловую последовательность последовательности MORT-1-связывающего белка, или (b) лекарственные средства, которые блокируют протеолитическую активность изоформ МАСН. Фармацевтические композиции согласно данному изобретению включают в себя достаточное количество активного ингредиента для достижения предполагаемой цели. Кроме того, фармацевтические композиции могут содержать подходящие фармацевтически приемлемые носители, включающие наполнители и добавки, которые облегчают обработку активных соединений в препараты, которые могут быть использованы фармацевтически и которые могут стабилизировать такие препараты для введения субъекту, нуждающемуся в них, также хорошо известные специалистам в данной области. MORT-1-связывающий белок МАСН экспрессируется в различных тканях при значительно отличающихся уровнях и, очевидно, с различными распределениями изотопов. Эти различия, возможно, способствуют тканеспецифическим особенностям ответа на лиганд FAS/APO1 и TNF. Как и в случае других гомологов CED3/ICE (Wang et al., 1994; Alnemri et al., 1995), обнаружено, что изоформы МАСН, которые содержат неполные районы CED3/ICE, (например, МАСН Возможно также, что некоторые из изоформ МАСН выполняют другие функции. Способность MACH Вследствие уникальной способности FAS/APO1 и рецепторов TNF вызывать гибель клеток, а также способности рецепторов TNF запускать другие повреждающие ткани активности, нарушения в функции этих рецепторов могли бы быть особенно вредными для организма. Действительно, было показано, что как избыточное, так и недостаточное функционирование этих рецепторов способствует патологическим проявлениям различных заболеваний (Vassalli, 1992; Nagata and Golstein, 1995). Идентификация молекул, которые участвуют в активности передачи сигнала этих рецепторов, и нахождение путей модулирования этой активности этих молекул, могли бы лечь в основу новых терапевтических подходов. В связи с предполагаемой центральной ролью МАСН Другие аспекты данного изобретения будут ясны из следующих далее примеров. Данное изобретение будет описано далее более подробно в следующих неограничивающих примерах и сопутствующих чертежах. Следует также заметить, что процедуры (i) двухгибридного скрининга и двухгибридного теста Пример 1: Клонирование и выделение белка MORT-1, который связывается с внутриклеточным доменом FAS-R (i) Двухгибридный скрининг и двухгибридный тест экспрессии Для выделения белков, взаимодействующих с внутриклеточным доменом FAS-R, использовали дрожжевую двухгибридную систему (Fields and Song, 1989). Вкратце, эта двухгибридная система представляет собой генетический анализ на основе дрожжей для обнаружения специфических белок-белковых взаимодействий in vivo путем восстановления эукариотического активатора транскрипции, такого как GAL4, который имеет два отдельных домена, ДНК-связывающий домен и домен активации, причем эти домены при экспрессии и соединении вместе образуют восстановленный белок GAL4, который способен связываться с лежащей против хода транскрипции активирующей последовательностью, которая, в свою очередь, активирует промотор, который управляет экспрессией репортерного гена, такого как LacZ или HIS3, экспрессию которого легко наблюдать в культивируемых клетках. В этой системе гены для предполагаемых взаимодействующих белков клонируют в разные экспрессирующие векторы. В одном экспрессирующем векторе последовательность предполагаемого белка клонируют в фазе с последовательностью ДНК-связывающего домена GAL4 для образования гибридного белка с ДНК-связывающим доменом GAL4, а в другом векторе последовательность второго предполагаемого взаимодействующего белка клонируют в фазе с последовательностью домена активации GAL4 для образования гибридного белка с доменом активации GAL4. Затем два гибридных вектора котрансформируют в дрожжевой штамм-хозяин, имеющий репортерный ген LacZ или HIS3 под контролем сайтов связывания GAL4 против хода транскрипции. Только трансформированные клетки (котрансформанты), в которых экспрессируются эти два гибридных белка, которые способны взаимодействовать друг с другом, будут способны к экспрессии репортерного гена. В случае присутствия репортерного гена LacZ, клетки-хозяева, экспрессирующие этот ген, станут голубыми при добавлении Х-gа1 к культурам. Следовательно, голубые колонии свидетельствуют о том, что два клонированных кандидата-белка способны взаимодействовать друг с другом. При помощи этой двухгибридной системы клонировали внутриклеточный домен, FAS-IC, отдельно в вектор pGBT9 (несущий ДНК-связывающую последовательностью GAL4, полученный из CLONTECH, USA, см. ниже) для создания слитых белков с ДНК-связывающим доменом GAL4. Для клонирования FAS-R в pGBT9 использовали клон, кодирующий полноразмерную последовательность кДНК FAS-R (WO 9531544), из которой внутриклеточный домен (IC) вырезали стандартными процедурами при помощи различных рестриктаз и затем встраивали в вектор pGBT9, открытый в его районе сайтов множественного клонирования (MCS), соответствующими рестриктазами. Следует отметить, что FAS-IC простирается от аминокислотного остатка 175 до остатка 319 интактного FAS-R, причем эта часть, содержащая остатки 175-319, является FAS-IC, встроенным в вектор pGBT9. Описанный выше гибридный (химерный) вектор котрансфицировали затем вместе с библиотекой кДНК из клеток HeLa человека, клонированный в вектор pGAD GH, несущий активирующий домен GAL4, в дрожжевой штамм-хозяин НЕ7с (все указанные выше векторы, pGBT9 и pGAD GH, несущий кДНК-библиотеку клеток HeLa, и штамм дрожжей были куплены из Clontech Laboratories, Inc., USA, как часть двухгибридной системы MATCHMAKER, №РТ1265-1). Котрансфицированные дрожжи отбирали на их способность расти в среде без гистидина (Нis-среде), причем выращивание колоний свидетельствовало о положительных трансформантах. Затем отобранные дрожжевые клоны тестировали на их способность экспрессировать ген LacZ, т.е. на их активность LACZ, и это выполняли путем добавления Х-gаl к культуральной среде, которая катаболизируется с образованием голубого окрашенного продукта Плазмидную ДНК из His+, LACZ+ дрожжевых колоний выделяли и вводили электропорацией в штамм Е. coli HB 101 стандартными процедурами с последующим отбором Leu+ и ампициллин-резистентных трансформантов, причем эти трансформанты являются трансформантами, несущими гибридный вектор pGAD GH, который имел кодирующие последовательности как АМРR, так и Leu2. Такие трансформанты являются, следовательно, клонами, несущими последовательности, кодирующие новые идентифицированные белки, способные связываться с FAS-IC. Затем из этих трансформированных клеток Е. coli выделяли плазмидную ДНК и повторно тестировали при помощи: (a) повторной трансформации их исходной содержащей внутриклеточный домен FAS-R гибридной плазмидой (гибридом pGBT9, несущим FAS-IC) в дрожжевой штамм HF7, как описано выше. В качестве контролей использовали только векторы, несущие последовательности, кодирующие посторонний белок, например, рАСТ-ламин или pGBT9, для котрансформации с плазмидой, кодирующей FAS-IC-связывающий белок (т.е. MORT-1). Затем котрансформированные дрожжи тестировали на рост на одной His– среде или с различными уровнями 3-аминотриалзола; и (b) повторной трансформации плазмидной ДНК и исходной FAS-IC-гибридной плазмидой и контрольными плазмидами, описанными в (А), в дрожжевые клетки-хозяева штамма SEY526 и определения LАСZ+-активности (эффективности образования Результаты описанных выше тестов выявили, что распределение роста колоний в Нis–-среде было идентичным распределению LACZ-активности, как было оценено по цвету колоний, т.е. His+-колонии были также LACZ+. Далее, LACZ-активность в жидкой культуре (предпочтительных условиях культивирования) оценивали после трансфекции гибридами с ДНК-связывающим доменом GAL4 и активирующим доменом GAL4 в дрожжи-хозяева SFY526, которые имеют лучшую индуцируемость LACZ активатором транскрипции GAL4, чем клетки-хозяева HF7. При помощи описанной выше процедуры был идентифицирован, выделен и охарактеризован белок, обозначенный ранее как MORT-1, а теперь называемый MORT-1 (“Медиатор индуцируемой рецептором токсичности”). Кроме того, следует также отметить, что в ряде описанных выше двухгибридных (ii) Индуцированная экспрессия, метаболическое мечение и иммунопреципитация белков В клетках HeLa экспрессировали MORT-1, N-связанный с октапептидом FLAG (FLAG-MORT-1; Eastman Kodak, New Haven, Ct., USA), FAS-IC, FAS-R, p55-R, химеру, состоящую из внеклеточного домена p55-R (аминокислоты 1-168), слитого с трансмембранным и внутриклеточным доменом FAS-R (аминокислоты 153-319), и кДНК люциферазы, служащей в качестве контроля. Экспрессию проводили с использованием контролируемого тетрациклином экспрессирующего вектора в клоне клеток HeLa (HtTA-1), который экспрессирует контролируемый тетрациклином трансактиватор (Gossen and Bujard, 1992); см. также Boldin et al., 1995). Метаболическое мечение [35S]-метионином и [35S]-цистеином (DUPONT, Wilmington, DE, USA and Amershama, Buckinghamshire, England) выполняли через 18 ч после трансфекции дальнейшим 4-часовым инкубированием при 37 (iii) Связывание in vitro Слитые белки глутатион-S-трансферазы (GST) с FAS-IC дикого типа или с мутированным FAS-IC получали и абсорбировали на глутатион-агарозных гранулах; см. Boldin et al., 1995; Current Protocols in Molecular Biology, 1995; Frangioni and Neel, 1993). Связывание метаболически меченого слитого белка FLAG-MORT-1 с GST-FAS-IC оценивали инкубированием этих гранул в течение 2 ч при 4 (iv) Оценка цитотоксичности, запускаемой индуцированной экспрессией MORT-1 кДНК MORT-1, FAS-IC, p55-R и люциферазы встраивали в контролируемый тетрациклином экспрессирующий вектор и трансфицировали в клетки HtTA-1 (линия клеток HeLa) (Gossen and Bujard, 1992) вместе с кДНК секретируемой плацентарной щелочной фосфатазы, помещали под контроль промотора SV40 (вектор pSBC-2, Dirks et al., 1993). Гибель клеток оценивали спустя 40 ч после трансфекции, либо при помощи теста поглощения красителя нейтрального красного (Wallach, 1984), либо специфически оценкой гибели в клетках, экспрессирующих трансфицированные кДНК путем определения количеств плацентарной щелочной фосфатазы (Berger et аl., 1988), секретируемой в среду для выращивания в последние 5 ч инкубирования. В другой серии экспериментов для анализа района белка MORT-1, участвующего в связывании с FAS-IC, следующие белки экспрессировали временно в клетках HeLa, содержащих контролируемый тетрациклином трансактиватор (HtTA-1), с использованием контролируемого тетрациклином экспрессирующего вектора (pUHD10-3): один FAS-R человека; FAS-R человека, а также N-концевую часть MORT-1 (аминокислоты 1-117, “голова MORT-1”); FAS-R человека, а также С-концевую часть MORT-1, содержащую район гомологии его “домена гибели” (аминокислоты 130-245, “MORT-1 DD”); Flag-55.11 (аминокислоты 309-900 белка 55.11, слитого при N-конце с октапептидом FLAG, причем белок 55.11 является специфически р55-IС-связывающим белком. Спустя 20 ч после трансфекции клетки трипсинизировали и повторно высевали при концентрации 30000 клеток на лунку. После 24 ч дополнительной инкубации клетки обрабатывали в течение 6 ч моноклональным антителом против внеклеточного домена FAS-R (моноклональное антитело СН-11, Oncor, Gaithersburg, MD, USA) при различных концентрациях (0,001-10 мкг/мл моноклонального антитела), в присутствии 10 мкг/мл циклогексимида. Затем определяли жизнеспособность клеток тестом поглощения нейтрального красного, и эти результаты представлены в % жизнеспособных клеток в сравнении с клетками, которые инкубировали только с циклогексимидом (в отсутствие моноклонального антитела СН-11 против FAS-R). (v) Нозерн-анализ и анализ последовательности Поли А+-РНК выделяли из общей РНК клеток HeLa (Oligotex-dT-mRNA kit. QIAGEN, Hilden, Germany). Нозерн-анализ с использованием кДНК MORT-1 в качестве зонда вьшолняли общепринятыми способами (см. Bolding et al., 1995). Нуклеотидную последовательность MORT-1 определяли в обоих направлениях при помощи способа дидезокситерминации цепи. Анализ последовательности кДНК MORT-1, клонированной двухгибридным способом, показал, что она кодирует новый белок. Дальнейшее применение двухгибридного теста для оценки специфичности связывания этого белка (MORT-1 обозначает “Медиатор индуцированной рецептором токсичности”) с FAS-IC, с которым он связывается, привело к следующим результатам (фиг.1): (а) Белок MORT-1 связывается как с человеческим, так и с мышиным FAS-IC, но не связывается с несколькими другими тестированными белками, в том числе с тремя рецепторами семейства рецепторов TNF/NGF (рецепторами TNF р55 и р75 и CD40); (b) Было показано, что заместительные мутации в положении 255 (Ilе) в “домене гибели” FAS-R уничтожали передачу сигнала как in vitro, так и in vivo (мутация lprсg (Watanabe-Fukunga et al., 1992; Itoh and Nagata, 1993), также предотвращает связывание MORT-1 с FAS-IC; (с) Сайт связывания MORT-1 в FAS-R находится внутри “домена гибели” этого рецептора; и (d) MORT-1 связывается с самим собой. Это самосвязывание и связывание MORT-1 с FAS-R происходит с участием различных участков этого белка: Фрагмент MORT-1, соответствующий остаткам 1-117, связывается с полноразмерным MORT-1, но не связывается с самим собой и с FAS-IC. Напротив, фрагмент, соответствующий остаткам 130-245, связывается с FAS-R, но не связывается с MORT-1 (фиг.1). Кроме того, из результатов на фиг.1 видно, что район “домена гибели” FAS-R является решающим для самоассоциации FAS-IC, так же как и район “домена гибели” p55-R для самоассоциации p55-R=IC. Делеции на обеих сторонах этих “доменов гибели” не влияют на способность их самоассоциации, однако делеция внутри этих “доменов гибели” действительно влияет на самоассоциацию. В случае MORT-1, связывание MORT-1 с FAS-IC также зависит от полного “домена гибели” FAS-R, однако она также не зависит от районов вне района “домена гибели” для связывания FAS-IC. На фиг.1 показано взаимодействие белков, кодируемых конструкциями ДНК-связывающего домена и активирующего домена GAL4 (pGBT9 и pGAD-GH) в трансфицированных дрожжах SFY526, оценивамое тестом экспрессии Экспрессия молекул MORT-1, слитых на N-конце с октапептидом FLAG (FLAG-MORT-1), приводила к образованию белков клеток HeLa четырех различных размеров – приблизительно 27, 28, 32 и 34 кД. Взаимодействие MORT-1 с FAS-IC in vitro наблюдали проведением иммунопреципитации белков из экстрактов клеток HeLa, трансфицированных слитым белком FLAG-MORT-1 или кДНК люциферазы в качестве контроля, причем иммунопреципитацию выполняли с антителом против FLAG ( Белки, кодируемые кДНК FLAG-MORT-1, обнаружили также способность связываться с внутриклеточным доменом FAS-R, а также с внутриклеточным доменом химеры FAS-R, внеклеточный домен которой был заменен доменом p55-R (p55-FAS), при коэкспрессии с этими рецепторами в клетках HeLa. В этом случае, взаимодействие MORT-1 с FAS-IC в трансфицированных клетках HeLa, т.е. in vivo, наблюдаемое по иммунопреципитатам различных трансфицированных клеток HeLa, показало взаимодействие in vivo и специфичность взаимодействия между MORT-1 и FAS-IC в клетках, котрансфицированных конструкциями, кодирующими эти белки. Так, слитый белок FLAG-MORT-1 экспрессировали и метаболически метили [32S]-цистеином (20 мкКи/мл) и [32S]-метионином (40 мкКи/мл) в клетках HeLa, отдельно, или вместе с FAS-R человека, химерой FAS-R, в которой внеклеточный домен FAS-R был заменен соответствующим районом человеческого p55-R (p55-FAS), или p55-R в качестве отрицательного контроля. Перекрестную иммунопреципитацию MORT-1 с коэкспрессируемым рецептором выполняли с использованием различных специфических антител. Результаты показали, что FLAG-MORT-1 способен связываться с внутриклеточным доменом химеры FAS-R-p55R, имеющей внеклеточный домен p55-R и внутриклеточный домен FAS-R, при коэкспрессии с этими рецепторами в клетках HeLa. Далее, иммунопреципитация FLAG-MORT-1 из экстрактов трансфицированных клеток также приводила к преципитации коэкспрессированного FAS-R или коэкспрессированной химеры p55-R-FAS. Наоборот, иммунопреципитация этих рецепторов приводила к копреципитации FLAG-MORT-1. Нозерн-анализ с использованием кДНК MORT-1 в качестве зонда обнаружил единственный гибридизующийся транскрипт в клетках HeLa. В Нозерн-блоттинге, в котором поли А+-РНК (0,3 мкг) из трансфицированных клеток гибридизовали с кДНК MORT-1, было обнаружено, что размер РНК-транскрипта (~1,8 т.п.н.) был близок к размеру кДНК MORT-1 (~1702 нуклеотида). В секвенирующем анализе было обнаружено, что эта кДНК содержит открытую рамку считывания для ~250 аминокислот. Фиг.2 изображает предварительную нуклеотидную (SEQ ID №1) и расшифрованную аминокислотную последовательность (SEQ ID №2) MORT-1, в которой подчеркнут мотив “домена гибели”, а также возможный стартовый остаток Met (положение 49; напечатанный жирным шрифтом, подчеркнутый М) и стоп-кодон трансляции (звездочка под кодоном в положении 769-771). Этот мотив “домена гибели” имеет гомологию с известными мотивами “доменов гибели” p55R и FAS-R (p55-DD и FAS-DD). Для определения точного С-конца MORT-1 и для получения доказательства в отношении точного N-конца (начального Met) MORT-1 проводили следующие дополнительные эксперименты. При помощи описанных выше способов конструировали ряд конструкций, кодирующих молекулы MORT-1, слитые на их N-конце с октапептидом FLAG (FLAG-MORT-1), и экспрессировали их в клетках HeLa с метаболическим мечением белков при помощи [32S]-цистеина и [32S]-метионина. Молекулы MORT-1-FLAG кодировались следующими кДНК, содержащими различные части кодирующей MORT-1 последовательности: i) кДНК октапептида FLAG, соединенной с 5`-концом кДНК MORT-1, из которой были делетированы нуклеотиды 1-145 SEQ ID №1 (см. фиг.2); ii) кДНК октапептида FLAG, соединенной с 5`-концом кДНК полноразмерного MORT-1; iii) кДНК FLAG, соединенной с 5`-концом кДНК MORT-1, из которой были делетированы нуклеотиды 1-145, а также нуклеотиды 832-1701 SEQ ID №1 (фиг.2), и кодон GCC в положении 142-144 был мутирован в ТСС для предотвращения начала трансляции в этом сайте. После экспрессии указанных выше слитых продуктов FLAG-MORT-1 проводили иммунопреципитацию, как описано выше, с использованием моноклональных антител против FLAG (M2) или антител против TNF-R р75 в качестве контроля (№9), с последующими электрофорезом в ДСН-ПААГ (на 10% акриламиде) и авторадиографией. Результаты этого анализа с описанными выше слитыми продуктами FLAG-MORT-1 подтвердили С-конец MORT-1 и обеспечили доказательство, что N-конец MORT-1 может находиться в положении 49 последовательности, приведенной на фиг.2. Действительно, было показано дополнительными экспериментами по экспрессии MORT-1 без октапептида FLAG, слитого с его 5`-концом, что Met49 функционирует в качестве эффективного сайта инициации трансляции. Поиск, проведенный в базах данных “Gene Bank” и “Protein Bank”, обнаружил, что в них нет последовательности, соответствующей выделенной последовательности MORT-1. Таким образом, MORT-1 представляет собой новый специфический FAS-IC-связывающий белок. Высокая экспрессия р55-IС приводит к запуску вызывающего гибель клеток действия (Boldin et al., 1995). Экспрессия FAS-IC в клетках HeLa также имеет такое же действие, хотя в более низкой степени, которое можно детектировать только с применением чувствительного теста. Проводили анализ лиганд-независимого запуска цитоцидных эффектов в клетках, трансфицированных MORT-1, а также р55-IС и FAS-IC человека. Действие временной экспрессии MORT-1, FAS-IC человека, р55-IС человека или люциферазы (в качестве контроля) на жизнеспособность клеток HeLa оценивали с использованием контролируемого тетрациклином экспрессирующего вектора. Жизнеспособность клеток оценивали через 40 мин после трансфекции этих кДНК в присутствии или в отсутствие тетрациклина (1 мкг/мл, для ингибирования экспрессии), вместе с кДНК, кодирующей секретируемую плацентарную щелочную фосфатазу. Жизнеспособность клеток определяли тестом поглощения нейтрального красного или (для специфического определения жизнеспособности конкретных клеток, экспрессирующих трансфицированную ДНК) измерением количеств щелочной фосфатазы плаценты, секретируемых в среду для выращивания. Вышеописанный анализ выявил, что экспрессия MORT-1 в клетках HeLa приводила к значительной гибели клеток, большей, чем гибель клеток, вызываемая экспрессией FAS-IC. Эти цитотоксические эффекты всех белков р55-IС, FAS-IC и MORT-1, по-видимому, связаны с районами “доменов гибели”, присутствующими во всех этих белках и имеющими склонность к самоассоциации и тем самым, возможно, усиливающими цитотоксические эффекты. В связи с вышеупомянутыми свойствами MORT-1, а именно, специфическим связыванием MORT-1 с конкретным районом FAS-R, который участвует в индукции гибели клеток, и в связи с фактом, что даже небольшое изменение структуры этого района, препятствующее передаче сигнала (мутация lрrсg], отменяет также связывание MORT-1, можно думать, что этот белок играет важную роль в передаче сигнала или запуске гибели клеток. Это подтверждается далее наблюдаемой способностью MORT-1 самостоятельно запускать цитоцидное действие. Таким образом, MORT-1 может функционировать как (i) модулятор самоассоциации FAS-R благодаря его собственной способности связываться с FAS-R, а также с самим собой, или (ii) служить сайтом стыковки для дополнительных белков, участвующих в передаче сигнала FAS-R, т.е. MORT-1 может быть “стыкующим” белком и, следовательно, может связывать другие рецепторы, кроме FAS-R, или (iii) MORT-1 может быть частью отдельной системы передачи сигнала, которая взаимодействует с передачей сигнала FAS-R. Для дальнейшего анализа районов MORT-1, участвующих в связывании FAS-IC и модулировании опосредованных FAS-R клеточных эффектов (цитотоксичности), вышеописанные эксперименты проводили с использованием векторов, кодирующих части MORT-1 (“голову MORT-1”, аминокислоты 1-117, и “MORT-1-dd”, аминокислоты 130-245) (отдельно), с вектором, кодирующим FAS-R человека для котрансфекции клеток HeLa. В этих экспериментах различные белки и комбинации белков экспрессировали временно в клетках HeLa, содержащих контролируемый тетрациклином трансактиватор (HtTA-1), путем встраивания последовательностей, кодирующих эти белки, в контролируемый тетрациклином экспрессирующий ветор pUHD10-3. В контрольных трансфекциях использовали векторы, кодирующие только FAS-R, и векторы, кодирующие слитый белок FLAG-55.11 (белок 55.11 представляет собой специфически р55-IС-связывающий белок, часть которого, содержащая аминокислоты 309-900, была слита (на ее N-конце) с октапептидом FLAG). После периодов трансфекции и инкубации трансфицированные клетки обрабатывали различными концентрациями моноклонального антитела против FAS-R (CH-11), которое связывается специфически с внеклеточным доменом FAS-R, экспрессируемым клетками. Это связывание антитела против FAS-R индуцирует агрегацию FAS-R на поверхности клеток (а также лиганда FAS-R) и индуцирует внутриклеточный каскад реакций передачи сигнала, медиируемый FAS-IC, приводящий в конце концов к гибели клеток (опосредованной FAS-R клеточной цитотоксичности). Использовали концентрации моноклонального антитела против FAS-R (СН-11) в диапазоне 0,01-10 мкг/мл, обычно концентрации 0,005; 0,05; 0,5 и 5 мкг/мл. Клетки обрабатывали антителом против FAS-R в присутствии 10 мкг/мл циклогексимида. Результаты этого анализа показывают, что экспрессия FAS-R в трансфицированных клетках сообщает увеличенную чувствительность к цитоцидным эффектам антител против FAS-R (сравните “fas” и “55.11”). Далее, коэкспрессия района MORT-1, содержащего район гомологии “домена гибели” и FAS-R (“fas + MORT-1 dd”), сильно препятствует индуцируемой FAS (т.е. опосредованной FAS-R) гибели клеток, как следовало ожидать на основании способности района “домена гибели” (DD) к связыванию с “доменом гибели” FAS-R (FAS-DD). Кроме того, коэкспрессия N-концевой части MORT-1 и FAS-R (“fas + MORT-1 he”) не препятствует опосредованной FAS-R гибели клеток и, если вообще действует, немного увеличивает цитотоксичность (т.е. слегка увеличивает гибель клеток). Таким образом, приведенные выше результаты ясно показывают, что белок MORT-1 имеет два отдельных района, относящихся к связыванию с FAS-IC и медиированию цитотоксичности FAS-R. Следовательно, эти результаты обеспечивают также основу для использования различных частей (т. е. активных фрагментов или аналогов) белка MORT-1 для различных фармацевтических применений. Например, аналоги или фрагменты или их производные белка MORT-1, которые содержат по существу только С-концевую часть MORT-1, включающую его район “домена гибели”, можно использовать для ингибирования опосредованных FAS-R цитотоксических эффектов в содержащих FAS-R клетках или тканях и, следовательно, защищать эти клетки или ткани от вредных действий лиганда FAS-R в таких случаях, как, например, острый гепатит. Альтернативно, аналоги или фрагменты или их производные белка MORT-1, которые содержат по существу только N-концевую часть MORT-1, можно использовать для усиления опосредованных FAS-R цитотоксических эффектов в содержащих FAS-R клетках и тканях и, следовательно, вызывать усиленное разрушение этих клеток или тканей, если это желательно, в таких случаях, как, например, опухолевые клетки и аутореактивные Т- и В-клетки. Как подробно описано выше, указанные применения различных районов MORT-1 можно выполнять с использованием различных рекомбинантных вирусов (например, вируса коровьей оспы) для ведения кодирующей район MORT-1 последовательности в специфические клетки или ткани, которые должны быть обработаны. Кроме того, можно также приготовить и использовать различные другие молекулы, такие как антитела, пептиды и органические молекулы, которые имеют последовательности или молекулярные структуры, соответствующие описанным выше районам MORT-1, для достижения тех же желаемых эффектов, медиируемых этими районами MORT-1. Кроме того, MORT-1 можно использовать для специфической идентификации, выделения и характеристики других белков, способных связываться с MORT-1 (т.е. MORT-1-связывающих белков), см. Примеры 2 и 3. Пример 2: Выделение MORT-1-связывающего белка (i) Двухгибридный скрининг и двухгибридный тест экспрессии Аналогично процедуре, описанной в Примере 1, с использованием внутриклеточного домена р55 TNF-R (р55-IС) и MORT-1 в качестве “приманок” и скрининга библиотеки В-клеток человека были получены два клона кДНК, которые кодируют белковый продукт, способный связываться как с MORT-1, так и с р55-IС. Оба клона имеют идентичные нуклеотидные последовательности на 5`-конце, как показано на фиг.3 (SEQ ID №3). (ii) Связывающие свойства новых клонированных кДНК в двухгибридных скринингах С использованием вышеупомянутой дрожжевой двухгибридной процедуры конструкцию, содержащую кДНК нового MORT-1-связывающего белка, использовали в качестве “добычи”, к которой добавляли конструкции ряда “приманок” в отдельных реакциях, для определения специфичности связывания MORT-1-связывающего белка, кодируемого этой кДНК. Эти “приманки” включали конструкции, кодирующие MORT-1, части MORT-1 (“голову MORT-1”, аминокислоты 1-117, “хвост MORT-1”, аминокислоты 130-245), р55-IС (206-426 р55) или его части (“домен гибели”, 326-426 р55; и другие против хода транскрипции “домена гибели”, т.е. 206-326). Результаты показаны в таблице 2. Приведенные выше результаты двухгибридного теста экспрессии В общем, MORT-1-связывающий белок может быть использован непосредственно для модулирования или медиирования связанных с MORT-1 действий на клетки или, опосредованно, для модулирования или медиирования действия лиганда FAS-R на клетки, кода это действие модулируется или медиируется MORT-1. То же самое является справедливым в отношении других внутриклеточных белков или внутриклеточных доменов трансмембранных белков, как было специально продемонстрировано для TNF-R p55 здесь. MORT-1-связывающие белки включают белки, которые специфически связываются с целым белком MORT-1, или белки, которые связываются с различными районами белка MORT-1, например, с указанными выше N- и С-концевыми районами MORT-1. MORT-1-связывающие белки, которые специфически связываются с такими районами, могут использоваться для модулирования активности этих районов и, следовательно, специфической активности MORT-1, определяемой этими районами. Пример 3: Выделение и характеристика белка МАСН, другого MORT-1-связывающего белка (1) Двухгибридный скрининг, двухгибридный При помощи процедуры, описанной в Примерах 1 и 2, полноразмерную конструкцию, кодирующую белок MORT-1 человека, использовали в качестве “приманки” в дрожжевой двухгибридной системе для выделения клона кДНК, кодирующего еще один новый MORT-1-связывающий белок. Этот новый белок первоначально был обозначен как MORT-2, а теперь переименован и называется МАСН (т.е. MORT-1-ассоциированный гомолог CED3) на основании его характеристик, подробно описанных ниже. Этот клон кДНК секвенировали стандартными способами, изложенными в Примерах 1 и 2 выше. Анализ последовательности при помощи стандартных процедур и компьютерной программы (см. Примеры 1 и 2) обнаружил, что эта кДНК является новой последовательностью и кодирует новый белок (ни последовательность ДНК, ни аминокислотная последовательность не были найдены в базах данных GENBANK или PROTEINBANK). Далее, кДНК, кодирующая MACH, обнаружила открытую рамку считывания ORF-B, которая имеет сильную гомологию с описанным выше районом (5` против хода транскрипции) мотива “домена гибели” белка MORT-1 (см. Пример 1). На фиг.4А-С показаны структура части клона кДНК MACH, которая содержит ORF-B (235 аминокислотных остатков; фиг.4А); расшифрованная аминокислотная последовательность (SEQ ID №5) ORF-B MACH (фиг.4В); и нуклеотидная последовательность (SEQ ID №4) молекулы кДНК MACH (фиг.4С). На фиг.4А заштрихованная область ORF-B является районом, имеющим высокую гомологию с районом MORT-1 против хода транскрипции от мотива “домена гибели” MORT-1, и этот район гомологии ORF-B MACH состоит из аминокислотных остатков, подчеркнутых на фиг.5В. Далее дрожжевой двухгибридный тест применяли для оценки специфичности связывания MACH с MORT-1, в частности, для определения района MORT-1, с которым связывается MACH, a также для определения, какая из ORF MACH взаимодействует с MORT-1, причем процедуры изложены здесь выше в Примерах 1 и 2. Вкратце, готовили различные конструкции MORT-1 и MACH для тестирования взаимодействия белков, кодируемых конструкциями ДНК-связывающего домена и активирующего домена GAL4, в трансфицированных SЕY526-дрожжевых клетках с оценкой при помощи теста на фильтрах экспрессии Таким образом, как видно из результатов, представленных в таблице 3 выше, очевидно, что: (a) МАСН связывается с MORT-1 очень сильно и специфично; (b) сайт связывания МАСН в MORT-1 находится перед (против хода транскрипции) мотивом “домена гибели” в MORT-1, т.е. он находится в районе MORT-1, определяемом аминокислотами 1-117 MORT-1; (c) Район ORF-B МАСН является взаимодействующим с MORT-1 районом белка МАСН; и (d) Район ORF-B МАСН способен к самосвязыванию (самоассоциации). (ii) Клеточно-цитотоксические эффекты, опосредованные способностью самоассоциации белка МАСН Наблюдение, что МАСН может самоассоциироваться, в частности, что район ORF-B МАСН самоассоциируется, и клеточная цитотоксичность, наблюдаемая для внутриклеточных доменов TNF-R р55 и FAS-R и наблюдаемая для MORT-1 (см. Пример 1), предполагали, что самоассоциация МАСН может также принимать участие в клеточной цитотоксичности. Для исследования этой возможности готовили конструкции, кодирующие МАСН с применением контролируемого тетрациклином экспрессирующего вектора (детали см. в Примере 1). Эти конструкции использовали для трансфекции клеток HeLa, в которых эти векторы временно экспрессировали. Кроме конструкций МАСН, другие контрольные конструкции применяли для оценки действия временной экспрессии на жизнеспособность клеток HeLa, с которыми можно было сравнивать действие конструкций МАСН. Эти другие конструкции включали MORT-1, FAS-IC человека и люциферазу (Luc). Кроме того, тестировали также котрансфекцию клеток HeLa с использованием конструкций MORT-1 и МАСН для определения того, какие эффекты могло бы вызвать взаимодействие между этими белками. После трансфекции клетки HeLa инкубировали и жизнеспособность клеток оценивали спустя 48 ч после трансфекции в присутствии или в отсутствие тетрациклина (1 мкг/мл) для ингибирования экспрессии. Жизнеспособность клеток определяли тестом поглощения нейтрального красного. Эти результаты показаны на фиг.6, которая изображает в виде диаграммы лиганд-независимый запуск цитоцидных эффектов в клетках, трансфицированных МАСН, в сравнении с клетками, трансфицированными конструкциями, кодирующими другие белки, а также котрансфицированными клетками (MORT 1 + МАСН). Результаты представлены в виде жизнеспособности клеток в единицах OD при 540 нм для каждой конструкции, причем для каждой конструкции заштрихованный столбец представляет инкубацию клеток после трансфекции в отсутствие тетрациклина, а сплошной столбец представляет инкубацию трансфицированных клеток в присутствии тетрациклина. Из результатов, показанных на фиг.6, видно, что МАСН индуцирует сильный цитотоксический эффект в клетках HeLa, т.е. индуцированную сверхэкспрессию кДНК МАСН в клетках HeLa, приводящую к драматическому цитотоксическому эффекту. Этот цитотоксический эффект, по-видимому, связан со способностью МАСН к самоассоциации. (iii) Нозерн-анализ При помощи хорошо известных процедур (см. Пример 1) проводили Нозерн-анализ некоторых клеточных линий с использованием кДНК МАСН в качестве зонда. Результаты этого анализа показывают, что в большом числе клеточных линий, в частности, в клеточных линиях СЕМ, Raji, Daudi, HeLa, Alexander, Jurkat и А673 существуют два гибридизующихся транскрипта с размером приблизительно 3,2 т.п.н. В связи с вышесказанным, белок МАСН, в частности, белок MACH Дальнейшие анализы белка МАСН и последовательностей ДНК, кодирующих его, проводили, как описано ниже. Далее, было обнаружено, что ORF-B МАСН представляет собой только одну из изоформ МАСН. Поэтому белок МАСН и кодирующие его последовательности ДНК были переименованы, как станет ясно из следующего описания. (а) Двухгибридный скрининг на белки, которые связываются с MORT-1, обнаружил новый белок, который содержит общий мотив последовательности с MORT-1 Как упоминалось выше, для идентификации белков, которые участвуют в индукции гибели клеток MORT-1, использовали двухгибридный способ для скрининга библиотек кДНК на белки, которые связываются с MORT-1. Двухгибридный скрининг библиотеки В-клеток человека (Durfee et al., 1993) с использованием кДНК MORT-1 в качестве “приманки” дал клоны кДНК самого MORT-1, что отражает способность этого белка к самоассоциации, а также клоны TRADD, с которыми эффективно связывается MORT-1 (см. Пример 2). Скрининг дал также клоны кДНК новой последовательности, продукт которой специфически связывается с MORT-1. Этот белок, который первоначально был назван МАСН, а позднее, после обнаружения, что он встречается в виде множественных изоформ (см. ниже), был переименован и назван МАСН На фиг.5 показаны результаты взаимодействия MORT-1 и МАСН в трансфицированных клетках дрожжей. Вкратце, MORT-1 и MACH Сравнение аминокислотных последовательностей в MACH Фиг.7А изображает расшифрованную аминокислотную последовательность (SEQ ID №5) MACH Фиг.8 дает представление в виде диаграммы домена гибели и модулей MORT и района гомологии CED3/ICE в FAS/APO1, MACH Было показано, что район в MORT-1, который содержит “модуль MORT”, принимает участие в индукции гибели клеток этим белком (см. Пример 1 выше). Было показано также, что он способствует, хотя и не является достаточным для этого, самоассоциации MORT-1 (см. Пример 1). Как показано на фиг.5, анализ связывающих свойств делеционных конструкций MACH Фиг.9А показывает оценку экспрессии этих белков и их молекулярных размеров иммунопреципитацией из клеточных лизатов при помощи антитела против FLAG. Использовали следующие антитела: Кроличьи антисыворотки против MACH (b) MACH встречается в множественных изоформах Нозерн-анализ с использованием кДНК МАСН Исследуя природу этой гетерогенности размеров, библиотеки кДНК подвергали скринингу на транскрипты, которые гибридизуются с кДНК-зондом MACH Для подтверждения, что МАСН Фиг.10 показывает в виде диаграммы различные изоформы МАСН. Кодирующие районы представлены в виде заключенных в блоки зон. Различные домены в кодирующих районах обозначены различными затенениями: модули MORT-1 ( Изоформы клонировали из библиотеки кДНК В-клеток человека (МАСН Клонирование из мРНК клеток Raji и Daudi выполняли при помощи RT-PCR с использованием олигонуклеотидов, соответствующих 3`-некодирующему району и последовательности во втором модуле MORT-1 в MACH Последовательности в различных изоформах связаны друг с другом следующим образом: (а) все изоформы МАСН имеют общий состоящий из 182 аминокислоты N-концевой участок, который охватывает модули MORT, хотя вариируют карбокси-терминально (3`- по ходу транскрипции) относительно этих модулей, а также в их некодирующих районах. (b) На основании их С-концевых последовательностей эти изоформы подразделяются на две подгруппы: четыре изоформы, определяемые как подгруппа Часть изоформ МАСН включает в себя гомолог CED3/ICE. Поиск в банке данных выявил, что С-концевой район изоформ МАСН Указанный выше С-концевой район МАСН наиболее близко сходно с СРР32 (с 41% идентичностью и 62% гомологией) и CTD3 (с 34% идентичностью и 56% гомологией). Он обнаруживает гораздо меньшее сходство с ICE (с 28% идентичностью и 50% гомологией) и с ее близкородственными гомологами ICErelII (также называемый ТХ и Ich) и ICErelIII. Сходство наблюдали почти по всему району, начинающемуся от Туг226 в блоке 3, до С-конца изоформ МАСН Особенно заметными являются два момента сходства: (а) Все известные протеазы семейства CED3/ICE расщепляют белки при сайтах, определяемых присутствием Asp в положении Р1 и остатка небольшой гидрофобной кислоты при Р1`. Хотя эта специфичность отличается в отношении других структурных признаков субстрата, включающих природу остатков в положениях Р2-Р4. Соответственно этому, остатки активного сайта, участвующего в катализе (соответствующие His237, Gly238 и Cys285 в ICE), и карман связывания для карбоксилатной боковой цепи PI Asp (Argl79, Gln283, Arg341 и, возможно, также Ser347) являются консервативными среди этих протеаз. Как показано на фиг.11, эти остатки (отмеченные затенением остатков и сплошными или пустыми кружками под последовательностями) являются также консервативными в MACH (b) Протеазы семейства CED3/ICE содержат сайты саморасщепления. Известно, что некоторые из этих протеаз действительно саморасщепляются и проявление максимальной активности зависит от этого процессинга. Их полная биоактивная форма состоит из двух нековалентно связанных продуктов расщепления, которые отличаются по размеру (р20 и р17 в ICE; p17 и р12 в СРР32, как показано стрелками на фиг.11). Присутствие потенциальных сайтов ауторасщепления в других членах этого семейства предполагает, что они также подвергаются подобному процессингу, от которого зависит проявление максимальной активности. Такие потенциальные сайты ауторасщепления встречаются в MACH (с) Район гомологии CED3/ICE в МАСН имеет протеолитическую активность Для выяснения, обладает ли район гомологии CED3/ICE в МАСН Фиг.12A-F и 13А показывают кинетику расщепления произведенного из последовательности PERP флуорогенного субстрата, Ac-DEVD-AMC (50 мкМ), экстрактами Е. coli, экспрессирующими слитый с GST белок района гомологии CED3/ICE в MACH Это также показывает зависимость от концентрации субстрата расщепления Ac-DEVD-AMC, инкубированного в течение 180 мин с экстрактами бактерий, экспрессирующих район гомологии CED3/ICE MACH Вкратце, слитые с GST белки получали в бактериях XL1-blue с использованием экспрессирующего вектора pGEX3. Бактерии лизировали обработкой ультразвуком в буфере, содержащем 25 мМ HEPES (рН 7,5), 0,1% 3-[3-холамидопропил)диметиламино]-1-пропансульфонат, 5 мМ ЭДТА и 2 мМ ДДТ, с последующим центрифугированием при 16000 g в течение 10 мин. Анализ электрофорезом в ДНС-ПААГ подтвердил присутствие одинаковых уровней различных слитых белков в лизатах (не показано). Аликвоты 50 мкл экстрактов (4 мг/мл общего белка) инкубировали при комнатной температуре в течение указанных периодов времени в общем объеме реакции 500 мкл с флуорогенными субстратами при указанных концентрациях. Высвобождение АМС измеряли спектрофлуорометрией при возбуждающих длинах волн 380 нм и длине волны эмиссии 460 нм. Концентрацию АМС определяли при помощи кривой стандартов. Оба флуорогенных субстрата получали из Peptide Institute Inc. (Osaka, Japan). Было показано, что другие протеазы CED3/ICE проявляют полную активность только после протеолитического процессинга, которые осуществляется либо саморасщеплением, либо через их расщепление другими протеазами (обзор Kumar, 1995; Henkart, 1995). Наблюдение заявителей, что лизаты бактерий, экспрессирующих молекулы GST-MACH Субстратная специфичность МАСН Многие другие ферменты, в том числе, фосфолипазы, сфингомиелиназы и протеинкиназы, могут принимать участие в индукции гибели клеток TNF-R и FAS-R (см. Eischen et al., 1995; Vandenabeele et al., 1995; Cifone et al., 1995 и ссылки в них). Некоторые из этих ферментов становятся активированными в результате протеолитического расщепления, инициируемого МАСН (d) MACH Для выяснения, может ли MACH Как MACH (е) Молекулы МАСН, содержащие район гомологии CED3/ICE, могут медиировать гибель клеток Для выяснения участия МАСН в индукции гибели клеток исследовали действие сверхэкспрессии различных изоформ МАСН на жизнеспособность клеток. Тест выполняли трансфицированием экспрессирующих векторов МАСН вместе с экспрессирующим вектором Вкратце, клетки 293EBNA, клетки карциномы молочной железы человека MCF7 и клетки HeLa HtTA-1 выращивали в модифицированной Дульбекко минимальной основной среде Игла с добавлением 10% фетальной телячьей сыворотки, неосновных аминокислот, 100 Ед/мл пенициллина и 100 мкг/мл стрептомицина. Чашки для культуры ткани (5 Культуры, трансфицированные экспрессирующим вектором MACH В частности, фиг.14A-D показывают морфологию эмбриональных клеток почек человека 293-EBNA, временно экспрессирующих указанные изоформы МАСН. Стрелки (фиг.14В) указывают обнаружившие апоптоз клетки. Фторографии делали через 26 ч после трансфекции. Фиг.15 показывает количественное определение индуцированной МАСН гибели клеток 293-EBNA (светлые прямоугольники) и MCF7 клеток (черные прямоугольники путем определения части экспрессирующих Для исследования участия района гомологии CED3/ICE в изоформах МАСН Фиг.19 представляет в виде диаграммы взаимодействия рецептора и белка-мишени, участвующие в индукции гибели клеток FAS/APO1 (FAS-R) и p55-R. Активность МАСН Возможно, что некоторые из изоформ МАСН обслуживают дополнительные функции. Способность MACH (f) Ингибирование функции МАСН Для оценки вклада МАСН В частности, фиг.16A-D показывают морфологию клеток 293-ENBA, в которых гибель клеток индуцировали временной экспрессией химеры, состоящей из внеклеточного домена p55-R (аминокислоты 1-168), слитого с трансмембранным и внутриклеточным доменами FAS/APO1 (аминокислоты 153-319) (химеры р55-R-FAS) (фиг.16А и 16В), или экспрессией p55-R (фиг.16С и 16D), и клеток, которые были защищены от этих цитотоксических эффектов одновременной трансфекцией их MACH МАСН экспрессируется в различных тканях при заметно отличающихся уровнях и, очевидно, также с различным распределением изотипов. Эти различия, возможно, способствуют тканеспецифическим особенностям ответа на лиганд FAS/APO1 и TNF. Как и в случае других гомологов CED3/ICE (Wang et al., 1994; Ainemri, 1995), обнаружено, что изоформы МАСН, содержащие неполные районы CED3/ICE (например, МАСН После полного описания данного изобретения специалистам данной области должно быть понятно, что все то же самое может быть выполнено в широком диапазоне равноценных параметров, концентраций и условий без отхода от идеи и сферы действия данного изобретения и без чрезмерного экспериментирования. Хотя данное изобретение было описано в связи с его характерными вариантами, должно быть понятно, что возможны дальнейшие его модификации. Эта заявка должна охватывать любые вариации, использования или адаптации данных открытий в соответствии, в общем, с принципами данного изобретения и с такими отступлениями от данного изобретения, которые позволительны в пределах известной и общепринятой практики в области, к которой относится данное изобретение, и в соответствии с его основными признаками, изложенными в объеме прилагаемой формулы изобретения. Все цитированные здесь ссылки, в том числе журнальные статьи или тезисы, опубликованные или соответствующие патентные заявки США или других стран, опубликованные патенты США или иностранные патенты или любые иные ссылки полностью включены ссылкой здесь, в том числе, все данные, таблицы, чертежи и текст, представленные в цитированных ссылках. Кроме того, все содержание цитированных ссылок также включено в качестве ссылок. Ссылка на известные стадии способа, стадии общепринятых способов, известные способы или общепринятые способы ни в коем случае не являются признанием того, что какие-либо аспект, описание или вариант данного изобретения описаны, сообщены или предполагаются в относящейся к делу области знаний. Представленное выше описание характерных вариантов настолько полно раскрывает общий характер данного изобретения, что другие исследователи могут, с применением знаний обычной школы в данной области (в том числе содержания цитированных здесь ссылок), легко модифицировать и/или адаптировать для различных приложений эти характерные варианты, без чрезмерного экспериментирования, без отхода от общей концепции данного изобретения. Таким образом, подобные адаптации и модификации находятся в пределах идеи и диапазона эквивалентов описанных вариантов, основанных на представленных здесь описании и руководящих указаниях. Должно быть понятно, что фразеология или терминология использована здесь для цели описания, а не ограничения, так что эта терминология или фразеология данной заявки должна интерпретироваться специалистом в свете описания и руководящих указаний, представленных здесь, в сочетании со знаниями специалиста с обычной квалификацией в данной области. Источники информации REFERENCES Ainemri, E.S. et al. (1995) J. Biol. Chem. 270:4312-4317. Barinaga, M. (1993) Science 262:1512-1514. Beidler, J. et al., (1995) J. Biol. Chem. 270: 16526-16528. Berger, J. et al., (1988) Gene 66:1-10. Beutler, B. and Cerami, C. (1987) NEJM: 316:379-385. Bigda, J. et al. (1994) J.Exp.Med. 180:445-460. Boldin, M.P. et al. (1995a) J.Biol.Chem. 270:337-341. Boldin, M.P. et al. (1995b) J.Biol.Chem. 270:7795-7798. Brakebusch, C. et al. (1992) EMBO J., 11:943-950. Brockhaus, M. et al. (1990) Proc.Natl.Acad.Sci. USA, 11:3127-3131. Cantor, G.H. et al. (1993) Proc.Natl.Acad.Sci. USA 90:10932-6. Cerreti, D.P. et al. (1992) Science 256:97-100. Chen, C.J. et al. (1992) Ann. N.Y. Acad. Sci. 660:271-3. Chinnaiyan et al. (1995) Cell 81:505-512. Chinnaiyan et al. (1996) J.Biol.Chem. 271:4961-4965. Cifone, M.G. et al. (1995) EMBO J. 14:5859-5868. Clement, M.V. et al. (1994) J.Exp.Med. 180:557-567. Crisell, P. et al., (1993) Nucleic Acids Res. (England) 21 (22):5251-5. Current Protocols in Molecular Biology (Ausubel, F.M., Brent, R., Kingston, R.E., Moore, D.D., Seidman, J.G., Smith, J.A., Struhl, K., Albright, L.M., Coen, D.M. & Varki, A., eds.), (1994) pp.8.1.1-8.1.6 and 16.7-16.7.8, Greene Publishing Associates, Inc. and Wiley & Sons, Inc., New York. Dirks, W., et al., (1993) Gene 128:247-249. Durfee, T. et al. (1993) Genes Dev. 7:555-569. Eischen, C.M. et al. (1994) J. Immunol. 153:1947-1954. Ellis, H.M. et al. (1986) Cell 44:817-829. Enari, M. et al. (1995) Nature 375:78-81. Engelmann, H. et al. (1990) J.Biol.Chem., 265:1531-1536. Faucheu, C. et al. (1995) EMBO J. 14: 1914-1922. Fernandes-Alnemri. T. et al. (1994) J.Biol.Chem. 269:3076l-30764. Fernandes-Alnemri, T. et al. (1995) Cancer Res. 55: 2737-2742. Field, J. et al. (1988) Mol. Cell Biol. 8:2159-2165. Fields, S. and Song, O. (1989) Nature, 110:245-246. Frangioni, J.V. and Neel, B.G. (1993) Anal. Biochem. 210:179-187. Geysen, H.M. (1985) Immunol. Today 6:364-369. Geysen, H.M. et al. (1987) J. Immunol. Meth. 102:259-274. Gossen, M. and Boujard, H. (1992) Proc.Natl.Acad.Sci. USA, 11:5547-5551. Grell, M. et al. (1994) Eur.J.Immunol. 24:2563-2566. Heller, R.A. et al. (1990) Proc.Natl.Acad.Sci. USA, 11:6151-6155. Henkart, P.A. (1996) Immunity 4.:195-201. Hohmann, H.-P. et al. (1989) J.Biol.Chem., 264: 14927-14934. Howard, A.D. et al. (1991) J. Immunol. 147:2964-2969. Hsu, H. et al. (1995) Cell 81:495-504. Hsu, H. et al. (1996) Cell 84:299-308. Itoh, N. et al. (1991) Cell 66:233. Itoh, N. and Nagata, S. (1993) J.Biol.Chem. 268:10932-7. Joseph, S. and Burke, J.M. (1993) J.Biol.Chem. 268:24515-8. Kamens, J. et al. (1995) J. Biol. Chem. 270:15250-15256. Kaufmann, S.H. (1989) Cancer Res. 49:5870-5878. Kaufmann, S.H. (1993) Cancer Res. 53:3976-3985. Kischkel, F.C. et al. (1995) EMBO J. 14:5579-5588. Koizumi, M. et al. (1993) Biol. Pharm. Bull (Japan) 16 (9):879-83. Kumar, S. et al. (1994) Genes Dev. 1:1613-1626. Kumar, S. (1995) Trends Biochem Sci. 20:198-202. Lazebnik, Y.A. et al. (1994) Nature 371:346-347. Leithauser, F. et al. (1993) Lab. Invest. 69:415-429. Loetscher, H. et al. (1990) Cell, 61:351-359. Los, M. et al. (1995) Nature 375:81-83. Martin, S.J. et al. (1995) J.Biol.Chem. 270: 6425-6428. Mashima, T. et al. (1995) Biochem. Biophys. Res. Commun. 209; 907-915. Miller, B.E. et al. (1995) J.Immunol. 154:1331-1338. Milligan, C.E. et al. (1995) Neuron 15:385-393. Miura, M. et al. (1995) Proc.Natl.Acad.Sci., USA 91:8318-8322. Munday, N.A. et al. (1995) J.Biol.Chem. 270:15870-15876. Muranishi, S. et al. (1991) Pharm. Research 8:649. Nagata, S. and Golstein, P. (1995) Science 267, 1449-1456. Nicholson, D.W. et al. (1995) Nature 376:37-43. Nophar, Y. et al. (1990) EMBO J., 1:3269-3278. Piquet, P.P. et al. (1987) J.Exp.Med., 166:1280-89. Ray et al. (1992) Cell 19:597-604. Ruggiero, V. et al. (1987) Cell Immunol. 107:317-25. Sambrook et al. (1989) Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY. Schall, T.J. et al. (1990) Cell, 61:361-370. Schlegel et al. (1996) J. Biol. Chem. 271:1841-1844. Schulze-Osthoff, K. et al. (1994) EMBO J. 13:4587-4596. Shimayama, T. et al., (1993) Nucleic Acids Symp. Ser. 29:177-8. Shore, S.K. et al. (1993) Oncogene 8:3183-8. Sleath, P.R. et al. (1990) J.Biol.Chem. 265:14526-14528. Smith, C.A. et al. (1990) Science, 248:1019-1023. Song, H.Y. et al. (1994) J.Biol.Chem. 269:22492-22495. Stanger, B.Z. et al. (1995) Cell 81:513-523. Tartaglia, L. A. et al. (1993) Cell, 74:845-853. Tewari, M. et al. (1995) J.Biol.Chem. 270:3255-3260. Tewari, M. et al. (1995a) J.Biol.Chem. 270:18738-18741. Tewari, M. et al. (1995b) Cell 81:1-20. Thornberry, N.A. et al. (1992) Nature 356:768-774. Thornberry, N.A. et al. (1994) Biochemistry 33:3934-3940. Tracey, J.T. et al. (1987) Nature, 330:662-664. Vandenabeele, P. et al. (1995) Trends Cell Biol.5:392-400. Vassalli, P. (1992) Ann. Rev. Immunol. 10:411-452. Wallach, D. (1984) J. Immunol. 132:2464-9. Wallach, D. (1986) In: Interferon 7 (Ion Gresser, ed.), pp.83-122, Academic Press, London. Wallach, D. et al. (1994) Cytokine 6:556. Wang, L. et al. (1994) Cell 78:739-750. Watanabe-Fukunaga, R. et al. (1992) Nature, 356:314-317. Watanabe, F.R. et al. (1992) J.Immunol. 148.: 1274–1279. Weitzen, M. et al. (1980) J.Immunol. 125:719-24. Wilks, A.F. et al. (1989) Proc. Natl. Acad. Sci. USA, 86:1603-1607. Wong, et al. (1994) J. Immunol. 152:1751-1755. Xue, D. et al. (1995) Nature 377:248-251. Yonehara, S. et al. (1989) J.Exp.Med. 169:1747-1756. Yuan, J. et al. (1993) Cell 75:641-652. Zaccharia, S. et al. (1991) Eur.J.Pharmacol. 203:353-357. Zhao, J.J. and Pick, L. (1993) Nature (England) 365:448-51. Формула изобретения
1. Последовательность ДНК, кодирующая полипептид, который связывается с MORT-1, где MORT-1 является белком, который связывается с внутриклеточным доменом FAS-R, и который связывается с белком TRADD, который связывается с внутриклеточным доменом р55-TNF-R, и определяющая аминокислотную последовательность указанного полипептида, содержащего а) остатки 1-182 последовательности SEQ ID № 5; b) фрагмент последовательности а), который связывается с MORT-1; или с) аналог а) или b), имеющий не более десяти консервативных замен в аминокислотной последовательности а) или b), где каждая указанная замена является замещением, делецией или инсерцией аминокислоты, при этом аналог связывается с MORT-1. 2. Последовательность ДНК по п.1, где полипептид по подпункту а) п.1 имеет последовательность, идентичную последовательности нативного белка, который связывается с MORT-1, и воздействует на внутриклеточный процесс передачи сигнала, инициируемый связыванием FAS-лиганда с его рецептором или связыванием TNF c p55-TNF-R. 3. Последовательность ДНК по п.1, где полипептид по подпункту а) п.1 является изоформой белка МАСН, выбранной из группы, включающей МАСН 4. Последовательность ДНК по п.3, где указанный полипептид, имеющий последовательность, содержащую а), является МАСН 5. Последовательность ДНК по п.3, где указанная изоформа белка МАСН является МАСН 6. Последовательность ДНК по п.3, где указанная изоформа белка МАСН является МАСН 7. Последовательность ДНК по п.3, где указанная изоформа белка МАСН является МАСН 8. Последовательность ДНК по п.2, кодирующая белок, у которого последовательность является идентичной нативному белку, который связывается с MORT-1. 9. Последовательность ДНК по п.3, кодирующая изоформу белка МАСН выбранную из группы, включающей МАСН 10. Последовательность ДНК по п.9, где указанная изоформа белка МАСН является МАСН 11. Последовательность ДНК по п.9, где указанная изоформа белка МАСН является МАСН 12. Последовательность ДНК по п.9, где указанная изоформа белка МАСН является МАСН 13. Последовательность ДНК по п.9, где указанная изоформа белка МАСН является МАСН 14. Последовательность ДНК, кодирующая полипептид, который связывается с МORT-1, где MORT-1 является белком, который связывается с внутриклеточным доменом FAS-R и который связывается с белком TRADD, который связывается с внутриклеточным доменом р55-TNF-R, причем полипептид воздействует на внутриклеточный процесс передачи сигнала, инициируемый связыванием FAS-лиганда с его рецептором или связыванием TNF c p55-TNF-R, и определяющая аминокислотную последовательность указанного полипептида, содержащего а) остатки 1-182 и 221-479 последовательности SEQ ID № 7; b) фрагмент а), который связывается с MORT-1 и воздействует на внутриклеточный процесс передачи сигнала, инициируемый связыванием FAS-лиганда с его рецептором или связыванием TNF c p55-TNF-R; или с) аналог а) или b), имеющий не более десяти консервативных замен в аминокислотной последовательности а) или b), где каждая указанная замена является замещением, делецией или инсерцией аминокислоты, при этом аналог связывается с MORT-1 и воздействует на внутриклеточный процесс передачи сигнала, инициируемый связыванием FAS-лиганда с его рецептором или связыванием TNF c p55-TNF-R. 15. Последовательность ДНК по п.14, где полипептид по подпункту а) п.14 является нативным белком, который связывается с MORT-1 и воздействует на внутриклеточный процесс передачи сигнала, инициируемый связыванием FAS-лиганда с его рецептором или связыванием TNF с р55-TNF-R. 16. Последовательность ДНК по п.14, где полипептид по подпункту а) п.14 является изоформой белка МАСН, выбранной из группы, включающей МАСН 17. Последовательность ДНК по п.14, кодирующая нативный белок, который связывается с MORT-1 и воздействует на внутриклеточный процесс передачи сигнала, инициируемый связыванием FAS лиганда с его рецептором или связыванием TNF c p55-TNF-R. 18. Последовательность ДНК по п.17, кодирующая изоформу белка МАСН, выбранную из группы, включающей МАСН 19. Вектор для экспрессии, включающий регуляторную последовательность, оперативно связанную с последовательностью ДНК по п.1. 20. Вектор по п.19, способный экспрессироваться в эукариотической клетке -хозяине. 21. Вектор по п.19, способный экспрессироваться в прокариотической клетке-хозяине. 22. Способ получения полипептида, который связывается с MORT-1, включающий выращивание клеток-хозяев, трансформированных вектором по п.19, в условиях, пригодных для экспрессии указанного полипептида, и выделение экспрессированного белка. 23. Полипептид, который связывается с MORT-1, где указанный полипептид имеет последовательность, включающую а) остатки 1-182 последовательности SEQ ID № 5; b) фрагмент а), который связывается с белком МORT-1; или с) аналог а) или b), отличающуюся от них не более чем десятью аминокислотными консервативными заменами, при этом аналог связывается с белком MORT-1. 24. Полипептид п.23, где указанная последовательность, содержащая а), является изоформой белка МАСН, выбранной из группы, включающей МАСН 25. Полипептид по п.23, где указанная последовательность, содержащая а) является МАСН 26. Полипептид по п.23, где указанная последовательность, содержащая а), является МАСН 27. Полипептид по п.23, где указанная последовательность, содержащая а), является МАСН 28. Полипептид по п.23, где указанная последовательность, содержащая а), является МАСН 29. Полипептид по п.23, имеющий последовательность, содержащую а). 30. Полипептид по п.23, имеющий последовательность, содержащую b). 31. Полипептид по п.23, имеющий последовательность, содержащую с). 32. Полипептид по п.23, где указанный аналог с) отличается от а) или b) не более чем пятью аминокислотными заменами. 33. Полипептид по п.23, где указанный аналог с) отличается от а) или b) не более чем тремя аминокислотными заменами. 34. Полипептид, который связывается с MORT-1, где MORT-1 является белком, который связывается с внутриклеточным доменом FAS-R, и который связывается с белком TRADD, который связывается с внутриклеточным доменом р55-TNF-R, причем полипептид воздействует на внутриклеточный процесс передачи сигнала, инициируемый связыванием FAS-лиганда с его рецептором или связыванием TNF c p55-TNF-R, где указанный полипептид содержит а) остатки 1-182 и 221-479 последовательности SEQ ID № 7; b) фрагмент а), который связывается с MORT-1 и воздействует на внутриклеточный процесс передачи сигнала, инициируемый связыванием FAS-лиганда с его рецептором или связыванием TNF c p55-TNF-R; или с) аналог а) или b), имеющий не более десяти консервативных замен в аминокислотной последовательности а) или b), где каждая указанная замена является замещением, делецией или инсерцией аминокислоты, при этом аналог связывается с MORT-1 и воздействует на внутриклеточный процесс передачи сигнала, инициируемый связыванием FAS-лиганда с его рецептором или связыванием TNF c р55-TNF-R. 35. Полипептид по п.34, где полипептид по подпункту а) п.34 является идентичным нативному белку, который связывается с МORT-1 и воздействует на внутриклеточный процесс передачи сигнала, инициируемый связыванием FAS лиганда с его рецептором или связыванием TNF с p55-TNF-R. 36. Полипептид по п.34, где полипептид по подпункту а) п.34 является изоформой белка МАСН, выбранной из группы, включающей МАСН 37. Полипептид по п.34, который имеет последовательность, идентичную последовательности нативного белка, который связывается с MORT-1 и воздействует на внутриклеточный процесс передачи сигнала, инициируемый связыванием FAS-лиганда с его рецептором или связыванием TNF c p55-TNF-R. 38. Полипептид по п.37, который имеет последовательность, идентичную последовательности изоформы белка МАСН, выбранного из группы, включающей МАСН 39. Способ модулирования действия лиганда FAS-R или TNF на клетки, несущие FAS-R или p55-R, предусматривающий обработку указанных клеток полипептидом по п.34. 40. Способ по п.39, где указанная обработка указанных клеток включает введение в клетки одного или нескольких указанных полипептидов в форме, пригодной для их внутриклеточного введения, или введение в указанные клетки последовательности ДНК, кодирующей один или несколько указанных полипептидов в форме подходящего вектора, несущего указанную последовательность, причем этот вектор способен осуществлять введение этой последовательности в эти клетки таким образом, что эта последовательность экспрессируется в клетках. 41. Способ модулирования действия лиганда FAS-R или TNF на клетки по п.40, где указанная обработка клеток включает введение в клетки указанного полипептида или последовательности ДНК, кодирующей указанный полипептид в форме подходящего вектора, несущего указанную последовательность, причем этот вектор способен осуществлять введение этой последовательности в эти клетки таким образом, что эта последовательность экспрессируется в клетках. 42. Способ по п.40, в котором указанная обработка указанных клеток представляет собой трансфекцию этих клеток рекомбинантным вирусным вектором (вируса животного), включающую стадии (а) конструирования рекомбинантного вирусного вектора (вируса животного), несущего последовательность, кодирующую вирусный поверхностный белок (лиганд), который способен связываться со специфическим рецептором клеточной поверхности на поверхности, несущей FAS-R или p55-R клетки, и вторую последовательность, кодирующую указанный полипептид, который при экспрессии в указанных клетках способен модулировать/медиировать активность FAS-R или p55-R, и (b) инфицирования этих клеток вектором (а). 43. Способ по п.39, в котором MORT-1-связывающий белок или указанный полипептид, один из которых способен специфически связываться с MORT-1, который, в свою очередь, специфически связывается с FAS-IC, или который способен связываться с MORT-1, который, в свою очередь, связывается с TRADD, который, в свою очередь, связывается с p55-IC. 44. Способ по п.39, в где указанный полипептид является изоформой МАСН, обозначенной как МАСН 45. Способ по п.39, где указанный полипептид является изоформой МАСН, обозначенной как МАСН 46. Способ модулирования действия лиганда FAS-R или TNF на клетки, несущие FAS-R или p55-R, предусматривающий обработку указанных клеток олигонуклеотидной последовательностью, кодирующей антисмысловую последовательность, комплементарную по меньшей мере части последовательности мРНК, кодирующей MORT-1-связывающий белок по п.34, причем эта олигонуклеотидная последовательность способна ингибировать экспрессию MORT-1 связывающего белка. 47. Способ по п.46, в котором указанная олигонуклеотидная последовательность вводится в указанную клетку с помощью рекомбинантного вирусного вектора (вируса животного). 48. Способ обработки опухолевых клеток, или ВИЧ-инфицированных клеток или других патологических клеток, включающий (а) конструирование рекомбинантного вирусного вектора (вируса животного), несущего последовательность, кодирующую вирусный поверхностный белок, способный связываться со специфическим рецептором поверхности опухолевых клеток, или рецептором поверхности ВИЧ-инфицированных клеток, или рецептором, находящимся на поверхности других патологических клеток, и последовательность, кодирующую полипептид по п.34, который при экспрессии в опухолевой, ВИЧ-инфицированной или другой патологической клетке способен убивать эту клетку; и (b) инфицирование опухолевых, или ВИЧ-инфицированных клеток, или других патологических клеток вектором (а). 49. Способ модулирования действия лиганда FAS-R или TNF на клетки, предусматривающий применение рибозимного способа, в котором вектор, кодирующий последовательность рибозима, способную взаимодействовать с последовательностью клеточной мРНК, кодирующей полипептид по п.34, вводят в эти клетки в форме, которая позволяет экспрессировать последовательность рибозима в этих клетках, причем экспрессия последовательности рибозима в этих клетках приводит к ингибированию экспрессии указанного полипептида в этих клетках. 50. Способ выделения и идентификации белков по п.23, способных связываться с МORT-1, предусматривающий применение дрожжевого двухгибридного способа, в котором последовательность, кодирующая белок MORT-1, переносится одним гибридным вектором, а последовательность из библиотеки кДНК или геномной ДНК переносится вторым гибридным вектором, причем эти векторы затем используются для трансформации дрожжевых клеток-хозяев и позитивные трансформированные клетки выделяют с последующей экстракцией второго гибридного вектора с получением последовательности, кодирующей белок, который связывается с указанным белком MORT-1, причем этот белок является MORT-1-связывающим белком. 51. Способ модулирования индуцируемого MORT-1 действия или индуцируемого MORT-1-связывающим белком действия на клетки, предусматривающий обработку этих клеток полипептидом по п.23 или 34 или последовательностями, кодирующими полипептид по п.23 или 34, причем эта обработка приводит к усилению или ингибированию опосредованного MORT-1 действия и вследствие этого также опосредованного FAS-R или p55-R действия. 52. Способ по п.51, в котором указанный полипептид представляет собой часть MORT-1-связывающего белка, которая специфически участвует в связывании с MORT-1 или с самим MORT-1-связывающим белком, или указанный MORT-1-связывающий белок кодируется последовательностью, которая кодирует часть MORT-1-связывающего белка, который специфически участвует в связывании с MORT-1 или с самим MORT-1-связывающим белком. 53. Способ по п.51, в котором указанный полипептид является одной из изоформ МАСН, выбранной из МАСН 54. Способ по п.51, в котором указанный полипептид является любой из изоформ МАСН, выбранной из МАСН 55. Фармацевтическая композиция для модулирования действия лиганда FAS-R или TNF на клетки, содержащая в качестве активного ингредиента полипептид по п.34 в эффективном количестве для связывания MORT-1, посредством чего снижается действие лиганда FAS-R или TNF на клетки. РИСУНКИ
|
||||||||||||||||||||||||||

 ) и Лимфотоксин (TNF-
) и Лимфотоксин (TNF- ) (далее TNF будет относиться как к TNF-
) (далее TNF будет относиться как к TNF- . Остатки Аlа против хода транскрипции от остатков, соответствующих Cys285 и ICE и остатки Arg и Gly по ходу транскрипции относительно Суs, являются консервативными во всех ранее описанных протеазах семейства CED3/ICE. Остатки, проксимальные относительно остатков P1-P4 субстрата, отмечены треугольниками ниже линии выстраивания
. Остатки Аlа против хода транскрипции от остатков, соответствующих Cys285 и ICE и остатки Arg и Gly по ходу транскрипции относительно Суs, являются консервативными во всех ранее описанных протеазах семейства CED3/ICE. Остатки, проксимальные относительно остатков P1-P4 субстрата, отмечены треугольниками ниже линии выстраивания  ). Известные и ранее предполагаемые сайты расщепления Asp-X и потенциальные сайты расщепления, обнаруженные в сходных положениях в МАСН, заключены в блоки. Стрелки указывают N- и С-терминальные концы субъединиц р20 и р10 ICE и субъединиц р17 и р12 СРР32. С-концы белков обозначены звездочками (*).
). Известные и ранее предполагаемые сайты расщепления Asp-X и потенциальные сайты расщепления, обнаруженные в сходных положениях в МАСН, заключены в блоки. Стрелки указывают N- и С-терминальные концы субъединиц р20 и р10 ICE и субъединиц р17 и р12 СРР32. С-концы белков обозначены звездочками (*). ), в сравнении с отсутствием расщепления экстрактами бактерий, экспрессирующих GST-слитый белок полноразмерного MACH
), в сравнении с отсутствием расщепления экстрактами бактерий, экспрессирующих GST-слитый белок полноразмерного MACH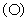 , или районом гомологии CED3/ICE, в котором Суs360 заменен Ser (
, или районом гомологии CED3/ICE, в котором Суs360 заменен Ser ( ), или экстрактами бактерий, экспрессирующими GST-слитые продукты любых из двух потенциальных протеолитических продуктов района гомологии CED3/ICE (Ser217 – Аsр373 (
), или экстрактами бактерий, экспрессирующими GST-слитые продукты любых из двух потенциальных протеолитических продуктов района гомологии CED3/ICE (Ser217 – Аsр373 ( ). В, Субстрат-концентрационная зависимость расщепления Ac-DEVD-AMC. Субстрат инкубировали в течение 180 мин с экстрактами бактерий, экспрессирующих GST-слитый продукт района гомологии CED3/ICE MACH
). В, Субстрат-концентрационная зависимость расщепления Ac-DEVD-AMC. Субстрат инкубировали в течение 180 мин с экстрактами бактерий, экспрессирующих GST-слитый продукт района гомологии CED3/ICE MACH ). Расщепление этого субстрата экстрактами ингибировали в присутствии иодуксусной кислоты
). Расщепление этого субстрата экстрактами ингибировали в присутствии иодуксусной кислоты 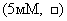 . Ac-YVAD-AMC, флуорогенный субстрат, соответствующий сайту расщепления в предшественнике IL-1
. Ac-YVAD-AMC, флуорогенный субстрат, соответствующий сайту расщепления в предшественнике IL-1 ).
).
 106 кДНК содержат вставку MORT-1. Затем выделенные таким образом клонированные вставки кДНК MORT-1 секвенировали при помощи стандартных процедур секвенирования ДНК. Аминокислотную последовательность MORT-1 (SEQ ID №2) расшифровывали из этой последовательности ДНК. Нумерация остатков в белках, кодируемых этими вставками кДНК, соответствует нумерации банка данных Swiss-Prot. Делеционные мутанты получали при помощи ПЦР, а точковые мутанты – олигонуклеотид-направленным мутагенезом (Current Protocols in Molec. Biol., 1994).
106 кДНК содержат вставку MORT-1. Затем выделенные таким образом клонированные вставки кДНК MORT-1 секвенировали при помощи стандартных процедур секвенирования ДНК. Аминокислотную последовательность MORT-1 (SEQ ID №2) расшифровывали из этой последовательности ДНК. Нумерация остатков в белках, кодируемых этими вставками кДНК, соответствует нумерации банка данных Swiss-Prot. Делеционные мутанты получали при помощи ПЦР, а точковые мутанты – олигонуклеотид-направленным мутагенезом (Current Protocols in Molec. Biol., 1994). С в модифицированной Дульбекко среде Игла, не содержащей метионина и цистеина, но содержащей дополнительно 2% диализованную телячью сыворотку. Затем клетки лизировали в буфере RIPA (10 мМ Трис-HCl, рН 7,5, 150 мМ NaCl, 1% NP-40, 1% деоксихолат, 0,1% ДСН и 1 мМ ЭДТА) и лизат предварительно осветляли инкубированием с посторонней кроличьей антисывороткой (3 мкл/мл) и гранулами Protein G-Sepharose (Pharmacia, Uppsala, Sweden; 60 мкл/мл). Иммунопреципитацию выполняли инкубированием в течение 1 ч при 4
С в модифицированной Дульбекко среде Игла, не содержащей метионина и цистеина, но содержащей дополнительно 2% диализованную телячью сыворотку. Затем клетки лизировали в буфере RIPA (10 мМ Трис-HCl, рН 7,5, 150 мМ NaCl, 1% NP-40, 1% деоксихолат, 0,1% ДСН и 1 мМ ЭДТА) и лизат предварительно осветляли инкубированием с посторонней кроличьей антисывороткой (3 мкл/мл) и гранулами Protein G-Sepharose (Pharmacia, Uppsala, Sweden; 60 мкл/мл). Иммунопреципитацию выполняли инкубированием в течение 1 ч при 4

 ); три блока аминокислотной последовательности, которые встречаются в различных комбинациях в этих изоформах. Показаны положения остатков в районе гомологии CED3/ICE, которые считают определяющими каталитическую активность ICE, на основании рентгеновской (кристаллической) структуры. Те части нуклеотидной последовательности MACH
); три блока аминокислотной последовательности, которые встречаются в различных комбинациях в этих изоформах. Показаны положения остатков в районе гомологии CED3/ICE, которые считают определяющими каталитическую активность ICE, на основании рентгеновской (кристаллической) структуры. Те части нуклеотидной последовательности MACH