Патент на изобретение №2235771
|
||||||||||||||||||||||||||
(54) ШТАММ БАКТЕРИЙ PSEUDOMONAS FLUORESCENS P469 ДЛЯ ПОЛУЧЕНИЯ ПРЕПЕРАТА ПРОТИВ БОЛЕЗНЕЙ РАСТЕНИЙ, ВЫЗЫВАЕМЫХ ФИТОПАТОГЕННЫМИ ГРИБАМИ И БАКТЕРИЯМИ
(57) Реферат:
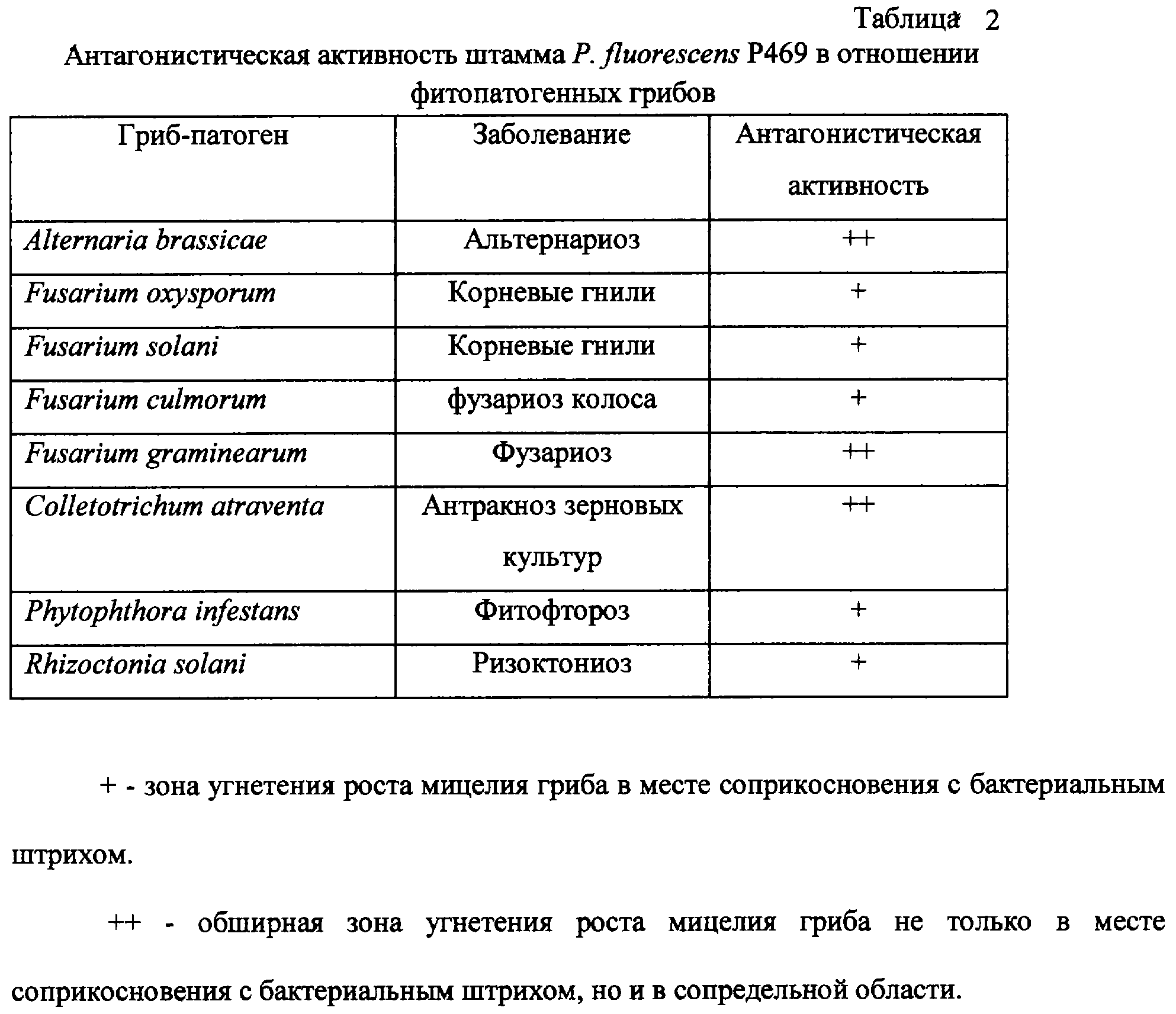
Изобретение относится к биотехнологии и сельскому хозяйству, может быть использовано для получения бактериального препарата против болезней растений, вызываемых фитопатогенными грибами и бактериями, из родов Alternaria, Colletotrichum, Fusarium, Rhizoctonia, Phoma, Phytophthora, Oospora, Erwinia и Pseudomonas. Штамм Pseudomonas fluorescens P469 ЦКМ В-1982 выделен из ризосферы озимой пшеницы Краснодарского края. Штамм хорошо растет на различных средах, в том числе синтетических, в условиях аэрации при 30 Изобретение относится к биотехнологии и касается нового бактериального штамма Pseudomonas fluorescens P469, обладающего супрессорной активностью в отношении фитопатогенных грибов и бактерий из родов Alternaria, Colletotrichum, Fusarium, Rhizoctonia, Phoma, Phytophthora, Oospora, Erwinia и Pseudomonas, который может быть использован для получения бактериального препарата для защиты растений от фитопатогенов. Известны штаммы рода Pseudomonas, предназначенные для защиты растений от грибных и бактериальных патогенов (US №5232850). Однако целевое применение этих штаммов ограничено. Наиболее близким к предлагаемому изобретению является штамм бактерий Pseudomonas putida BKM В-1743Д (патент SU №1805849 A3), предназначенный для получения препарата, используемого для стимуляции роста растений и защиты растений от грибных и бактериальных патогенов. Однако данный штамм имеет более узкий круг супрессируемых фитопатогенов по сравнению с заявляемым штаммом. Задачей изобретения является получение нового штамма Pseudomonas fluorescens, обладающего способностью к подавлению роста широкого круга фитопатогенных грибов и бактерий, и создание на его основе препарата против болезней растений, вызываемых грибными и бактериальными патогенами. Поставленная задача решается тем, что предлагается штамм Pseudomonas fluorescens P469, выделенный из ризосферы озимой пшеницы Краснодарского края, с использованием селективной агаризованной среды Кинга В. Основными критериями отбора служили стимуляция роста растений и подавление роста фитопатогенных грибов и бактерий из родов Alternaria, Colletotrichum, Fusarium, Rhizoctonia, Phoma, Phytophthora, Oospora, Erwinia и Pseudomonas. Штамм Р. fluorescens P469 характеризуется следующими свойствами: Культурально-морфологические признаки Клетки подвижные, палочковидные, с полярными жгутиками, грамотрицательные, спор не образуют. Штамм хорошо растет на следующих средах: МПБ (мясопептонный бульон), LB (триптон – 10 г/л, дрожжевой экстракт – 5 г/л, хлористый натрий – 10 г/л, рН 7,2), Кинга Б (пептон – 20 г/л, глицерин – 10 мл/л, MgSO4 Двухсуточные колонии на ПА сероватые, слизистые, плоские, выпуклые к центру, диаметр 1,5-2 мм. Пигмент зеленый, диффундирующий в среду. Под ультрафиолетом зона вокруг колоний флуоресцирует зеленым светом. Физиолого-биохимические признаки Облигатный аэроб, температурный оптимум роста 28-30 Устойчивость к антибиотикам Штамм проявляет устойчивость к стрептомицину (100 мкг/мл), ампициллину (200 мкг/мл) и тетрациклину (10 мкг/мл). Условия хранения Штамм бактерий Р. fluorescens P469 хранят на чашках или косяках с МПА, ПА или со средой Кинга Б при 5-7 Штамм Р. fluorescens P469 может быть использован в производстве препарата для комплексной защиты растений от широкого круга грибных и бактериальных фитопатогенов. Штамм мало патогенен для теплокровных животных (относится к IV группе патогенности), не токсичен для растений. Штамм Р. fluorescens P469 депонирован в Центральной коллекции микроорганизмов РАО “Биопрепарат”, коллекционный номер ЦКМ В-1982. Пример 1, демонстрирующий отсутствие фитотоксичности у штамма Р. fluorescens P469. Суспензию клеток штамма Р. fluorescens P469 для испытаний готовят следующим образом: в колбу емкостью 750 мл наливают 250 мл стерильной среды LB, вносят 1-2 мл стационарной культуры исследуемого штамма и инкубируют с аэрацией (250 об/мин) при 28 Фитотоксическую активность штамма рассчитывают по формуле: А=(100-Д0/Дк где А – показатель фитотоксичности; Д0 – средний показатель параметра в опыте; Дк – средний показатель параметра в контроле. Фитотоксичными считаются те штаммы, показатель фитотоксичности которых превышает 30%. Отрицательные значения показателя А свидетельствуют о стимулирующем эффекте. Показатели фитотоксичности штамма Р. fluorescens P469 имеют отрицательные значения (таблица 1), свидетельствующие о наличие стимулирующего эффекта. Всхожесть семян в контроле 100%. Пример 2, демонстрирующий антагонизм штамма Р. fluorescens P469 в отношении фитопатогенных бактерий. В качестве тест-объектов используют следующие штаммы фитопатогенных бактерий (в скобках указано вызываемое патогеном заболевание): Pseudomonas solanacearum №9049 (бурая гниль или вилт картофеля), Pseudomonas sp. № 37 (клубневая гниль картофеля), № 115 (мягкая гниль капусты), № 116 (мягкая гниль картофеля) и Erwinia carotovora pv. carotovora S39 (резиновая гниль картофеля). Тестирование антагонистической активности проводят в чашках Петри методом лунок. Используют метод двух слоев, при котором нижним слоем служит голодный агар (в количестве 20 мл на чашку Петри), а верхним (10 мл) питательная среда, оптимальная для роста того или иного патогена: сахарозопептонный агар для Pseudomonas spp. и картофельно-сахарозный агар или Кинга Б для Erwinia carotovora pv. carotovora. Клетки фитопатогенов вносят поверхностно. Для этого на поверхность застывшего слоя питательной среды наносят 0,2 мл суспензии патогена и растирают шпателем. Концентрация суспензии тест-культур должна соответствовать 10 ЕД стандарта мутности. Затем в агаровом слое делают лунки диаметром 8-10 мм и вносят в них по 0,1 мл культуры штамма Р. fluorescens P469, которые для этого растят в среде LB при 28 Чашки инкубируют при 28 Зоны угнетения роста бактерий Erwinia carotovora pv. carotovora S39 составляют 5 мм, a Pseudomonas solanacearum № 9049, Pseudomonas sp. № 37, Erwinia carotovora pv. carotovora № 115 и Erwinia carotovora pv. carotovora № 116 – 15-20 мм, что указывает на антагонистическую активность штамма Р. fluorescens P469 в отношении этих видов фитопатогенов. Пример 3, демонстрирующий антагонистическую активность штамма Р. fluorescens P469 в отношении фитопатогенных грибов Oospora lactis и Phoma esigia. Осуществляют аналогично примеру 2, но в качестве индикаторных тест-объектов используют штаммы грибов Oospora lactis № 5 (резиновая гниль картофеля) и Phoma esigia № 6 (фомозная гниль), и клетки фитопатогенов вносят глубинно (0,18 мл суспензии на 10 мл среды) в составе верхнего слоя питательной среды, в качестве которой используют картофельно-сахарозный агар. Зоны угнетения роста грибов Oospora lactis № 5 и Phoma esigia № 6 штаммом Р. fluorescens P469 составляет в этих условиях 10-30 мм, что показывает антагонистические возможности штамма Р. fluorescens P469 в отношении этих фитопатогенных микроорганизмов. Пример 4, демонстрирующий антагонистическую активность штамма Р. fluorescens P469 в отношении фитопатогенных грибов из родов Alternaria, Fusarium, Colletotrichum, Phytophthora и Rhizoctonia. Тестирование антагонистической активности проводят в чашках Петри с питательным агаром методом штриха. Готовят суспензию штамма Р. fluorescens P469 с плотностью 109 кл/мл, смывая клетки с бактериального газона стерильным раствором 0,9% NaCl. Суспензии фитопатогенных грибов готовят, смывая мицелиальную и споровую массу с газонов грибов на среде Чапека. По диаметральной линии чашки Петри с питательным агаром на основе гидролизата кильки штрихом засевают суспензию патогенного гриба и перпендикулярно к нему – штрихом – суспензии анализируемых бактериальных культур. Чашки инкубируют при 28-30 Пример 5, демонстрирующий антагонистическую активность штамма P. fluorescens P469 в отношении фитопатогенного гриба Gaeumannomyces graminis var. ritici. На чашку Петри с агаризованной средой Каннера сеют бактериальный штамм Р. fluorescens P469 (пятном диаметром 5 мм на расстоянии 3-3,5 см от центра чашки) из суспензии, приготовленной как в примере 4, и выращивают в течение 2 суток для достижения полного синтеза вторичных метаболитов. Затем в центр чашки Петри на поверхность питательного агара помещают сегмент мицелия (диаметром 9 мм) грибного штамма Gaeumannomyces graminis var. tritici, вызывающего офиоболезную гниль корней пшеницы. Мицелий для этого эксперимента выращивают на глюкозокартофельном агаре при комнатной температуре в течение 7 суток. Чашки Петри заклеивают парафильмом для поддержания необходимой влажности и инкубируют при комнатной температуре в течение 5-7 суток. Наличие зоны подавления роста мицелия G. graminis var. tritici штаммом Р. fluorescens P469 свидетельствует об антагонистической активности бактериального штамма в отношении указанного фитопатогенного гриба. Таким образом, штамм Pseudomonas fluorescens P469 обладает способностью к подавлению роста широкого спектра фитопатогенных микроорганизмов (фитопатогенных грибов и бактерий из родов Alternaria, Colletotrichum, Fusarium, Rhizoctonia, Phoma, Phytophthora, Oospora, Erwinia и Pseudomonas), основных возбудителей болезней зерновых культур и картофеля. Штамм не токсичен для растений в рекомендуемых для обработок концентрациях и может быть использован для создания на его основе препарата, предназначенного для профилактической обработки клубней картофеля (защита от гнилей), а также всходов с целью защиты от фитофтороза. Формула изобретения
Штамм бактерий Pseudomonas fluorescens P469 (коллекционный номер ЦКМ В-1982) для получения препарата против болезней растений, вызываемых фитопатогенными грибами и бактериями. MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 14.05.2006
Извещение опубликовано: 10.05.2007 БИ: 13/2007
|
||||||||||||||||||||||||||

 С, рН 6,8-7,5. Штамм Pseudomonas fluorescens P469 обладает способностью к подавлению роста широкого круга фитопатогенных грибов и бактерий, стимулирует рост растений. 2 табл.
С, рН 6,8-7,5. Штамм Pseudomonas fluorescens P469 обладает способностью к подавлению роста широкого круга фитопатогенных грибов и бактерий, стимулирует рост растений. 2 табл.
 7Н2О – 1,5 г/л), ПА (питательном агаре на основе гидролизата кильки (ДИПС, г. Махачкала) – 35 г/л), на минимальной синтетической среде М9 следующего состава: К2НРO4 – 7 г/л, KH4PO4 – 3 г/л, NH4
7Н2О – 1,5 г/л), ПА (питательном агаре на основе гидролизата кильки (ДИПС, г. Махачкала) – 35 г/л), на минимальной синтетической среде М9 следующего состава: К2НРO4 – 7 г/л, KH4PO4 – 3 г/л, NH4 Cl – 1 г/л, глюкоза – 2 г/л.
Cl – 1 г/л, глюкоза – 2 г/л.