Патент на изобретение №2235768
|
||||||||||||||||||||||||||
(54) ТРАНСФОРМИРОВАННЫЙ ШТАММ ДРОЖЖЕЙ HANSENULA POLYMORPHA-ПРОДУЦЕНТ РЕКОМБИНАНТНОГО ПОВЕРХНОСТНОГО АНТИГЕНА ВИРУСА ГЕПАТИТА B-HBSAG/ADW
(57) Реферат:
Изобретение относится к генной инженерии и может быть использовано для создания микробиологического дрожжевого продуцента, обеспечивающего высокий выход рекомбинантного антигена вируса гепатита В серотипа adw. Путем проведения генно-инженерных операций с использованием определенных олигонуклеотидов получают штамм дрожжей Hansenula polymorpha VKPM Y-2412, трансформированный последовательностью ДНК, кодирующей HBsAg/adw, слитой с промотором гена МОХ и геном TRP3, являющийся продуцентом рекомбинантного поверхностного антигена вируса гепатита В. Изобретение позволяет достичь более высоких уровней синтеза антигена при упрощении способов получения культур высокой плотности. Изобретение относится к области биотехнологии, а именно генной инженерии, и может быть использовано для создания микробиологического дрожжевого продуцента рекомбинантного поверхностного антигена вируса гепатита В. Известны различные штаммы, являющиеся продуцентами поверхностного антигена вируса гепатита В. Известен штамм Е.coli ВКПМ В-6955, являющийся продуцентом корового антигена вируса гепатита В. Для получения штамма – продуцента кор антигена с экспонированным на его поверхности главным нейтрализующим эпитопом HBsAg, компетентные клетки бактерий Е.coli JM 103 трансформируют сконструированной плазмидой рКНВс33 (RU, патент 2112039, 1995, С 12 N 15/51). Известен также штамм дрожжей Saccharomyces cerevisiae KCTC 0098BP, являющийся продуцентом поверхностного антигена вируса гепатита В, содержащего пре S2 пептид (RU, патент №2122430, 1995, C 12 N 15/51). Аналогом изобретения является патент, в котором описан штамм дрожжей Saccharomyces cerevisiae ВКПМ Y-2203 – продуцент поверхностного антигена вируса гепатита В (Патент РФ №2088664, 1996, А 61 К 39/29). При осуществлении изобретений в соответствии с указанными патентами невозможно добиться высоких уровней синтеза антигена. Задачей изобретения является создание эффективного микробиологического дрожжевого продуцента, обеспечивающего высокий выход рекомбинантного поверхностного антигена вируса гепатита В серотипа adw. Задача решена тем, что согласно изобретению одна копия синтетической последовательности ДНК, кодирующей HBsAg/adw, интегрирована в геном штамма Hansenula polymorpha. Для увеличения уровня синтеза антигена используется штамм с нарушенным геном МОХ, кодирующем алкогольоксидазу. Отсутствие мутаций, которые могли образоваться в гене, кодирующем HBsAg/adw, в процессе его введения в геном дрожжей или при культивировании штамма-продуцента, может быть выявлено определением нуклеотидной последовательности продукта полимеразной цепной реакции с праймерами к этому гену. Дрожжи Н. polymorpha являются предпочтительными по сравнению с S. cerevisiae, поскольку позволяют добиваться более высоких уровней синтеза антигена при более простых способах получения культур высокой плотности. Высокий уровень синтеза полипептида в клетках дрожжей достигается при помощи введения в клетки одной копии клетки гена, его кодирующего. Заявленный штамм дрожжей Н. polymorpha, являющийся продуцентом поверхностного антигена вируса гепатита В серотипа ad, является новым и в патентной литературе не описан. Изобретение может быть проиллюстрировано следующими примерами. При этом все рутинные генно-инженерные операции осуществляют согласно стандартным методикам и инструкциям компаний – производителей ферментов и наборов для манипуляций с ДНК in vitro. Для ПЦР во всех случаях использовали полимеразу Vent (NEB). Синтез олигонуклеотидов производился ЗАО “Синтол” г. Москва. В работе для получения антигена серотипа adw использовали следующие олигонуклеотиды: Пример 1. Получение фрагмента ДНК, кодирующего HBsAg/adw (фрагмент А) Реакционную смесь, содержащую олигонуклеотиды 1u и 8L по 1 мкМ, олигонуклеотиды со 2u по 8u; с 1L по 7L по 10 пМ, ThermoPol буфер (10 mM KCl, 20 тМ tris-HCl pH 8.8, 10 тМ (NH4)2SO4, 2 mМ MgSO4, 0,1% Triton X-100, 250 uM dNTP) и 5 единиц активности Vent полимеразы инкубируют в течение 30 циклов изменения температуры. Каждый цикл включает инкубацию при 95 Пример 2. Получение фрагмента геномной ДНК Н. polymorpha, содержащего промотор гена МОХ (фрагмент Б) Суспендируют 2-3 мкг клеток штамма Hansenula polymorpha BKM 4-2559 (получен из почвы СС4 38-22-2 Институт биохимии и физиологии микроорганизмов РАН) в 0,1 мл 0,25% раствора додецилсульфата натрия и инкубируют на кипящей водяной бане в течение 5 мин. Клетки осаждают центрифугированием при 10000 g 5 мин. 1 мкл полученного супернатанта добавляют к 25 мкл смеси, содержащей олигонуклеотиды moxU5 и moxL3 по 1 мкМ, ThermoPol буфер (10 mM KCl, 20 mМ tris-HCl pH 8.8, 10 mМ (NH4)2SO4, 2 mМ MgSO4, 0,1% Triton X-100, 250 uM dNTP) и 5 единиц активности Vent полимеразы. Реакционную смесь инкубируют в течение 30 циклов изменения температуры. Каждый цикл включает инкубацию при 95 Пример 3. Получение фрагмента геномной ДНК Н. polymorpha, содержащего часть гена TRP 3 (фрагмент В) Суспендируют 2-3 мкг клеток штамма Н. polymorpha BKM 4-2559 в 0,1 мл 0,25% раствора додецилсульфата натрия и инкубируют на кипящей водяной бане в течение 5 мин. Клетки осаждают центрифугированием при 10000 g 5 мин. 1 мкл полученного супернатанта добавляют к смеси, содержащей олигонуклеотиды trpU5 и trpL3 по 1 мкМ, ThermoPol буфер (10 mM KCl, 20 mM tris-HCl pH 8.8, 10 mM (NH4)2SO4, 2 mM MgSO4, 0,1% Triton Х-100, 250 uM dNTP) и 5 единиц активности Vent полимеразы. Реакционную смесь инкубируют в течение 30 циклов изменения температуры. Каждый цикл включает инкубацию при 95 Пример 4. Получение фрагмента ДНК Н. polymorpha, содержащего последовательность, кодирующую HBsAg/adw, слитую с промотором МОХ и геном TRP 3 (фрагмент Г) Реакционную смесь (0,05 мл), содержащую олигонуклеотиды moxU5 и trpL3 по 1 мкМ, фрагменты А, Б и В по 1 пг, ThermoPol буфер (10 mM KCl, 20 mM tris-HCl рН 8.8, 10 mM (NH4)SO4, 2 mM MgSO4, 0,1% Triton X-100, 250 uM dNTP) и 5 единиц активности Vent полимеразы инкубируют в течение 30 циклов изменения температуры. Каждый цикл включает инкубацию при 95 Пример 5. Интеграция последовательности, кодирующей HBsAg/adw, в геном Н. polymorpha Штамм Н. polymorpha DLT (Agaphonov et al., 2002; коллекция штаммов лаборатории молекулярной генетики РКНПК МЗ РФ) выращивают в течение 15-20 часов в среде YNB-D, содержащей триптофан 20 мг/л, при 37 Трансформационную смесь инкубируют при 45 Пример 6. Анализ способности штамма синтезировать HBsAg/adw Тестируемый штамм засевают в среду YPD (1% дрожжевого экстракта, 2% пептона и 2% глюкозы) и инкубируют при 37 Пример 7. Определение последовательности гена HBsAg/adw в геноме дрожжей. Суспендируют 2-3 мкг клеток анализируемого штамма в 0,1 мл 0,25% раствора додецилсульфата натрия и инкубируют на кипящей водяной бане в течение 5 мин. Клетки осаждают центрифугированием при 10000 g 5 мин. 1 мкл полученного супернатанта добавляют к смеси, содержащей олигонуклеотиды МОХ и TRP по 1 мкМ, ThermoPol буфер (10 mM KCl, 20 mM tris-HCl pH 8.8, 10 mM (NH4)2SO4, 2 mM MgSO4, 0,1% Triton Х-100, 250 uM dNTP) и 5 единиц активности Vent полимеразы. Реакционную смесь инкубируют в течение 30 циклов изменения температуры. Каждый цикл включает инкубацию при 95 Пример 8. Выделение HBsAg(adw) из клеток Н. polymorpha После ферментации исходного штамма дрожжей Н. polymorpha антиген HBsAg выделяют согласно общепринятой методике по следующей схеме. Клетки из культуральной жидкости осаждают центрифугированием при 4000 g на центрифуге Beckman. Осажденную биомассу ресуспендируют до концентрации 250 г влажных клеток на 1 литр в буфере экстракции PBS pH 6,8 с добавлением EDTA, PMSF и Tween-20. Далее клетки разрушают в мельнице Dyno-Mill типа KDL, используя стеклянные шары диаметра 0,5-0,7 мм. Основную массу нецелевых белков из полученного гомогенизата осаждают добавлением полиэтиленгликоля (PEG) до концентрации 4,5%. Осажденные белки отделяют центрифугированием. Полученный супернатант фильтруют на ультрафильтрах (500кДа) Pellicon. При этом отделяются белки с мол. массой меньше 500 кДа, а также удаляется PEG и раствор HBs антигена переводится в буфер PBS рН 6,7. Одновременно происходит концентрирование раствора, что существенно для следующей стадии абсорбции на стекло. Посадку HBsAg на макропористое стекло (МПС) осуществляют в колонках системы StreamLine, разработанной фирмой Pharmacia (Sweden). Для удаления неспецифически связанных белков колонку промывают тем же буфером PBS. Антиген элюируют карбонатным буфером (КБ) рН 9,5. Элюат концентрируют ультрафильтрацией и разделяют при помощи ультрацентрифугирования на зональном роторе (Beckman) в градиенте глицерин/сахароза. Полученные фракции анализируют на содержание HBsAg, используя РОПГА набор и фракции, содержащие антиген, объединяют и очищают гельфильтрацией на сорбенте Toyopearl HW-65 (ToyoSoda Corp., Japan). Чистоту полученного таким образом HBs антигена определяют методом SDS-PAGE. Если чистота продукта недостаточна (<95%), производят дополнительную очистку при помощи ионообменной хроматографии на сорбенте TSK-DEAE (ToyoSoda Corp., Japan). Выход антигена 25-30 мг с 1 л культуральной жидкости. Полученный раствор HBsAg анализируют рядом методов: 1. Антигенную активность измеряют наборами РОПГА (реакция обратной пассивной гемагглютинации эритроцитов) по методике производителя (НПО “Диагностические Системы”, Нижний Новгород) с использованием в качестве стандарта отраслевой стандартный образец активности HBsAg (ОСО 42-28-153-88), выпускаемый ГИСК им. Л.А.Тарасевича. 2. Чистота рекомбинантного HBsAg определяется электрофорезом в полиакриламидном геле в восстанавливающих условиях (SDS-PAGE) с окрашиванием серебром и Coomassie Brilliant Blue R-250. Чистота выделенного антигена не <95%. 3. Иммуноспецифичность антигена определяют методом иммуноблотинга. Первичные антитела для этой цели получали иммунизацией кролей рекомбинантным HBsAg (производства Комбиотех), восстановленным в присутствии 2% SDS и 5% меркаптоэтанола. Иммунными антисыворотками окрашивали иммуноблот с последующей визуализацией при помощи специфических антител к иммуноглобулинам кролей, конъюгированных с пероксидазой хрена, по методике улучшенной хемилюминисценции (ECL) (Amersham, UK). Рекомбинантный HBs антиген представлен в виде полосы мономера 24-27 кДа и слабых полос димера и тримера. Видовое название культуры Hansenula Polymorpha. Культурально-морфологические особенности штамма: клетки округлой формы, небольшие по размеру; на агаризованной среде YPD образуют крупные круглые колонии с выраженной выпуклой серединой. Активность штамма – не менее 30 мг/л культуральной жидкости. Хранение при -70 Генетические особенности: ауксотроф по лейцину, фаги у дрожжей не обнаружены. Штамм не является зоопатогенным или фитопатогенным. Способ определения активности: в осветленном гомогенизате клеток методом иммуноферментного анализа. Способ, условия и состав сред для размножения штамма: инкубирование прокачиванием при 30 Условия и состав среды для ферментации: прокачивание при 29±1 Выделенный антиген вируса гепатита В серотипа adw может быть использован для создания на его основе вакцин против гепатита В. Формула изобретения
Штамм дрожжей Hansenula polymorpha VKPM Y-2412, трансформированный последовательностью ДНК, кодирующей HBsAg/adw, слитой с промотором гена МОХ и геном TRP3, – продуцент рекомбинантного поверхностного антигена вируса гепатита В. |
||||||||||||||||||||||||||



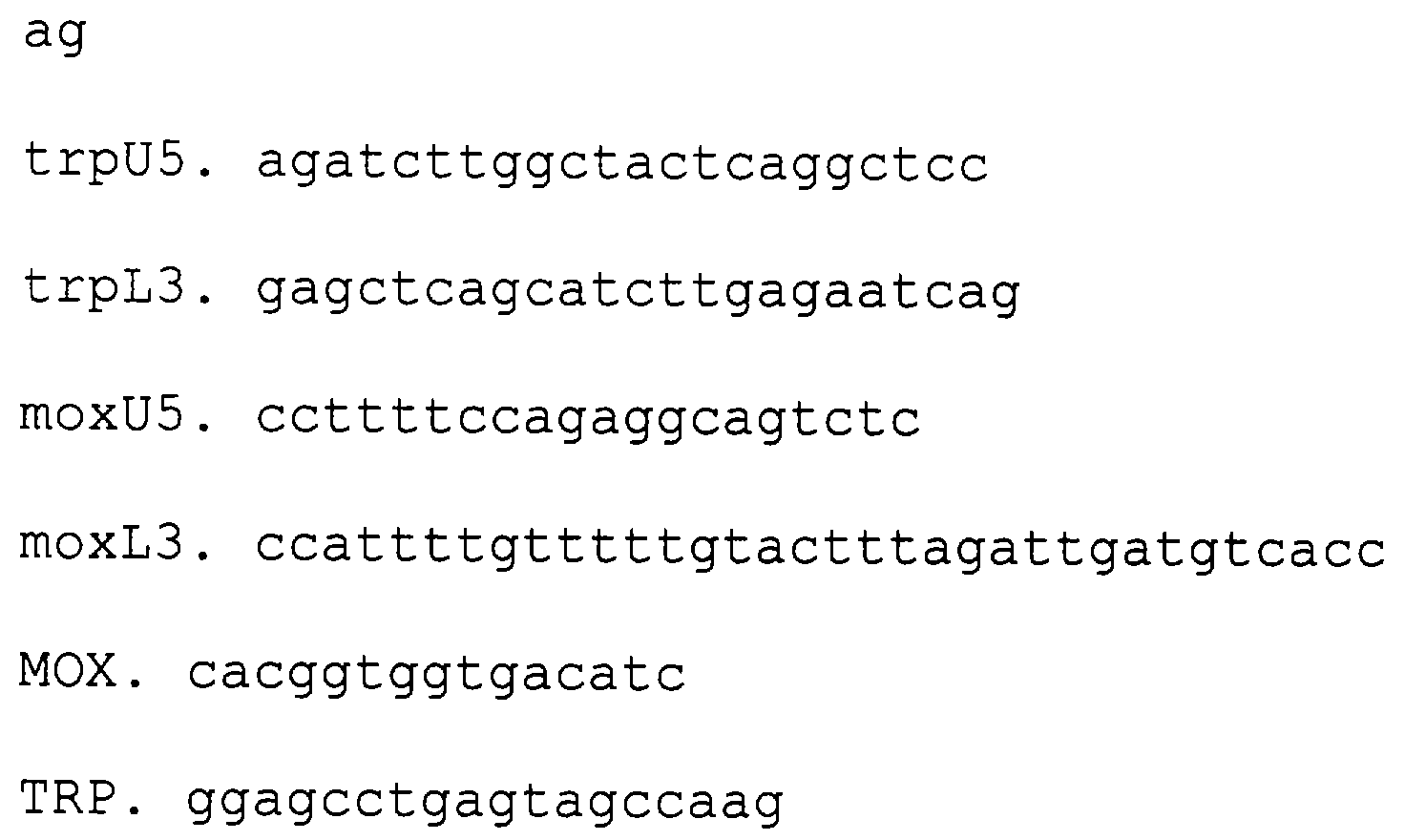
 С в течение 30 сек, при 50
С в течение 30 сек, при 50