Патент на изобретение №2233843
|
||||||||||||||||||||||||||
(54) СПОСОБ ПОЛУЧЕНИЯ ЗАМЕЩЕННЫХ ДИПИРАЗОЛО[1,2-А; 1′,2′-D][1,2,4,5]ТЕТРАЗИН-1,7-ДИОНОВ (ВАРИАНТЫ)
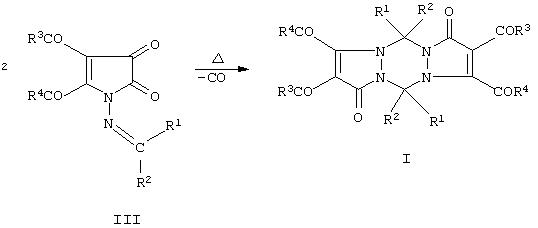
(57) Реферат: Предложено два варианта получения 5,11-замещенных 2,3,8,9-тетраацил-1,5,7,11-тетрагидродипиразоло[1,2-а; 1’,2’-d] [1,2,4,5]тетразин-1,7-дионов 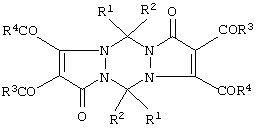 Ia: R1=R2=R3=R4=С6Н5; Iб: R1=R2=С6Н5; R3=п-СН3С6Н4; R4=ОСН3. Первый вариант характеризуется тем, что замещенные 4,5-диацил-1-метиленамино-2,3-дигидро-2,3-пирролдионы подвергают декарбонилированию в среде инертных апротонных растворителей при температуре 100-150
Ia: R1=R2=R3=R4=С6Н5; Iб: R1=R2=С6Н5; R3=п-СН3С6Н4; R4=ОСН3. Первый вариант характеризуется тем, что замещенные 4,5-диацил-1-метиленамино-2,3-дигидро-2,3-пирролдионы подвергают декарбонилированию в среде инертных апротонных растворителей при температуре 100-150 С. Второй вариант характеризуется тем, что замещенные 1,2-диацил-1-метиленгидразиноэтилены подвергают взаимодействию с оксалилхлоридом в среде инертных апротонных растворителей при 50-70 С. Второй вариант характеризуется тем, что замещенные 1,2-диацил-1-метиленгидразиноэтилены подвергают взаимодействию с оксалилхлоридом в среде инертных апротонных растворителей при 50-70 С с последующим повышением температуры реакционной массы до 100-150 С с последующим повышением температуры реакционной массы до 100-150 С для декарбонилирования образующихся на первой стадии замещенных 4,5-диацил-1-метиленамино-2,3-дигидро-2,3-пирролдионов. Технический результат – получение новых соединений, которые могут найти применение в препаративной химии и обладать биологической активностью, например противоопухолевой активностью. 2 с.п. ф-лы.
Изобретение относится к области органической химии, а именно к способам получения неизвестных ранее 5,11-замещенных 2,3,8,9-тетраацил-1,5,7,11-тетрагидродипиразоло[1,2-а;1’,2’-d][1,2,4,5]тетразин-1,7-дионов (I) общей формулы С для декарбонилирования образующихся на первой стадии замещенных 4,5-диацил-1-метиленамино-2,3-дигидро-2,3-пирролдионов. Технический результат – получение новых соединений, которые могут найти применение в препаративной химии и обладать биологической активностью, например противоопухолевой активностью. 2 с.п. ф-лы.
Изобретение относится к области органической химии, а именно к способам получения неизвестных ранее 5,11-замещенных 2,3,8,9-тетраацил-1,5,7,11-тетрагидродипиразоло[1,2-а;1’,2’-d][1,2,4,5]тетразин-1,7-дионов (I) общей формулы
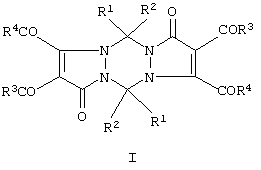 где Ia: R1=R2=R3=R4=С6Н5;
Iб: R1=R2=С6Н5, R3=п-СН3С6Н4; R4=ОСН3.
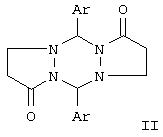
Ближайшими аналогами по структуре являются 5,11-диарилпергидродипиразоло[1,2-а;1’,2’-d][1,2,4,5]тетразин-1,7-дионы формулы II (см. Н.Dorn, R. Ozegowski, R.Radeglina, J. Pract. Chem., 1977, 319, 177, H.Dorn, Т. Kreher. Tetrahedron Lett., 1988, 29, 2939-2942):
где Ia: R1=R2=R3=R4=С6Н5;
Iб: R1=R2=С6Н5, R3=п-СН3С6Н4; R4=ОСН3.
Ближайшими аналогами по структуре являются 5,11-диарилпергидродипиразоло[1,2-а;1’,2’-d][1,2,4,5]тетразин-1,7-дионы формулы II (см. Н.Dorn, R. Ozegowski, R.Radeglina, J. Pract. Chem., 1977, 319, 177, H.Dorn, Т. Kreher. Tetrahedron Lett., 1988, 29, 2939-2942):
 Из литературных источников известны следующие способы получения замещенных пергидро-1,2,4,5-тетразинов, содержащих заместители у всех атомов цикла:
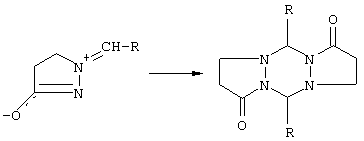
1) Димеризация замещенных 1-метилен-4,5-дигидро-1Н-пиразол-3-илоксидов (см. Н.Dorn, R. Ozegowski, R.Radeglina, J. Pract. Chem., 1977, 319, 177; H.Dorn, T. Kreher, Tetrahedron Lett., 1988, 29, 2939-2942):
Из литературных источников известны следующие способы получения замещенных пергидро-1,2,4,5-тетразинов, содержащих заместители у всех атомов цикла:
1) Димеризация замещенных 1-метилен-4,5-дигидро-1Н-пиразол-3-илоксидов (см. Н.Dorn, R. Ozegowski, R.Radeglina, J. Pract. Chem., 1977, 319, 177; H.Dorn, T. Kreher, Tetrahedron Lett., 1988, 29, 2939-2942):
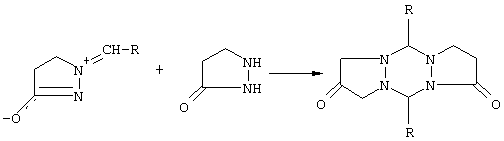
 2) Взаимодействие замещенных 1-метилен-4,5-дигидро-1Н-пиразол-3-илоксидов с 3-пиразолидиноном (см. Н.Dorn, R. Ozegowski, R.Radeglina, J. Pract Chem., 1977, 319, 177; H.Dorn, Т. Kreher, Tetrahedron Lett., 1988, 29, 2939-2942)
2) Взаимодействие замещенных 1-метилен-4,5-дигидро-1Н-пиразол-3-илоксидов с 3-пиразолидиноном (см. Н.Dorn, R. Ozegowski, R.Radeglina, J. Pract Chem., 1977, 319, 177; H.Dorn, Т. Kreher, Tetrahedron Lett., 1988, 29, 2939-2942)
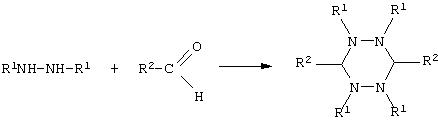
 3) Взаимодействие алкилгидразинов с алифатическими альдегидами (см. K.Jensen, S. Hammerum, Acta Chem. Scand., 1972, 26, 1258; S. Hammerum, Tetrahedron Lett., 1972, 13, 949; S. Hammerum, Acta Chem. Scand., 1973, 27, 779)
3) Взаимодействие алкилгидразинов с алифатическими альдегидами (см. K.Jensen, S. Hammerum, Acta Chem. Scand., 1972, 26, 1258; S. Hammerum, Tetrahedron Lett., 1972, 13, 949; S. Hammerum, Acta Chem. Scand., 1973, 27, 779)
 4) Взаимодействие диметилгидразина с 3-фенил-2-пропиналем в присутствии триэтиламина (см. а.с. 686336 (СССР), МКИ С 07 D 257/08, А 61 К 31/395, БИ, 1980, №38)
4) Взаимодействие диметилгидразина с 3-фенил-2-пропиналем в присутствии триэтиламина (см. а.с. 686336 (СССР), МКИ С 07 D 257/08, А 61 К 31/395, БИ, 1980, №38)
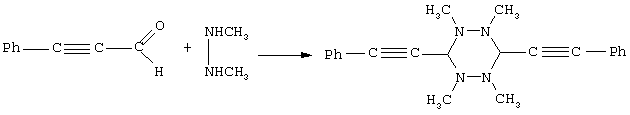 Существенным недостатком приведенных методов является их ограниченность: они не позволяют разнообразить природу заместителей в цикле. Ни одним из известных методов не могут быть получены 5,11-замещенные 2,3,8,9-тетраацил-1,5,7,11-тетрагидродипиразоло [1,2-а;1’,2’-d][1,2,4,5]тетразин-1,7-дионы (I).
Целью данного изобретения является разработка способа синтеза новых соединений, которые могут найти применение в препаративной органической химии, а также обладать полезными свойствами, например противоопухолевой активностью по аналогии с известными пергидро-1,2,4,5-тетеразинами (см. а.с. 686336 (СССР), МКИ С 07 D 257/08; А 61 К 31/395, БИ, 1980, №38).
Указанная цель достигается синтезом 5,11-замещенных 2,3,8,9-тетраацил-1,5,7,11-тетрагидродипиразоло[1,2-а;1’,2’-d][1,2,4,5]тетразин-1,7-дионов (I) общей формулы
Существенным недостатком приведенных методов является их ограниченность: они не позволяют разнообразить природу заместителей в цикле. Ни одним из известных методов не могут быть получены 5,11-замещенные 2,3,8,9-тетраацил-1,5,7,11-тетрагидродипиразоло [1,2-а;1’,2’-d][1,2,4,5]тетразин-1,7-дионы (I).
Целью данного изобретения является разработка способа синтеза новых соединений, которые могут найти применение в препаративной органической химии, а также обладать полезными свойствами, например противоопухолевой активностью по аналогии с известными пергидро-1,2,4,5-тетеразинами (см. а.с. 686336 (СССР), МКИ С 07 D 257/08; А 61 К 31/395, БИ, 1980, №38).
Указанная цель достигается синтезом 5,11-замещенных 2,3,8,9-тетраацил-1,5,7,11-тетрагидродипиразоло[1,2-а;1’,2’-d][1,2,4,5]тетразин-1,7-дионов (I) общей формулы
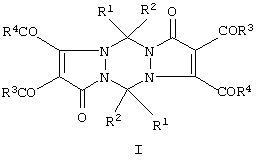 где Ia: R1=R2=R3=R4=С6Н5;
Iб: R1=R2=С6Н5; R3=п-СН3С6Н4; R4=ОСН3.
Отличие соединений I по сравнению с ближайшими аналогами – соединениями II – заключается в наличии четырех ацильных заместителей в положениях С2, С3, С8 и С9, в наличии двойных связей С2=С3 и С8=С9, а также в наличии двух заместителей R1 и R2 у атомов С5 и С11.
Указанная цель достигается двумя вариантами способа получения соединений I. По первому варианту замещенные 4,5-диацил-1-метиленамино-2,3-дигидро-2,3-пирролдионы (III) подвергают декарбонилированию в среде инертных апротонных растворителей (например, в толуоле, или о-, м-, п-ксилолах, или псевдокумоле, или декане и др.) при температуре 100-150
где Ia: R1=R2=R3=R4=С6Н5;
Iб: R1=R2=С6Н5; R3=п-СН3С6Н4; R4=ОСН3.
Отличие соединений I по сравнению с ближайшими аналогами – соединениями II – заключается в наличии четырех ацильных заместителей в положениях С2, С3, С8 и С9, в наличии двойных связей С2=С3 и С8=С9, а также в наличии двух заместителей R1 и R2 у атомов С5 и С11.
Указанная цель достигается двумя вариантами способа получения соединений I. По первому варианту замещенные 4,5-диацил-1-метиленамино-2,3-дигидро-2,3-пирролдионы (III) подвергают декарбонилированию в среде инертных апротонных растворителей (например, в толуоле, или о-, м-, п-ксилолах, или псевдокумоле, или декане и др.) при температуре 100-150 С. С.
 Контроль за окончанием реакции (выбор оптимального временного режима) для каждого конкретного соединения при указанной температуре осуществляется методом тонкослойной хроматографии: фиксируется исчезновение пятна исходного 2,3-дигидро-2,3-пирролдиона.
Следующие примеры иллюстрируют первый вариант заявляемого способа.
Пример 1. Синтез 2,3,8,9-тетрабензоил-5,5,11,11-тетрафенил-1,5,7,11-тетрагидродипиразоло[1,2-а;1’,2’-d][1,2,4,5]тетразин-1,7-диона (Iа).
Раствор 2,0 г 4,5-дибензоил-1-дифенилметиленамино-2,3-дигидро-2,3-пирролдиона в 15 мл абсолютного п-ксилола выдержали при температуре 138-139
Контроль за окончанием реакции (выбор оптимального временного режима) для каждого конкретного соединения при указанной температуре осуществляется методом тонкослойной хроматографии: фиксируется исчезновение пятна исходного 2,3-дигидро-2,3-пирролдиона.
Следующие примеры иллюстрируют первый вариант заявляемого способа.
Пример 1. Синтез 2,3,8,9-тетрабензоил-5,5,11,11-тетрафенил-1,5,7,11-тетрагидродипиразоло[1,2-а;1’,2’-d][1,2,4,5]тетразин-1,7-диона (Iа).
Раствор 2,0 г 4,5-дибензоил-1-дифенилметиленамино-2,3-дигидро-2,3-пирролдиона в 15 мл абсолютного п-ксилола выдержали при температуре 138-139 С в течение 20 минут. Охладили, выпавший осадок отфильтровали, перекристаллизовали из смесей диэтиловый эфир – гексан (1:1). Получили 1,0 г (53%) 2,3,8,9-тетрабензоил-5,5,11,11-тетрафенил-1,5,7,11-тетрагидродипиразоло[1,2-а;1’,2’-d[1,2,4,5]тетразин-1,7-диона. Т. пл. 170-172 С в течение 20 минут. Охладили, выпавший осадок отфильтровали, перекристаллизовали из смесей диэтиловый эфир – гексан (1:1). Получили 1,0 г (53%) 2,3,8,9-тетрабензоил-5,5,11,11-тетрафенил-1,5,7,11-тетрагидродипиразоло[1,2-а;1’,2’-d[1,2,4,5]тетразин-1,7-диона. Т. пл. 170-172 С (с разл.)
Вычислено, %: С 78,93, Н 4,42, N 6,14. Найдено, %: С 79,20, Н 4,58, N 6,06. ИК спектр (ваз. масло, С (с разл.)
Вычислено, %: С 78,93, Н 4,42, N 6,14. Найдено, %: С 79,20, Н 4,58, N 6,06. ИК спектр (ваз. масло,  , см-1): 1680 (NCO), 1660 (АrСО), 1600(С=С).
Пример 2. Синтез 3,9-диметоксикарбонил-2,8-дитолуоил-5,5,11,11-тетрафенил-1,5,7,11-тетрагадродипиразоло[1,2-а;1’,2’-d][1,2,4,5]тетразин-1,7-диона (Iб).
Раствор 2,0 г 1-дифенилметиленамино-5-метоксикарбонил-4-п-толуоил-2,3-дигидро-2,3-пирролдиона в 6 мл абсолютного псевдокумола выдержали при температуре 138-139 , см-1): 1680 (NCO), 1660 (АrСО), 1600(С=С).
Пример 2. Синтез 3,9-диметоксикарбонил-2,8-дитолуоил-5,5,11,11-тетрафенил-1,5,7,11-тетрагадродипиразоло[1,2-а;1’,2’-d][1,2,4,5]тетразин-1,7-диона (Iб).
Раствор 2,0 г 1-дифенилметиленамино-5-метоксикарбонил-4-п-толуоил-2,3-дигидро-2,3-пирролдиона в 6 мл абсолютного псевдокумола выдержали при температуре 138-139 С в течение 30 минут. Охладили, выпавший осадок отфильтровали, перекристаллизовали из смеси диэтиловый эфир – гексан (1:1). Получили 0,8 г (42%) 3,9-диметоксикарбонил-2,8-дитолуоил-5,5,11,11-тетрафенил-1,5,7,11-тетрагидродипиразоло[1,2-а;1’,2’-d][1,2,4,5]тетразин-1,7-диона. Т.пл. 207-209 С в течение 30 минут. Охладили, выпавший осадок отфильтровали, перекристаллизовали из смеси диэтиловый эфир – гексан (1:1). Получили 0,8 г (42%) 3,9-диметоксикарбонил-2,8-дитолуоил-5,5,11,11-тетрафенил-1,5,7,11-тетрагидродипиразоло[1,2-а;1’,2’-d][1,2,4,5]тетразин-1,7-диона. Т.пл. 207-209 С (с разл.).
Вычислено, %: С 73,57; Н 4,75, N 6,60 Найдено, % С 73,69, Н 4,66; N 6,72. ИК спектр (ваз. масло, С (с разл.).
Вычислено, %: С 73,57; Н 4,75, N 6,60 Найдено, % С 73,69, Н 4,66; N 6,72. ИК спектр (ваз. масло,  , см-1): 1760 (СООСН3), 1690 (NCO, п-СН3С6Н4СО), 1600 (С=С). Спектр ЯМР 1H (400 МГц, ДМСО-d6, , см-1): 1760 (СООСН3), 1690 (NCO, п-СН3С6Н4СО), 1600 (С=С). Спектр ЯМР 1H (400 МГц, ДМСО-d6,  , м. д.): 2,35 (с, 6Н, СН3), 3,43 (с, 6Н, СН3О), 6,95-7,75 (гр.с, 28Н, АrН)
Тетразины I – бесцветные кристаллические вещества, хорошо растворимые в диэтиловом эфире, хлороформе, нерастворимые в алканах, воде. Структура заявляемых соединений подтверждена методом РСА на примере тетразина формулы I, где R1=R2=С6Н5, R3=(СН3)3С, R4=СН3ООС.
Для проведения реакций выбран оптимальный температурный режим. При снижении температуры синтеза уменьшается скорость декарбонилирования исходных 2,3-дигидро-2,3-пирролдионов III, вследствие чего удлиняется время реакции или декарбонилирование не происходит, что делает синтез целевых продуктов I невозможным.
Повышение температуры проведения реакции приводит к осмолению реакционной массы и к уменьшению выхода целевых соединений I, что иллюстрируется следующим примером.
Пример 3. Синтез 3,9-диметоксикарбонил-2,8-дитолуоил-5,5,11,11-тетрафенил-1,5,7,11-тетрагидродипиразоло[1,2-а;1’,2’-d][1,2,4,5]тетразин-1,7-диона (Iб).
Раствор 2,0 г 1-дифенилметиленамино-5-метоксикарбонил-4-п-толуоил-2,3-дигидро-2,3-пирролдиона в 6 мл абсолютного псевдокумола выдержали при температуре 166-168 , м. д.): 2,35 (с, 6Н, СН3), 3,43 (с, 6Н, СН3О), 6,95-7,75 (гр.с, 28Н, АrН)
Тетразины I – бесцветные кристаллические вещества, хорошо растворимые в диэтиловом эфире, хлороформе, нерастворимые в алканах, воде. Структура заявляемых соединений подтверждена методом РСА на примере тетразина формулы I, где R1=R2=С6Н5, R3=(СН3)3С, R4=СН3ООС.
Для проведения реакций выбран оптимальный температурный режим. При снижении температуры синтеза уменьшается скорость декарбонилирования исходных 2,3-дигидро-2,3-пирролдионов III, вследствие чего удлиняется время реакции или декарбонилирование не происходит, что делает синтез целевых продуктов I невозможным.
Повышение температуры проведения реакции приводит к осмолению реакционной массы и к уменьшению выхода целевых соединений I, что иллюстрируется следующим примером.
Пример 3. Синтез 3,9-диметоксикарбонил-2,8-дитолуоил-5,5,11,11-тетрафенил-1,5,7,11-тетрагидродипиразоло[1,2-а;1’,2’-d][1,2,4,5]тетразин-1,7-диона (Iб).
Раствор 2,0 г 1-дифенилметиленамино-5-метоксикарбонил-4-п-толуоил-2,3-дигидро-2,3-пирролдиона в 6 мл абсолютного псевдокумола выдержали при температуре 166-168 С в течение 30 минут. Охладили, добавили 3 мл гексана, выпавший осадок отфильтровали, перекристаллизовали из смеси диэтиловый эфир – гексан (1:1). Получили 0,25 г (13%) целевого продукта. Т.пл. 207-209 С в течение 30 минут. Охладили, добавили 3 мл гексана, выпавший осадок отфильтровали, перекристаллизовали из смеси диэтиловый эфир – гексан (1:1). Получили 0,25 г (13%) целевого продукта. Т.пл. 207-209 С (с разл.).
Первый вариант заявляемого способа получения замещенных 2,3,8,9-тетраацил-1,5,7,11-тетрагидродипиразоло[1,2-а;1’,2’-d][1,2,4,5]тетразин-1,7-дионов безопасен, прост в исполнении, однако он не во всех случаях обеспечивает высокий выход целевых продуктов I в пересчете на доступные товарные реактивы. Фактором, существенно снижающим такой выход, является наличие стадии синтеза и выделения в чистом виде замещенных 4,5-диацил-2-метиленамино-2,3-дигидро-2,3-пирролдионов (соединения III), которые получаются с выходами не более 40-60%. Эту стадию можно исключить, проводя получение исходных соединений II и целевых тетразинов I однореакторным методом. В этом заключается второй вариант заявляемого способа получения тетразинов I.
Указанная цель данного изобретения согласно второму варианту достигается тем, что замещенные 1,2-диацил-1-метиленгидразиноэтилены (соединения IV) подвергают взаимодействию с оксалилхлоридом в среде инертных апротонных абсолютных растворителей (например, хлороформ, дихлорэтан, толуол и др.) при 50-70 С (с разл.).
Первый вариант заявляемого способа получения замещенных 2,3,8,9-тетраацил-1,5,7,11-тетрагидродипиразоло[1,2-а;1’,2’-d][1,2,4,5]тетразин-1,7-дионов безопасен, прост в исполнении, однако он не во всех случаях обеспечивает высокий выход целевых продуктов I в пересчете на доступные товарные реактивы. Фактором, существенно снижающим такой выход, является наличие стадии синтеза и выделения в чистом виде замещенных 4,5-диацил-2-метиленамино-2,3-дигидро-2,3-пирролдионов (соединения III), которые получаются с выходами не более 40-60%. Эту стадию можно исключить, проводя получение исходных соединений II и целевых тетразинов I однореакторным методом. В этом заключается второй вариант заявляемого способа получения тетразинов I.
Указанная цель данного изобретения согласно второму варианту достигается тем, что замещенные 1,2-диацил-1-метиленгидразиноэтилены (соединения IV) подвергают взаимодействию с оксалилхлоридом в среде инертных апротонных абсолютных растворителей (например, хлороформ, дихлорэтан, толуол и др.) при 50-70 С с последующим повышением реакционной массы до 100-150 С с последующим повышением реакционной массы до 100-150 С и проведением декарбонилирования образующихся на первой стадии замещенных 4,5-диацил-2-метиленамино-2,3-дигидро-2,3-пирролдионов (III), как это было описано выше в первом варианте заявляемого способа С и проведением декарбонилирования образующихся на первой стадии замещенных 4,5-диацил-2-метиленамино-2,3-дигидро-2,3-пирролдионов (III), как это было описано выше в первом варианте заявляемого способа
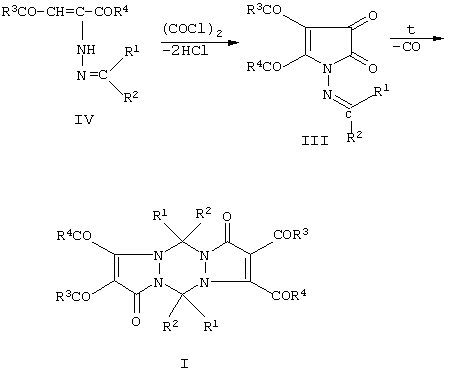 Следующие примеры иллюстрируют второй вариант заявляемого способа получения соединений I.
Пример 4. Синтез 3,9-диметоксикарбонил-2,8-дитолуоил-5,5,11,11-тетрафенил-1,5,7,11-тетрагидродипиразоло[1,2-а;1’,2’-d][1,2,4,5]тетразин-1,7-диона (Iб).
К раствору 1,05 г метилового эфира 2-дифенилметиленгидразино-4-оксо-4-п-толил-2-бутеновой кислоты в 5 мл абсолютного хлороформа добавили 0,24 мл оксалилхлорида (дихлорангидрида щавелевой кислоты), кипятили 100 минут, прилили 4 мл абсолютного п-ксилола, отогнали хлороформ и выдержали реакционную массу при 128-130
Следующие примеры иллюстрируют второй вариант заявляемого способа получения соединений I.
Пример 4. Синтез 3,9-диметоксикарбонил-2,8-дитолуоил-5,5,11,11-тетрафенил-1,5,7,11-тетрагидродипиразоло[1,2-а;1’,2’-d][1,2,4,5]тетразин-1,7-диона (Iб).
К раствору 1,05 г метилового эфира 2-дифенилметиленгидразино-4-оксо-4-п-толил-2-бутеновой кислоты в 5 мл абсолютного хлороформа добавили 0,24 мл оксалилхлорида (дихлорангидрида щавелевой кислоты), кипятили 100 минут, прилили 4 мл абсолютного п-ксилола, отогнали хлороформ и выдержали реакционную массу при 128-130 С в течение 30 минут. Охладили, выпавший осадок отфильтровали, перекристаллизовали из смеси диэтиловый эфир – гексан (1:1). Получили 0,34 г (35%) целевого продукта. Т.пл. 207-209 С в течение 30 минут. Охладили, выпавший осадок отфильтровали, перекристаллизовали из смеси диэтиловый эфир – гексан (1:1). Получили 0,34 г (35%) целевого продукта. Т.пл. 207-209 С (с разл.).
Выход тетразина в данной реакции рассчитывали, основываясь на допуске, что промежуточный 2,3-дигидро-2,3-пирролдион образуется из исходного метиленгидразиноэтилена с выходом 100%. Реально 2,3-дигидро-2,3-пирролдионы (соединения III) в чистом виде выделяются с выходом ~40-60% от теоретического. Таким образом, второй вариант заявляемого способа синтеза замещенных 2,3,8,9-тетраацил-1,5,7,11-тетрагидродипиразоло[1,2-а;1’,2’-d][1,2,4,5]тетразин-1,7-дионов более предпочтителен по сравнению с первым вариантом в тех случаях, когда 4,5-диацил-2-метиленамино-2,3-дигидро-2,3-пирролдионы (соединения III) выделяются в чистом виде с маленьким выходом, или когда имеются существенные временные ограничения, поскольку синтез заявляемых тетразинов I занимает значительно меньшее количество времени при использовании второго варианта способа их получения.
Объединение двух технических решений в одну заявку связано с тем, что два предлагаемых способа решают одну и ту же задачу – синтез замещенных 2,3,8,9-тетраацил-1,5,7,11-тетрагидродипиразоло[1,2-а;1’,2’-d][1,2,4,5]тетразин-1,7-дионов принципиально одним и тем же путем.
Предполагаемый эффект заявляемых соединений состоит в возможном наличии у них полезных биологических свойств и возможности использования их в органическом синтезе. С (с разл.).
Выход тетразина в данной реакции рассчитывали, основываясь на допуске, что промежуточный 2,3-дигидро-2,3-пирролдион образуется из исходного метиленгидразиноэтилена с выходом 100%. Реально 2,3-дигидро-2,3-пирролдионы (соединения III) в чистом виде выделяются с выходом ~40-60% от теоретического. Таким образом, второй вариант заявляемого способа синтеза замещенных 2,3,8,9-тетраацил-1,5,7,11-тетрагидродипиразоло[1,2-а;1’,2’-d][1,2,4,5]тетразин-1,7-дионов более предпочтителен по сравнению с первым вариантом в тех случаях, когда 4,5-диацил-2-метиленамино-2,3-дигидро-2,3-пирролдионы (соединения III) выделяются в чистом виде с маленьким выходом, или когда имеются существенные временные ограничения, поскольку синтез заявляемых тетразинов I занимает значительно меньшее количество времени при использовании второго варианта способа их получения.
Объединение двух технических решений в одну заявку связано с тем, что два предлагаемых способа решают одну и ту же задачу – синтез замещенных 2,3,8,9-тетраацил-1,5,7,11-тетрагидродипиразоло[1,2-а;1’,2’-d][1,2,4,5]тетразин-1,7-дионов принципиально одним и тем же путем.
Предполагаемый эффект заявляемых соединений состоит в возможном наличии у них полезных биологических свойств и возможности использования их в органическом синтезе.
Формула изобретения 1. Способ получения 5,11-замещенных 2,3,8,9-тетраацил-1,5,7,11-тетрагидродипиразоло[1,2-а;1’,2’-d][1,2,4,5]тетразин-1,7-дионов 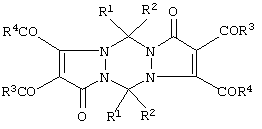 Ia: R1=R2=R3=R4=С6Н5;
1б: R1=R2=С6Н5; R3=п-СН3С6Н4; R4=ОСН3, характеризующийся тем, что замещенные 4,5-диацил-1-метиленамино-2,3-дигидро-2,3-пирролдионы подвергают декарбонилированию в среде инертных апротонных растворителей при температуре 100-150
Ia: R1=R2=R3=R4=С6Н5;
1б: R1=R2=С6Н5; R3=п-СН3С6Н4; R4=ОСН3, характеризующийся тем, что замещенные 4,5-диацил-1-метиленамино-2,3-дигидро-2,3-пирролдионы подвергают декарбонилированию в среде инертных апротонных растворителей при температуре 100-150 С.
2. Способ получения 5,11-замещенных 2,3,8,9-тетраацил-1,5,7,11-тетрагидродипиразоло[1,2-а; 1’,2’-d][1,2,4,5]тетразин-1,7-дионов С.
2. Способ получения 5,11-замещенных 2,3,8,9-тетраацил-1,5,7,11-тетрагидродипиразоло[1,2-а; 1’,2’-d][1,2,4,5]тетразин-1,7-дионов
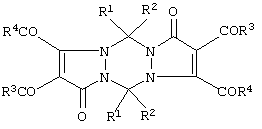 Ia: R1=R2=R3=R4=С6Н5;
1б: R1-R2=С6Н5; R3=п-СН3С6Н4; R4=ОСН3,
характеризующийся тем, что замещенные 1,2-диацил-1-метиленгидразиноэтилены подвергают взаимодействию с оксалилхлоридом в среде инертных апротонных растворителей при 50-70
Ia: R1=R2=R3=R4=С6Н5;
1б: R1-R2=С6Н5; R3=п-СН3С6Н4; R4=ОСН3,
характеризующийся тем, что замещенные 1,2-диацил-1-метиленгидразиноэтилены подвергают взаимодействию с оксалилхлоридом в среде инертных апротонных растворителей при 50-70 С с последующим повышением температуры реакционной массы до 100-150 С с последующим повышением температуры реакционной массы до 100-150 С для декарбонилирования образующихся на первой стадии замещенных 4,5-диацил-1-метиленамино-2,3-дигидро-2,3-пирролдионов. С для декарбонилирования образующихся на первой стадии замещенных 4,5-диацил-1-метиленамино-2,3-дигидро-2,3-пирролдионов.
MM4A Досрочное прекращение действия патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 07.07.2003
Извещение опубликовано: 27.08.2005 БИ: 24/2005
|
||||||||||||||||||||||||||
