Патент на изобретение №2233842
|
||||||||||||||||||||||||||
(54) ПРОИЗВОДНЫЕ ПУРИНА, ОБЛАДАЮЩИЕ ПРОТИВОВИРУСНОЙ АКТИВНОСТЬЮ
(57) Реферат: Изобретение относится к производным пурина, обладающим противовирусной активностью в отношении цитомегаловируса человека и вируса иммунодефицита человека типа 1, общей формулы: 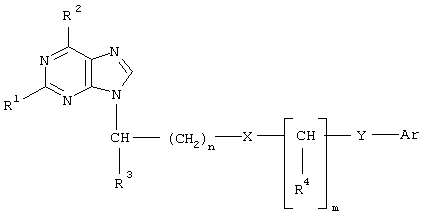 где n = 0 – 4; m = 0 – 3; R1 = Н, ОН или NH2; R2 = ОН, NH2, ацетиламино или бензоиламино; R3 = Н или низший алкил C1–С4; R4 = Н, низший алкил C1-С4 или фенил; Х = СН2, О, S, NH или С(O)O; Y = СН2, СН=СН, С(O), О или ординарная связь; Ar = фенил, пиридил, нафтил или замещенный фенил формулы
где n = 0 – 4; m = 0 – 3; R1 = Н, ОН или NH2; R2 = ОН, NH2, ацетиламино или бензоиламино; R3 = Н или низший алкил C1–С4; R4 = Н, низший алкил C1-С4 или фенил; Х = СН2, О, S, NH или С(O)O; Y = СН2, СН=СН, С(O), О или ординарная связь; Ar = фенил, пиридил, нафтил или замещенный фенил формулы
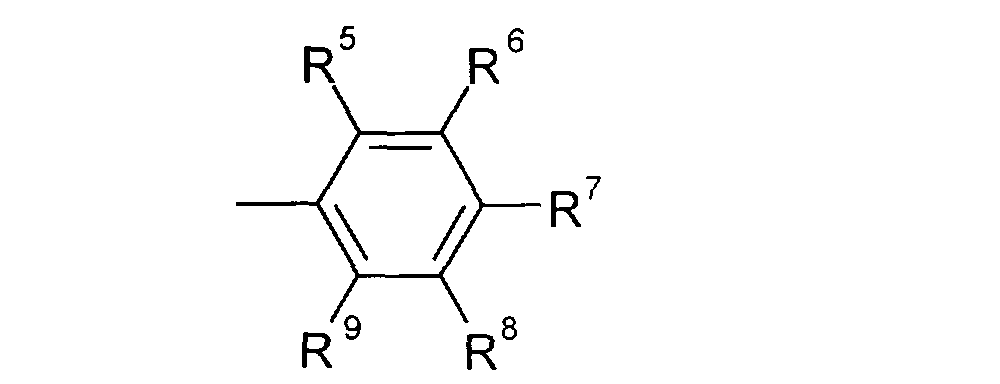 где независимо R5–R9 = алкил С1–C8, циклоалкил C5–С6, 1-адамантил, аллил, фенил, бензил, F, Cl, Br, J, трифторметил, алкокси C1–С5, фенокси, бензилокси, бензоилокси, циано, карбокси, ацетил или нитро, противовирусное действие наиболее активных веществ в отношении цитомегаловируса человека in vitro проявляется в концентрациях 0,01-0,0005
где независимо R5–R9 = алкил С1–C8, циклоалкил C5–С6, 1-адамантил, аллил, фенил, бензил, F, Cl, Br, J, трифторметил, алкокси C1–С5, фенокси, бензилокси, бензоилокси, циано, карбокси, ацетил или нитро, противовирусное действие наиболее активных веществ в отношении цитомегаловируса человека in vitro проявляется в концентрациях 0,01-0,0005  М и характеризуется селективностью 1-400 тысяч. 5 табл.
Изобретение относится к области медицины и химии азотсодержащих гетероциклических соединений, в частности к новым производным пурина общей формулы М и характеризуется селективностью 1-400 тысяч. 5 табл.
Изобретение относится к области медицины и химии азотсодержащих гетероциклических соединений, в частности к новым производным пурина общей формулы
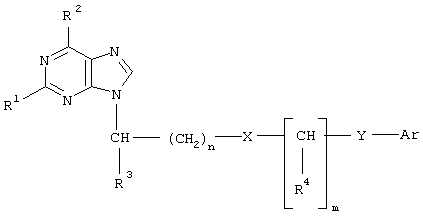 где n=0-4;
m=0-3;
R1=Н, ОН или NH2;
R2=ОН, NH2, ацетиламино или бензоиламино;
R3=Н или низший алкил C1-С4;
R4=Н, низший алкил С1-С4 или фенил;
Х=СН2, О, S, NH или С(O)O;
Y=СН2, СН=СН, С(O), О или ординарная связь;
Аr = фенил, пиридил, нафтил или замещенный фенил формулы
где n=0-4;
m=0-3;
R1=Н, ОН или NH2;
R2=ОН, NH2, ацетиламино или бензоиламино;
R3=Н или низший алкил C1-С4;
R4=Н, низший алкил С1-С4 или фенил;
Х=СН2, О, S, NH или С(O)O;
Y=СН2, СН=СН, С(O), О или ординарная связь;
Аr = фенил, пиридил, нафтил или замещенный фенил формулы
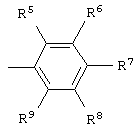 где независимо R5-R9 = алкил C1-C8, циклоалкил С5-С6, 1-адамантил, аллил, фенил, бензил, F, Cl, Br, J, трифторметил, алкокси C1-С5, фенокси, бензилокси, бензоилокси, циано, карбокси, ацетил или нитро, которые обладают противовирусной активностью, в том числе в отношении цитомегаловируса человека и вируса иммунодефицита человека типа 1, и могут найти применение в медицине в качестве лекарственных веществ в лекарственных средствах, применяющихся в комплексной терапии СПИД и оппортунистических вирусных инфекций.
Описаны изомерные аналоги ацикловира и ганцикловира, обладающие противовирусной активностью и имеющие принципиально иное строение ациклической цепи, соединенной с положением N9 пуринового цикла непосредственно через атом кислорода [Пат. США №4965270 (1990), МКИ С 07 D 473/18, А 61 К 31/52 / Hamden M.R., Wyatt P.G., Bailey S. Purine derivatives].
Однако все описанные выше производные пурина, за исключением ганцикловира, не обладают уровнем анти-ЦМВ действия, достаточным для создания на их основе лекарственных средств для лечения ЦМВ инфекции.
Среди активных анти-ЦМВ агентов, имеющих иную, не цуриновую химическую природу, следует выделить производные 1,6-нафтиридина, проявляющие ингибиторные свойства в отношении ЦМВ in vitro в минимальной концентрации 0,0004
где независимо R5-R9 = алкил C1-C8, циклоалкил С5-С6, 1-адамантил, аллил, фенил, бензил, F, Cl, Br, J, трифторметил, алкокси C1-С5, фенокси, бензилокси, бензоилокси, циано, карбокси, ацетил или нитро, которые обладают противовирусной активностью, в том числе в отношении цитомегаловируса человека и вируса иммунодефицита человека типа 1, и могут найти применение в медицине в качестве лекарственных веществ в лекарственных средствах, применяющихся в комплексной терапии СПИД и оппортунистических вирусных инфекций.
Описаны изомерные аналоги ацикловира и ганцикловира, обладающие противовирусной активностью и имеющие принципиально иное строение ациклической цепи, соединенной с положением N9 пуринового цикла непосредственно через атом кислорода [Пат. США №4965270 (1990), МКИ С 07 D 473/18, А 61 К 31/52 / Hamden M.R., Wyatt P.G., Bailey S. Purine derivatives].
Однако все описанные выше производные пурина, за исключением ганцикловира, не обладают уровнем анти-ЦМВ действия, достаточным для создания на их основе лекарственных средств для лечения ЦМВ инфекции.
Среди активных анти-ЦМВ агентов, имеющих иную, не цуриновую химическую природу, следует выделить производные 1,6-нафтиридина, проявляющие ингибиторные свойства в отношении ЦМВ in vitro в минимальной концентрации 0,0004  Целью предлагаемого изобретения является создание новых, высокоэффективных, селективных и малотоксичных антивирусных агентов для лечения ЦМВ и других вирусных инфекций.
Сущность изобретения заключается в синтезе новых производных пурина, в том числе аденина, гуанина, гипоксантина и 2,6-диаминопурина, содержащих в качестве заместителя незамещенное или замещенное ароматическое ядро (фенил, нафтил или пиридил), соединенное с атомом азота N9 пуриновой гетероциклической системы ациклической цепью, состоящей из 1-5 атомов углерода, которая может дополнительно включать атомы кислорода, серы или азота, и отвечающих указанной выше общей формуле.
Синтез новых соединений был осуществлен путем алкилирования соответствующего пуринового основания (аденина, гуанина, гипоксантина или 2,6-диаминопурина) тозилатами
Целью предлагаемого изобретения является создание новых, высокоэффективных, селективных и малотоксичных антивирусных агентов для лечения ЦМВ и других вирусных инфекций.
Сущность изобретения заключается в синтезе новых производных пурина, в том числе аденина, гуанина, гипоксантина и 2,6-диаминопурина, содержащих в качестве заместителя незамещенное или замещенное ароматическое ядро (фенил, нафтил или пиридил), соединенное с атомом азота N9 пуриновой гетероциклической системы ациклической цепью, состоящей из 1-5 атомов углерода, которая может дополнительно включать атомы кислорода, серы или азота, и отвечающих указанной выше общей формуле.
Синтез новых соединений был осуществлен путем алкилирования соответствующего пуринового основания (аденина, гуанина, гипоксантина или 2,6-диаминопурина) тозилатами  -арилалканолов или -арилалканолов или  -арилалкилбромидами в среде безводного диметилформамида в присутствии безводного карбоната калия или гидрида натрия по схеме: -арилалкилбромидами в среде безводного диметилформамида в присутствии безводного карбоната калия или гидрида натрия по схеме:
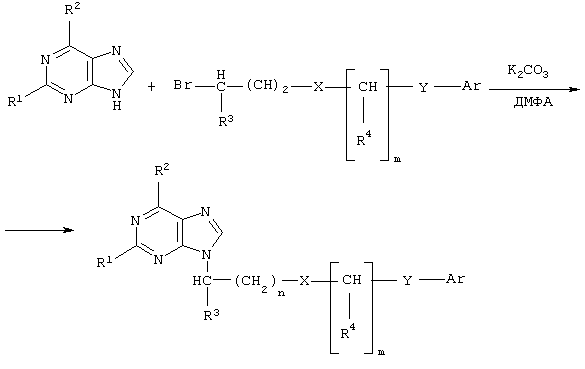 где n=0-4;
m=0-3;
R1=Н, ОН или NH2;
R2=ОН, NH2, ацетиламино или бензоиламино;
R3=Н или низший алкил C1-С4;
R4=Н, низший алкил C1-С4 или фенил;
Х=СН2, О, S, NH или С(O)O;
Y=СН2, СН=СН, С(O), О или ординарная связь;
Аr = фенил, пиридил, нафтил или замещенный фенил формулы
где n=0-4;
m=0-3;
R1=Н, ОН или NH2;
R2=ОН, NH2, ацетиламино или бензоиламино;
R3=Н или низший алкил C1-С4;
R4=Н, низший алкил C1-С4 или фенил;
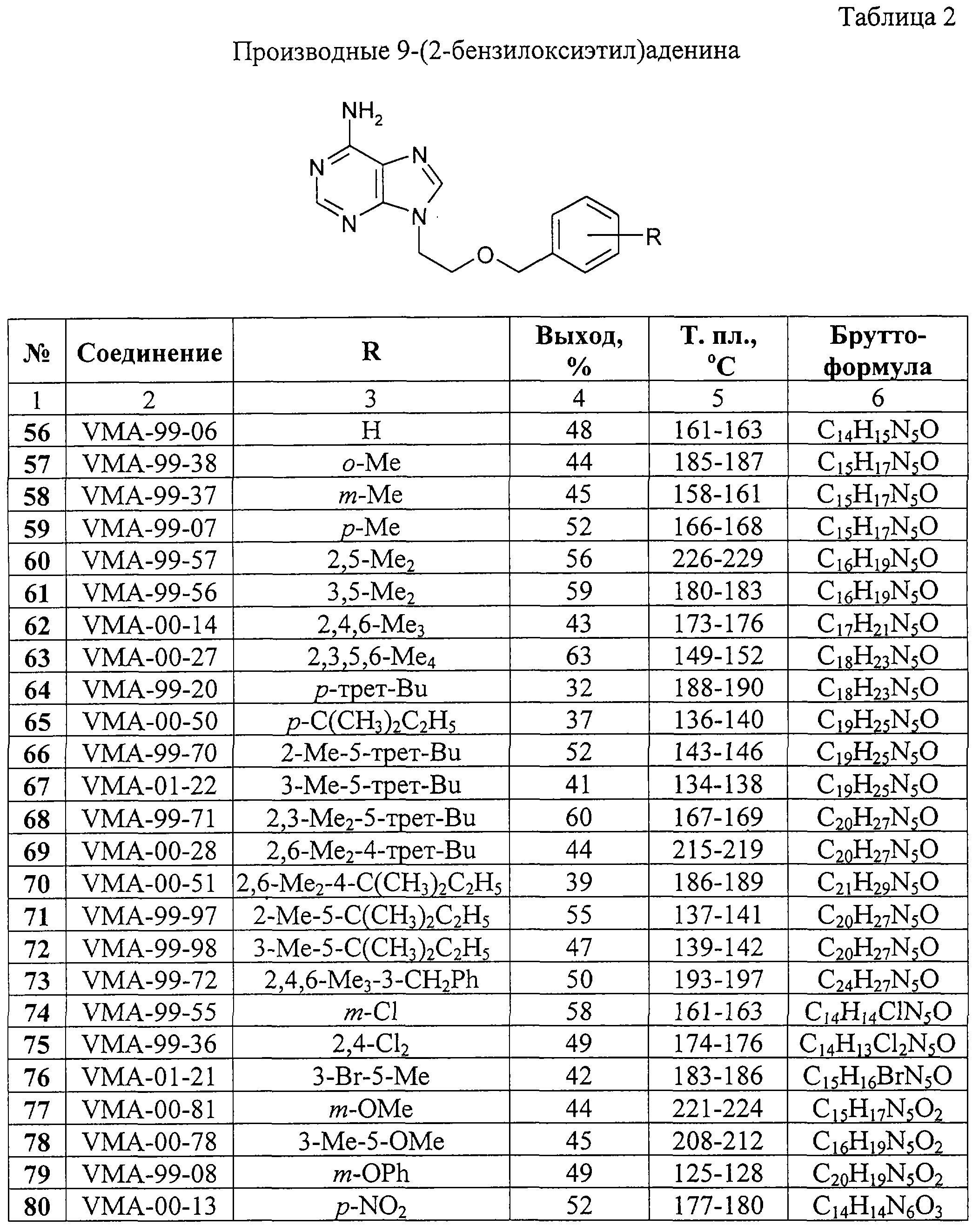
Х=СН2, О, S, NH или С(O)O;
Y=СН2, СН=СН, С(O), О или ординарная связь;
Аr = фенил, пиридил, нафтил или замещенный фенил формулы
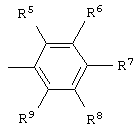 где независимо R5-R9 = алкил C1-C8, циклоалкил С5-С6, 1-адамантил, аллил, фенил, бензил, F, Cl, Br, J, трифторметил, алкокси C1-С5, фенокси, бензилокси, бензоилокси, циано, карбокси, ацетил или нитро.
Химическое строение, выход и физико-химические свойства синтезированных соединений 1-130 представлены в таблицах 1-3. Структура и элементный состав соединений доказаны методами ПМР-спектроскопии и масс-спектрометрии, чистота и индивидуальность – методом тонкослойной хроматографии.
Пример 1. 9-[2-(4-Изопропилфенокси)этил]аденин (11, VMA-99-82).
2-(4-Изопропилфенокси)этанол.
К раствору 40,0 г (0,294 моль) 4-изопропилфенола в 200 мл воды, содержащей 30,0 г (0,535 моль) КОН, при температуре 75-80
где независимо R5-R9 = алкил C1-C8, циклоалкил С5-С6, 1-адамантил, аллил, фенил, бензил, F, Cl, Br, J, трифторметил, алкокси C1-С5, фенокси, бензилокси, бензоилокси, циано, карбокси, ацетил или нитро.
Химическое строение, выход и физико-химические свойства синтезированных соединений 1-130 представлены в таблицах 1-3. Структура и элементный состав соединений доказаны методами ПМР-спектроскопии и масс-спектрометрии, чистота и индивидуальность – методом тонкослойной хроматографии.
Пример 1. 9-[2-(4-Изопропилфенокси)этил]аденин (11, VMA-99-82).
2-(4-Изопропилфенокси)этанол.
К раствору 40,0 г (0,294 моль) 4-изопропилфенола в 200 мл воды, содержащей 30,0 г (0,535 моль) КОН, при температуре 75-80 С и интенсивном перемешивании в течение 30 мин добавляют 20,6 мл (0,307 моль) 2-хлорэтанола. Реакционную массу перемешивают при той же температуре еще 2 ч и оставляют на ночь при комнатной температуре. Органическую фазу отделяют, водную фазу экстрагируют хлороформом (4 С и интенсивном перемешивании в течение 30 мин добавляют 20,6 мл (0,307 моль) 2-хлорэтанола. Реакционную массу перемешивают при той же температуре еще 2 ч и оставляют на ночь при комнатной температуре. Органическую фазу отделяют, водную фазу экстрагируют хлороформом (4 25 мл), органическую фазу и экстракты объединяют, сушат Na2SO4, фильтруют и упаривают в вакууме водоструйного насоса на кипящей водяной бане. Остаток перегоняют в вакууме, собирая фракцию, кипящую при 157-162 25 мл), органическую фазу и экстракты объединяют, сушат Na2SO4, фильтруют и упаривают в вакууме водоструйного насоса на кипящей водяной бане. Остаток перегоняют в вакууме, собирая фракцию, кипящую при 157-162 С (3 мм рт.ст.). Получают 39,0 г бесцветной вязкой жидкости, n20D 1,5246, выход 74%.
1-(4-Изопропилфенокси)-2-(n-толуолсульфонилокси)этан.
К раствору 30,0 г (0,166 моль) 2-(4-изопропилфенокси)этанола в 150 мл безводного дихлорметана и 40 мл пиридина при интенсивном перемешивании и охлаждении до 0 С (3 мм рт.ст.). Получают 39,0 г бесцветной вязкой жидкости, n20D 1,5246, выход 74%.
1-(4-Изопропилфенокси)-2-(n-толуолсульфонилокси)этан.
К раствору 30,0 г (0,166 моль) 2-(4-изопропилфенокси)этанола в 150 мл безводного дихлорметана и 40 мл пиридина при интенсивном перемешивании и охлаждении до 0 С добавляют порциями в течение 20 мин 38,0 г (0,199 моль) n-толуолсульфохлорида с такой скоростью, чтобы температура реакционной смеси не поднималась выше 5 С добавляют порциями в течение 20 мин 38,0 г (0,199 моль) n-толуолсульфохлорида с такой скоростью, чтобы температура реакционной смеси не поднималась выше 5 С. После этого реакционную массу перемешивают при той же температуре еще 2 ч и оставляют на ночь при комнатной температуре. Реакционную массу последовательно промывают 2%-ным водным раствором соляной кислоты (2 С. После этого реакционную массу перемешивают при той же температуре еще 2 ч и оставляют на ночь при комнатной температуре. Реакционную массу последовательно промывают 2%-ным водным раствором соляной кислоты (2 100 мл), водой (2 100 мл), водой (2 80 мл), насыщенным раствором соды (2 80 мл), насыщенным раствором соды (2 100 мл) и вновь водой до нейтральной реакции, сушат Na2SO4, фильтруют и упаривают в вакууме водоструйного насоса. Остаток дополнительно вакуумируют при 40-50 100 мл) и вновь водой до нейтральной реакции, сушат Na2SO4, фильтруют и упаривают в вакууме водоструйного насоса. Остаток дополнительно вакуумируют при 40-50 С (5 мм рт.ст.) в течение 1 ч. Получают 47,4 г вязкого сиропообразного продукта светло-желтого цвета, выход 85%.
1-Бром-2-(4-изопропилфенокси)этан. Метод А.
К раствору 14,0 г (0,078 моль) 2-(4-изопропилфенокси)этанола в 100 мл безводного хлороформа и 10 мл пиридина при интенсивном перемешивании и охлаждении до -10 С (5 мм рт.ст.) в течение 1 ч. Получают 47,4 г вязкого сиропообразного продукта светло-желтого цвета, выход 85%.
1-Бром-2-(4-изопропилфенокси)этан. Метод А.
К раствору 14,0 г (0,078 моль) 2-(4-изопропилфенокси)этанола в 100 мл безводного хлороформа и 10 мл пиридина при интенсивном перемешивании и охлаждении до -10 С прибавляют по каплям в течение 10 мин 2,7 мл (0,029 моль) трехбромистого фосфора. После этого реакционную массу перемешивают при 0 С прибавляют по каплям в течение 10 мин 2,7 мл (0,029 моль) трехбромистого фосфора. После этого реакционную массу перемешивают при 0 С еще 2 ч, затем 2 ч при комнатной температуре и оставляют на ночь. Реакционную массу выливают в 250 мл холодной воды, органический слой промывают насыщенным раствором соды (2 С еще 2 ч, затем 2 ч при комнатной температуре и оставляют на ночь. Реакционную массу выливают в 250 мл холодной воды, органический слой промывают насыщенным раствором соды (2 100 мл) и водой до нейтральной реакции, сушат Na2SO4, фильтруют и упаривают в вакууме водоструйного насоса. Остаток перегоняют в вакууме, собирая фракцию, кипящую при 158-162 100 мл) и водой до нейтральной реакции, сушат Na2SO4, фильтруют и упаривают в вакууме водоструйного насоса. Остаток перегоняют в вакууме, собирая фракцию, кипящую при 158-162 С (3 мм рт.ст.). Получают 10,2 г бесцветной прозрачной жидкости, n20D 1,5112, выход 54%.
1-Бром-2-(4-изопропилфенокси)этан. Метод Б.
Смесь 15,0 г (0,110 моль) 4-изопропилфенола, 20,0 мл (0,232 моль) 1,2-дибромэтана и раствора 6,2 г (0,110 моль) КОН в 10 мл воды кипятят в течение 8 ч до нейтральной реакции. Реакционную массу разбавляют 100 мл хлороформа, органический слой промывают 3%-ным раствором NaOH (100 мл) и водой (2 С (3 мм рт.ст.). Получают 10,2 г бесцветной прозрачной жидкости, n20D 1,5112, выход 54%.
1-Бром-2-(4-изопропилфенокси)этан. Метод Б.
Смесь 15,0 г (0,110 моль) 4-изопропилфенола, 20,0 мл (0,232 моль) 1,2-дибромэтана и раствора 6,2 г (0,110 моль) КОН в 10 мл воды кипятят в течение 8 ч до нейтральной реакции. Реакционную массу разбавляют 100 мл хлороформа, органический слой промывают 3%-ным раствором NaOH (100 мл) и водой (2 100 мл) до нейтральной реакции, сушат Na2SO4, фильтруют, растворитель и избыток 1,2-дибромэтана отгоняют в вакууме водоструйного насоса на кипящей водяной бане. Остаток перегоняют в вакууме, собирая фракцию, кипящую при 158-163 100 мл) до нейтральной реакции, сушат Na2SO4, фильтруют, растворитель и избыток 1,2-дибромэтана отгоняют в вакууме водоструйного насоса на кипящей водяной бане. Остаток перегоняют в вакууме, собирая фракцию, кипящую при 158-163 С (3 мм рт.ст.). Получают 13,5 г бесцветной прозрачной жидкости, n20D 1,5118, выход 51%.
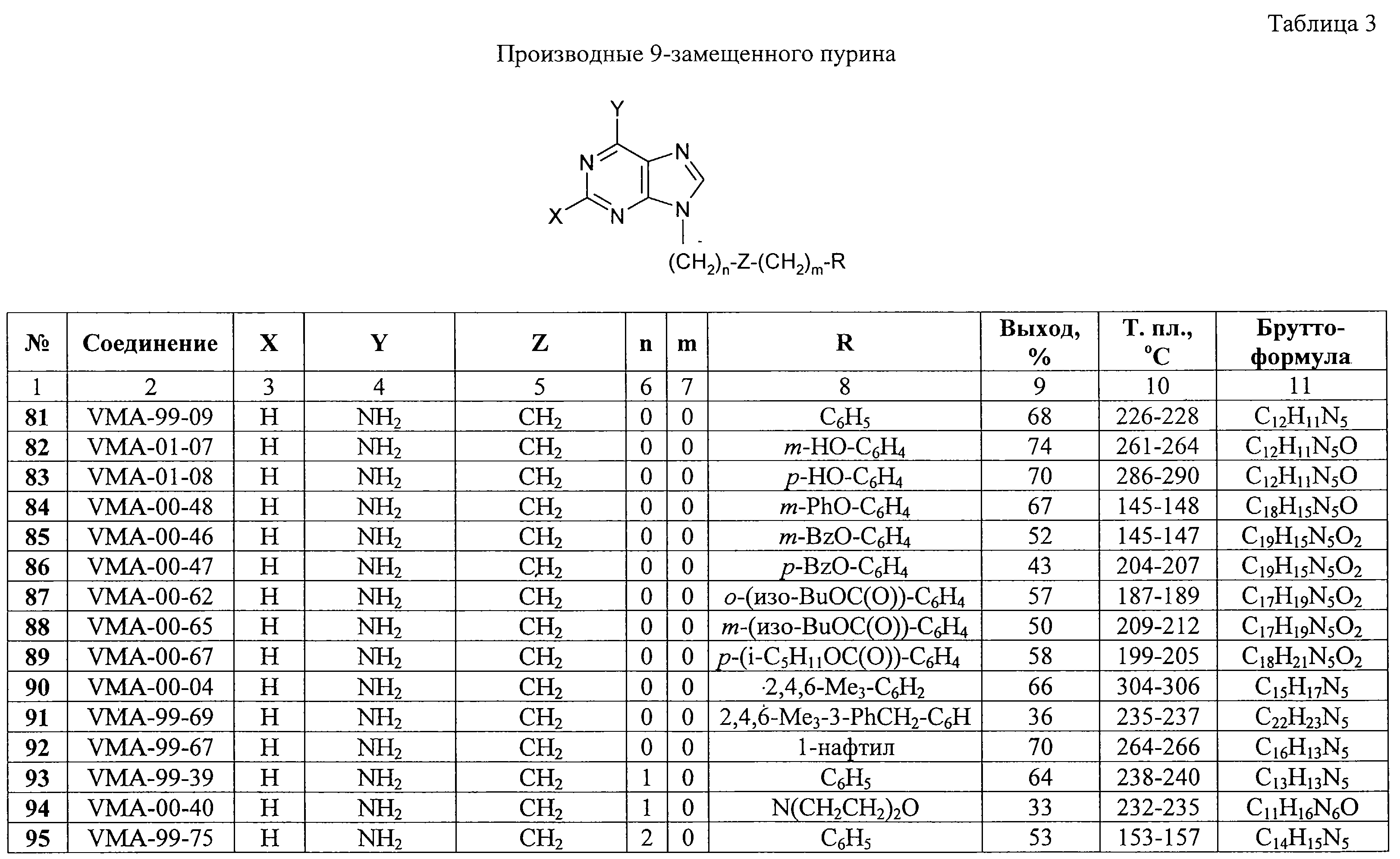
9-[2-(4-Изопропилфенокси)этил]аденин (11, VMA-99-82). Метод А.
Суспензию 15,0 г (0,111 моль) аденина и 17,3 г (0,125 моль) свежепрокаленного карбоната калия в 100 мл ДМФА перемешивают при температуре 80-85 С (3 мм рт.ст.). Получают 13,5 г бесцветной прозрачной жидкости, n20D 1,5118, выход 51%.
9-[2-(4-Изопропилфенокси)этил]аденин (11, VMA-99-82). Метод А.
Суспензию 15,0 г (0,111 моль) аденина и 17,3 г (0,125 моль) свежепрокаленного карбоната калия в 100 мл ДМФА перемешивают при температуре 80-85 С в течение 1,5 ч, добавляют раствор 37,0 г (0,111 моль) 1-(4-изопропилфенокси)-2-(n-толуолсульфонилокси)этана в 50 мл ДМФА и полученную смесь перемешивают при той же температуре еще 8 ч. Реакционную массу оставляют на ночь при комнатной температуре, фильтруют, фильтрат упаривают в вакууме, остаток обрабатывают 200 мл холодной воды и охлаждают при 0-5 С в течение 1,5 ч, добавляют раствор 37,0 г (0,111 моль) 1-(4-изопропилфенокси)-2-(n-толуолсульфонилокси)этана в 50 мл ДМФА и полученную смесь перемешивают при той же температуре еще 8 ч. Реакционную массу оставляют на ночь при комнатной температуре, фильтруют, фильтрат упаривают в вакууме, остаток обрабатывают 200 мл холодной воды и охлаждают при 0-5 С в течение суток. Закристаллизовавшийся остаток отфильтровывают и после сушки на воздухе перекристаллизовывают из смеси 100 мл ДМФА и 10 мл воды. Получают 22,1 г VMA-99-82 в виде белого мелкокристаллического продукта с выходом 67%. Rf (метиленхлорид – метанол, 10 : 1) 0,64. Т. пл. 231-233 С в течение суток. Закристаллизовавшийся остаток отфильтровывают и после сушки на воздухе перекристаллизовывают из смеси 100 мл ДМФА и 10 мл воды. Получают 22,1 г VMA-99-82 в виде белого мелкокристаллического продукта с выходом 67%. Rf (метиленхлорид – метанол, 10 : 1) 0,64. Т. пл. 231-233 С.
Масс-спектр: M+ 297 (6%), 282 (2%), 254 (2%), 178 (9%), 163 (81%), 149 (84%), 134 (100%), 119 (30%), 107 (50%), 105 (47%), 92 (99%), 91 (80%).
9-[2-(4-Изопропилфенокси)этил]аденин (11, VMA-99-82). Метод Б.
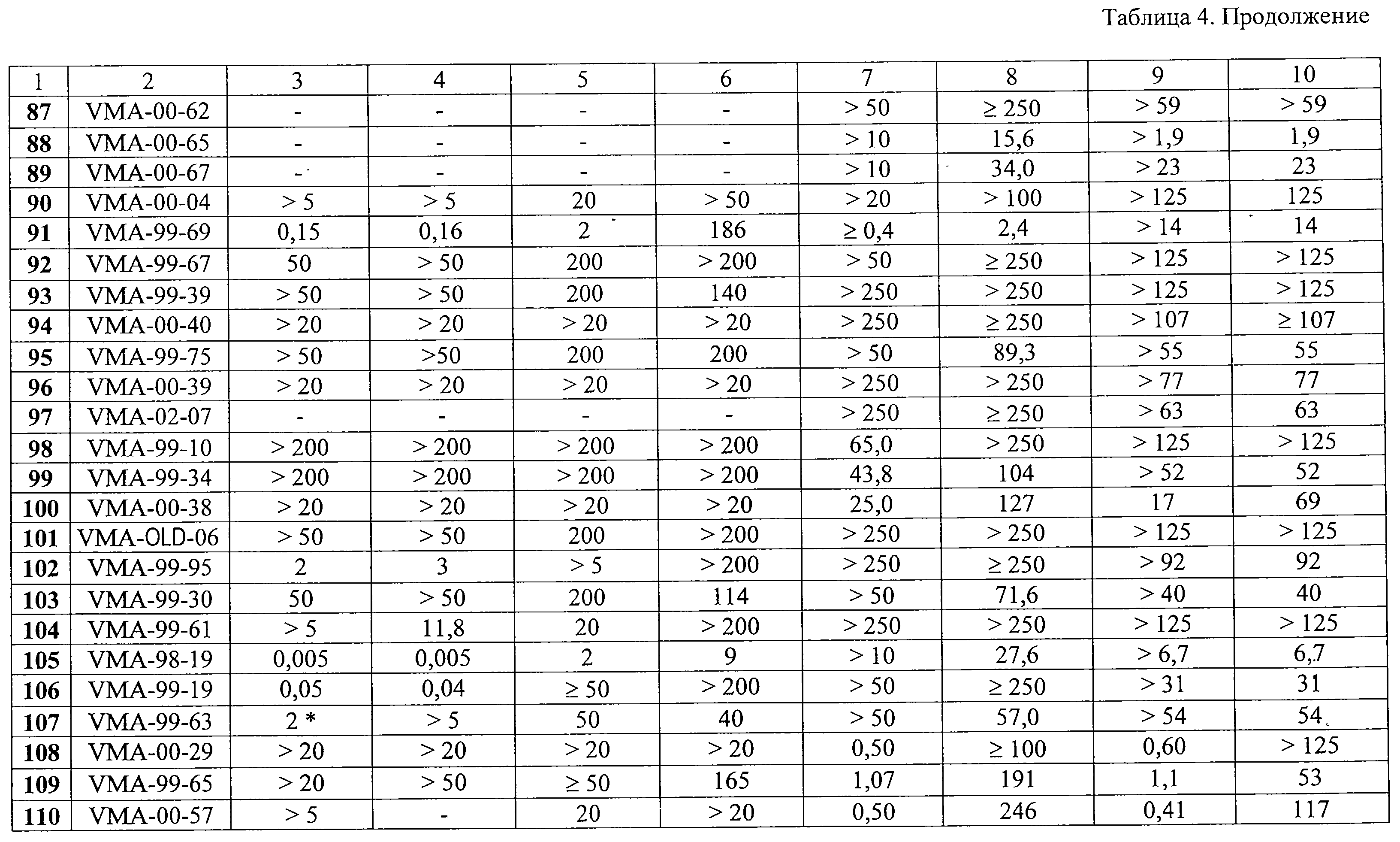
Суспензию 5,0 г (0,037 моль) аденина и 6,3 г (0,045 моль) свежепрокаленного карбоната калия в 60 мл ДМФА перемешивают при температуре 105-110 С.
Масс-спектр: M+ 297 (6%), 282 (2%), 254 (2%), 178 (9%), 163 (81%), 149 (84%), 134 (100%), 119 (30%), 107 (50%), 105 (47%), 92 (99%), 91 (80%).
9-[2-(4-Изопропилфенокси)этил]аденин (11, VMA-99-82). Метод Б.
Суспензию 5,0 г (0,037 моль) аденина и 6,3 г (0,045 моль) свежепрокаленного карбоната калия в 60 мл ДМФА перемешивают при температуре 105-110 С в течение 1,5 ч, добавляют раствор 9,0 г (0,037 моль) 1-бром-2-(4-изопропилфенокси)этана в 20 мл ДМФА и полученную смесь перемешивают при той же температуре еще 2 ч. Выделение и очистка аналогична описанному выше. Получают 6,1 г VMA-99-82 в виде белого мелкокристаллического продукта, выход 55%.
Пример 2. 9-[2-(3,5-Диметилбензилокси)этил]аденин (61, VMA-99-56).
2-(3,5-Диметилбензилокси)этанол.
К раствору 210 мл (1,509 моль) мезитилена и 100 мл ССl4 при кипячении и облучении светом добавляют в течение 30 мин раствор 14,0 мл (0,272 моль) брома в 25 мл ССl4. Реакционную массу упаривают в вакууме водоструйного насоса на водяной бане, к остатку прибавляют раствор 16,0 г (0,285 моль) КОН в 100 мл (1,793 моль) этиленгликоля и полученную смесь перемешивают на водяной бане при температуре 80-90 С в течение 1,5 ч, добавляют раствор 9,0 г (0,037 моль) 1-бром-2-(4-изопропилфенокси)этана в 20 мл ДМФА и полученную смесь перемешивают при той же температуре еще 2 ч. Выделение и очистка аналогична описанному выше. Получают 6,1 г VMA-99-82 в виде белого мелкокристаллического продукта, выход 55%.
Пример 2. 9-[2-(3,5-Диметилбензилокси)этил]аденин (61, VMA-99-56).
2-(3,5-Диметилбензилокси)этанол.
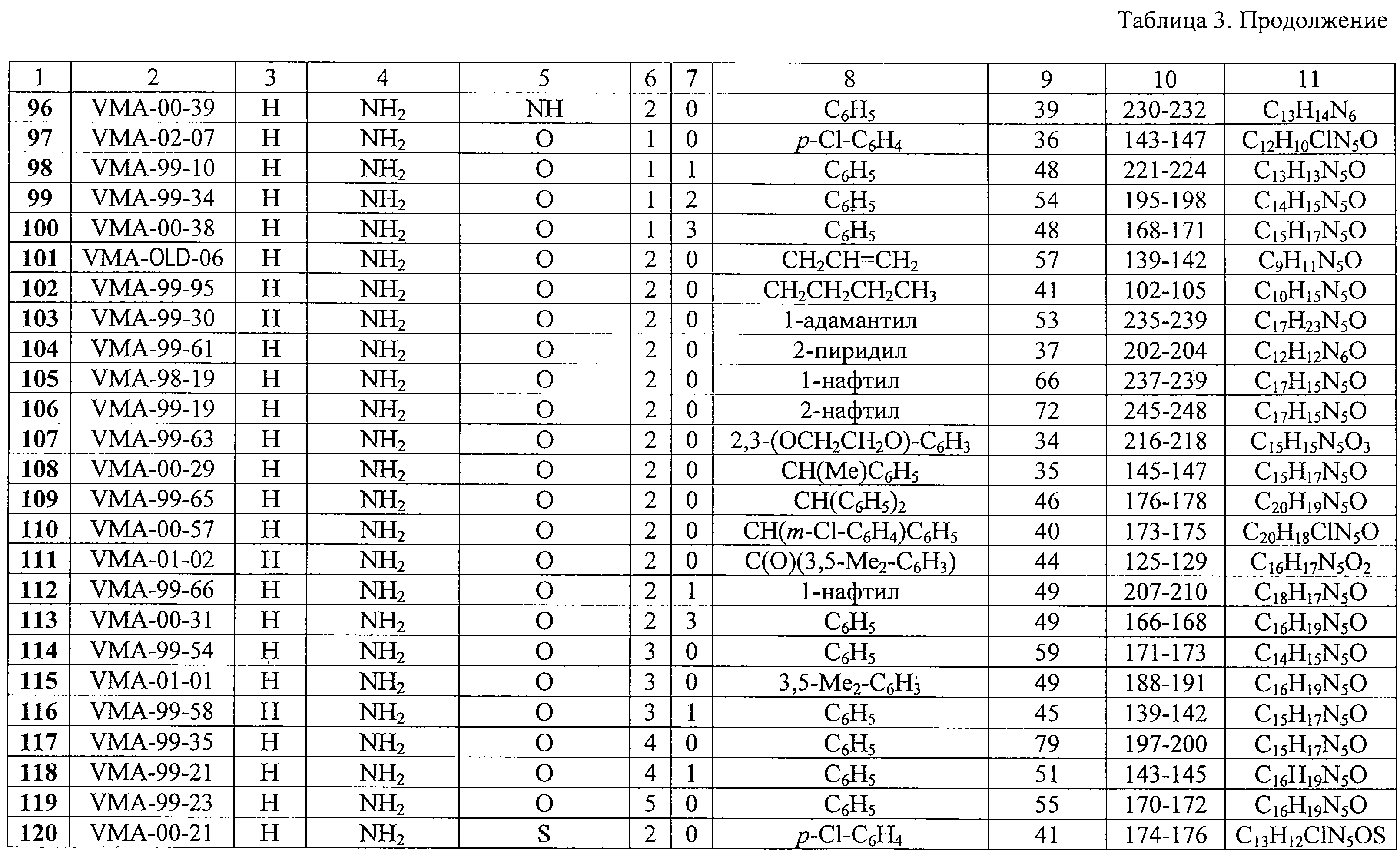
К раствору 210 мл (1,509 моль) мезитилена и 100 мл ССl4 при кипячении и облучении светом добавляют в течение 30 мин раствор 14,0 мл (0,272 моль) брома в 25 мл ССl4. Реакционную массу упаривают в вакууме водоструйного насоса на водяной бане, к остатку прибавляют раствор 16,0 г (0,285 моль) КОН в 100 мл (1,793 моль) этиленгликоля и полученную смесь перемешивают на водяной бане при температуре 80-90 С в течение 10 ч. Реакционную массу разбавляют 250 мл холодной воды, органическую фазу отделяют, водную фазу экстрагируют мезитиленом (3 С в течение 10 ч. Реакционную массу разбавляют 250 мл холодной воды, органическую фазу отделяют, водную фазу экстрагируют мезитиленом (3 30 мл), органическую фазу и экстракты объединяют, промывают солевым раствором (100 мл), сушат Na2SO4, фильтруют и упаривают в вакууме водоструйного насоса. Остаток перегоняют в вакууме, собирая фракцию, кипящую при 168-172 30 мл), органическую фазу и экстракты объединяют, промывают солевым раствором (100 мл), сушат Na2SO4, фильтруют и упаривают в вакууме водоструйного насоса. Остаток перегоняют в вакууме, собирая фракцию, кипящую при 168-172 С (3 мм рт.ст.). Получают 27,3 г бесцветной жидкости, n20D 1,5227, выход 56%.
1-(3,5-Диметилбензилокси)-2-(n-толуолсульфонилокси)этан.
К раствору 51,0 г (0,283 моль) 2-(3,5-диметилбензилокси)этанола в 250 мл безводного хлороформа и 80 мл пиридина при интенсивном перемешивании и охлаждении до 0 С (3 мм рт.ст.). Получают 27,3 г бесцветной жидкости, n20D 1,5227, выход 56%.
1-(3,5-Диметилбензилокси)-2-(n-толуолсульфонилокси)этан.
К раствору 51,0 г (0,283 моль) 2-(3,5-диметилбензилокси)этанола в 250 мл безводного хлороформа и 80 мл пиридина при интенсивном перемешивании и охлаждении до 0 С добавляют порциями в течение 30 мин 64,7 г (0,339 моль) n-толуолсульфохлорида с такой скоростью, чтобы температура реакционной смеси не поднималась выше 5 С добавляют порциями в течение 30 мин 64,7 г (0,339 моль) n-толуолсульфохлорида с такой скоростью, чтобы температура реакционной смеси не поднималась выше 5 С. После этого реакционную массу перемешивают при той же температуре еще 2 ч и оставляют на ночь при комнатной температуре. Затем реакционную массу последовательно промывают 2%-ным водным раствором соляной кислоты (2 С. После этого реакционную массу перемешивают при той же температуре еще 2 ч и оставляют на ночь при комнатной температуре. Затем реакционную массу последовательно промывают 2%-ным водным раствором соляной кислоты (2 150 мл), водой (2 150 мл), водой (2 100 мл), насыщенным раствором соды (2 100 мл), насыщенным раствором соды (2 100 мл) и вновь водой до нейтральной реакции, сушат Na2SO4, фильтруют и упаривают в вакууме водоструйного насоса. Остаток растворителя удаляют в вакууме при 40-50 100 мл) и вновь водой до нейтральной реакции, сушат Na2SO4, фильтруют и упаривают в вакууме водоструйного насоса. Остаток растворителя удаляют в вакууме при 40-50 С (5 мм рт.ст.) в течение 1 ч. Получают 77,6 г вязкого сиропообразного продукта светло-желтого цвета, выход 82%.
1-Бром-2-(3,5-диметилбензилокси)этан.
К раствору 18,75 г (0,104 моль) 2-(3,5-диметилбензилокси)этанола в 100 мл безводного хлороформа и 10 мл пиридина при интенсивном перемешивании и охлаждении до 10 С (5 мм рт.ст.) в течение 1 ч. Получают 77,6 г вязкого сиропообразного продукта светло-желтого цвета, выход 82%.
1-Бром-2-(3,5-диметилбензилокси)этан.
К раствору 18,75 г (0,104 моль) 2-(3,5-диметилбензилокси)этанола в 100 мл безводного хлороформа и 10 мл пиридина при интенсивном перемешивании и охлаждении до 10 С добавляют в течение 10 мин 3,6 мл (0,0379 моль) трехбромистого фосфора. После этого реакционную массу перемешивают при 0 С добавляют в течение 10 мин 3,6 мл (0,0379 моль) трехбромистого фосфора. После этого реакционную массу перемешивают при 0 С еще 1 ч, 2 ч при комнатной температуре и оставляют на ночь. Затем реакционную массу выливают в 300 мл холодной воды, органический слой промывают насыщенным раствором соды (2 С еще 1 ч, 2 ч при комнатной температуре и оставляют на ночь. Затем реакционную массу выливают в 300 мл холодной воды, органический слой промывают насыщенным раствором соды (2 100 мл) и водой до нейтральной реакции, сушат Na2SO4, фильтруют и упаривают в вакууме водоструйного насоса. Остаток перегоняют в вакууме, собирая фракцию, кипящую при 167-173 100 мл) и водой до нейтральной реакции, сушат Na2SO4, фильтруют и упаривают в вакууме водоструйного насоса. Остаток перегоняют в вакууме, собирая фракцию, кипящую при 167-173 С (3 мм рт.ст.). Получают 12,9 г бесцветной прозрачной жидкости, n20D 1,5391, выход 51%.
9-[2-(3,5-Диметилбензилокси)этил]аденин (61, VMA-99-56). Метод А.
Суспензию 23,0 г (0,170 моль) аденина и 27,0 г (0,195 моль) свежепрокаленного карбоната калия в 250 мл ДМФА перемешивают при температуре 80-85 С (3 мм рт.ст.). Получают 12,9 г бесцветной прозрачной жидкости, n20D 1,5391, выход 51%.
9-[2-(3,5-Диметилбензилокси)этил]аденин (61, VMA-99-56). Метод А.
Суспензию 23,0 г (0,170 моль) аденина и 27,0 г (0,195 моль) свежепрокаленного карбоната калия в 250 мл ДМФА перемешивают при температуре 80-85 С в течение 1,5 ч, добавляют раствор 60,0 г (0,176 моль) 1-(3,5-диметилбензилокси)-2-(n-толуолсульфонилокси)этана в 50 мл ДМФА и полученную смесь перемешивают при той же температуре еще 8 ч. Реакционную массу оставляют на ночь при комнатной температуре, фильтруют, твердый осадок обрабатывают 0,5 л холодной воды, фильтруют и после сушки на воздухе получают 17,8 г белого кристаллического продукта-сырца. Фильтрат первичной реакционной массы упаривают в вакууме, к остатку добавляют 0,5 л холодной воды, перемешивают и охлаждают при 0-5 С в течение 1,5 ч, добавляют раствор 60,0 г (0,176 моль) 1-(3,5-диметилбензилокси)-2-(n-толуолсульфонилокси)этана в 50 мл ДМФА и полученную смесь перемешивают при той же температуре еще 8 ч. Реакционную массу оставляют на ночь при комнатной температуре, фильтруют, твердый осадок обрабатывают 0,5 л холодной воды, фильтруют и после сушки на воздухе получают 17,8 г белого кристаллического продукта-сырца. Фильтрат первичной реакционной массы упаривают в вакууме, к остатку добавляют 0,5 л холодной воды, перемешивают и охлаждают при 0-5 С в течение суток. Закристаллизовавшийся остаток отфильтровывают и после сушки на воздухе дополнительно получают 22,2 г целевого продукта-сырца. Обе партии продукта объединяют и перекристаллизовывают из смеси 100 мл ДМФА и 15 мл воды. Получают 29,6 г белого мелкокристаллического продукта с выходом 59%. Rf (метиленхлорид – метанол, 10:1) 0,60. Т.пл. 180-183 С в течение суток. Закристаллизовавшийся остаток отфильтровывают и после сушки на воздухе дополнительно получают 22,2 г целевого продукта-сырца. Обе партии продукта объединяют и перекристаллизовывают из смеси 100 мл ДМФА и 15 мл воды. Получают 29,6 г белого мелкокристаллического продукта с выходом 59%. Rf (метиленхлорид – метанол, 10:1) 0,60. Т.пл. 180-183 С.
Масс-спектр: M+ 297 (3%), 178 (14%), 163 (31%), 149 (22%), 134 (100%), 119 (67%), 105 (47%), 92 (64%), 91 (46%).
9-[2-(3,5-Диметилбензилокси)этил]аденин (61, VMA-99-56). Метод Б.
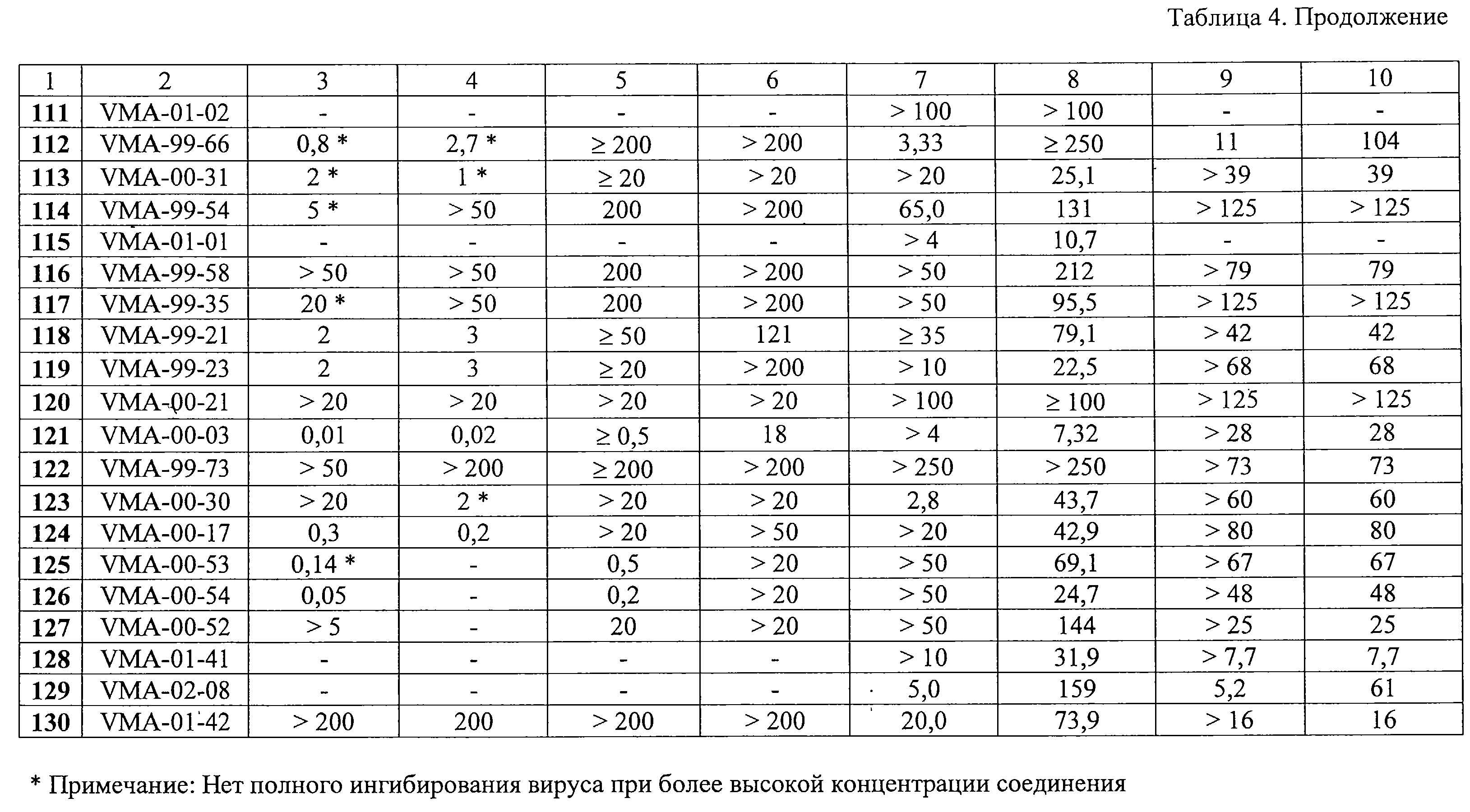
Суспензию 5,0 г (0,037 моль) аденина и 6,3 г (0,045 моль) свежепрокаленного карбоната калия в 60 мл ДМФА перемешивают при температуре 105-110 С.
Масс-спектр: M+ 297 (3%), 178 (14%), 163 (31%), 149 (22%), 134 (100%), 119 (67%), 105 (47%), 92 (64%), 91 (46%).
9-[2-(3,5-Диметилбензилокси)этил]аденин (61, VMA-99-56). Метод Б.
Суспензию 5,0 г (0,037 моль) аденина и 6,3 г (0,045 моль) свежепрокаленного карбоната калия в 60 мл ДМФА перемешивают при температуре 105-110 С в течение 1,5 ч, добавляют раствор 9,0 г (0,037 моль) 1-бром-2-(3,5-диметилбензилокси)этана в 20 мл ДМФА и полученную смесь перемешивают при той же температуре еще 2 ч. Выделение и очистка аналогична описанному выше. Получают 5,6 г VMA-99-56 в виде белого мелкокристаллического продукта, выход 51%.
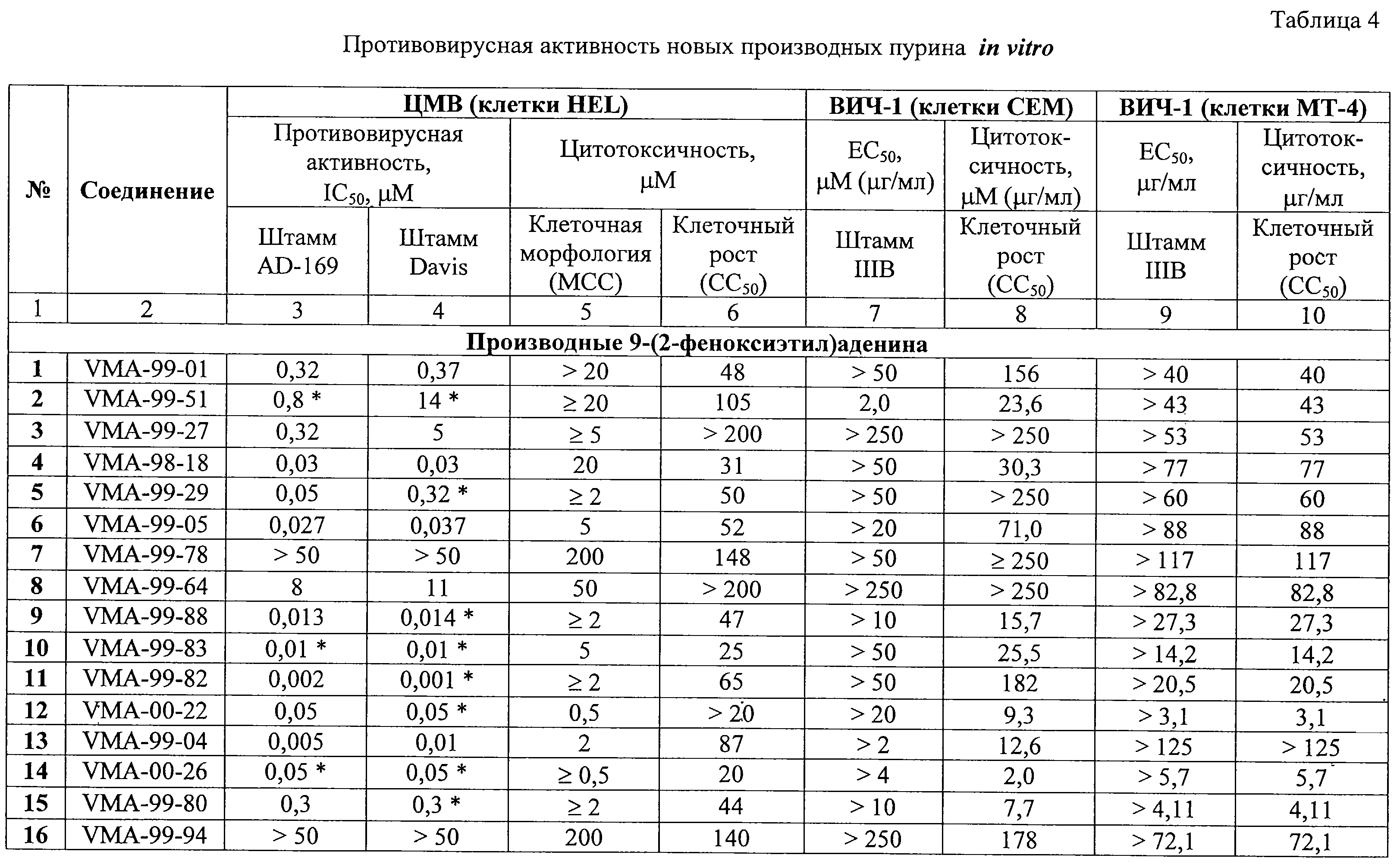
Противовирусная активность in vitro синтезированных соединений 1-130 в отношении ЦМВ, ВИЧ-1 и ряда других ДНК- и РНК-содержащих вирусов была исследована в Rega Institute for Medical Research (Католический университет, Лювен, Бельгия). Результаты скрининга веществ в отношении ЦМВ и ВИЧ-1 представлены в таблице 4.
Анти-ЦМВ активность.
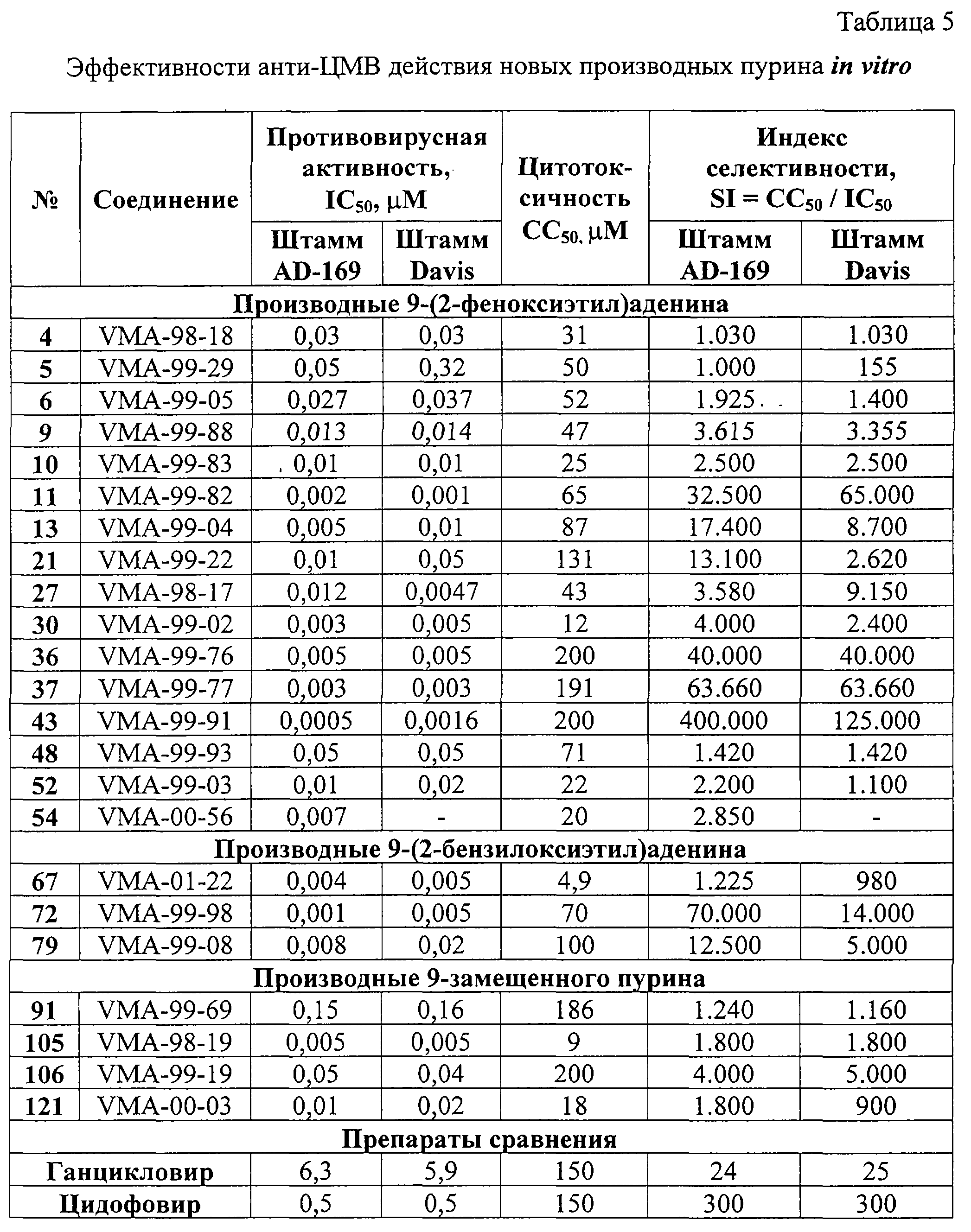
Производные 9-(2-феноксиэтил)аденина оказались исключительно активными ингибиторами репликации ЦМВ в культуре клеток HEL. В частности, соединения 11, 13, 27, 30, 36, 37, 43 и 54 ингибировали ЦМВ в концентрациях, равных или значительно ниже 0,01 С в течение 1,5 ч, добавляют раствор 9,0 г (0,037 моль) 1-бром-2-(3,5-диметилбензилокси)этана в 20 мл ДМФА и полученную смесь перемешивают при той же температуре еще 2 ч. Выделение и очистка аналогична описанному выше. Получают 5,6 г VMA-99-56 в виде белого мелкокристаллического продукта, выход 51%.
Противовирусная активность in vitro синтезированных соединений 1-130 в отношении ЦМВ, ВИЧ-1 и ряда других ДНК- и РНК-содержащих вирусов была исследована в Rega Institute for Medical Research (Католический университет, Лювен, Бельгия). Результаты скрининга веществ в отношении ЦМВ и ВИЧ-1 представлены в таблице 4.
Анти-ЦМВ активность.
Производные 9-(2-феноксиэтил)аденина оказались исключительно активными ингибиторами репликации ЦМВ в культуре клеток HEL. В частности, соединения 11, 13, 27, 30, 36, 37, 43 и 54 ингибировали ЦМВ в концентрациях, равных или значительно ниже 0,01  М, хотя в случае некоторых веществ, например 11, 37, 43, не было достигнуто полного подавления вирусной репликации. Для ряда производных 9-(2-феноксиэтил)аденина была достигнута селективность противовирусного действия (отношение СС50/IС50), равная или значительно превышающая 1000 (таблица 5).
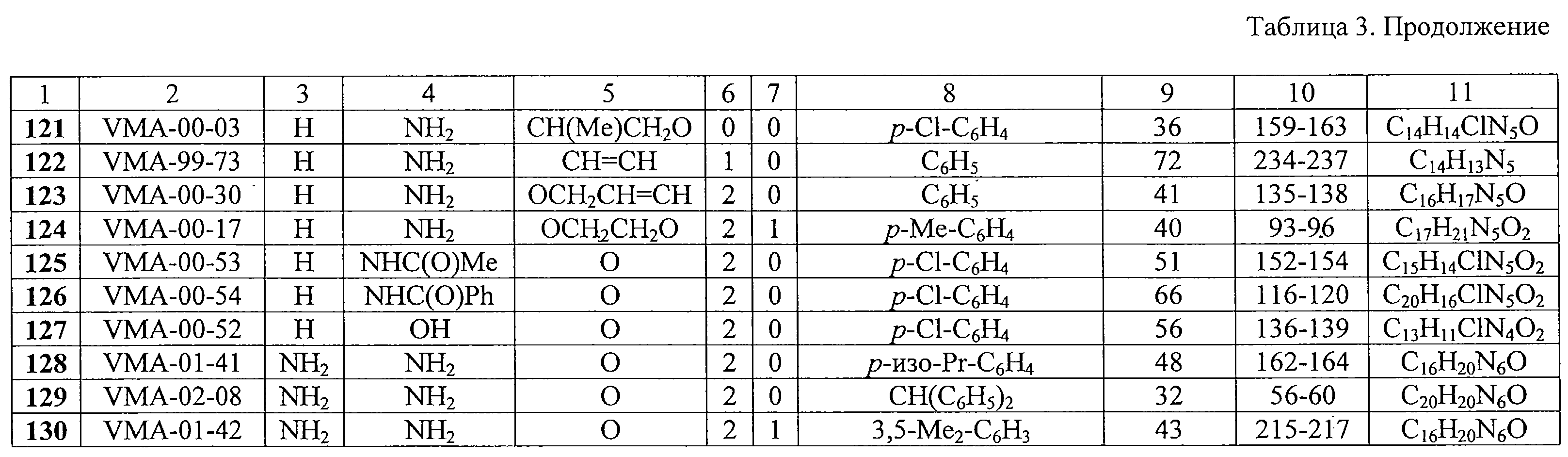
Среди производных 9-(2-бензилоксиэтил)аденина некоторые соединения также были высокоактивны против ЦМВ. В частности, соединения 67 и 72 проявляли ингибиторные свойства в концентрациях ниже наномолярного уровня.
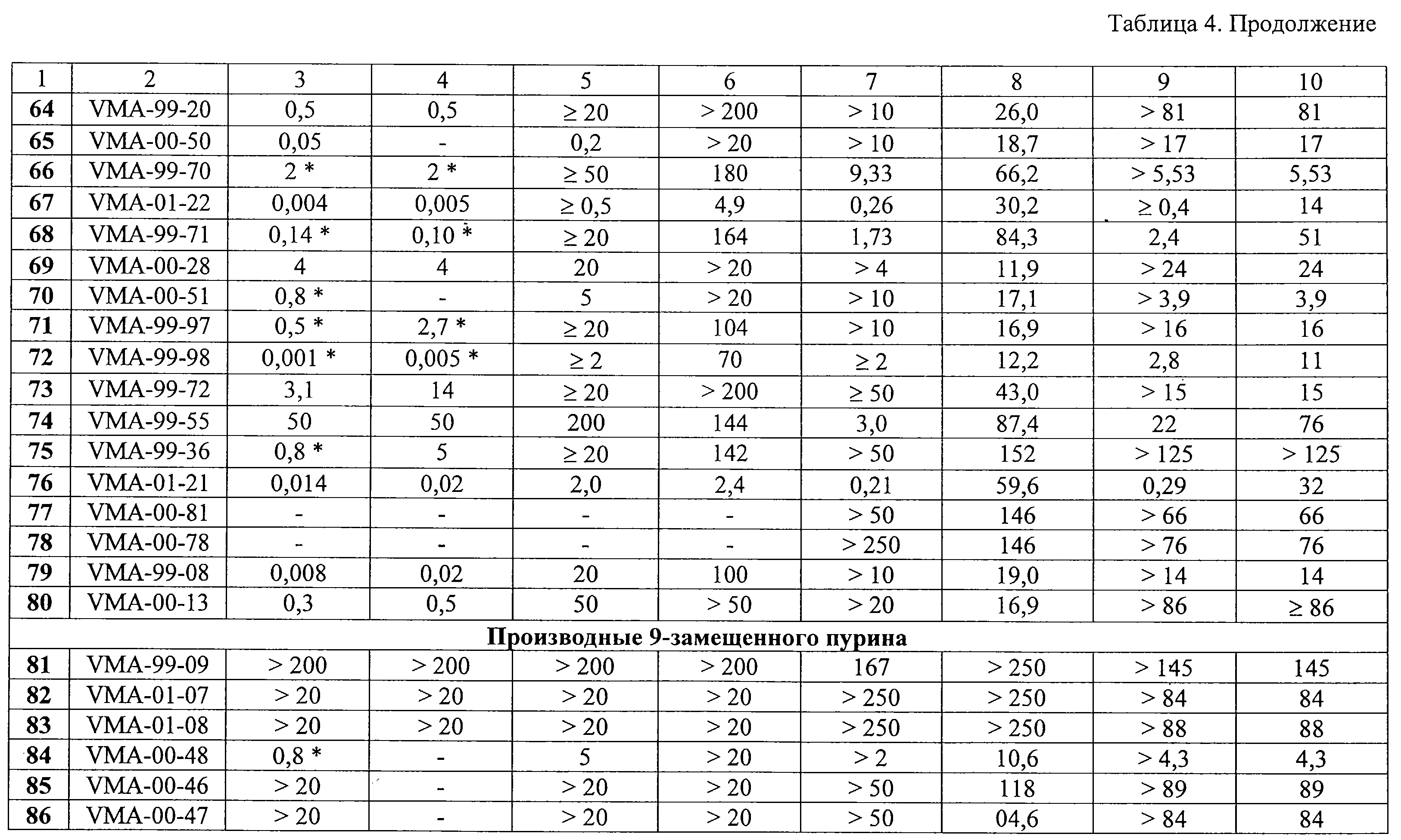
Некоторые 9-замещенные производные пурина были высокоактивными в отношении репликации ЦМВ, в том числе соединения 91 (IС50 0,15 М, хотя в случае некоторых веществ, например 11, 37, 43, не было достигнуто полного подавления вирусной репликации. Для ряда производных 9-(2-феноксиэтил)аденина была достигнута селективность противовирусного действия (отношение СС50/IС50), равная или значительно превышающая 1000 (таблица 5).
Среди производных 9-(2-бензилоксиэтил)аденина некоторые соединения также были высокоактивны против ЦМВ. В частности, соединения 67 и 72 проявляли ингибиторные свойства в концентрациях ниже наномолярного уровня.
Некоторые 9-замещенные производные пурина были высокоактивными в отношении репликации ЦМВ, в том числе соединения 91 (IС50 0,15  M), 105 (IC50 0,005 M), 105 (IC50 0,005  M), 106 (IC50 0,05 M), 106 (IC50 0,05  M), 121 (IC50 0,01 M), 121 (IC50 0,01  M) и 126 (IC50 0,05 M) и 126 (IC50 0,05  М). В частности, соединения 105 и 106 показали резко выраженную селективность (свыше 1000).
Анти-ВИЧ-1 активность.
За исключением соединения 2, которое имело индекс селективности около 10 в отношении ВИЧ-1 в культуре СЕМ-клеток, ни одно из производных 9-(2-феноксиэтил)аденина, имеющих заместитель в фенильном ядре и оказывающих высокую активность в отношении ЦМВ, не ингибировало репликацию ВИЧ-1 в культурах клеток СЕМ и МТ-4. Однако некоторые соединения (например, 14, 29, 30, 39, 40, 54 и 55) обладали высокой цитотоксичностью в использованных клеточных культурах (50%-ная цитотоксическая концентрация СС50 находилась в диапазоне 1-10 М). В частности, соединения 105 и 106 показали резко выраженную селективность (свыше 1000).
Анти-ВИЧ-1 активность.
За исключением соединения 2, которое имело индекс селективности около 10 в отношении ВИЧ-1 в культуре СЕМ-клеток, ни одно из производных 9-(2-феноксиэтил)аденина, имеющих заместитель в фенильном ядре и оказывающих высокую активность в отношении ЦМВ, не ингибировало репликацию ВИЧ-1 в культурах клеток СЕМ и МТ-4. Однако некоторые соединения (например, 14, 29, 30, 39, 40, 54 и 55) обладали высокой цитотоксичностью в использованных клеточных культурах (50%-ная цитотоксическая концентрация СС50 находилась в диапазоне 1-10  М).
В противоположность этому, некоторые производные 9-(2-бензилоксиэтил)аденина показали выраженную и селективную анти-ВИЧ-1 активность. В частности, соединения 61, 67 и 76, проявили себя как наиболее мощные и селективные ингибиторы репликации ВИЧ-1 в культурах клеток СЕМ и МТ-4. Величина их ингибиторной концентрации ЕС50 составляла 0,1-0,3 М).
В противоположность этому, некоторые производные 9-(2-бензилоксиэтил)аденина показали выраженную и селективную анти-ВИЧ-1 активность. В частности, соединения 61, 67 и 76, проявили себя как наиболее мощные и селективные ингибиторы репликации ВИЧ-1 в культурах клеток СЕМ и МТ-4. Величина их ингибиторной концентрации ЕС50 составляла 0,1-0,3  г/мл, тогда как клеточная токсичность СС50 была в пределах 13-75 г/мл, тогда как клеточная токсичность СС50 была в пределах 13-75  г/мл. В целом, цитостатическая активность была более выражена в культуре лимфоцитов МТ-4, чем в СЕМ клетках. Во всех трех случаях заместители (Me, трет-Bu или Вr) были в положениях 3 и 5 фенильного кольца. Перемещение указанных заместителей из положения 3 в положение 2 приводило к заметному понижению антивирусной активности соединений.
Соединения 108, 109 и 110, содержащие соответственно 2-(1-фенилэтокси)этильный, 2-(дифенилметокси)этильный и 2-(фенил-м-Сl-фенилметокси)этильный заместители, также проявили заметную активность в отношении ВИЧ-1 в культурах клеток СЕМ и МТ-4 (ЕС50 0,4-1,1 г/мл. В целом, цитостатическая активность была более выражена в культуре лимфоцитов МТ-4, чем в СЕМ клетках. Во всех трех случаях заместители (Me, трет-Bu или Вr) были в положениях 3 и 5 фенильного кольца. Перемещение указанных заместителей из положения 3 в положение 2 приводило к заметному понижению антивирусной активности соединений.
Соединения 108, 109 и 110, содержащие соответственно 2-(1-фенилэтокси)этильный, 2-(дифенилметокси)этильный и 2-(фенил-м-Сl-фенилметокси)этильный заместители, также проявили заметную активность в отношении ВИЧ-1 в культурах клеток СЕМ и МТ-4 (ЕС50 0,4-1,1  г/мл, СС50 53-191 г/мл, СС50 53-191  г/мл). Таким образом, некоторые из синтезированных соединений продемонстрировали выраженную способность ингибировать цитопатический эффект ВИЧ-1 в клеточных культурах в наномолярных концентрациях и имели индекс селективности (СС50/ЕС50) в пределах от 200 до 750, в зависимости от природы клеточной линии, включенной в исследование.
Из изучения закономерности структура – противовирусная активность следует, что у полученных пуриновых производных однозначной корреляции между активностью против ВИЧ-1 и против ЦМВ нет. Некоторые соединения, которые показали мощную активность в отношении ВИЧ-1, были неактивными против ВИЧ-2 (данные не приводятся). У отдельных высокоактивных ингибиторов ЦМВ отсутствует какая-либо анти-ВИЧ активность (например, у соединений 30, 36, 37, 105). Другие соединения этого же химического ряда были заметно активны против обоих вирусов (например, соединения 61, 67, 68, 72, 76). Это в целом отличает синтезированный новый класс пуриновых производных от известных ненуклеозидных ингибиторов обратной транскриптазы ВИЧ. Вероятно, некоторые из полученных производных 9-замещенного аденина имеют новый механизм противовирусного действия.
Таким образом, открыт новый класс противовирусных агентов ненуклеозидной природы, которые проявляют выраженную активность в отношении ВИЧ-1 и ЦМВ in vitro и по эффективности анти-ЦМВ действия в десятки и сотни раз превосходят использующиеся в клинике современные лекарственные средства. Наличие у одних и тех же соединений одновременно высокой анти-ВИЧ-1 и анти-ЦМВ активности позволяет считать их перспективными для комплексного лечения СПИД и оппортунистических цитомегаловирусных инфекций. г/мл). Таким образом, некоторые из синтезированных соединений продемонстрировали выраженную способность ингибировать цитопатический эффект ВИЧ-1 в клеточных культурах в наномолярных концентрациях и имели индекс селективности (СС50/ЕС50) в пределах от 200 до 750, в зависимости от природы клеточной линии, включенной в исследование.
Из изучения закономерности структура – противовирусная активность следует, что у полученных пуриновых производных однозначной корреляции между активностью против ВИЧ-1 и против ЦМВ нет. Некоторые соединения, которые показали мощную активность в отношении ВИЧ-1, были неактивными против ВИЧ-2 (данные не приводятся). У отдельных высокоактивных ингибиторов ЦМВ отсутствует какая-либо анти-ВИЧ активность (например, у соединений 30, 36, 37, 105). Другие соединения этого же химического ряда были заметно активны против обоих вирусов (например, соединения 61, 67, 68, 72, 76). Это в целом отличает синтезированный новый класс пуриновых производных от известных ненуклеозидных ингибиторов обратной транскриптазы ВИЧ. Вероятно, некоторые из полученных производных 9-замещенного аденина имеют новый механизм противовирусного действия.
Таким образом, открыт новый класс противовирусных агентов ненуклеозидной природы, которые проявляют выраженную активность в отношении ВИЧ-1 и ЦМВ in vitro и по эффективности анти-ЦМВ действия в десятки и сотни раз превосходят использующиеся в клинике современные лекарственные средства. Наличие у одних и тех же соединений одновременно высокой анти-ВИЧ-1 и анти-ЦМВ активности позволяет считать их перспективными для комплексного лечения СПИД и оппортунистических цитомегаловирусных инфекций.
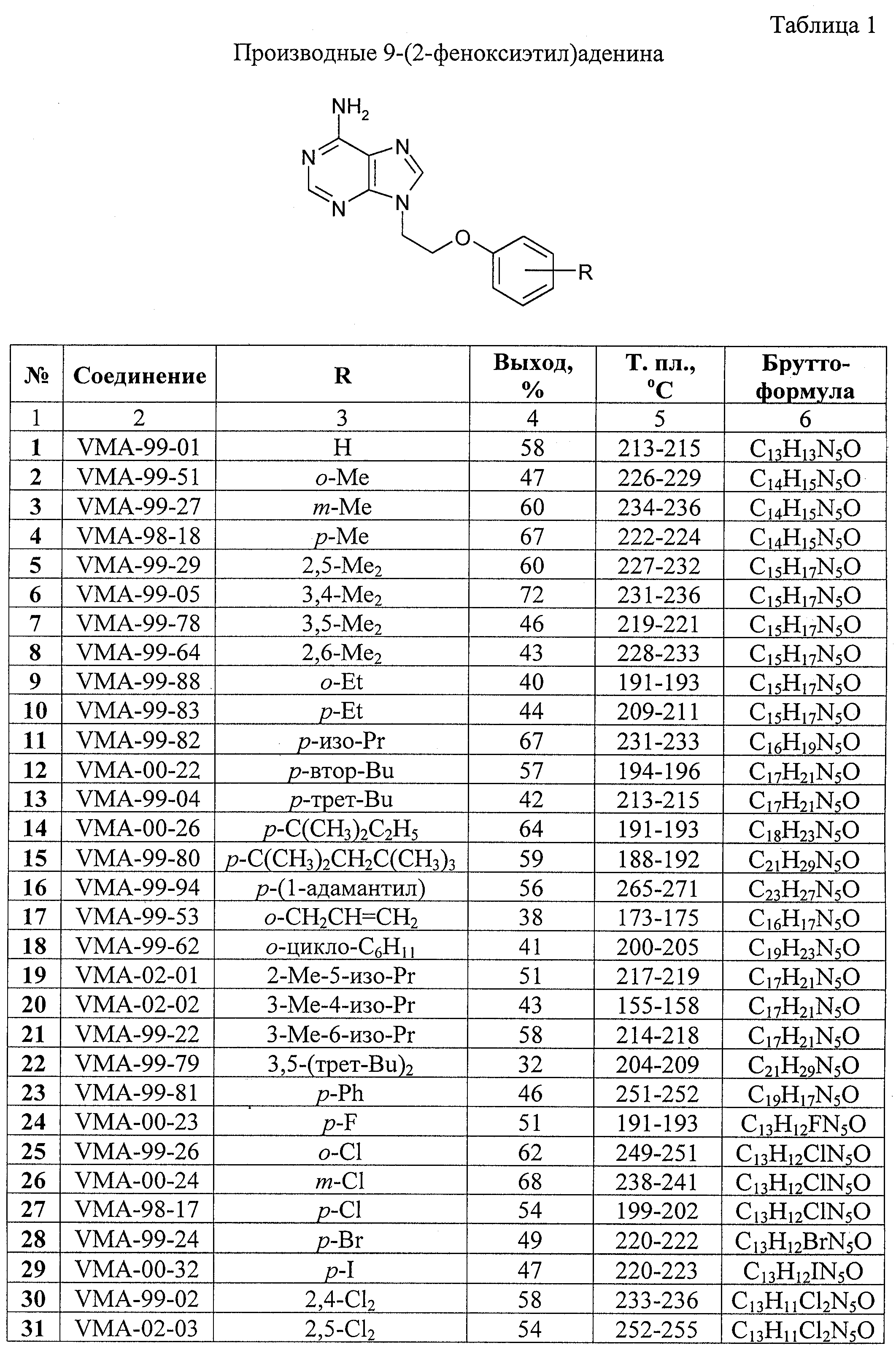       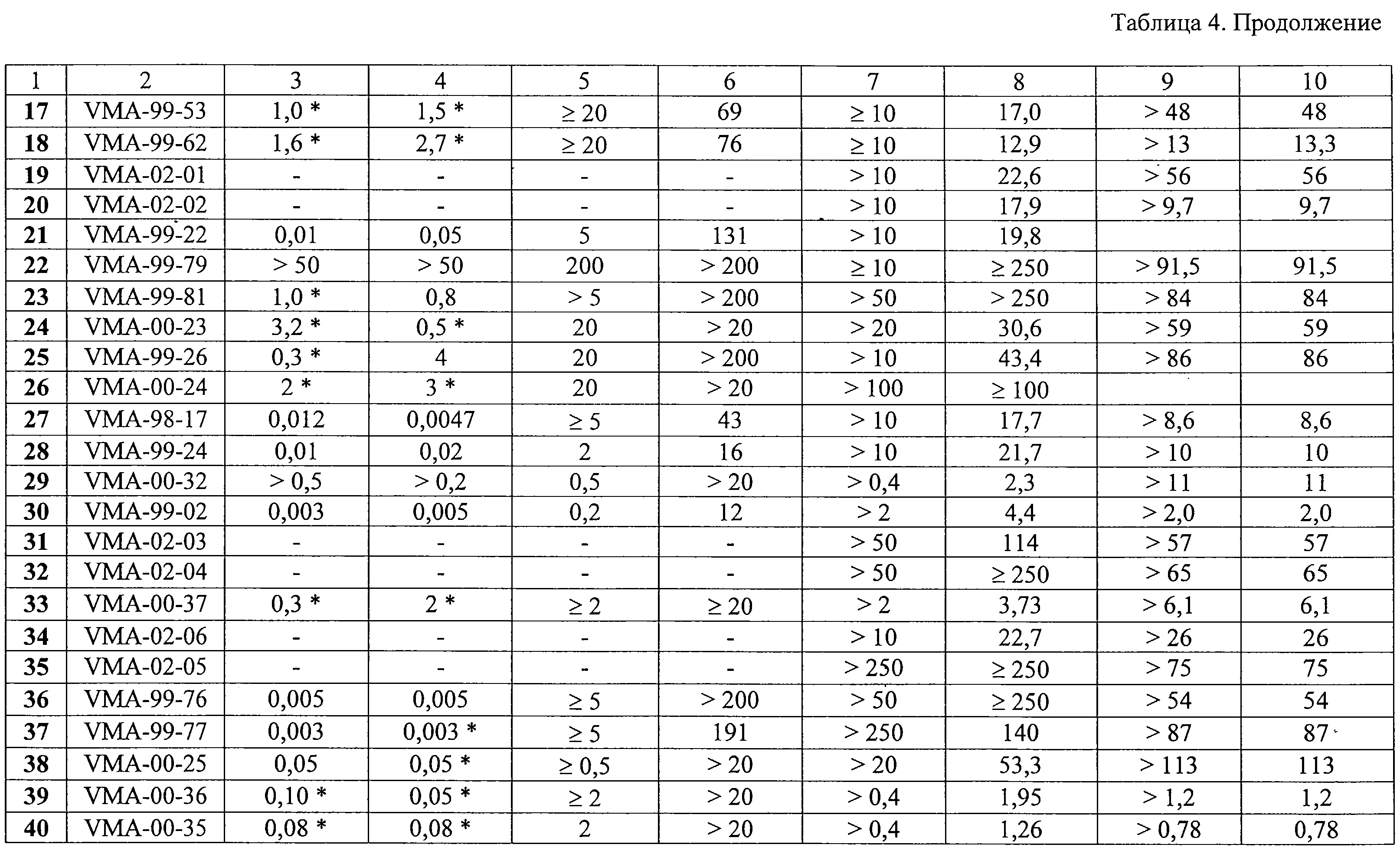 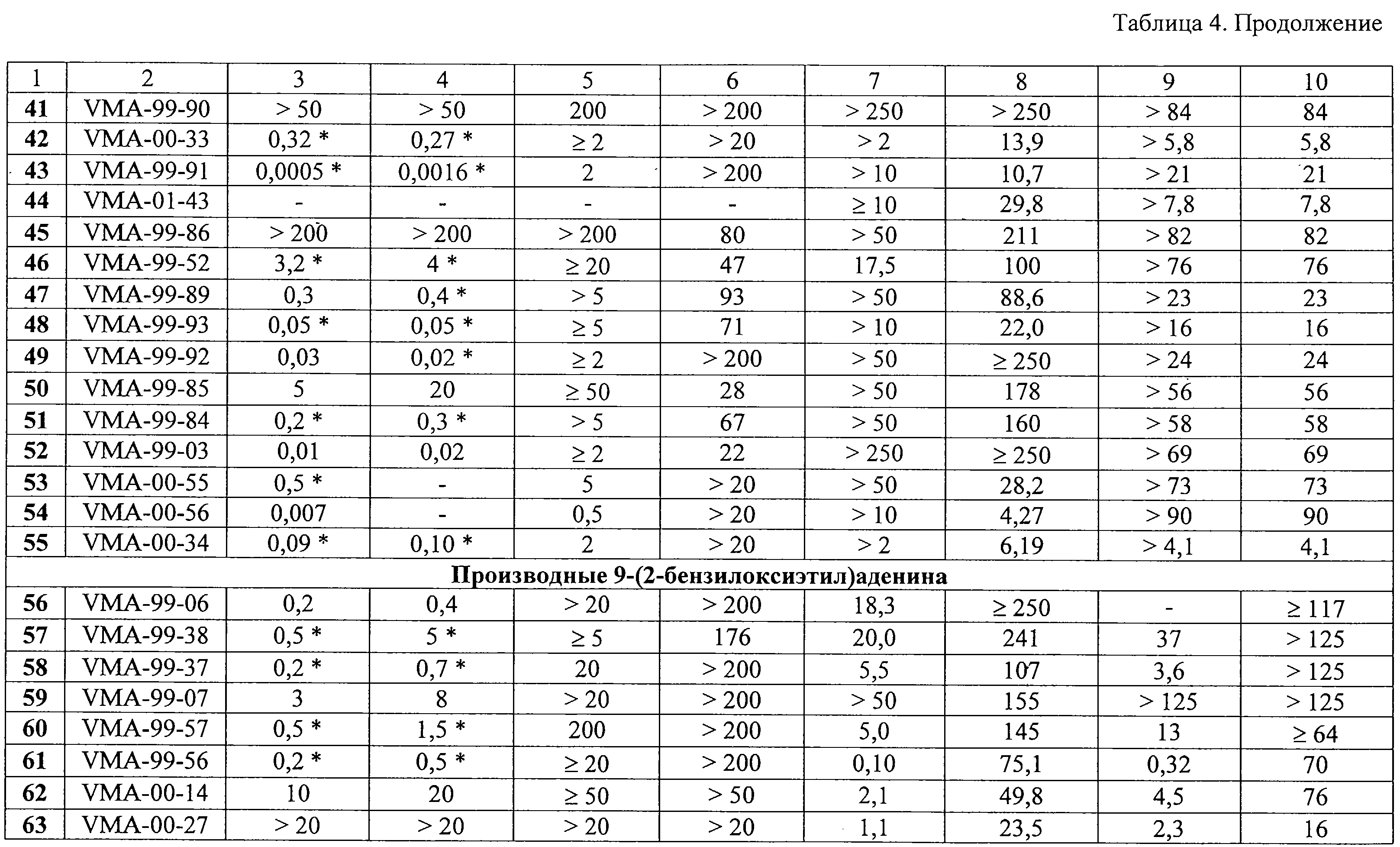    
Формула изобретения Производные пурина общей формулы 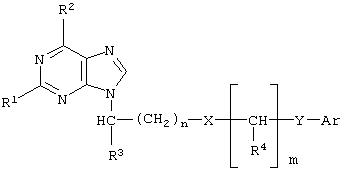 где n = 0 – 4;
m = 0 – 3;
R1 = Н, ОН или NH2;
R2 = ОН, NH2, ацетиламино или бензоиламино;
R3 = Н или низший алкил C1–С4;
R4 = Н, низший алкил C1-С4 или фенил;
Х = СН2, О, S, NH или С(O)O;
Y = СН2, СН=СН, С(O), О или ординарная связь;
Ar = фенил, пиридил, нафтил или замещенный фенил формулы
где n = 0 – 4;
m = 0 – 3;
R1 = Н, ОН или NH2;
R2 = ОН, NH2, ацетиламино или бензоиламино;
R3 = Н или низший алкил C1–С4;
R4 = Н, низший алкил C1-С4 или фенил;
Х = СН2, О, S, NH или С(O)O;
Y = СН2, СН=СН, С(O), О или ординарная связь;
Ar = фенил, пиридил, нафтил или замещенный фенил формулы
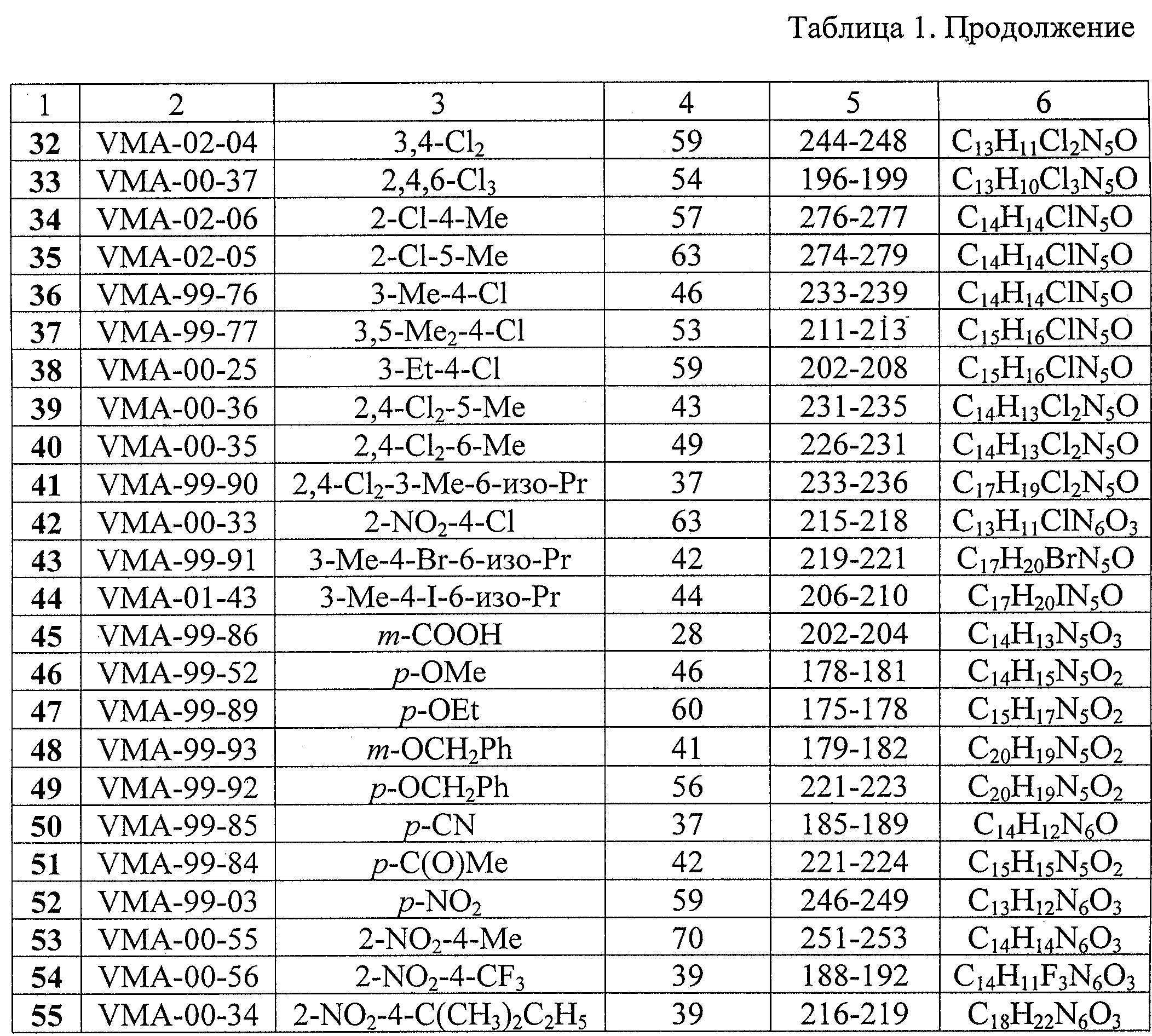
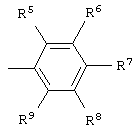 где независимо R5–R9 = алкил С1–C8, циклоалкил C5–С6, 1-адамантил, аллил, фенил, бензил, F, CI, Br, J, трифторметил, алкокси C1–С5, фенокси, бензилокси, бензоилокси, циано, карбокси, ацетил или нитро, обладающие противовирусной активностью.
где независимо R5–R9 = алкил С1–C8, циклоалкил C5–С6, 1-адамантил, аллил, фенил, бензил, F, CI, Br, J, трифторметил, алкокси C1–С5, фенокси, бензилокси, бензоилокси, циано, карбокси, ацетил или нитро, обладающие противовирусной активностью.
|
||||||||||||||||||||||||||
