Патент на изобретение №2232995
|
||||||||||||||||||||||||||
(54) СПОСОБ ОПРЕДЕЛЕНИЯ ЦЕЛЕСООБРАЗНОСТИ НАЗНАЧЕНИЯ ЭМОКСИПИНА БОЛЬНЫМ РОЖЕЙ
(57) Реферат: Изобретение относится к медицине, а именно к инфекционным болезням, и предназначено для определения целесообразности назначения эмоксипина при лечении рожи. У больных рожей в первые три дня болезни до начала лечения забирают венозную кровь для биохимического исследования показателей оксидантно-антиоксидантной системы и определяют в ее плазме содержание гидроперекисей липидов (ГПЛ) и супероксиддисмутазы (СОД), а в сыворотке – общую пероксидазную активность (ОПА), концентрацию малонового диальдегида (МДА) и активность каталазы (К), затем рассчитывают величину оксидантно-антиоксидантного коэффициента (ОАК) по формуле 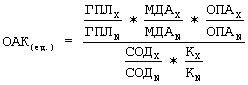 (где ГПЛх, МДАх, ОПАх, СОДх, Кх – значения исследованных биохимических показателей у больных, а ГПЛN, МДАN, СОДN, КN – у здоровых людей). При величине ОАК 2,1 ед. и выше прогнозируется благоприятный эффект от лечения с применением эмоксипина. Способ обеспечивает определение эффективности терапии эмоксипином больных рожей. 1 табл.
Изобретение относится к медицине, а именно инфекционным болезням, и может быть использовано при лечении больных рожей.
Рожа, вызываемая, как известно,
(где ГПЛх, МДАх, ОПАх, СОДх, Кх – значения исследованных биохимических показателей у больных, а ГПЛN, МДАN, СОДN, КN – у здоровых людей). При величине ОАК 2,1 ед. и выше прогнозируется благоприятный эффект от лечения с применением эмоксипина. Способ обеспечивает определение эффективности терапии эмоксипином больных рожей. 1 табл.
Изобретение относится к медицине, а именно инфекционным болезням, и может быть использовано при лечении больных рожей.
Рожа, вызываемая, как известно,  Если диагностика рожи не вызывает особых затруднений, поскольку базируется в подавляющем большинстве случаев на выявлении достаточно характерных клинических симптомов, то применяющееся в настоящее время лечение разработано совершенно недостаточно.
Однако последующий опыт применения эмоксипина у больных рожей показал, что при введении этого препарата не у всех больных удается добиться желаемого клинического эффекта. Более того, в ряде случаев вероятность рецидивов заболевания даже увеличивается.
В связи с этим в ходе обследования пациента с рожей возникает необходимость в каждом конкретном случае решать вопрос о целесообразности и возможной эффективности патогенетической терапии с применением эмоксипина. Подобного способа в научной и патентной литературе нам обнаружить не удалось.
Наиболее близким по технической сущности, который мы выбрали в качестве прототипа, является способ определения показаний к применению эмоксипина при лечении токсической дифтерии (патент РФ №2137128 (Амбалов Ю.М., Пополитова С.Б., 1999.). К сожалению, данный способ при всех своих достоинствах не может быть применен у больных рожей, поскольку разработан применительно совершенно к другому заболеванию – дифтерии.
Цель настоящего изобретения – определение целесообразности назначения эмоксипина больным рожей.
Определение концентрации ГПЛ в плазме крови осуществляют путем измерения ультрафиолетового поглощения липидных экстрактов крови. Принцип метода основан на интенсивном поглощении коньюгированных диеновых структур ГПЛ в области 232-234 нм. Результаты измерения выражают в относительных единицах величины оптической плотности на 1 мл крови (AD233 на 1 мл крови). К 0,2 мл плазмы добавляют 4,0 мл смеси гептанизопропанол (1:1) и встряхивают 10-15 мин. Далее в пробирку добавляют 1 мл р-ра НСЕ с рН 2,0 и 2,0 мл гептана, интенсивно встряхивают и после отстаивания и расслоения смеси через 20-30 мин отбирают гептановый слой, в котором измеряют D233. Расчет содержания ГПЛ проводят в относительных единицах по формуле
Если диагностика рожи не вызывает особых затруднений, поскольку базируется в подавляющем большинстве случаев на выявлении достаточно характерных клинических симптомов, то применяющееся в настоящее время лечение разработано совершенно недостаточно.
Однако последующий опыт применения эмоксипина у больных рожей показал, что при введении этого препарата не у всех больных удается добиться желаемого клинического эффекта. Более того, в ряде случаев вероятность рецидивов заболевания даже увеличивается.
В связи с этим в ходе обследования пациента с рожей возникает необходимость в каждом конкретном случае решать вопрос о целесообразности и возможной эффективности патогенетической терапии с применением эмоксипина. Подобного способа в научной и патентной литературе нам обнаружить не удалось.
Наиболее близким по технической сущности, который мы выбрали в качестве прототипа, является способ определения показаний к применению эмоксипина при лечении токсической дифтерии (патент РФ №2137128 (Амбалов Ю.М., Пополитова С.Б., 1999.). К сожалению, данный способ при всех своих достоинствах не может быть применен у больных рожей, поскольку разработан применительно совершенно к другому заболеванию – дифтерии.
Цель настоящего изобретения – определение целесообразности назначения эмоксипина больным рожей.
Определение концентрации ГПЛ в плазме крови осуществляют путем измерения ультрафиолетового поглощения липидных экстрактов крови. Принцип метода основан на интенсивном поглощении коньюгированных диеновых структур ГПЛ в области 232-234 нм. Результаты измерения выражают в относительных единицах величины оптической плотности на 1 мл крови (AD233 на 1 мл крови). К 0,2 мл плазмы добавляют 4,0 мл смеси гептанизопропанол (1:1) и встряхивают 10-15 мин. Далее в пробирку добавляют 1 мл р-ра НСЕ с рН 2,0 и 2,0 мл гептана, интенсивно встряхивают и после отстаивания и расслоения смеси через 20-30 мин отбирают гептановый слой, в котором измеряют D233. Расчет содержания ГПЛ проводят в относительных единицах по формуле
 D233 на 1 мл плазмы = (D233*Vэ)/Vп=20*D233,
где D233 – измеренное значение оптической плотности;
Vэ=4 мл – конечный объем гептанового экстракта;
VП=0,2 мл – объем взятой плазмы крови;
* – знак умножения.
Определение активности СОД проводят следующим образом. К 1,0 мл плазмы добавляют 0,6 мл этилового спирта и 0,3 мл хлороформа и 600 мг кристаллического КН2РО4. Вещества, мешающие определению активности СОД, осаждают при перемешивании р-ра стеклянной палочкой с последующим центрифугированием при 12000 g и температуре 4 D233 на 1 мл плазмы = (D233*Vэ)/Vп=20*D233,
где D233 – измеренное значение оптической плотности;
Vэ=4 мл – конечный объем гептанового экстракта;
VП=0,2 мл – объем взятой плазмы крови;
* – знак умножения.
Определение активности СОД проводят следующим образом. К 1,0 мл плазмы добавляют 0,6 мл этилового спирта и 0,3 мл хлороформа и 600 мг кристаллического КН2РО4. Вещества, мешающие определению активности СОД, осаждают при перемешивании р-ра стеклянной палочкой с последующим центрифугированием при 12000 g и температуре 4 С. Каждая процедура выполняется в течение 15 мин. Надосадочная жидкость, в которой определяется активность фермента, должна быть прозрачной и бесцветной. Об активности СОД в надосадочной жидкости судят по степени ингибирования восстановления нитросинего тетразолия в присутствии НАД-Н и феназинметасульфата. В состав инкубационной смеси входят 1 мкМ феназинметасульфата, 0,1 мл 1 мМ НАД-Н, НАД-Н растворяли в 1 М трис-ЭДТА рН 8,0. Супернатант добавляют в инкубационную смесь в количестве 0,3 мл, что вызывает торможение восстановления нитросинего тетразолия от 30 до 70%.
Общий объем инкубационной смеси доводят до 3 мл фосфатным буфером (0,15 М), рН 7,8. В контрольных пробах содержатся те же компоненты реакционной смеси за исключением препарата фермента. Реакцию запускают добавлением 0,1 мл 1 мм НАД-Н в опытные и контрольные пробы. Инкубацию осуществляют за 10 мин в темноте при комнатной температуре (20-22 С. Каждая процедура выполняется в течение 15 мин. Надосадочная жидкость, в которой определяется активность фермента, должна быть прозрачной и бесцветной. Об активности СОД в надосадочной жидкости судят по степени ингибирования восстановления нитросинего тетразолия в присутствии НАД-Н и феназинметасульфата. В состав инкубационной смеси входят 1 мкМ феназинметасульфата, 0,1 мл 1 мМ НАД-Н, НАД-Н растворяли в 1 М трис-ЭДТА рН 8,0. Супернатант добавляют в инкубационную смесь в количестве 0,3 мл, что вызывает торможение восстановления нитросинего тетразолия от 30 до 70%.
Общий объем инкубационной смеси доводят до 3 мл фосфатным буфером (0,15 М), рН 7,8. В контрольных пробах содержатся те же компоненты реакционной смеси за исключением препарата фермента. Реакцию запускают добавлением 0,1 мл 1 мм НАД-Н в опытные и контрольные пробы. Инкубацию осуществляют за 10 мин в темноте при комнатной температуре (20-22 С) в аэробных условиях. Через 10 мин измеряют величину оптической плотности исследуемых проб на спектрофотометре СФ-16 при длине волны 540 нм против смеси, содержащей все компоненты, кроме НАД-Н.
Для расчета активности СОД вначале определяют процент торможения реакции восстановления нитросинего тетразолия в опытной пробе за 1 мин (Т%). Принято считать, что 50% ингибирования этой реакции соответствует одной условной единицы активности СОД. По формуле
А=Т%/(100%-Т%)
рассчитывают величину активности фермента, внесенного в кюветку (в условных единицах). Активность выражают в условных единицах, рассчитанных на 1 мл исследуемой плазмы.
Определение в сыворотке крови содержания МДА осуществляют следующим образом. К 0,5 мл сыворотки доливают 2,5 мл 20% трихлоруксусной кислоты (ТХУ). Смесь выдерживают при комнатной температуре в течение 10 мин и центрифугируют еще 10 мин при 3500 об/мин. Осадок промывают 2,0 мл 5% р-ра H2SО4 и снова центрифугируют 10 мин при 3000 об/мин. К осадку добавляют 2,5 мл 5% р-ра H2S04 и 3,0 мл 0,2% р-ра тиобарбитуровой кислоты, приготовленного на насыщенном (0,2 М) р-ре Н2SO4, и ставят пробирку на 30 мин на водяную баню (100 С) в аэробных условиях. Через 10 мин измеряют величину оптической плотности исследуемых проб на спектрофотометре СФ-16 при длине волны 540 нм против смеси, содержащей все компоненты, кроме НАД-Н.
Для расчета активности СОД вначале определяют процент торможения реакции восстановления нитросинего тетразолия в опытной пробе за 1 мин (Т%). Принято считать, что 50% ингибирования этой реакции соответствует одной условной единицы активности СОД. По формуле
А=Т%/(100%-Т%)
рассчитывают величину активности фермента, внесенного в кюветку (в условных единицах). Активность выражают в условных единицах, рассчитанных на 1 мл исследуемой плазмы.
Определение в сыворотке крови содержания МДА осуществляют следующим образом. К 0,5 мл сыворотки доливают 2,5 мл 20% трихлоруксусной кислоты (ТХУ). Смесь выдерживают при комнатной температуре в течение 10 мин и центрифугируют еще 10 мин при 3500 об/мин. Осадок промывают 2,0 мл 5% р-ра H2SО4 и снова центрифугируют 10 мин при 3000 об/мин. К осадку добавляют 2,5 мл 5% р-ра H2S04 и 3,0 мл 0,2% р-ра тиобарбитуровой кислоты, приготовленного на насыщенном (0,2 М) р-ре Н2SO4, и ставят пробирку на 30 мин на водяную баню (100 С), после чего охлаждают и приливают 4,0 мл бутанола, встряхивают и фракцию опытной пробы смотрят на спектрофотометре СФ-26 при длине волны С), после чего охлаждают и приливают 4,0 мл бутанола, встряхивают и фракцию опытной пробы смотрят на спектрофотометре СФ-26 при длине волны  =530 нМ против контрольной бутаноловой фракции. Расчет содержания МДА проводят по формуле
С=(V*Еэкст)/(I*d* =530 нМ против контрольной бутаноловой фракции. Расчет содержания МДА проводят по формуле
С=(V*Еэкст)/(I*d* ),
где С – содержание МДА в нмоль/мл сыворотки;
V – объем пробы (мл);
Eэкст – показатель экстинции на приборе;
I – длина кюветы;
d – удельная плотность вещества; ),
где С – содержание МДА в нмоль/мл сыворотки;
V – объем пробы (мл);
Eэкст – показатель экстинции на приборе;
I – длина кюветы;
d – удельная плотность вещества;
 – молярный коэффициент.
Активность каталазы определяют спектрофотометрически. Принцип метода основан на способности перекиси водорода образовывать с солями молибдена стойкий окрашенный комплекс. К 1,0 мл три-НСЕ-буфера, 0,05 М, рН 7,8 и 2,0 мл 0,03% р-ра перекиси водорода добавляют 0,1 мл сыворотки крови. В холостую пробу вместо сыворотки вносят 0,1 мл дистиллированной воды. Спустя 10 мин к полученной смеси добавляют 1,0 мл 4% молибдата аммония. Интенсивность развившейся окраски измеряют на спектрофотометре при длине волны 410 нм против контрольной пробы, в которую вместо Н2O2 вносят 2,0 мл Н2О.
Активность сывороточной каталазы рассчитывают по формуле
E=(Axoл-Aоп)* V*t*K (мкат/л),
где Е – активность сывороточной каталазы (мкат/л);
Ахол и Аоп – экстинция холостой и опытной проб;
V – объем вносимой пробы 0,1 мл;
t – время инкубации 600 с;
К – коэффициент миллимолярной экстинции H2O2, равный 22,2*103 мM-1*см-1.
* – знак умножения.
Определение общей пероксидазной активности осуществляют также с помощью спектрофотометра. Принцип метода: пероксидаза окисляет в присутствии Н2О2 бензидин, причем появляется синее окрашивание, которое подвергается количественному колориметрическому определению.
К 2,5 мл комплексного реактива добавляют 0,01 мл сыворотки крови и спустя 10 мин спектрофотометрируют против комплексного реактива при длине волны – молярный коэффициент.
Активность каталазы определяют спектрофотометрически. Принцип метода основан на способности перекиси водорода образовывать с солями молибдена стойкий окрашенный комплекс. К 1,0 мл три-НСЕ-буфера, 0,05 М, рН 7,8 и 2,0 мл 0,03% р-ра перекиси водорода добавляют 0,1 мл сыворотки крови. В холостую пробу вместо сыворотки вносят 0,1 мл дистиллированной воды. Спустя 10 мин к полученной смеси добавляют 1,0 мл 4% молибдата аммония. Интенсивность развившейся окраски измеряют на спектрофотометре при длине волны 410 нм против контрольной пробы, в которую вместо Н2O2 вносят 2,0 мл Н2О.
Активность сывороточной каталазы рассчитывают по формуле
E=(Axoл-Aоп)* V*t*K (мкат/л),
где Е – активность сывороточной каталазы (мкат/л);
Ахол и Аоп – экстинция холостой и опытной проб;
V – объем вносимой пробы 0,1 мл;
t – время инкубации 600 с;
К – коэффициент миллимолярной экстинции H2O2, равный 22,2*103 мM-1*см-1.
* – знак умножения.
Определение общей пероксидазной активности осуществляют также с помощью спектрофотометра. Принцип метода: пероксидаза окисляет в присутствии Н2О2 бензидин, причем появляется синее окрашивание, которое подвергается количественному колориметрическому определению.
К 2,5 мл комплексного реактива добавляют 0,01 мл сыворотки крови и спустя 10 мин спектрофотометрируют против комплексного реактива при длине волны  =602 нМ.
Комплексный реактив готовят следующим образом: 16 г ацетата натрия растворяют в 100 мл 7%-ного р-ра уксусной кислоты. Далее раствор насыщают трилоном Б (ЭДТА) в количестве 1 г. Взбалтывают, затем фильтруют. Фильтрат насыщают бензидином хлоргидратом или сернокислотным бензидином в количестве 1,0 г. Затем в течение 10 мин взбалтывают в колбе и снова фильтруют. К фильтрату прибавляют 30% 0,1 мл Н2О2 (последнюю прибавляют непосредственно перед добавлением комплексного реактива к сыворотке). Общую пероксидазную активность выражают в единицах оптической плотности на 1 мл сыворотки. =602 нМ.
Комплексный реактив готовят следующим образом: 16 г ацетата натрия растворяют в 100 мл 7%-ного р-ра уксусной кислоты. Далее раствор насыщают трилоном Б (ЭДТА) в количестве 1 г. Взбалтывают, затем фильтруют. Фильтрат насыщают бензидином хлоргидратом или сернокислотным бензидином в количестве 1,0 г. Затем в течение 10 мин взбалтывают в колбе и снова фильтруют. К фильтрату прибавляют 30% 0,1 мл Н2О2 (последнюю прибавляют непосредственно перед добавлением комплексного реактива к сыворотке). Общую пероксидазную активность выражают в единицах оптической плотности на 1 мл сыворотки.
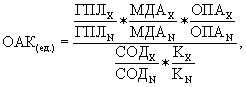 где ГПЛх, МДАх, ОПАх, СОДх, Кх – значения исследованных показателей у больного;
ГПЛN, МДАN, ОПАN, СОДN, KN – значения тех же показателей у здоровых людей (нормальная величина OAK соответствует 1,0 у.е.);
* – знак умножения.
Выявление у больного рожей в первые три дня от начала заболевания до начала лечения величины OAK более 2,1 ед. позволяет прогнозировать благоприятный клинический эффект от проведения лечения с применением эмоксипина.
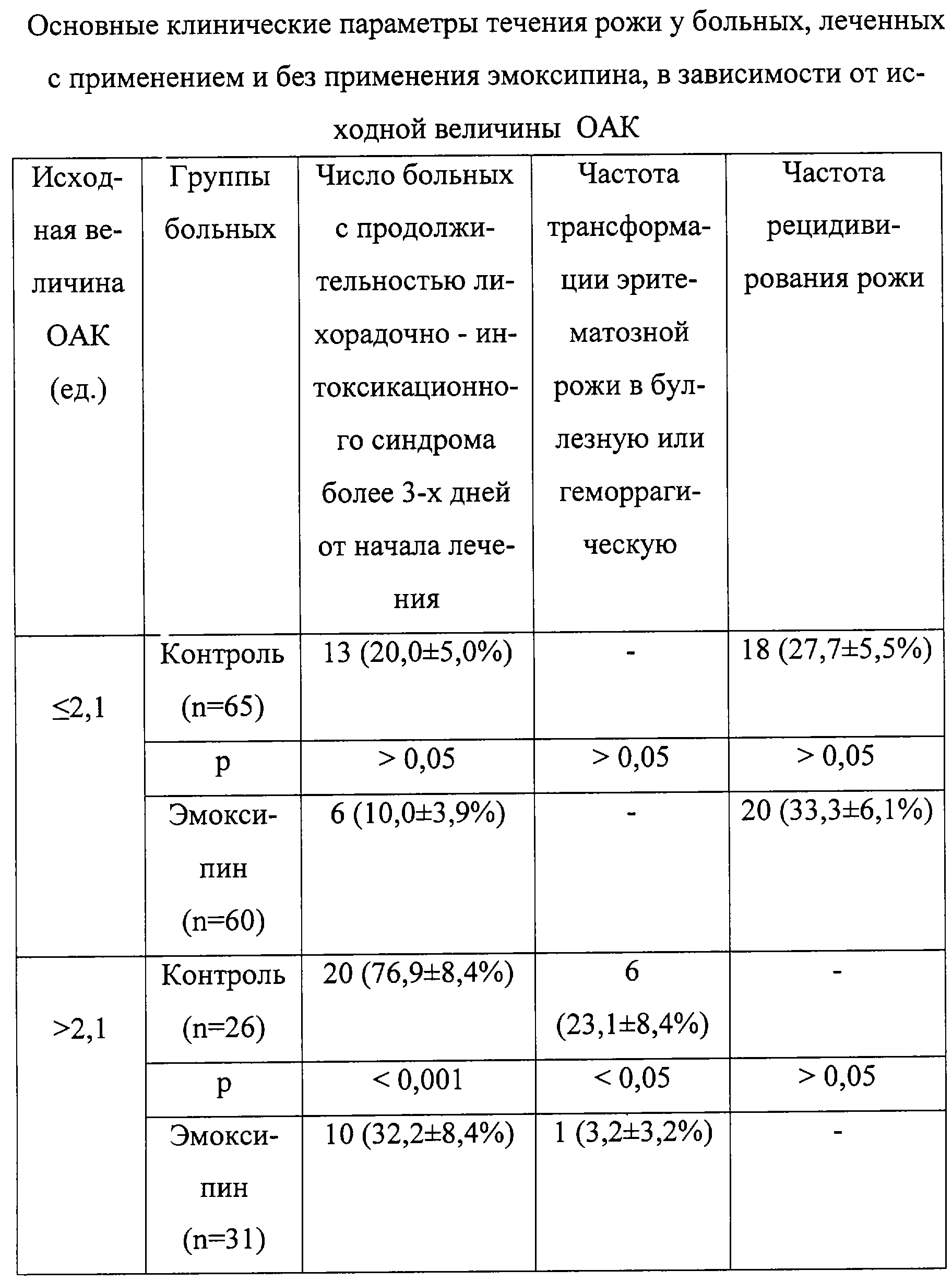
Клиническая апробация предлагаемого способа была проведена в 5-м инфекционном отделении ГБ №1 г. Ростова-на-Дону, являющемся базой кафедры инфекционных болезней Ростовского государственного медицинского университета. Под наблюдением находилось 182 больных рожей, из числа которых 91 получил традиционную этиопатогенетическую терапию, а 91 – дополнительно эмоксипин по 1,0 мл внутримышечно ежедневно в течение 10 дней.
Анализ результатов исследования показателей оксидантно-антиоксидантной системы крови у больных рожей показал (таблица), что, если исходная величина OAK, определяемая у больных рожей в первые три дня заболевания была меньше или равна 2,1 ед., то лечение с назначением эмоксипина не давало каких-либо клинических преимуществ по сравнению со стандартной терапией лиц контрольной группы (таблица). В тех же случаях, когда величина OAK превышала 2,1 ед., эффект от использования эмоксипина был выражен достаточно четко. Об этом свидетельствует более чем двукратное снижение числа лиц с длительно (более 3-х дней) сохраняющимся лихорадочно-интоксикационным синдромом, а также значительное снижение частоты перехода эритематозного воспаления кожи в более неблагоприятное – буллезное или геморрагическое. При этом увеличение частоты рецидивирования заболевания не наблюдалось.
Как нам представляется, показатель OAK, равный или превышающий 2,1 ед., свидетельствует о выраженной активации у больных рожей перекисно-окислительных процессов и одновременном угнетении антиоксидантных систем защиты. Именно в этом случае организм больных рожей становится особенно восприимчив к воздействию эмоксипина, поскольку испытывает максимальную потребность в антиоксидантах. Подтверждением эффективности предложенного способа являются клинические примеры.
Пример 1. Больная К., 57 лет (и.б. 881 – 01), поступила в 5-е инфекционное отделение городской больницы №1 им. Н.А.Семашко г. Ростова-на-Дону на 2-й день болезни с явлениями эритематозно-буллезной рожи. Исходный OAK оказался равным 2,4 у.е., что требовало назначение пациентке помимо антибиотиков эмоксипина. Уже спустя 7 ч после введения препарата состояние больной значительно улучшилось. Температура тела критически упала с 38,4 до 36,1
где ГПЛх, МДАх, ОПАх, СОДх, Кх – значения исследованных показателей у больного;
ГПЛN, МДАN, ОПАN, СОДN, KN – значения тех же показателей у здоровых людей (нормальная величина OAK соответствует 1,0 у.е.);
* – знак умножения.
Выявление у больного рожей в первые три дня от начала заболевания до начала лечения величины OAK более 2,1 ед. позволяет прогнозировать благоприятный клинический эффект от проведения лечения с применением эмоксипина.
Клиническая апробация предлагаемого способа была проведена в 5-м инфекционном отделении ГБ №1 г. Ростова-на-Дону, являющемся базой кафедры инфекционных болезней Ростовского государственного медицинского университета. Под наблюдением находилось 182 больных рожей, из числа которых 91 получил традиционную этиопатогенетическую терапию, а 91 – дополнительно эмоксипин по 1,0 мл внутримышечно ежедневно в течение 10 дней.
Анализ результатов исследования показателей оксидантно-антиоксидантной системы крови у больных рожей показал (таблица), что, если исходная величина OAK, определяемая у больных рожей в первые три дня заболевания была меньше или равна 2,1 ед., то лечение с назначением эмоксипина не давало каких-либо клинических преимуществ по сравнению со стандартной терапией лиц контрольной группы (таблица). В тех же случаях, когда величина OAK превышала 2,1 ед., эффект от использования эмоксипина был выражен достаточно четко. Об этом свидетельствует более чем двукратное снижение числа лиц с длительно (более 3-х дней) сохраняющимся лихорадочно-интоксикационным синдромом, а также значительное снижение частоты перехода эритематозного воспаления кожи в более неблагоприятное – буллезное или геморрагическое. При этом увеличение частоты рецидивирования заболевания не наблюдалось.
Как нам представляется, показатель OAK, равный или превышающий 2,1 ед., свидетельствует о выраженной активации у больных рожей перекисно-окислительных процессов и одновременном угнетении антиоксидантных систем защиты. Именно в этом случае организм больных рожей становится особенно восприимчив к воздействию эмоксипина, поскольку испытывает максимальную потребность в антиоксидантах. Подтверждением эффективности предложенного способа являются клинические примеры.
Пример 1. Больная К., 57 лет (и.б. 881 – 01), поступила в 5-е инфекционное отделение городской больницы №1 им. Н.А.Семашко г. Ростова-на-Дону на 2-й день болезни с явлениями эритематозно-буллезной рожи. Исходный OAK оказался равным 2,4 у.е., что требовало назначение пациентке помимо антибиотиков эмоксипина. Уже спустя 7 ч после введения препарата состояние больной значительно улучшилось. Температура тела критически упала с 38,4 до 36,1 С, практически исчезли симптомы интоксикации. Еще через сутки стал быстро инволюционировать местный воспалительный процесс кожи. Трансформации рожистого воспаления в геморрагическую фору не произошло. В течение всего срока наблюдения (после выписки из стационара) рецидивов заболевания зарегистрировано не было. Это свидетельствует о правильном определении показаний к назначению данной больной эмоксипина.
Пример 2. Больная М., 49 лет (и.б. №1021 – 01), поступила в то же отделение на 3-й день болезни с диагнозом: “Первичная эритематозная рожа правого бедра и голени”. Заболевание проявлялось, помимо воспалительных изменений на коже, гипертермией до 40,1 С, практически исчезли симптомы интоксикации. Еще через сутки стал быстро инволюционировать местный воспалительный процесс кожи. Трансформации рожистого воспаления в геморрагическую фору не произошло. В течение всего срока наблюдения (после выписки из стационара) рецидивов заболевания зарегистрировано не было. Это свидетельствует о правильном определении показаний к назначению данной больной эмоксипина.
Пример 2. Больная М., 49 лет (и.б. №1021 – 01), поступила в то же отделение на 3-й день болезни с диагнозом: “Первичная эритематозная рожа правого бедра и голени”. Заболевание проявлялось, помимо воспалительных изменений на коже, гипертермией до 40,1 С и выраженными симптомами интоксикации. Исходная величина OAK оказалась равной 1,6 ед., поэтому показаний для назначения эмоксипина не было. Тем не менее, лечащим врачом наряду с антибиотиком (линкомицином) был назначен и эмоксипин. Уже спустя сутки температура тела снизилась до нормальных цифр, общее состояние стало улучшаться. Эритематозные явления на коже пошли на убыль, однако сравнительно медленно. Даже спустя 10 дней с момента поступления в стационар сохранялись умеренные гиперемия и болезненность кожи пораженной конечности. По категорическому настоянию родственников больная была выписана из стационара. Но спустя 1,5 месяца вновь повысилась температура тела, и на той же конечности появились краснота, отечность и болезненность кожи, что позволило квалифицировать у пациентки рецидив рожистого воспаления. Это свидетельствовало об отсутствии полноценного эффекта от лечения с применением эмоксипина, что и прогнозировалось на начальных этапах заболевания, когда больная поступила в стационар. С и выраженными симптомами интоксикации. Исходная величина OAK оказалась равной 1,6 ед., поэтому показаний для назначения эмоксипина не было. Тем не менее, лечащим врачом наряду с антибиотиком (линкомицином) был назначен и эмоксипин. Уже спустя сутки температура тела снизилась до нормальных цифр, общее состояние стало улучшаться. Эритематозные явления на коже пошли на убыль, однако сравнительно медленно. Даже спустя 10 дней с момента поступления в стационар сохранялись умеренные гиперемия и болезненность кожи пораженной конечности. По категорическому настоянию родственников больная была выписана из стационара. Но спустя 1,5 месяца вновь повысилась температура тела, и на той же конечности появились краснота, отечность и болезненность кожи, что позволило квалифицировать у пациентки рецидив рожистого воспаления. Это свидетельствовало об отсутствии полноценного эффекта от лечения с применением эмоксипина, что и прогнозировалось на начальных этапах заболевания, когда больная поступила в стационар.
 Предлагаемый способ обеспечивает целесообразность назначения эмоксипина в комплексном лечении рожи с положительными результатами и предупреждает возникновение различных рецидивов.
Предлагаемый способ обеспечивает целесообразность назначения эмоксипина в комплексном лечении рожи с положительными результатами и предупреждает возникновение различных рецидивов.
Формула изобретения Способ определения целесообразности назначения эмоксипина больным рожей, предусматривающий исследование крови, отличающийся тем, что у больного в первые три дня болезни до начала лечения забирают венозную кровь для биохимического исследования показателей оксидантно-антиоксидантной системы и определяют в ее плазме содержание гидроперекисей липидов (ГПЛ) и супероксиддисмутазы (СОД), а в сыворотке – общую пероксидазную активность (ОПА), концентрацию малонового диальдегида (МДА) и активность каталазы (К), затем рассчитывают величину оксидантно-антиоксидантного коэффициента (OAK) по формуле 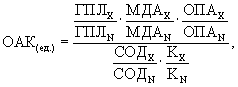 где ГПЛх, МДАх, ОПАх, СОДх, Кх – значения исследованных биохимических показателей у больных;
а ГПЛN, МДАN, ОПАN, СОДN, КN – у здоровых людей,
и при величине OAK 2,1 ед. и выше считают целесообразным назначение эмоксипина наряду с традиционной терапией.
где ГПЛх, МДАх, ОПАх, СОДх, Кх – значения исследованных биохимических показателей у больных;
а ГПЛN, МДАN, ОПАN, СОДN, КN – у здоровых людей,
и при величине OAK 2,1 ед. и выше считают целесообразным назначение эмоксипина наряду с традиционной терапией.
MM4A Досрочное прекращение действия патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 01.11.2005
Извещение опубликовано: 20.10.2006 БИ: 29/2006
|
||||||||||||||||||||||||||
