Патент на изобретение №2232772
|
||||||||||||||||||||||||||
(54) МОДИФИЦИРОВАННЫЙ КОЛОНИЕСТИМУЛИРУЮЩИЙ ФАКТОР ГРАНУЛОЦИТОВ ЧЕЛОВЕКА И СПОСОБ ЕГО ПОЛУЧЕНИЯ, ДНК, ЭКСПРЕССИРУЮЩИЙ ВЕКТОР
(57) Реферат: Изобретение относится к биотехнологии, в частности генной инженерии, и может быть использовано для получения секретируемого модифицированного колониестимулирующего фактора гранулоцитов человека (hG-CSF). Модифицированный hG-CSF получают путем замены в аминокислотной последовательности hG-CSF дикого типа 1-ой аминокислоты на Ser или 1-ой и 17-ой – на Ser, 2-ой аминокислоты на Met и 3-ей на Val, или 2-ой на Met, 3-ей на Val и 17-ой на Ser, или 17-ой на Thr. Клетки микроорганизма, трансформированные вектором, содержащим ДНК, кодирующую модифицированный hG-CSF, культивируют с получением и секрецией в периплазму hG-CSF. Изобретение позволяет эффективно экспрессировать и секретировать в микроорганизме hG-CSF, сохраняющий биологическую активность белка дикого типа. 4 с. и 10 з.п. ф-лы, 11 ил., 1 табл. Область техники Настоящее изобретение относится к модифицированному колониестимулирующему фактору гранулоцитов человека (hG-CSF), гену, кодирующему указанный пептид, вектору, содержащему указанный ген, микроорганизму, трансформированному указанным вектором, и способу получения модифицированного hG-CSF с использованием указанного микроорганизма. Предпосылки изобретения Термин “колониестимулирующий фактор” (CSF) включает колониестимулирующий фактор гранулоцитов/макрофагов (GM-CSF), колониестимулирующий фактор макрофагов (M-CSF) и колониестимулирующий фактор гранулоцитов (G-CSF), продуцируемые Т-клетками, макрофагами, фибробластами и эндотелиальными клетками. GM-CSF стимулирует стволовые клетки гранулоцитов или макрофагов, вызывая их дифференцировку и пролиферацию колоний гранулоцитов или макрофагов. M-CSF и G-CSF индуцируют соответственно образование колоний макрофагов и гранулоцитов. In vivo G-CSF вызывает дифференцировку лейкоцитов костного мозга и усиливает функцию зрелых гранулоцитов и, следовательно, определяет их клиническую значимость при лечении лейкоза. G-CSF человека (hG-CSF) представляет собой белок, состоящий из 174 или 177 аминокислот, причем разновидность, включающая 174 аминокислоты, обладает более высокой активностью, стимулирующей нейтрофилы (Morishita, К. et al., J. Biol. Chem., 262, 15208-15213 (1987)). Аминокислотная последовательность hG-CSF, состоящая из 174 аминокислот, показана на фиг.1. Были выполнены многочисленные исследования по массовому продуцированию hG-CSF при помощи гена, кодирующего указанный hG-CSF. Например, компанией Chugai Pharmaceuticals Co., Ltd (Япония) была представлена аминокислотная последовательность hG-CSF и кодирующий ее ген (корейская патентная публикация №91-5624 и 92-2312) и описан способ получения белков, обладающих активностью hG-CSF, методом генетической рекомбинации (патенты Кореи №47178, 53723 и 57582). В соответствии с описанным способом в клетке млекопитающего продуцируют гликозилированный hG-CSF, используя геномную ДНК или кДНК, содержащую полинуклеотид, кодирующий hG-CSF. Гликозилированный hG-CSF имеет цепь О-гликозидного сахара, но известно, что указанная цепь не нужна для обеспечения активности hG-CSF (Lawrence, M. et al., Science, 232, 61 (1986). Кроме того, хорошо известно, что продуцирование гликозилированного hG-CSF с использованием клеток млекопитающего требует использования дорогостоящих веществ и устройств, поэтому такой способ является неприемлемым с экономической точки зрения. Были предприняты попытки продуцировать негликозилированный hG-CSF, используя микроорганизмы, например Е. coli. В результате выполнения таких исследований получен hG-CSF, содержащий 175 или 178 аминокислот с остатком метионина, присоединенным у N-конца, благодаря использованию в микроорганизме инициирующего кодона ATG. Однако дополнительный остаток метионина вызывает нежелательные иммунные реакции в организме человека при введении рекомбинантного hG-CSF (европейская патентная публикация № 256843). Кроме того, большая часть метионинсодержащего hG-CSF, продуцированного в Е. coli, осаждается в клетках в виде нерастворимых телец включения, которые необходимо превратить в активную форму путем повторной укладки цепи при значительной потере выхода продукта. В этой связи следует отметить, что четыре из пяти остатков Cys, присутствующих в hG-CSF дикого типа, участвуют в образовании дисульфидных связей, в то время как последний остаток вызывает агрегацию продукта hG-CSF в процессе повторной укладки цепи, что уменьшает выход продукта. Чтобы решить проблемы, связанные с продуцированием чужеродного белка в микробной клетке, недавно были предприняты попытки создать способ на основе эффективной секреции целевого белка через мембрану микробной клетки во внеклеточный домен. Например, при осуществлении способа с использованием сигнального пептида требуемый белок экспрессирован в форме слитого белка, в котором сигнальный пептид присоединен к N-концу белка. При прохождении слитого белка через клеточную мембрану сигнальный пептид удаляется ферментом и требуемый белок секретируется в зрелой форме. Способ секреторного продуцирования является эффективным, так как продуцированная аминокислотная последовательность обычно идентична последовательности дикого типа. Однако выход продукта при осуществлении способа секреторного продуцирования часто оказывается довольно низким из-за недостаточно эффективного переноса через мембрану и последующей очистки. Это согласуется с известными данными о том, что выход белка млекопитающего, продуцированного секреторным способом в прокариотах, является очень низким, поэтому ни один из микробных способов не был признан пригодным для эффективной экспрессии и секреции растворимого hG-CSF, не имеющего дополнительного остатка метионина, присоединенного к N-концу. Авторы настоящего изобретения ранее сообщали об использовании нового секреторного сигнального пептида, полученного путем модификации сигнального пептида терморезистентного энтеротоксина II Е. coli (открытая корейская патентная публикация № 2000-19788), при продуцировании hG-CSF. В частности, был получен экспрессирующий вектор, содержащий ген hG-CSF, присоединенный к 3′-концу модифицированного сигнального пептида терморезистентного энтеротоксина II Е. coli, и экспрессирован биологически активный, зрелый hG-CSF с использованием Е. coii, трансформированного вышеуказанным экспрессирующим вектором. Однако большая часть экспрессированного hG-CSF накапливается в цитоплазме, а не в периплазме. Авторы настоящего изобретения предприняли попытку создать эффективный секреторный способ получения hG-CSF в микроорганизме и обнаружили, что модифицированный hG-CSF, полученный путем замены по крайней мере одного аминокислотного остатка, в частности 17-го остатка цистеина, hG-CSF дикого типа другой аминокислотой, позволяет сохранить биологическую активность белка дикого типа, при этом в микроорганизме можно эффективно экспрессировать и секретировать модифицированный hG-CSF, не имеющий остатка метионина у N-конца, используя соответствующий секреторный сигнальный пептид. Краткое изложение существа изобретения Целью настоящего изобретения является получение модифицированного колониестимулирующего фактора гранулоцитов человека (hG-CSF), который можно эффективно продуцировать при помощи микроорганизма. Другой целью настоящего изобретения является получение гена, кодирующего указанный пептид, и вектора, содержащего указанный ген, Другой целью настоящего изобретения является получение микроорганизма, трансформированного указанным вектором. Еще одной целью настоящего изобретения является представление способа получения hG-CSF без остатка метионина, присоединенного к аминоконцу, с использованием указанного микроорганизма. Одним объектом настоящего изобретения является модифицированный hG-CSF, отличающийся тем, что по крайней мере одна из 1-ой, 2-ой, 3-ей и 17-ой аминокислот hG-CSF дикого типа заменена другой аминокислотой. Краткое описание чертежей Вышеуказанные и другие цели и особенности настоящего изобретения будут очевидны из нижеследующего описания изобретения со ссылкой на прилагаемые чертежи, где: На фиг.1 показаны нуклеотидная и аминокислотная последовательности колониестимулирующего фактора гранулоцитов человека дикого типа, состоящие из 174 аминокислотных остатков (SEQ ID NOS: 1 и 2). На фиг.2 показан способ создания вектора pT-CSF. На фиг.3 показан способ создания вектора pT14S1SG. На фиг.4 показан способ создания вектора pT14SS1SG. На фиг.5 показан способ создания вектора pT140SSG-4T22Q. На фиг.6 показан способ создания вектора pT14SS1S17SEG. На фиг.7 показан способ создания вектора pTO1SG. На фиг.8 показан способ создания вектора pBADG. На фиг.9 показан способ создания вектора pBAD2M3VG. На фиг.10а и 10b приведены результаты анализов методом вестерн-блоттинга, которые подтверждают экспрессию hG-CSF и по-разному модифицированных hG-CSF в рекомбинантных линиях клеток, и указаны молекулярные массы экспрессированных белков. На фиг.11 показана клеточная активность hG-CSF и модифицированного hG-CSF, продуцированного в рекомбинантных линиях клеток. Подробное описание изобретения Модифицированные hG-CSF по настоящему изобретению получают, заменяя одну или несколько аминокислот hG-CSF дикого типа (SEQ ID NO: 2), предпочтительно 1-ую, 2-ую, 3-ю и 17-ю аминокислоты другими аминокислотами. Более предпочтительные факторы получают, заменяя 17-ю аминокислоту hG-CSF аминокислотой, которая не заряжена при нейтральном рН. Конкретные примеры предпочтительных модифицированных hG-CSF имеют аминокислотную последовательность hG-CSF дикого типа за исключением того, что: (a) 1-ая аминокислота является Ser; (b) 1-ая аминокислота является Ser и 17-ая аминокислота является X; (c) 2-ая аминокислота является Met и 3-я аминокислота является Val; (d) 2-ая аминокислота является Met, 3-я аминокислота является Val и 17-ая аминокислота является X; или (f) 17-ая аминокислота является X, где Х означает аминокислоту, которая не заряжена при нейтральном рН, предпочтительно Ser, Thr, Ala или Gly, более предпочтительно Ser. Четыре из пяти остатков Суs в hG-CSF участвуют в образовании дисульфидных связей, в то время как 17-ый остаток Cys остается несвязанным в естественном состоянии. Когда в рекомбинантных клетках экспрессировано большое количество hG-CSF, 17-ый остаток Cys принимает участие в образовании межмолекулярных дисульфидных связей, вызывая накопление агломерированного hG-CSF в цитоплазме. Однако в модифицированном hG-CSF по настоящему изобретению, имеющем в положении 17 не Суs, а другой аминокислотный остаток, такая проблема отсутствует, поэтому его можно эффективно продуцировать секреторным способом, используя должным образом трансформированный микроорганизм. Модифицированный hG-CSF по настоящему изобретению может быть кодирован геном, содержащим нуклеотидную последовательность, выведенную из аминокислотной последовательности модифицированного hG-CSF в соответствии с генетическим кодом. Известно, что может быть несколько разных кодонов, кодирующих специфическую аминокислоту, вследствие вырожденности кодона, поэтому в объем настоящего изобретения входят все нуклеотидные последовательности, выведенные из аминокислотной последовательности модифицированного hG-CSF. Предпочтительно последовательность гена модифицированного hG-CSF включает один или несколько предпочтительных кодонов Е. coli. Полученный таким образом ген можно вставить в обычный вектор, чтобы получить экспрессирующий вектор, который, в свою очередь, можно ввести в приемлемого хозяина, например Е. coli. Экспрессирующий вектор может дополнительно содержать сигнальный пептид. Типичными сигнальными пептидами являются сигнальный пептид терморезистентного энтеротоксина II Е. coli (SEQ ID NO: 53), модифицированный сигнальный пептид терморезистентного энтеротоксина II Е. coli (SEQ ID NO: 54), сигнальный пептид бета-лактамазы (SEQ ID NO: 24), сигнальный пептид Gene III (SEQ ID NO: 42) или их модифицированный пептид, но указанные пептиды не ограничивают число сигнальных пептидов, пригодных для использования в настоящем изобретении. Промотор, используемый для получения экспрессирующего вектора по настоящему изобретению, относится к типу, способному экспрессировать гетерологичный белок в микроорганизме-хозяине. В частности, lac, Tac и арабинозный промотор являются предпочтительными при экспрессии гетерологичного белка в Е. coli. Экспрессирующими векторами по настоящему изобретению, использующимися в качестве примера, являются pT14SS1SG, PT14SS1S17SEG, pTO1SG, pTO1S17SG, pTО17SG, pTО17TG, pTО17AG, pTО17GG, pBAD2M3VG, pBAD17SG и pBAD2M3V17SG. Экспрессирующие векторы по настоящему изобретению можно вводить в такие микроорганизмы, как, например, Е. coli BL21(DE3) (Novagen), Е. coli XL-1 синий (Novagen), путем обычной трансформации (Sambrook et al., см. выше), получая при этом трансформанты Е. coli BL21(DE3)/DT14SS1SG (НМ 10310), Е.coli BL21(DE3)/pT14SS1S17SEG (HM 10311), E. coli BL21(DE3)/ pTO1SG (HM 10409), E. coli BL21(DE3)/pTО1S17SG (HM 10410), E. coli BL21(DE3)/pTО17SG (HM 10411), E. coli BL21(DE3)/pTО17TG (HM 10413), E. coli BL21 (DE3)/pTО17AG (HM 10414), E. coli BL21(DE3)/pTO17GG (HM 10415), E. coli BL21 (DE3)/ pBAD2M3VG (HM 10510), E. coli BL21 (DE3)/ pBAD17SG (HM 10511) и E. coli BL21 (DE3)/ pBAD2M3V17SG (HM 10512). Среди трансформированных микроорганизмов предпочтительными являются трансформанты E. coli BL21(DE3)/ pT14SS1S17SEG (HM 10311), E. coli BL21(DE3)/ pTО1S17SG (HM 10410), E. coli BL21(DE3)/ pTО17SG (HM 10411) и E. coli BL21 (DE3)/ pBAD2M3VG (HM 10510), которые были задепонированы в Корейском центре регистрации культур микроорганизмов (КССМ) (адрес: Department of Food Engineering, College of Eng., Yonsei University, Sodaemungu, Seoul 120-749, Republic of Korea) 24 марта 1999 г. под номерами доступа КССМ-10154, КССМ-10151, КССМ-10152 и КССМ-10153 в соответствии с положениями Будапештского договора о международном признании регистрации микроорганизмов при проведении патентной экспертизы. Модифицированный белок hG-CSF по настоящему изобретению можно получить, культивируя трансформированные микроорганизмы с целью экспрессии гена, кодирующего модифицированный белок hG-CSF, секреции модифицированного белка hG-CSF в периплазму и выделения модифицированного белка hG-CSF из периплазмы. Трансформированный микроорганизм можно культивировать в соответствии с известным способом (Sambrook et al., см. выше). Культуру микроорганизмов центрифугируют или фильтруют, собирая таким образом микроорганизм, секретирующий модифицированный белок hG-CSF. Трансформированный микроорганизм можно разрушить обычным способом (Ausubel, F.M. et al., Current Protocols in Molecular Biology, (1989)) с получением раствора периплазмы. Например, микроорганизм можно разрушить в гипотоническом растворе, например дистиллированной воде, при помощи осмотического шока. Модифицированный hG-CSF может быть выделен из раствора периплазмы обычным способом (Sambrook et al., см. выше), например, при помощи ионообменной хроматографии, гель-фильтрационной хроматографии на колонках или иммуногель-хроматографии на колонках. Например, hG-CSF можно очистить, последовательно выполняя хроматографию на колонках с СМ-сефарозой и хроматографию на колонках с фенилсефарозой. Модифицированный белок hG-CSF, полученный по настоящему изобретению, не имеет остатка метионина у N-конца и обладает биологической активностью, которая равна или выше активности hG-CSF дикого типа. Поэтому указанный белок можно использовать в разных областях применения. Нижеследующие примеры приведены для более полной иллюстрации настоящего изобретения и не ограничивают его объем. Пример 1. Получение гена, кодирующего hG-CSFГен кДНК, кодирующий hG-CSF, получают, выполняя полимеразную цепную реакцию (PCR) с использованием матрицы hG-CSF (R&D system, США). Использованные затравки описаны в патенте США NO: 4810643. Чтобы получить ген кДНК, кодирующий зрелый hG-CSF, вектор pUC19-G-CSF (Biolabs, США) подвергают PCR, используя затравки SEQ ID NOS: 3 и 4. Затравка SEQ ID NO: 3 предназначена для получения сайта рестрикции NdeI (5‘-САТАТС-3′) вверху от кодона первой аминокислоты (треонин) зрелого hG-CSF, и затравка SEQ ID NO: 4 предназначена для получения сайта рестрикции BamHI (5′-GGATCC-3′) внизу от кодона терминации. Амплифицированный ген hG-CSF расщепляют при помощи NdeI и BamHI и получают ген, кодирующий зрелый hG-CSF. Ген hG-CSF вводят на участке NdeI/BamHI вектора pET14b (Novagen, США), получая при этом вектор pT-CSF. На фиг.2 показан вышеописанный способ создания вектора pT-CSF. Пример 2. Создание вектора, содержащего ген, кодирующий сигнальный пептид энтеротоксина Е. coli и модифицированный hG-CSF (Стадия 1) Клонирование гена сигнального пептида энтеротоксина II Е. coli Чтобы получить ген сигнального пептида энтеротоксина II Е. coli, создают пару комплементарных олигонуклеотидов, имеющих SEQ ID NOS: 5 и 6, на основе нуклеотидной последовательности сигнального пептида энтеротоксина II Е. coli, которые синтезируют в синтезаторе ДНК (модель 380В, Applied Biosystem, США). Вышеуказанные олигонуклеотиды предназначены для получения сайта рестрикции BspHI (сайты, комплементарные сайтам рестрикции NcoI) вверху от инициирующего кодона энтеротоксина II Е. coli и сайта рестрикции MluI, вводимого путем молчащей замены у другого конца. Оба олигонуклеотида отжигают при 95°С, получая при этом фрагменты ДНК с “тупыми” концами, имеющие нуклеотидную последовательность, кодирующую сигнальный пептид энтеротоксина II Е. coli (ген STII). Ген STII вводят на сайте SmaI вектора pUC19 (Biolabs, США) и получают вектор pUC19ST. (Стадия 2) Получение гена, кодирующего STII/hG-CSF Чтобы получить ген, кодирующий STII/hG-CSF, вектор рТ-CSF, полученный в препаративном примере 1, подвергают PCR, используя затравки SEQ ID NOS: 7 и 8. Затравка SEQ ID NO: 7 предназначена для замены первого кодона hG-CSF кодоном Ser, и затравка SEQ ID NO: 8 предназначена для получения сайта рестрикции BamHI (5′-GGATCC-3′) внизу от кодона терминации. Амплифицированные фрагменты ДНК расщепляют при помощи MluI и BamHI и затем вводят на участке MluI/BamHI вектора pUC19ST, полученного на стадии 1, и получают вектор PUC19S1SG. Созданный таким образом вектор pUC19S1SG содержит ген, кодирующий STII/hG-CSF (именуемый геном STII-hG-CSF). Вектор pUC19S1SG расщепляют при помощи BspHI и BamHI, получая при этом фрагмент ДНК (522 п.о.). Фрагмент ДНК вводят на участке NcoI/ BamHI вектора pET14b (Novagen, США), получая при этом вектор pT14S1SG. На фиг.3 показан вышеописанный способ создания вектора PT14S1SG. (Стадия 3) Присоединение последовательности Шайна-Дальгарно энтеротоксина II Е. coli к гену STII-hG-CSF Вектор pT14S1SG, полученный на стадии 2, подвергают PCR, используя затравки SEQ ID NOS: 9 и 10. Затравка SEQ ID NO: 9 предназначена для получения последовательности Шайна-Дальгарно (именуемая последовательностью STII SD) энтеротоксина II Е. coli и сайта рестрикции XbaI, и затравка SEQ ID NO: 10 предназначена для получения сайта рестрикции BamHI внизу от кодона терминации зрелого hG-CSF с целью создания фрагмента ДНК (STII SD-STII-hCSF), содержащего ген STII SD и STII-hG-CSF. Фрагмент STII SD-STII-hG-CSF расщепляют при помощи XbaI и BamHI и затем вводят на участке XbaI/BamHI вектора pET14b (Novagen, США), получая вектор pT14SS1SG. На фиг.4 показан вышеописанный способ создания вектора PT14SS1SG. E. coli BL21(DE3) (Stratagene, США) трансформируют вектором pT14SS1SG и получают трансформант, обозначаемый как E. coli HM 10310. (Стадия 4) Создание вектора, содержащего ген, кодирующий слитый белок STII/hG-CSF Первый кодон модифицированного гена hG-CSF плазмиды pT14SS1SSG, полученной на стадии 3, заменяют на Thr путем сайт-направленного мутагенеза (Papworth, С. et al., Strategies, 9, 3 (1996)), осуществляя PCR в отношении плазмиды с использованием смысловой затравки (SEQ ID NO: 12), содержащей модифицированную нуклеотидную последовательность, комплементарной антисмысловой затравки (SEQ ID NO: 13) и pfu (Stratagene, США). Выделяют амплифицированный фрагмент ДНК и добавляют к нему рестрикционный фермент Dpnl, чтобы удалить нетрансформированные плазмиды. E. coli XL-1 синий (Novagen, США) трансформируют модифицированной плазмидой. Производят определение последовательности оснований ДНК, выделенной из трансформированных колоний, и таким образом получают плазмиду pT14SSG, которая содержит ген, имеющий Thr вместо первой аминокислоты hG-CSF (SEQ ID NO: 11). 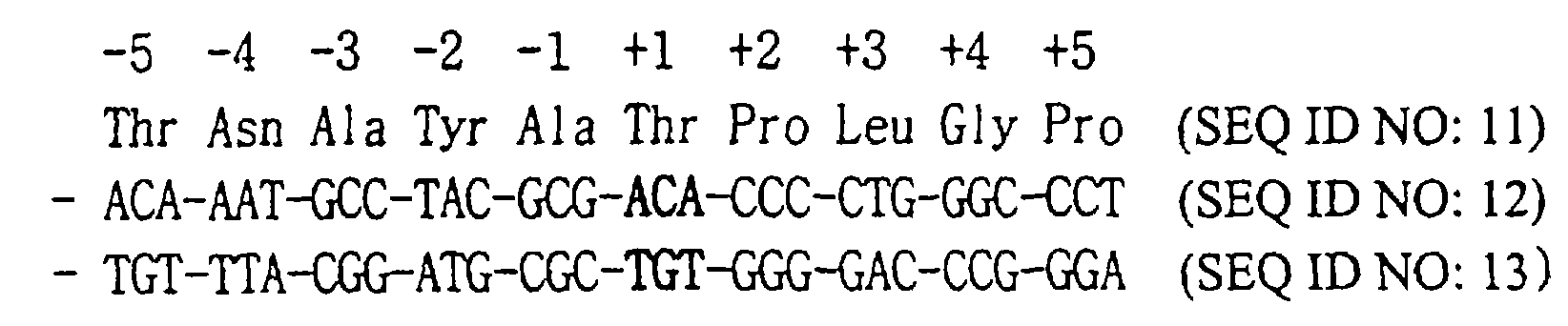 E. coli BL21(DS3) (Stratagene, США) трансформируют вектором pT14SSG и получают трансформант, обозначаемый как E. coli HM 10301.
(Стадия 5) Создание вектора, содержащего ген, кодирующий модифицированный STII/hG-CSF
Вектор pT14SSG, полученный на стадии 4, подвергают PCR, используя комплементарные затравки SEQ ID NOS: 15 и 16, которые предназначены для замены 4-го кодона STII кодоном Thr в соответствии со способом, описанным на стадии 4, и получают модифицированную плазмиду.
E. coli XL-1 синий (Novagen, США) трансформируют модифицированной плазмидой. Производят определение последовательности оснований ДНК, выделенной из трансформированных колоний, и получают таким образом плазмиду, которая содержит ген, имеющий Thr вместо 4-ой аминокислоты STII (SEQ ID NO: 14).
E. coli BL21(DS3) (Stratagene, США) трансформируют вектором pT14SSG и получают трансформант, обозначаемый как E. coli HM 10301.
(Стадия 5) Создание вектора, содержащего ген, кодирующий модифицированный STII/hG-CSF
Вектор pT14SSG, полученный на стадии 4, подвергают PCR, используя комплементарные затравки SEQ ID NOS: 15 и 16, которые предназначены для замены 4-го кодона STII кодоном Thr в соответствии со способом, описанным на стадии 4, и получают модифицированную плазмиду.
E. coli XL-1 синий (Novagen, США) трансформируют модифицированной плазмидой. Производят определение последовательности оснований ДНК, выделенной из трансформированных колоний, и получают таким образом плазмиду, которая содержит ген, имеющий Thr вместо 4-ой аминокислоты STII (SEQ ID NO: 14).
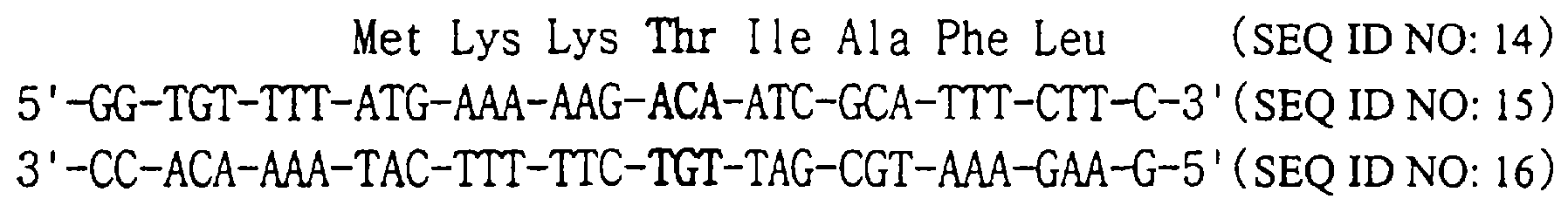 Полученную таким образом плазмиду расщепляют при помощи XbaI и MluI и вводят на участке XbaI/MluI вектора pT14SSG, полученного на стадии 4, получая вектор pT14SSG-4T.
(Стадия 6) Создание вектора, содержащего ген, кодирующий модифицированный STII/hG-CSF
Вектор pT14SSG-4T, полученный на стадии 5, подвергают PCR, используя комплементарные затравки SEQ ID NOS: 18 и 19, которые предназначены для замены 22-го кодона STII кодоном Gln в соответствии со способом, описанным на стадии 4, и получают модифицированную плазмиду.
Е. coli XL-1 синий (Novagen, США) трансформируют модифицированной плазмидой. Производят определение последовательности оснований ДНК, выделенной из трансформированных колоний, и получают таким образом плазмиду pT14SSG-4T22Q, которая содержит ген, имеющий Gln вместо 22-ой аминокислоты STII (SEQ ID NO: 17).
Полученную таким образом плазмиду расщепляют при помощи XbaI и MluI и вводят на участке XbaI/MluI вектора pT14SSG, полученного на стадии 4, получая вектор pT14SSG-4T.
(Стадия 6) Создание вектора, содержащего ген, кодирующий модифицированный STII/hG-CSF
Вектор pT14SSG-4T, полученный на стадии 5, подвергают PCR, используя комплементарные затравки SEQ ID NOS: 18 и 19, которые предназначены для замены 22-го кодона STII кодоном Gln в соответствии со способом, описанным на стадии 4, и получают модифицированную плазмиду.
Е. coli XL-1 синий (Novagen, США) трансформируют модифицированной плазмидой. Производят определение последовательности оснований ДНК, выделенной из трансформированных колоний, и получают таким образом плазмиду pT14SSG-4T22Q, которая содержит ген, имеющий Gln вместо 22-ой аминокислоты STII (SEQ ID NO: 17).
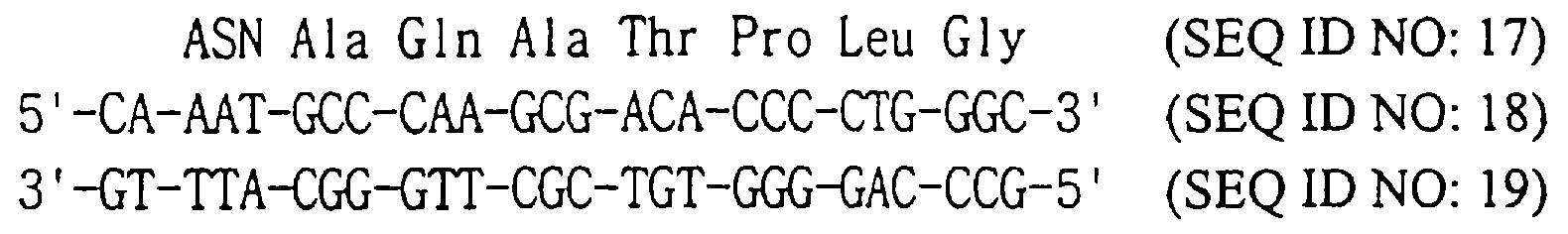 (Стадия 7) Создание вектора, содержащего модифицированную последовательность STII SD и гена, кодирующего модифицированный STII/hG-CSF
Вектор pT14SSG-4T22Q, полученный на стадии 6, подвергают PCR, используя комплементарные затравки SEQ ID NOS: 20 и 21, в соответствии со способом, описанным на стадии 4, и получают вектор рТ14OSSG-4T22Q, имеющий шесть нуклеотидных последовательностей между последовательностью STII SD (GAGG) и инициирующим кодоном STII (модифицированная последовательность STII SD SEQ ID NO: 71).
На фиг.5 показан вышеописанный способ создания вектора pT14OSSG-4T22Q.
Е. coli BL21(DE3) трансформируют вектором рТ14OSSG-4T22Q и получают трансформант, обозначаемый как Е. coli HM 10302.
Пример 3. Создание вектора, содержащего ген, кодирующий модифицированный hG-CSF
Чтобы получить ген модифицированного hG-CSF, олигомер S1 (SEQ ID NO: 22), имеющий предпочтительные для Е. coli кодоны и Ser вместо 17-ой аминокислоты hG-CSF, и олигомер AS1 (SEQ ID NO:) синтезируют в синтезаторе ДНК (модель 380В, Applied Biosystem, США).
Олигонуклеотиды в количестве 0,5 мкл (50 пмоль) подвергают взаимодействию при 95
(Стадия 7) Создание вектора, содержащего модифицированную последовательность STII SD и гена, кодирующего модифицированный STII/hG-CSF
Вектор pT14SSG-4T22Q, полученный на стадии 6, подвергают PCR, используя комплементарные затравки SEQ ID NOS: 20 и 21, в соответствии со способом, описанным на стадии 4, и получают вектор рТ14OSSG-4T22Q, имеющий шесть нуклеотидных последовательностей между последовательностью STII SD (GAGG) и инициирующим кодоном STII (модифицированная последовательность STII SD SEQ ID NO: 71).
На фиг.5 показан вышеописанный способ создания вектора pT14OSSG-4T22Q.
Е. coli BL21(DE3) трансформируют вектором рТ14OSSG-4T22Q и получают трансформант, обозначаемый как Е. coli HM 10302.
Пример 3. Создание вектора, содержащего ген, кодирующий модифицированный hG-CSF
Чтобы получить ген модифицированного hG-CSF, олигомер S1 (SEQ ID NO: 22), имеющий предпочтительные для Е. coli кодоны и Ser вместо 17-ой аминокислоты hG-CSF, и олигомер AS1 (SEQ ID NO:) синтезируют в синтезаторе ДНК (модель 380В, Applied Biosystem, США).
Олигонуклеотиды в количестве 0,5 мкл (50 пмоль) подвергают взаимодействию при 95 С в течение 15 минут и выдерживают в течение 3 часов до достижения температуры 35 С в течение 15 минут и выдерживают в течение 3 часов до достижения температуры 35 С. Смесь осаждают в этаноле и подвергают гель-электрофорезу (SDS-PAGE), получая при этом двухцепочечный олигомер с “липкими” концами.
Плазмиду pT14SS1SG, полученную на стадии 3 примера 2, расщепляют при помощи ApaI и BstXI и затем лигируют с двухцепочечным олигомером с “липкими” концами, получая вектор PT14SS1S17SEG. Вектор pT14SS1S17SEG содержит ген, кодирующий hG-CSF, который имеет предпочтительные для Е. coli кодоны у аминоконца и Ser вместо 1-ой и 17-ой аминокислот hG-CSF.
На фиг.6 показан вышеописанный способ создания вектора pT14OSS1S17SEG.
Е. coli BL21(DE3) трансформируют вектором pT14SS1S173EG и получают трансформант, обозначаемый как Е. coli HM 10311, который задепонирован в Корейском центре регистрации культур микроорганизмов (КССМ) 24 марта 1999 г. под номером доступа КССМ-10154.
Пример 4. Создание вектора, содержащего ген, кодирующий сигнальный пептид OmpA E. coli и модифицированный hG-CSF
Вектор, содержащий ген, кодирующий промотор Тас и сигнальный пептид OmpA (SEQ ID NO: 24), а также ген, кодирующий модифицированный hG-CSF, получают следующим образом: С. Смесь осаждают в этаноле и подвергают гель-электрофорезу (SDS-PAGE), получая при этом двухцепочечный олигомер с “липкими” концами.
Плазмиду pT14SS1SG, полученную на стадии 3 примера 2, расщепляют при помощи ApaI и BstXI и затем лигируют с двухцепочечным олигомером с “липкими” концами, получая вектор PT14SS1S17SEG. Вектор pT14SS1S17SEG содержит ген, кодирующий hG-CSF, который имеет предпочтительные для Е. coli кодоны у аминоконца и Ser вместо 1-ой и 17-ой аминокислот hG-CSF.
На фиг.6 показан вышеописанный способ создания вектора pT14OSS1S17SEG.
Е. coli BL21(DE3) трансформируют вектором pT14SS1S173EG и получают трансформант, обозначаемый как Е. coli HM 10311, который задепонирован в Корейском центре регистрации культур микроорганизмов (КССМ) 24 марта 1999 г. под номером доступа КССМ-10154.
Пример 4. Создание вектора, содержащего ген, кодирующий сигнальный пептид OmpA E. coli и модифицированный hG-CSF
Вектор, содержащий ген, кодирующий промотор Тас и сигнальный пептид OmpA (SEQ ID NO: 24), а также ген, кодирующий модифицированный hG-CSF, получают следующим образом:
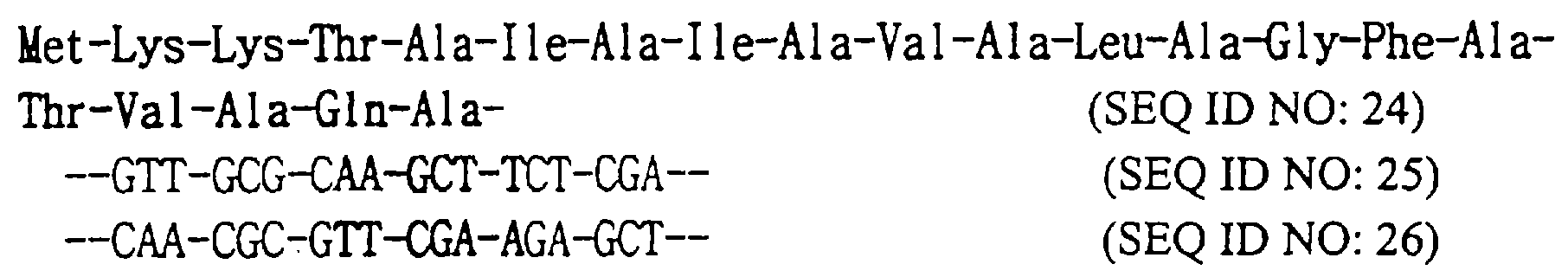 Сайт рестрикции HindIII
Вектор pT-CSF, полученный в примере 1, подвергают PCR, используя затравку (SEQ ID NO: 27), предназначенную для замены 1-го кодона hG-CSF кодоном Ser, и другую затравку (SEQ ID NO: 28), предназначенную для получения сайта рестрикции EcoRI (5′-GAATTC-3′) внизу от кодона терминации, и получают фрагмент ДНК, содержащий ген, кодирующий модифицированный hG-CSF.
Фрагмент ДНК расщепляют при помощи HindIII и EcoRI и затем вводят на участке HindIII/EcoRI вектора pFlag.CTS (Eastman, США), получая вектор pTО1SG, который содержит ген, кодирующий сигнальный пептид OmpA E. coli и модифицированный hG-CSF (SEQ ID NO: 29).
На фиг.7 показан вышеописанный способ создания вектора pTO1SG.
E. coli BL21(DE3) (Stratagene, США) трансформируют вектором pTOlSG и получают трансформант, обозначаемый как E. coli НM 10409.
Пример 5. Создание вектора, содержащего ген, кодирующий сигнальный пептид OmpA E. coli и модифицированный hG-CSF
Первый кодон гена модифицированного hG-CSF плазмиды pTO1SG, полученного в примере 4, заменяют Thr путем сайт-направленного мутагенеза (Papworth, С. et al., Strategies, 9, 3 (1996), выполняя PCR в отношении плазмиды pTO1SG, полученной в примере 4, с использованием смысловой затравки (SEQ ID NO: 30), предназначенной для замены 1-го кодона hG-CSF кодоном Thr, и комплементарной антисмысловой затравки (SEQ ID NO: 31).
E. coli XL-1 синий (Novagen, США) трансформируют модифицированной плазмидой. Производят определение последовательности оснований ДНК, выделенной из трансформированных колоний, и получают таким образом плазмиду pTОG, которая содержит ген, имеющий Thr вместо первой аминокислоты hG-CSF.
E. coli BL21(DE3) (Stratagene, США) трансформируют вектором pTOG и получают трансформант, обозначаемый как E. coli НМ 10401.
Пример 6. Получение модифицированных hG-CSF
(a) Получение [Ser1, Serl7] hG-CSF
Вектор pTO1SG, полученный в примере 4, подвергают PCR, используя смысловую затравку (SEQ ID NO: 32), предназначенную для замены 17-го кодона hG-CSF кодоном Ser, и комплементарную антисмысловую затравку (SEQ ID NO: 33), в соответствии со способом, описанным на стадии 4 примера 2, и получают модифицированную плазмиду.
E. coli XL-1 синий (Novagen, США) трансформируют модифицированной плазмидой. Производят определение последовательности оснований ДНК, выделенной из трансформированных колоний, получая таким образом плазмиду pTO1S17SG, которая содержит ген, имеющий Ser вместо 1-ой и 17-ой аминокислот hG-CSF.
E. coli BL21(DE3) (Stratagene, США) трансформируют вектором pTO1S17SG и получают трансформант, обозначаемый как E. coli НМ 10410, который задепонирован в Корейском центре регистрации культур микроорганизмов (КССМ) 24 марта 1999 г. под номером доступа КССМ-10151.
(b) Получение [Ser17] hG-CSF
Вектор pTOG, полученный в примере 5, подвергают PCR, используя смысловую затравку (SEQ ID NO: 32), предназначенную для замены 17-го кодона hG-CSF кодоном Ser, и комплементарную антисмысловую затравку (SEQ ID NO: 33), в соответствии со способом, описанным на стадии 4 примера 2, и получают модифицированную плазмиду.
Е. coli XL-1 синий (Novagen, США) трансформируют модифицированной плазмидой. Производят определение последовательности оснований ДНК, выделенной из трансформированных колоний, получая таким образом плазмиду pTO17SG, которая содержит ген, имеющий Ser вместо 17-ой аминокислоты hG-CSF.
Е. coli BL21(DE3) (Stratagene, США) трансформируют вектором pTO17SG и получают трансформант, обозначаемый Е. coli HM 10411, который задепонирован в Корейском центре регистрации культур микроорганизмов (КССМ) 24 марта 1999 г. под номером доступа КССМ-10152.
(с) Получение [Thrl7] hG-CSF
Вектор pTOG, полученный в примере 5, подвергают PCR, используя смысловую затравку (SEQ ID NO: 34), предназначенную для замены 17-го кодона hG-CSF кодоном Thr, и комплементарную антисмысловую затравку (SEQ ID NO: 35), в соответствии со способом, описанным на стадии 4 примера 2, и получают модифицированную плазмиду.
Е. coli XL-1 синий (Novagen, США) трансформируют модифицированной плазмидой. Производят определение последовательности оснований ДНК, выделенной из трансформированных колоний, получая таким образом плазмиду pTO17TG, которая содержит ген, имеющий Thr вместо 17-ой аминокислоты hG-CSF.
Е. coli BL21(DE3) (Stratagen, США) трансформируют вектором pTO17TG и получают трансформант, именуемый Е. coli HM 10413.
(d) Получение [А1а17] hG-CSF
Вектор pTOG, полученный в примере 5, подвергают PCR, используя смысловую затравку (SEQ ID NO: 36), предназначенную для замены 17-го кодона hG-CSF кодоном А1а, и комплементарную антисмысловую затравку (SEQ ID NO: 37), в соответствии со способом, описанным на стадии 4 примера 2, и получают модифицированную плазмиду.
Е. coli XL-1 синий (Novagen, США) трансформируют модифицированной плазмидой. Производят определение последовательности оснований ДНК, выделенной из трансформированных колоний, получая таким образом плазмиду pTО17AG, которая содержит ген, имеющий Аlа вместо 17-ой аминокислоты hG-CSF.
Е. coli BL21(DE3) (Stratagene, США) трансформируют вектором pTО17AG и получают трансформант, именуемый Е. coli HM 10414.
(e) Получение [Gly17] hG-CSF
Вектор pTOG, полученный в примере 5, подвергают PCR, используя смысловую затравку (SEQ ID NO: 38), предназначенную для замены 17-го кодона hG-CSF кодоном Gly, и комплементарную антисмысловую затравку (SEQ ID NO: 39), в соответствии со способом, описанным на стадии 4 примера 2, и получают модифицированную плазмиду.
Е. coli XL-1 синий (Novagen, США) трансформируют модифицированной плазмидой. Производят определение последовательности оснований ДНК, выделенной из трансформированных колоний, получая таким образом плазмиду pTO17GG, которая содержит ген, имеющий Gly вместо 17-ой аминокислоты hG-CSF.
Е. coli BL21 (DE3) (Stratagene, США) трансформируют вектором pTO17GG и получают трансформант, именуемый Е. coli НМ 10415.
(f) Получение [Asp17] hG-CSF
Вектор pTOG, полученный в примере 5, подвергают PCR, используя смысловую затравку (SEQ ID NO: 40), предназначенную для замены 17-го кодона hG-CSF кодоном Asp, и комплементарную антисмысловую затравку (SEQ ID NO: 41), в соответствии со способом, описанным на стадии 4 примера 2, и получают модифицированную плазмиду.
Е. coli XL-1 синий (Novagen, США) трансформируют модифицированной плазмидой. Производят определение последовательности оснований ДНК, выделенной из трансформированных колоний, получая таким образом плазмиду pTО17APG, которая содержит ген, имеющий Asp вместо 17-ой аминокислоты hG-CSF.
Е. coli BL21(DE3) (Stratagene, США) трансформируют вектором pTО17APG и получают трансформант, именуемый Е. coli НМ 10416.
Пример 7. Создание вектора, содержащего ген, кодирующий сигнальный пептид Gene III E. coli и модифицированный hG-CSF
(а) Создание вектора, содержащего ген, кодирующий арабинозный промотор и сигнальный пептид Gene III E. Coli.
Вектор, содержащий ген, кодирующий арабинозный промотор и сигнальный пептид Gene III E. coli (SEQ ID NO: 42), a также ген, кодирующий модифицированный hG-CSF, получают следующим образом:
Сайт рестрикции HindIII
Вектор pT-CSF, полученный в примере 1, подвергают PCR, используя затравку (SEQ ID NO: 27), предназначенную для замены 1-го кодона hG-CSF кодоном Ser, и другую затравку (SEQ ID NO: 28), предназначенную для получения сайта рестрикции EcoRI (5′-GAATTC-3′) внизу от кодона терминации, и получают фрагмент ДНК, содержащий ген, кодирующий модифицированный hG-CSF.
Фрагмент ДНК расщепляют при помощи HindIII и EcoRI и затем вводят на участке HindIII/EcoRI вектора pFlag.CTS (Eastman, США), получая вектор pTО1SG, который содержит ген, кодирующий сигнальный пептид OmpA E. coli и модифицированный hG-CSF (SEQ ID NO: 29).
На фиг.7 показан вышеописанный способ создания вектора pTO1SG.
E. coli BL21(DE3) (Stratagene, США) трансформируют вектором pTOlSG и получают трансформант, обозначаемый как E. coli НM 10409.
Пример 5. Создание вектора, содержащего ген, кодирующий сигнальный пептид OmpA E. coli и модифицированный hG-CSF
Первый кодон гена модифицированного hG-CSF плазмиды pTO1SG, полученного в примере 4, заменяют Thr путем сайт-направленного мутагенеза (Papworth, С. et al., Strategies, 9, 3 (1996), выполняя PCR в отношении плазмиды pTO1SG, полученной в примере 4, с использованием смысловой затравки (SEQ ID NO: 30), предназначенной для замены 1-го кодона hG-CSF кодоном Thr, и комплементарной антисмысловой затравки (SEQ ID NO: 31).
E. coli XL-1 синий (Novagen, США) трансформируют модифицированной плазмидой. Производят определение последовательности оснований ДНК, выделенной из трансформированных колоний, и получают таким образом плазмиду pTОG, которая содержит ген, имеющий Thr вместо первой аминокислоты hG-CSF.
E. coli BL21(DE3) (Stratagene, США) трансформируют вектором pTOG и получают трансформант, обозначаемый как E. coli НМ 10401.
Пример 6. Получение модифицированных hG-CSF
(a) Получение [Ser1, Serl7] hG-CSF
Вектор pTO1SG, полученный в примере 4, подвергают PCR, используя смысловую затравку (SEQ ID NO: 32), предназначенную для замены 17-го кодона hG-CSF кодоном Ser, и комплементарную антисмысловую затравку (SEQ ID NO: 33), в соответствии со способом, описанным на стадии 4 примера 2, и получают модифицированную плазмиду.
E. coli XL-1 синий (Novagen, США) трансформируют модифицированной плазмидой. Производят определение последовательности оснований ДНК, выделенной из трансформированных колоний, получая таким образом плазмиду pTO1S17SG, которая содержит ген, имеющий Ser вместо 1-ой и 17-ой аминокислот hG-CSF.
E. coli BL21(DE3) (Stratagene, США) трансформируют вектором pTO1S17SG и получают трансформант, обозначаемый как E. coli НМ 10410, который задепонирован в Корейском центре регистрации культур микроорганизмов (КССМ) 24 марта 1999 г. под номером доступа КССМ-10151.
(b) Получение [Ser17] hG-CSF
Вектор pTOG, полученный в примере 5, подвергают PCR, используя смысловую затравку (SEQ ID NO: 32), предназначенную для замены 17-го кодона hG-CSF кодоном Ser, и комплементарную антисмысловую затравку (SEQ ID NO: 33), в соответствии со способом, описанным на стадии 4 примера 2, и получают модифицированную плазмиду.
Е. coli XL-1 синий (Novagen, США) трансформируют модифицированной плазмидой. Производят определение последовательности оснований ДНК, выделенной из трансформированных колоний, получая таким образом плазмиду pTO17SG, которая содержит ген, имеющий Ser вместо 17-ой аминокислоты hG-CSF.
Е. coli BL21(DE3) (Stratagene, США) трансформируют вектором pTO17SG и получают трансформант, обозначаемый Е. coli HM 10411, который задепонирован в Корейском центре регистрации культур микроорганизмов (КССМ) 24 марта 1999 г. под номером доступа КССМ-10152.
(с) Получение [Thrl7] hG-CSF
Вектор pTOG, полученный в примере 5, подвергают PCR, используя смысловую затравку (SEQ ID NO: 34), предназначенную для замены 17-го кодона hG-CSF кодоном Thr, и комплементарную антисмысловую затравку (SEQ ID NO: 35), в соответствии со способом, описанным на стадии 4 примера 2, и получают модифицированную плазмиду.
Е. coli XL-1 синий (Novagen, США) трансформируют модифицированной плазмидой. Производят определение последовательности оснований ДНК, выделенной из трансформированных колоний, получая таким образом плазмиду pTO17TG, которая содержит ген, имеющий Thr вместо 17-ой аминокислоты hG-CSF.
Е. coli BL21(DE3) (Stratagen, США) трансформируют вектором pTO17TG и получают трансформант, именуемый Е. coli HM 10413.
(d) Получение [А1а17] hG-CSF
Вектор pTOG, полученный в примере 5, подвергают PCR, используя смысловую затравку (SEQ ID NO: 36), предназначенную для замены 17-го кодона hG-CSF кодоном А1а, и комплементарную антисмысловую затравку (SEQ ID NO: 37), в соответствии со способом, описанным на стадии 4 примера 2, и получают модифицированную плазмиду.
Е. coli XL-1 синий (Novagen, США) трансформируют модифицированной плазмидой. Производят определение последовательности оснований ДНК, выделенной из трансформированных колоний, получая таким образом плазмиду pTО17AG, которая содержит ген, имеющий Аlа вместо 17-ой аминокислоты hG-CSF.
Е. coli BL21(DE3) (Stratagene, США) трансформируют вектором pTО17AG и получают трансформант, именуемый Е. coli HM 10414.
(e) Получение [Gly17] hG-CSF
Вектор pTOG, полученный в примере 5, подвергают PCR, используя смысловую затравку (SEQ ID NO: 38), предназначенную для замены 17-го кодона hG-CSF кодоном Gly, и комплементарную антисмысловую затравку (SEQ ID NO: 39), в соответствии со способом, описанным на стадии 4 примера 2, и получают модифицированную плазмиду.
Е. coli XL-1 синий (Novagen, США) трансформируют модифицированной плазмидой. Производят определение последовательности оснований ДНК, выделенной из трансформированных колоний, получая таким образом плазмиду pTO17GG, которая содержит ген, имеющий Gly вместо 17-ой аминокислоты hG-CSF.
Е. coli BL21 (DE3) (Stratagene, США) трансформируют вектором pTO17GG и получают трансформант, именуемый Е. coli НМ 10415.
(f) Получение [Asp17] hG-CSF
Вектор pTOG, полученный в примере 5, подвергают PCR, используя смысловую затравку (SEQ ID NO: 40), предназначенную для замены 17-го кодона hG-CSF кодоном Asp, и комплементарную антисмысловую затравку (SEQ ID NO: 41), в соответствии со способом, описанным на стадии 4 примера 2, и получают модифицированную плазмиду.
Е. coli XL-1 синий (Novagen, США) трансформируют модифицированной плазмидой. Производят определение последовательности оснований ДНК, выделенной из трансформированных колоний, получая таким образом плазмиду pTО17APG, которая содержит ген, имеющий Asp вместо 17-ой аминокислоты hG-CSF.
Е. coli BL21(DE3) (Stratagene, США) трансформируют вектором pTО17APG и получают трансформант, именуемый Е. coli НМ 10416.
Пример 7. Создание вектора, содержащего ген, кодирующий сигнальный пептид Gene III E. coli и модифицированный hG-CSF
(а) Создание вектора, содержащего ген, кодирующий арабинозный промотор и сигнальный пептид Gene III E. Coli.
Вектор, содержащий ген, кодирующий арабинозный промотор и сигнальный пептид Gene III E. coli (SEQ ID NO: 42), a также ген, кодирующий модифицированный hG-CSF, получают следующим образом:
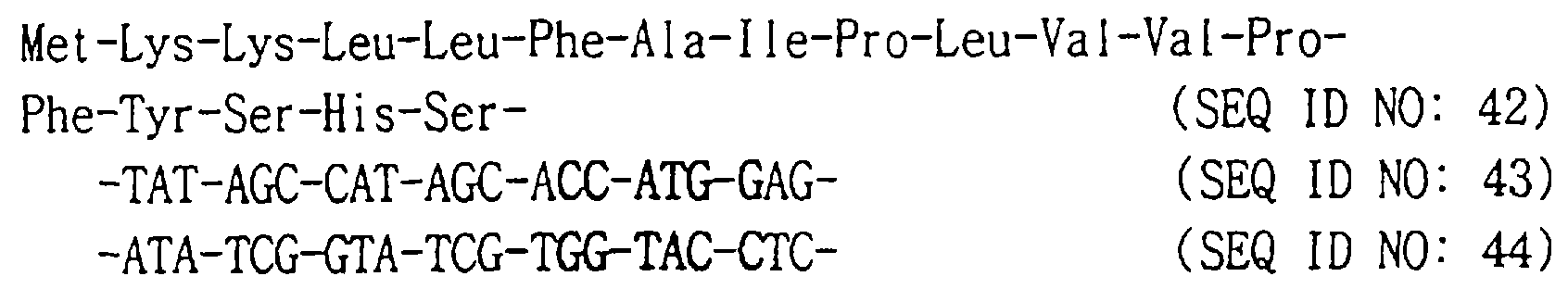 Сайт рестрикции NcoI
Плазмиду pBAD gIIIA (Invitrogen, США), содержащую ген, кодирующий арабинозный промотор и сигнальный пептид Gene III, расщепляют при помощи NcoI, одноцепочечные ДНК удаляют при помощи ДНК-полимеразы Кленова и получают двухцепочечную ДНК с “тупыми” концами, которую затем расщепляют при помощи BgIII, получая при этом фрагмент вектора с “тупым” концом и “липким” концом.
Вектор pT-CSF, полученный в примере 1, подвергают PCR, используя смысловую затравку (SEQ ID NO: 46), имеющую нуклеотидную последовательность, кодирующую со 2-ой по 9-ую аминокислоты hG-CSF (SEQ ID NO: 45), и комплементарную антисмысловую затравку (SEQ ID NO: 47), в соответствии со способом, описанным на стадии 4 примера 2, и получают фрагмент ДНК с “тупыми” концами, содержащий ген hG-CSF и сайт рестрикции BamHI у карбоксильного конца. Полученный фрагмент затем расщепляют при помощи BamHI, получая фрагмент гена hG-CSF с “тупым” концом и “липким” концом.
Сайт рестрикции NcoI
Плазмиду pBAD gIIIA (Invitrogen, США), содержащую ген, кодирующий арабинозный промотор и сигнальный пептид Gene III, расщепляют при помощи NcoI, одноцепочечные ДНК удаляют при помощи ДНК-полимеразы Кленова и получают двухцепочечную ДНК с “тупыми” концами, которую затем расщепляют при помощи BgIII, получая при этом фрагмент вектора с “тупым” концом и “липким” концом.
Вектор pT-CSF, полученный в примере 1, подвергают PCR, используя смысловую затравку (SEQ ID NO: 46), имеющую нуклеотидную последовательность, кодирующую со 2-ой по 9-ую аминокислоты hG-CSF (SEQ ID NO: 45), и комплементарную антисмысловую затравку (SEQ ID NO: 47), в соответствии со способом, описанным на стадии 4 примера 2, и получают фрагмент ДНК с “тупыми” концами, содержащий ген hG-CSF и сайт рестрикции BamHI у карбоксильного конца. Полученный фрагмент затем расщепляют при помощи BamHI, получая фрагмент гена hG-CSF с “тупым” концом и “липким” концом.
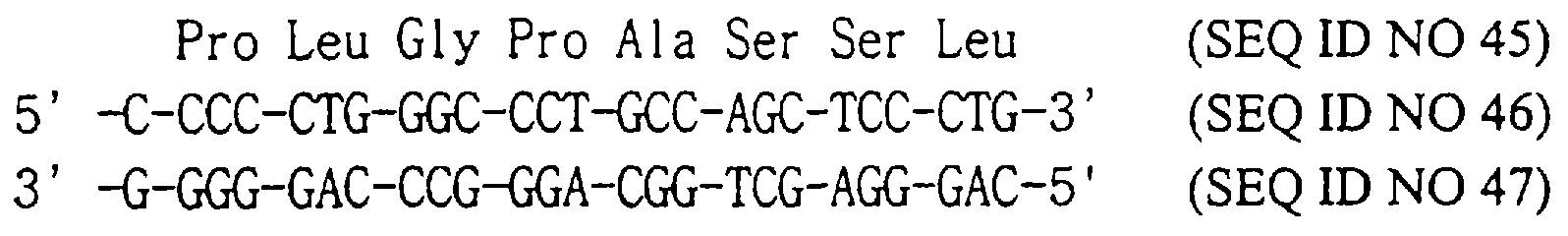 Фрагмент гена hG-CSF встраивают в созданный выше вектор, получая таким образом вектор pBADG, который содержит ген, кодирующий сигнальный пептид Gene III E. coli и hG-CSF (SEQ ID NO: 48).
На фиг.8 показан вышеописанный способ создания вектора pBADG.
E. coli BL21(DE3) (Stratagene, США) трансформируют вектором pBADG и получают трансформант, обозначаемый как E. coli НМ 10501.
(b) Получение [Met2, Val3] hG-CSF
Плазмиду pBAD gIIIA (Invitrogen, США) расщепляют при помощи NcoI и BgIII и получают фрагмент, имеющий два “липких” конца.
Вектор pT-CSF, полученный в примере 1, подвергают PCR, используя смысловую затравку (SEQ ID NO: 50), имеющую нуклеотидную последовательность, кодирующую с 1-ой по 9-ую аминокислоты [Met2, Val3] hG-CSF (SEQ ID NO: 49), и комплементарную антисмысловую затравку (SEQ ID NO: 51), в соответствии со способом, описанным на стадии 4 примера 2, и получают фрагмент ДНК с “тупыми” концами, содержащий ген hG-CSF и сайт рестрикции BamHI у карбоксильного конца, который затем расщепляют при помощи NeoI и BamHI, получая таким образом фрагмент гена hG-CSF, имеющий два “липких” конца.
Фрагмент гена hG-CSF встраивают в созданный выше вектор, получая таким образом вектор pBADG, который содержит ген, кодирующий сигнальный пептид Gene III E. coli и hG-CSF (SEQ ID NO: 48).
На фиг.8 показан вышеописанный способ создания вектора pBADG.
E. coli BL21(DE3) (Stratagene, США) трансформируют вектором pBADG и получают трансформант, обозначаемый как E. coli НМ 10501.
(b) Получение [Met2, Val3] hG-CSF
Плазмиду pBAD gIIIA (Invitrogen, США) расщепляют при помощи NcoI и BgIII и получают фрагмент, имеющий два “липких” конца.
Вектор pT-CSF, полученный в примере 1, подвергают PCR, используя смысловую затравку (SEQ ID NO: 50), имеющую нуклеотидную последовательность, кодирующую с 1-ой по 9-ую аминокислоты [Met2, Val3] hG-CSF (SEQ ID NO: 49), и комплементарную антисмысловую затравку (SEQ ID NO: 51), в соответствии со способом, описанным на стадии 4 примера 2, и получают фрагмент ДНК с “тупыми” концами, содержащий ген hG-CSF и сайт рестрикции BamHI у карбоксильного конца, который затем расщепляют при помощи NeoI и BamHI, получая таким образом фрагмент гена hG-CSF, имеющий два “липких” конца.
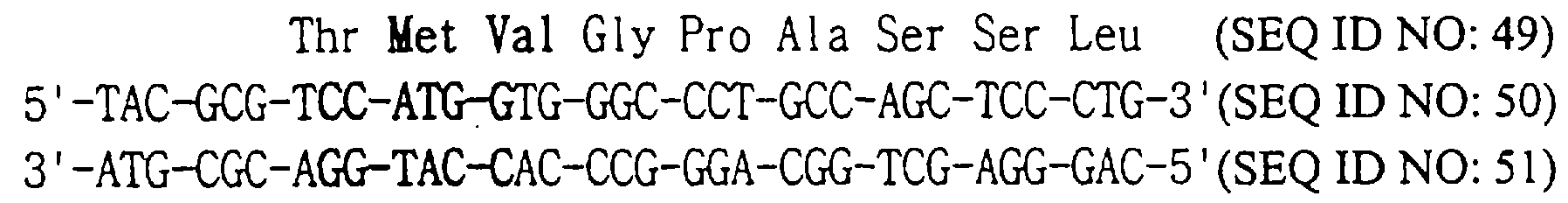 Сайт рестрикции NcoI
Фрагмент гена hG-CSF встраивают в созданный выше вектор и получают вектор pBAD2M2VG, содержащий ген, кодирующий сигнальный пептид Gene III E. coli, и Met и Val вместо 2-ой и 3-ей аминокислот hG-CSF (SEQ ID NO: 52).
На фиг.9 показан вышеописанный способ создания вектора pBAD2M3VG.
E. coli BL21(DE3) (Stratagene, США) трансформируют вектором pBAD2M3VG и получают трансформант, обозначаемый как E. coli HM 10510, который задепонирован в Корейском центре регистрации культур микроорганизмов (КССМ) 24 марта 1999 г. под номером доступа КССМ-10153.
(с) Получение [Ser17] hG-CSF
Вектор pBADG, полученный в пункте (а), подвергают PCR, используя смысловую затравку (SEQ ID NO: 32), предназначенную для замены 17-го кодона hG-CSF кодоном Ser, и комплементарную антисмысловую затравку (SEQ ID NO: 33), в соответствии со способом, описанным на стадии 4 примера 2, и получают модифицированную плазмиду.
Е. coli XL-1 синий (Novagen, США) трансформируют модифицированной плазмидой. Производят определение последовательности оснований ДНК, выделенной из трансформированных колоний, получая таким образом плазмиду pBAD17SG, которая содержит ген, имеющий Ser вместо 17-ой аминокислоты hG-CSF.
Е. coli BL21(DE3) (Stratagene, США) трансформируют вектором pBAD17SG и получают трансформант, обозначаемый как Е. coli HM 10511.
(d) Получение [Met2, Val3, Serl7] hG-CSF
Bектор pBAD2M3VG, полученный в пункте (b), подвергают PCR, используя смысловую затравку (SEQ ID NO: 32), предназначенную для замены 17-го кодона hG-CSF кодоном Ser, и комплементарную антисмысловую затравку (SEQ ID NO: 33), в соответствии со способом, описанным на стадии 4 примера 2, и получают модифицированную плазмиду.
Е. coli XL-1 синий (Novagen, США) трансформируют модифицированной плазмидой. Производят определение последовательности оснований ДНК, выделенной из трансформированных колоний, получая таким образом плазмиду pBAD2M3V17SG, которая содержит ген, имеющий Met, Val и Ser соответственно вместо 2-ой, 3-ей и 17-ой аминокислот hG-CSF.
E. coli BL21(DE3) (Stratagene, США) трансформируют вектором pBAD2M3V17SG и получают трансформант, именуемый как E. coli HM 10512.
Пример 8. Получение hG-CSF
Трансформанты, полученные в примерах 2-7, культивируют в среде LB (1% бактотриптона, 0,5% бактодрожжевого экстракта и 1% NaCl) и затем инкубируют в присутствии индуктора экспрессии (IPTG) в течение 3 часов или культивируют без IPTG в течение более 15 часов. Все культуры центрифугируют со скоростью 6000 оборотов/мин в течение 20 минут для осаждения бактериальных клеток, после чего осадок суспендируют в 1/10 объема изотонического раствора (20% сахарозы, 10 мМ трис-Сl буферного раствора, содержащего 1 мМ EDTA, рН 7,0). Суспензию оставляют выстаиваться при комнатной температуре в течение 30 минут, затем центрифугируют со скоростью 7000 оборотов/мин в течение 10 минут и собирают бактериальные клетки. Полученные клетки вновь суспендируют в дистиллированной воде при 4
Сайт рестрикции NcoI
Фрагмент гена hG-CSF встраивают в созданный выше вектор и получают вектор pBAD2M2VG, содержащий ген, кодирующий сигнальный пептид Gene III E. coli, и Met и Val вместо 2-ой и 3-ей аминокислот hG-CSF (SEQ ID NO: 52).
На фиг.9 показан вышеописанный способ создания вектора pBAD2M3VG.
E. coli BL21(DE3) (Stratagene, США) трансформируют вектором pBAD2M3VG и получают трансформант, обозначаемый как E. coli HM 10510, который задепонирован в Корейском центре регистрации культур микроорганизмов (КССМ) 24 марта 1999 г. под номером доступа КССМ-10153.
(с) Получение [Ser17] hG-CSF
Вектор pBADG, полученный в пункте (а), подвергают PCR, используя смысловую затравку (SEQ ID NO: 32), предназначенную для замены 17-го кодона hG-CSF кодоном Ser, и комплементарную антисмысловую затравку (SEQ ID NO: 33), в соответствии со способом, описанным на стадии 4 примера 2, и получают модифицированную плазмиду.
Е. coli XL-1 синий (Novagen, США) трансформируют модифицированной плазмидой. Производят определение последовательности оснований ДНК, выделенной из трансформированных колоний, получая таким образом плазмиду pBAD17SG, которая содержит ген, имеющий Ser вместо 17-ой аминокислоты hG-CSF.
Е. coli BL21(DE3) (Stratagene, США) трансформируют вектором pBAD17SG и получают трансформант, обозначаемый как Е. coli HM 10511.
(d) Получение [Met2, Val3, Serl7] hG-CSF
Bектор pBAD2M3VG, полученный в пункте (b), подвергают PCR, используя смысловую затравку (SEQ ID NO: 32), предназначенную для замены 17-го кодона hG-CSF кодоном Ser, и комплементарную антисмысловую затравку (SEQ ID NO: 33), в соответствии со способом, описанным на стадии 4 примера 2, и получают модифицированную плазмиду.
Е. coli XL-1 синий (Novagen, США) трансформируют модифицированной плазмидой. Производят определение последовательности оснований ДНК, выделенной из трансформированных колоний, получая таким образом плазмиду pBAD2M3V17SG, которая содержит ген, имеющий Met, Val и Ser соответственно вместо 2-ой, 3-ей и 17-ой аминокислот hG-CSF.
E. coli BL21(DE3) (Stratagene, США) трансформируют вектором pBAD2M3V17SG и получают трансформант, именуемый как E. coli HM 10512.
Пример 8. Получение hG-CSF
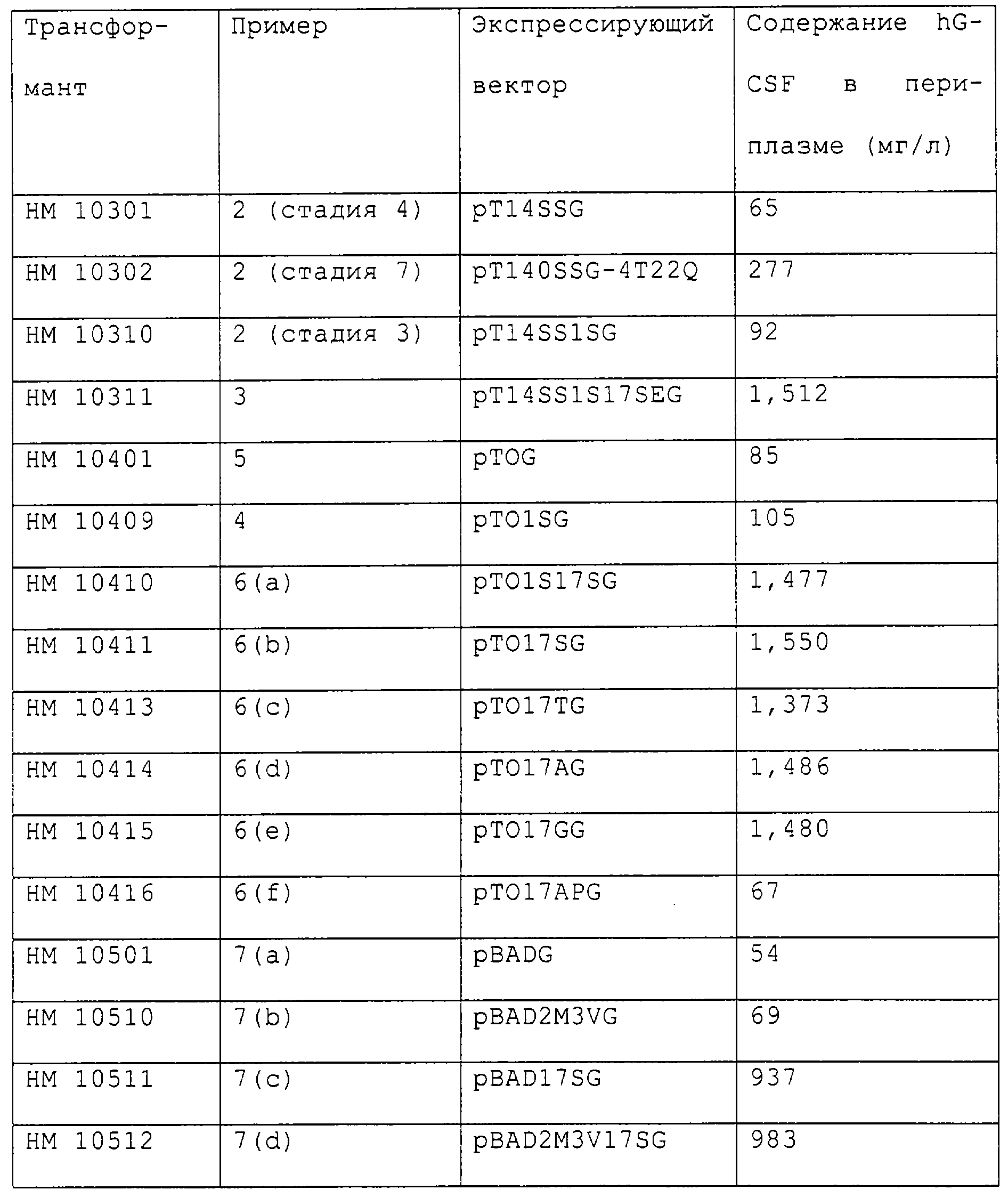
Трансформанты, полученные в примерах 2-7, культивируют в среде LB (1% бактотриптона, 0,5% бактодрожжевого экстракта и 1% NaCl) и затем инкубируют в присутствии индуктора экспрессии (IPTG) в течение 3 часов или культивируют без IPTG в течение более 15 часов. Все культуры центрифугируют со скоростью 6000 оборотов/мин в течение 20 минут для осаждения бактериальных клеток, после чего осадок суспендируют в 1/10 объема изотонического раствора (20% сахарозы, 10 мМ трис-Сl буферного раствора, содержащего 1 мМ EDTA, рН 7,0). Суспензию оставляют выстаиваться при комнатной температуре в течение 30 минут, затем центрифугируют со скоростью 7000 оборотов/мин в течение 10 минут и собирают бактериальные клетки. Полученные клетки вновь суспендируют в дистиллированной воде при 4 С, центрифугируют со скоростью 7000 оборотов/мин в течение 10 минут и получают супернатант в виде раствора периплазмы. Содержание hG-CSF в растворе периплазмы определяют методом ELISA (Kato, К. et al., J. Immunol., 116, 1554 (1976)), используя антитело против hG-CSF (Aland, США), которое вычисляют в виде количества hG-CSF, продуцируемого в 1 л культуры. Результаты приведены в таблице. С, центрифугируют со скоростью 7000 оборотов/мин в течение 10 минут и получают супернатант в виде раствора периплазмы. Содержание hG-CSF в растворе периплазмы определяют методом ELISA (Kato, К. et al., J. Immunol., 116, 1554 (1976)), используя антитело против hG-CSF (Aland, США), которое вычисляют в виде количества hG-CSF, продуцируемого в 1 л культуры. Результаты приведены в таблице.
 Пример 9. Очистка hG-CSF
Трансформант Е. coli НМ 10411, полученный в примере 6(b), культивируют в среде LB, после чего культуру центрифугируют со скоростью 6000 оборотов/мин в течение 20 минут и собирают клетки. Выполняя способ по примеру 8, из клеток получают раствор периплазмы.
Раствор периплазмы доводят до рН 5,0-5,5, адсорбируют в колонке с СМ-сефарозой (Pharmacia Inc., Швеция), предварительно уравновешенной до рН 5,3, и промывают колонку 25 мМ NaCl. hG-CSF элюируют, последовательно добавляя в колонку буферные растворы, содержащие 50 мМ, 100 мМ и 200 мМ NaCl, и фракции, содержащие hG-CSF, собирают и объединяют.
Объединенные фракции подвергают хроматографии на колонках с фенилсефарозой (Pharmacia Inc., Швеция), получая при этом [Ser17] hG-CSF с чистотой 99%.
Далее вышеописанный способ выполняют, используя трансформанты Е. coli НМ 10311, НМ 10409, НМ 10411, НМ 10413, HМ 10414, НМ 10415, НМ 10510 и НМ 10512, полученные соответственно в примерах 3, 4, 6(b), 6(с), 6(d), 6(е), 7(b) и 7(d).
Каждую очищенную фракцию hG-CSF подвергают электрофорезу в полиакриламидном геле в присутствии додецилсульфата натрия (SDS-PAGE) с целью определения чистоты и примерной концентрации hG-CSF и затем анализируют методом ELISA для определения точной концентрации hG-CSF в растворе периплазмы. В качестве контрольного вещества используют Met-hG-CSF (Kirin amgen).
На фиг.10а приведены результаты SDS-PAGE, где дорожка 1 соответствует Met-G-CSF, дорожка 2 соответствует раствору трансформанта Е. coli НМ 10411 в периплазме и дорожка 3 соответствует очищенному [Ser17] hG-CSF. Как показано на фиг.10b, молекулярная масса [Ser17] hG-CSF аналогична молекулярной массе hG-CSF дикого типа и раствор трансформанта Е. coli НМ 10411 в периплазме характеризуется высоким содержанием [Ser17] hG-CSF.
Кроме того, производят определение N-концевых аминокислотных последовательностей разных hG-CSF и нуклеотидных последовательностей, кодирующих с 1-ой по 32-ую аминокислоты, полученные с использованием трансформантов НМ 10311, НМ 10409, НМ 10411, НМ 10413, НМ 10414, НМ 10415, НМ 10510 и НМ 10512, приведенных соответственно в SEQ ID NOS: 56, 58, 60, 62, 64, 66, 68 и 70. Полученный результат показывает, что модифицированный hG-CSF по настоящему изобретению не имеет остатка метионина у N-конца.
Нитроцеллюлозный фильтр (Bio-Rad Lab., США) смачивают буферным раствором для блоттинга (170 мМ глицина, 25 мМ трис HCl (рН 8), 20% метанола) и белки, отделенные на геле, анализируют методом вестерн-блоттинга на нитроцеллюлозном фильтре (Bio-Rad Lab., США) в течение 3 часов. Фильтр выдерживают в 1% казеине в течение 1 часа и трижды промывают PBS, содержащим 0,05% Tween 20. Фильтр помещают в раствор козьего анти-G-CSF антитела (R&D System, AB-214-NA, США), разведенный PBS, и подвергают взаимодействию при комнатной температуре в течение 2 часов. После окончания реакции фильтр трижды промывают раствором PBST, чтобы удалить непрореагировавшее антитело. Добавляют конъюгированный с пероксидазой хрена кроличьего антикозьего IgG(Bio-Rad Lab., США), разведенный PBS, и подвергают взаимодействию при комнатной температуре в течение 2 часов. Фильтр промывают PBST и добавляют раствор пероксидазы из набора веществ (Bio-Rad Lab., США) для осуществления окрашивания. Результаты вышеописанного вестерн-блоттинга приведены на фиг.10b, где дорожка 1 соответствует положительному контролю, Met-G-CSF, и дорожка 2 соответствует очищенному [Ser17] hG-CSF. Как показано на фиг.10b, молекулярная масса [Ser17] hG-CSF равна молекулярной массе hG-CSF дикого типа.
Пример 10. Клеточная активность hG-CSF и модифицированного hG-CSF
Линию клеток HL-60 (ATCC CCL-240, полученную из костного мозга белой 36-летней женщины, страдающей промиелоцитарным лейкозом) культивируют в среде RPMI 1640, содержащей 10% фетальной телячьей сыворотки, доводят до 2,2
Пример 9. Очистка hG-CSF
Трансформант Е. coli НМ 10411, полученный в примере 6(b), культивируют в среде LB, после чего культуру центрифугируют со скоростью 6000 оборотов/мин в течение 20 минут и собирают клетки. Выполняя способ по примеру 8, из клеток получают раствор периплазмы.
Раствор периплазмы доводят до рН 5,0-5,5, адсорбируют в колонке с СМ-сефарозой (Pharmacia Inc., Швеция), предварительно уравновешенной до рН 5,3, и промывают колонку 25 мМ NaCl. hG-CSF элюируют, последовательно добавляя в колонку буферные растворы, содержащие 50 мМ, 100 мМ и 200 мМ NaCl, и фракции, содержащие hG-CSF, собирают и объединяют.
Объединенные фракции подвергают хроматографии на колонках с фенилсефарозой (Pharmacia Inc., Швеция), получая при этом [Ser17] hG-CSF с чистотой 99%.
Далее вышеописанный способ выполняют, используя трансформанты Е. coli НМ 10311, НМ 10409, НМ 10411, НМ 10413, HМ 10414, НМ 10415, НМ 10510 и НМ 10512, полученные соответственно в примерах 3, 4, 6(b), 6(с), 6(d), 6(е), 7(b) и 7(d).
Каждую очищенную фракцию hG-CSF подвергают электрофорезу в полиакриламидном геле в присутствии додецилсульфата натрия (SDS-PAGE) с целью определения чистоты и примерной концентрации hG-CSF и затем анализируют методом ELISA для определения точной концентрации hG-CSF в растворе периплазмы. В качестве контрольного вещества используют Met-hG-CSF (Kirin amgen).
На фиг.10а приведены результаты SDS-PAGE, где дорожка 1 соответствует Met-G-CSF, дорожка 2 соответствует раствору трансформанта Е. coli НМ 10411 в периплазме и дорожка 3 соответствует очищенному [Ser17] hG-CSF. Как показано на фиг.10b, молекулярная масса [Ser17] hG-CSF аналогична молекулярной массе hG-CSF дикого типа и раствор трансформанта Е. coli НМ 10411 в периплазме характеризуется высоким содержанием [Ser17] hG-CSF.
Кроме того, производят определение N-концевых аминокислотных последовательностей разных hG-CSF и нуклеотидных последовательностей, кодирующих с 1-ой по 32-ую аминокислоты, полученные с использованием трансформантов НМ 10311, НМ 10409, НМ 10411, НМ 10413, НМ 10414, НМ 10415, НМ 10510 и НМ 10512, приведенных соответственно в SEQ ID NOS: 56, 58, 60, 62, 64, 66, 68 и 70. Полученный результат показывает, что модифицированный hG-CSF по настоящему изобретению не имеет остатка метионина у N-конца.
Нитроцеллюлозный фильтр (Bio-Rad Lab., США) смачивают буферным раствором для блоттинга (170 мМ глицина, 25 мМ трис HCl (рН 8), 20% метанола) и белки, отделенные на геле, анализируют методом вестерн-блоттинга на нитроцеллюлозном фильтре (Bio-Rad Lab., США) в течение 3 часов. Фильтр выдерживают в 1% казеине в течение 1 часа и трижды промывают PBS, содержащим 0,05% Tween 20. Фильтр помещают в раствор козьего анти-G-CSF антитела (R&D System, AB-214-NA, США), разведенный PBS, и подвергают взаимодействию при комнатной температуре в течение 2 часов. После окончания реакции фильтр трижды промывают раствором PBST, чтобы удалить непрореагировавшее антитело. Добавляют конъюгированный с пероксидазой хрена кроличьего антикозьего IgG(Bio-Rad Lab., США), разведенный PBS, и подвергают взаимодействию при комнатной температуре в течение 2 часов. Фильтр промывают PBST и добавляют раствор пероксидазы из набора веществ (Bio-Rad Lab., США) для осуществления окрашивания. Результаты вышеописанного вестерн-блоттинга приведены на фиг.10b, где дорожка 1 соответствует положительному контролю, Met-G-CSF, и дорожка 2 соответствует очищенному [Ser17] hG-CSF. Как показано на фиг.10b, молекулярная масса [Ser17] hG-CSF равна молекулярной массе hG-CSF дикого типа.
Пример 10. Клеточная активность hG-CSF и модифицированного hG-CSF
Линию клеток HL-60 (ATCC CCL-240, полученную из костного мозга белой 36-летней женщины, страдающей промиелоцитарным лейкозом) культивируют в среде RPMI 1640, содержащей 10% фетальной телячьей сыворотки, доводят до 2,2 105 клеток/мл и добавляют DMSO (диметилсульфоксид, со степенью чистоты для культивирования/SIGMA) до концентрации 1,25% (об./об.). В 96-луночный планшет (Corning/96-луночный планшет с низкой степенью испарения) добавляют 90 мкл полученного раствора в количестве 2 105 клеток/мл и добавляют DMSO (диметилсульфоксид, со степенью чистоты для культивирования/SIGMA) до концентрации 1,25% (об./об.). В 96-луночный планшет (Corning/96-луночный планшет с низкой степенью испарения) добавляют 90 мкл полученного раствора в количестве 2 104 клеток/лунку и инкубируют при 37 104 клеток/лунку и инкубируют при 37 С и 5% СО2 в течение 48 часов.
Все модифицированные [Ala17] hG-CSF, [Gly17] hG-CSF, [Ser17] hG-CSF и [Thr17] hG-CSF разводят в средах RPMI 1640 до концентрации 500 нг/мл и 10 раз последовательно разводят двукратным количеством среды RPMI 1640.
Полученный раствор добавляют в лунки в количестве 10 мкл/лунку и инкубируют при 37 С и 5% СО2 в течение 48 часов.
Все модифицированные [Ala17] hG-CSF, [Gly17] hG-CSF, [Ser17] hG-CSF и [Thr17] hG-CSF разводят в средах RPMI 1640 до концентрации 500 нг/мл и 10 раз последовательно разводят двукратным количеством среды RPMI 1640.
Полученный раствор добавляют в лунки в количестве 10 мкл/лунку и инкубируют при 37 С в течение 48 часов. В качестве положительного контроля используют коммерчески доступный hG-CSF (Jeil Pharmaceutical).
Увеличенную концентрацию линии клеток определяют, используя коммерчески доступный титр клеток CellTiter96 С в течение 48 часов. В качестве положительного контроля используют коммерчески доступный hG-CSF (Jeil Pharmaceutical).
Увеличенную концентрацию линии клеток определяют, используя коммерчески доступный титр клеток CellTiter96 (№ по каталогу G4100, Promega), на основании измеренной оптической плотности при 670 нм.
Как показано на фиг.11, клеточная активность модифицированных hG-CSF аналогична или выше, чем у положительного контрольного вещества, hG-CSF дикого типа.
Очевидно, что помимо описанных и проиллюстрированных вариантов осуществления данного изобретения возможны разные изменения и модификации в пределах настоящего изобретения, которые ограничиваются только объемом прилагаемой формулы изобретения.
Будапештский договор о международном признании регистрации микроорганизмов при проведении патентной экспертизы приведен в конце описания.
Список последовательностей приведен в конце описания. (№ по каталогу G4100, Promega), на основании измеренной оптической плотности при 670 нм.
Как показано на фиг.11, клеточная активность модифицированных hG-CSF аналогична или выше, чем у положительного контрольного вещества, hG-CSF дикого типа.
Очевидно, что помимо описанных и проиллюстрированных вариантов осуществления данного изобретения возможны разные изменения и модификации в пределах настоящего изобретения, которые ограничиваются только объемом прилагаемой формулы изобретения.
Будапештский договор о международном признании регистрации микроорганизмов при проведении патентной экспертизы приведен в конце описания.
Список последовательностей приведен в конце описания.
Формула изобретения 1. Модифицированный колониестимулирующий фактор гранулоцитов человека (hG-CSF), аминокислотная последовательность которого соответствует таковой дикого типа (SEQ ID NO:2), за исключением того, что (а) 1-я аминокислота является Ser; (b) 1-я аминокислота является Ser и 17-я аминокислота является Ser; (с) 2-я аминокислота является Met и 3-я аминокислота является Val; (d) 2-я аминокислота является Met, 3-я аминокислота является Val и 17-я аминокислота является Ser; или (f) 17-я аминокислота является Thr. 2. ДНК, кодирующая модифицированный hG-CSF, имеющая нуклеотидную последовательность, определяющую аминокислотную последовательность модифицированного hG-CSF по п.1. 3. ДНК по п.2, отличающаяся тем, что нуклеотидная последовательность 1-60 ДНК модифицированного hG-CSF соответствует нуклеотидной последовательности, выбираемой из группы, состоящей из SEQ ID NO:55, 57, 61, 67 и 69. 4. Экспрессирующий вектор для Е.coli, содержащий ДНК по п.2, и полинуклеотид, кодирующий сигнальный пептид, выбранный из группы, состоящей из сигнального пептида терморезистентного энтеротоксина II Е.coli, модифицированного сигнального пептида терморезистентного энтеротоксина II Е.coli, сигнального пептида бета-лактамазы Е.coli, модифицированного сигнального пептида бета-лактамазы Е.coli, сигнального пептида Gene III Е.coli или модифицированного сигнального пептида Gene III Е.coli, присоединенный по 5’-концу к ДНК, кодирующей модифицированный hG-CSF. 5. Экспрессирующий вектор по п.4, отличающийся тем, что сигнальный пептид терморезистентного энтеротоксина II Е.coli имеет аминокислотную последовательность SEQ ID NO:53. 6. Экспрессирующий вектор по п.4, отличающийся тем, что модифицированный сигнальный пептид терморезистентного энтеротоксина II Е.coli имеет аминокислотную последовательность SEQ ID NO:54. 7. Экспрессирующий вектор по п.4, отличающийся тем, что дополнительно включает модифицированную последовательность Шайна-Дальгарно энтеротоксина II Е.coli, имеющую нуклеотидную последовательность SEQ ID NO:71. 8. Экспрессирующий вектор по п.4, отличающийся тем, что сигнальный пептид бета-лактамазы Е.coli имеет аминокислотную последовательность SEQ ID NO:24. 9. Экспрессирующий вектор по п.4, отличающийся тем, что сигнальный пептид Gene III Е.coli имеет аминокислотную последовательность SEQ ID NO:42. 10. Экспрессирующий вектор по п.4, отличающийся тем, что представляет собой pT14SS1SG, pT14SS1S17SEG, pTО1SG, pTО1S17SG, pTО17SG или pBAD2M3V17SG. 11. Экспрессирующий вектор по п.4, отличающийся тем, что его используют для встраивания в микроорганизм. 12. Экспрессирующий вектор по п.11, отличающийся тем, что указанный микроорганизм представляет собой трансформированную Е.coli. 13. Экспрессирующий вектор по п.12, отличающийся тем, что трансформированная Е.coli представляет собой Е.coli BL21(DE3)/pT14SS1SG(HM 10310), Е.coli BL21 (DE3)/pT14SS1S17SEG(HM 10311, КССМ-10154), Е.coli BL21(DE3)/pTО1SG (HM 10409), Е.coli ВL21 (DE3)/pTО1S17SG (HM 10410, КССМ-10151), Е.coli BL21(DE3)/pTО17SG (HM 10411, КССМ-10152), Е.coli ВL21 (DE3)/pTO17TG (HM 10413), Е. coli BL21 (DE3)/pTО17AG (НМ 10414), Е.coli BL21 (DE3)/pTО17GG (НМ 10415), Е.coli ВL21 (DE3)/pBAD2M3VG (НМ 10510, КССМ-10153), Е.coli ВL21(DE3)/pBAD17SG (НМ 10511) или Е.coli ВL21 (DE3)/pBAD2M3V17SG (НМ 10512). 14. Способ получения модифицированного hG-CSF в микроорганизме, включающий культивирование микроорганизма, трансформированного вектором по п.4, с получением и секрецией в периплазму модифицированного hG-CSF. РИСУНКИ
|
||||||||||||||||||||||||||
