Патент на изобретение №2228928
|
||||||||||||||||||||||||||
(54) СОЕДИНЕНИЕ, СПОСОБ ЕГО ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ
(57) Реферат: Изобретение относится к соединениям формулы I – аналогам витамина D, в которой R представляет (C1-C6)-алкил или (С7-С9)аралкил, необязательно замещенный одной или более группами, выбранными из (C1-С3) алкила, F и фенила; n равно целому числу 0, 1 или 2; а Х представляет гидроксил или галоген, а также любые возможные диастереоизомеры формулы I или их смесь. Соединение I проявляет сильную активность при индуцировании дифференциации и ингибировании нежелательной пролиферации клеток кожи и раковых клеток, а также при иммуномодулировании и противовоспалительном действии. 3 с. и 6 з.п.ф-лы, 7 табл. 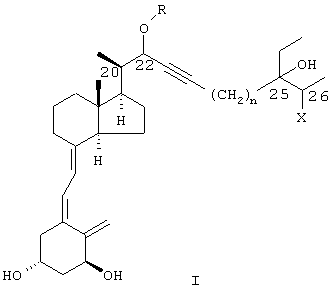 Область изобретения
Изобретение относится к неизвестному до сих пор классу соединений, проявляющих сильную активность при индуцировании дифференциации и ингибировании нежелательной пролиферации определенных клеток, включая клетки кожи и раковые клетки, а также иммуномодулировании и противовоспалительном действии; к фармацевтическим препаратам, содержащим указанные соединения, к единичным дозировкам таких препаратов и к их применению для лечения и/или профилактики заболеваний, характеризуемых аномальной дифференциацией и/или пролиферацией клеток.
Предпосылки изобретения
Описан ряд аналогов витамина D, проявляющих некоторую степень селективности по отношению к индуцированию дифференциации клеток/ингибирующей активности пролиферации клеток in vitro по сравнению с действием на метаболизм кальция in vivo (определяемым при повышенной концентрации кальция в сыворотке и/или повышенном выделении кальция с мочой), неблагоприятно ограничивающими дозу, которая может быть безопасно введена пациентам. Одним из первых таких препаратов является кальципотриол (INN) или кальципотриен (USAN), разработанный на основе указанной селективности и признанный во всем мире как эффективный и безопасный лекарственный препарат для местного лечения псориаза.
Исследование другого аналога витамина D, сеокальцитола, выбранного на таком же основании, поддерживает идею о том, что систематически вводимые аналоги витамина D могут ингибировать пролиферацию клеток при раке молочной железы in vivo при субтоксических дозах (Colston K.W. et al., Biochem. Pharmacol., 44, 2273-2280 (1992)).
Другой аналог витамина D, CB1093 (20-эпи-22-этокси-23-ин-24а, 26а, 27а, трисгомо-1
Область изобретения
Изобретение относится к неизвестному до сих пор классу соединений, проявляющих сильную активность при индуцировании дифференциации и ингибировании нежелательной пролиферации определенных клеток, включая клетки кожи и раковые клетки, а также иммуномодулировании и противовоспалительном действии; к фармацевтическим препаратам, содержащим указанные соединения, к единичным дозировкам таких препаратов и к их применению для лечения и/или профилактики заболеваний, характеризуемых аномальной дифференциацией и/или пролиферацией клеток.
Предпосылки изобретения
Описан ряд аналогов витамина D, проявляющих некоторую степень селективности по отношению к индуцированию дифференциации клеток/ингибирующей активности пролиферации клеток in vitro по сравнению с действием на метаболизм кальция in vivo (определяемым при повышенной концентрации кальция в сыворотке и/или повышенном выделении кальция с мочой), неблагоприятно ограничивающими дозу, которая может быть безопасно введена пациентам. Одним из первых таких препаратов является кальципотриол (INN) или кальципотриен (USAN), разработанный на основе указанной селективности и признанный во всем мире как эффективный и безопасный лекарственный препарат для местного лечения псориаза.
Исследование другого аналога витамина D, сеокальцитола, выбранного на таком же основании, поддерживает идею о том, что систематически вводимые аналоги витамина D могут ингибировать пролиферацию клеток при раке молочной железы in vivo при субтоксических дозах (Colston K.W. et al., Biochem. Pharmacol., 44, 2273-2280 (1992)).
Другой аналог витамина D, CB1093 (20-эпи-22-этокси-23-ин-24а, 26а, 27а, трисгомо-1 , 25(ОН)2О3 витамин D3) (Calverley M.J. et al., In: Vitamin D, Proceedings of the Ninth Workshop on Vitamin D, Oriando, Florida, Walter de Gruyter, Berlin, 1994, pp.85-86; и описан в WO 93/19044), продемонстрировал высокую активность при исследовании in vitro по ингибированию инвазивности клеток карциномы человека (Hansen C.M. et al., In: Vitamin D, Proceedings of the Ninth Workshop on Vitamin D, Oriando, Florida, Walter de Gruyter, Berlin, 1994, pp.508-509).
CB1093 также продемонстрировал сильное ингибирующее действие на пролиферацию и стимулирующее действие на дифференциацию и апоптоз различных видов раковых клеток, таких как глиальные опухолевые клетки мозга in vitro (Baudet С. et al., Cancer Lett., 1996, 100, 3); клетки рака молочной железы MCF-7 – in vitro и in vivo (Colston K.W. et al., In: Vitamin D, Proceedings of the Tenth Workshop on Vitamin D, Strasbourg, France, 1997, University of California, Riverside, 1997, pp.443-450; Danielsson C. et al., In: Vitamin D, Proceedings of the Tenth Workshop on Vitamin D, Strasbourg, France, 1997, University of California, Riverside, 1997, pp.485-486; Danielsson C. et al., J. Cellular Biochem., 1997, 66, 552); клетки острого промиелоцитарного лейкоза NB4 in vitro (Elstner Е., et al., J. Clin. Invest., 1997, 99, 349); HL-60 и новые клетки острого миелоидного лейкоза человека in vitro (Pakkala I. et al., Blood, 1995, 86 (10 Suppl.), 775a; Pakkala I. et al., Leukemia Research, 1997, 21, 321); и клетки остеосаркомы человека MG-63 in vitro ( , 25(ОН)2О3 витамин D3) (Calverley M.J. et al., In: Vitamin D, Proceedings of the Ninth Workshop on Vitamin D, Oriando, Florida, Walter de Gruyter, Berlin, 1994, pp.85-86; и описан в WO 93/19044), продемонстрировал высокую активность при исследовании in vitro по ингибированию инвазивности клеток карциномы человека (Hansen C.M. et al., In: Vitamin D, Proceedings of the Ninth Workshop on Vitamin D, Oriando, Florida, Walter de Gruyter, Berlin, 1994, pp.508-509).
CB1093 также продемонстрировал сильное ингибирующее действие на пролиферацию и стимулирующее действие на дифференциацию и апоптоз различных видов раковых клеток, таких как глиальные опухолевые клетки мозга in vitro (Baudet С. et al., Cancer Lett., 1996, 100, 3); клетки рака молочной железы MCF-7 – in vitro и in vivo (Colston K.W. et al., In: Vitamin D, Proceedings of the Tenth Workshop on Vitamin D, Strasbourg, France, 1997, University of California, Riverside, 1997, pp.443-450; Danielsson C. et al., In: Vitamin D, Proceedings of the Tenth Workshop on Vitamin D, Strasbourg, France, 1997, University of California, Riverside, 1997, pp.485-486; Danielsson C. et al., J. Cellular Biochem., 1997, 66, 552); клетки острого промиелоцитарного лейкоза NB4 in vitro (Elstner Е., et al., J. Clin. Invest., 1997, 99, 349); HL-60 и новые клетки острого миелоидного лейкоза человека in vitro (Pakkala I. et al., Blood, 1995, 86 (10 Suppl.), 775a; Pakkala I. et al., Leukemia Research, 1997, 21, 321); и клетки остеосаркомы человека MG-63 in vitro ( S. et al., J. Cellular Biochem., 1998, 70, 414).
CB1093 также существенно снижает уровень РТН (паратиреоидные гормоны) и фосфата в плазме хронически уремических крыс с вторичным гиперпаратиреоидизмом (Hruby М. et al., Nephrol. Dial.Transplant., 1966, 11, 1781).
Было установлено, что классическая кальцемическая витамина D активность вещества CB1093, определяемая при помощи выделения кальция с мочой у крыс, составляет до 27% активности 1 S. et al., J. Cellular Biochem., 1998, 70, 414).
CB1093 также существенно снижает уровень РТН (паратиреоидные гормоны) и фосфата в плазме хронически уремических крыс с вторичным гиперпаратиреоидизмом (Hruby М. et al., Nephrol. Dial.Transplant., 1966, 11, 1781).
Было установлено, что классическая кальцемическая витамина D активность вещества CB1093, определяемая при помощи выделения кальция с мочой у крыс, составляет до 27% активности 1 , 25(ОН)2О3, а кальцемическая активность сеокальцитола в этом же исследовании составляет до 50% (Danielsson С. et al., J. Cellular Biochem., 1997, 66, 552). В эксперименте in vivo no обработке у крыс опухоли молочной железы с применением CB1093 (1 мкг/кг массы тела в течение 28 дней) наблюдается 49% снижение начального объема опухоли, однако все еще имеется небольшое повышение концентрации кальция в сыворотке (там же). Это означает, что терапевтическое окно может все еще оставаться довольно узким и что нельзя исключить проблему возможного индуцируемого повышения уровня кальция в сыворотке.
Другой проблемой при использовании аналогов витамина D для неместного лечения гиперпролиферативных заболеваний, таких как рак, является метаболическая стабильность in vivo. Такая стабильность должна быть выше определенного минимального уровня для соединения, применяемого для практического лечения. Как показано в таблице 2, стабильность СВ1093 на модели метаболической стабильности in vitro с применением гомогената печени крысы “S-9” (Kissmeyer, A.M. et al., Biochem. Pharmacol., 1997, 53, 1087) является довольно низкой по сравнению с сеокальцитолом (Т1/2 1,3 час) и 1 , 25(ОН)2О3, а кальцемическая активность сеокальцитола в этом же исследовании составляет до 50% (Danielsson С. et al., J. Cellular Biochem., 1997, 66, 552). В эксперименте in vivo no обработке у крыс опухоли молочной железы с применением CB1093 (1 мкг/кг массы тела в течение 28 дней) наблюдается 49% снижение начального объема опухоли, однако все еще имеется небольшое повышение концентрации кальция в сыворотке (там же). Это означает, что терапевтическое окно может все еще оставаться довольно узким и что нельзя исключить проблему возможного индуцируемого повышения уровня кальция в сыворотке.
Другой проблемой при использовании аналогов витамина D для неместного лечения гиперпролиферативных заболеваний, таких как рак, является метаболическая стабильность in vivo. Такая стабильность должна быть выше определенного минимального уровня для соединения, применяемого для практического лечения. Как показано в таблице 2, стабильность СВ1093 на модели метаболической стабильности in vitro с применением гомогената печени крысы “S-9” (Kissmeyer, A.M. et al., Biochem. Pharmacol., 1997, 53, 1087) является довольно низкой по сравнению с сеокальцитолом (Т1/2 1,3 час) и 1 ,25(ОН)2О3 (Т1/2 2,5 час).
Поэтому сохраняется потребность в новых аналогах витамина D с высокой противоклеточной пролиферативной и/или индуцирующей клеточную дифференциацию активностью, имеющих приемлемое сочетание пролонгированной терапевтической активности и минимального токсического действия по сравнению с 1 ,25(ОН)2О3 (Т1/2 2,5 час).
Поэтому сохраняется потребность в новых аналогах витамина D с высокой противоклеточной пролиферативной и/или индуцирующей клеточную дифференциацию активностью, имеющих приемлемое сочетание пролонгированной терапевтической активности и минимального токсического действия по сравнению с 1 , 25(ОН)2D3. Целью настоящего изобретения является разработка таких новых соединений, достигаемая при помощи новых соединений, имеющих приведенную ниже формулу I.
Краткое описание изобретения
Соединения данного изобретения составляют новый класс аналогов витамина D, представленный общей формулой I: , 25(ОН)2D3. Целью настоящего изобретения является разработка таких новых соединений, достигаемая при помощи новых соединений, имеющих приведенную ниже формулу I.
Краткое описание изобретения
Соединения данного изобретения составляют новый класс аналогов витамина D, представленный общей формулой I:
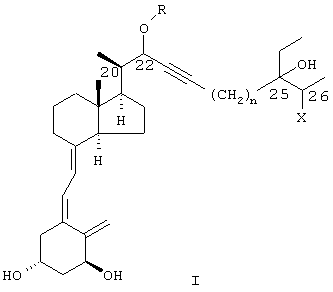 в которой R представляет водород или (C1-C6) алкил, фенил или (С7-С9) аралкил, необязательно замещенный одним или более (C1-С3) алкилами, F или фенилами; n равно целому числу 0, 1 или 2; а Х представляет гидроксил или галоген.
Подробное описание изобретения
Предпочтительные варианты осуществления данного изобретения
Предпочтительные соединения формулы I включают соединения, в которых R представляет метил, этил, пропил, изопропил, бензил и орто-метилбензил, мета-метилбензил и параметилбензил. Более предпочтительно R представляет метил или этил; n предпочтительно равно 0 или 1, наиболее предпочтительно 1. Х предпочтительно представляет ОН, F или Сl. Наиболее предпочтительно Х представляет F, либо Х наиболее предпочтительно представляет ОН или Сl.
Соединения данного изобретения могут иметь более одной диастереоизомерной формы; т.е. как R-, так и S-конфигурации у атомов углерода, обозначенных как 22, 25 и 26 в формуле I. Данное изобретение включает все указанные диастереоизомеры в чистом виде, а также в виде их смесей. Предпочтительными изомерами являются соединения, имеющие конфигурации 22(3), 25(3), 26(3) и 22(3), 25(3), 26(R). Кроме того, также могут быть включены пролекарства соединений формулы I, в которой одна или более гидроксильных групп защищены в виде групп, которые вновь могут быть превращены в гидроксильные группы in vivo.
Соединения I могут быть получены в кристаллическом виде либо непосредственно путем концентрирования из органического растворителя, либо путем кристаллизации или перекристаллизации из органического растворителя или смеси указанного растворителя и сорастворителя, который может быть органическим или неорганическим, таким как вода. Кристаллы могут быть выделены в по существу свободном от растворителя виде или в виде сольвата, такого как гидрат. Данное изобретение включает все кристаллические модификации и формы, а также их смеси.
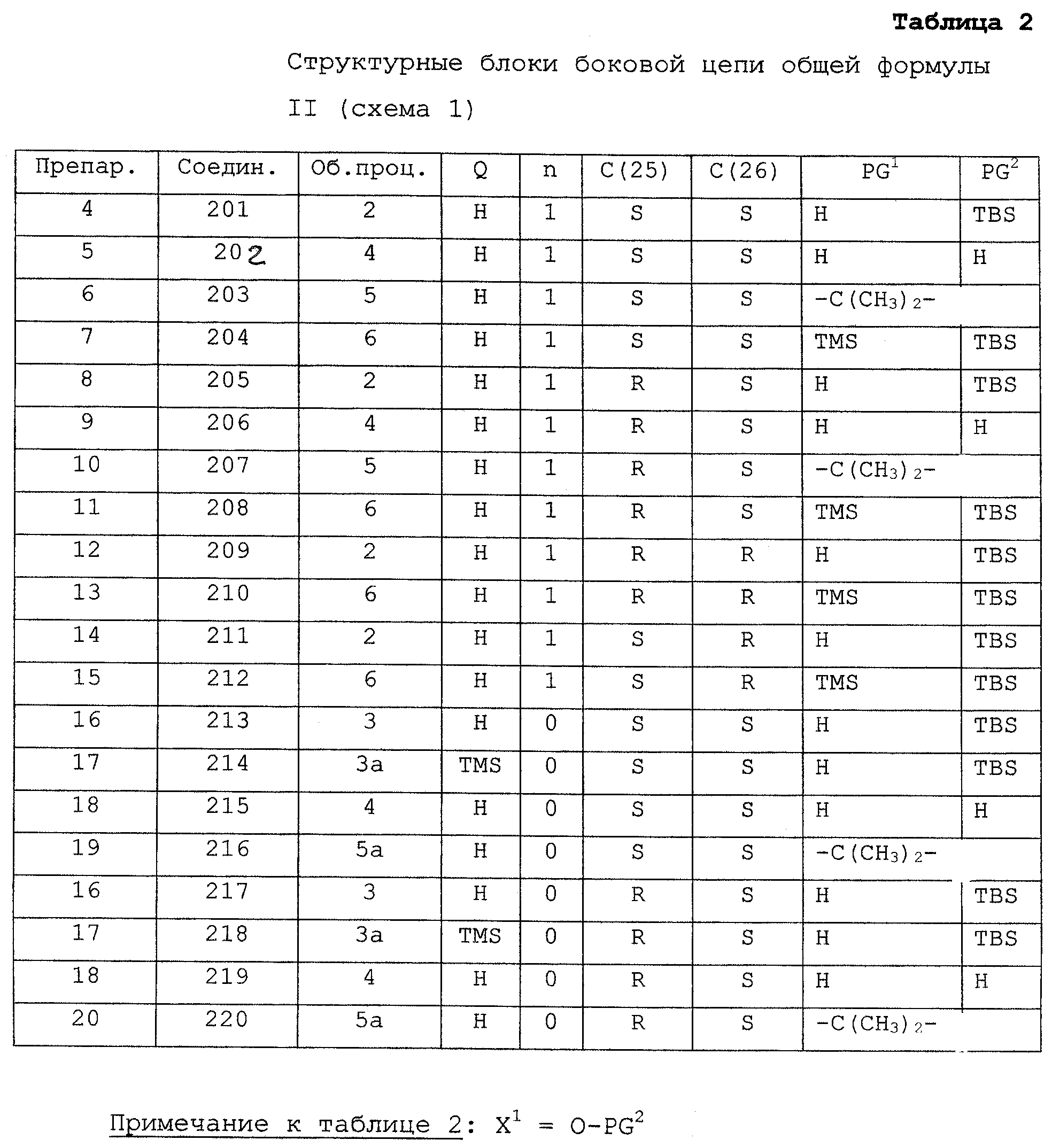
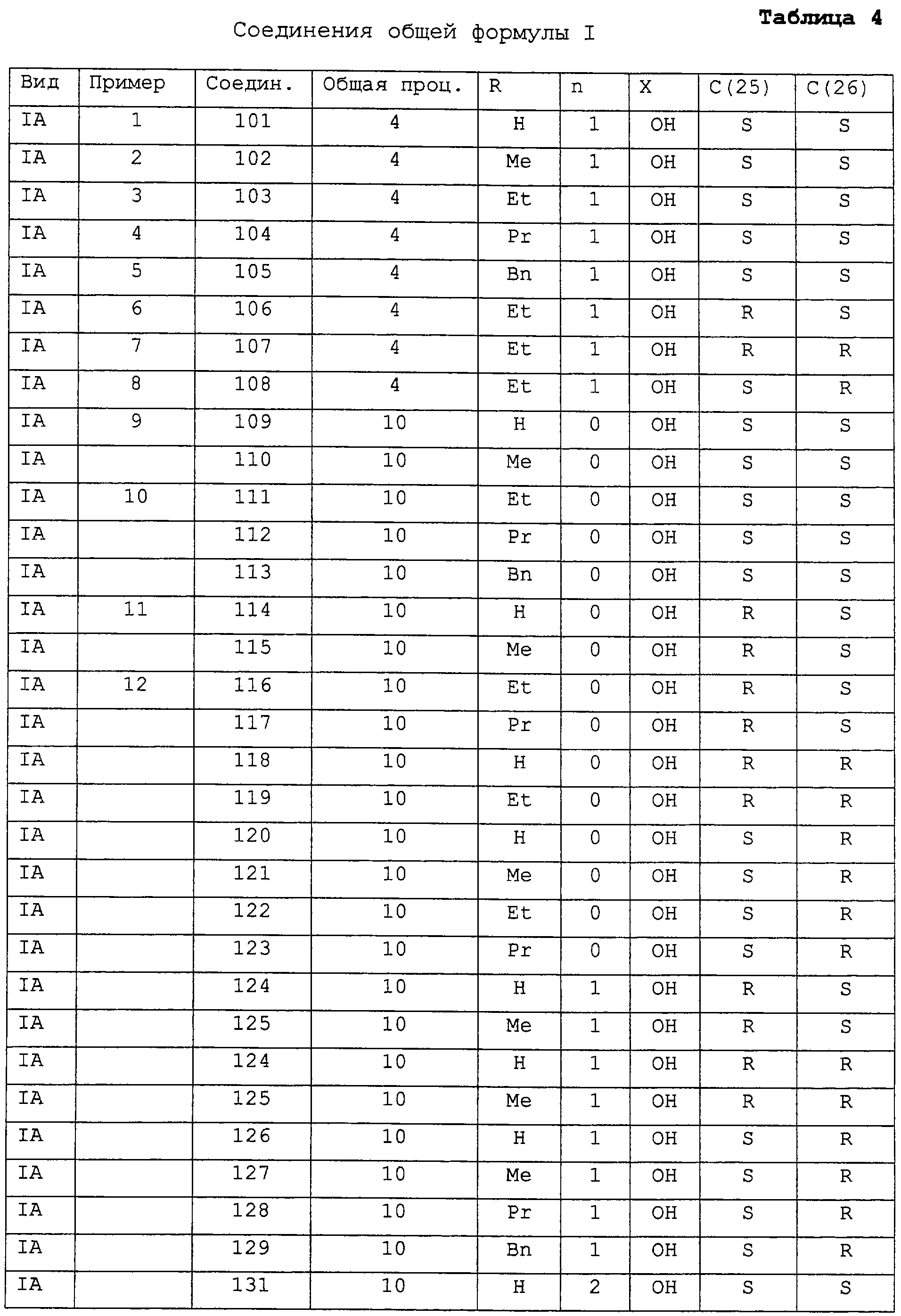
Примеры соединений в соответствии с данным изобретением включают:
1(S),3(R)-дигидрокси-20(R)-(5-этил-1(S),5(S),6(S)-тригидрокси-2-гептин-1-ил)-9,10-секопрегна-5(Z),7(E),10(19)-триен (соединение 101),
1(S),3(R)-дигидрокси-20(R)-(5(S),6(S)-дигидрокси-5-этил-1(S)-метокси-2-гептин-1-ил)-9,10-секопрегна-5(Z),7(Е),10(19)-триен (соединение 102),
1(S),3(R)-дигидрокси-20(R)-(5(S),6(S)-дигидрокси-1(S)-этокси-5-этил-2-гептин-1-ил)-9,10-секопрегна-5(Z),7(E),10(19)-триен (соединение 103),
1(S),3(R)-дигидрокси-20(R)-(5(S),6(S)-дигидрокси-5-этил-1(S)-(1-пропилокси)-2-гептин-1-ил)-9,10-секопрегна-5(Z),7(Е),-10(19)-триен (соединение 104),
1(S),3(R)-дигидрокси-20(R)-(1(S)-бензилилокси-5(S),6(S)-дигидрокси-5-этил-2-гептин-1-ил)-9,10-секопрегна-5(Z),7(Е),10(19)-триен (соединение 105),
1(S),3(R)-дигидрокси-20(R)-(5(R),6(S)-дигидрокси-1(S)-этокси-5-этил-2-гептин-1-ил)-9,10-секопрегна-5(Z),7(Е),10(19)-триен (соединение 106),
1(S),3(R)-дигидрокси-20(R)-(5(R),6(R)-дигидрокси-1(S)-этокси-5-этил-2-гептин-1-ил)-9,10-секопрегна-5(Z),7(Е),10(19)-триен (соединение 107),
1(S),3(R)-дигидрокси-20(R)-(5(S),6(R)-дигидрокси-1(S)-этокси-5-этил-2-гептин-1-ил)-9,10-секопрегна-5(Z),7(Е),10(19)-триен (соединение 108),
(S),3(R)-дигидрокси-20(R)-(4-этил-1(S),4(S),5(S)-тригидрокси-2-гексин-1-ил)-9,10-секопрегна-5(Z),7(Е),10(19)-триен (соединение 109),
(S),3(R)-дигидрокси-20(R)-(4(S),5(S)-дигидрокси-1(S)-этокси-4-этил-2-гексин-1-ил)-9,10-секопрегна-5(Z),7(Е),10(19)-триен (соединение 111),
1(S),3(R)-дигидрокси-20(R)-(4-этил-1(S),4(R),5(S)-тригидрокси-2-гексин-1-ил)-9,10-секопрегна-5(Z),7(E),10(19)-триен (соединение 114),
1(S),3(R)-дигидрокси-20(R)-(4(R),5(S)-дигидрокси-1(S)-этокси-4-этил-2-гексин-1-ил)-9,10-секопрегна-5(Z),7(E),10(19)-триен (соединение 116),
1(S),3(R)-дигидрокси-20(R)-(1(S)-этокси-5-этил-6(S)-фтор-5(S)-гидрокси-2-гептин-1-ил)-9,10-секопрегна-5(Z),7(Е),10(19)-триен (соединение 149),
1(S),3(R)-дигидрокси-20(R)-(1(S)-этокси-5-этил-6(R)-фтор-5(S)-гидрокси-2-гептин-1-ил)-9,10-секопрегна-5(Z),7(Е),10(19)-триен (соединение 150),
1(S),3(R)-дигидрокси-20(R)-(1(S),5(R/S)-дигидрокси-5-этил-6(S)-фтор-2-гептин-1-ил)-9,10-секопрегна-5(Z),7(Е),10(19)-триен (соединение 157),
1(S),3(R)-дигидрокси-20(R)-(1(S)-этокси-5-этил-6(S)-фтор-2-гептин-5(R/S)-гидрокси-1-ил)-9,10-секопрегна-5(Z),7(Е),10(19)-триен (соединение 158),
1(S),3(R)-дигидрокси-20(R)-(1(S),5(R/S)-дигидрокси-5-этил-6(R)-фтор-2-гептин-1-ил)-9,10-секопрегна-5(Z),7(Е),10(19)-триен (соединение 159),
1(S),3(R)-дигидрокси-20(R)-(1(S)-этокси-5-этил-6(R)-фтор-2-гептин-5(R/S)-гидрокси-1-ил)-9,10-секопрегна-5(Z),7(Е),10(19)-триен (соединение 160).
В данном описании указанные термины имеют следующие значения:
“Алкил” относится к любой одновалентной группе, получаемой из алкана путем удаления атома водорода от любого атома углерода, и включает подклассы нормального алкила (н-алкила), а также первичные, вторичные и третичные алкильные группы соответственно, имеющие указанное количество атомов углерода, включая, например, (C1-С3) алкил, (C1-С6) алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, н-пентил и н-гексил. “Алкан” относится к ациклическому прямому или разветвленному углеводороду, имеющему общую формулу СnН2n+2 и поэтому состоящему полностью из атомов водорода и насыщенных атомов углерода.
“(С7-С9)аралкил” относится к любой алкильной группе, замещенной ароматической группой, такой как фенил, и имеющей указанное общее количество атомов углерода; предпочтительными являются (C7-C8)аралкильные группы. Примеры включают бензил, 2-фенилэтил, орто-метилбензил, мета-метилбензил и параметилбензил.
“Галоген” означает одинаковые или различные фтор, хлор, бром и иод.
Настоящее изобретение предусматривает не описанную до сих пор серию аналогов витамина D, характеризующуюся наличием дополнительной гидроксильной группы или атома галогена в положении 26 боковой цепи. По сравнению с известными аналогами витамина D, такими как, например, СВ1093, описываемые новые аналоги витамина D обладают необходимыми свойствами (таблица 1): половинной и менее кальцемической активностью (на модели кальциурии у крыс) и гораздо более высокой метаболической стабильностью (на модели гомогената печени крыс S-9) наряду со всего лишь слегка пониженной антипролиферативной активностью (в двух различных исследованиях рака: исследование клеток лейкоза U937 (Kissmeyer A.-M. et al., Biochem. Pharmacol., 1997, 53, 1087) и исследование клеток рака молочной железы MCF-7 (Danielsson С. et al., J. Cellular Biochem., 1997, 66, 552). Более того, активность описываемых соединений I в исследовании НаСаТ, модели псориаза (Kissmeyer, A.M. et al., Biochem. Pharmacol., 1997, 53, 1087), несколько выше, чем активность СВ1093. Предпочтительные свойства 26-гидрокси- или 26-галоген-аналогов витамина D настоящего изобретения являются совершенно неожиданными, поскольку известно, что подобное введение 26-гидроксильной группы в сеокальцитол приводит к получению соединений с сильно пониженной активностью как в исследовании U937, так и НаСаТ. Было установлено, что все четыре возможных аналога 26-гидроксисеокальцитола являются природными метаболитами сеокальцитола in vitro и in vivo на крысах, а также in vitro на людях (Binderup E. et al., In: Vitamin D, Proceedings of the Tenth Workshop on Vitamin D, Strasbourg, France, 1997, University of California, Riverside, 1997, pp.80-90; Kissmeyer A.-M. et al., Biochem. Pharmacol., 1997, 53, 1087).
в которой R представляет водород или (C1-C6) алкил, фенил или (С7-С9) аралкил, необязательно замещенный одним или более (C1-С3) алкилами, F или фенилами; n равно целому числу 0, 1 или 2; а Х представляет гидроксил или галоген.
Подробное описание изобретения
Предпочтительные варианты осуществления данного изобретения
Предпочтительные соединения формулы I включают соединения, в которых R представляет метил, этил, пропил, изопропил, бензил и орто-метилбензил, мета-метилбензил и параметилбензил. Более предпочтительно R представляет метил или этил; n предпочтительно равно 0 или 1, наиболее предпочтительно 1. Х предпочтительно представляет ОН, F или Сl. Наиболее предпочтительно Х представляет F, либо Х наиболее предпочтительно представляет ОН или Сl.
Соединения данного изобретения могут иметь более одной диастереоизомерной формы; т.е. как R-, так и S-конфигурации у атомов углерода, обозначенных как 22, 25 и 26 в формуле I. Данное изобретение включает все указанные диастереоизомеры в чистом виде, а также в виде их смесей. Предпочтительными изомерами являются соединения, имеющие конфигурации 22(3), 25(3), 26(3) и 22(3), 25(3), 26(R). Кроме того, также могут быть включены пролекарства соединений формулы I, в которой одна или более гидроксильных групп защищены в виде групп, которые вновь могут быть превращены в гидроксильные группы in vivo.
Соединения I могут быть получены в кристаллическом виде либо непосредственно путем концентрирования из органического растворителя, либо путем кристаллизации или перекристаллизации из органического растворителя или смеси указанного растворителя и сорастворителя, который может быть органическим или неорганическим, таким как вода. Кристаллы могут быть выделены в по существу свободном от растворителя виде или в виде сольвата, такого как гидрат. Данное изобретение включает все кристаллические модификации и формы, а также их смеси.
Примеры соединений в соответствии с данным изобретением включают:
1(S),3(R)-дигидрокси-20(R)-(5-этил-1(S),5(S),6(S)-тригидрокси-2-гептин-1-ил)-9,10-секопрегна-5(Z),7(E),10(19)-триен (соединение 101),
1(S),3(R)-дигидрокси-20(R)-(5(S),6(S)-дигидрокси-5-этил-1(S)-метокси-2-гептин-1-ил)-9,10-секопрегна-5(Z),7(Е),10(19)-триен (соединение 102),
1(S),3(R)-дигидрокси-20(R)-(5(S),6(S)-дигидрокси-1(S)-этокси-5-этил-2-гептин-1-ил)-9,10-секопрегна-5(Z),7(E),10(19)-триен (соединение 103),
1(S),3(R)-дигидрокси-20(R)-(5(S),6(S)-дигидрокси-5-этил-1(S)-(1-пропилокси)-2-гептин-1-ил)-9,10-секопрегна-5(Z),7(Е),-10(19)-триен (соединение 104),
1(S),3(R)-дигидрокси-20(R)-(1(S)-бензилилокси-5(S),6(S)-дигидрокси-5-этил-2-гептин-1-ил)-9,10-секопрегна-5(Z),7(Е),10(19)-триен (соединение 105),
1(S),3(R)-дигидрокси-20(R)-(5(R),6(S)-дигидрокси-1(S)-этокси-5-этил-2-гептин-1-ил)-9,10-секопрегна-5(Z),7(Е),10(19)-триен (соединение 106),
1(S),3(R)-дигидрокси-20(R)-(5(R),6(R)-дигидрокси-1(S)-этокси-5-этил-2-гептин-1-ил)-9,10-секопрегна-5(Z),7(Е),10(19)-триен (соединение 107),
1(S),3(R)-дигидрокси-20(R)-(5(S),6(R)-дигидрокси-1(S)-этокси-5-этил-2-гептин-1-ил)-9,10-секопрегна-5(Z),7(Е),10(19)-триен (соединение 108),
(S),3(R)-дигидрокси-20(R)-(4-этил-1(S),4(S),5(S)-тригидрокси-2-гексин-1-ил)-9,10-секопрегна-5(Z),7(Е),10(19)-триен (соединение 109),
(S),3(R)-дигидрокси-20(R)-(4(S),5(S)-дигидрокси-1(S)-этокси-4-этил-2-гексин-1-ил)-9,10-секопрегна-5(Z),7(Е),10(19)-триен (соединение 111),
1(S),3(R)-дигидрокси-20(R)-(4-этил-1(S),4(R),5(S)-тригидрокси-2-гексин-1-ил)-9,10-секопрегна-5(Z),7(E),10(19)-триен (соединение 114),
1(S),3(R)-дигидрокси-20(R)-(4(R),5(S)-дигидрокси-1(S)-этокси-4-этил-2-гексин-1-ил)-9,10-секопрегна-5(Z),7(E),10(19)-триен (соединение 116),
1(S),3(R)-дигидрокси-20(R)-(1(S)-этокси-5-этил-6(S)-фтор-5(S)-гидрокси-2-гептин-1-ил)-9,10-секопрегна-5(Z),7(Е),10(19)-триен (соединение 149),
1(S),3(R)-дигидрокси-20(R)-(1(S)-этокси-5-этил-6(R)-фтор-5(S)-гидрокси-2-гептин-1-ил)-9,10-секопрегна-5(Z),7(Е),10(19)-триен (соединение 150),
1(S),3(R)-дигидрокси-20(R)-(1(S),5(R/S)-дигидрокси-5-этил-6(S)-фтор-2-гептин-1-ил)-9,10-секопрегна-5(Z),7(Е),10(19)-триен (соединение 157),
1(S),3(R)-дигидрокси-20(R)-(1(S)-этокси-5-этил-6(S)-фтор-2-гептин-5(R/S)-гидрокси-1-ил)-9,10-секопрегна-5(Z),7(Е),10(19)-триен (соединение 158),
1(S),3(R)-дигидрокси-20(R)-(1(S),5(R/S)-дигидрокси-5-этил-6(R)-фтор-2-гептин-1-ил)-9,10-секопрегна-5(Z),7(Е),10(19)-триен (соединение 159),
1(S),3(R)-дигидрокси-20(R)-(1(S)-этокси-5-этил-6(R)-фтор-2-гептин-5(R/S)-гидрокси-1-ил)-9,10-секопрегна-5(Z),7(Е),10(19)-триен (соединение 160).
В данном описании указанные термины имеют следующие значения:
“Алкил” относится к любой одновалентной группе, получаемой из алкана путем удаления атома водорода от любого атома углерода, и включает подклассы нормального алкила (н-алкила), а также первичные, вторичные и третичные алкильные группы соответственно, имеющие указанное количество атомов углерода, включая, например, (C1-С3) алкил, (C1-С6) алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, н-пентил и н-гексил. “Алкан” относится к ациклическому прямому или разветвленному углеводороду, имеющему общую формулу СnН2n+2 и поэтому состоящему полностью из атомов водорода и насыщенных атомов углерода.
“(С7-С9)аралкил” относится к любой алкильной группе, замещенной ароматической группой, такой как фенил, и имеющей указанное общее количество атомов углерода; предпочтительными являются (C7-C8)аралкильные группы. Примеры включают бензил, 2-фенилэтил, орто-метилбензил, мета-метилбензил и параметилбензил.
“Галоген” означает одинаковые или различные фтор, хлор, бром и иод.
Настоящее изобретение предусматривает не описанную до сих пор серию аналогов витамина D, характеризующуюся наличием дополнительной гидроксильной группы или атома галогена в положении 26 боковой цепи. По сравнению с известными аналогами витамина D, такими как, например, СВ1093, описываемые новые аналоги витамина D обладают необходимыми свойствами (таблица 1): половинной и менее кальцемической активностью (на модели кальциурии у крыс) и гораздо более высокой метаболической стабильностью (на модели гомогената печени крыс S-9) наряду со всего лишь слегка пониженной антипролиферативной активностью (в двух различных исследованиях рака: исследование клеток лейкоза U937 (Kissmeyer A.-M. et al., Biochem. Pharmacol., 1997, 53, 1087) и исследование клеток рака молочной железы MCF-7 (Danielsson С. et al., J. Cellular Biochem., 1997, 66, 552). Более того, активность описываемых соединений I в исследовании НаСаТ, модели псориаза (Kissmeyer, A.M. et al., Biochem. Pharmacol., 1997, 53, 1087), несколько выше, чем активность СВ1093. Предпочтительные свойства 26-гидрокси- или 26-галоген-аналогов витамина D настоящего изобретения являются совершенно неожиданными, поскольку известно, что подобное введение 26-гидроксильной группы в сеокальцитол приводит к получению соединений с сильно пониженной активностью как в исследовании U937, так и НаСаТ. Было установлено, что все четыре возможных аналога 26-гидроксисеокальцитола являются природными метаболитами сеокальцитола in vitro и in vivo на крысах, а также in vitro на людях (Binderup E. et al., In: Vitamin D, Proceedings of the Tenth Workshop on Vitamin D, Strasbourg, France, 1997, University of California, Riverside, 1997, pp.80-90; Kissmeyer A.-M. et al., Biochem. Pharmacol., 1997, 53, 1087).
 В данном описании использованы следующие стандартные сокращения:
АсОН – уксусная кислота
18С6 – 18-Краун-6
т.кип. – температура кипения
Вn – бензил
Bu – н-бутил
Соед. – соединение №
DMAP – 4-диметиламинопиридин
ДМФ – N,N-диметилформамид
Et – этил
EtOAc – этилацетат
Прим. – пример №
экв. – эквивалент (молярный)
эфир – диэтиловый эфир
об.проц. – общая процедура №
Hal – Сl, Вr или I
h – час
Me – метил
т.пл. – температура плавления
Ms – метансульфонат
PG – защитная группа
Ph – фенил
Рr – н-пропил
Преп. – препарат №
PPTS – п-толуолсульфонат пиридиния
Ру – пиридин
TBAF – фторид тетра-н-бутиламмония
TBS – трет-бутилдиметилсилил
Tf – трифторметансульфонил
ТГФ – тетрагидрофуран
ТНР – тетрагидро-4Н-пиран-2-ил
TMS – триметилсилил
Tol – толуол
Ts – 4-толуолсульфонил
Как показано в таблице 4, соединения формулы I могут быть получены с применением общего способа, представленного на схеме 1:
В данном описании использованы следующие стандартные сокращения:
АсОН – уксусная кислота
18С6 – 18-Краун-6
т.кип. – температура кипения
Вn – бензил
Bu – н-бутил
Соед. – соединение №
DMAP – 4-диметиламинопиридин
ДМФ – N,N-диметилформамид
Et – этил
EtOAc – этилацетат
Прим. – пример №
экв. – эквивалент (молярный)
эфир – диэтиловый эфир
об.проц. – общая процедура №
Hal – Сl, Вr или I
h – час
Me – метил
т.пл. – температура плавления
Ms – метансульфонат
PG – защитная группа
Ph – фенил
Рr – н-пропил
Преп. – препарат №
PPTS – п-толуолсульфонат пиридиния
Ру – пиридин
TBAF – фторид тетра-н-бутиламмония
TBS – трет-бутилдиметилсилил
Tf – трифторметансульфонил
ТГФ – тетрагидрофуран
ТНР – тетрагидро-4Н-пиран-2-ил
TMS – триметилсилил
Tol – толуол
Ts – 4-толуолсульфонил
Как показано в таблице 4, соединения формулы I могут быть получены с применением общего способа, представленного на схеме 1:
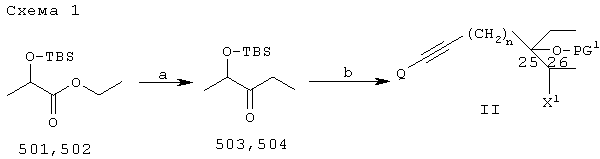
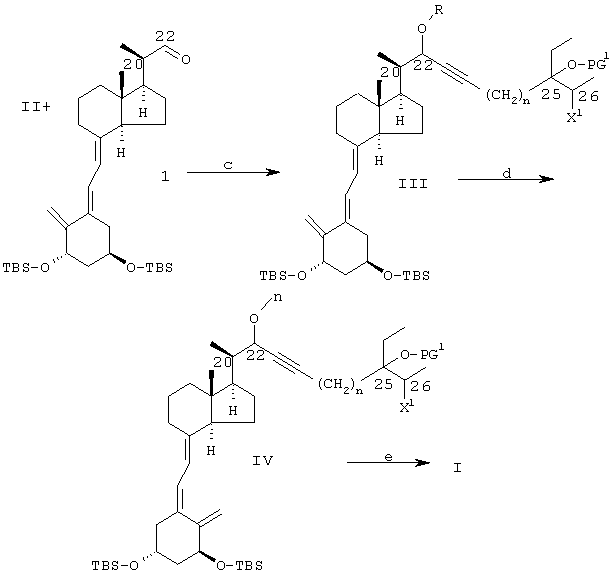 Примечания к схеме 1:
Общие: X1=O-PG2, F, Br или I
PG1 и PG2 = водород или защитные группы: одинаковые или различные, либо объединенная бифункциональная группа.
Q = Н или Ме3Si; n=1, 2 или 3.
(a) СН3МН-ОСН3, НСl; EtMgBr (3 экв.)
(b) i) Q-C
Примечания к схеме 1:
Общие: X1=O-PG2, F, Br или I
PG1 и PG2 = водород или защитные группы: одинаковые или различные, либо объединенная бифункциональная группа.
Q = Н или Ме3Si; n=1, 2 или 3.
(a) СН3МН-ОСН3, НСl; EtMgBr (3 экв.)
(b) i) Q-C C-(CH2)n-Met; (Met=-Li, -MgHal; -АlВr2, -Br+SmI2);
если требуется (только для Q=Н), чтобы PG1=TMS, а Х1=O-PG2=O-TBS, а Q=Н:
ii) Me3SiCl/Et3N/CH2Cl2/DMAP,
либо, если требуется, чтобы: PG1-PG2=-С(СН3)2-, т.е. X1=O-PG2(-PG1-), а Q=Н:
ii) TBAF/ТГФ ( C-(CH2)n-Met; (Met=-Li, -MgHal; -АlВr2, -Br+SmI2);
если требуется (только для Q=Н), чтобы PG1=TMS, а Х1=O-PG2=O-TBS, а Q=Н:
ii) Me3SiCl/Et3N/CH2Cl2/DMAP,
либо, если требуется, чтобы: PG1-PG2=-С(СН3)2-, т.е. X1=O-PG2(-PG1-), а Q=Н:
ii) TBAF/ТГФ ( PG1=PG2=Q=Н)
iii) СН2=С(СН3)-O-СН3 или (СН3)2С (ОСН3)2/TsOH
либо, если требуется, чтобы PG1=TMS, а X1=F:
соединения 509 или 510 (например, полученные в соответствии со схемой 1а) заменяют соединения 503 и 504 в схеме 1;
либо, если требуется, чтобы: PG1=TMS, X1=F, Cl, Вr или I, a Q=Н:
ii) TBAF/ТГФ ( PG1=PG2=Q=Н)
iii) СН2=С(СН3)-O-СН3 или (СН3)2С (ОСН3)2/TsOH
либо, если требуется, чтобы PG1=TMS, а X1=F:
соединения 509 или 510 (например, полученные в соответствии со схемой 1а) заменяют соединения 503 и 504 в схеме 1;
либо, если требуется, чтобы: PG1=TMS, X1=F, Cl, Вr или I, a Q=Н:
ii) TBAF/ТГФ ( PG1=PG2=Q=Н, т.е. X1=ОН)
iii) превращение X1 (=ОН) в X1=F, Cl, Вr или I, например, как показано на схеме 2;
iv) необязательно превращение PG1=Н в PG1=TMS, например с применением Me3SiCl/Et3N/CH2Cl2/DMAP
(c) i) II+BuLi;
ii) 1;
iii) необязательное алкилирование группы 22-ОН RZ/основанием (Z = легко отщепляемая группа, например Hal, Ms, Ts или Tf)
(d) i) сенсибилизированная триплетом фотоизомеризация триена витамина D, 5(6) (Е) в 5(6) (Z);
ii) необязательное алкилирование 22-ОН RZ/основанием
(e) i) снятие защиты с применением НF/СН3
TBAF/ТГФ, необязательно после или перед применением PPTS/EtOH.
Схема 1а PG1=PG2=Q=Н, т.е. X1=ОН)
iii) превращение X1 (=ОН) в X1=F, Cl, Вr или I, например, как показано на схеме 2;
iv) необязательно превращение PG1=Н в PG1=TMS, например с применением Me3SiCl/Et3N/CH2Cl2/DMAP
(c) i) II+BuLi;
ii) 1;
iii) необязательное алкилирование группы 22-ОН RZ/основанием (Z = легко отщепляемая группа, например Hal, Ms, Ts или Tf)
(d) i) сенсибилизированная триплетом фотоизомеризация триена витамина D, 5(6) (Е) в 5(6) (Z);
ii) необязательное алкилирование 22-ОН RZ/основанием
(e) i) снятие защиты с применением НF/СН3
TBAF/ТГФ, необязательно после или перед применением PPTS/EtOH.
Схема 1а
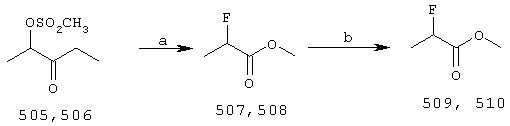 Примечания к схеме 1a;
(a) KF, HCONH2, 70
Примечания к схеме 1a;
(a) KF, HCONH2, 70 C (способ Fritz-Langhals E. et al., Tetr.Lett., 1993, 34, 293)
(b) СН3NН-ОСН3, НСl, EtMgBr (3 экв.)
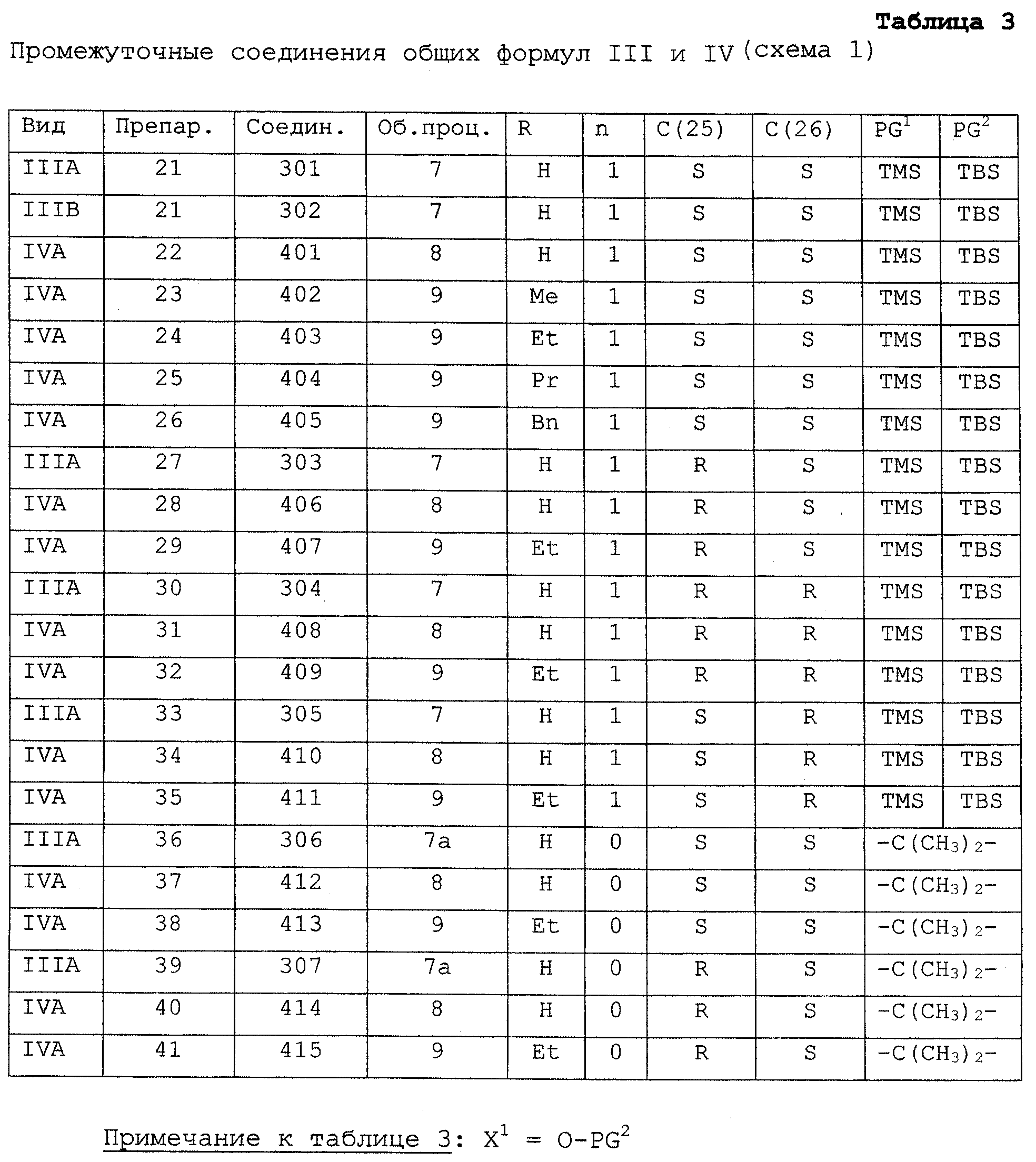
Соединения I могут быть получены из производного витамина D альдегидного соединения 1, синтез которого был описан (Calverley M.J., Tetrahedron, 1987, 43, 4609), например, способами, представленными на схеме 1, взаимодействием с металлоорганическим производным структурного блока боковой цепи общей формулы II.
Соединения II, применяемые для получения соединений I, в которых Х=ОН, могут быть синтезированы следующим образом:
L(-)этиллактат или D(+)этиллактат (либо соответствующий метиловый эфир) защищают силилированием с применением трет-бутилдиметилсилилхлорида, получая соответствующий этил-TBS-лактат (501, 502). Прямым способом с применением этилмагний-бромида его превращают в соответствующий этилкетон (503, 504) через промежуточные N-метокси-М-метиламиды способом, описанным Williams, J.M. et al., (Tetr.Lett., 1995, 36, 5461).
Кетон 503 или 504 превращают в частично защищенный синтон боковой цепи общей формулы II взаимодействием с металлоорганическим реагентом типа Q-C C (способ Fritz-Langhals E. et al., Tetr.Lett., 1993, 34, 293)
(b) СН3NН-ОСН3, НСl, EtMgBr (3 экв.)
Соединения I могут быть получены из производного витамина D альдегидного соединения 1, синтез которого был описан (Calverley M.J., Tetrahedron, 1987, 43, 4609), например, способами, представленными на схеме 1, взаимодействием с металлоорганическим производным структурного блока боковой цепи общей формулы II.
Соединения II, применяемые для получения соединений I, в которых Х=ОН, могут быть синтезированы следующим образом:
L(-)этиллактат или D(+)этиллактат (либо соответствующий метиловый эфир) защищают силилированием с применением трет-бутилдиметилсилилхлорида, получая соответствующий этил-TBS-лактат (501, 502). Прямым способом с применением этилмагний-бромида его превращают в соответствующий этилкетон (503, 504) через промежуточные N-метокси-М-метиламиды способом, описанным Williams, J.M. et al., (Tetr.Lett., 1995, 36, 5461).
Кетон 503 или 504 превращают в частично защищенный синтон боковой цепи общей формулы II взаимодействием с металлоорганическим реагентом типа Q-C C-(CH2)n-Met; (Met=-Li, -MgHal; -AlBr2; -Hal+например, SmI2; Q=H или Me3Si; n=1, 2 или 3). Если Q-C C-(CH2)n-Met; (Met=-Li, -MgHal; -AlBr2; -Hal+например, SmI2; Q=H или Me3Si; n=1, 2 или 3). Если Q-C C- (СН2)n-На1 + например, SmI2, то прибегают к реакции типа Barbier между галоидом, кетоном и металлом/солью металла.
Обычно используется смесь двух диастереоизомеров: R- и S-изомер у атома углерода, обозначенного как (25) на схеме 1, т.е. атома углерода, занимающего положение атома углерода С (25) в конечном соединении формулы I. При необходимости, на данном этапе два диастереоизомера могут быть разделены либо, если это более удобно, они могут быть разделены позднее, во время синтеза синтонов II боковых цепей.
Синтез полностью защищенных синтонов II боковых цепей включает следующие стадии: 1) если Q представляет триметилсилил, то его превращают в водород, снимая защиту, например, с помощью основания; 2) незащищенную гидроксильную группу у атома углерода, обозначенного цифрой (25), защищают, например, силилированием с применением TMS-Cl; таким образом, чтобы PG1=TMS (a PG2=TBS).
Альтернативно группа TBS (PG2) соединения II может быть удалена, например, с применением TBAF (если Q=TMS, то ее одновременно превращают в H). Две карбоксильные группы у атомов углерода, обозначенных цифрами (25) и (26) соответственно, затем могут быть защищены в результате одной стадии превращения в циклический ацеталь или кеталь, например ацетонид (изопропилиденкеталь), например с помощью 2-метоксипропена или 2,2-диметоксипропана и кислоты таким образом, чтобы PG1 и PG2 были связаны в одну группу: -С(СН3)2-. В литературе также описаны другие способы защиты 1,2-диолов, например Greene T.W. and Wuts P.G.M., Protective Groups in Organic Synthesis”, Sec. Ed., John Wiley and Sons, New York, 1991, pp.118-142. Преимуществом применения циклических ацеталей или кеталей, таких как ацетониды, в качестве защитных групп соединений II является то, что они особенно хорошо подходят для обеспечения стереохимии у углеродов (25) и (26) с применением ЯМР-спектроскопии с ядерным усилением по эффекту Оверхаузера.
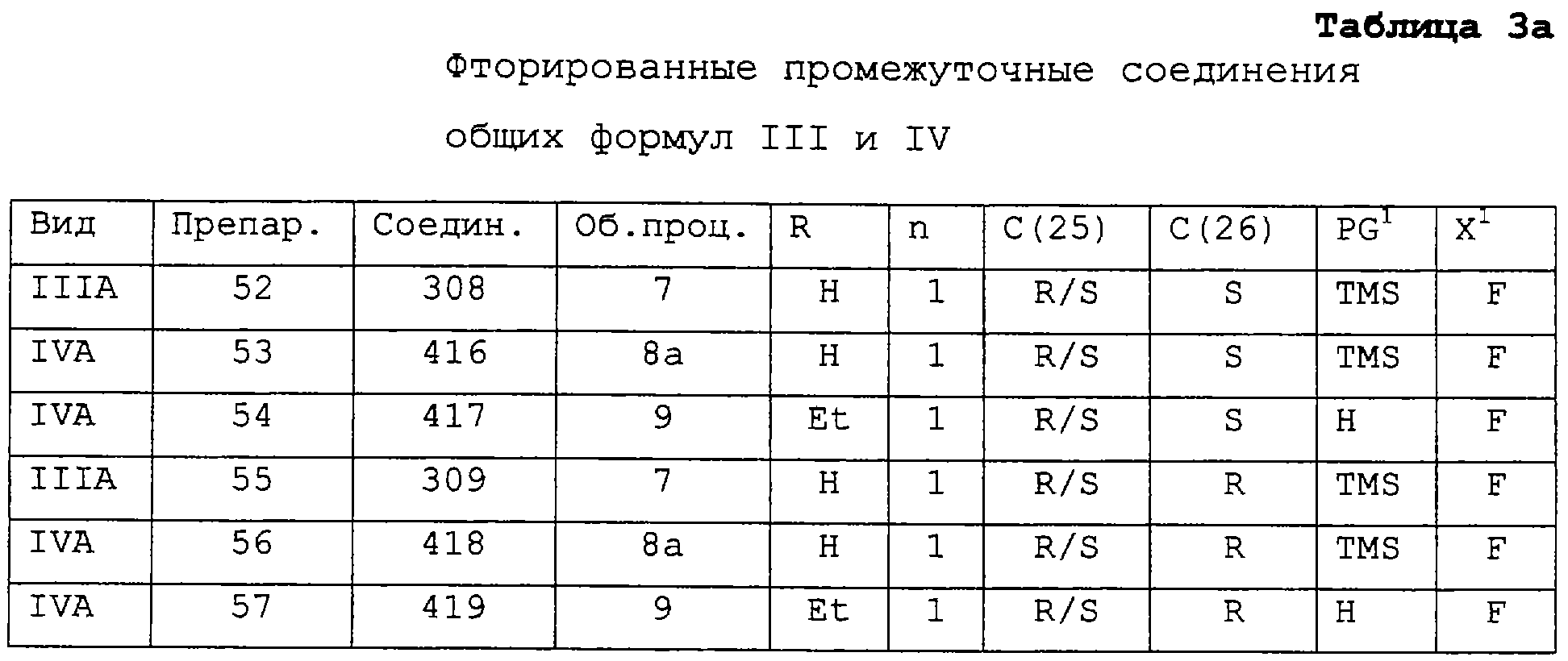
Соединения II, применяемые для получения соединений I, в которых Х=F, могут быть синтезированы из кетона 509 или 510 с применением способа, представленного на схеме 1а, и промежуточных соединений из таблицы 1а: C- (СН2)n-На1 + например, SmI2, то прибегают к реакции типа Barbier между галоидом, кетоном и металлом/солью металла.
Обычно используется смесь двух диастереоизомеров: R- и S-изомер у атома углерода, обозначенного как (25) на схеме 1, т.е. атома углерода, занимающего положение атома углерода С (25) в конечном соединении формулы I. При необходимости, на данном этапе два диастереоизомера могут быть разделены либо, если это более удобно, они могут быть разделены позднее, во время синтеза синтонов II боковых цепей.
Синтез полностью защищенных синтонов II боковых цепей включает следующие стадии: 1) если Q представляет триметилсилил, то его превращают в водород, снимая защиту, например, с помощью основания; 2) незащищенную гидроксильную группу у атома углерода, обозначенного цифрой (25), защищают, например, силилированием с применением TMS-Cl; таким образом, чтобы PG1=TMS (a PG2=TBS).
Альтернативно группа TBS (PG2) соединения II может быть удалена, например, с применением TBAF (если Q=TMS, то ее одновременно превращают в H). Две карбоксильные группы у атомов углерода, обозначенных цифрами (25) и (26) соответственно, затем могут быть защищены в результате одной стадии превращения в циклический ацеталь или кеталь, например ацетонид (изопропилиденкеталь), например с помощью 2-метоксипропена или 2,2-диметоксипропана и кислоты таким образом, чтобы PG1 и PG2 были связаны в одну группу: -С(СН3)2-. В литературе также описаны другие способы защиты 1,2-диолов, например Greene T.W. and Wuts P.G.M., Protective Groups in Organic Synthesis”, Sec. Ed., John Wiley and Sons, New York, 1991, pp.118-142. Преимуществом применения циклических ацеталей или кеталей, таких как ацетониды, в качестве защитных групп соединений II является то, что они особенно хорошо подходят для обеспечения стереохимии у углеродов (25) и (26) с применением ЯМР-спектроскопии с ядерным усилением по эффекту Оверхаузера.
Соединения II, применяемые для получения соединений I, в которых Х=F, могут быть синтезированы из кетона 509 или 510 с применением способа, представленного на схеме 1а, и промежуточных соединений из таблицы 1а:
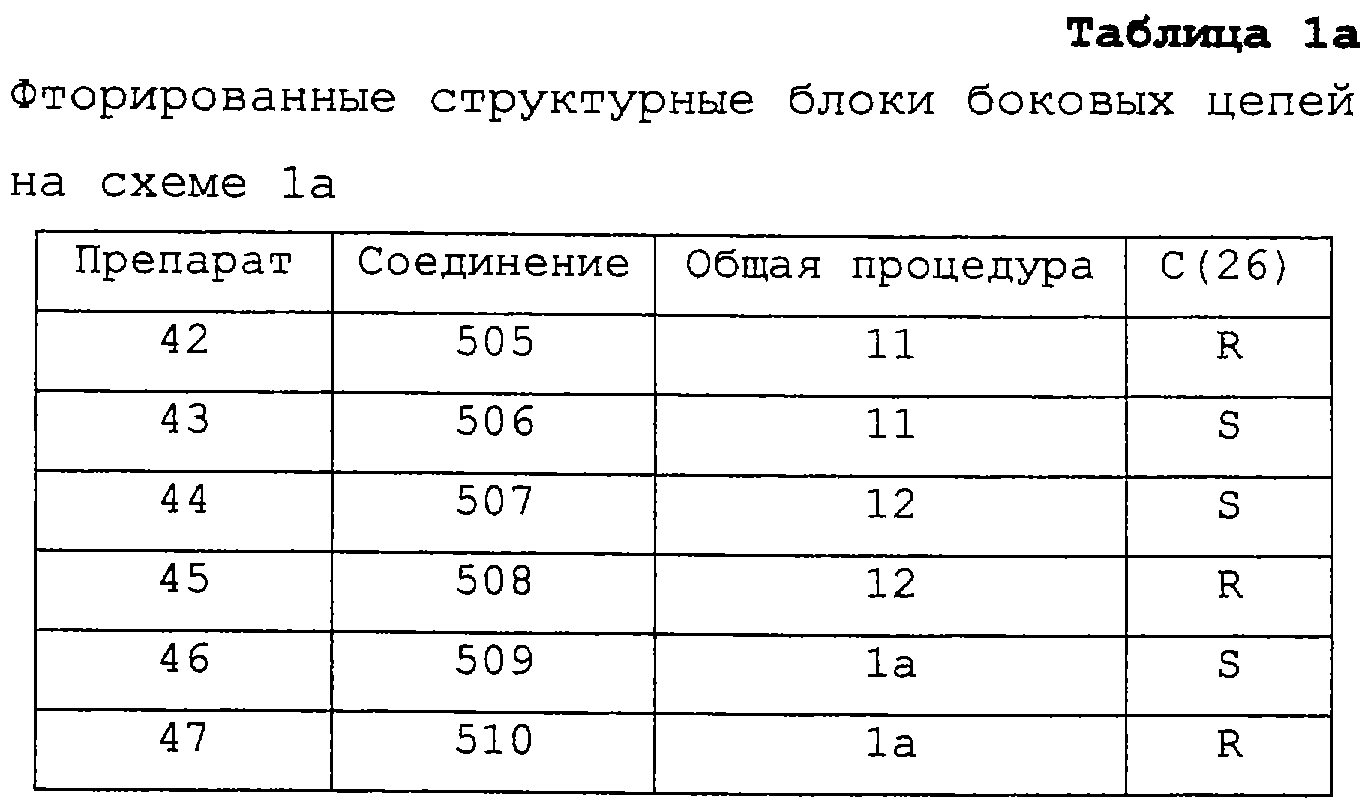 Соединения II, применяемые для получения соединений I, в которых Х представляет Сl, Вr или I, предпочтительно получают (а для X=F могут быть получены) из соответствующих соединений II, в которых O-PG1 и O-PG2 (=Х1) оба представляют ОН, например, как показано на схеме 2:
Соединения II, применяемые для получения соединений I, в которых Х представляет Сl, Вr или I, предпочтительно получают (а для X=F могут быть получены) из соответствующих соединений II, в которых O-PG1 и O-PG2 (=Х1) оба представляют ОН, например, как показано на схеме 2:
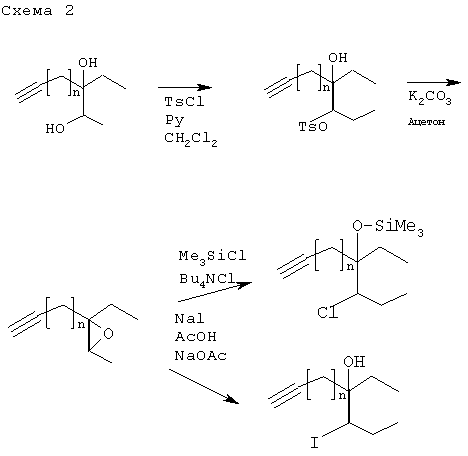 Примечание к схеме 2
Соединения II, в которых X1=Cl или I, могут быть превращены друг в друга, либо превращены в соответствующие соединения, в которых X1=F или Вr, обычными способами, например, описанными R.C.Larock, Comprehensive Organic Transformations, VCH Publishers, Inc., New York, N.Y., USA, 1989, pp.337-339, приводимом здесь в качестве ссылки.
Примечание к схеме 2
Соединения II, в которых X1=Cl или I, могут быть превращены друг в друга, либо превращены в соответствующие соединения, в которых X1=F или Вr, обычными способами, например, описанными R.C.Larock, Comprehensive Organic Transformations, VCH Publishers, Inc., New York, N.Y., USA, 1989, pp.337-339, приводимом здесь в качестве ссылки.
 Взаимодействие альдегида 1 с металлоорганическими реагентами, полученными из структурных блоков боковых цепей II, может быть осуществлено обычными способами нуклеофильного присоединения металлоорганических реагентов к карбонильным соединениям, т.е. путем взаимодействия промежуточного соединения алкилена II с реактивом Гриньяра, таким как этилмагнийбромид, либо с алкиллитием, таким как бутиллитий (общая процедура 7), в подходящем безводном растворителе, таком как простой эфир и/или ТГФ, для получения ацетилида металла, затем добавления соединения 1 для получения соединения III после обычной обработки водой (которая, как правило, предполагается во всех взаимодействиях схемы 1). В целом, реакционный продукт III представляет собой смесь двух возможных С-22 эпимеров, обозначенных здесь как IIIA и IIIB. Обычно предпочтительным является разделение эпимеров IIIA и IIIB, которое целесообразно осуществлять при помощи хроматографии.
Неограничивающие примеры таких соединений формулы III представлены в таблицах 3 и 3а. Выход соединений IIIA гораздо выше, чем выход соответствующих эпимеров IIIB, обычно соотношение составляет приблизительно 95 к 5. Соединения IIIA, IVA и IA имеют 22 (S) стереохимию, а соответствующие соединения с буквой В имеют 22(R) стереохимию. Соединения IA являются предпочтительными.
Необязательное алкилирование 22-гидроксильных соединений общей формулы III или IV для получения соответствующего соединения III или IV, в котором R представляет (C1-C6) алкил, фенил или (С7-С9) аралкил, может быть осуществлено обычными способами, хорошо известными специалисту. Иллюстративные, но не ограничивающие соединения такого рода представлены в таблице 3.
В реакции алкилирования предпочтительно применяют алкилирующий агент RZ, в котором Z означает легко отщепляемую группу, такую как, например, Hal, Ms, Ts, Tf; при этом RZ позволяют вступать во взаимодействие с анионом соответствующего соединения III или IV (R=Н), полученного из него с помощью подходящего сильного основания, такого как алкоголят щелочного металла, алкил щелочного металла или гидрид щелочного металла. Подходящий краун эфир может быть добавлен в качестве межфазного агента для ускорения процесса алкилирования. Применимый способ описан в разделе “Общая процедура 9”.
Фотоизомеризацию триена витамина D, 5(6) (Е), соединений III схемы 1 в 5(6) (Z), соединения IV схемы 1 осуществляют при помощи УФ-света в присутствии триплетного сенсибилизатора, например антрацена; применимые способы описаны в разделе “Общая процедура 8 и 8а”. Неограничивающие примеры таких соединений общей формулы IV представлены в таблицах 3 и 3а наряду со ссылками на получение каждого соединения.
Сенсибилизированная триплетом фотоизомеризация триена витамина D, 5(6) (Е), соединений III до 5(6) (Z), соединений IV и (необязательное) алкилирование 22-ОН-группы с применением RHal/основания для получения соединения 22-O-R, в котором R
Взаимодействие альдегида 1 с металлоорганическими реагентами, полученными из структурных блоков боковых цепей II, может быть осуществлено обычными способами нуклеофильного присоединения металлоорганических реагентов к карбонильным соединениям, т.е. путем взаимодействия промежуточного соединения алкилена II с реактивом Гриньяра, таким как этилмагнийбромид, либо с алкиллитием, таким как бутиллитий (общая процедура 7), в подходящем безводном растворителе, таком как простой эфир и/или ТГФ, для получения ацетилида металла, затем добавления соединения 1 для получения соединения III после обычной обработки водой (которая, как правило, предполагается во всех взаимодействиях схемы 1). В целом, реакционный продукт III представляет собой смесь двух возможных С-22 эпимеров, обозначенных здесь как IIIA и IIIB. Обычно предпочтительным является разделение эпимеров IIIA и IIIB, которое целесообразно осуществлять при помощи хроматографии.
Неограничивающие примеры таких соединений формулы III представлены в таблицах 3 и 3а. Выход соединений IIIA гораздо выше, чем выход соответствующих эпимеров IIIB, обычно соотношение составляет приблизительно 95 к 5. Соединения IIIA, IVA и IA имеют 22 (S) стереохимию, а соответствующие соединения с буквой В имеют 22(R) стереохимию. Соединения IA являются предпочтительными.
Необязательное алкилирование 22-гидроксильных соединений общей формулы III или IV для получения соответствующего соединения III или IV, в котором R представляет (C1-C6) алкил, фенил или (С7-С9) аралкил, может быть осуществлено обычными способами, хорошо известными специалисту. Иллюстративные, но не ограничивающие соединения такого рода представлены в таблице 3.
В реакции алкилирования предпочтительно применяют алкилирующий агент RZ, в котором Z означает легко отщепляемую группу, такую как, например, Hal, Ms, Ts, Tf; при этом RZ позволяют вступать во взаимодействие с анионом соответствующего соединения III или IV (R=Н), полученного из него с помощью подходящего сильного основания, такого как алкоголят щелочного металла, алкил щелочного металла или гидрид щелочного металла. Подходящий краун эфир может быть добавлен в качестве межфазного агента для ускорения процесса алкилирования. Применимый способ описан в разделе “Общая процедура 9”.
Фотоизомеризацию триена витамина D, 5(6) (Е), соединений III схемы 1 в 5(6) (Z), соединения IV схемы 1 осуществляют при помощи УФ-света в присутствии триплетного сенсибилизатора, например антрацена; применимые способы описаны в разделе “Общая процедура 8 и 8а”. Неограничивающие примеры таких соединений общей формулы IV представлены в таблицах 3 и 3а наряду со ссылками на получение каждого соединения.
Сенсибилизированная триплетом фотоизомеризация триена витамина D, 5(6) (Е), соединений III до 5(6) (Z), соединений IV и (необязательное) алкилирование 22-ОН-группы с применением RHal/основания для получения соединения 22-O-R, в котором R Н, может быть осуществлена в произвольном порядке в зависимости от того, что является наиболее целесообразным в каждом случае.
Конечная стадия синтеза соединений I в соответствии с настоящим изобретением, примеры которых приведены в таблице 4, включает одну или несколько процедур по снятию защиты с целью удаления всех защитных групп соединений общей формулы IV схемы 1. Снятие защиты может быть, например, осуществлено либо с применением TBAF для удаления силильных групп, таких как TMS-или ТВS-группы (общая процедура 4), либо с применением HF, который удаляет как силильные группы, так и чувствительные к кислоте защитные группы, такие как изопропилиденовые (кетальные) группы (общая процедура 10). Альтернативно при необходимости удаления обоих видов защитных групп могут быть прследовательно проведены две различные селективные процедуры, например, как описано в WO 97/46522 (общая процедура 7): силильные группы удаляют с применением TBAF с последующим применением PPTS, который селективно удаляет чувствительные к кислоте защитные группы (либо в обратном порядке). Н, может быть осуществлена в произвольном порядке в зависимости от того, что является наиболее целесообразным в каждом случае.
Конечная стадия синтеза соединений I в соответствии с настоящим изобретением, примеры которых приведены в таблице 4, включает одну или несколько процедур по снятию защиты с целью удаления всех защитных групп соединений общей формулы IV схемы 1. Снятие защиты может быть, например, осуществлено либо с применением TBAF для удаления силильных групп, таких как TMS-или ТВS-группы (общая процедура 4), либо с применением HF, который удаляет как силильные группы, так и чувствительные к кислоте защитные группы, такие как изопропилиденовые (кетальные) группы (общая процедура 10). Альтернативно при необходимости удаления обоих видов защитных групп могут быть прследовательно проведены две различные селективные процедуры, например, как описано в WO 97/46522 (общая процедура 7): силильные группы удаляют с применением TBAF с последующим применением PPTS, который селективно удаляет чувствительные к кислоте защитные группы (либо в обратном порядке).
 Подтвержденные примерами соединения I данного изобретения представлены в таблице 4, при этом в пронумерованных примерах приведены ссылки на иллюстративные способы синтеза вместе со спектроскопическими данными для подтвержденных примерами соединений.
Соединения 110, 112-113, 115 и 117-156 получают в результате последовательности синтетических стадий, аналогичной последовательности, применяемой для получения соединений 101-109, 111, 114, 116 и 157-160, примеры 1-12 и 16-19.
Соединение 1 и соответствующие структурные блоки боковых цепей общей формулы II, Н-С
Подтвержденные примерами соединения I данного изобретения представлены в таблице 4, при этом в пронумерованных примерах приведены ссылки на иллюстративные способы синтеза вместе со спектроскопическими данными для подтвержденных примерами соединений.
Соединения 110, 112-113, 115 и 117-156 получают в результате последовательности синтетических стадий, аналогичной последовательности, применяемой для получения соединений 101-109, 111, 114, 116 и 157-160, примеры 1-12 и 16-19.
Соединение 1 и соответствующие структурные блоки боковых цепей общей формулы II, Н-С С-(СН2)n-C(C2H5) (OPG1)-СН(X1)СН3, подвергают взаимодействию в соответствии с общей процедурой 7 (об.%.7), получая соответствующее соединение формулы III.
Не включенные в таблицы 2 или 2а описываемые соединения II могут быть получены способами, подобными способам, применяемым для синтеза соединений II, указанных в таблицах 2 или 2а.
Соединение формулы III подвергают фотоизомеризации в соответствии с общей процедурой 8 или 8а, получая соответствующее соединение формулы IV.
Соединение формулы IV и соответствующий алкилирующий агент RZ необязательно подвергают взаимодействию в соответствии с общей процедурой 9, получая соответствующее соединение формулы IV, в котором R С-(СН2)n-C(C2H5) (OPG1)-СН(X1)СН3, подвергают взаимодействию в соответствии с общей процедурой 7 (об.%.7), получая соответствующее соединение формулы III.
Не включенные в таблицы 2 или 2а описываемые соединения II могут быть получены способами, подобными способам, применяемым для синтеза соединений II, указанных в таблицах 2 или 2а.
Соединение формулы III подвергают фотоизомеризации в соответствии с общей процедурой 8 или 8а, получая соответствующее соединение формулы IV.
Соединение формулы IV и соответствующий алкилирующий агент RZ необязательно подвергают взаимодействию в соответствии с общей процедурой 9, получая соответствующее соединение формулы IV, в котором R Н. При необходимости стадия фотоизомеризации и стадия алкилирования могут быть осуществлены в обратном порядке.
На последней стадии из соединения формулы IV удаляют защиту в соответствии либо с общей процедурой 4, либо с общей процедурой 10, получая требуемое соединение 1. Н. При необходимости стадия фотоизомеризации и стадия алкилирования могут быть осуществлены в обратном порядке.
На последней стадии из соединения формулы IV удаляют защиту в соответствии либо с общей процедурой 4, либо с общей процедурой 10, получая требуемое соединение 1.
 Описываемые соединения предназначены для использования в фармацевтических композициях, применимых для местного или системного лечения или профилактики нарушений у людей и животных, таких как, например, псориаз (влючая пустулезный акродерматит, персистирующий акродерматит и псориаз ногтей) и другие нарушения кератинизации, ВИЧ-ассоциированные дерматозы, заживление ран, различные виды рака, такие как лейкоз, рак молочных желез, глиальные опухоли мозга, остеосаркома, миелофиброз, меланома, другие виды рака кожи, а также заболеваний или нарушений иммунной системы, таких как реакция “хозяин против трансплантата” и “трансплантат против хозяина”, отторжение трансплантата, аутоиммунные заболевания, такие как дисковидный эритематоз и эритематоз системной волчанки, сахарный диабет и хронические дерматозы аутоиммунного типа, например склеродермия и пузырчатка вульгарная, воспалительные заболевания, такие как астма и ревматоидные артрит, а также ряд других болезненных состояний, включая гиперпаратироидизм, особенно вторичный гиперпаратироидизм, связанный с почечной недостаточностью, ухудшение познавательной способности или старческая деменция (болезнь Альцгеймера) и другие нейродегенеративные заболевания, гипертензия, акне, алопеция, аторфия кожи, например атрофия кожи, индуцированная стероидами, старение кожи, включая фотостарение, а также для их применения с целью промотирования остеогенеза и лечения/профилактики остеопороза и остеомаляции.
Описываемые соединения могут применяться в сочетании с другими фармацевтическими препаратами или способами лечения. При лечении псориаза данные соединения могут применяться в сочетании с другими антипсориатическими лекарственными препаратами, например стероидами, либо с другими видами лечения, например лечение светом или УФ-светом, либо сочетанное лечение PUVA. При лечении рака данные соединения могут применяться в сочетании с другими противораковыми лекарственными препаратами либо направленными против рака видами лечения, такими как лечение облучением. При профилактике отторжения трансплантата и реакции “трансплантат против хозяина” либо при лечении аутоиммунных заболеваний данные соединения могут быть наилучшим способом использованы в сочетании с другими иммуноподавляющими/иммунорегулирующими лекарственными препаратами или видами лечения, например циклоспорином А.
Количество соединения формулы I (в дальнейшем называемого активным ингредиентом), необходимое для достижения терапевтического эффекта, безусловно зависит как от конкретного соединения, способа введения, так и от подвергаемого лечению млекопитающего. Соединения в соответствии с данным изобретением могут быть введены парентеральным, интраартикулярным, энтеральным или местным способом. Они хорошо всасываются при энтеральном приеме, который является предпочтительным способом введения при лечении системных нарушений. При лечении дерматологических нарушений, таких как псориаз или глазные болезни, предпочтительными являются местные или энтеральные формы.
Несмотря на то что активный ингредиент может быть введен как таковой в виде необработанного химического вещества, предпочтительным является его введение в виде фармацевтического состава. Обычно активный ингредиент включает от 0,1 частей на млн до 0,1 маc.% состава.
Таким образом, составы в соответствии с настоящим изобретением, предназначенные как для ветеринарных целей, так и для медицинского лечения людей, включают активный ингредиент в сочетании с фармацевтически приемлемым носителем и, необязательно, другим лекарственным ингредиентом (ингредиентами). Носитель (носители) должен быть “приемлемым” в смысле совместимости с другими ингредиентами составов и безвредным для его реципиента.
Составы должны иметь форму, подходящую для перорального, офтальмологического, ректального, парентерального (включая подкожное, внутримышечное и внутривенное), трансдермального, интраартикулярного и местного, назального или трансбуккального введения.
Термин “единичная доза” подразумевает стандартную, т.е. разовую дозу, которая может быть введена пациенту и которая может быть легко обработана и упакована, оставаясь физически и химически устойчивой унифицированной дозой, включающей либо активный материал как таковой, либо его смесь с твердыми или жидкими фармацевтическими разбавителями или носителями.
Составы обычно представлены в форме единичной дозы и могут быть получены любым из способов, хорошо известных в области фармации. Все способы включают стадию смешения активного ингредиента с носителем, составляющим один или несколько вспомогательных ингредиентов. В целом, составы получают путем равномерного и однородного смешения активного ингредиента с жидким носителем, или тонкоизмельченным твердым носителем, либо с тем и другим, а затем, при необходимости, приготовления нужного состава.
Составы в соответствии с настоящим изобретением, подходящие для перорального введения, могут быть в форме дискретных доз, таких как капсулы, саше, таблетки или лепешки, каждая из которых содержит определенное количество активного ингредиента, в виде порошка или гранул, в виде раствора или суспензии в водной или безводной жидкости либо в виде эмульсии типа масло в воде или вода в масле. Активный ингредиент также может быть введен в виде болюса, электуария или пасты.
Составы для ректального введения могут быть в виде суппозитория, включающего активный ингредиент и носитель, либо в виде клизмы.
Составы, подходящие для парентерального введения, обычно включают стерильный масляный или водный препарат активного ингредиета, предпочтительно изотонический с кровью реципиента. Трансдермальные составы могут быть в виде пластыря.
Составы, подходящие для интраартикулярного или офтальмологического введения, могут быть в виде стерильного водного препарата активного ингредиента, который может иметь микрокристаллическую форму, например, в виде водной микрокристаллической суспензии. Липосомальные составы или биорасщепляемые полимерные системы также могут быть использованы для получения активного ингредиента как для интраартикулярного, так и для офтальмологического введения.
Составы, подходящие для местного или офтальмологического введения включают жидкие или полужидкие препараты, такие как линименты, лосьоны, гели, апликации, эмульсии типа масло в воде или вода в масле, такие как кремы, мази или пасты, либо растворы или суспензии, такие как капли.
Составы, подходящие для введения в нос или щечный карман, включают порошок, самоподающиеся и разбрызгиваемые составы, такие как аэрозоли и распылители.
Помимо указанных выше ингредиентов составы в соответствии с данным изобретением могут включать один или несколько дополнительных ингредиентов, таких как разбавители, связующие, консерванты и т.д.
Соединения могут также содержать другие терапевтически активные соединения, обычно применяемые при лечении указанных выше патологических состояний, такие как другие иммунодепрессанты для лечения иммунологических заболеваний или стероиды для лечения дерматологических заболеваний.
Настоящее изобретение также относится к способу лечения пациентов, страдающих от одного из указанных выше состояний, при этом данный способ включает введение нуждающемуся в лечении пациенту эффективного количества одного или нескольких соединений формулы I как такового или в сочетании с одним или несколькими терапевтически активными соединениями, обычно применяемыми для лечения указанных патологических состояний. Лечение с применением данных соединений и/или других терапевтических соединений может быть одновременным или с интервалами.
При системном лечении вводят суточные дозы, составляющие 0,001-2 мкг на кг массы тела, предпочтительно 0,002-0,3 мкг/кг массы тела млекопитающего, например 0,003-0,2 мкг/кг соединения формулы I, обычно соответствующие суточной дозе для взрослого человека, составляющей от 0,2 до 15 мкг. При местном лечении дерматологических нарушений вводят мази, кремы или лосьоны, содержащие 0,1-500 мкг/г, предпочтительно 0,1-100 мкг/г соединения формулы I. При местном применении в офтальмологических мазях вводят капли или гели, содержащие 0,1-500 мкг/г, предпочтительно 0,1-100 мкг/г, соединения формулы I. Получают также композиции для перорального применения предпочтительно в виде таблеток, капсул или капель, содержащих 0,05-50 мкг, предпочтительно 0,1-25 мкг, соединения формулы I на единичную дозу.
Данное изобретение далее проиллюстрировано следующими общими процедурами, приготовлениями и примерами.
Примеры
Общие процедуры, приготовления и примеры
Общее:
ТГФ сушат над молекулярными ситами 4А. Если не указано иначе, то реакции обычно осуществляют в атмосфере аргона. В соответствии со стандартным разработанным способом реакционную смесь выливают в воду и трижды экстрагируют подходящим органическим растворителем. Органический слой промывают водой и насыщенным раствором хлорида натрия, сушат над безводным сульфатом натрия и концентрируют в вакууме, получая продукт, очищаемый хроматографией на силикагеле (40-63 мкм), кристаллизацией или дистилляцией.
Для спектров 1H ядерно-магнитного резонанса (300 МГц) и 13С ЯМР (NMR) (75,6 МГц) указаны величины химических сдвигов (
Описываемые соединения предназначены для использования в фармацевтических композициях, применимых для местного или системного лечения или профилактики нарушений у людей и животных, таких как, например, псориаз (влючая пустулезный акродерматит, персистирующий акродерматит и псориаз ногтей) и другие нарушения кератинизации, ВИЧ-ассоциированные дерматозы, заживление ран, различные виды рака, такие как лейкоз, рак молочных желез, глиальные опухоли мозга, остеосаркома, миелофиброз, меланома, другие виды рака кожи, а также заболеваний или нарушений иммунной системы, таких как реакция “хозяин против трансплантата” и “трансплантат против хозяина”, отторжение трансплантата, аутоиммунные заболевания, такие как дисковидный эритематоз и эритематоз системной волчанки, сахарный диабет и хронические дерматозы аутоиммунного типа, например склеродермия и пузырчатка вульгарная, воспалительные заболевания, такие как астма и ревматоидные артрит, а также ряд других болезненных состояний, включая гиперпаратироидизм, особенно вторичный гиперпаратироидизм, связанный с почечной недостаточностью, ухудшение познавательной способности или старческая деменция (болезнь Альцгеймера) и другие нейродегенеративные заболевания, гипертензия, акне, алопеция, аторфия кожи, например атрофия кожи, индуцированная стероидами, старение кожи, включая фотостарение, а также для их применения с целью промотирования остеогенеза и лечения/профилактики остеопороза и остеомаляции.
Описываемые соединения могут применяться в сочетании с другими фармацевтическими препаратами или способами лечения. При лечении псориаза данные соединения могут применяться в сочетании с другими антипсориатическими лекарственными препаратами, например стероидами, либо с другими видами лечения, например лечение светом или УФ-светом, либо сочетанное лечение PUVA. При лечении рака данные соединения могут применяться в сочетании с другими противораковыми лекарственными препаратами либо направленными против рака видами лечения, такими как лечение облучением. При профилактике отторжения трансплантата и реакции “трансплантат против хозяина” либо при лечении аутоиммунных заболеваний данные соединения могут быть наилучшим способом использованы в сочетании с другими иммуноподавляющими/иммунорегулирующими лекарственными препаратами или видами лечения, например циклоспорином А.
Количество соединения формулы I (в дальнейшем называемого активным ингредиентом), необходимое для достижения терапевтического эффекта, безусловно зависит как от конкретного соединения, способа введения, так и от подвергаемого лечению млекопитающего. Соединения в соответствии с данным изобретением могут быть введены парентеральным, интраартикулярным, энтеральным или местным способом. Они хорошо всасываются при энтеральном приеме, который является предпочтительным способом введения при лечении системных нарушений. При лечении дерматологических нарушений, таких как псориаз или глазные болезни, предпочтительными являются местные или энтеральные формы.
Несмотря на то что активный ингредиент может быть введен как таковой в виде необработанного химического вещества, предпочтительным является его введение в виде фармацевтического состава. Обычно активный ингредиент включает от 0,1 частей на млн до 0,1 маc.% состава.
Таким образом, составы в соответствии с настоящим изобретением, предназначенные как для ветеринарных целей, так и для медицинского лечения людей, включают активный ингредиент в сочетании с фармацевтически приемлемым носителем и, необязательно, другим лекарственным ингредиентом (ингредиентами). Носитель (носители) должен быть “приемлемым” в смысле совместимости с другими ингредиентами составов и безвредным для его реципиента.
Составы должны иметь форму, подходящую для перорального, офтальмологического, ректального, парентерального (включая подкожное, внутримышечное и внутривенное), трансдермального, интраартикулярного и местного, назального или трансбуккального введения.
Термин “единичная доза” подразумевает стандартную, т.е. разовую дозу, которая может быть введена пациенту и которая может быть легко обработана и упакована, оставаясь физически и химически устойчивой унифицированной дозой, включающей либо активный материал как таковой, либо его смесь с твердыми или жидкими фармацевтическими разбавителями или носителями.
Составы обычно представлены в форме единичной дозы и могут быть получены любым из способов, хорошо известных в области фармации. Все способы включают стадию смешения активного ингредиента с носителем, составляющим один или несколько вспомогательных ингредиентов. В целом, составы получают путем равномерного и однородного смешения активного ингредиента с жидким носителем, или тонкоизмельченным твердым носителем, либо с тем и другим, а затем, при необходимости, приготовления нужного состава.
Составы в соответствии с настоящим изобретением, подходящие для перорального введения, могут быть в форме дискретных доз, таких как капсулы, саше, таблетки или лепешки, каждая из которых содержит определенное количество активного ингредиента, в виде порошка или гранул, в виде раствора или суспензии в водной или безводной жидкости либо в виде эмульсии типа масло в воде или вода в масле. Активный ингредиент также может быть введен в виде болюса, электуария или пасты.
Составы для ректального введения могут быть в виде суппозитория, включающего активный ингредиент и носитель, либо в виде клизмы.
Составы, подходящие для парентерального введения, обычно включают стерильный масляный или водный препарат активного ингредиета, предпочтительно изотонический с кровью реципиента. Трансдермальные составы могут быть в виде пластыря.
Составы, подходящие для интраартикулярного или офтальмологического введения, могут быть в виде стерильного водного препарата активного ингредиента, который может иметь микрокристаллическую форму, например, в виде водной микрокристаллической суспензии. Липосомальные составы или биорасщепляемые полимерные системы также могут быть использованы для получения активного ингредиента как для интраартикулярного, так и для офтальмологического введения.
Составы, подходящие для местного или офтальмологического введения включают жидкие или полужидкие препараты, такие как линименты, лосьоны, гели, апликации, эмульсии типа масло в воде или вода в масле, такие как кремы, мази или пасты, либо растворы или суспензии, такие как капли.
Составы, подходящие для введения в нос или щечный карман, включают порошок, самоподающиеся и разбрызгиваемые составы, такие как аэрозоли и распылители.
Помимо указанных выше ингредиентов составы в соответствии с данным изобретением могут включать один или несколько дополнительных ингредиентов, таких как разбавители, связующие, консерванты и т.д.
Соединения могут также содержать другие терапевтически активные соединения, обычно применяемые при лечении указанных выше патологических состояний, такие как другие иммунодепрессанты для лечения иммунологических заболеваний или стероиды для лечения дерматологических заболеваний.
Настоящее изобретение также относится к способу лечения пациентов, страдающих от одного из указанных выше состояний, при этом данный способ включает введение нуждающемуся в лечении пациенту эффективного количества одного или нескольких соединений формулы I как такового или в сочетании с одним или несколькими терапевтически активными соединениями, обычно применяемыми для лечения указанных патологических состояний. Лечение с применением данных соединений и/или других терапевтических соединений может быть одновременным или с интервалами.
При системном лечении вводят суточные дозы, составляющие 0,001-2 мкг на кг массы тела, предпочтительно 0,002-0,3 мкг/кг массы тела млекопитающего, например 0,003-0,2 мкг/кг соединения формулы I, обычно соответствующие суточной дозе для взрослого человека, составляющей от 0,2 до 15 мкг. При местном лечении дерматологических нарушений вводят мази, кремы или лосьоны, содержащие 0,1-500 мкг/г, предпочтительно 0,1-100 мкг/г соединения формулы I. При местном применении в офтальмологических мазях вводят капли или гели, содержащие 0,1-500 мкг/г, предпочтительно 0,1-100 мкг/г, соединения формулы I. Получают также композиции для перорального применения предпочтительно в виде таблеток, капсул или капель, содержащих 0,05-50 мкг, предпочтительно 0,1-25 мкг, соединения формулы I на единичную дозу.
Данное изобретение далее проиллюстрировано следующими общими процедурами, приготовлениями и примерами.
Примеры
Общие процедуры, приготовления и примеры
Общее:
ТГФ сушат над молекулярными ситами 4А. Если не указано иначе, то реакции обычно осуществляют в атмосфере аргона. В соответствии со стандартным разработанным способом реакционную смесь выливают в воду и трижды экстрагируют подходящим органическим растворителем. Органический слой промывают водой и насыщенным раствором хлорида натрия, сушат над безводным сульфатом натрия и концентрируют в вакууме, получая продукт, очищаемый хроматографией на силикагеле (40-63 мкм), кристаллизацией или дистилляцией.
Для спектров 1H ядерно-магнитного резонанса (300 МГц) и 13С ЯМР (NMR) (75,6 МГц) указаны величины химических сдвигов ( ) (в миллионных долях, м.д.) в растворах дейтерохлороформа, если не указано иначе, относительно внутреннего тетраметилсилана ( ) (в миллионных долях, м.д.) в растворах дейтерохлороформа, если не указано иначе, относительно внутреннего тетраметилсилана ( =0,00) или хлороформа ( =0,00) или хлороформа ( =7,25), или дейтерохлороформа ( =7,25), или дейтерохлороформа ( =76,81 для 13С ЯМР). Указана величина для мультиплета или определенного (дублет (д), триплет (т), квартет (кв)), или не определенного в приблизительной средней точке (м), если не указан диапазон (с = синглет, шир. = широкий).
Общие процедуры
Общая процедура 1. Синтез кетонов 503 и 504
К раствору/суспензии соответствующего силилированного этиллактата соединения 501 или 502 (23,2 г, 0,1 моль) и гидрохлорида N,O-диметилгидроксиламина (12,2 г, 0,125 моль) в сухом ТГФ (800 мл) добавляют 3,0-молярный раствор этилмагнийбромида в простом эфире (167 мл, 0,5 моль) в течение одного часа при перемешивании и охлаждении до -5°С. Перемешивание продолжают в течение 18 часов при 25°С, после чего реакционную смесь гидролизуют, выливая ее в раствор аммонийхлорида (160 г) в воде (1,2 л). После обработки простым эфиром сырой продукт очищают хроматографией (элюент: от 0% до 1% простого эфира в петролейном эфире), получая желаемый продукт.
Вариант: общая процедура 1а. Синтез кетонов 509 и 510
К раствору/суспензии соответствующего R или S, метил или этил 2-фторпропионата (0,1 моль) и гидрохлорида N,O-диметилгидроксиламина (10,7 г, 0,11 моль) в сухом ТГФ (300 мл) добавляют 3,0-молярный раствор этилмагнийбромида в простом эфире (107 мл, 0,32 моль) в течение одного часа, при перемешивании и охлаждении до 0 – 5°С. Перемешивание продолжают в течение 4 часов при 0°С и 16 часов при 25°С, после чего реакционную смесь гидролизуют, добавляя 25% водный аммонийхлорид (300 мл) при энергичном перемешивании. Температура поднимается приблизительно до 35°С, ее удерживают на данном уровне при помощи горячей водяной бани; рН контролируют рН-метром (рН составляет приблизительно 8). Через 15 минут рН доводят до 3, применяя 4н водную соляную кислоту, и перемешивание продолжают в течение 15 минут. Полученную двухфазную смесь разделяют и водную фазу дважды экстрагируют простым эфиром (50 мл). Объединенные органические фазы дважды экстрагируют насыщенным раствором хлорида натрия (25 мл) и сушат над безводным сульфатом натрия. Раствор сырого материала концентрируют, отгоняя простой эфир и некоторое количество ТГФ при атмосферном давлении в эффективном дистилляторе (сетчатые круги Dixon размером 1/16″, набитые в 7-см колонку). Остаток (около 200 г) фракционируют на 15-см колонке Vigreux, связанной с охлаждаемым льдом конденсатором и приемником. Постепенно понижая давление до 0,25 бар, собирают фракции, состоящие из ТГФ и увеличивающейся доли указанного в заголовке соединения (оставляя в остатке промежуточные и побочные продукты, имеющие более высокую температуру кипения). При желании первые фракции могут быть сконцентрированы путем повторной дистилляции. Чистые соединения, указанные в заголовке, имеют температуру кипения, составляющую около 45°С/27 мбар, однако фракции, смешанные с ТГФ, после сушки могут быть использованы на следующей синтетической стадии, при этом процентное содержание указанного в заголовке соединения определяют при помощи ЯМР.
Общая процедура 2. Синтез третичных пропрагиловых спиртов. Соединения II
Смесь алюминиевой стружки (0,45 г), хлорида ртути(II) (12 мг) и сухого ТГФ (10 мл) перемешивают в течение 20 минут. При перемешивании в течение 20 минут при 25-30°С добавляют раствор пропаргилбромида (1,88 мл, 2,97 г, 25 ммоль) в сухом ТГФ (5 мл). Перемешивание продолжают в течение 30 минут при 40°С. В течение 10 минут при 25°С добавляют раствор соответствующего кетона, соединение 503 или 504 (5,0 г, 23 ммоль) в сухом ТГФ (10 мл); реакционную смесь перемешивают еще в течение 1,5 часов при 25°С, а затем обрабатывают простым эфиром. Сырой продукт очищают хроматографией, применяя 1% простой эфир в петролейном эфире в качестве элюента и повторяя данную процедуру дважды с подходящим сочетанием фракций, получая каждое их двух изомерных соединений, указанных в заголовке, в чистом виде.
Вариант: общая процедура 2 а: Синтез фторированных третичных пропаргиловых спиртов. Соединения II
1,5 М раствор алленилмагнийбромида в простом эфире (13 мл, около 20 ммоль) (L.Brandsma, “Preparative Acetylenic Chemistry”, 2nd Ed., Elsevier, Amsterdam, 1988, pp.35-36) охлаждают до -40°С и при перемешивании в течение 30 минут добавляют сухой раствор кетона 509 или 510 (16 ммоль) в ТГФ (20 мл) с последующим перемешиванием в течение 10 минут при охлаждении до температуры -30°С – -40°С. Реакционную смесь выливают в 25% водный аммонийхлорид (50 мл) при перемешивании и охлаждении на льду. Водную фазу экстрагируют простым эфиром (20 мл), а объединенные органические фазы сушат сульфатом магния и концентрируют в вакууме, получая указанное в заголовке соединение в виде масла. Продукт, состоящий из двух эпимеров в соотношении, составляющим приблизительно 3:1, используют на следующей синтетической стадии без дальнейшей очистки.
Общая процедура 3. Синтва третичных ацетиловых спиртов. Соединения II
К перемешиваемой суспензии литийацетилида, этилендиаминовому комплексу (5,3 г, 58 ммоль) в сухом ТГФ (250 мл) в течение 20 минут при 35°С добавляют раствор подходящего кетона, соединение 503 или 504 (12,5 г, 58 ммоль) в сухом ТГФ (50 мл). Перемешивание продолжают в течение 4 часов при 25°С, после чего реакционную смесь гидролизуют, выливая ее в раствор хлорида натрия (70 г) в воде (200 мл). После окончательной обработки простым эфиром сырой продукт очищают хроматографией (элюент: от 0 до 2% простого эфира в петролейном эфире), получая два изомерных, указанных в заголовке соединения в виде всего лишь частично разделяемой, но в других отношениях чистой смеси. Смесь используют как таковую на следующей стадии (удаление силильной защитной группы), после чего два изомерных 25,26-диола могут быть разделены при помощи хроматографии.
Общая процедура 3а. Синтез третичных триметилсилильных ацатиленовых спиртов. Соединения II
К перемешиваемому раствору триметилсилилацетилена (0,25 мл, 0,177 г, 1,8 ммоль) в сухом ТГФ (6 мл) в течение 10 минут при -60°С добавляют 1,6-молярный раствор бутиллития в гексане (0,83 мл, 1,3 ммоль). Перемешивание продолжают в течение 10 минут при -60°С и при 25°С в течение 30 минут. Полученный раствор литийтриметилсилилацетилида вновь охлаждают до -60°С и в течение 2 минут добавляют раствор соответствующего кетона, соединения 503 или 504 (0,3 г, 1,4 ммоль) в сухом тетрагидрофуране (1 мл). Перемешивание продолжают в течение 3 часов при -60°С, после чего реакционную смесь гидролизуют, выливая ее в раствор аммонийхлорида (2 г) в воде (20 мл). После окончательной обработки простым эфиром сырой продукт очищают хроматографией (элюент: от 0 до 1% простого эфира в петролейном эфире), получая два изомерных, указанных в заголовке соединения в виде неразделимой смеси. Данную смесь используют на следующей стадии (удаление обеих силильных защитных групп), после чего два изомерных 25,26-диола могут быть разделены при помощи хроматографии.
Общая процедура 4. Снятие защиты с силилзащищенных соединений с применением TBAF
К раствору соответствующего моносилилзащищенного соединения (соединений) (0,4 ммоль), или дисилилзащищенного соединения (соединений) (0,2 ммоль), или тетрасилилзащищенного соединения (соединений) (0,1 ммоль) в ТГФ (10 мл) добавляют тригидрат TBAF (0,32 г, 1,0 ммоль) (т.е. 2,5 моль TBAF на каждый молярный эквивалент силилзащитной группы) и смесь нагревают при температуре кипения с обратным холодильником в течение одного часа при перемешивании. После добавления 1М бикарбоната натрия (10 мл) смесь окончательно обрабатывают простым эфиром или этилацетатом. Остаток очищают хроматографией, получая требуемое соединение(соединения).
Общая процедура 5. Защита 25,26-диолов II как ацетонидов с применением 2-метоксипропена
Раствор незащищенного 25,26-диола, соединение II (0,35 ммоль), 2-метоксипропена (50 мг, 0,7 ммоль) и п-толуолсульфоновой кислоты (1 мг) в сухом ДМФ (2 мл), содержащий молекулярные сита размером =76,81 для 13С ЯМР). Указана величина для мультиплета или определенного (дублет (д), триплет (т), квартет (кв)), или не определенного в приблизительной средней точке (м), если не указан диапазон (с = синглет, шир. = широкий).
Общие процедуры
Общая процедура 1. Синтез кетонов 503 и 504
К раствору/суспензии соответствующего силилированного этиллактата соединения 501 или 502 (23,2 г, 0,1 моль) и гидрохлорида N,O-диметилгидроксиламина (12,2 г, 0,125 моль) в сухом ТГФ (800 мл) добавляют 3,0-молярный раствор этилмагнийбромида в простом эфире (167 мл, 0,5 моль) в течение одного часа при перемешивании и охлаждении до -5°С. Перемешивание продолжают в течение 18 часов при 25°С, после чего реакционную смесь гидролизуют, выливая ее в раствор аммонийхлорида (160 г) в воде (1,2 л). После обработки простым эфиром сырой продукт очищают хроматографией (элюент: от 0% до 1% простого эфира в петролейном эфире), получая желаемый продукт.
Вариант: общая процедура 1а. Синтез кетонов 509 и 510
К раствору/суспензии соответствующего R или S, метил или этил 2-фторпропионата (0,1 моль) и гидрохлорида N,O-диметилгидроксиламина (10,7 г, 0,11 моль) в сухом ТГФ (300 мл) добавляют 3,0-молярный раствор этилмагнийбромида в простом эфире (107 мл, 0,32 моль) в течение одного часа, при перемешивании и охлаждении до 0 – 5°С. Перемешивание продолжают в течение 4 часов при 0°С и 16 часов при 25°С, после чего реакционную смесь гидролизуют, добавляя 25% водный аммонийхлорид (300 мл) при энергичном перемешивании. Температура поднимается приблизительно до 35°С, ее удерживают на данном уровне при помощи горячей водяной бани; рН контролируют рН-метром (рН составляет приблизительно 8). Через 15 минут рН доводят до 3, применяя 4н водную соляную кислоту, и перемешивание продолжают в течение 15 минут. Полученную двухфазную смесь разделяют и водную фазу дважды экстрагируют простым эфиром (50 мл). Объединенные органические фазы дважды экстрагируют насыщенным раствором хлорида натрия (25 мл) и сушат над безводным сульфатом натрия. Раствор сырого материала концентрируют, отгоняя простой эфир и некоторое количество ТГФ при атмосферном давлении в эффективном дистилляторе (сетчатые круги Dixon размером 1/16″, набитые в 7-см колонку). Остаток (около 200 г) фракционируют на 15-см колонке Vigreux, связанной с охлаждаемым льдом конденсатором и приемником. Постепенно понижая давление до 0,25 бар, собирают фракции, состоящие из ТГФ и увеличивающейся доли указанного в заголовке соединения (оставляя в остатке промежуточные и побочные продукты, имеющие более высокую температуру кипения). При желании первые фракции могут быть сконцентрированы путем повторной дистилляции. Чистые соединения, указанные в заголовке, имеют температуру кипения, составляющую около 45°С/27 мбар, однако фракции, смешанные с ТГФ, после сушки могут быть использованы на следующей синтетической стадии, при этом процентное содержание указанного в заголовке соединения определяют при помощи ЯМР.
Общая процедура 2. Синтез третичных пропрагиловых спиртов. Соединения II
Смесь алюминиевой стружки (0,45 г), хлорида ртути(II) (12 мг) и сухого ТГФ (10 мл) перемешивают в течение 20 минут. При перемешивании в течение 20 минут при 25-30°С добавляют раствор пропаргилбромида (1,88 мл, 2,97 г, 25 ммоль) в сухом ТГФ (5 мл). Перемешивание продолжают в течение 30 минут при 40°С. В течение 10 минут при 25°С добавляют раствор соответствующего кетона, соединение 503 или 504 (5,0 г, 23 ммоль) в сухом ТГФ (10 мл); реакционную смесь перемешивают еще в течение 1,5 часов при 25°С, а затем обрабатывают простым эфиром. Сырой продукт очищают хроматографией, применяя 1% простой эфир в петролейном эфире в качестве элюента и повторяя данную процедуру дважды с подходящим сочетанием фракций, получая каждое их двух изомерных соединений, указанных в заголовке, в чистом виде.
Вариант: общая процедура 2 а: Синтез фторированных третичных пропаргиловых спиртов. Соединения II
1,5 М раствор алленилмагнийбромида в простом эфире (13 мл, около 20 ммоль) (L.Brandsma, “Preparative Acetylenic Chemistry”, 2nd Ed., Elsevier, Amsterdam, 1988, pp.35-36) охлаждают до -40°С и при перемешивании в течение 30 минут добавляют сухой раствор кетона 509 или 510 (16 ммоль) в ТГФ (20 мл) с последующим перемешиванием в течение 10 минут при охлаждении до температуры -30°С – -40°С. Реакционную смесь выливают в 25% водный аммонийхлорид (50 мл) при перемешивании и охлаждении на льду. Водную фазу экстрагируют простым эфиром (20 мл), а объединенные органические фазы сушат сульфатом магния и концентрируют в вакууме, получая указанное в заголовке соединение в виде масла. Продукт, состоящий из двух эпимеров в соотношении, составляющим приблизительно 3:1, используют на следующей синтетической стадии без дальнейшей очистки.
Общая процедура 3. Синтва третичных ацетиловых спиртов. Соединения II
К перемешиваемой суспензии литийацетилида, этилендиаминовому комплексу (5,3 г, 58 ммоль) в сухом ТГФ (250 мл) в течение 20 минут при 35°С добавляют раствор подходящего кетона, соединение 503 или 504 (12,5 г, 58 ммоль) в сухом ТГФ (50 мл). Перемешивание продолжают в течение 4 часов при 25°С, после чего реакционную смесь гидролизуют, выливая ее в раствор хлорида натрия (70 г) в воде (200 мл). После окончательной обработки простым эфиром сырой продукт очищают хроматографией (элюент: от 0 до 2% простого эфира в петролейном эфире), получая два изомерных, указанных в заголовке соединения в виде всего лишь частично разделяемой, но в других отношениях чистой смеси. Смесь используют как таковую на следующей стадии (удаление силильной защитной группы), после чего два изомерных 25,26-диола могут быть разделены при помощи хроматографии.
Общая процедура 3а. Синтез третичных триметилсилильных ацатиленовых спиртов. Соединения II
К перемешиваемому раствору триметилсилилацетилена (0,25 мл, 0,177 г, 1,8 ммоль) в сухом ТГФ (6 мл) в течение 10 минут при -60°С добавляют 1,6-молярный раствор бутиллития в гексане (0,83 мл, 1,3 ммоль). Перемешивание продолжают в течение 10 минут при -60°С и при 25°С в течение 30 минут. Полученный раствор литийтриметилсилилацетилида вновь охлаждают до -60°С и в течение 2 минут добавляют раствор соответствующего кетона, соединения 503 или 504 (0,3 г, 1,4 ммоль) в сухом тетрагидрофуране (1 мл). Перемешивание продолжают в течение 3 часов при -60°С, после чего реакционную смесь гидролизуют, выливая ее в раствор аммонийхлорида (2 г) в воде (20 мл). После окончательной обработки простым эфиром сырой продукт очищают хроматографией (элюент: от 0 до 1% простого эфира в петролейном эфире), получая два изомерных, указанных в заголовке соединения в виде неразделимой смеси. Данную смесь используют на следующей стадии (удаление обеих силильных защитных групп), после чего два изомерных 25,26-диола могут быть разделены при помощи хроматографии.
Общая процедура 4. Снятие защиты с силилзащищенных соединений с применением TBAF
К раствору соответствующего моносилилзащищенного соединения (соединений) (0,4 ммоль), или дисилилзащищенного соединения (соединений) (0,2 ммоль), или тетрасилилзащищенного соединения (соединений) (0,1 ммоль) в ТГФ (10 мл) добавляют тригидрат TBAF (0,32 г, 1,0 ммоль) (т.е. 2,5 моль TBAF на каждый молярный эквивалент силилзащитной группы) и смесь нагревают при температуре кипения с обратным холодильником в течение одного часа при перемешивании. После добавления 1М бикарбоната натрия (10 мл) смесь окончательно обрабатывают простым эфиром или этилацетатом. Остаток очищают хроматографией, получая требуемое соединение(соединения).
Общая процедура 5. Защита 25,26-диолов II как ацетонидов с применением 2-метоксипропена
Раствор незащищенного 25,26-диола, соединение II (0,35 ммоль), 2-метоксипропена (50 мг, 0,7 ммоль) и п-толуолсульфоновой кислоты (1 мг) в сухом ДМФ (2 мл), содержащий молекулярные сита размером  (стержни размером 1/16″ весом около 0,1 г), нагревают до 70°С при перемешивании в течение 30 минут. После окончательной обработки простым эфиром сырой продукт очищают хроматографией с 5% простым эфиром в петролейном эфире в качестве элюента, получая чистый ацетонид, соединение II.
Общая процедура 5а. Защита 25,26-диолов II как ацетонидов с применением 2,2-диметоксипропана
Раствор незащищенного 25,26-диола, соединение II (2,0 ммоль), 2,2-диметоксипропана (2 мл, 1,7 г, 16 ммоль) и п-толуолсульфоновой кислоты (38 мг) в сухом ацетоне (10 мл) перемешивают при 25°С в течение 2 часов. Добавляют триэтиламин (1 мл) и реакционную смесь концентрируют приблизительно до 2 мл, применяя короткую (около 3 см) колонку Vigreux, при температуре кипения около 30°С/0,4 бар. Добавляют воду (2 мл) и 1М бикарбонат натрия (1 мл) и смесь экстрагируют простым эфиром (3 (стержни размером 1/16″ весом около 0,1 г), нагревают до 70°С при перемешивании в течение 30 минут. После окончательной обработки простым эфиром сырой продукт очищают хроматографией с 5% простым эфиром в петролейном эфире в качестве элюента, получая чистый ацетонид, соединение II.
Общая процедура 5а. Защита 25,26-диолов II как ацетонидов с применением 2,2-диметоксипропана
Раствор незащищенного 25,26-диола, соединение II (2,0 ммоль), 2,2-диметоксипропана (2 мл, 1,7 г, 16 ммоль) и п-толуолсульфоновой кислоты (38 мг) в сухом ацетоне (10 мл) перемешивают при 25°С в течение 2 часов. Добавляют триэтиламин (1 мл) и реакционную смесь концентрируют приблизительно до 2 мл, применяя короткую (около 3 см) колонку Vigreux, при температуре кипения около 30°С/0,4 бар. Добавляют воду (2 мл) и 1М бикарбонат натрия (1 мл) и смесь экстрагируют простым эфиром (3 8 мл). Объединенные экстракты простого эфира сушат сульфатом магния и концентрируют приблизительно до 0,5 мл (как описано выше). Сырой продукт очищают хроматографией с 5% простым эфиром в петролейном эфире в качестве элюента. После концентрации (как описано выше) соответствующих объединенных фракций получают чистый ацетонид, соединение II.
Общая процедура 6. Защита 25-моногидроксильных соединений II триметилсилилированием
Триметилхлорсилан (1,08 г, 10 ммоль) в течение 10 минут при 0°С добавляют к перемешиваемому раствору 25-гидрокси-26-трет-бутилдиметилсилилокси-(или 26-фтор-)соединения II (5,0 ммоль), триэтиламина (1,51 г, 15 ммоль) и DMAP (5 мг) в сухом дихлорметане (10 мл). Перемешивание продолжают в течение 48 часов при 25°С. После окончательной обаботки (простым эфиром) сырой продукт очищают хроматографией с петролейным эфиром в качестве элюента, получая чистое 25-триметилсилилокси-26-трет-бутилдиметилсилилокси-(или 26-фтор-)соединение II.
Общая процедура 7. Синтез соединения III из соединения I и структурного блока боковой цепи II
К раствору соответствующего структурного блока боковой цепи, соединение II (3,0 ммоль) в сухом ТГФ (5 мл), охлажденного до -78°С и перемешиваемого в атмосфере аргона, в течение 2 минут по каплям добавляют раствор н-бутиллития (1, 6М в гексане; 1,5 мл). Перемешивание продолжают при -78°С в течение 15 минут и при 20°С в течение еще 15 минут. Смесь вновь охлаждают до -78°С и в течение 4 минут по каплям добавляют раствор альдегида, соединение 1 (1,5 ммоль) в сухом ТГФ (5 мл), после чего перемешивание продолжают при -78°С в течение 30 минут. Реакционную смесь окончательно обрабатывают (простой эфир), получая сырой продукт, содержащий изомерные, 22-гидроксильные соединения А (менее полярное) и В (более полярное). Их разделяют хроматографией (смесь этилацетата и петролейного эфира в качестве элюента), получая чистые соединения III.
Вариант: Общая процедура 7а
Повторяют ход общей процедуры 7 за исключением того, что применяют 1,87 мл н-бутиллития (1,6 М) и 3 ммоля соединения I.
Общая процедура 8. Фозюиаомерилация соединения III в соединение IV
Раствор соответствующего соединения III (0,28 ммоль), антрацена (0,1 г) и триэтиламина (0,20 мл, 1,4 ммоль) в дихлорметане (16 мл) в 25-мл круглодонной колбе Руrех облучают приблизительно при 10°С УФ-светом от ультрафиолетовой лампы высокого давления типа TQ760Z2 (Hanau) при 700 Вт в течение 30 минут (15 минут при шкале 0,08 ммоль) при перемешивании. Реакционную смесь упаривают в вакууме, а остаток обрабатывают петролейным эфиром (2 8 мл). Объединенные экстракты простого эфира сушат сульфатом магния и концентрируют приблизительно до 0,5 мл (как описано выше). Сырой продукт очищают хроматографией с 5% простым эфиром в петролейном эфире в качестве элюента. После концентрации (как описано выше) соответствующих объединенных фракций получают чистый ацетонид, соединение II.
Общая процедура 6. Защита 25-моногидроксильных соединений II триметилсилилированием
Триметилхлорсилан (1,08 г, 10 ммоль) в течение 10 минут при 0°С добавляют к перемешиваемому раствору 25-гидрокси-26-трет-бутилдиметилсилилокси-(или 26-фтор-)соединения II (5,0 ммоль), триэтиламина (1,51 г, 15 ммоль) и DMAP (5 мг) в сухом дихлорметане (10 мл). Перемешивание продолжают в течение 48 часов при 25°С. После окончательной обаботки (простым эфиром) сырой продукт очищают хроматографией с петролейным эфиром в качестве элюента, получая чистое 25-триметилсилилокси-26-трет-бутилдиметилсилилокси-(или 26-фтор-)соединение II.
Общая процедура 7. Синтез соединения III из соединения I и структурного блока боковой цепи II
К раствору соответствующего структурного блока боковой цепи, соединение II (3,0 ммоль) в сухом ТГФ (5 мл), охлажденного до -78°С и перемешиваемого в атмосфере аргона, в течение 2 минут по каплям добавляют раствор н-бутиллития (1, 6М в гексане; 1,5 мл). Перемешивание продолжают при -78°С в течение 15 минут и при 20°С в течение еще 15 минут. Смесь вновь охлаждают до -78°С и в течение 4 минут по каплям добавляют раствор альдегида, соединение 1 (1,5 ммоль) в сухом ТГФ (5 мл), после чего перемешивание продолжают при -78°С в течение 30 минут. Реакционную смесь окончательно обрабатывают (простой эфир), получая сырой продукт, содержащий изомерные, 22-гидроксильные соединения А (менее полярное) и В (более полярное). Их разделяют хроматографией (смесь этилацетата и петролейного эфира в качестве элюента), получая чистые соединения III.
Вариант: Общая процедура 7а
Повторяют ход общей процедуры 7 за исключением того, что применяют 1,87 мл н-бутиллития (1,6 М) и 3 ммоля соединения I.
Общая процедура 8. Фозюиаомерилация соединения III в соединение IV
Раствор соответствующего соединения III (0,28 ммоль), антрацена (0,1 г) и триэтиламина (0,20 мл, 1,4 ммоль) в дихлорметане (16 мл) в 25-мл круглодонной колбе Руrех облучают приблизительно при 10°С УФ-светом от ультрафиолетовой лампы высокого давления типа TQ760Z2 (Hanau) при 700 Вт в течение 30 минут (15 минут при шкале 0,08 ммоль) при перемешивании. Реакционную смесь упаривают в вакууме, а остаток обрабатывают петролейным эфиром (2 2 мл) и фильтруют. Фильтрат концентрируют и очищают хроматографией, получая требуемое соединение IV.
Вариант: Общая процедура 8а
Раствор соответствующего соединения III (0,13 ммоль), 9-ацетилантрацена (23 мг) и триэтиламина (0,10 мл, 0,7 ммоль) в толуоле (5 мл) в 10-мл круглодонной пробирке Руrех облучают приблизительно при 10°С УФ-светом от ультрафиолетовой лампы высокого давления типа TQ150Z2 (Hanau) (150 Вт) в течение 60 минут. Реакционную смесь охлаждают до -20°С и фильтруют. Фильтрат выпаривают в вакууме, а остаток очищают хроматографией, получая требуемое соединение IV вместе с некоторым количеством 9-ацетилантрацена, которые удаляют после конечной стадии снятия защиты.
Общая процедура 9. Алкилирование С-22-гидроксисоединения III или IV
К раствору соответствующего 22-гидроксисоединения (R=H) (0,5 ммоль) в сухом ТГФ (5 мл) при перемешивании при 20°С в атмосфере аргона добавляют 20% суспензию гидрида калия в минеральном масле (0,2 мл), а затем алкилирующий агент RZ (1,5 ммоль) и, наконец, в течение 5 минут раствор 18-Краун-6 (0,13 г) в сухом ТГФ (2 мл). Перемешивание при 25°С продолжают в течение двух часов, после чего реакционную смесь окончательно обрабатывают (простой эфир). Сырой продукт очищают хроматографией (смесь простого и петролейного эфира в качестве элюента), получая требуемое алкоксисоединение III или IV.
Общая процедура 10. Синтез соединения I путем снятия защиты соединения IV с применением HF
К перемешиваемому раствору соответствующего соединения IV (0,25 ммоль) в этилацетате (3 мл) добавляют ацетонитрил (6 мл), а затем 5% раствор фтористоводородной кислоты в ацетонитриле-Н2О 7:1 (4 мл). После перемешивания в течение 2 часов при 25°С добавляют этилацетат (40 мл) и 1М бикарбонат натрий (20 мл) и реакционную смесь окончательно обрабатывают этилацетатом. Остаток очищают хроматографией, получая требуемое соединение I.
Общая процедура 11. Синтез мезилатов сложных эфиров молочной кислоты
Раствор метансульфонилхлорида (18,6 мл, 27,5 г, 0,24 моль) в трет-бутилметиловом простом эфире (100 мл) добавляют в течение часа к перемешиваемому раствору соответствующего R или S, метил или этил, лактата (0,20 моль), триэтиламина (28,3 г, 0,28 моль) и DMAP (0,24 г, 0,002 моль) в трет-бутилметиловом простом эфире (200 мл) при охлаждении на ледяной бане. Перемешивание продолжают в течение 0,5 часа на ледяной бане, а затем в течение 2 часов при 25°С. Реакционную смесь вновь охлаждают на ледяной бане и медленно добавляют воду (250 мл), поддерживая температуру ниже 10°С. После перемешивания еще в течение 20 минут фазы разделяют и водную фазу дважды экстрагируют простым эфиром (100 мл). Объединенные органические фазы экстрагируют: 1н серной кислотой (100 мл), водой (100 мл), 1М бикарбонатом натрия (100 мл), водой (2 2 мл) и фильтруют. Фильтрат концентрируют и очищают хроматографией, получая требуемое соединение IV.
Вариант: Общая процедура 8а
Раствор соответствующего соединения III (0,13 ммоль), 9-ацетилантрацена (23 мг) и триэтиламина (0,10 мл, 0,7 ммоль) в толуоле (5 мл) в 10-мл круглодонной пробирке Руrех облучают приблизительно при 10°С УФ-светом от ультрафиолетовой лампы высокого давления типа TQ150Z2 (Hanau) (150 Вт) в течение 60 минут. Реакционную смесь охлаждают до -20°С и фильтруют. Фильтрат выпаривают в вакууме, а остаток очищают хроматографией, получая требуемое соединение IV вместе с некоторым количеством 9-ацетилантрацена, которые удаляют после конечной стадии снятия защиты.
Общая процедура 9. Алкилирование С-22-гидроксисоединения III или IV
К раствору соответствующего 22-гидроксисоединения (R=H) (0,5 ммоль) в сухом ТГФ (5 мл) при перемешивании при 20°С в атмосфере аргона добавляют 20% суспензию гидрида калия в минеральном масле (0,2 мл), а затем алкилирующий агент RZ (1,5 ммоль) и, наконец, в течение 5 минут раствор 18-Краун-6 (0,13 г) в сухом ТГФ (2 мл). Перемешивание при 25°С продолжают в течение двух часов, после чего реакционную смесь окончательно обрабатывают (простой эфир). Сырой продукт очищают хроматографией (смесь простого и петролейного эфира в качестве элюента), получая требуемое алкоксисоединение III или IV.
Общая процедура 10. Синтез соединения I путем снятия защиты соединения IV с применением HF
К перемешиваемому раствору соответствующего соединения IV (0,25 ммоль) в этилацетате (3 мл) добавляют ацетонитрил (6 мл), а затем 5% раствор фтористоводородной кислоты в ацетонитриле-Н2О 7:1 (4 мл). После перемешивания в течение 2 часов при 25°С добавляют этилацетат (40 мл) и 1М бикарбонат натрий (20 мл) и реакционную смесь окончательно обрабатывают этилацетатом. Остаток очищают хроматографией, получая требуемое соединение I.
Общая процедура 11. Синтез мезилатов сложных эфиров молочной кислоты
Раствор метансульфонилхлорида (18,6 мл, 27,5 г, 0,24 моль) в трет-бутилметиловом простом эфире (100 мл) добавляют в течение часа к перемешиваемому раствору соответствующего R или S, метил или этил, лактата (0,20 моль), триэтиламина (28,3 г, 0,28 моль) и DMAP (0,24 г, 0,002 моль) в трет-бутилметиловом простом эфире (200 мл) при охлаждении на ледяной бане. Перемешивание продолжают в течение 0,5 часа на ледяной бане, а затем в течение 2 часов при 25°С. Реакционную смесь вновь охлаждают на ледяной бане и медленно добавляют воду (250 мл), поддерживая температуру ниже 10°С. После перемешивания еще в течение 20 минут фазы разделяют и водную фазу дважды экстрагируют простым эфиром (100 мл). Объединенные органические фазы экстрагируют: 1н серной кислотой (100 мл), водой (100 мл), 1М бикарбонатом натрия (100 мл), водой (2 100 мл) и насыщенным водным хлоридом натрия (100 мл). После сушки сульфатом натрия раствор концентрируют (при 35°С и 0,2 бар), а остаток фракционируют в вакууме на 45-см колонке типа Podbielniak, получая требуемое соединение, указанное в заголовке.
Общая процедура 12. Синтез R или S, метил или этил, 2-фторпропионата
Раствор соответствующего мезилата сложного эфира молочной кислоты (0,125 моль) добавляют на протяжении приблизительно одного часа к раствору/суспензии (лиофилизованного) фторида калия (29 г, 0,5 моль) в формамиде (70 мл), который перемешивают и нагревают на масляной бане при 60°С в вакууме, составляющем около 27 мбар. Колба оборудована боковым отводом типа Claisen, связанным с охлаждаемыми сухим льдом холодильником и сборником, в котором конденсируют сложный эфир 2-фторпропионовой кислоты, непрерывно отгоняемый из реакционной смеси. Перемешивание при 60°С и 20 мм Нg продолжают до тех пор, пока конденсация дистиллята не прекратится, т.е. в течение 4-5 часов. Дистиллят, содержащий некоторое количество воды, разбавляют простым эфиром (40 мл), сушат сульфатом магния и очищяют перегонкой на установке, подобной установке, применяемой для вышеуказанного получения, поддерживая температуру ванны довольно постоянной при 50-60°С и постепенно снижая давление до тех пор, пока в сборнике не будет собрано чистое, указанное в заголовке соединение.
Получение 1. Соединение 502
Раствор (+)-этил-D-лактата (R-изомер, неприродный) (5,2 г, 44 ммоль), имидазол (13,6 г) и трет-бутилдиметилсилилхлорид (15 г) в сухом ДМФ (50 мл) перемешивают при 25°С в течение 1 часа. Добавляют этилацетат (200 мл) и органический раствор экстрагируют водой (2 100 мл) и насыщенным водным хлоридом натрия (100 мл). После сушки сульфатом натрия раствор концентрируют (при 35°С и 0,2 бар), а остаток фракционируют в вакууме на 45-см колонке типа Podbielniak, получая требуемое соединение, указанное в заголовке.
Общая процедура 12. Синтез R или S, метил или этил, 2-фторпропионата
Раствор соответствующего мезилата сложного эфира молочной кислоты (0,125 моль) добавляют на протяжении приблизительно одного часа к раствору/суспензии (лиофилизованного) фторида калия (29 г, 0,5 моль) в формамиде (70 мл), который перемешивают и нагревают на масляной бане при 60°С в вакууме, составляющем около 27 мбар. Колба оборудована боковым отводом типа Claisen, связанным с охлаждаемыми сухим льдом холодильником и сборником, в котором конденсируют сложный эфир 2-фторпропионовой кислоты, непрерывно отгоняемый из реакционной смеси. Перемешивание при 60°С и 20 мм Нg продолжают до тех пор, пока конденсация дистиллята не прекратится, т.е. в течение 4-5 часов. Дистиллят, содержащий некоторое количество воды, разбавляют простым эфиром (40 мл), сушат сульфатом магния и очищяют перегонкой на установке, подобной установке, применяемой для вышеуказанного получения, поддерживая температуру ванны довольно постоянной при 50-60°С и постепенно снижая давление до тех пор, пока в сборнике не будет собрано чистое, указанное в заголовке соединение.
Получение 1. Соединение 502
Раствор (+)-этил-D-лактата (R-изомер, неприродный) (5,2 г, 44 ммоль), имидазол (13,6 г) и трет-бутилдиметилсилилхлорид (15 г) в сухом ДМФ (50 мл) перемешивают при 25°С в течение 1 часа. Добавляют этилацетат (200 мл) и органический раствор экстрагируют водой (2 100 мл), 3М CaCl2 (2 100 мл), 3М CaCl2 (2 100 мл), водой (100 мл) и 35% NaCl (100 мл), сушат сульфатом натрия и концентрируют в вакууме. Сырой продукт очищают хроматографией с 1% простым эфиром в петролейном эфире в качестве элюента, получая соединение 502 в виде масла.
[ 100 мл), водой (100 мл) и 35% NaCl (100 мл), сушат сульфатом натрия и концентрируют в вакууме. Сырой продукт очищают хроматографией с 1% простым эфиром в петролейном эфире в качестве элюента, получая соединение 502 в виде масла.
[ ]20d+30,5° (с 2,14, СНСl3)
13С ЯМР ]20d+30,5° (с 2,14, СНСl3)
13С ЯМР  173,9, 68,3, 60,5, 25,5, 21,1, 18,1, 14,0, -5,1, -5,5.
Получение 2. Соединение 503
Способ: Общая процедура 1
Исходный материал: этил (S)-(-)-O-трет-бутилдиметилсилиллактат (соединение 501)
Элюент для хроматографии: 0-5% простой эфир в петролейном эфире.
[ 173,9, 68,3, 60,5, 25,5, 21,1, 18,1, 14,0, -5,1, -5,5.
Получение 2. Соединение 503
Способ: Общая процедура 1
Исходный материал: этил (S)-(-)-O-трет-бутилдиметилсилиллактат (соединение 501)
Элюент для хроматографии: 0-5% простой эфир в петролейном эфире.
[ ]20D-10,8° (с 2,17, СНСl3)
13С ЯМР ]20D-10,8° (с 2,17, СНСl3)
13С ЯМР  214,7, 74,6, 29,9, 25,5, 20,8, 17,8, 7,1, -4,9, -5,3.
Получение 3. Соединение 504
Способ: Общая процедура 1
Исходный материал: соединение 502
Элюент для хроматографии: 0-5% простой эфир в петролейном эфире.
13С ЯМР 214,7, 74,6, 29,9, 25,5, 20,8, 17,8, 7,1, -4,9, -5,3.
Получение 3. Соединение 504
Способ: Общая процедура 1
Исходный материал: соединение 502
Элюент для хроматографии: 0-5% простой эфир в петролейном эфире.
13С ЯМР  214,7, 74,6, 29,9, 25,5, 20,8, 17,8, 7,1, -4,9, -5,3.
Получение 4. Соединение 201 (+ соединение 205)
Способ: Общая процедура 2
Исходный материал: соединение 503
Элюент для хроматографии: 1% простой эфир в петролейном эфире.
13С ЯМР 214,7, 74,6, 29,9, 25,5, 20,8, 17,8, 7,1, -4,9, -5,3.
Получение 4. Соединение 201 (+ соединение 205)
Способ: Общая процедура 2
Исходный материал: соединение 503
Элюент для хроматографии: 1% простой эфир в петролейном эфире.
13С ЯМР  1H ЯМР d 81,1, 75,6, 71,3, 70,0, 26,5, 25,8, 25,6, 17,8, 17,1, 7,4, -4,3, -5,2.
Получение 5. Соединение 202
Способ: Общая процедура 4
Исходный материал: соединение 201
Элюент для хроматографии: 25-50% простой эфир в петролейном эфире.
13С ЯМР 1H ЯМР d 81,1, 75,6, 71,3, 70,0, 26,5, 25,8, 25,6, 17,8, 17,1, 7,4, -4,3, -5,2.
Получение 5. Соединение 202
Способ: Общая процедура 4
Исходный материал: соединение 201
Элюент для хроматографии: 25-50% простой эфир в петролейном эфире.
13С ЯМР  80,7, 75,5, 71,2, 71,1, 27,1, 26,0, 17,1, 7,6.
Получение 6. Соединение 203
Способ: Общая процедура 5
Исходный материал: соединение 202
Элюент для хроматографии: 5% простой эфир в петролейном эфире.
13С ЯМР 80,7, 75,5, 71,2, 71,1, 27,1, 26,0, 17,1, 7,6.
Получение 6. Соединение 203
Способ: Общая процедура 5
Исходный материал: соединение 202
Элюент для хроматографии: 5% простой эфир в петролейном эфире.
13С ЯМР  106,8, 82,4, 80,2, 78,2, 70,8, 28,3, 26,7, 25,6, 25,0, 14,6, 7,2.
Получение 7. Соединение 204
Способ: Общая процедура 6
Исходный материал: соединение 201
Элюент для хроматографии: петролейный эфир.
[ 106,8, 82,4, 80,2, 78,2, 70,8, 28,3, 26,7, 25,6, 25,0, 14,6, 7,2.
Получение 7. Соединение 204
Способ: Общая процедура 6
Исходный материал: соединение 201
Элюент для хроматографии: петролейный эфир.
[ ]20D-4,4° (с 1,8, СНСl3)
13С ЯМР ]20D-4,4° (с 1,8, СНСl3)
13С ЯМР  82,2, 80,1, 71,4, 70,3, 28,8, 25,8, 24,9, 17,9, 17,3, 7,5, 2,4, -4,4, -4,9.
Получение 8. Соединение 205 (+ соединение 201)
Способ: Общая процедура 2
Исходный материал: соединение 503
Элюент для хроматографии: 1% простой эфир в петролейном эфире.
13С ЯМР 82,2, 80,1, 71,4, 70,3, 28,8, 25,8, 24,9, 17,9, 17,3, 7,5, 2,4, -4,4, -4,9.
Получение 8. Соединение 205 (+ соединение 201)
Способ: Общая процедура 2
Исходный материал: соединение 503
Элюент для хроматографии: 1% простой эфир в петролейном эфире.
13С ЯМР  80,8, 75,1, 72,3, 70,2, 27,8, 25,6, 24,4, 17,8, 17,6, 7,4, -4,3, -5,2.
Получение 9. Соединение 206
Способ: Общая процедура 4
Исходный материал: соединение 205
Элюент для хроматографии: 25-50% простой эфир в петролейном эфире.
13С ЯМР 80,8, 75,1, 72,3, 70,2, 27,8, 25,6, 24,4, 17,8, 17,6, 7,4, -4,3, -5,2.
Получение 9. Соединение 206
Способ: Общая процедура 4
Исходный материал: соединение 205
Элюент для хроматографии: 25-50% простой эфир в петролейном эфире.
13С ЯМР  80,8, 75,2, 71,6, 71,1, 29,1, 24,7, 17,0, 7,4.
Получение 10. Соединение 207
Способ: Общая процедура 5
Исходный материал: соединение 206
Элюент для хроматографии: 5% простой эфир в петролейном эфире.
13С ЯМР 80,8, 75,2, 71,6, 71,1, 29,1, 24,7, 17,0, 7,4.
Получение 10. Соединение 207
Способ: Общая процедура 5
Исходный материал: соединение 206
Элюент для хроматографии: 5% простой эфир в петролейном эфире.
13С ЯМР  106,9, 83,1, 81,0, 76,8, 70,1, 28,4, 28,2, 26,5, 24,5, 14,5, 8,1.
Получение 11. Соединение 208
Способ: Общая процедура 6
Исходный материал: соединение 205
Элюент для хроматографии: петролейный эфир.
[ 106,9, 83,1, 81,0, 76,8, 70,1, 28,4, 28,2, 26,5, 24,5, 14,5, 8,1.
Получение 11. Соединение 208
Способ: Общая процедура 6
Исходный материал: соединение 205
Элюент для хроматографии: петролейный эфир.
[ ]20D+6,9° (с 1,6, СНСl3)
13С ЯМР ]20D+6,9° (с 1,6, СНСl3)
13С ЯМР  82,0, 79,8, 72,7, 70,5, 27,9, 27,0, 25,8, 25,7, 17,6, 8,3, 2,5, -4,4, -5,0.
Получение 12. Соединение 209 (+ соединение 211)
Способ: Общая процедура 2
Исходный материал: соединение 504
Элюент для хроматографии: 1-2% простой эфир в петролейном эфире.
13С ЯМР 82,0, 79,8, 72,7, 70,5, 27,9, 27,0, 25,8, 25,7, 17,6, 8,3, 2,5, -4,4, -5,0.
Получение 12. Соединение 209 (+ соединение 211)
Способ: Общая процедура 2
Исходный материал: соединение 504
Элюент для хроматографии: 1-2% простой эфир в петролейном эфире.
13С ЯМР  81,1, 75,6, 71,3, 70,0, 26,5, 25,8, 25,6, 17,8, 17,1, 7,4, -4,3, -5,2.
Получение 13. Соединение 210
Способ: Общая процедура 6
Исходный материал: соединение 209
Элюент для хроматографии: петролейный эфир.
[ 81,1, 75,6, 71,3, 70,0, 26,5, 25,8, 25,6, 17,8, 17,1, 7,4, -4,3, -5,2.
Получение 13. Соединение 210
Способ: Общая процедура 6
Исходный материал: соединение 209
Элюент для хроматографии: петролейный эфир.
[ ]20D+4,1° (с 2,1, СНСl3)
13С ЯМР ]20D+4,1° (с 2,1, СНСl3)
13С ЯМР  82,2, 80,1, 71,4, 70,3, 28,8, 25,8, 25,0, 17,9, 17,3, 7,5, 2,4, -4,4, -4,9.
Получение 14. Соединение 211 (+ соединение 209)
Способ: Общая процедура 2
Исходный материал: соединение 504
Элюент для хроматографии: 1-2% простой эфир в петролейном эфире.
13С ЯМР 82,2, 80,1, 71,4, 70,3, 28,8, 25,8, 25,0, 17,9, 17,3, 7,5, 2,4, -4,4, -4,9.
Получение 14. Соединение 211 (+ соединение 209)
Способ: Общая процедура 2
Исходный материал: соединение 504
Элюент для хроматографии: 1-2% простой эфир в петролейном эфире.
13С ЯМР  80,8, 75,1, 72,3, 70,2, 27,8, 25,6, 24,4, 17,8, 17,6, 7,4, -4,3, -5,2.
Получение 15. Соединение 212
Способ: Общая процедура 6
Исходный материал: соединение 211
Элюент для хроматографии: петролейный эфир.
[ 80,8, 75,1, 72,3, 70,2, 27,8, 25,6, 24,4, 17,8, 17,6, 7,4, -4,3, -5,2.
Получение 15. Соединение 212
Способ: Общая процедура 6
Исходный материал: соединение 211
Элюент для хроматографии: петролейный эфир.
[ ]20D-7,0° (с 1,2, СНСl3)
13С ЯМР ]20D-7,0° (с 1,2, СНСl3)
13С ЯМР  82,0, 79,8, 72,8, 70,5, 27,9, 27,0, 25,7, 17,8, 17,6, 8,3, 2,5, -4,4, -5,0.
Получение 16. Соединение 213 + соединение 217
Способ: Общая процедура 3
Исходный материал: соединение 503
Элюент для хроматографии: 0-2% простой эфир в петролейном эфире.
Соединение 213
13H ЯМР 82,0, 79,8, 72,8, 70,5, 27,9, 27,0, 25,7, 17,8, 17,6, 8,3, 2,5, -4,4, -5,0.
Получение 16. Соединение 213 + соединение 217
Способ: Общая процедура 3
Исходный материал: соединение 503
Элюент для хроматографии: 0-2% простой эфир в петролейном эфире.
Соединение 213
13H ЯМР  3,70 (кв, 1Н), 2,51 (с, 1Н), 1,80 (м, 1Н), 1,64 (м, 1Н), 1,25 (д, 3Н), 0,98 (т, 3Н), 0,88 (с, 9Н), 0,20 (с, 6Н).
Соединение 217
13С ЯМР 3,70 (кв, 1Н), 2,51 (с, 1Н), 1,80 (м, 1Н), 1,64 (м, 1Н), 1,25 (д, 3Н), 0,98 (т, 3Н), 0,88 (с, 9Н), 0,20 (с, 6Н).
Соединение 217
13С ЯМР  83,9, 74,7, 73,3, 73,1, 31,0, 25,6, 25,5, 18,6, 8,1, -4,3, -5,1.
Получение 17. Соединение 214 + соединение 218
Способ: Общая процедура 3а
Исходный материал: соединение 503
Элюент для хроматографии: 0-1% простой эфир в петролейном эфире.
Соединение 214
13С ЯМР 83,9, 74,7, 73,3, 73,1, 31,0, 25,6, 25,5, 18,6, 8,1, -4,3, -5,1.
Получение 17. Соединение 214 + соединение 218
Способ: Общая процедура 3а
Исходный материал: соединение 503
Элюент для хроматографии: 0-1% простой эфир в петролейном эфире.
Соединение 214
13С ЯМР  105,9, 89,2, 74,6, 73,5, 30,9, 25,7, 18,7, 17,2, 8,3, -0,3, -4,5, -4,9.
Соединение 218
13С ЯМР 105,9, 89,2, 74,6, 73,5, 30,9, 25,7, 18,7, 17,2, 8,3, -0,3, -4,5, -4,9.
Соединение 218
13С ЯМР  105,9, 89,6, 75,1, 73,4, 30,9, 25,7, 25,6, 18,7, 8,3, -0,3, -4,2, -5,0.
Получение 18. Соединение 215 + соединение 219
Способ: Общая процедура 4
Исходный материал:
соединение 213 + соединение 217, или
соединение 214 + соединение 218
Элюент для хроматографии:
а) 40% простой эфир в петролейном эфире.
b) 33% простой эфир в петролейном эфире.
Соединение 215
13H ЯМР 105,9, 89,6, 75,1, 73,4, 30,9, 25,7, 25,6, 18,7, 8,3, -0,3, -4,2, -5,0.
Получение 18. Соединение 215 + соединение 219
Способ: Общая процедура 4
Исходный материал:
соединение 213 + соединение 217, или
соединение 214 + соединение 218
Элюент для хроматографии:
а) 40% простой эфир в петролейном эфире.
b) 33% простой эфир в петролейном эфире.
Соединение 215
13H ЯМР  3,84 (1Н, кв), 2,49 (1H, с), 1,74 (1Н, м), 1,61 (1Н, м), 1,27 (3Н, д), 1,09 (3Н, т).
Соединение 219
Кристаллизуют из смеси простой эфир/н-гептан, т.пл. 52-53°С.
13H ЯМР 3,84 (1Н, кв), 2,49 (1H, с), 1,74 (1Н, м), 1,61 (1Н, м), 1,27 (3Н, д), 1,09 (3Н, т).
Соединение 219
Кристаллизуют из смеси простой эфир/н-гептан, т.пл. 52-53°С.
13H ЯМР  3,65 (кв, 1Н), 2,46 (с, 1Н), 1,65 (м, 2Н), 1,31 (д, 3Н), 1,08 (т, 3Н).
Получение 19. Соединение 216
Способ: Общая процедура 5а
Исходный материал: соединение 219
Элюент для хроматографии: 5% простой эфир в петролейном эфире.
13С ЯМР 3,65 (кв, 1Н), 2,46 (с, 1Н), 1,65 (м, 2Н), 1,31 (д, 3Н), 1,08 (т, 3Н).
Получение 19. Соединение 216
Способ: Общая процедура 5а
Исходный материал: соединение 219
Элюент для хроматографии: 5% простой эфир в петролейном эфире.
13С ЯМР  108,6, 83,9, 79,3, 79,2, 72,8, 29,3, 28,3, 26,0, 13,6, 8,2.
Получение 20. Соединение 220
Способ: Общая процедура 5а
Исходный материал: соединение 215
Элюент для хроматографии: 5% простой эфир в петролейном эфире.
13С ЯМР 108,6, 83,9, 79,3, 79,2, 72,8, 29,3, 28,3, 26,0, 13,6, 8,2.
Получение 20. Соединение 220
Способ: Общая процедура 5а
Исходный материал: соединение 215
Элюент для хроматографии: 5% простой эфир в петролейном эфире.
13С ЯМР  108,6, 82,8, 81,3, 78,4, 75,1, 31,3, 27,6, 27,1, 15,8, 8,8.
Получение 21. Соединение 301 + соединение 302
Способ: Общая процедура 7
Исходный материал: соединение 204
Элюент для хроматографии: 0-10% простой эфир в петролейном эфире.
Соединение 301
13С ЯМР 108,6, 82,8, 81,3, 78,4, 75,1, 31,3, 27,6, 27,1, 15,8, 8,8.
Получение 21. Соединение 301 + соединение 302
Способ: Общая процедура 7
Исходный материал: соединение 204
Элюент для хроматографии: 0-10% простой эфир в петролейном эфире.
Соединение 301
13С ЯМР  153,4, 142,8, 135,3, 121,5, 116,4, 106,5, 83,2, 82,9, 80,3, 71,6, 70,1, 67,0, 64,6, 56,0, 51,4, 45,5, 43,8, 41,0, 39,6, 36,4, 29,0, 28,7, 26,4, 25,8, 25,7, 25,6, 25,2, 23,2, 21,9, 18,1, 17,9, 17,9, 17,3, 13,0, 12,4, 7,6, 2,5, -4,3.
Соединение 302
13С ЯМР 153,4, 142,8, 135,3, 121,5, 116,4, 106,5, 83,2, 82,9, 80,3, 71,6, 70,1, 67,0, 64,6, 56,0, 51,4, 45,5, 43,8, 41,0, 39,6, 36,4, 29,0, 28,7, 26,4, 25,8, 25,7, 25,6, 25,2, 23,2, 21,9, 18,1, 17,9, 17,9, 17,3, 13,0, 12,4, 7,6, 2,5, -4,3.
Соединение 302
13С ЯМР  152,5, 141,9, 134,3, 120,5, 115,4, 105,5, 82,3, 82,0, 79,3, 70,7, 69,1, 66,0, 64,7, 55,1, 51,1, 44,6, 42,8, 41,5, 39,2, 35,5, 28,0, 27,7, 26,0, 24,9, 24,7, 24,6, 24,4, 22,3, 21,0, 17,1, 17,0, 16,9, 16,4, 12,4, 10,8, 6,6, 1,5, -5,3, -5,8, -5,9.
Получение 22. Соединение 401
Способ: Общая процедура 8
Исходный материал: соединение 301
Элюент для хроматографии: 0-2% простой эфир в петролейном эфире.
13С ЯМР 152,5, 141,9, 134,3, 120,5, 115,4, 105,5, 82,3, 82,0, 79,3, 70,7, 69,1, 66,0, 64,7, 55,1, 51,1, 44,6, 42,8, 41,5, 39,2, 35,5, 28,0, 27,7, 26,0, 24,9, 24,7, 24,6, 24,4, 22,3, 21,0, 17,1, 17,0, 16,9, 16,4, 12,4, 10,8, 6,6, 1,5, -5,3, -5,8, -5,9.
Получение 22. Соединение 401
Способ: Общая процедура 8
Исходный материал: соединение 301
Элюент для хроматографии: 0-2% простой эфир в петролейном эфире.
13С ЯМР  148,2, 140,4, 135,0, 122,9, 117,9, 111,0, 83,1, 82,9, 80,3, 71,8, 71,6, 67,3, 64,6, 55,9, 51,4, 45,8, 45,3, 44,6, 41,0, 39,7, 29,0, 28,6, 26,5, 25,8, 25,7, 25,6, 25,2, 23,2, 21,8, 18,0, 17,9, 17,3, 13,0, 12,3, 7,6, 2,5, -4,3, -4,9, -5,0, -5,3.
Получение 23. Соединение 402
Способ: Общая процедура 9
Исходный материал: соединение 401
Алкилирующий агент: метилиодид
Элюент для хроматографии: 0-1% простой эфир в петролейном эфире.
13С ЯМР 148,2, 140,4, 135,0, 122,9, 117,9, 111,0, 83,1, 82,9, 80,3, 71,8, 71,6, 67,3, 64,6, 55,9, 51,4, 45,8, 45,3, 44,6, 41,0, 39,7, 29,0, 28,6, 26,5, 25,8, 25,7, 25,6, 25,2, 23,2, 21,8, 18,0, 17,9, 17,3, 13,0, 12,3, 7,6, 2,5, -4,3, -4,9, -5,0, -5,3.
Получение 23. Соединение 402
Способ: Общая процедура 9
Исходный материал: соединение 401
Алкилирующий агент: метилиодид
Элюент для хроматографии: 0-1% простой эфир в петролейном эфире.
13С ЯМР  148,2, 140,6, 134,9, 122,9, 117,8, 111,0, 83,9, 80,8, 80,4, 73,6, 71,8, 71,7, 67,4, 56,0, 55,8, 51,4, 45,8, 45,3, 44,6, 40,4, 39,4, 29,1, 28,7, 26,5, 25,9, 25,7, 25,6, 25,3, 23,3, 21,8, 19,2, 18,0, 18,0, 17,4, 13,8, 12,4, 7,6, 2,5, -4,4, -4,9, -5,0, -5,3.
Получение 24. Соединение 403
Способ: Общая процедура 9
Исходный материал: соединение 401
Алкилирующий агент: этилбромид
Элюент для хроматографии: 0-1% простой эфир в петролейном эфире.
13С ЯМР 148,2, 140,6, 134,9, 122,9, 117,8, 111,0, 83,9, 80,8, 80,4, 73,6, 71,8, 71,7, 67,4, 56,0, 55,8, 51,4, 45,8, 45,3, 44,6, 40,4, 39,4, 29,1, 28,7, 26,5, 25,9, 25,7, 25,6, 25,3, 23,3, 21,8, 19,2, 18,0, 18,0, 17,4, 13,8, 12,4, 7,6, 2,5, -4,4, -4,9, -5,0, -5,3.
Получение 24. Соединение 403
Способ: Общая процедура 9
Исходный материал: соединение 401
Алкилирующий агент: этилбромид
Элюент для хроматографии: 0-1% простой эфир в петролейном эфире.
13С ЯМР  148,2, 140,7, 134,8, 123,0, 117,7, 111,0, 83,3, 81,4, 80,4, 72,0, 71,8, 71,7, 67,4, 63,8, 55,9, 51,4, 45,8, 45,4, 44,6, 40,3, 39,3, 29,1, 28,7, 26,4, 25,9, 25,7, 25,6, 25,3, 23,3, 21,8, 18,1, 18,0, 17,4, 15,0, 13,9, 12,4, 7,6, 2,5, -4,4, -4,9, – 5,0, -5,3.
Получение 25. Соединение 404
Способ: Общая процедура 9
Исходный материал: соединение 401
Алкилирующий агент: пропилбромид
Элюент для хроматографии: 0-1% простой эфир в петролейном эфире.
13С ЯМР 148,2, 140,7, 134,8, 123,0, 117,7, 111,0, 83,3, 81,4, 80,4, 72,0, 71,8, 71,7, 67,4, 63,8, 55,9, 51,4, 45,8, 45,4, 44,6, 40,3, 39,3, 29,1, 28,7, 26,4, 25,9, 25,7, 25,6, 25,3, 23,3, 21,8, 18,1, 18,0, 17,4, 15,0, 13,9, 12,4, 7,6, 2,5, -4,4, -4,9, – 5,0, -5,3.
Получение 25. Соединение 404
Способ: Общая процедура 9
Исходный материал: соединение 401
Алкилирующий агент: пропилбромид
Элюент для хроматографии: 0-1% простой эфир в петролейном эфире.
13С ЯМР  148,2, 140,8, 134,8, 123,0, 117,7 111,0, 83,3, 81,5, 80,5, 72,1, 71,8, 71,7, 70,1, 67,4, 55,9, 51,4, 45,8, 45,4, 44,6, 40,4, 39,5, 29,1, 28,7, 26,3, 25,9, 25,7, 25,6, 25,3, 23,3, 22,9, 21,8, 18,0, 18,0, 17,3, 13,9, 12,4, 10,7, 7,6, 2,5, -4,4, -4,9, -5,0, -5,3.
Получение 26. Соединение 405
Способ: Общая процедура 9
Исходный материал: соединение 401
Алкилирующий агент: бензилбромид
Элюент для хроматографии: 0-1% простой эфир в петролейном эфире.
13С ЯМР 148,2, 140,8, 134,8, 123,0, 117,7 111,0, 83,3, 81,5, 80,5, 72,1, 71,8, 71,7, 70,1, 67,4, 55,9, 51,4, 45,8, 45,4, 44,6, 40,4, 39,5, 29,1, 28,7, 26,3, 25,9, 25,7, 25,6, 25,3, 23,3, 22,9, 21,8, 18,0, 18,0, 17,3, 13,9, 12,4, 10,7, 7,6, 2,5, -4,4, -4,9, -5,0, -5,3.
Получение 26. Соединение 405
Способ: Общая процедура 9
Исходный материал: соединение 401
Алкилирующий агент: бензилбромид
Элюент для хроматографии: 0-1% простой эфир в петролейном эфире.
13С ЯМР  148,2, 140,7, 138,5, 134,9, 128,2, 128,0, 127,6, 127,4, 127,1, 122,9, 117,7, 111,0, 84,1, 81,0, 80,4, 71,8, 71,7, 70,1, 67,4, 55,8, 51,4, 45,8, 45,4, 44,6, 40,4, 39,4, 29,2, 28,7, 26,3, 25,9, 25,7, 25,6, 25,3, 23,2, 21,8, 18,0, 18,0, 17,4, 14,0, 12,4, 7,7, 2,5, -4,4, -4,9, -5,0, -5,3.
Получение 27. Соединение 303
Способ: Общая процедура 7
Исходный материал: соединение 208
Элюент для хроматографии: 0-2% простой эфир в петролейном эфире.
13С ЯМР 148,2, 140,7, 138,5, 134,9, 128,2, 128,0, 127,6, 127,4, 127,1, 122,9, 117,7, 111,0, 84,1, 81,0, 80,4, 71,8, 71,7, 70,1, 67,4, 55,8, 51,4, 45,8, 45,4, 44,6, 40,4, 39,4, 29,2, 28,7, 26,3, 25,9, 25,7, 25,6, 25,3, 23,2, 21,8, 18,0, 18,0, 17,4, 14,0, 12,4, 7,7, 2,5, -4,4, -4,9, -5,0, -5,3.
Получение 27. Соединение 303
Способ: Общая процедура 7
Исходный материал: соединение 208
Элюент для хроматографии: 0-2% простой эфир в петролейном эфире.
13С ЯМР  153,4, 142,8, 135,3, 121,5, 116,4, 106,5, 83,1, 82,9, 80,0, 77,0, 72,9, 70,1, 67,0, 64,6, 56,0, 51,4, 45,5, 43,8, 41,0, 39,6, 36,4, 28,7, 28,0, 27,2, 26,4, 25,8, 25,7, 25,7, 25,6, 23,2, 21,9, 18,1, 17,9, 17,7, 13,0, 12,4, 8,4, 2,5, -4,4, -5,0, -5,1, -5,1.
Получение 28. Соединение 406
Способ: Общая процедура 8
Исходный материал: соединение 303
Элюент для хроматографии: 0-5% простой эфир в петролейном эфире.
13С ЯМР 153,4, 142,8, 135,3, 121,5, 116,4, 106,5, 83,1, 82,9, 80,0, 77,0, 72,9, 70,1, 67,0, 64,6, 56,0, 51,4, 45,5, 43,8, 41,0, 39,6, 36,4, 28,7, 28,0, 27,2, 26,4, 25,8, 25,7, 25,7, 25,6, 23,2, 21,9, 18,1, 17,9, 17,7, 13,0, 12,4, 8,4, 2,5, -4,4, -5,0, -5,1, -5,1.
Получение 28. Соединение 406
Способ: Общая процедура 8
Исходный материал: соединение 303
Элюент для хроматографии: 0-5% простой эфир в петролейном эфире.
13С ЯМР  148,2, 140,5, 135,0, 122,9, 117,9, 111,0, 83,1, 82,9, 80,0, 72,9, 71,8, 67,3, 64,6, 55,9, 51,4, 45,8, 45,3, 44,6, 41,0, 39,7, 28,6, 28,0, 27,2, 26,5, 25,8, 25,7, 25,7, 25,6, 23,2, 21,8, 18,0, 17,9, 17,9, 17,7, 13,0, 12,3, 8,4, 2,5, -4,4, -4,9, -4,9, -5,0, -5,3.
Получение 29. Соединение 407
Способ: Общая процедура 9
Исходный материал: соединение 406
Алкилирующий агент: этилбромид
Элюент для хроматографии: 0-2% простой эфир в петролейном эфире.
13С ЯМР 148,2, 140,5, 135,0, 122,9, 117,9, 111,0, 83,1, 82,9, 80,0, 72,9, 71,8, 67,3, 64,6, 55,9, 51,4, 45,8, 45,3, 44,6, 41,0, 39,7, 28,6, 28,0, 27,2, 26,5, 25,8, 25,7, 25,7, 25,6, 23,2, 21,8, 18,0, 17,9, 17,9, 17,7, 13,0, 12,3, 8,4, 2,5, -4,4, -4,9, -4,9, -5,0, -5,3.
Получение 29. Соединение 407
Способ: Общая процедура 9
Исходный материал: соединение 406
Алкилирующий агент: этилбромид
Элюент для хроматографии: 0-2% простой эфир в петролейном эфире.
13С ЯМР  148,2, 140,8, 134,8, 123,0, 117,7, 111,0, 83,1, 81,4, 80,1, 72,9, 71,9, 71,8, 67,4, 63,8, 55,9, 51,4, 45,8, 45,8, 45,4, 44,6, 40,4, 39,4, 28,7, 28,0, 27,2, 26,5, 25,8, 25,7, 25,6, 23,3, 21,8, 18,0, 18,0, 17,9, 17,7, 15,0, 13,9, 12,4, 8,3, 2,4, -4,4, -4,9, -4,9, -5,0, -5,3.
Получение 30. Соединение 304
Способ: Общая процедура 7
Исходный материал: соединение 210
Элюент для хроматографии: 5% простой эфир в петролейном эфире.
13С ЯМР 148,2, 140,8, 134,8, 123,0, 117,7, 111,0, 83,1, 81,4, 80,1, 72,9, 71,9, 71,8, 67,4, 63,8, 55,9, 51,4, 45,8, 45,8, 45,4, 44,6, 40,4, 39,4, 28,7, 28,0, 27,2, 26,5, 25,8, 25,7, 25,6, 23,3, 21,8, 18,0, 18,0, 17,9, 17,7, 15,0, 13,9, 12,4, 8,3, 2,4, -4,4, -4,9, -4,9, -5,0, -5,3.
Получение 30. Соединение 304
Способ: Общая процедура 7
Исходный материал: соединение 210
Элюент для хроматографии: 5% простой эфир в петролейном эфире.
13С ЯМР  153,4, 142,8, 135,3, 121,5, 116,4, 106,5, 83,2, 82,9, 80,3, 71,6, 70,1, 67,0, 64,6, 56,0, 51,4, 45,5, 43,8, 41,0, 39,6, 36,4, 28,9, 28,7, 26,4, 25,8, 25,7, 25,6, 25,2, 23,2, 21,9, 18,1, 18,0, 17,9, 17,3, 13,0, 12,4, 7,6, 2,5, -4,3, -4,9, -5,0, -5,1, -5,1.
Получение 31. Соединение 408
Способ: Общая процедура 8
Исходный материал: соединение 304
Элюент для хроматографии: 5% простой эфир в петролейном эфире.
13С ЯМР 153,4, 142,8, 135,3, 121,5, 116,4, 106,5, 83,2, 82,9, 80,3, 71,6, 70,1, 67,0, 64,6, 56,0, 51,4, 45,5, 43,8, 41,0, 39,6, 36,4, 28,9, 28,7, 26,4, 25,8, 25,7, 25,6, 25,2, 23,2, 21,9, 18,1, 18,0, 17,9, 17,3, 13,0, 12,4, 7,6, 2,5, -4,3, -4,9, -5,0, -5,1, -5,1.
Получение 31. Соединение 408
Способ: Общая процедура 8
Исходный материал: соединение 304
Элюент для хроматографии: 5% простой эфир в петролейном эфире.
13С ЯМР  148,2, 140,4, 135,0, 122,9, 117,9, 111,0, 83,1, 83,0, 80,3, 71,8, 71,6, 67,3, 64,6, 55,9, 51,4, 45,8, 45,3, 44,6, 41,0, 39,7, 28,9, 28,6, 26,5, 25,8, 25,7, 25,7, 25,6, 25,2, 23,2, 21,8, 18,0, 17,9, 17,3, 13,0, 12,3, 7,6, 2,5, -4,3, -4,9, -5,0, -5,3.
Получение 32. Соединение 409
Способ: Общая процедура 9
Исходный материал: соединение 408
Алкилирующий агент: этилбромид
Элюент для хроматографии: 1% простой эфир в петролейном эфире.
13С ЯМР 148,2, 140,4, 135,0, 122,9, 117,9, 111,0, 83,1, 83,0, 80,3, 71,8, 71,6, 67,3, 64,6, 55,9, 51,4, 45,8, 45,3, 44,6, 41,0, 39,7, 28,9, 28,6, 26,5, 25,8, 25,7, 25,7, 25,6, 25,2, 23,2, 21,8, 18,0, 17,9, 17,3, 13,0, 12,3, 7,6, 2,5, -4,3, -4,9, -5,0, -5,3.
Получение 32. Соединение 409
Способ: Общая процедура 9
Исходный материал: соединение 408
Алкилирующий агент: этилбромид
Элюент для хроматографии: 1% простой эфир в петролейном эфире.
13С ЯМР  148,2, 140,7, 134,8, 123,0, 117,7, 111,0, 83,4, 81,4, 80,4, 72,0, 71,8, 71,7, 67,8, 67,4, 63,8, 55,9, 51,3, 45,8, 45,4, 44,6, 40,3, 39,3, 29,0, 28,7, 26,3, 25,8, 25,7, 25,6, 25,4, 25,3, 23,3, 21,8, 18,0, 18,0, 17,4, 15,0, 14,0, 12,4, 7,6, 2,5, -4,4, -4,9, -5,0, -5,3.
Получение 33. Соединение 305
Способ: Общая процедура 7
Исходный материал: соединение 212
Элюент для хроматографии: 3% простой эфир в петролейном эфире.
13С ЯМР 148,2, 140,7, 134,8, 123,0, 117,7, 111,0, 83,4, 81,4, 80,4, 72,0, 71,8, 71,7, 67,8, 67,4, 63,8, 55,9, 51,3, 45,8, 45,4, 44,6, 40,3, 39,3, 29,0, 28,7, 26,3, 25,8, 25,7, 25,6, 25,4, 25,3, 23,3, 21,8, 18,0, 18,0, 17,4, 15,0, 14,0, 12,4, 7,6, 2,5, -4,4, -4,9, -5,0, -5,3.
Получение 33. Соединение 305
Способ: Общая процедура 7
Исходный материал: соединение 212
Элюент для хроматографии: 3% простой эфир в петролейном эфире.
13С ЯМР  263,2, 153,4, 142,8, 135,3, 121,5, 116,4, 106,5, 82,9, 80,0, 72,9, 70,1, 67,0, 64,7, 56,0, 51,4, 45,5, 43,8, 41,0, 39,6, 36,4, 28,7, 28,0, 27,2, 26,4, 25,7, 25,7, 25,6, 23,2, 21,9, 18,1, 17,9, 17,6, 13,0, 12,4, 8,4, 2,5, -4,4, -5,0, -5,1.
Получение 34. Соединение 410
Способ: Общая процедура 8
Исходный материал: соединение 305
Элюент для хроматографии: 3% простой эфир в петролейном эфире.
13С ЯМР 263,2, 153,4, 142,8, 135,3, 121,5, 116,4, 106,5, 82,9, 80,0, 72,9, 70,1, 67,0, 64,7, 56,0, 51,4, 45,5, 43,8, 41,0, 39,6, 36,4, 28,7, 28,0, 27,2, 26,4, 25,7, 25,7, 25,6, 23,2, 21,9, 18,1, 17,9, 17,6, 13,0, 12,4, 8,4, 2,5, -4,4, -5,0, -5,1.
Получение 34. Соединение 410
Способ: Общая процедура 8
Исходный материал: соединение 305
Элюент для хроматографии: 3% простой эфир в петролейном эфире.
13С ЯМР  148,2, 140,5, 135,0, 122,9, 117,9, 111,0, 83,1, 82,9, 80,0, 72,9, 71,8, 67,3, 64,7, 55,9, 51,4, 45,8, 45,3, 44,6, 41,0, 39,7, 28,7, 28,0, 27,2, 26,5, 25,7, 25,7, 25,6, 23,2, 21,8, 18,1, 18,0, 17,9, 17,6, 13,0, 12,3, 8,4, 2,5, -4,4, -4,9, -4,9, -5,0, -5,3.
Получение 35. Соединение 411
Способ: Общая процедура 9
Исходный материал: соединение 410
Элюент для хроматографии: 1% простой эфир в петролейном эфире.
13С ЯМР 148,2, 140,5, 135,0, 122,9, 117,9, 111,0, 83,1, 82,9, 80,0, 72,9, 71,8, 67,3, 64,7, 55,9, 51,4, 45,8, 45,3, 44,6, 41,0, 39,7, 28,7, 28,0, 27,2, 26,5, 25,7, 25,7, 25,6, 23,2, 21,8, 18,1, 18,0, 17,9, 17,6, 13,0, 12,3, 8,4, 2,5, -4,4, -4,9, -4,9, -5,0, -5,3.
Получение 35. Соединение 411
Способ: Общая процедура 9
Исходный материал: соединение 410
Элюент для хроматографии: 1% простой эфир в петролейном эфире.
13С ЯМР  148,2, 140,8, 134,8, 123,0, 117,7, 111,0, 83,0, 81,4, 80,1, 72,9, 72,0, 71,8, 67,4, 63,8, 55,9, 51,4, 45,8, 45,4, 44,7, 40,3, 39,3, 28,7, 28,0, 27,2, 26,4, 25,8, 25,7, 25,6, 23,3, 21,8, 18,0, 18,0, 17,9, 17,6, 15,0, 14,0, 12,4, 8,4, 2,5, -4,4, -4,9, -4,9, -5,0, -5,3.
Получение 36. Соединение 306
Способ: Общая процедура 7а
Исходный материал: соединение 216
Алкилирующий агент: пропилбромид
Элюент для хроматографии: 0-20% простой эфир в петролейном эфире.
13С ЯМР 148,2, 140,8, 134,8, 123,0, 117,7, 111,0, 83,0, 81,4, 80,1, 72,9, 72,0, 71,8, 67,4, 63,8, 55,9, 51,4, 45,8, 45,4, 44,7, 40,3, 39,3, 28,7, 28,0, 27,2, 26,4, 25,8, 25,7, 25,6, 23,3, 21,8, 18,0, 18,0, 17,9, 17,6, 15,0, 14,0, 12,4, 8,4, 2,5, -4,4, -4,9, -4,9, -5,0, -5,3.
Получение 36. Соединение 306
Способ: Общая процедура 7а
Исходный материал: соединение 216
Алкилирующий агент: пропилбромид
Элюент для хроматографии: 0-20% простой эфир в петролейном эфире.
13С ЯМР  153,4, 142,7, 135,4, 121,5, 116,4, 108,1, 106,5, 85,6, 84,8, 79,3, 78,9, 70,1, 67,0, 64,4, 55,9, 51,2, 45,5, 43,8, 40,6, 39,5, 36,4, 28,7, 28,2, 28,0, 26,2, 25,9, 25,7, 25,6, 23,2, 21,9, 18,1, 17,9, 13,5, 13,1, 12,4, 8,2, -5,0, -5,1, -5,1.
Получение 37. Соединение 412
Способ: Общая процедура 8
Исходный материал: соединение 306
Элюент для хроматографии: 10% простой эфир в петролейном эфире.
13С ЯМР 153,4, 142,7, 135,4, 121,5, 116,4, 108,1, 106,5, 85,6, 84,8, 79,3, 78,9, 70,1, 67,0, 64,4, 55,9, 51,2, 45,5, 43,8, 40,6, 39,5, 36,4, 28,7, 28,2, 28,0, 26,2, 25,9, 25,7, 25,6, 23,2, 21,9, 18,1, 17,9, 13,5, 13,1, 12,4, 8,2, -5,0, -5,1, -5,1.
Получение 37. Соединение 412
Способ: Общая процедура 8
Исходный материал: соединение 306
Элюент для хроматографии: 10% простой эфир в петролейном эфире.
13С ЯМР  148,1, 140,3, 135,0, 122,9, 117,9, 111,0, 108,1, 85,6, 84,7, 79,3, 78,9, 71,9, 67,3, 64,4, 55,8, 51,2, 45,8, 45,3, 44,6, 40,6, 39,5, 28,6, 28,2, 28,0, 26,2, 25,9, 25,7, 25,6, 23,1, 21,8, 18,0, 17,9, 13,5, 13,1, 12,4, 8,2, -4,9, -5,0, -5,3.
Получение 38. Соединение 413
Способ: Общая процедура 9
Исходный материал: соединение 412
Алкилирующий агент: этилбромид
Элюент для хроматографии: 0-2% простой эфир в петролейном эфире.
13Н ЯМР 148,1, 140,3, 135,0, 122,9, 117,9, 111,0, 108,1, 85,6, 84,7, 79,3, 78,9, 71,9, 67,3, 64,4, 55,8, 51,2, 45,8, 45,3, 44,6, 40,6, 39,5, 28,6, 28,2, 28,0, 26,2, 25,9, 25,7, 25,6, 23,1, 21,8, 18,0, 17,9, 13,5, 13,1, 12,4, 8,2, -4,9, -5,0, -5,3.
Получение 38. Соединение 413
Способ: Общая процедура 9
Исходный материал: соединение 412
Алкилирующий агент: этилбромид
Элюент для хроматографии: 0-2% простой эфир в петролейном эфире.
13Н ЯМР  6,22 (д, 1Н), 6,00 (д, 1Н), 5,17 (д, 1Н), 4,85 (д, 1Н), 4,36 (м, 1Н), 4,30 (кв, 1Н), 4,20 (д, 1Н), 4,16 (м, 1Н), 3,72 (м, 1Н), 3,30 (м, 1Н), 2,82 (дд, 1Н), 2,43 (дд, 1Н), 2,20 (дд, 1Н), 1,99 (т, 1Н), 2,0-0,8 (м, 15Н), 1,44 (с, 3Н), 1,40 (с, 3Н), 1,26 (д, 3Н), 1,18 (т, 3Н), 1,07 (т, 3Н), 1,00 (д, 3Н), 0,87 (с, 18Н), 0,51 (с, 3Н), 0,05 (с, 12Н).
Получение 39. Соединение 307
Способ: Общая процедура 7а
Исходный материал: соединение 220
Элюент для хроматографии: 0-20% простой эфир в петролейном эфире.
13С ЯМР 6,22 (д, 1Н), 6,00 (д, 1Н), 5,17 (д, 1Н), 4,85 (д, 1Н), 4,36 (м, 1Н), 4,30 (кв, 1Н), 4,20 (д, 1Н), 4,16 (м, 1Н), 3,72 (м, 1Н), 3,30 (м, 1Н), 2,82 (дд, 1Н), 2,43 (дд, 1Н), 2,20 (дд, 1Н), 1,99 (т, 1Н), 2,0-0,8 (м, 15Н), 1,44 (с, 3Н), 1,40 (с, 3Н), 1,26 (д, 3Н), 1,18 (т, 3Н), 1,07 (т, 3Н), 1,00 (д, 3Н), 0,87 (с, 18Н), 0,51 (с, 3Н), 0,05 (с, 12Н).
Получение 39. Соединение 307
Способ: Общая процедура 7а
Исходный материал: соединение 220
Элюент для хроматографии: 0-20% простой эфир в петролейном эфире.
13С ЯМР  153,4, 142,7, 135,3, 121,5, 116,4, 108,2, 106,5, 87,9, 83,8, 81,2, 78,4, 70,1, 67,0, 64,4, 55,9, 51,3, 45,5, 43,8, 40,7, 39,5, 36,4, 31,3, 28,7, 27,6, 26,8, 26,3, 25,7, 25,6, 23,2, 21,9, 18,1, 17,9, 15,8, 13,1, 12,4, 8,7, -5,0, -5,1, -5,1.
Получение 40. Соединение 414
Способ: Общая процедура 8
Исходный материал: соединение 307
Номер хроматографии: сырой продукт, применяемый на следующей стадии.
13H ЯМР 153,4, 142,7, 135,3, 121,5, 116,4, 108,2, 106,5, 87,9, 83,8, 81,2, 78,4, 70,1, 67,0, 64,4, 55,9, 51,3, 45,5, 43,8, 40,7, 39,5, 36,4, 31,3, 28,7, 27,6, 26,8, 26,3, 25,7, 25,6, 23,2, 21,9, 18,1, 17,9, 15,8, 13,1, 12,4, 8,7, -5,0, -5,1, -5,1.
Получение 40. Соединение 414
Способ: Общая процедура 8
Исходный материал: соединение 307
Номер хроматографии: сырой продукт, применяемый на следующей стадии.
13H ЯМР  6,22 (1Н, д), 6,01 (1Н, д), 5,17 (1Н, д), 4,85 (1Н, д), 4,67 (1Н, с), 4,36 (1Н, м), 4,17 (1Н, м), 3,85 (1Н, кв), 2,82 (1Н, дд), 2,43 (1Н, дд), 2,21 (1Н, дд), 1,89 (1Н, т), 1,85-1,00 (13Н, м), 1,68 (2Н, кв), 1,51 (3Н, с), 1,35 (3Н, д), 1,33 (3Н, с), 1,06 (3Н, т), 1,04 (3Н, д), 0,87 (18, с), 0,53 (3Н, с), 0,05 (12Н, с).
Получение 41. Соединение 415
Способ: Общая процедура 9
Исходный материал: соединение 414
Алкилирующий агент: этилбромид
Элюент для хроматографии: 0-2% простой эфир в петролейном эфире.
13С ЯМР 6,22 (1Н, д), 6,01 (1Н, д), 5,17 (1Н, д), 4,85 (1Н, д), 4,67 (1Н, с), 4,36 (1Н, м), 4,17 (1Н, м), 3,85 (1Н, кв), 2,82 (1Н, дд), 2,43 (1Н, дд), 2,21 (1Н, дд), 1,89 (1Н, т), 1,85-1,00 (13Н, м), 1,68 (2Н, кв), 1,51 (3Н, с), 1,35 (3Н, д), 1,33 (3Н, с), 1,06 (3Н, т), 1,04 (3Н, д), 0,87 (18, с), 0,53 (3Н, с), 0,05 (12Н, с).
Получение 41. Соединение 415
Способ: Общая процедура 9
Исходный материал: соединение 414
Алкилирующий агент: этилбромид
Элюент для хроматографии: 0-2% простой эфир в петролейном эфире.
13С ЯМР  148,1, 140,7, 134,9, 122,9, 117,8, 111,0, 108,1, 86,5, 84,2, 81,3, 78,5, 71,9, 71,8, 67,3, 63,9, 55,9, 51,4, 45,9, 45,4, 44,6, 40,2, 39,3, 31,4, 28,7, 27,5, 26,9, 26,3, 25,7, 25,6, 23,3, 21,8, 18,0, 18,0, 15,8, 15,0, 14,0, 12,4, 8,8, -4,9, -5,0, -5,3.
Получение 42. Соединение 505
Способ: Общая процедура 11
Исходный материал: метил (R)-(+)-лактат
Очистка: дистилляция; т.кип. 94°С/1,3 мбар;
[ 148,1, 140,7, 134,9, 122,9, 117,8, 111,0, 108,1, 86,5, 84,2, 81,3, 78,5, 71,9, 71,8, 67,3, 63,9, 55,9, 51,4, 45,9, 45,4, 44,6, 40,2, 39,3, 31,4, 28,7, 27,5, 26,9, 26,3, 25,7, 25,6, 23,3, 21,8, 18,0, 18,0, 15,8, 15,0, 14,0, 12,4, 8,8, -4,9, -5,0, -5,3.
Получение 42. Соединение 505
Способ: Общая процедура 11
Исходный материал: метил (R)-(+)-лактат
Очистка: дистилляция; т.кип. 94°С/1,3 мбар;
[ ]20D +54,4° (с 2,29, СНСl3)
13С ЯМР ]20D +54,4° (с 2,29, СНСl3)
13С ЯМР  170,0, 74,1, 52,8, 39,1, 18,4.
Получение 43. Соединение 506
Способ: Общая процедура 11
Исходный материал: этил (S)-(-)-лактат
Очистка: дистилляция; т.кип. 98,1°С/1,5 мбар;
[ 170,0, 74,1, 52,8, 39,1, 18,4.
Получение 43. Соединение 506
Способ: Общая процедура 11
Исходный материал: этил (S)-(-)-лактат
Очистка: дистилляция; т.кип. 98,1°С/1,5 мбар;
[ ]20D-53,1° (с 2,03, СНСl3)
(лит.: Breitschuh, R. et al., Synthesis, 1992, 1170:
[ ]20D-53,1° (с 2,03, СНСl3)
(лит.: Breitschuh, R. et al., Synthesis, 1992, 1170:
[ ]20D-54,6° (с 4,36, СНСl3)
Получение 44. Соединение 507
Способ: Общая процедура 12
Исходный материал: соединение 505
Очистка: дистилляция; т.кип. 39°С/53 мбар;
[ ]20D-54,6° (с 4,36, СНСl3)
Получение 44. Соединение 507
Способ: Общая процедура 12
Исходный материал: соединение 505
Очистка: дистилляция; т.кип. 39°С/53 мбар;
[ ]20D-2,8° (с 2,21, СНСl3)
13H ЯМР ]20D-2,8° (с 2,21, СНСl3)
13H ЯМР  5,02 (дкв, 1Н), 3,80 (с, 3Н), 1,58 (дд, 3Н).
Получение 45. Соединение 508
Способ: Общая процедура 12
Исходный материал: соединение 506
Очистка: дистилляция; т.кип. 34°С/27 мбар;
[ 5,02 (дкв, 1Н), 3,80 (с, 3Н), 1,58 (дд, 3Н).
Получение 45. Соединение 508
Способ: Общая процедура 12
Исходный материал: соединение 506
Очистка: дистилляция; т.кип. 34°С/27 мбар;
[ ]20D +3,8° (с 2,32, СНСl3)
13С ЯМР ]20D +3,8° (с 2,32, СНСl3)
13С ЯМР  170,5, 85,7, 61,5, 18,3, 14,1.
Получение 46. Соединение 509
Способ: Общая процедура 1a
Исходный материал: соединение 507
Очистка: дистилляция; т.кип. около 45°С/27 мбар;
[ 170,5, 85,7, 61,5, 18,3, 14,1.
Получение 46. Соединение 509
Способ: Общая процедура 1a
Исходный материал: соединение 507
Очистка: дистилляция; т.кип. около 45°С/27 мбар;
[ ]20D -51,6° (прибл.) (с 2,1, СНСl3:ТГФ 4:1)
13H ЯМР ]20D -51,6° (прибл.) (с 2,1, СНСl3:ТГФ 4:1)
13H ЯМР  4,88 (дкв, 1Н), 2,64 (м, 2Н), 1,47 (дд, 3Н), 1,08 (т, 3Н).
Получение 47. Соединение 510
Способ: Общая процедура 1а
Исходный материал: соединение 508
Очистка: дистилляция; т.кип. около 45°С/27 мбар;
[ 4,88 (дкв, 1Н), 2,64 (м, 2Н), 1,47 (дд, 3Н), 1,08 (т, 3Н).
Получение 47. Соединение 510
Способ: Общая процедура 1а
Исходный материал: соединение 508
Очистка: дистилляция; т.кип. около 45°С/27 мбар;
[ ]20D +43,3° (прибл.) (с 2,0, СНСl3:ТГФ 7:3)
13С ЯМР ]20D +43,3° (прибл.) (с 2,0, СНСl3:ТГФ 7:3)
13С ЯМР  210,8, 92,6, 30,7, 17,7, 6,8.
Получение 48. Соединение 221
Способ: Общая процедура 2а
Очистка: отсутствует
Исходный материал: соединение 209
13С ЯМР 210,8, 92,6, 30,7, 17,7, 6,8.
Получение 48. Соединение 221
Способ: Общая процедура 2а
Очистка: отсутствует
Исходный материал: соединение 209
13С ЯМР  основной: 93,4, 79,6, 74,3, 71,3, 27,8, 25,0, 14,8, 7,4
второстепенный: 93,0, 80,0, 74,6, 71,0, 27,0, 25,4, 14,7, 7,2.
Получение 49. Соединение 222
Способ: Общая процедура 6
Исходный материал: соединение 221
Элюент для хроматографии: петролейный эфир.
Получение 50. Соединение 223
Способ: Общая процедура 2а
Исходный материал: соединение 210
Очистка: отсутствует
13С ЯМР
основной: 93,4, 79,6, 74,3, 71,3, 27,8, 25,0, 14,8, 7,4
второстепенный: 93,0, 80,0, 74,6, 71,0, 27,0, 25,4, 14,7, 7,2.
Получение 49. Соединение 222
Способ: Общая процедура 6
Исходный материал: соединение 221
Элюент для хроматографии: петролейный эфир.
Получение 50. Соединение 223
Способ: Общая процедура 2а
Исходный материал: соединение 210
Очистка: отсутствует
13С ЯМР  основной: 93,4, 79,7, 74,3, 71,4, 27,8, 25,0, 14,8, 7,4
второстепенный: 93,0, 80,0, 74,8, 71,0, 27,0, 25,4, 14,7, 7,2.
Получение 51. Соединение 224
Способ: Общая процедура 6
Исходный материал: соединение 223
Элюент для хроматографии: петролейный эфир
13С ЯМР
основной: 93,4, 79,7, 74,3, 71,4, 27,8, 25,0, 14,8, 7,4
второстепенный: 93,0, 80,0, 74,8, 71,0, 27,0, 25,4, 14,7, 7,2.
Получение 51. Соединение 224
Способ: Общая процедура 6
Исходный материал: соединение 223
Элюент для хроматографии: петролейный эфир
13С ЯМР  основной: 93,2, 80,4, 78,3, 70,5, 28,1, 25,9, 14,9, 7,7, 2,1
второстепенный: 92,5, 80,6, 78,2, 70,3, 27,9, 25,1, 14,6, 7,2, 2,1.
Получение 52. Соединение 308
Способ: Общая процедура 7
Исходные материалы: соединение 1 и соединение 222
Элюент для хроматографии: 0-20% простой эфир в петролейном эфире.
Получение 53. Соединение 416
Способ: Общая процедура 8а
Исходный материал: соединение 308
Элюент для хроматографии: 50% дихлорметан в петролейном эфире.
Получение 54. Соединение 417
Способ: Общая процедура 9
Исходный материал: соединение 416
Алкилирующий агент: этилбромид
Элюент для хроматографии: 0-10% простой эфир в петролейном эфире.
Получение 55. Соединение 309
Способ: Общая процедура 7
Исходные материалы: соединение 1 и соединение 224
Элюент для хроматографии: 0-20% простой эфир в петролейном эфире.
13С ЯМР
основной: 93,2, 80,4, 78,3, 70,5, 28,1, 25,9, 14,9, 7,7, 2,1
второстепенный: 92,5, 80,6, 78,2, 70,3, 27,9, 25,1, 14,6, 7,2, 2,1.
Получение 52. Соединение 308
Способ: Общая процедура 7
Исходные материалы: соединение 1 и соединение 222
Элюент для хроматографии: 0-20% простой эфир в петролейном эфире.
Получение 53. Соединение 416
Способ: Общая процедура 8а
Исходный материал: соединение 308
Элюент для хроматографии: 50% дихлорметан в петролейном эфире.
Получение 54. Соединение 417
Способ: Общая процедура 9
Исходный материал: соединение 416
Алкилирующий агент: этилбромид
Элюент для хроматографии: 0-10% простой эфир в петролейном эфире.
Получение 55. Соединение 309
Способ: Общая процедура 7
Исходные материалы: соединение 1 и соединение 224
Элюент для хроматографии: 0-20% простой эфир в петролейном эфире.
13С ЯМР  153,4, 142,7, 135,4, 121,5, 116,4, 106,5, 93,3, 83,1, 81,5, 78,5, 70,1, 67,0, 64,6, 55,9, 51,4, 45,5, 43,8, 41,2, 40,9, 39,6, 36,4, 28,9, 28,7, 28,3, 27,5, 26,3, 25,7, 25,6, 23,2, 22,4, 21,9, 20,2, 19,2, 18,1, 17,9, 15,1, 14,8, 14,1, 13,0, 12,4, 11,2, 7,8, 2,2, -5,0, -5,1, -5,1.
Получение 56. Соединение 418
Способ: Общая процедура 8а
Исходный материал: соединение 309
Элюент для хроматографии: 50% дихлорметан в петролейном эфире.
13Н ЯМР 153,4, 142,7, 135,4, 121,5, 116,4, 106,5, 93,3, 83,1, 81,5, 78,5, 70,1, 67,0, 64,6, 55,9, 51,4, 45,5, 43,8, 41,2, 40,9, 39,6, 36,4, 28,9, 28,7, 28,3, 27,5, 26,3, 25,7, 25,6, 23,2, 22,4, 21,9, 20,2, 19,2, 18,1, 17,9, 15,1, 14,8, 14,1, 13,0, 12,4, 11,2, 7,8, 2,2, -5,0, -5,1, -5,1.
Получение 56. Соединение 418
Способ: Общая процедура 8а
Исходный материал: соединение 309
Элюент для хроматографии: 50% дихлорметан в петролейном эфире.
13Н ЯМР  6,22 (д, 1Н), 6,02 (д, 1Н), 5,17 (д, 1Н), 4,85 (д, 1Н), 4,62 (дкв, 1Н), 4,60 (м, 1Н), 4,37 (м, 1Н), 4,18 (м, 1Н), 2,83 (д, 1Н), 2,50-2,80 (м, 24Н), 1,31 (дд, 3Н), 1,01 (д, 3Н), 0,85 (с, 18Н), 0,83 (д, 3Н), 0,12 (с, 9Н), 0,06 (д, 12Н).
Получение 57. Соединение 419
Способ: Общая процедура 9
Исходный материал: соединение 418
Алкилирующий агент: этилбромид
Элюент для хроматографии: 0-10% простой эфир в петролейном эфире.
13С ЯМР 6,22 (д, 1Н), 6,02 (д, 1Н), 5,17 (д, 1Н), 4,85 (д, 1Н), 4,62 (дкв, 1Н), 4,60 (м, 1Н), 4,37 (м, 1Н), 4,18 (м, 1Н), 2,83 (д, 1Н), 2,50-2,80 (м, 24Н), 1,31 (дд, 3Н), 1,01 (д, 3Н), 0,85 (с, 18Н), 0,83 (д, 3Н), 0,12 (с, 9Н), 0,06 (д, 12Н).
Получение 57. Соединение 419
Способ: Общая процедура 9
Исходный материал: соединение 418
Алкилирующий агент: этилбромид
Элюент для хроматографии: 0-10% простой эфир в петролейном эфире.
13С ЯМР  148,1, 140,6, 134,9, 122,9, 117,8, 111,0, 93,4, 82,6, 80,5, 74,3, 71,9, 67,3, 64,0, 55,8, 51,3, 45,9, 45,4, 44,6, 40,1, 39,3, 28,7, 27,8, 26,2, 25,7, 25,6, 25,0, 23,3, 21,8, 18,0, 17,9, 14,7, 14,0, 12,4, 7,2, 2,2, -4,9, -5,0, -5,3.
Примеры
Пример 1. 1(S),3(R)-дигидрокси-20(R)-(5-этил-1(S),5(3),6(S)-тригидрокси-2-гептин-1-ил)-9,10-секопрегна-5(Z),7(E),10(19)-триен
Соединение 101
Способ: Общая процедура 4
Исходный материал: соединение 401
Элюент для хроматографии: 50-0% петролейный эфир в этилацетате.
13С ЯМР (CD3OD) 148,1, 140,6, 134,9, 122,9, 117,8, 111,0, 93,4, 82,6, 80,5, 74,3, 71,9, 67,3, 64,0, 55,8, 51,3, 45,9, 45,4, 44,6, 40,1, 39,3, 28,7, 27,8, 26,2, 25,7, 25,6, 25,0, 23,3, 21,8, 18,0, 17,9, 14,7, 14,0, 12,4, 7,2, 2,2, -4,9, -5,0, -5,3.
Примеры
Пример 1. 1(S),3(R)-дигидрокси-20(R)-(5-этил-1(S),5(3),6(S)-тригидрокси-2-гептин-1-ил)-9,10-секопрегна-5(Z),7(E),10(19)-триен
Соединение 101
Способ: Общая процедура 4
Исходный материал: соединение 401
Элюент для хроматографии: 50-0% петролейный эфир в этилацетате.
13С ЯМР (CD3OD)  149,8, 142,5, 135,8, 124,9, 119,0, 112,1, 84,3, 82,4, 77,1, 71,6, 71,5, 67,4, 65,5, 57,3, 52,7, 46,9, 46,2, 43,7, 42,4, 40,9, 30,1, 28,5, 27,0, 26,2, 24,5, 23,2, 17,3, 14,0, 13,1, 7,9.
Пример 2. 1(S),3(R)-дигидрокси-20(R)-(5(S),6(S)-дигидрокси-5-этил-1(S)-метокси-2-гептин-1-ил)-9,10-секопрегна-5(Z),7(Е),10(19)-триен
Соединение 102
Способ: Общая процедура 4
Исходный материал: соединение 402
Элюент для хроматографии: 50-0% петролейный эфир в этилацетате.
13С ЯМР 149,8, 142,5, 135,8, 124,9, 119,0, 112,1, 84,3, 82,4, 77,1, 71,6, 71,5, 67,4, 65,5, 57,3, 52,7, 46,9, 46,2, 43,7, 42,4, 40,9, 30,1, 28,5, 27,0, 26,2, 24,5, 23,2, 17,3, 14,0, 13,1, 7,9.
Пример 2. 1(S),3(R)-дигидрокси-20(R)-(5(S),6(S)-дигидрокси-5-этил-1(S)-метокси-2-гептин-1-ил)-9,10-секопрегна-5(Z),7(Е),10(19)-триен
Соединение 102
Способ: Общая процедура 4
Исходный материал: соединение 402
Элюент для хроматографии: 50-0% петролейный эфир в этилацетате.
13С ЯМР  147,7, 142,9, 133,1, 124,9, 117,2, 111,8, 82,4, 82,0, 75,6, 73,8, 71,3, 70,9, 66,8, 56,4, 56,0, 51,5, 45,7, 45,3, 42,9, 40,3, 39,4, 29,1, 27,2, 26,5, 26,4, 23,5, 22,1, 17,1, 14,1, 12,6, 7,7.
Пример 3. 1(S),3(R)-дигидрокси-20(R)-(5(S),6(S)-дигидрокси-1(S)-этокси-5-этил-2-гептин-1-ил)-9,10-секопрегна-5(Z),7(Е),10(19)-трие
Соединение 103
Способ: Общая процедура 4
Исходный материал: соединение 403
Элюент для хроматографии: 50-0% петролейный эфир в этилацетате.
13С ЯМР 147,7, 142,9, 133,1, 124,9, 117,2, 111,8, 82,4, 82,0, 75,6, 73,8, 71,3, 70,9, 66,8, 56,4, 56,0, 51,5, 45,7, 45,3, 42,9, 40,3, 39,4, 29,1, 27,2, 26,5, 26,4, 23,5, 22,1, 17,1, 14,1, 12,6, 7,7.
Пример 3. 1(S),3(R)-дигидрокси-20(R)-(5(S),6(S)-дигидрокси-1(S)-этокси-5-этил-2-гептин-1-ил)-9,10-секопрегна-5(Z),7(Е),10(19)-трие
Соединение 103
Способ: Общая процедура 4
Исходный материал: соединение 403
Элюент для хроматографии: 50-0% петролейный эфир в этилацетате.
13С ЯМР  147,7, 142,9, 133,2, 124,8, 117,2, 111,8, 82,6, 81,9, 75,6, 72,3, 71,3, 70,8, 66,8, 64,2, 56,0, 51,5, 45,8, 45,3, 42,8, 40,2, 39,3, 29,1, 27,2, 26,4, 26,3, 23,5, 22,2, 17,1, 15,2, 14,2, 12,7, 7,7.
Пример 4. 1(S),3(R)-дигидрокси-20(R)-(5(S),6(S)-дигидрокси-5-этил-1(S)-(1-н-пропилокси-2-гептин-1-ил)-9,10-секопрегна-5(Z),7(Е),10(19)-триен
Соединение 104
Способ: Общая процедура 4
Исходный материал: соединение 404
Элюент для хроматографии: 50-0% петролейный эфир в этилацетате.
13С ЯМР 147,7, 142,9, 133,2, 124,8, 117,2, 111,8, 82,6, 81,9, 75,6, 72,3, 71,3, 70,8, 66,8, 64,2, 56,0, 51,5, 45,8, 45,3, 42,8, 40,2, 39,3, 29,1, 27,2, 26,4, 26,3, 23,5, 22,2, 17,1, 15,2, 14,2, 12,7, 7,7.
Пример 4. 1(S),3(R)-дигидрокси-20(R)-(5(S),6(S)-дигидрокси-5-этил-1(S)-(1-н-пропилокси-2-гептин-1-ил)-9,10-секопрегна-5(Z),7(Е),10(19)-триен
Соединение 104
Способ: Общая процедура 4
Исходный материал: соединение 404
Элюент для хроматографии: 50-0% петролейный эфир в этилацетате.
13С ЯМР  147,7, 143,0, 133,0, 125,0, 117,1, 111,8, 82,9, 81,7, 75,6, 72,4, 71,3, 70,9, 70,5, 66,9, 56,0, 51,5, 45,8, 45,3, 42,9, 40,3, 39,5, 29,1, 27,2, 26,5, 26,3, 23,5, 23,1, 22,2, 17,1, 14,2, 12,7, 10,9, 7,7.
Пример 5. 1(S),3(R)-дигидрокси-20(R)-(1(S)-бензилокси-5(S),6(S)-дигидрокси-5-этил-2-гептин-1-ил)-9,10-секопрегна-5(Z),7(Е),10(19)-триен
Соединение 105
Способ: Общая процедура 4
Исходный материал: соединение 405
Элюент для хроматографии: 50-0% петролейный эфир в этилацетате.
13С ЯМР 147,7, 143,0, 133,0, 125,0, 117,1, 111,8, 82,9, 81,7, 75,6, 72,4, 71,3, 70,9, 70,5, 66,9, 56,0, 51,5, 45,8, 45,3, 42,9, 40,3, 39,5, 29,1, 27,2, 26,5, 26,3, 23,5, 23,1, 22,2, 17,1, 14,2, 12,7, 10,9, 7,7.
Пример 5. 1(S),3(R)-дигидрокси-20(R)-(1(S)-бензилокси-5(S),6(S)-дигидрокси-5-этил-2-гептин-1-ил)-9,10-секопрегна-5(Z),7(Е),10(19)-триен
Соединение 105
Способ: Общая процедура 4
Исходный материал: соединение 405
Элюент для хроматографии: 50-0% петролейный эфир в этилацетате.
13С ЯМР  147,7, 142,9, 138,5, 133,1, 128,2, 127,7, 127,4, 124,9, 117,1, 111,8, 82,6, 82,2, 75,6, 71,9, 71,3, 70,8, 70,4, 66,8, 56,0, 51,5, 45,8, 45,3, 42,9, 40,3, 39,4, 29,0, 27,2, 26,4, 26,3, 23,5, 22,1, 20,8, 17,1, 12,7, 7,7.
Пример 6. 1(S),3(R)-дигидрокси-20(R)-(5(R),6(S)-дигидрокси-1(S)-этокси-5-этил-2-гептин-1-ил)-9,10-секопрегна-5(Z),7(Е),10(19)-трие
Соединение 106
Способ: Общая процедура 4
Исходный материал: соединение 407
Элюент для хроматографии: 50-0% петролейный эфир в этилацетате.
13С ЯМР 147,7, 142,9, 138,5, 133,1, 128,2, 127,7, 127,4, 124,9, 117,1, 111,8, 82,6, 82,2, 75,6, 71,9, 71,3, 70,8, 70,4, 66,8, 56,0, 51,5, 45,8, 45,3, 42,9, 40,3, 39,4, 29,0, 27,2, 26,4, 26,3, 23,5, 22,1, 20,8, 17,1, 12,7, 7,7.
Пример 6. 1(S),3(R)-дигидрокси-20(R)-(5(R),6(S)-дигидрокси-1(S)-этокси-5-этил-2-гептин-1-ил)-9,10-секопрегна-5(Z),7(Е),10(19)-трие
Соединение 106
Способ: Общая процедура 4
Исходный материал: соединение 407
Элюент для хроматографии: 50-0% петролейный эфир в этилацетате.
13С ЯМР  147,7, 142,8, 133,2, 124,8, 117,2, 111,8, 82,9, 81,9, 75,3, 72,3, 71,2, 70,8, 66,8, 64,2, 56,0, 51,5, 45,8, 45,2, 42,9, 40,2, 39,3, 29,2, 29,1, 26,2, 25,1, 23,5, 22,2, 17,1, 15,2, 14,2, 12,7, 7,5.
Пример 7. 1(S),3(R)-дигидрокси-20(R)-(5(R),6(R)-дигидрокси-1(S)-этокси-5-этил-2-гептин-1-ил)-9,10-секопрегна-5(Z),7(Е),10(19)-трие
Соединение 107
Способ: Общая процедура 4
Исходный материал: соединение 409
Злюент для хроматографии: 50-0% петролейный эфир в этилацетате.
13С ЯМР 147,7, 142,8, 133,2, 124,8, 117,2, 111,8, 82,9, 81,9, 75,3, 72,3, 71,2, 70,8, 66,8, 64,2, 56,0, 51,5, 45,8, 45,2, 42,9, 40,2, 39,3, 29,2, 29,1, 26,2, 25,1, 23,5, 22,2, 17,1, 15,2, 14,2, 12,7, 7,5.
Пример 7. 1(S),3(R)-дигидрокси-20(R)-(5(R),6(R)-дигидрокси-1(S)-этокси-5-этил-2-гептин-1-ил)-9,10-секопрегна-5(Z),7(Е),10(19)-трие
Соединение 107
Способ: Общая процедура 4
Исходный материал: соединение 409
Злюент для хроматографии: 50-0% петролейный эфир в этилацетате.
13С ЯМР  147,7, 142,9, 133,2, 124,9, 117,2, 111,8, 82,6, 81,9, 75,6, 72,3, 71,3, 70,8, 66,8, 64,2, 56,0, 51,5, 45,8, 45,2, 42,8, 40,2, 39,3, 29,1, 27,2, 26,4, 26,3, 23,5, 22,1, 17,1, 15,2, 14,2, 12,7, 7,7.
Пример 8. 1(S),3(R)-дигидрокси-20(R)-(5(S),6(R)-дигидрокси-1(S)-этокси-5-этил-2-гептин-1-ил)-9,10-секопрогна-5(Z),7(Е),10(19)-трие
Соединение 108
Способ: Общая процедура 4
Исходный материал: соединение 411
Элюент для хроматографии: 50-0% петролейный эфир в этилацетате.
13С ЯМР 147,7, 142,9, 133,2, 124,9, 117,2, 111,8, 82,6, 81,9, 75,6, 72,3, 71,3, 70,8, 66,8, 64,2, 56,0, 51,5, 45,8, 45,2, 42,8, 40,2, 39,3, 29,1, 27,2, 26,4, 26,3, 23,5, 22,1, 17,1, 15,2, 14,2, 12,7, 7,7.
Пример 8. 1(S),3(R)-дигидрокси-20(R)-(5(S),6(R)-дигидрокси-1(S)-этокси-5-этил-2-гептин-1-ил)-9,10-секопрогна-5(Z),7(Е),10(19)-трие
Соединение 108
Способ: Общая процедура 4
Исходный материал: соединение 411
Элюент для хроматографии: 50-0% петролейный эфир в этилацетате.
13С ЯМР  147,7, 142,8, 133,2, 124,8, 117,2, 111,8, 83,0, 81,9, 75,4, 72,3, 71,2, 70,8, 66,8, 64,2, 56,0, 51,5, 45,8, 45,2, 42,9, 40,2, 39,3, 29,3, 29,1, 26,3, 25,1, 23,5, 22,1, 17,1, 15,2, 14,2, 12,7, 7,7.
Пример 9. 1(S),3(R)-дигидрокси-20(R)-(4-этил-1(S),4(S),5(S)-тригидрокси-2-гeксин-1-ил)-9,10-секопрегна-5(Z),7(Е),10(19)-триен
Соединение 109
Способ: Общая процедура 10
Исходный материал: соединение 412
Элюент для хроматографии: этилацетат.
13H ЯМР (СD3ОD) 147,7, 142,8, 133,2, 124,8, 117,2, 111,8, 83,0, 81,9, 75,4, 72,3, 71,2, 70,8, 66,8, 64,2, 56,0, 51,5, 45,8, 45,2, 42,9, 40,2, 39,3, 29,3, 29,1, 26,3, 25,1, 23,5, 22,1, 17,1, 15,2, 14,2, 12,7, 7,7.
Пример 9. 1(S),3(R)-дигидрокси-20(R)-(4-этил-1(S),4(S),5(S)-тригидрокси-2-гeксин-1-ил)-9,10-секопрегна-5(Z),7(Е),10(19)-триен
Соединение 109
Способ: Общая процедура 10
Исходный материал: соединение 412
Элюент для хроматографии: этилацетат.
13H ЯМР (СD3ОD)  6,32 (д, 1Н), 6,08 (д, 1Н), 5,28 (д, 1Н), 4,90 (д, 1Н), 4,57 (д, 1Н), 4,35 (т, 1Н), 4,12 (м, 1Н), 3,63 (кв. 1Н), 2,86 (дд, 1Н), 2,55 (дд, 1Н), 2,25 (дд, 1Н), 2,0-1,0 (м, 16Н), 1,27 (д, 3Н), 1,23 (д, 3Н), 1,05 (т, 3Н), 0,56 (с, 3Н).
Пример 10. 1(S),3(R)-дигидрокси-20(R)-(4(S),5(S)-дигидрокси-1(S)-этокси-4-этил-2-гексин-1-ил)-9,10-секопрегна-5(Z),7(Е),10(19)-трие
Соединение 111
Способ: Общая процедура 10
Исходный материал: соединение 413
Элюент для хроматографии: 50-0% петролейный эфир в этилацетате.
13Н ЯМР 6,32 (д, 1Н), 6,08 (д, 1Н), 5,28 (д, 1Н), 4,90 (д, 1Н), 4,57 (д, 1Н), 4,35 (т, 1Н), 4,12 (м, 1Н), 3,63 (кв. 1Н), 2,86 (дд, 1Н), 2,55 (дд, 1Н), 2,25 (дд, 1Н), 2,0-1,0 (м, 16Н), 1,27 (д, 3Н), 1,23 (д, 3Н), 1,05 (т, 3Н), 0,56 (с, 3Н).
Пример 10. 1(S),3(R)-дигидрокси-20(R)-(4(S),5(S)-дигидрокси-1(S)-этокси-4-этил-2-гексин-1-ил)-9,10-секопрегна-5(Z),7(Е),10(19)-трие
Соединение 111
Способ: Общая процедура 10
Исходный материал: соединение 413
Элюент для хроматографии: 50-0% петролейный эфир в этилацетате.
13Н ЯМР  6,37 (д, 1Н), 6,01 (д, 1Н), 5,32 (т, 1Н), 5,00 (д, 1Н), 4,42 (т, 1Н), 4,41 (м, 2Н), 3,81 (кв., 1Н), 3,73 (м, 1Н), 3,31 (м, 1Н), 2,83 (дд, 1Н), 2,59 (дд, 1Н), 2,31 (м, 2Н), 2,1-1,0 (м, 14Н), 1,25 (д, 3Н), 1,21 (т, 3Н), 1,08 (т, 3Н), 1,02 (д, 3Н), 0,55 (с, 5Н).
Пример 11. 1(S),3(R)-дигидрокси-20(R)-(4-этил-1(S),4(R),5(S)-тригидрокси-2-гексин-1-ил)-9,10-секопрегна-5(Z),7(Е),10(19)-триен
Соединение 114
Способ: Общая процедура 10
Исходный материал: соединение 414
Элюент для хроматографии: этилацетат.
13С ЯМР (СD3OD) 6,37 (д, 1Н), 6,01 (д, 1Н), 5,32 (т, 1Н), 5,00 (д, 1Н), 4,42 (т, 1Н), 4,41 (м, 2Н), 3,81 (кв., 1Н), 3,73 (м, 1Н), 3,31 (м, 1Н), 2,83 (дд, 1Н), 2,59 (дд, 1Н), 2,31 (м, 2Н), 2,1-1,0 (м, 14Н), 1,25 (д, 3Н), 1,21 (т, 3Н), 1,08 (т, 3Н), 1,02 (д, 3Н), 0,55 (с, 5Н).
Пример 11. 1(S),3(R)-дигидрокси-20(R)-(4-этил-1(S),4(R),5(S)-тригидрокси-2-гексин-1-ил)-9,10-секопрегна-5(Z),7(Е),10(19)-триен
Соединение 114
Способ: Общая процедура 10
Исходный материал: соединение 414
Элюент для хроматографии: этилацетат.
13С ЯМР (СD3OD)  149,9, 142,4, 135,8, 130,2, 124,9, 119,1, 112,1, 73,5, 71,5, 67,4, 65,3, 61,6, 57,3, 52,7, 46,9, 46,2, 43,8, 42,2, 40,9, 32,1, 30,1, 27,1, 24,6, 23,2, 18,3, 14,5, 14,0, 13,0, 9,0.
Пример 12. 1(S),3(R)-дигидрокси-20(R)-(4(R),5(S)-дигидрокси-1(S)-этокси-4-этил-2-гексин-1-ил)-9,10-секопрегна-5(Z),7(Е),10(19)-трие
Соединение 116
Способ: Общая процедура 10
Исходный материал: соединение 415
Элюент для хроматографии: 50%-0% петролейный эфир в этилацетате.
13С ЯМР 149,9, 142,4, 135,8, 130,2, 124,9, 119,1, 112,1, 73,5, 71,5, 67,4, 65,3, 61,6, 57,3, 52,7, 46,9, 46,2, 43,8, 42,2, 40,9, 32,1, 30,1, 27,1, 24,6, 23,2, 18,3, 14,5, 14,0, 13,0, 9,0.
Пример 12. 1(S),3(R)-дигидрокси-20(R)-(4(R),5(S)-дигидрокси-1(S)-этокси-4-этил-2-гексин-1-ил)-9,10-секопрегна-5(Z),7(Е),10(19)-трие
Соединение 116
Способ: Общая процедура 10
Исходный материал: соединение 415
Элюент для хроматографии: 50%-0% петролейный эфир в этилацетате.
13С ЯМР  147,6, 142,9, 133,0, 125,0, 117,1, 111,9, 85,8, 85,3, 75,5, 73,2, 72,0, 70,9, 66,9, 64,3, 56,0, 51,5, 45,7, 45,3, 42,9, 40,2, 39,4, 31,0, 29,1, 26,4, 23,5, 22,1, 18,5, 15,2, 14,2, 12,7, 8,3.
Пример 13. Капсулы, содержавшие соединение 103
Соединение 103 растворяют в арахисовом масле до конечной концентрации, составляющей 1 мкг соединения 103/мл масла. 10 частей мас. желатина, 5 частей мас. глицерина, 0,08 частей мас. сорбата калия и 14 частей мас. дистиллированной воды смешивают вместе при нагревании и формуют в мягкие желатиновые капсулы. Затем каждую из таких капсул наполняют 100 мкл соединения 103 в масляном растворе таким образом, чтобы каждая капсула содержала 0,1 мкг соединения 103.
Пример 14. Дерматологический крем, содержащий соединение 102
В 1 г миндального масла растворяют 0,05 мг соединения 102. К полученному раствору добавляют 40 мг минерального масла и 20 г самоэмульгирующегося пчелиного воска. Смесь нагревают до разжижения. После добавления 40 мл горячей воды смесь хорошо перемешивают. Полученный крем содержит приблизительно 0,5 мкг соединения 102 на грамм крема.
Пример 15. Раствор для инъекций, содержащий соединение 108
Соединение 108 (активное вещество) 10 мкг
Динатрийфосфата дигидрат (буфер) 15,4 мкг
Дигидрофосфат натрия дигидрат (буфер) 2 мкг
Хлорид натрия 0,8 мкг
Аскорбат натрия (антиоксидант) 5 мкг
Solutol 147,6, 142,9, 133,0, 125,0, 117,1, 111,9, 85,8, 85,3, 75,5, 73,2, 72,0, 70,9, 66,9, 64,3, 56,0, 51,5, 45,7, 45,3, 42,9, 40,2, 39,4, 31,0, 29,1, 26,4, 23,5, 22,1, 18,5, 15,2, 14,2, 12,7, 8,3.
Пример 13. Капсулы, содержавшие соединение 103
Соединение 103 растворяют в арахисовом масле до конечной концентрации, составляющей 1 мкг соединения 103/мл масла. 10 частей мас. желатина, 5 частей мас. глицерина, 0,08 частей мас. сорбата калия и 14 частей мас. дистиллированной воды смешивают вместе при нагревании и формуют в мягкие желатиновые капсулы. Затем каждую из таких капсул наполняют 100 мкл соединения 103 в масляном растворе таким образом, чтобы каждая капсула содержала 0,1 мкг соединения 103.
Пример 14. Дерматологический крем, содержащий соединение 102
В 1 г миндального масла растворяют 0,05 мг соединения 102. К полученному раствору добавляют 40 мг минерального масла и 20 г самоэмульгирующегося пчелиного воска. Смесь нагревают до разжижения. После добавления 40 мл горячей воды смесь хорошо перемешивают. Полученный крем содержит приблизительно 0,5 мкг соединения 102 на грамм крема.
Пример 15. Раствор для инъекций, содержащий соединение 108
Соединение 108 (активное вещество) 10 мкг
Динатрийфосфата дигидрат (буфер) 15,4 мкг
Дигидрофосфат натрия дигидрат (буфер) 2 мкг
Хлорид натрия 0,8 мкг
Аскорбат натрия (антиоксидант) 5 мкг
Solutol HS 15 от BASF (солюбилизатор) 5 мкг
Вода для инъекций ad 1 мл
Solutol HS 15 от BASF (солюбилизатор) 5 мкг
Вода для инъекций ad 1 мл
Solutol HS 15 растворяют в воде для инъекций, нагревая ее до температуры, не превышающей 80°С, в атмофере азота. Добавляют буферные вещества и хлорид натрия, а затем раствор охлаждают максимум до 30°С. После этого добавляют аскорбат натрия и, наконец, в полученном растворе растворяют соединение 108.
Раствор подвергают стерильной фильтрации и обработке в автоклаве при соответствующем режиме время-температура.
Пример 16. 1(S),3(R)-дигидрокси-20(R)-(1(S),5(R/S)-дигидрокси-5-этил-6(S)-фтор-2-гептин-1-ил)-9,10-секопрегна-5(Z),7(Е),10(19)-трие
Соединение 157
Способ: Общая процедура 10
Исходный материал: соединение 416
Элюент для хроматографии: 50%-0% петролейный эфир в этилацетате.
Пример 17. 1(S),3(R)-дигидрокси-20(R)-(1(S)-этокси-5-этил-6(S)-фтор-2-гептин-5(R/S)-гидрокси-1-ил)-9,10-секопрегна-5(Z),7(Е),10(19)-триен
Соединение 158
Способ: Общая процедура 10
Исходный материал: соединение 417
Элюент для хроматографии: 50% петролейный эфир в этилацетате.
Пример 18. 1(S),3(R)-дигидрокси-20(R)-(1(S),5(R/S)-дигидрокси-5-этил-6(R)-фтор-2-гептин-1-ил)-9,10-секопрегна-5(Z),7(Е),10(19)-трие
Соединение 159
Способ: Общая процедура 10
Исходный материал: соединение 418
Элюент для хроматографии: 50%-0% петролейный эфир в этилацетате.
13С ЯМР HS 15 растворяют в воде для инъекций, нагревая ее до температуры, не превышающей 80°С, в атмофере азота. Добавляют буферные вещества и хлорид натрия, а затем раствор охлаждают максимум до 30°С. После этого добавляют аскорбат натрия и, наконец, в полученном растворе растворяют соединение 108.
Раствор подвергают стерильной фильтрации и обработке в автоклаве при соответствующем режиме время-температура.
Пример 16. 1(S),3(R)-дигидрокси-20(R)-(1(S),5(R/S)-дигидрокси-5-этил-6(S)-фтор-2-гептин-1-ил)-9,10-секопрегна-5(Z),7(Е),10(19)-трие
Соединение 157
Способ: Общая процедура 10
Исходный материал: соединение 416
Элюент для хроматографии: 50%-0% петролейный эфир в этилацетате.
Пример 17. 1(S),3(R)-дигидрокси-20(R)-(1(S)-этокси-5-этил-6(S)-фтор-2-гептин-5(R/S)-гидрокси-1-ил)-9,10-секопрегна-5(Z),7(Е),10(19)-триен
Соединение 158
Способ: Общая процедура 10
Исходный материал: соединение 417
Элюент для хроматографии: 50% петролейный эфир в этилацетате.
Пример 18. 1(S),3(R)-дигидрокси-20(R)-(1(S),5(R/S)-дигидрокси-5-этил-6(R)-фтор-2-гептин-1-ил)-9,10-секопрегна-5(Z),7(Е),10(19)-трие
Соединение 159
Способ: Общая процедура 10
Исходный материал: соединение 418
Элюент для хроматографии: 50%-0% петролейный эфир в этилацетате.
13С ЯМР  147,7, 142,7, 133,2, 124,9, 117,3, 111,8, 93,4, 84,2, 80,5, 74,5, 70,9, 66,9, 64,8, 56,0, 51,5, 45,7, 45,3, 42,9, 41,0, 39,6, 29,0, 28,0, 26,4, 25,3, 23,4, 22,1, 14,9, 13,3, 12,6, 7,5.
Пример 19. 1(S),3(R)-дигидрокси-20(R)-(1(S)-этокси-5-этил-6(R)-фтор-2-гептин-5(R/S)-гидрокси-1-ил)-9,10-секопрегна-5(Z),7(Е),10(19)-триен
Соединение 160
Способ: Общая процедура 10
Исходный материал: соединение 419
Элюент для хроматографии: 50% петролейный эфир в этилацетате.
13Н ЯМР 147,7, 142,7, 133,2, 124,9, 117,3, 111,8, 93,4, 84,2, 80,5, 74,5, 70,9, 66,9, 64,8, 56,0, 51,5, 45,7, 45,3, 42,9, 41,0, 39,6, 29,0, 28,0, 26,4, 25,3, 23,4, 22,1, 14,9, 13,3, 12,6, 7,5.
Пример 19. 1(S),3(R)-дигидрокси-20(R)-(1(S)-этокси-5-этил-6(R)-фтор-2-гептин-5(R/S)-гидрокси-1-ил)-9,10-секопрегна-5(Z),7(Е),10(19)-триен
Соединение 160
Способ: Общая процедура 10
Исходный материал: соединение 419
Элюент для хроматографии: 50% петролейный эфир в этилацетате.
13Н ЯМР  6,37 (д, 1Н), 6,02 (д, 1Н), 5,33 (с, 1Н), 5,00 (с, 1Н), 4,68 (дкв, 1Н), 4,43 (м, 1Н), 4,23 (м, 1Н), 4,13 (с, 1Н), 3,73 (м, 1Н), 3,30 (м, 1Н), 2,84 (дд, 1Н), 2,58 (м, 2Н), 2,40 (дд, 1Н), 2,31 (дд, 1Н), 2,05-1,20 (м, 19Н), 1,38 (дд, 3Н), 1,20 (т, 3Н), 1,01 (д, 3Н), 0,96 (т, 3Н), 0,54 (с, 3Н). 6,37 (д, 1Н), 6,02 (д, 1Н), 5,33 (с, 1Н), 5,00 (с, 1Н), 4,68 (дкв, 1Н), 4,43 (м, 1Н), 4,23 (м, 1Н), 4,13 (с, 1Н), 3,73 (м, 1Н), 3,30 (м, 1Н), 2,84 (дд, 1Н), 2,58 (м, 2Н), 2,40 (дд, 1Н), 2,31 (дд, 1Н), 2,05-1,20 (м, 19Н), 1,38 (дд, 3Н), 1,20 (т, 3Н), 1,01 (д, 3Н), 0,96 (т, 3Н), 0,54 (с, 3Н).
Формула изобретения 1. Соединение формулы I 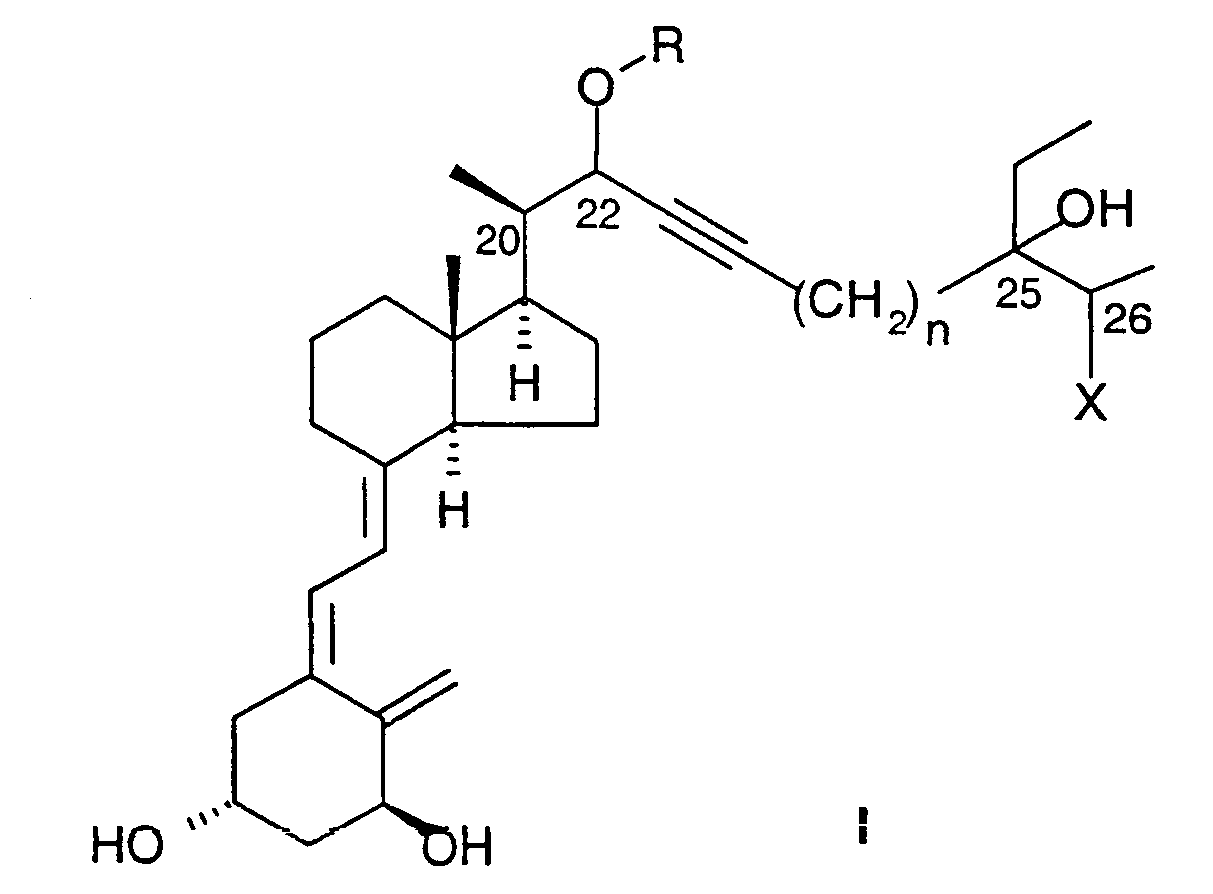 в которой R представляет водород либо R представляет (С1-С6)-алкил или (С7-С9)аралкил, необязательно замещенный одной или более группами, выбранными из (С1-С3)алкила, F и фенила;
n = 0, 1 или 2;
Х – гидроксил или галоген,
включая любые возможные диастереоизомеры формулы I в чистом виде и любую смесь диастереоизомеров формулы I.
2. Соединение по п.1, в котором R выбран из группы, состоящей из метила, этила, пропила, изопропила, бензила, ортометилбензила, метаметилбензила и параметилбензила.
3. Соединение по любому из предыдущих пунктов, в котором n = 0 или 1, предпочтительно n = 1.
4. Соединение по любому из предыдущих пунктов, в котором Х представляет заместитель, выбранный из группы, состоящей из ОН, F и Cl.
5. Соединение по любому из предыдущих пунктов, имеющее конфигурацию 22(S), 25(S), 26(S) или 22(S), 25(S), 26(R).
6. Соединение по п.1, выбранное из группы, включающей
1(S),3(R)-дигидрокси-20(R)-(5-этил-1(S),5(S),6(S)-тригид-рокси-2-гептин-1-ил)-9,10-секопрегна-5(Z),7(E),10(19)-триен (соединение 101),
1(S),3(R)-дигидрокси-20(R)-(5(S),6(S)-дигидрокси-5-этил-1(S)-метокси-2-гептин-1-ил)-9,10-секопрегна-5(Z),7(E),10(19)-триен (соединение 102),
1(S),3(R)-дигидрокси-20(R)-(5(S),6(S)-дигидрокси-1(S)-этокси-5-этил-2-гептин-1-ил)-9,10-секопрегна-5(Z),7(E),10(19)-триен (соединение 103),
1(S),3(R)-дигидрокси-20(R)-(5(S),6(S)-дигидрокси-5-этил-1(S)-(1-пропилокси)-2-гептин-1-ил)-9,10-секопрегна-5(Z),7(E),-10(19)-триен (соединение 104),
1(S),3(R)-дигидрокси-20(R)-(1(S)-бензилилокси-5(S),6(S)-дигидрокси-5-этил-2-гептин-1-ил)-9,10-секопрегна-5(Z),7(E),-10(19)-триен (соединение 105),
1(S),3(R)-дигидрокси-20(R)-(5(R),6(S)-дигидрокси-1(S)-этокси-5-этил-2-гептин-1-ил)-9,10-секопрегна-5(Z),7(E),10(19)-триен (соединение 106),
1(S),3(R)-дигидрокси-20(R)-(5(R),6(R)-дигидрокси-1(S)-этокси-5-этил-2-гептин-1-ил)-9,10-секопрегна-5(Z),7(E),10(19)-триен (соединение 107),
1(S),3(R)-дигидрокси-20(R)-(5(S),6(R)-дигидрокси-1(S)-этокси-5-этил-2-гептин-1-ил)-9,10-секопрегна-5(Z),7(E),10(19)-триен (соединение 108),
(S),3(R)-дигидрокси-20(R)-(4-этил-1(S),4(S),5(S)-тригид-рокси-2-гексин-1-ил)-9,10-секопрегна-5(Z),7(E),10(19)-триен (соединение 109),
(S),3(R)-дигидрокси-20(R)-(4(S),5(S)-дигидрокси-1(S)-этокси-4-этил-2-гексин-1-ил)-9,10-секопрегна-5(Z),7(E),10(19)-триен (соединение 111),
1(S),3(R)-дигидрокси-20(R)-(4-этил-1(S),4(R),5(S)-тригид-рокси-2-гексин-1-ил)-9,10-секопрегна-5(Z),7(E),10(19)-триен (соединение 114),
1(S),3(R)-дигидрокси-20(R)-(4(R),5(S)-дигидрокси-1(S)-этокси-4-этил-2-гексин-1-ил)-9,10-секопрегна-5(Z),7(E),10(19)-триен (соединение 116),
1(S),3(R)-дигидрокси-20(R)-(1(S)-этокси-5-этил-6(S)-фтор-5(S)-гидрокси-2-гептин-1-ил)-9,10-секопрегна-5(Z),7(E),10(19)-триен (соединение 149) и
1(S),3(R)-дигидрокси-20(R)-(1(S)-этокси-5-этил-6(R)-фтор-5(S)-гидрокси-2-гептин-1-ил)-9,10-секопрегна-5(Z),7(E),10(19)-триен (соединение 150),
1(S),3(R)-дигидрокси-20(R)-(1(S),5(R/S)-дигидрокси-5-этил-6(S)-фтор-2-гептин-1-ил)-9,10-секопрегна-5(Z),7(E),10(19)-триен (соединение 157),
1(S),3(R)-дигидрокси-20(R)-(1(S)-этокси-5-этил-6(S)-фтор-2-гептин-5(R/S)-гидрокси-1-ил)-9,10-секопрегна-5(Z),7(E),10(19)-триен (соединение 158),
1(S),3(R)-дигидрокси-20(R)-(1(S),5(R/S)-дигидрокси-5-этил-6(R)-фтор-2-гептин-1-ил)-9,10-секопрегна-5(Z),7(E),10(19)-триен (соединение 159),
1(S),3(R)-дигидрокси-20(R)-(1(S)-этокси-5-этил-6(R)-фтор-2-гептин-6(R/S)-гидрокси-1-ил)-9,10-секопрегна-5(Z),7(E),10(19)-триен (соединение 160).
7. Способ получения соединения формулы I по п.1, отличающийся а) взаимодействием 1(S),3(R)-бис(трет-бутилдиметилсилил-окси)-20(R)-формил-9,10-секопрегна-5(Е),7(E),10(19)-триена с металлоорганическим реагентом, полученным из структурного блока боковой цепи HC
в которой R представляет водород либо R представляет (С1-С6)-алкил или (С7-С9)аралкил, необязательно замещенный одной или более группами, выбранными из (С1-С3)алкила, F и фенила;
n = 0, 1 или 2;
Х – гидроксил или галоген,
включая любые возможные диастереоизомеры формулы I в чистом виде и любую смесь диастереоизомеров формулы I.
2. Соединение по п.1, в котором R выбран из группы, состоящей из метила, этила, пропила, изопропила, бензила, ортометилбензила, метаметилбензила и параметилбензила.
3. Соединение по любому из предыдущих пунктов, в котором n = 0 или 1, предпочтительно n = 1.
4. Соединение по любому из предыдущих пунктов, в котором Х представляет заместитель, выбранный из группы, состоящей из ОН, F и Cl.
5. Соединение по любому из предыдущих пунктов, имеющее конфигурацию 22(S), 25(S), 26(S) или 22(S), 25(S), 26(R).
6. Соединение по п.1, выбранное из группы, включающей
1(S),3(R)-дигидрокси-20(R)-(5-этил-1(S),5(S),6(S)-тригид-рокси-2-гептин-1-ил)-9,10-секопрегна-5(Z),7(E),10(19)-триен (соединение 101),
1(S),3(R)-дигидрокси-20(R)-(5(S),6(S)-дигидрокси-5-этил-1(S)-метокси-2-гептин-1-ил)-9,10-секопрегна-5(Z),7(E),10(19)-триен (соединение 102),
1(S),3(R)-дигидрокси-20(R)-(5(S),6(S)-дигидрокси-1(S)-этокси-5-этил-2-гептин-1-ил)-9,10-секопрегна-5(Z),7(E),10(19)-триен (соединение 103),
1(S),3(R)-дигидрокси-20(R)-(5(S),6(S)-дигидрокси-5-этил-1(S)-(1-пропилокси)-2-гептин-1-ил)-9,10-секопрегна-5(Z),7(E),-10(19)-триен (соединение 104),
1(S),3(R)-дигидрокси-20(R)-(1(S)-бензилилокси-5(S),6(S)-дигидрокси-5-этил-2-гептин-1-ил)-9,10-секопрегна-5(Z),7(E),-10(19)-триен (соединение 105),
1(S),3(R)-дигидрокси-20(R)-(5(R),6(S)-дигидрокси-1(S)-этокси-5-этил-2-гептин-1-ил)-9,10-секопрегна-5(Z),7(E),10(19)-триен (соединение 106),
1(S),3(R)-дигидрокси-20(R)-(5(R),6(R)-дигидрокси-1(S)-этокси-5-этил-2-гептин-1-ил)-9,10-секопрегна-5(Z),7(E),10(19)-триен (соединение 107),
1(S),3(R)-дигидрокси-20(R)-(5(S),6(R)-дигидрокси-1(S)-этокси-5-этил-2-гептин-1-ил)-9,10-секопрегна-5(Z),7(E),10(19)-триен (соединение 108),
(S),3(R)-дигидрокси-20(R)-(4-этил-1(S),4(S),5(S)-тригид-рокси-2-гексин-1-ил)-9,10-секопрегна-5(Z),7(E),10(19)-триен (соединение 109),
(S),3(R)-дигидрокси-20(R)-(4(S),5(S)-дигидрокси-1(S)-этокси-4-этил-2-гексин-1-ил)-9,10-секопрегна-5(Z),7(E),10(19)-триен (соединение 111),
1(S),3(R)-дигидрокси-20(R)-(4-этил-1(S),4(R),5(S)-тригид-рокси-2-гексин-1-ил)-9,10-секопрегна-5(Z),7(E),10(19)-триен (соединение 114),
1(S),3(R)-дигидрокси-20(R)-(4(R),5(S)-дигидрокси-1(S)-этокси-4-этил-2-гексин-1-ил)-9,10-секопрегна-5(Z),7(E),10(19)-триен (соединение 116),
1(S),3(R)-дигидрокси-20(R)-(1(S)-этокси-5-этил-6(S)-фтор-5(S)-гидрокси-2-гептин-1-ил)-9,10-секопрегна-5(Z),7(E),10(19)-триен (соединение 149) и
1(S),3(R)-дигидрокси-20(R)-(1(S)-этокси-5-этил-6(R)-фтор-5(S)-гидрокси-2-гептин-1-ил)-9,10-секопрегна-5(Z),7(E),10(19)-триен (соединение 150),
1(S),3(R)-дигидрокси-20(R)-(1(S),5(R/S)-дигидрокси-5-этил-6(S)-фтор-2-гептин-1-ил)-9,10-секопрегна-5(Z),7(E),10(19)-триен (соединение 157),
1(S),3(R)-дигидрокси-20(R)-(1(S)-этокси-5-этил-6(S)-фтор-2-гептин-5(R/S)-гидрокси-1-ил)-9,10-секопрегна-5(Z),7(E),10(19)-триен (соединение 158),
1(S),3(R)-дигидрокси-20(R)-(1(S),5(R/S)-дигидрокси-5-этил-6(R)-фтор-2-гептин-1-ил)-9,10-секопрегна-5(Z),7(E),10(19)-триен (соединение 159),
1(S),3(R)-дигидрокси-20(R)-(1(S)-этокси-5-этил-6(R)-фтор-2-гептин-6(R/S)-гидрокси-1-ил)-9,10-секопрегна-5(Z),7(E),10(19)-триен (соединение 160).
7. Способ получения соединения формулы I по п.1, отличающийся а) взаимодействием 1(S),3(R)-бис(трет-бутилдиметилсилил-окси)-20(R)-формил-9,10-секопрегна-5(Е),7(E),10(19)-триена с металлоорганическим реагентом, полученным из структурного блока боковой цепи HC C-(CH2)n-C(C2H5)(O-PG1)(CHX1-CH3), в котором n и R имеют вышеуказанные значения; Х1 представляет O-PG2, фтор, хлор, бром или иод; PG1 и PG2 представляют одинаковые или различные группы, выбранные из триметилсилила и трет-бутилдиметилсилила, либо PG1 и PG2 вместе образуют одну бифункциональную изопропилиденовую кетальную защитную группу, для получения соединения формулы III; b) необязательным отделением от диастереоизомеров соединения, полученного на стадии а); с) триплетно-сенсибилизированной фотоизомеризацией соединения, полученного на стадии а) или на стадии b), в 5(Z)-изомер; d) необязательным алкилированием соединения, полученного на стадии с), у 22-гидроксильной группы (С1-С6)алкил- или (С7-С9)аралкилбромидом или -иодидом в присутствии основания и межфазного катализатора, а также е) снятием защиты с соединения, полученного на стадии с) или стадии d) для получения соединения формулы I.
8. Фармацевтическая композиция для лечения и/или профилактики заболеваний, характеризуемых аномальной дифференциацией и/или пролиферацией клеток, таких, как, например, псориаз, включая пустулезный акродерматит, персистирующий акродерматит и псориаз ногтей, а также другие нарушения кератинизации; ВИЧ-ассоциированные дерматозы; заживление ран и различные виды рака, такие, как лейкоз, рак молочных желез, глиальные опухоли мозга, остеосаркома, миелофиброз, меланома, другие виды рака кожи; заболевания или нарушения иммунной системы, такие, как реакции “хозяин против трансплантата” и “трансплантат против хозяина”, отторжение трансплантата; аутоиммунные заболевания, включая дисковидный эритематоз и эритематоз системной волчанки; сахарный диабет и хронические дерматозы аутоиммунного типа, например, склеродермия и пузырчатка вульгарная; воспалительные заболевания, такие, как астма и ревматоидный артрит; а также ряд других болезненных состояний, включая гиперпаратироидизм, особенно вторичный гиперпаратироидизм, связанный с почечной недостаточностью; когнитивное ухудшение или старческая деменция (болезнь Альцгеймера) и другие нейродегенеративные заболевания; гипертензия; акне; алопеция; атрофия кожи, например, индуцированная стероидами атрофия кожи; старение кожи, включая фотостарение; а также при остеогенезе, остеопорозе и остеомаляции, содержащая эффективное количество одного или нескольких соединений по пп.1-6 вместе с фармацевтически приемлемыми нетоксическими носителями и/или вспомогательными агентами.
9. Соединение по любому из пп.1-6, используемое для изготовления медикамента, предназначенного для лечения и/или профилактики заболеваний, характеризуемых аномальной дифференциацией и/или пролиферацией клеток, таких, как, например, псориаз, включая пустулезный акродерматит, персистирующий акродерматит и псориаз ногтей, а также другие нарушения кератинизации; ВИЧ-ассоциированные дерматозы; заживление ран; различные виды рака, такие, как лейкоз, рак молочных желез, глиальные опухоли мозга, остеосаркома, миелофиброз, меланома, другие виды рака кожи; заболевания или нарушения иммунной системы, такие, как реакции “хозяин против трансплантата” и “трансплантат против хозяина”; отторжение трансплантата; аутоиммунные заболевания, включая дисковидный эритематоз и эритематоз системной волчанки; сахарный диабет; хронические дерматозы аутоиммунного типа, например, склеродермия и пузырчатка вульгарная; воспалительные заболевания, такие, как астма и ревматоидный артрит; а также ряд других болезненных состояний, включая гиперпаратироидизм, особенно вторичный гиперпаратироидизм, связанный с почечной недостаточностью; когнитивное ухудшение или старческая деменция (болезнь Альцгеймера) и другие нейродегенеративные заболевания; гипертензия; акне; алопеция; атрофия кожи, например, индуцированная стероидами атрофия кожи; старение кожи, включая фотостарение, а также для их применения с целью промотирования остеогенеза и лечения и профилактики остеопороза и остеомаляции. C-(CH2)n-C(C2H5)(O-PG1)(CHX1-CH3), в котором n и R имеют вышеуказанные значения; Х1 представляет O-PG2, фтор, хлор, бром или иод; PG1 и PG2 представляют одинаковые или различные группы, выбранные из триметилсилила и трет-бутилдиметилсилила, либо PG1 и PG2 вместе образуют одну бифункциональную изопропилиденовую кетальную защитную группу, для получения соединения формулы III; b) необязательным отделением от диастереоизомеров соединения, полученного на стадии а); с) триплетно-сенсибилизированной фотоизомеризацией соединения, полученного на стадии а) или на стадии b), в 5(Z)-изомер; d) необязательным алкилированием соединения, полученного на стадии с), у 22-гидроксильной группы (С1-С6)алкил- или (С7-С9)аралкилбромидом или -иодидом в присутствии основания и межфазного катализатора, а также е) снятием защиты с соединения, полученного на стадии с) или стадии d) для получения соединения формулы I.
8. Фармацевтическая композиция для лечения и/или профилактики заболеваний, характеризуемых аномальной дифференциацией и/или пролиферацией клеток, таких, как, например, псориаз, включая пустулезный акродерматит, персистирующий акродерматит и псориаз ногтей, а также другие нарушения кератинизации; ВИЧ-ассоциированные дерматозы; заживление ран и различные виды рака, такие, как лейкоз, рак молочных желез, глиальные опухоли мозга, остеосаркома, миелофиброз, меланома, другие виды рака кожи; заболевания или нарушения иммунной системы, такие, как реакции “хозяин против трансплантата” и “трансплантат против хозяина”, отторжение трансплантата; аутоиммунные заболевания, включая дисковидный эритематоз и эритематоз системной волчанки; сахарный диабет и хронические дерматозы аутоиммунного типа, например, склеродермия и пузырчатка вульгарная; воспалительные заболевания, такие, как астма и ревматоидный артрит; а также ряд других болезненных состояний, включая гиперпаратироидизм, особенно вторичный гиперпаратироидизм, связанный с почечной недостаточностью; когнитивное ухудшение или старческая деменция (болезнь Альцгеймера) и другие нейродегенеративные заболевания; гипертензия; акне; алопеция; атрофия кожи, например, индуцированная стероидами атрофия кожи; старение кожи, включая фотостарение; а также при остеогенезе, остеопорозе и остеомаляции, содержащая эффективное количество одного или нескольких соединений по пп.1-6 вместе с фармацевтически приемлемыми нетоксическими носителями и/или вспомогательными агентами.
9. Соединение по любому из пп.1-6, используемое для изготовления медикамента, предназначенного для лечения и/или профилактики заболеваний, характеризуемых аномальной дифференциацией и/или пролиферацией клеток, таких, как, например, псориаз, включая пустулезный акродерматит, персистирующий акродерматит и псориаз ногтей, а также другие нарушения кератинизации; ВИЧ-ассоциированные дерматозы; заживление ран; различные виды рака, такие, как лейкоз, рак молочных желез, глиальные опухоли мозга, остеосаркома, миелофиброз, меланома, другие виды рака кожи; заболевания или нарушения иммунной системы, такие, как реакции “хозяин против трансплантата” и “трансплантат против хозяина”; отторжение трансплантата; аутоиммунные заболевания, включая дисковидный эритематоз и эритематоз системной волчанки; сахарный диабет; хронические дерматозы аутоиммунного типа, например, склеродермия и пузырчатка вульгарная; воспалительные заболевания, такие, как астма и ревматоидный артрит; а также ряд других болезненных состояний, включая гиперпаратироидизм, особенно вторичный гиперпаратироидизм, связанный с почечной недостаточностью; когнитивное ухудшение или старческая деменция (болезнь Альцгеймера) и другие нейродегенеративные заболевания; гипертензия; акне; алопеция; атрофия кожи, например, индуцированная стероидами атрофия кожи; старение кожи, включая фотостарение, а также для их применения с целью промотирования остеогенеза и лечения и профилактики остеопороза и остеомаляции.
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 12.07.2007
Извещение опубликовано: 20.07.2010 БИ: 20/2010
|
||||||||||||||||||||||||||
