Патент на изобретение №2228901
|
||||||||||||||||||||||||||
(54) СПОСОБ ПОЛУЧЕНИЯ СИНТЕЗ-ГАЗА
(57) Реферат: Изобретение относится к способу получения синтез-газа, содержащего в основном Н2 и СО, для производства спиртов, аммиака, для процессов Фишера-Тропша. Способ получения синтез-газа с заданным соотношением Н2/СО в диапазоне от 1,0 до 2,0 включает две стадии: стадию А) парциального окисления и стадию Б) конверсии остаточного метана с продуктами стадии А) на катализаторе. Стадию А) парциального окисления проводят в две ступени: а) некаталитического парциального окисления природного газа кислородом с получением в продуктах реакции неравновесного содержания Н2О и СН4 при мольном соотношении кислорода и метана, примерно равном 0,76-0,84, б) конверсии продуктов реакции ступени а) с корректирующими добавками СО2 и Н2О или Н2О и СН4 с получением газовой смеси, которая проходит конверсию остаточного метана водяным паром на катализаторе. Изобретение позволяет снизить энергозатраты. 2 з.п.ф-лы, 1 ил. Изобретение относится к получению синтез-газа, содержащего, в основном, Н2 и СО для производства спиртов или аммиака, процессов Фишера-Тропша и оксосинтеза. Способ в соответствии с изобретением предпочтительно относится к переработке природного газа в синтез-газ с заданным мольным соотношением Н2/СО в диапазоне от 1,0 до 2,0. Известны способы получения синтез-газа из природного газа, газовых смесей, содержащих Н2 и СО, на основе различных видов конверсии: кислородной конверсии или, как это принято в зарубежной технической литературе, некаталитического парциального окисления, автотермического реформинга, протекающего на катализаторе в реакторе шахтного типа и парового реформинга, проводимого в трубчатой печи с внешним обогревом труб (см. “Производство технологического газа для синтеза аммиака и метанола из углеводородных газов”. Изд. “Химия”, Москва, 1971, под ред. А.Г. Лейбуш). При получении газа для синтеза метанола автотермический реформинг природного газа с добавлением СO2 проводится путем выполнения следующих стадий: сатурации с Н2О исходного природного газа, смешивания его с СО2 и подогрева до температуры 550-600  С в теплообменнике возвратным конвертированным газом и последующей конверсии парогазовой смеси исходного состава при следующих соотношениях: СO2:Н2О:CH4=0,2:0,9:1,0 в шахтном каталитическом реакторе с кислородом при соотношении О2:СН4=0,6:1,0.
Реакция протекает на никельсодержащем катализаторе (6% NiO на носителе из Аl2О3) при температуре 850-950 С в теплообменнике возвратным конвертированным газом и последующей конверсии парогазовой смеси исходного состава при следующих соотношениях: СO2:Н2О:CH4=0,2:0,9:1,0 в шахтном каталитическом реакторе с кислородом при соотношении О2:СН4=0,6:1,0.
Реакция протекает на никельсодержащем катализаторе (6% NiO на носителе из Аl2О3) при температуре 850-950 С. Полученный конвертированный газ после охлаждения в котле-утилизаторе, теплообменнике для подогрева исходной парогазовой смеси, водном скруббере проходит далее очистку от CO2 с использованием моноэтаноламинового раствора (МЭА) (18-20 мас.% МЭА) и подается далее на компрессию и синтез метанола.
К недостаткам приведенного способа можно отнести следующее:
1. В конвертированном газе после автотермической конверсии имеет место повышенное содержание СО2 (>9 об.%), что требует дальнейшей дополнительной очистки от СО2.
2. В конвертированном газе высоко содержание водорода и, следовательно, повышенное соотношение Н2/СО (>2,3), что приводит к повышенным расходам СО+Н2 на единицу продукции. При синтезе метанола требуется соотношение, так называемый “функционал” f=(H2-СO2)/(СО+СO2) С. Полученный конвертированный газ после охлаждения в котле-утилизаторе, теплообменнике для подогрева исходной парогазовой смеси, водном скруббере проходит далее очистку от CO2 с использованием моноэтаноламинового раствора (МЭА) (18-20 мас.% МЭА) и подается далее на компрессию и синтез метанола.
К недостаткам приведенного способа можно отнести следующее:
1. В конвертированном газе после автотермической конверсии имеет место повышенное содержание СО2 (>9 об.%), что требует дальнейшей дополнительной очистки от СО2.
2. В конвертированном газе высоко содержание водорода и, следовательно, повышенное соотношение Н2/СО (>2,3), что приводит к повышенным расходам СО+Н2 на единицу продукции. При синтезе метанола требуется соотношение, так называемый “функционал” f=(H2-СO2)/(СО+СO2) 2,05.
3. В результате проведения реакции синтеза метанола водород оказывается в избытке и он попадает в “продувки”, что в результате приводит к повышенным энергоматериальным затратам.
Другим способом получения синтез-газа с низким соотношением 2/СО для синтеза метанола является некаталитическое парциальное окисление природного или другого углеводородного газа (Справочник азотчика, Издательство “Химия”, Москва, 1986). Природный газ реагирует с кислородом при высокой температуре (1300-1500 2,05.
3. В результате проведения реакции синтеза метанола водород оказывается в избытке и он попадает в “продувки”, что в результате приводит к повышенным энергоматериальным затратам.
Другим способом получения синтез-газа с низким соотношением 2/СО для синтеза метанола является некаталитическое парциальное окисление природного или другого углеводородного газа (Справочник азотчика, Издательство “Химия”, Москва, 1986). Природный газ реагирует с кислородом при высокой температуре (1300-1500 С) в свободном объеме. Получаемый газ состоит в основном из водорода и оксида углерода.
В первом приближении процесс описывается уравнением для метана: С) в свободном объеме. Получаемый газ состоит в основном из водорода и оксида углерода.
В первом приближении процесс описывается уравнением для метана:
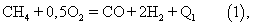 а для гомологов метана:
а для гомологов метана:
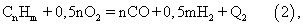 Возможность проведения процесса в отсутствие катализатора обеспечивается высокой температурой горения (1350-1400
Возможность проведения процесса в отсутствие катализатора обеспечивается высокой температурой горения (1350-1400 С). Для осуществления автотермичности процесса при указанной температуре отношение O2:СН4 держат несколько выше стехиометрического, в результате чего в продуктах реакции, кроме Н2 и СО, появляются водяной пар (Н2О) и двуокись углерода (СО2). Соотношение Н2 и СО в синтез-газе после некаталитического парциального окисления природного газа составляет около 1,7-1,8.
Соотношение Н2/СО можно варьировать либо дополнительной подачей Н2О, либо дополнительной подачей СО2.
Конечное состояние процесса некаталитического парциального окисления природного газа соответствует равновесию реакции водяного газа: С). Для осуществления автотермичности процесса при указанной температуре отношение O2:СН4 держат несколько выше стехиометрического, в результате чего в продуктах реакции, кроме Н2 и СО, появляются водяной пар (Н2О) и двуокись углерода (СО2). Соотношение Н2 и СО в синтез-газе после некаталитического парциального окисления природного газа составляет около 1,7-1,8.
Соотношение Н2/СО можно варьировать либо дополнительной подачей Н2О, либо дополнительной подачей СО2.
Конечное состояние процесса некаталитического парциального окисления природного газа соответствует равновесию реакции водяного газа:
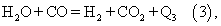 которое устанавливается до температуры ~1200
которое устанавливается до температуры ~1200 С. При более низких температурах из-за кинетических торможений состав газа будет отличаться от равновесного.
Независимо от состава исходного природного газа в продуктах реакции в небольшом количестве остается только метан.
В процессе неполного окисления углеводорода возможно выделение свободного углерода (сажи) по реакции: С. При более низких температурах из-за кинетических торможений состав газа будет отличаться от равновесного.
Независимо от состава исходного природного газа в продуктах реакции в небольшом количестве остается только метан.
В процессе неполного окисления углеводорода возможно выделение свободного углерода (сажи) по реакции:
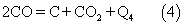 Выделение свободного углерода увеличивается при конверсии высших углеводородов. Для ограничения процесса выделения сажи к исходным реагентам добавляют водяной пар.
Таким образом, состав получаемого газа, соотношение Н2/СО, температура и граница сажевыделения устанавливаются в соответствии с исходными параметрами.
Реакция неполного окисления природного газа сопровождается увеличением объема, поэтому применение давления должно препятствовать окислению.
С ростом температуры (более 1200
Выделение свободного углерода увеличивается при конверсии высших углеводородов. Для ограничения процесса выделения сажи к исходным реагентам добавляют водяной пар.
Таким образом, состав получаемого газа, соотношение Н2/СО, температура и граница сажевыделения устанавливаются в соответствии с исходными параметрами.
Реакция неполного окисления природного газа сопровождается увеличением объема, поэтому применение давления должно препятствовать окислению.
С ростом температуры (более 1200 С) давление не лимитирует количественное окисление метана, поскольку температурный фактор компенсирует отрицательное влияние давления и является определяющим.
Однако некаталитическое парциальное окисление имеет ряд существенных недостатков:
1. Повышенный расход кислорода на исходный метан (или природный газ) приводит к повышенным расходам по сравнению с автотермическим реформингом. Оборудование для производства кислорода дорогостоящее и составляет до 70% от стоимости производства метанола (Me). Кроме того, производство кислорода является энергоемким производством.
2. В процессе выделяется небольшое количество сажи (углерода), что требует дополнительной стадии очистки, усложняет работу на последующих технологических стадиях.
Все это приводит к большим энергоматериальным затратам на единицу продукции.
Наиболее близким по технической сущности способом к заявляемому изобретению является способ, разработанный английской фирмой ICI (патент Великобритании 2139644 от 14 ноября 1984 и патент США 4618451 от 21 октября 1986).
Синтез-газ получают в двухстадийном процессе. На первой стадии природный газ реагирует с кислородом или кислородосодержащим газом. Количество кислорода берется достаточным, чтобы избежать сажеобразования.
Полученный на первой стадии горячий газовый поток, содержащий Н2 и СО, имеет температуру порядка 1093-1260 С) давление не лимитирует количественное окисление метана, поскольку температурный фактор компенсирует отрицательное влияние давления и является определяющим.
Однако некаталитическое парциальное окисление имеет ряд существенных недостатков:
1. Повышенный расход кислорода на исходный метан (или природный газ) приводит к повышенным расходам по сравнению с автотермическим реформингом. Оборудование для производства кислорода дорогостоящее и составляет до 70% от стоимости производства метанола (Me). Кроме того, производство кислорода является энергоемким производством.
2. В процессе выделяется небольшое количество сажи (углерода), что требует дополнительной стадии очистки, усложняет работу на последующих технологических стадиях.
Все это приводит к большим энергоматериальным затратам на единицу продукции.
Наиболее близким по технической сущности способом к заявляемому изобретению является способ, разработанный английской фирмой ICI (патент Великобритании 2139644 от 14 ноября 1984 и патент США 4618451 от 21 октября 1986).
Синтез-газ получают в двухстадийном процессе. На первой стадии природный газ реагирует с кислородом или кислородосодержащим газом. Количество кислорода берется достаточным, чтобы избежать сажеобразования.
Полученный на первой стадии горячий газовый поток, содержащий Н2 и СО, имеет температуру порядка 1093-1260 С. В этот газ вводится дополнительное количество углеводородов и водяной пар или СО2.
На второй стадии получаемая газовая смесь направляется на катализатор автотермического парового реформинга, где протекает адиабатический процесс паровой конверсии с получением синтез-газа.
Конечная температура полученного газа равна 750-950 С. В этот газ вводится дополнительное количество углеводородов и водяной пар или СО2.
На второй стадии получаемая газовая смесь направляется на катализатор автотермического парового реформинга, где протекает адиабатический процесс паровой конверсии с получением синтез-газа.
Конечная температура полученного газа равна 750-950 С. Давление процесса – от 0,5 до 5 МПа. В результате получается синтез-газ с f=(Н2-СO2)/(СО+СO2) С. Давление процесса – от 0,5 до 5 МПа. В результате получается синтез-газ с f=(Н2-СO2)/(СО+СO2) 1,5-2,2, где Н2, СО, СO2 – число молей этих газов в газовом потоке, что дает возможность использовать этот газ в производстве Me.
Данный способ производства синтез-газа имеет также ряд недостатков:
1. Получаемая низкая температура на первой стадии приводит к повышенному содержанию метана в конечном синтез-газе; непрореагировавший метан на следующих стадиях в цикле производства Me будет накапливаться, что приведет к повышенным продувкам синтез-газа и, как результат, к увеличенным расходам О2 и исходного углеводорода на единицу получаемого продукта.
2. Предлагаемая подача пара во второй ступени непосредственно перед катализатором не приведет к интенсивному смешиванию с горячим конвертированным газом, поскольку не предусмотрена зона смешивания и, как следствие, появится неравномерное распределение температуры по сечению шахтного конвертера.
3. Исходя из расчетов термодинамики, в соответствии со способом, описанным в вышеупомянутом патенте фирмы ICI, невозможно получить газ с мольным соотношением Н2/СО, равным 1:1, т.к. теплового потенциала на первой стадии конверсии будет недостаточно для конверсии СО2 по реакции: 1,5-2,2, где Н2, СО, СO2 – число молей этих газов в газовом потоке, что дает возможность использовать этот газ в производстве Me.
Данный способ производства синтез-газа имеет также ряд недостатков:
1. Получаемая низкая температура на первой стадии приводит к повышенному содержанию метана в конечном синтез-газе; непрореагировавший метан на следующих стадиях в цикле производства Me будет накапливаться, что приведет к повышенным продувкам синтез-газа и, как результат, к увеличенным расходам О2 и исходного углеводорода на единицу получаемого продукта.
2. Предлагаемая подача пара во второй ступени непосредственно перед катализатором не приведет к интенсивному смешиванию с горячим конвертированным газом, поскольку не предусмотрена зона смешивания и, как следствие, появится неравномерное распределение температуры по сечению шахтного конвертера.
3. Исходя из расчетов термодинамики, в соответствии со способом, описанным в вышеупомянутом патенте фирмы ICI, невозможно получить газ с мольным соотношением Н2/СО, равным 1:1, т.к. теплового потенциала на первой стадии конверсии будет недостаточно для конверсии СО2 по реакции:
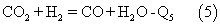 Задачей представленного изобретения является разработка способа получения синтез-газа заданного состава основных компонентов Н2 и СО в диапазоне соотношений Н2/СО от 1:1 до 2:1 и снижения энергозатрат.
Указанная задача решается способом получения синтез-газа заданного состава основных компонентов Н2 и СО в диапазоне изменения соотношения от 1:1 до 2:1 для производства метанола, диметилового эфира или для синтезов Фишера-Тропша, включающим две стадии: стадию А) парциального окисления и стадию Б) конверсии остаточного метана с продуктами стадии А на катализаторе, при этом стадию А) парциального окисления проводят в две ступени: а) некаталитического парциального окисления природного газа кислородом с получением в продуктах реакции неравновесного содержания Н2О и СН4 при мольном соотношении кислорода и метана, примерно равном 0,76-0,84, б) конверсии продуктов реакции ступени (а) с корректирующими добавками СО2 и Н2О или Н2О и CH4 с получением газовой смеси, которая проходит конверсию остаточного метана водяным паром на катализаторе.
Ступень а) стадии А) осуществляют при подаче 100% от общего требуемого расхода кислорода, 75-100% от общего расхода исходного природного газа с получением мольного соотношения кислород: метан, примерно равного 0,76-0,84, при времени пребывания в зоне горения t, равном 0,005-0,01 с в диапазоне рабочего давления 2,0-10 МПа, при этом в получаемом газе мольная концентрация Н2О составляет от 18 до 30%, а СН4 – от 1 до 8%, ступень б) стадии А) осуществляют при подаче оставшейся части природного газа от 25 до 0%, корректирующих добавок с временем пребывания t=0,003-1 с.
Первая ступень осуществляется в режиме некаталитического парциального окисления (автотермического) с температурой 1800-1400
Задачей представленного изобретения является разработка способа получения синтез-газа заданного состава основных компонентов Н2 и СО в диапазоне соотношений Н2/СО от 1:1 до 2:1 и снижения энергозатрат.
Указанная задача решается способом получения синтез-газа заданного состава основных компонентов Н2 и СО в диапазоне изменения соотношения от 1:1 до 2:1 для производства метанола, диметилового эфира или для синтезов Фишера-Тропша, включающим две стадии: стадию А) парциального окисления и стадию Б) конверсии остаточного метана с продуктами стадии А на катализаторе, при этом стадию А) парциального окисления проводят в две ступени: а) некаталитического парциального окисления природного газа кислородом с получением в продуктах реакции неравновесного содержания Н2О и СН4 при мольном соотношении кислорода и метана, примерно равном 0,76-0,84, б) конверсии продуктов реакции ступени (а) с корректирующими добавками СО2 и Н2О или Н2О и CH4 с получением газовой смеси, которая проходит конверсию остаточного метана водяным паром на катализаторе.
Ступень а) стадии А) осуществляют при подаче 100% от общего требуемого расхода кислорода, 75-100% от общего расхода исходного природного газа с получением мольного соотношения кислород: метан, примерно равного 0,76-0,84, при времени пребывания в зоне горения t, равном 0,005-0,01 с в диапазоне рабочего давления 2,0-10 МПа, при этом в получаемом газе мольная концентрация Н2О составляет от 18 до 30%, а СН4 – от 1 до 8%, ступень б) стадии А) осуществляют при подаче оставшейся части природного газа от 25 до 0%, корректирующих добавок с временем пребывания t=0,003-1 с.
Первая ступень осуществляется в режиме некаталитического парциального окисления (автотермического) с температурой 1800-1400 С с получением в синтез-газе неравновесного содержания Н2О и СН4 и мольного соотношения Н2/СО С с получением в синтез-газе неравновесного содержания Н2О и СН4 и мольного соотношения Н2/СО 1,4-1,8.
Вторая стадия проводится на насадке, которая может иметь несколько слоев; первый слой по ходу газа – инертный, имеющий развитую поверхность для выгазовывания сажи и последующие слои – каталитические – для доконверсии оставшегося метана.
Преимущества заявляемого способа заключаются в следующем:
1. На первой ступени первой стадии процесс конверсии осуществляется как термодинамически неравновесный с временем пребывания 0,005-0,01 с, при этом в конвертируемом газа сохраняется повышенное содержание водяного пара в продуктах реакции (Н2О) до 18-20 об.% при давлении до 2,0 МПа или 25-30% при давлении до 10,0 МПа и непрореагировавшего метана 1-3% и 7-8% соответственно давлению, минимальным количеством образующейся сажи (до 50 мг/нм3 конвертированного газа).
2. Количество подаваемого кислорода на первую ступень первой стадии соответствует мольному соотношению 1,4-1,8.
Вторая стадия проводится на насадке, которая может иметь несколько слоев; первый слой по ходу газа – инертный, имеющий развитую поверхность для выгазовывания сажи и последующие слои – каталитические – для доконверсии оставшегося метана.
Преимущества заявляемого способа заключаются в следующем:
1. На первой ступени первой стадии процесс конверсии осуществляется как термодинамически неравновесный с временем пребывания 0,005-0,01 с, при этом в конвертируемом газа сохраняется повышенное содержание водяного пара в продуктах реакции (Н2О) до 18-20 об.% при давлении до 2,0 МПа или 25-30% при давлении до 10,0 МПа и непрореагировавшего метана 1-3% и 7-8% соответственно давлению, минимальным количеством образующейся сажи (до 50 мг/нм3 конвертированного газа).
2. Количество подаваемого кислорода на первую ступень первой стадии соответствует мольному соотношению  =0,5[О2]/[СН4] в диапазоне 0,38-0,42 в зависимости от получения необходимого мольного соотношения Н2:СО в конечном продукте – конвертированном газе, а также величины содержания непрореагировавшего метана.
3. Во вторую ступень первой стадии подается корректирующая часть СО2 и Н2O или Н2О и СН4 (15-25% от суммарного расхода), при этом благодаря высокому содержанию паров Н2О в газе образования сажи не происходит.
Время пребывания составляет 0,3-3 с, на выходе из второй ступени устанавливается равновесная температура, которая составляет 1100-1500 =0,5[О2]/[СН4] в диапазоне 0,38-0,42 в зависимости от получения необходимого мольного соотношения Н2:СО в конечном продукте – конвертированном газе, а также величины содержания непрореагировавшего метана.
3. Во вторую ступень первой стадии подается корректирующая часть СО2 и Н2O или Н2О и СН4 (15-25% от суммарного расхода), при этом благодаря высокому содержанию паров Н2О в газе образования сажи не происходит.
Время пребывания составляет 0,3-3 с, на выходе из второй ступени устанавливается равновесная температура, которая составляет 1100-1500 С.
Благодаря принятым решениям реализуется экономичный технологический способ.
Способ может быть осуществлен по следующей схеме, показанной на чертеже, где:
1 – смесительная горелка (СГ);
2 – камера конверсии для осуществления процесса не каталитического парциального окисления;
3 – камера смешивания СO2 и Н2О или Н2О и СН4 с продуктами первичного некаталитического парциального окисления;
4 – камера коррекции;
5 – шахтный реактор;
6 – фильтр из специальных материалов;
7 – катализатор;
8 – фильтр;
9 – опорная решетка.
Предлагаемый процесс проводится следующим образом: природный газ после компрессии от 2 до 15 МПа и подогретый до 520 С.
Благодаря принятым решениям реализуется экономичный технологический способ.
Способ может быть осуществлен по следующей схеме, показанной на чертеже, где:
1 – смесительная горелка (СГ);
2 – камера конверсии для осуществления процесса не каталитического парциального окисления;
3 – камера смешивания СO2 и Н2О или Н2О и СН4 с продуктами первичного некаталитического парциального окисления;
4 – камера коррекции;
5 – шахтный реактор;
6 – фильтр из специальных материалов;
7 – катализатор;
8 – фильтр;
9 – опорная решетка.
Предлагаемый процесс проводится следующим образом: природный газ после компрессии от 2 до 15 МПа и подогретый до 520 С подается в горелку (п.1), куда также подается кислород, сжатый до давления от 2 до 15 МПа и подогретый до 150-250 С подается в горелку (п.1), куда также подается кислород, сжатый до давления от 2 до 15 МПа и подогретый до 150-250 С. Концентрация кислорода составляет 95-99 об.%. Температуру, давление и расходы потоков регулируют автоматически.
Кислород и природный газ раздельно поступают в камеру конверсии (п.2), где протекает реакция конверсии метана при температуре от 1200 до 1900 С. Концентрация кислорода составляет 95-99 об.%. Температуру, давление и расходы потоков регулируют автоматически.
Кислород и природный газ раздельно поступают в камеру конверсии (п.2), где протекает реакция конверсии метана при температуре от 1200 до 1900 С.
Время пребывания конвертированного газа, температура и давление рассчитываются таким образом, чтобы получить газ заданного состава после шахтного реактора (п.5).
Состав газа после камеры конверсии является неравновесным, т.е. не достигается термодинамического равновесия реакции С.
Время пребывания конвертированного газа, температура и давление рассчитываются таким образом, чтобы получить газ заданного состава после шахтного реактора (п.5).
Состав газа после камеры конверсии является неравновесным, т.е. не достигается термодинамического равновесия реакции
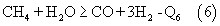 и газ имеет следующий состав, об.%: СН4 – 1-8; СО2 – 1,5-4; Н2O – 15-20; Н2 – 40-50; СО – 25-35.
В газе присутствует до 50 мг/нм3 непрореагировавшего углерода (сажа).
После камеры конверсии газ поступает на смешение с СO2 и CH4, если требуется получить конечный синтез-газ с соотношением Н2/СО
и газ имеет следующий состав, об.%: СН4 – 1-8; СО2 – 1,5-4; Н2O – 15-20; Н2 – 40-50; СО – 25-35.
В газе присутствует до 50 мг/нм3 непрореагировавшего углерода (сажа).
После камеры конверсии газ поступает на смешение с СO2 и CH4, если требуется получить конечный синтез-газ с соотношением Н2/СО 1:1, или с Н2O и CH4, если требуется получить конечный синтез-газ с соотношением Н2/СО 1:1, или с Н2O и CH4, если требуется получить конечный синтез-газ с соотношением Н2/СО 2:1.
После камеры смешения (п.3) газ поступает в камеру коррекции (п.4), в которой происходит гомогенная реакция (5) при температуре 1200-1100 2:1.
После камеры смешения (п.3) газ поступает в камеру коррекции (п.4), в которой происходит гомогенная реакция (5) при температуре 1200-1100 С.
Дальнейшая конверсия остаточного СН4 происходит в шахтном конверторе (п.5). Сажа фильтруется на входе в шахтный реактор фильтром (п.6) и конвертируется водяным паром полностью.
Далее изобретение будет более подробно пояснено на конкретных примерах, которые приведены как иллюстрация изобретения и ни в коей мере не ограничивают объем притязаний, заявленный в формуле изобретения.
Пример 1. Получение синтез-газа с мольным соотношением Н2:СО, равным 2:1
Природный газ в количестве 1000 нм3/ч под давлением 3 МПа и температуре 450 С.
Дальнейшая конверсия остаточного СН4 происходит в шахтном конверторе (п.5). Сажа фильтруется на входе в шахтный реактор фильтром (п.6) и конвертируется водяным паром полностью.
Далее изобретение будет более подробно пояснено на конкретных примерах, которые приведены как иллюстрация изобретения и ни в коей мере не ограничивают объем притязаний, заявленный в формуле изобретения.
Пример 1. Получение синтез-газа с мольным соотношением Н2:СО, равным 2:1
Природный газ в количестве 1000 нм3/ч под давлением 3 МПа и температуре 450 С и кислород в количестве 730 нм3/ч под давлением 3 МПа при температуре 150 С и кислород в количестве 730 нм3/ч под давлением 3 МПа при температуре 150 С подают в горелку (п.1) и далее в камеру конверсии (п.2).
В камере конверсии протекает реакция высокотемпературной конверсии при температуре 1860 С подают в горелку (п.1) и далее в камеру конверсии (п.2).
В камере конверсии протекает реакция высокотемпературной конверсии при температуре 1860 С с получением конвертированного газа, содержащего (на влажный газ), об.%: CH4 – 2,39; СO2 – 2,03; Н2О – 16,43; Н2 – 48,64; СО – 30,51.
В полученный газ в камеру смешивания дополнительно подаются 166 нм3/ч СН4 и 373 нм3/ч Н2О. Смесь конвертированного и дополнительного газа поступает в камеру коррекции (п.4) и затем в шахтный реактор (п.5).
На выходе из шахтного реактора газ имеет следующий состав, об.%: СН4 – 0,65; СO2 – 2,78; Н2O – 15,33; Н2 – 54,16; СО – 27,08 в количестве 3821 нм3/ч.
Полученный газ с температурой 1240 С с получением конвертированного газа, содержащего (на влажный газ), об.%: CH4 – 2,39; СO2 – 2,03; Н2О – 16,43; Н2 – 48,64; СО – 30,51.
В полученный газ в камеру смешивания дополнительно подаются 166 нм3/ч СН4 и 373 нм3/ч Н2О. Смесь конвертированного и дополнительного газа поступает в камеру коррекции (п.4) и затем в шахтный реактор (п.5).
На выходе из шахтного реактора газ имеет следующий состав, об.%: СН4 – 0,65; СO2 – 2,78; Н2O – 15,33; Н2 – 54,16; СО – 27,08 в количестве 3821 нм3/ч.
Полученный газ с температурой 1240 С направляется далее на охлаждение с утилизацией тепла и выделением технологического конденсата и далее на последующую переработку.
Пример 2. Получение конвертированного газа с мольным соотношением Н2:СО, равным 1:1
На первой ступени конверсия проводится, как это описано в примере 1.
В полученный газ в камеру смешивания (п.3) дополнительно подается 192,0 нм3/ч Н2O и 754 нм3/ч СО2.
Смесь конвертированного и дополнительного газа поступает в камеру коррекции (п.4) и затем в шахтный реактор (п.5).
На выходе из шахтного реактора газ имеет следующий состав, об.%: СН4 – 1,94; СО2 – 9,86; Н2О – 21,10; Н2 – 34,00; СО – 33,10 в количестве 4276 нм3/ч. С направляется далее на охлаждение с утилизацией тепла и выделением технологического конденсата и далее на последующую переработку.
Пример 2. Получение конвертированного газа с мольным соотношением Н2:СО, равным 1:1
На первой ступени конверсия проводится, как это описано в примере 1.
В полученный газ в камеру смешивания (п.3) дополнительно подается 192,0 нм3/ч Н2O и 754 нм3/ч СО2.
Смесь конвертированного и дополнительного газа поступает в камеру коррекции (п.4) и затем в шахтный реактор (п.5).
На выходе из шахтного реактора газ имеет следующий состав, об.%: СН4 – 1,94; СО2 – 9,86; Н2О – 21,10; Н2 – 34,00; СО – 33,10 в количестве 4276 нм3/ч.
Формула изобретения 1. Способ получения синтез-газа заданного состава основных компонентов Н2 и СО в диапазоне изменения соотношения от 1:1 до 2:1 для производства метанола, диметилового эфира или для синтезов Фишера-Тропша, включающий две стадии: стадию А) парциального окисления и стадию Б) конверсии остаточного метана с продуктами стадии А) на катализаторе, отличающийся тем, что стадию А) парциального окисления проводят в две ступени: а) некаталитического парциального окисления природного газа кислородом с получением в продуктах реакции неравновесного содержания Н2О и СН4 при мольном соотношении кислорода и метана, примерно равном 0,76-0,84, б) конверсии продуктов реакции ступени (а) с корректирующими добавками СО2 и Н2О или Н2О и СН4 с получением газовой смеси, которая проходит конверсию остаточного метана водяным паром на катализаторе. 2. Способ по п.1, отличающийся тем, что ступень а) стадии А) осуществляют при подаче 100% от общего требуемого расхода кислорода, 75-100% от общего расхода исходного природного газа с получением мольного соотношения кислород:метан, примерно равного 0,76-0,84, и при времени пребывания в зоне горения t=0,005-0,01 с. в диапазоне рабочего давления 2,0-10 МПа, при этом в получаемом газе мольная концентрация Н2О составляет 18 – 30%, а СН4 1 – 8%. 3. Способ по п.2, отличающийся тем, что ступень б) стадии А) осуществляют при подаче оставшейся части природного газа от 25 до 0%, корректирующих добавок с временем пребывания t=0,003-1 с. РИСУНКИ
|
||||||||||||||||||||||||||
