Патент на изобретение №2228357
|
||||||||||||||||||||||||||
(54) РЕКОМБИНАНТНЫЙ ВЕКТОР, ЭКСПРЕССИРУЮЩИЙ ПОЛИПЕПТИД С АКТИВНОСТЬЮ ГЛЮКОЗООКСИДАЗЫ, ТРАНСФОРМИРОВАННЫЙ ШТАММ SACCHAROMYCES CEREVISIAE, РЕКОМБИНАНТНЫЙ ПОЛИПЕПТИД С АКТИВНОСТЬЮ ГЛЮКОЗООКСИДАЗЫ И СПОСОБ ЕГО ПОЛУЧЕНИЯ
(57) Реферат: Изобретение относится к биотехнологии и может быть использовано для получения глюкозооксидазы. Рекомбинантный вектор для экспрессии полипептида с активностью глюкозооксидазы (ГО) содержит нуклеотидную последовательность, кодирующую полипептид или его мутеин, имеющий Ser в положении Cys у аминокислотного остатка 521, и оперативно связанные регуляторные последовательности. Сконструированным вектором трансформируют клетки, в частности клетки Saccharomyces cerevisiae. Рекомбинантный полипептид с активностью ГО получают путем культивирования трансформированных клеток. Изобретение позволяет получать глюкозооксидазу из грибов рекомбинантным путем. 4 с. и 6 з.п. ф-лы, 17 ил., 5 табл. Методическая область Настоящее изобретение относится к использованию технологии рекомбинантной ДНК для получения белков для промышленного использования. Более конкретно, настоящее изобретение относится к рекомбинантным векторам, содержащим полинуклеотид, происходящий от грибов, который кодирует глюкозооксидазу, и к продукции глюкозооксидазы хозяйскими клетками, трансформированными векторами экспрессии, содержащими этод полинуклеотид. Предпосылки Методы генной инженерии успешно применялись в фармацевтической индустрии, что дало новый продукт. Более того, стало ясно, что те же методы могут быть применены в широких масштабах в производстве ферментов, ценных для других производств. Преимущества получения коммерчески полезных процессов посредством генной инженерии, как ожидается, включают снижение стоимости получения фермента, получение ферментов в безопасных организмах, что удобно для пищевых продуктов, и специфически генетические модификации на геномном уровне, улучщающие свойства фермента, такие как термостабильность и рабочие характеристики, так же, как и те, которые упрощают очистку фермента. Глюкозооксидаза – это фермент, который катализирует окисление глюкозы в глюконовую кислоту с сопутствующим образованием перекиси водорода. Фермент имеет много промышленных применений, включая его использование в обессахаривании яиц, в удалении кислорода из напитков, влажных пищевых продуктов /вкусовые добавки/ и герметично закрытых упаковок пищи, и в определении и оценке глюкозы в промышленных растворах и в таких жидкостях тела, как кровь и моча. Глюкозооксидаза была впервые выделена из клеток Aspergillus niger Мюллером /Biochemische Zeitschrift /1928/, 199, 136-170 и /1931/, 232, 423-424/ и была также выделена из А. niger Франке и Деффнером /Annalen der Chemie /1939/, 541, 117-150/. Продукция глюкозооксидазы клетками Penicillum chrysogenum, Penicillum glaucum, Penicillum purpurogenum, Aspergillus niger и Aspergillus bumaricus описана Бэйкером, патент США №2482724. Способ препаративного получения глюкозооксидазы, в котором подуцирующие глюкозооксидазу /ГО/ линии родов Aspergillus и Penicillum культивировали в среде, имеющей низкое содержание углеводов, описан в патенте США №3701715. Фермент из Aspergillus niger /A. niger/ был очищен до высокой степени чистоты и по сообщениям имеет мол. вес. приблизительно 150,000, изоэлектрическую точку 4.2 и содержание флавинадениннуклеотида /ФАД/ – 3 ФАД на моль /Pazur и Kleppe /1964/ Biochemistry 3,578-583/. Известны также аминокислотный состав фермента из А. niger, а также его гликопротеиновая природа /Pazur и др., /1965/, Aroh. Biochem. Biophys III, 351-357/. Однако неизвестны ни аминокислотная последовательность ГО, ни нуклеотидная последовательность, кодирующая ее. Проблема с использованием ГО, выделенной из ее природного источника, заключается в том, что организмы, продуцирующие фермент, могут иметь загрязнения, вредные для отдельных применений желаемого фермента. Например, ГО используется для коммерческого приготовления пищевых продуктов. Однако А. niger, который является основным источником коммерчески приготовленного фермента, сильно аллергенет и не применим для использования в пище. Более того, процедура жесткой очистки может быть относительно дорогой, поскольку ГО – преимущественно внутриклеточный фермент. Эти проблемы могут быть разрешены получением ГО в рекомбинантных системах. Ферменты грибов были экспрессированы в рекомбинантных векторах. Глюкоамилаза из Aspergillus /Innis и др., /1985/, Science 228, 21-26/ и эндоглюканаза 1 из brichoderma rusei (van Arsdelf и др., /1987/, Biotechnology. 5,60-64/ были экспрессированы в Saccharomyces cerevisial. Сссылки, цитированные в последующем тексте References Cited in Following Text Barr et аl. (1986), Biotechniques 4, 428. Boel et al. (1984), Embo J. 3, 1581. Botstein et al. (1979), Gene 8: 17. Broach (1981), in MOLECULAR BIOLOGY OF THE YEAST SACCHAROMYCES, vоl. 1, р. 445. Chang et al. (1977), Nature 198, 1056. Chirgwin et al. (1979), Biochemistry 18, 5294. Clewell et al. (1969), Proc. Natl. Acad. Sci. USA 62, 1159. Clewell et аl. (1972), J. Bacteriol. 110, 667. Cohen (1972), Proc. Natl. Acad. Sci. USA 69, 2110. De Воеr еt аl. (1983), Proc. Natl. Acad. Sci. USA 292, 128. Edge (1981), Nature 292, 756. Ehrhart and Hollenberg (1983), J. Bacterio1. 156, 625. Gate, ed. (1984), OLIGONUCLEOTIDE SYNTHESIS. Glisin (1974), Biochemistry 13, 2633. Glover, ed. (1985), DNA CLONING: vol. 1 and vol 2. Goeddel et al. (1980), Nucleic Acids Res. 8, 4057. Graham and Van der Eb (1978), Virology 52, 546. Grunstein and Hogness (1975), Proc. Natl. Acad. Sci. USA 73, 6961. Hames & Higgins, eds. (1985), NUCLEIC ACID HYBRIDIZATION. Hammerling et al. (1981) MONOCLONAL ANTIBODIES AND T-CELL HYBRIDOMAS. Hess et al. (1968), J. Adv. Enzym Reg. 7, 149. Hinnen et al. (1978), Proc. Natl. Acad. Sci. USA 75, 1929. Hitzeman (1980), J. Biol. chem. 255, 2073. Holland (1978), Biochemistry 17, 4900. Holland (1981) J. Biol. chem. 256, 1385. Huynh et al. (1985), DNA CLONING, A PRACTICAL APPROACH (D.M. Glover, ed., IRL Press, рр. 47-78). Innis et al. (1985), Science 228, 21. Jay et al. (1984), J. Biol. Chem. 259, 6311. Кеllеу and Reddy (1986), J. Bact. 166, 269. Kennet et al. (1980), MONOCLONAL ANTIBODIES. Laemmli (1970), Nature 227, 680. Lei et al. (1987), J. Bacteriol 169, 1987. Malikkides and Weiland (1982), Biotech. Bioeng. 24, 1911. Maniatis et al. (1982), MOLECULAR CLONING: А LABORATORY MANUAL. Maxam et al. (1980), Methods in Enzymology 65, 499. Messing et al. (1981), Nucleic Acids Res. 9, 309. Messing (1983), Methods in Enzymology 101, 20-37. METHODS IN ENZYMOLOGY (Academic Press, Inc.). Miller and Calos, eds. (1987), GENE TRANSFER VECTORS FOR MAMMALIAN CELLS (J.Н. Miller and М.P. Calos, eds., Cold Spring Harbor Laboratory). Nambair et al. (1984), Science 223, 1299 Pazur and Кlерре (1964), Biochem. 3, 578. Perbal (1984), А PRACTICAL GUIDE TO MOLECULAR CLONING. Poznansky et аl. (1980) in DRUG DELIVERY SYSTEMS (R.L. Juliano, ed., Oxford, N.Y. 1980). Poznansky et аl. (1984), Phar. Revs. 36, 277. Sanger et al. (1977), Proc. Natl. Acad. Sci. USA 74, 5463. Schreier et al. (1980), HYBRIDOMA TECHNIQUES. Scopes (1987), PROTEIN PURIFICATION, PRINCIPLES AND PRACTICE, 2nd edition (Springer-Verlag). Shimatake et al. (1981), Nature 292, 128. Taylor et аl. (1985), Nucl. Acids Res. 13, 8749. Travis et аl. (1985), J. Biol. Chem. 260, 4384-4389. Urdea et аl. (1983), Proc. Natl. Acad. Sci. USA 80, 7461. Warner (1984), DNA 3, 401. Wood et al. (1985), Proc. Natl. Acad. Sci. USA 82, 1585. Zoller (1982), Nucleic Acids Res. 10, 6487. Раскрытие изобретения Настоящее изобретение обеспечивает последовательность кДНК, кодирующую глюкозооксидазу /ГО/ из грибного источника из рода Aspergillus более конкретно из A. niger. Знание этой последовательности делает возможным экспрессию в рекомбинантных системах полипептидов, существенно сходных с ГО, включая ГО, аналоги ГО и фрагменты ГО. Что удивительно, относительно большие количества фермента продуцируются и секретируются дрожжевыми клетками, когда клетки трансформированы вектором экспрессии, кодирующим ГО и выращены при условиях, позволяющих экспрессию фермента. Секреция может быть под контролем либо дрожжевых секреторных последовательностей, либо препропоследовательности ГО, кодируемой в A. niger. Последовательность кДНК, обеспеченная здесь, также позволяет выделение последовательностей, кодирующих ГО, из других источников, которые также могут быть использованы для получения рекомбинантной ГО. Эти другие источники могут быть любого происхождения, в которых природно кодируется фермент, но должны быть преимущественно грибными источниками, в которых ГО-кодирующая последовательность содержит по крайней мере 8 пар оснований, предпочтительнее 20 пар оснований и даже более предпочтительно по крайней мере 40 пар оснований, которые сильно гомологичны /т.е. имеют максимум 1 нуклеотидную замену в комплементарных последовательностях/ с последовательностью на фиг. 5в. С другой стороны, ГО, выделенная из источника другого нежели A. nider, может иметь последовательность как минимум около 4 аминокислот, гомологичную последовательности ГО A. niger, кодируемой кДНК на фиг. 5в. Были исследованы полипептиды, экспрессированные в дрожжах, трансформированных векторами экспрессии, кодирующими кДНК ГО, и был получен удивительный результат, что продукты гипергликозилированы и что гипергликозилирование рекомбинантно полученных полипептидов мало влияет на ферментативную активность по сравнению с природной ГО, но что рекомбинантный продукт проявляет повышенную термостабильность. Другой удивительный результат заключается в том, что удаление углеводных остатков как рекомбинантно-полученной ГО, так и с нативной ГО, не ингибирует, по-видимому, ферметативную активность. Еще другой удивительный результат заключается в том, что хотя природная ГО присутствует в A. niger в относительно больших количествах, кодирующая ее мРНК относительно редка в клетках A. niger в течение фазы логарифмического роста. И еще удивительный результат заключается в том, что аналог ГО, т.е. мутеин, проявляет повышенную термостабильность по отношению к природной молекуле из A. niger и ее рекомбинантному аналогу, экспрессированному в дрожжах. Соответственно один аспект изобретения – вектор-рекомбинант, содержащий полинуклеотидную последовательность, кодирующую полипептид, существенно сходный с глюкозооксидазой /ГО/, существенно свободный от остальных векторов, не кодирующих ГО. Другой аспект изобретения – хозяйская клетка, трансформированная рекомбинантным полинуклеотидом с последовательностью, кодирующей полипептид, существенно сходный с ГО. И еще аспект изобретения – неприродный, существенно сходный с ГО. Изобретение включает способ получения рекомбинантного полипептида, существенно сходного с ГО, заключающийся в: а) получении популяции трансформированных клеток, содержащих рекомбинантный вектор, включающий кодирующую последовательность для полипептида, существенного сходного с ГО, операционно связанную с последовательностями, позволяющими экспрессию указанной кодирующей последовательности в указанных клетках; б) выращивании указанной популяции трансформированных клеток при условиях, когда указанный полипептид, существенно сходный с ГО, экспрессируется; в) выделении указанного полипептида, существенно сходного с ГО. Краткое описание чертежей Фиг. 1 демонстрирует аминокислотную последовательность природной ГО из A. niger. Фиг. 2 демонстрирует олигонуклеотидные пробы, полученные из аминокислотной последовательности природной ГО из A. niger для скрининга на последовательности, кодирующей ГО. Фиг. 3 демонстрирует 42-членные пробы long7 и long8 и их связь с пробой long6. Фиг. 4В демонстрирует последовательность кДНК ГО в клоне 4, полученную из нее аминокислотную последовательность и расположение сайтов рестрикции. Фиг. 5В показывает последовательность сложной кДНК, кодирующей ГО из A. niger, полученную из нее аминокислотную последовательность и расположение сайтов рестрикции. Фиг. 6 показывает идентичность фрагнетов нативной ГО из A. niger с последовательностями, полученными из сложной кДНК, показанной на фиг. 5В, и использование кодонов. Фиг. 7 показывает нуклеотидную последовательность 5’–района гена ГО из A. niger. Фиг. 8 показывает схему конструирования векторов экспрессии p.AB24AGSGO GO и pAB24AGАльфа GO. Фиг. 9 – карта существенных участков челночного вектора рАВ24. Фиг. 10 показывает полиакриламидный гель, в котором электрофоретически разделялись частично очищенная рекомбинантная ГО, когда ГО была обработана в присутствии и в отсутствие эндогликозидазы Н. Фиг. 11 – карта рSGO-2, показывающая некие существенные черты, включая сайты рестрикции. Фиг. 12 – карта pSGO-1, показывающая некоторые существенные черты, включая сайты рестрикции. Фиг. 13 – график, демонстрирующий термостабильность во времени полипептида ГО, экспрессированного в дрожжах с pAB24AGS6O в сравнении с природной ГО из A. niger. Фиг. 14 – график, показывающий термостабильность во времени мутеина, кодируемого C521S и экспрессированного в дрожжах в сравнении с природной ГО из A. niger. Фиг. 15 – рестриктная карта клона. Фиг. 16 показывает частичную нуклеотидную последовательность геномного сегмента P.amagasakiense в клоне pBRpGОxA11, также показаны аминокислоты и рестриктные сайты, кодируемые там. Фиг. 17 показывает сравнение аминокислот, кодируемых фрагментом, полученным из геномной вставки P.amagasakiense в pBRpGОХA11 с аминокислотной последовательностью ГО A. niger, кодируемой нуклеотидной последовательностью, показанной на фиг. 5В. Способы осуществления изобретения Определения 1. В описании настоящего изобретения будет использована следующая терминология в соответствии с определениями, представленными ниже. Как использовано здесь, термин “глюкозооксидаза” относится к полипептиду, который катализирует окисление глюкозы в глюконовую кислоту с сопутствующим образованием перекиси водорода. Способы определения активности глюкозооксидазы известны и включают, например, колориметрический анализ, в котором активность глюкозооксидазы сопряжена с системой пероксидаза-о-дианизидин. Этот тип системы анализа обсуждается в примере IV. Термин “рекомбинантный полинуклеотид”, как используется здесь, характеризует полинуклеотид, полезный для продукции ГО, означает полинуклеотид из источника: генома, кДНК, полусинтетического или синтетического, который благодаря источнику или манипуляциям: 1/ не ассоциирован совсем или частью полинуклеотида, с которым он ассоциирован в природе, и/или 2/ связан с другим полинуклеотидом нежели тот, с которым он связан в природе, или 3/ не существует в природе. Термин “полинуклеотид”, как используется здесь, относится к полимерной форме нуклеотидов любой длины как рибонуклеотидов, так и дезоксирибонуклеотидов. Этот термин относится только к первичной структуре молекулы. Следовательно, термин включает 2- и 1-нитевые ДНК, как и 2- и 1-нитевые РНК. Он также включает модифицированные, например, метилированием, фосфорилированием и /или кэппингом и немодифицированные формы полинуклеотидов. “Репликон” – любой генетический элемент, например плазмида, хромосома, вирус, который ведет себя как автономная единица полинуклеотидной репликации в клетке, т.е. способен к репликации под собственным контролем. “Вектор” – репликон, который встроен в другой полинуклеотидный сегмент так, чтобы сообщить внесенному сегменту способность к репликации и/или экспрессии. “Контрлирующая последовательность” относится к полинуклеотидным последовательностям, которые необходимы для влияния на экспрессию и/или секрецию кодирующей последовательности, к которой они подстроены. Природа таких контролирующих последовательностей различается в зависимости от хозяйского организма: у прокариот такие контролирующие последовательности в общем включают промотор, сайт связывания рибосомы и терминаторы; у эукариот, в общем, такие контролирующие последовательности включают промоторы, реминаторы и в некоторых случаях энхансеры. Кроме того, как у прокариот, так и эукариот лидерные последовательности контролируют серецию экспрессированного полипептида из хозяйской клетки. Термин “контролирующая последовательность” предназначен включать, как минимум, все компоненты, чье присутствие необходимо для экспрессии, и может также включать дополнительные компоненты, присутствие которых желательно, например лидерные последовательности. “Операционно связанные” – относится к соседству, где компоненты, описанные так, находятся во взаимодействии, позволяющем им функционировать в присущей им манере. Контролирующая последовательность, “операционно связанная” с кодирующей последовательностью, лигирована таким образом, что экспрессия кодирующей последовательности достигается при условии совместных с контролирующими последовательностями. “Открытая рамка считывания” – район полинуклеотидной последовательности, который кодирует полипептид; этот район может представлять собой часть кодирующей последовательности или всю кодирующую последовательность. “Кодирующая последовательность” – полинуклеотидная последовательность, транскрибируемая в мРНК и/или транслируемая в полипептид, будучи помещена под контроль подходящих регуляторных последовательностей. Границы кодирующей последовательности определены стартовым кодоном трансляции на 5-конце и стоп-кодоном трансляции на 3-конце. Кодирующая последовательность может включать мРНК, кДНК и рекомбинантные полинуклеотидные последовательности, но не ограничена ими. “Рекомбинантные хозяйские клетки”, “хозяйские клетки”, “клетки”, “линии клеток”, “культуры клеток” и другие термины, определяющие микроорганизмы или линии клеток высших эукариот, культивированные в одноклеточном виде, использованы взаимозаменяемо и относятся к клеткам, которые могут быть или были использованы как реципиенты для рекомбинантного вектора или других переносимых полинуклеотидов и включают потомство исходной клетки, которая была трансформирована. Понятно, что потомство единичной родительской клетки может не обязательно быть полностью идентично в морфологическом или геномном аспекте или в аспекте тотальной ДНК, исходному родителю из-за случайной или умышленной вызванной мутации. Потомство родительской клетки, которое существенно исходно с родителем, может быть характеризовано по оставшему свойству, такому как присутствие нуклеотидной последовательности, кодирующей желаемый пептид, включается в потомство, подразумеваемое этим определением, и перекрывается вышеперечисленными терминами. “Трасформация”, как использовано здесь, относится к введению экзогенного полинуклеотида в хозяйскую клетку безотносительно к способу, использованному для введения, например прямое введение, трансдукция, или f-спаривание. Экзогенный полинуклеотид может поддерживаться как неинтегрированный вектор, например плазмида, или альтернативно может быть интегрирован в хозяйский геном. Как использовано здесь, термин “полипептид” относится к аминокислотному продукту, имеющему последовательность, закодированную в геноме, и не относится к специфической длине продукта, т.е. пептиды, олигепептиды и белки включены в определение полипептида. Этот термин также не относится к постэкспрессионным модификациям полипептида, например гликозилированию, ацетилированию, фосфорилированию, сиалилированию и т.п. Термин “полипептид, существенно сходный с глюкозоксидазой или ГО”, относится к формам ГО неприродного происхождения, например, в отношении посттрансляционных модификаций, включая гликозилирование, фосфорилирование и т.п., но которые имеют ту же аминокислотную последовательность, что нативная ГО, аналоги ГО, фрагменты ГО, аналоги фрагментов ГО и слитные белки, где ГО, или аналог, или фрагмент слит с другим полипептидом, с которым он не слит обычно в природе. “Аналог ГО” или “фрагмент ГО” – тот, у которого гомология с нативной ГО или сравнимым фрагментом более примерно 70% в отношении аминокислотной последовательности и предпочтительно более примерно 80%. В этот термин также включены аналоги, в которых один или более природный аминокислотный остаток замещен веществом неприродного происхождения, которое известно, например аминокислотой неприродного происхождения, и т.д. Полипептиды, являющиеся аналогами или фрагментами ГО, могут быть или не быть “активными”. “Активный” полипептид – такой, который с подходящими кофакторами и субстратами катализируется реакцией, в номере катализируемую природным ферментом, выделенным из Aspergillus. “Неактивный” полипептид – такой, который утерял природную активность или у которого природная активность была существенно изменена в отношении образования продукта /тип или количество/, но который имеет по крайней мере указанную выше степень гомологии аминокислотной последовательности с природной ГО или со сравнимым фрагментом ГО. Способы определения форм и аналогов ГО неприродного происхождения известны. Формы и аналоги ГО неприродного происхождения могут быть детектированы, например, по изменениям в связывании с различными хромотографическими материалами и элюции с них и по их прохождению через электрофоретические гели. Кроме того, аналоги ГО могут быть детектированы, например, сравнением аминокислотных последовательностей. Один тип аналога ГО – полипептид, в котором один или более присутствующих в норме остаток цистеина заменен другой аминокислотой или делетирован; этот тип полипептида назван здесь “мутеин”. Способы получения мутеина известны. Как использовано здесь, термин “гипергликозилированная ГО” относится к ГО, которая содержит дополнительные остатки углеводов относительно количества углеводов, связанных с природной ГО. Методики определения того, содержит ли полипептид больше или меньше углеводов, известны и включают, например, ряд методик, следящих за разницей в молекулярном весе модифицированных полипептидов /например, электрофорез в полиакриламидном геле в присутствии ДДС-Na, как описано Лэммли/ и прохождение через колонки, содержащие материалы – молекулярные сита /например, Sephadex/, как и методики, основывающиеся на сродстве или потере сродства между углеводными группами и материалами, связывающими углеводы. “Полипептид дикого типа” – такой, который имеет аминокислотную последовательность, идннтичную последовательности, закодированной в геноме организма, который является источником кодируемой последовательности. “Природная ГО” и сходные термины относятся к ГО, выделенной из грибного источника, в котором она в норме продуцируется в природе с происходящего из природы генома. “Неприродный полипептид” относится к полипептиду, который продуцирован в хозяине, нежели такай, который продуцирован в природе. “Жесткие условия” гибридизации, как использовано здесь, это условия, которые позволяют не более 1-нуклеотидного нарушения спаривания двух комплементарных последовательностей. Условия гибридизации и отмывки различной степени жесткости известны экспериментаторам и обсуждаются, например, в Maniatis и др. /1982/. Как использовано здесь, “дрожжи” включают аскоспорогенные дрожжи /Endomycetales/, базидиоспорогенные дрожжи и дрожжи, принадлежащие к несовершенным грибам (Blastomycetes). Аскоспорогенные дрожжи подразделяются на два семейства, Spermophthraceal и Saccharomycetaceae. Последние представлены четырьмя подсемействами, Schizosaccharomycoideae /например, род Schizosaccharomycoideae/, Nadsonioideae, Lipomycoideae Saccharomycoideae /например, роды Pichia. Kluyverosnyces и Saccharomyces/. Базидиоспорогенные дрожжи включают роды Leucosporidium, Rhodosporidium, Sporidiobolus, Filobasidium и Filobasidiella. Дрожжи, принадлежащие к несовершенным грибам, подразделяются на два семейства, Sporobolomycetaceae /например, роды Sporobolomyces, Bullera (например, род Candida). Особенный интерес для данного изобретения представляют виды родов Pichia, Kluyveromyces, Saccharomyces, Schizosaccharomyces и Candida, конкретно интересны виды Saccharomyces S. cervisiae, S. carlsbergiensis, S. diastaticus, S. dougbasii, S. Kluyveri, S. norbensis и S. oviformis. Виды, представляющие особенный интерес в роде Kluyveromyces, включают K. lactis. Поскольку классификация дрожжей в будущем может меняться, для целей этого изобретения дрожжи будут определяться, как описано в BIOLOGY AND ACTIVITIES OF YEAST (F.A. Skinner, S.M. Passmore, R.R. Davenport eds. 1980) (Soc. App. Bacteriol Symp. Series №9/. В дополнение к предшествующему, те, кто достаточно опытен, преимущественно знакомы с биологией дрожжей и манипуляциями генетики дрожжей. См., например, BIOCHEMISTRY AND GENETICS OF YEAST (M. Bacila, B.L. Horecker, A.O.M. Steppany eds. 1978; THE YEAST (A.H. ROSE, J.S. Harrison eds. 2nd ed., 1987) и THE MOLECUZAR BIOLOGY OF THE YEAST SACCHAROMYCES (Strathern et al. eds.). Как использовано здесь, “грибы” включают классы Phycomycetes, Ascomycetes, Basidiomycetes и Deuteromycetes. Представительные группы Phycomycetes включают, например, Rhizopus, Mucor и водные плесени. Представительные группы Ascomycetes включают, например, Neurospora Penicillum Aspergillus (Aspergillus) и настоящие дрожжи, перечисленные выше. Примеры Basidiomycetes включают, например, грибы, ржавчины и головни. II. Описание изобретения Практическая часть настоящего изобретения использует, если не указано другое, общепринятые методики молекулярной биологии, микробиологии, рекомбинантной ДНК и энзимологии, которые приняты. Эти методики полностью объяснены в литературе. См., например, literature. See е.g., Maniatis, Fitsch & Sambrook, MOLECUIAR CLONING; А LABORATORY MANUAL (1982); DNA CLONING; VOLUMES I AND II (D.N. Glover ed. 1985); OLIGONUCLEOTIDE SYNTHESIS (M.J. Gait Ed. 1984); NUCLEIC ACID HYBRIDIZATION (B.D. Hames & S.J. Higgins eds. (1984); TRANSCRIPTION AND TRANSLATION (В.D. Hames & S.J. Higgins eds. 1984); ANIMAL CELL CULTURE (R.I Freshney ed. 1986); В. Perbal, А PRACTICAL GUIDE TO MOLECULAR CLONING (1984); the treatise, METHODS IN ENZYMOLOGY (Academic Press, Inc.) and particularly vols. 154 and 155 (Wu and Grossman, and Wu, eds., respectively); GENE TRANSFER VECTORS FOR MAMMALIAN CELLS (J.H. Miller and М.P. Calos eds., 1987, Cold Spring Harbor Laboratory); IMMUNOCHEMICAL METHODOS IN CELL AND MOLECULAR BIOLOGY (Academic Press, London), and Scopes, PROTEIN PURIFICATION; PRINCIPLES AND PRACTICE, 2nd edition (Springer Verlag, 1987). Все патенты, патентные приложения и публикации, упомянутые здесь как выше, так и ниже, включены здесь посредством ссылок. Неуклеотидная конструкция, кодирующая ГО, может быть использована в способах получения фермента рекомбинантными методами. ДНК, кодирующая ГО, более частно грибную ГО, еще более конкретно ГО из Aspergillus, еще более конкретно была выделена из библиотеки кДНК, созданной обратной транскрипцией поли /А+/ РНК, выделенной из A. niger в логарифмической фазе роста. Однако создание проб для скрининга библиотеки на последовательности, кодирующей ГО, было проблематично. Данные о как аминокислотной последовательности, так и нуклеотидной последовательности, которые кодируют грибной фермент, отсутствовали. Более того, неожиданно оказалось, что попытки секвенировать фермент, выделенный из A. niger, дали лишь последовательность первых 10 аминокислот природного полипептида, что сделало необходимым другой подход к конструированию последовательности, которые могли быть использованы для скрининга на ГО–кодирующие последовательности. Для конструирования проб, удобных для детектирования последовательностей кДНК, кодирующих ГО, в библиотеке олигопептидные фрагменты природного фермента из A. niger были очищены и аминокислотные последовательности определены. Основываясь на этих последовательностях, олигонуклеотидные пробы конструировали двумя способами. Пробы в 17-23 нуклеотида были получены из районов наименьшей вырожденности. Альтернативно уникальные более длинные пробы основывались на угадывании использования кодонов. Последовательности этих проб показаны на фиг. 2. Скрининг библиотеки кДНК A. niger в  gt 10 дал удивительные результаты. Во-первых, ни одна из коротких проб не была полезна для детектирования клонов, содержащих кДНК ГО. Кроме того, в то время как две 42-членные пробы могли быть использованы успешно для детектирования этих клонов, 72-членная проба, участками которой за исключением одного нуклеотида являлись 42-членные пробы, не были полезны для детектирования. 42-членные пробы, которые могут быть использованы для детектирования клонов, содержащих кДНК, показаны на фиг. 3.
С использованием 42-членных проб были получены клоны gt 10 дал удивительные результаты. Во-первых, ни одна из коротких проб не была полезна для детектирования клонов, содержащих кДНК ГО. Кроме того, в то время как две 42-членные пробы могли быть использованы успешно для детектирования этих клонов, 72-членная проба, участками которой за исключением одного нуклеотида являлись 42-членные пробы, не были полезны для детектирования. 42-членные пробы, которые могут быть использованы для детектирования клонов, содержащих кДНК, показаны на фиг. 3.
С использованием 42-членных проб были получены клоны  gt 10, которые содержали нуклеотидные последовательности, кодирующие полипептид ГО или их фрагменты; кДНК в этих клонах была субклонирована и секвенирована. Составная кДНК, составленная из 2 кДНК ГО, показана на фиг. 5В. Аминокислотная последовательность ГО была выведена из кодирующей ее нуклеотидной последовательности. Из последовательности может быть определено, что зрелый белок состоит из 583 аминокислот; аминокислотная последовательность содержит только 3 остатка цистеина и 8 консенсусов сайта гликозилирования. В аминокислотной последовательности есть препропоследовательность из 22 аминокислот с единственным основным сайтом расщепления у начала зрелой последовательности.
Рекомбинантный полинуклеотид, показанный на фиг. 5В, кодирует ГО из A. niger. Можно ожидать, однако, что ГО из других источников, конкретнее других грибных источников и более конкретно из других видов Aspergillus, содержит районы, которые гомологичны таковым ГО из A. niger. Районы гомологии могут быть определены сравнением аминокислотной последовательности ГО из другого источника с таковой ГО из A. niger; аминокислотная последовательность, полученная из последовательностей кДНК ГО, показана на фиг. 5В. Если аминокислотная последовательность всего полипептида не может быть определена, последовательности олигопептидных фрагментов могут быть сравнены с последовательностью ГО A. niger. Информация кодонового выбора источника также может быть сравнена; кодоновый выбор A. niger представлен на фиг. 6. Таким образом, пробы могут быть получены из последовательности на фиг. 5В и полезны в скрининге библиотек кДНК или геномных библиотек из других детектирования ГО–кодирующих последовательностей из этих источников. Параметры создания проб известны экспериментаторам, и некоторые обеспечены в примерах. Обычно пробы содержат как минимум 8 оснований, более предпочтительно как минимум 20 оснований и еще более предпочтительно как минимум 40 оснований, которые идентичны последовательности в последовательности кДНК на фиг. 5В. Идентичность может быть как кодирующей, так и с некодирующей нитью кДНК. Эти пробы будут гибридизоваться в жестких условиях с подходящей цепью дуплекса ДНК, содержащей ГО-кодирующую последовательность и которые должны быть выделены. Жесткие условия гибридизации известны и обсуждаются, например, в Maniatis и др. /1982/ и в Methods in Ensymology. ГО–кодирующие последовательности, которые были детектированы пробой/ами/, могут затем быть клонированы и выделены с использованием методик, которые общеизвестны. См., например, Maniatis (1982), B.Perbal (1984) и Glover ed. (1985).
Выделение последовательности, кодирующей часть ГО из Penicillum, более конкретно P.amagasakiense, описано в примерах. Выделение было проведено с использованием пробы, полученной из кДНК ГО, содержавшейся в рекомбинантном векторе, описанном здесь. С использованием фрагмента, кодирующего ГО Penicillum, для получения проб возможно получить целую последовательность полинуклеотида, кодирующего этот грибной фермент из библиотеки кДНК или геномных, созданных из источника Penicillum.
Хотя способ получения конструкции ДНК, кодирующей ГО A. niger, базирующийся на создании библиотеки кДНК, описан здесь, в настоящем изобретении получение таких конструкций не ограничено этим методом. С использованием информации о последовательности, обеспеченной здесь, могут быть выдвинуты другие методы получения полинуклеотидных конструкций, кодирующих ГО. Например, нуклеотидная последовательность, кодирующая ГО, может быть синтезирована с использованием автоматического синтеза ДНК. См., например, Edge (1981), Nambair и др. (1984) и Jay и др. (1984). С другой стороны, могут быть синтезированы олигонуклеотиды, содержащие часть информации о последовательности; они затем могут быть использованы как пробы для скринирования библиотек геномной ДНК и библиотек кДНК. Основные стратегии получения олигонуклеотидных проб и библиоте ДНК, как и их скрининг гибридизацией нуклеиновых кислот, общеизвестны. См., например, Glover D.P. ed. (1985), B.D. Hames and S.J. Higgins eds. (1985), M.J. Gate ed (1984), Maniatis и др. (1982) и B. Perbal (1984).
После того, как последовательность, кодирующая ГО, получена или выделена, она может быть клонирована в любой удобный репликон для создания вектора, и т.о. поддерживаться в состоянии, существенно свободном от векторов, которые не содержат ген ГО /например, других клонов, происходящих из библиотеки/. Множество векторов клонирования общеизвестно, и отбор подходящего вектора – дело выбора. Примеры векторов, удобных для клонирования рекомбинантной ДНК, и хозяйских клеток, которые они могут трансформировать, включают бактериофаг (E. coli); pBR 322 (E. coli); pACYC177 (E. coli); pKT230, gt 10, которые содержали нуклеотидные последовательности, кодирующие полипептид ГО или их фрагменты; кДНК в этих клонах была субклонирована и секвенирована. Составная кДНК, составленная из 2 кДНК ГО, показана на фиг. 5В. Аминокислотная последовательность ГО была выведена из кодирующей ее нуклеотидной последовательности. Из последовательности может быть определено, что зрелый белок состоит из 583 аминокислот; аминокислотная последовательность содержит только 3 остатка цистеина и 8 консенсусов сайта гликозилирования. В аминокислотной последовательности есть препропоследовательность из 22 аминокислот с единственным основным сайтом расщепления у начала зрелой последовательности.
Рекомбинантный полинуклеотид, показанный на фиг. 5В, кодирует ГО из A. niger. Можно ожидать, однако, что ГО из других источников, конкретнее других грибных источников и более конкретно из других видов Aspergillus, содержит районы, которые гомологичны таковым ГО из A. niger. Районы гомологии могут быть определены сравнением аминокислотной последовательности ГО из другого источника с таковой ГО из A. niger; аминокислотная последовательность, полученная из последовательностей кДНК ГО, показана на фиг. 5В. Если аминокислотная последовательность всего полипептида не может быть определена, последовательности олигопептидных фрагментов могут быть сравнены с последовательностью ГО A. niger. Информация кодонового выбора источника также может быть сравнена; кодоновый выбор A. niger представлен на фиг. 6. Таким образом, пробы могут быть получены из последовательности на фиг. 5В и полезны в скрининге библиотек кДНК или геномных библиотек из других детектирования ГО–кодирующих последовательностей из этих источников. Параметры создания проб известны экспериментаторам, и некоторые обеспечены в примерах. Обычно пробы содержат как минимум 8 оснований, более предпочтительно как минимум 20 оснований и еще более предпочтительно как минимум 40 оснований, которые идентичны последовательности в последовательности кДНК на фиг. 5В. Идентичность может быть как кодирующей, так и с некодирующей нитью кДНК. Эти пробы будут гибридизоваться в жестких условиях с подходящей цепью дуплекса ДНК, содержащей ГО-кодирующую последовательность и которые должны быть выделены. Жесткие условия гибридизации известны и обсуждаются, например, в Maniatis и др. /1982/ и в Methods in Ensymology. ГО–кодирующие последовательности, которые были детектированы пробой/ами/, могут затем быть клонированы и выделены с использованием методик, которые общеизвестны. См., например, Maniatis (1982), B.Perbal (1984) и Glover ed. (1985).
Выделение последовательности, кодирующей часть ГО из Penicillum, более конкретно P.amagasakiense, описано в примерах. Выделение было проведено с использованием пробы, полученной из кДНК ГО, содержавшейся в рекомбинантном векторе, описанном здесь. С использованием фрагмента, кодирующего ГО Penicillum, для получения проб возможно получить целую последовательность полинуклеотида, кодирующего этот грибной фермент из библиотеки кДНК или геномных, созданных из источника Penicillum.
Хотя способ получения конструкции ДНК, кодирующей ГО A. niger, базирующийся на создании библиотеки кДНК, описан здесь, в настоящем изобретении получение таких конструкций не ограничено этим методом. С использованием информации о последовательности, обеспеченной здесь, могут быть выдвинуты другие методы получения полинуклеотидных конструкций, кодирующих ГО. Например, нуклеотидная последовательность, кодирующая ГО, может быть синтезирована с использованием автоматического синтеза ДНК. См., например, Edge (1981), Nambair и др. (1984) и Jay и др. (1984). С другой стороны, могут быть синтезированы олигонуклеотиды, содержащие часть информации о последовательности; они затем могут быть использованы как пробы для скринирования библиотек геномной ДНК и библиотек кДНК. Основные стратегии получения олигонуклеотидных проб и библиоте ДНК, как и их скрининг гибридизацией нуклеиновых кислот, общеизвестны. См., например, Glover D.P. ed. (1985), B.D. Hames and S.J. Higgins eds. (1985), M.J. Gate ed (1984), Maniatis и др. (1982) и B. Perbal (1984).
После того, как последовательность, кодирующая ГО, получена или выделена, она может быть клонирована в любой удобный репликон для создания вектора, и т.о. поддерживаться в состоянии, существенно свободном от векторов, которые не содержат ген ГО /например, других клонов, происходящих из библиотеки/. Множество векторов клонирования общеизвестно, и отбор подходящего вектора – дело выбора. Примеры векторов, удобных для клонирования рекомбинантной ДНК, и хозяйских клеток, которые они могут трансформировать, включают бактериофаг (E. coli); pBR 322 (E. coli); pACYC177 (E. coli); pKT230,  pGV1106 грамотрицательные бактерии/; рМЕ290 /грамотрицательные бактерии, не E. coli /; pHV14 /E. coli и B.subtilis/; pBD9 (Bacillus); pIJ61 (Streptomyces); YIp5 (Saccharomyces); YCp19 (Saccharomyces) и вирус папилломы быка /клетки млекопитающих/. См., в основном, Т. Maniatis и др. (1982), B. Perbal (1984) и Glover, ed. (1985).
Полинуклеотидная последовательность, кодирующая ГО, экспрессирована вставлением последовательности в подходящий репликон, что создает вектор экспрессии, транформатцией подходящих хозяйских клеток образовавшимся вектором экспрессии и выращиванием хозяйских клеток при условиях, которые позволяют рост и экспрессию.
При создании вектора экспрессии ГО-кодирующая последовательность помещена в вектор так, что она операционно связана с подходящими последовательностями для экспрессии и, возможно, для секреции. Как минимум, контролирующие последовательности включают промотор и транскрипционный и трансляционный стоп-кодон. Расположение и ориентация кодирующей последовательности по отношению к контролирующим последовательностям таково, что кодирующая последовательность транскрибируется под “контролем” контролирующих последовательностей: т.е. промотор контролирует транскрипцию мРНК с кодирующей последовательностью, и стоп-кодон, использованный для терминации трансляции, расположен ранее по ходу транскрипции, чем кодон терминации транскрипции.
Дополнительно к контролирующим последовательностям может быть желательно добавление регуляторных последовательностей, которые позволяют регуляцию экспрессии ГО относительно роста хозяйстких клеток. Это особенно верно, когда ГО экспрессируется в клетках, растущих в среде, содержащей глюкозу, поскольку перекись водорода, образуемая ГО, может быть токсична для клетки. Примеры регуляторных систем – те, которые вызывают включение или выключение экспрессии гена в ответ на химическое или физическое воздействие, включая присутствие регуляторного соединения. В прокариотические системы включены системы операторов lac и trp. У дрожжей они могут включать, например, систему ADH2. В примерах экспрессия ГО в S. cerevisiae находится под регуляцией гибридного промотора ADH2/GAP. Другой пример регуляторных последовательной – те, которые позволяют амплификацию генов. В эукариотических системах они включают ген дигидрофолатредуктазы, который амплифицируется в присутствии метотрексата, и металлотионеиновые гены, которые амплифицируются в присутствии тяжелых металлов. В этих случаях последовательность, кодирующая ГО, должна быть помещена тандемно с регуляторным элементом.
Другие типы регуляторных элементов также могут присутствовать в векторе, например те, которые не обязательно должны быть расположены тандемно с последовательностью, кодирующей ГО. Энхансерные последовательности, например последовательность энхансера SV40 – этого типа. Энхансерная последовательность одним своим присутствием вызывает усиление экспрессии генов на расстоянии от них.
Модификация последовательности, кодирующей ГО, до или после ее вставления в репликон может быть желательна или необходима в зависимости от выбора системы экспрессии. Например, в некоторых случаях может быть необходимо модифицировать последовательность так, чтобы она имела подходящее расположение, будучи присоединенной к контролирующим последовательностям. В некоторых случаях может быть желательно добавить или изменить последовательности, которые вызывают секрецию полипептида из хозяйского организма, с последующим отщеплением секреторного сигнала. В примерах вектора экспрессии, которые были созданы, имели либо природную препропоследовательность ГО А. niger, или же в них в качестве секреторного сигнала использовался pGV1106 грамотрицательные бактерии/; рМЕ290 /грамотрицательные бактерии, не E. coli /; pHV14 /E. coli и B.subtilis/; pBD9 (Bacillus); pIJ61 (Streptomyces); YIp5 (Saccharomyces); YCp19 (Saccharomyces) и вирус папилломы быка /клетки млекопитающих/. См., в основном, Т. Maniatis и др. (1982), B. Perbal (1984) и Glover, ed. (1985).
Полинуклеотидная последовательность, кодирующая ГО, экспрессирована вставлением последовательности в подходящий репликон, что создает вектор экспрессии, транформатцией подходящих хозяйских клеток образовавшимся вектором экспрессии и выращиванием хозяйских клеток при условиях, которые позволяют рост и экспрессию.
При создании вектора экспрессии ГО-кодирующая последовательность помещена в вектор так, что она операционно связана с подходящими последовательностями для экспрессии и, возможно, для секреции. Как минимум, контролирующие последовательности включают промотор и транскрипционный и трансляционный стоп-кодон. Расположение и ориентация кодирующей последовательности по отношению к контролирующим последовательностям таково, что кодирующая последовательность транскрибируется под “контролем” контролирующих последовательностей: т.е. промотор контролирует транскрипцию мРНК с кодирующей последовательностью, и стоп-кодон, использованный для терминации трансляции, расположен ранее по ходу транскрипции, чем кодон терминации транскрипции.
Дополнительно к контролирующим последовательностям может быть желательно добавление регуляторных последовательностей, которые позволяют регуляцию экспрессии ГО относительно роста хозяйстких клеток. Это особенно верно, когда ГО экспрессируется в клетках, растущих в среде, содержащей глюкозу, поскольку перекись водорода, образуемая ГО, может быть токсична для клетки. Примеры регуляторных систем – те, которые вызывают включение или выключение экспрессии гена в ответ на химическое или физическое воздействие, включая присутствие регуляторного соединения. В прокариотические системы включены системы операторов lac и trp. У дрожжей они могут включать, например, систему ADH2. В примерах экспрессия ГО в S. cerevisiae находится под регуляцией гибридного промотора ADH2/GAP. Другой пример регуляторных последовательной – те, которые позволяют амплификацию генов. В эукариотических системах они включают ген дигидрофолатредуктазы, который амплифицируется в присутствии метотрексата, и металлотионеиновые гены, которые амплифицируются в присутствии тяжелых металлов. В этих случаях последовательность, кодирующая ГО, должна быть помещена тандемно с регуляторным элементом.
Другие типы регуляторных элементов также могут присутствовать в векторе, например те, которые не обязательно должны быть расположены тандемно с последовательностью, кодирующей ГО. Энхансерные последовательности, например последовательность энхансера SV40 – этого типа. Энхансерная последовательность одним своим присутствием вызывает усиление экспрессии генов на расстоянии от них.
Модификация последовательности, кодирующей ГО, до или после ее вставления в репликон может быть желательна или необходима в зависимости от выбора системы экспрессии. Например, в некоторых случаях может быть необходимо модифицировать последовательность так, чтобы она имела подходящее расположение, будучи присоединенной к контролирующим последовательностям. В некоторых случаях может быть желательно добавить или изменить последовательности, которые вызывают секрецию полипептида из хозяйского организма, с последующим отщеплением секреторного сигнала. В примерах вектора экспрессии, которые были созданы, имели либо природную препропоследовательность ГО А. niger, или же в них в качестве секреторного сигнала использовался  -фактор из дрожжей. Кроме того, в некоторых случаях может быть желательно удалить интроны из последовательностей, выделенных из геномных библиотек, чтобы сделать возможной экспрессию в системах, например прокариотических системах, которые не способны к эксцизии последовательности интронов или которые не позволяют экспрессию кодирующих последовательностей, содержащих интроны. Пример последней обсуждается в Innis и др. /1985/. Способы модификации нуклеотидных последовательностей с использованием клонирования общеизвестны. Они включают, например, использование рестриктаз или таких ферментов, как Bal31 для удаления лишних нуклеотидов, и химически синтезированных олигонуклеотидов для использования в качестве адапторов для замещения утеренных нуклеотидов и в сайт направленное мутагенезе. См., например, Maniatis и др. (1982), Glover, ed. (1985) и Hames and Higgins, eds. (1984).
Модификация последовательности, кодирующей ГО, может также быть необходима для синтеза полипептидов, существенно сходных с ГО. Эти полипептиды отличаются некоторым искусственным образом от фермента, выделенного из природного источника. Например, если желаемый продукт – фрагмент ГО, последовательность, кодирующая фермент, модифицируется для удаления нежелательных последовательностей, соответствующих делетируемым аминокислотам. Если желаемый продукт – активный фрагмент ГО, делетированные последовательности скорее всего будут в районах N- и C-конца.
С другой стороны, полипептиды, существенно сходные с ГО, могут быть синтезированы экспрессией природного гена в хозяине, который вызывает модификацию в процессинге и/или фолдинге полипептида. В примерах показано, что экспрессия рекомбинантной последовательности, кодирующей ГО A. niger в дрожжах, приводит к гипергликозилированным классам, которые сохраняют активность. Удивительно, однако, что эксперссированный в дрожжах, полипептид имеет большую термостабильность, чем природный фермент, что может увеличить его полезность в коммерческих процессах.
Может также быть интересно синтезировать аналоги ГО. Эти аналоги могут, например, отличаться по специфической активности, и/или простоте экспрессии, и/или простоте секреции, и/или простоте очистки. Известно, например, что сильно гликозилированные полипептиды часто трудно очищать. Данные в примерах содержат удивительный результат, что удаление углеводных остатков с ГО, полученной из А. niger, не нарушает ферментативную активность полипептида. Таким образом, может быть желательно варьировать, например, число сайтов гликозилирования. Кроме того, остатки Цис могут быть мутированы для изменения фолдинга рекомбинантного и/или модифицированного полипептида или для изменения других свойств с целью получения белка с повышенной коммерческой полезностью. Например, в разделе IV, I показано, что замещение серина на цистеин в положении 521 увеличивает термостабильность экспрессированной в дрожжах рекомбинантной ГО из А. niger.
В приведенных здесь примерах описаны рекомбинантно-полученные аналоги ГО дикого типа, проявляющие ферментативную активность ГО.
Может также представлять интерес синтез аналогов фрагментов ГО. Такие аналоги, которые могут включать неактивные аналоги, могут быть полезны, например, в получении антител на ГО.
Может также быть интересным синтез аналогов или фрагментов ГО, которые различаются по гидрофобности, делая возможным большее или меньшее взаимодействие с мембранами или с липосомами. Это может быть сделано замещением гидрофобных аминокислот на гидрофильные в некоторых из наружных доменов полипептида и наоборот. Такие изменения гидрофобности совершаются модификацией последовательностей, кодирующих специфические аминокислоты, которые должны быть замещены.
В случаях, когда ГО должна быть использована для получения пищевых продуктов, может быть желательно удаление иммуногенных районов полипептида, которые дают аллергические реакции, конкретно у людей. Методы тестирования на аллергенность общеизвестны.
Полипептиды, которые существенно сходны с ГО или ее фрагментами, но которые содержат изменения в активном центре, также могут быть синтезированы. В этом случае последовательность, кодирующая фермент, должна быть модифицирована так, чтобы кодоны, кодирующие аминокислоты активного центра, были заменены или делетированы.
Полипептиды, которые существенно сходны с ГО или ее фрагментами, включают также полипептиды, которых часть или вся последованость ГО слита с последовательностью, кодирующей другой полипептид. Слияние может происходить как на N-, так и на С-конце полипептида или фрагмента ГО. Способы создания слитных белков общеизвестны и включают, например, лигирование открытых рамок считывания, кодирующих полипептиды так, что они находятся в рамке, и так, что экспрессия слитного полипептида находится под регуляцией единственного промотора и терминатора. Слияние может также быть создано химической обработкой постэкспрессионных полипептидов. Химические методы слияния /или связывания/ полипептидов известны, см. например, Methods in Ensymology.
Выше приведены примеры того, как ГО может быть модифицирована модификацией последовательности, кодирующей ГО. Эти примеры не являются исчерпывающими, и опытный экспериментатор может с легкостью определить другие модификации, которые будут полезны. Все эти модификации могут быть выполнены с использованием методик и ссылок, цитированных выше и ниже, включая модификацию нуклеотидных последовательностей.
Последовательность, кодирующая полипептид, существенно сходный с ГО, включая ГО дикого типа, может быть лигирована с контролирующими последовательностями для образования кассеты экспрессии до вставления в репликон, формирующего вектор экспрессии. С другой стороны, кодирующая последовательность может быть клонирована прямо в векторе экспрессии, который уже содержит контролирующие последовательности и подходящий сайт рестрикции.
Контролирующие последовательности в векторе выбираются так, что они совместимы с трансформированным хозяином для разрешения экспрессии и/или секреции молекулы. Эти контролирующие последовательности могут быть из смешанных источников. К примеру, в одном из примеров, описанных ниже, экспрессия ГО А. niger в S. cerevisiae была под контролем полностью гетерологичных последовательностей, т.е. регулируемого дрожжами дрожжевого промотора, ADH 2/GAP, дрожжевого -фактор из дрожжей. Кроме того, в некоторых случаях может быть желательно удалить интроны из последовательностей, выделенных из геномных библиотек, чтобы сделать возможной экспрессию в системах, например прокариотических системах, которые не способны к эксцизии последовательности интронов или которые не позволяют экспрессию кодирующих последовательностей, содержащих интроны. Пример последней обсуждается в Innis и др. /1985/. Способы модификации нуклеотидных последовательностей с использованием клонирования общеизвестны. Они включают, например, использование рестриктаз или таких ферментов, как Bal31 для удаления лишних нуклеотидов, и химически синтезированных олигонуклеотидов для использования в качестве адапторов для замещения утеренных нуклеотидов и в сайт направленное мутагенезе. См., например, Maniatis и др. (1982), Glover, ed. (1985) и Hames and Higgins, eds. (1984).
Модификация последовательности, кодирующей ГО, может также быть необходима для синтеза полипептидов, существенно сходных с ГО. Эти полипептиды отличаются некоторым искусственным образом от фермента, выделенного из природного источника. Например, если желаемый продукт – фрагмент ГО, последовательность, кодирующая фермент, модифицируется для удаления нежелательных последовательностей, соответствующих делетируемым аминокислотам. Если желаемый продукт – активный фрагмент ГО, делетированные последовательности скорее всего будут в районах N- и C-конца.
С другой стороны, полипептиды, существенно сходные с ГО, могут быть синтезированы экспрессией природного гена в хозяине, который вызывает модификацию в процессинге и/или фолдинге полипептида. В примерах показано, что экспрессия рекомбинантной последовательности, кодирующей ГО A. niger в дрожжах, приводит к гипергликозилированным классам, которые сохраняют активность. Удивительно, однако, что эксперссированный в дрожжах, полипептид имеет большую термостабильность, чем природный фермент, что может увеличить его полезность в коммерческих процессах.
Может также быть интересно синтезировать аналоги ГО. Эти аналоги могут, например, отличаться по специфической активности, и/или простоте экспрессии, и/или простоте секреции, и/или простоте очистки. Известно, например, что сильно гликозилированные полипептиды часто трудно очищать. Данные в примерах содержат удивительный результат, что удаление углеводных остатков с ГО, полученной из А. niger, не нарушает ферментативную активность полипептида. Таким образом, может быть желательно варьировать, например, число сайтов гликозилирования. Кроме того, остатки Цис могут быть мутированы для изменения фолдинга рекомбинантного и/или модифицированного полипептида или для изменения других свойств с целью получения белка с повышенной коммерческой полезностью. Например, в разделе IV, I показано, что замещение серина на цистеин в положении 521 увеличивает термостабильность экспрессированной в дрожжах рекомбинантной ГО из А. niger.
В приведенных здесь примерах описаны рекомбинантно-полученные аналоги ГО дикого типа, проявляющие ферментативную активность ГО.
Может также представлять интерес синтез аналогов фрагментов ГО. Такие аналоги, которые могут включать неактивные аналоги, могут быть полезны, например, в получении антител на ГО.
Может также быть интересным синтез аналогов или фрагментов ГО, которые различаются по гидрофобности, делая возможным большее или меньшее взаимодействие с мембранами или с липосомами. Это может быть сделано замещением гидрофобных аминокислот на гидрофильные в некоторых из наружных доменов полипептида и наоборот. Такие изменения гидрофобности совершаются модификацией последовательностей, кодирующих специфические аминокислоты, которые должны быть замещены.
В случаях, когда ГО должна быть использована для получения пищевых продуктов, может быть желательно удаление иммуногенных районов полипептида, которые дают аллергические реакции, конкретно у людей. Методы тестирования на аллергенность общеизвестны.
Полипептиды, которые существенно сходны с ГО или ее фрагментами, но которые содержат изменения в активном центре, также могут быть синтезированы. В этом случае последовательность, кодирующая фермент, должна быть модифицирована так, чтобы кодоны, кодирующие аминокислоты активного центра, были заменены или делетированы.
Полипептиды, которые существенно сходны с ГО или ее фрагментами, включают также полипептиды, которых часть или вся последованость ГО слита с последовательностью, кодирующей другой полипептид. Слияние может происходить как на N-, так и на С-конце полипептида или фрагмента ГО. Способы создания слитных белков общеизвестны и включают, например, лигирование открытых рамок считывания, кодирующих полипептиды так, что они находятся в рамке, и так, что экспрессия слитного полипептида находится под регуляцией единственного промотора и терминатора. Слияние может также быть создано химической обработкой постэкспрессионных полипептидов. Химические методы слияния /или связывания/ полипептидов известны, см. например, Methods in Ensymology.
Выше приведены примеры того, как ГО может быть модифицирована модификацией последовательности, кодирующей ГО. Эти примеры не являются исчерпывающими, и опытный экспериментатор может с легкостью определить другие модификации, которые будут полезны. Все эти модификации могут быть выполнены с использованием методик и ссылок, цитированных выше и ниже, включая модификацию нуклеотидных последовательностей.
Последовательность, кодирующая полипептид, существенно сходный с ГО, включая ГО дикого типа, может быть лигирована с контролирующими последовательностями для образования кассеты экспрессии до вставления в репликон, формирующего вектор экспрессии. С другой стороны, кодирующая последовательность может быть клонирована прямо в векторе экспрессии, который уже содержит контролирующие последовательности и подходящий сайт рестрикции.
Контролирующие последовательности в векторе выбираются так, что они совместимы с трансформированным хозяином для разрешения экспрессии и/или секреции молекулы. Эти контролирующие последовательности могут быть из смешанных источников. К примеру, в одном из примеров, описанных ниже, экспрессия ГО А. niger в S. cerevisiae была под контролем полностью гетерологичных последовательностей, т.е. регулируемого дрожжами дрожжевого промотора, ADH 2/GAP, дрожжевого  -фактора для секреции и дрожжевого терминатора. В другом примере контроли были лишь частично гетерологичными, т.е. секреция регулировалась препропоследовательностью из А. niger в то время, как остальная экспрессия контролировалась дрожжевыми последовательностями. В случаях, когда ГО экспрессирована в прокариотических системах, кодирующая фермент последовательность должна быть свободна от интронов.
Ряд репликонов, которые могут быть использованы для конструирования прокариотических векторов экспрессии, общеизвестны. См., например, патент США №4440859; 4436815, 4431740, 4431739, 4428941, 4425437, 4418149, 4422994, 4366246 и 4342832. Репликоны, которые могут быть использованы для конструирования дрожжевых векторов экспрессии, также известны. См., например, патенты США №№4446235, 4443539, 4430428. Примеры, описанные здесь. Пример, который может быть использован для конструирования вектора экспрессии для хозяйских клеток млекопитающих, описан в распространенном U.SS.N 921730, раскрытие которого включено здесь ссылкой.
Предпочтенные системы экспрессии рекомбинантной ГО – в дрожжах, предпочтительно S. cerevisiae.
Как описано в примерах ниже, эта система экспрессируется в относительно высокие уровни ГО, а именно, когда последовательность, кодирующая фермент А. niger дикого типа, находится под контролем дрожжевого ADH2/GAP промотора, дрожжевого -фактора для секреции и дрожжевого терминатора. В другом примере контроли были лишь частично гетерологичными, т.е. секреция регулировалась препропоследовательностью из А. niger в то время, как остальная экспрессия контролировалась дрожжевыми последовательностями. В случаях, когда ГО экспрессирована в прокариотических системах, кодирующая фермент последовательность должна быть свободна от интронов.
Ряд репликонов, которые могут быть использованы для конструирования прокариотических векторов экспрессии, общеизвестны. См., например, патент США №4440859; 4436815, 4431740, 4431739, 4428941, 4425437, 4418149, 4422994, 4366246 и 4342832. Репликоны, которые могут быть использованы для конструирования дрожжевых векторов экспрессии, также известны. См., например, патенты США №№4446235, 4443539, 4430428. Примеры, описанные здесь. Пример, который может быть использован для конструирования вектора экспрессии для хозяйских клеток млекопитающих, описан в распространенном U.SS.N 921730, раскрытие которого включено здесь ссылкой.
Предпочтенные системы экспрессии рекомбинантной ГО – в дрожжах, предпочтительно S. cerevisiae.
Как описано в примерах ниже, эта система экспрессируется в относительно высокие уровни ГО, а именно, когда последовательность, кодирующая фермент А. niger дикого типа, находится под контролем дрожжевого ADH2/GAP промотора, дрожжевого  -фактора и дрожжевого терминатора GAP.
В зависимости от выбора системы экспрессии и хозяина полипептид, существенно сходный с ГО, включая ГО, или аналог ГО, или фрагмент ГО, продуцируется растущими хозяйскими клетками, трансформированными описанным выше вектором экспрессии в условиях, когда полипептид экспрессируется. Синтезированный полипептид затем выделяют из хозяйской клетки и очищают. Если система экспрессии секретирует фермент в среде роста, белок может быть очищен прямо из среды. Если рекомбинантный полипептид не секретируется, его выделяют из клеточных лизатов. Выбор подходящих условий роста и способов получения – дело опыта.
Выделение свежесинтезированного полипептида зависит от системы анализа, с использованием которой полипептид детектируется. Эти системы анализа очевидны опытному экспериментатору. Например, если свежесинтезированный полипептид проявляет ферментативную активность ГО, полипептид может быть детектирован анализом на энзиматическую активность. Анализы на энзиматическую активность ГО описаны ниже в примерах.
Также возможно детектировать свежесинтезированный полипептид иммуноанализом с использованием антител к полипептидам, существенно сходным с ГО, включая ГО. В этом случае тип использованных в анализе антител будет отражать ожидаемое присутствие или отсутствие известных специфических эпитопов. Методы иммуноанализа общеизвестны и поликлональные антитела к ГО из A. niger коммерчески доступны.
Экспрессированный полипептид может быть выделен и очищен до степени, необходимой для его применения. Очистка может осуществляться общеизвестными способами, например фракционирование солью, хромотаграфия на ионообменных смолах, аффинная хроматография, центрифугирование и т.п. См., например, Methods in Ensymology и Scopes (1987), где есть ряд способов очистки белков.
В общем рекомбинантная продукция ГО может обеспечить существенное количество соединений этого фермента, существенно свободных от загрязняющих белков, т.е. минимум 90% чистоты. Возможность получения существенных количеств полипептида высокой чистоты – результат рекомбинантных систем экспрессии, которые позволяют секрецию в среде рекомбинантно произведенного полипептида. Таким образом, с применением современных методик рекомбинантных культур составы ГО существенной чистоты и количества доступны.
Надо отметить, что с данными о последовательности настоящего изобретения получения ГО не ограничено рекомбинантными методами. Она может также быть синтезирована химическими методами, например твердофазным пептидным синтезом. Такие методы общеизвестны.
Рекомбинантные полипептиды, существенно сходные с ГО, включая ГО, могут быть использованы для получения антител как поликлональных, так и моноклональных. Если желательны поликлональные антитела, выбранные млекопитающие /например, мышь, кролик, козел, лошадь и т.д./ иммунизируют очищенной ГО или ее фрагментом, или ее аналогом, или фрагментом ее аналога. Сыворотка из иммунозированного млекопитающего собирается и обрабатывается в соответствии с известными методами. Если сыворотка, содержащая поликлональные антитела к ГО, содержит антитела к другим антигенам, поликлональные антитела ГО могут быть очищены иммуноаффинно.
Моноклональные антитела к ГО также могут быть с легкостью получены опытным экспериментатором. Общая методология получения моноклональных антител гибридомами хорошо известна. См., например, Schreier и др (1980), Hammerling и др. (1981), Kennet и др. (1980). Наборы моноклональных антител, полученных против ГО, могут быть скринированы на различные свойства; т.е. на изотип, эпитоп, аффинность и т.д. Моноклональные антитела, направленные против специфических эпитопов, полезны в определении взаимодействий ГО. Кроме того, моноклональные антитела полезны в очистке природной или рекомбинантно-полученнной ГО с использованием иммуноаффинных методов.
Если ГО полипептиды, существенно сходные с ГО, используются терапевтически, может быть желательно привязать полипептидную молекулу к эффективной системе для доставки ГО в подходящее место, которая также защищала бы полипептид от протеолиза, и в то же время вызывала контролированную доставку полипептида. Системы для доставки молекул общеизвестны и описаны, например, в Poznansky и др. /1980/. Системы доставки лекарств могут включать, например, липосомы или антитела против специфических клеток-мишеней.
III. Общие методы
Общие методики, использованные для выделения полинуклеотидов из клеток источника, получения и анализа кДНК-овых и/или геномных библиотек, секвенирования клонов, конструирования векторов экспрессии, трансформации клеток, и подобные общеизвестные, и лабораторные руководства, описывающие эти методики, доступны. Однако в качестве общего руководства следующие группы из некоторых источников доступны в настоящее время для таких процедур и материалов, полезных в проведении их.
III.А.
Хозяева и последовательности, контролирующие экспрессию
Для экспрессии желаемой кодирующей последовательности могут быть использованы как прокариотические, так и эукариотические хозяйские кдетки, когда используются подходящие контролирующие последовательности, совместимые с обозначенным хозяином. Среди прокариотических хозяев наиболее часто используется E. coli. Последовательности, контролирующие экспрессию у прокариот, включают промоторы, возможно содержание операторные части, и сайты связывания рибосомы. Вектора переноса, совместимые с прокариотическими хозяевами, в общем, получены из, например, рBR322, плазмиды, содержащей опероны ампициллин- и тетракциклик-резистентности и различных р С-плазмид, которые также содержат последовательности, несущие маркеры устойчивости к антибиотикам. Эти маркеры могут быть использованы для получения успешных трансформантов путем селекции. Используемые обычно прокариотические контролирующие последовательности включают -фактора и дрожжевого терминатора GAP.
В зависимости от выбора системы экспрессии и хозяина полипептид, существенно сходный с ГО, включая ГО, или аналог ГО, или фрагмент ГО, продуцируется растущими хозяйскими клетками, трансформированными описанным выше вектором экспрессии в условиях, когда полипептид экспрессируется. Синтезированный полипептид затем выделяют из хозяйской клетки и очищают. Если система экспрессии секретирует фермент в среде роста, белок может быть очищен прямо из среды. Если рекомбинантный полипептид не секретируется, его выделяют из клеточных лизатов. Выбор подходящих условий роста и способов получения – дело опыта.
Выделение свежесинтезированного полипептида зависит от системы анализа, с использованием которой полипептид детектируется. Эти системы анализа очевидны опытному экспериментатору. Например, если свежесинтезированный полипептид проявляет ферментативную активность ГО, полипептид может быть детектирован анализом на энзиматическую активность. Анализы на энзиматическую активность ГО описаны ниже в примерах.
Также возможно детектировать свежесинтезированный полипептид иммуноанализом с использованием антител к полипептидам, существенно сходным с ГО, включая ГО. В этом случае тип использованных в анализе антител будет отражать ожидаемое присутствие или отсутствие известных специфических эпитопов. Методы иммуноанализа общеизвестны и поликлональные антитела к ГО из A. niger коммерчески доступны.
Экспрессированный полипептид может быть выделен и очищен до степени, необходимой для его применения. Очистка может осуществляться общеизвестными способами, например фракционирование солью, хромотаграфия на ионообменных смолах, аффинная хроматография, центрифугирование и т.п. См., например, Methods in Ensymology и Scopes (1987), где есть ряд способов очистки белков.
В общем рекомбинантная продукция ГО может обеспечить существенное количество соединений этого фермента, существенно свободных от загрязняющих белков, т.е. минимум 90% чистоты. Возможность получения существенных количеств полипептида высокой чистоты – результат рекомбинантных систем экспрессии, которые позволяют секрецию в среде рекомбинантно произведенного полипептида. Таким образом, с применением современных методик рекомбинантных культур составы ГО существенной чистоты и количества доступны.
Надо отметить, что с данными о последовательности настоящего изобретения получения ГО не ограничено рекомбинантными методами. Она может также быть синтезирована химическими методами, например твердофазным пептидным синтезом. Такие методы общеизвестны.
Рекомбинантные полипептиды, существенно сходные с ГО, включая ГО, могут быть использованы для получения антител как поликлональных, так и моноклональных. Если желательны поликлональные антитела, выбранные млекопитающие /например, мышь, кролик, козел, лошадь и т.д./ иммунизируют очищенной ГО или ее фрагментом, или ее аналогом, или фрагментом ее аналога. Сыворотка из иммунозированного млекопитающего собирается и обрабатывается в соответствии с известными методами. Если сыворотка, содержащая поликлональные антитела к ГО, содержит антитела к другим антигенам, поликлональные антитела ГО могут быть очищены иммуноаффинно.
Моноклональные антитела к ГО также могут быть с легкостью получены опытным экспериментатором. Общая методология получения моноклональных антител гибридомами хорошо известна. См., например, Schreier и др (1980), Hammerling и др. (1981), Kennet и др. (1980). Наборы моноклональных антител, полученных против ГО, могут быть скринированы на различные свойства; т.е. на изотип, эпитоп, аффинность и т.д. Моноклональные антитела, направленные против специфических эпитопов, полезны в определении взаимодействий ГО. Кроме того, моноклональные антитела полезны в очистке природной или рекомбинантно-полученнной ГО с использованием иммуноаффинных методов.
Если ГО полипептиды, существенно сходные с ГО, используются терапевтически, может быть желательно привязать полипептидную молекулу к эффективной системе для доставки ГО в подходящее место, которая также защищала бы полипептид от протеолиза, и в то же время вызывала контролированную доставку полипептида. Системы для доставки молекул общеизвестны и описаны, например, в Poznansky и др. /1980/. Системы доставки лекарств могут включать, например, липосомы или антитела против специфических клеток-мишеней.
III. Общие методы
Общие методики, использованные для выделения полинуклеотидов из клеток источника, получения и анализа кДНК-овых и/или геномных библиотек, секвенирования клонов, конструирования векторов экспрессии, трансформации клеток, и подобные общеизвестные, и лабораторные руководства, описывающие эти методики, доступны. Однако в качестве общего руководства следующие группы из некоторых источников доступны в настоящее время для таких процедур и материалов, полезных в проведении их.
III.А.
Хозяева и последовательности, контролирующие экспрессию
Для экспрессии желаемой кодирующей последовательности могут быть использованы как прокариотические, так и эукариотические хозяйские кдетки, когда используются подходящие контролирующие последовательности, совместимые с обозначенным хозяином. Среди прокариотических хозяев наиболее часто используется E. coli. Последовательности, контролирующие экспрессию у прокариот, включают промоторы, возможно содержание операторные части, и сайты связывания рибосомы. Вектора переноса, совместимые с прокариотическими хозяевами, в общем, получены из, например, рBR322, плазмиды, содержащей опероны ампициллин- и тетракциклик-резистентности и различных р С-плазмид, которые также содержат последовательности, несущие маркеры устойчивости к антибиотикам. Эти маркеры могут быть использованы для получения успешных трансформантов путем селекции. Используемые обычно прокариотические контролирующие последовательности включают  -лактамазу /пенипиллиназу/ и систему лектозного промотора Chang и др., 1977, промоторную систему триптофана (trp) (Goeddel и др 1980), и полученные из -лактамазу /пенипиллиназу/ и систему лектозного промотора Chang и др., 1977, промоторную систему триптофана (trp) (Goeddel и др 1980), и полученные из  РL промотор и сайт связывания рибосомы гена N (Shimatake и др., 1981), и гибридный промотор tac (De Boer и др., 1983), полученный из последовательности промоторов trp и lac UV5. Последовательности, которые будучи слитыми с кодирующей последовательностью, вызывают секрецию экспрессированного полипептида из E. coli, также известны и включают бактериальный ген pelB /пектатлиаза/ из Ervinia carotovora (Zei и др., 1987). Предшествовавшие системы совместимы конкретно с E. coli; однако, если желательно, могут быть использованы другие прокариотические хозяева, как линии Bacillus или Pseudomonas, с соответствующими контролирующими последовательностями.
Эукариотические хозяева включают дрожжи и клетки млекопитающих в культуральных системах. S. cerevisiae и S. carbsbergiensis – наиболее общеиспользуемые дрожжевые хозяева и общепринятые грибные хозяева. Вектора, совместимые с дрожжами, несут маркеры, которые позволяют селекцию успешных трансформантов внесением прототрофности в ауксотрофные мутанты или резистентности к тяжелым металлам в линии дикого типа. Векторы, совместимые с дрожжами, могут использовать ориджин репликации двухмикронного кольца Broach и др. комбинацию CEN3 и ARS1 или другие средства для репликации как последовательности, которые приводят к включению подходящего фрагмента в геном хозяйской клетки. Контролирующие последовательности для дрожжевых векторов известны и включают промоторы для синтеза гликолитических ферментов (Hess и др., 1968, Holland и др. 1978), включая промотор 3-фосфоглицераткиназы Hitzeman, 1980). Могут также быть включены терминаторы, такие как полученные из гена енолазы (Holland, 1981) или из глицеральдегид-3-фосфатдегидрогеназы (GAP), см. примеры. Конкретно полезны контролирующие системы, содержащие промотор GAP или регулируемый промотор алкогольдегидрогеназы или их гибриды /см. примеры/, терминаторы, полученные из GAP, и, если желательна секреция, лидерные последовательности из РL промотор и сайт связывания рибосомы гена N (Shimatake и др., 1981), и гибридный промотор tac (De Boer и др., 1983), полученный из последовательности промоторов trp и lac UV5. Последовательности, которые будучи слитыми с кодирующей последовательностью, вызывают секрецию экспрессированного полипептида из E. coli, также известны и включают бактериальный ген pelB /пектатлиаза/ из Ervinia carotovora (Zei и др., 1987). Предшествовавшие системы совместимы конкретно с E. coli; однако, если желательно, могут быть использованы другие прокариотические хозяева, как линии Bacillus или Pseudomonas, с соответствующими контролирующими последовательностями.
Эукариотические хозяева включают дрожжи и клетки млекопитающих в культуральных системах. S. cerevisiae и S. carbsbergiensis – наиболее общеиспользуемые дрожжевые хозяева и общепринятые грибные хозяева. Вектора, совместимые с дрожжами, несут маркеры, которые позволяют селекцию успешных трансформантов внесением прототрофности в ауксотрофные мутанты или резистентности к тяжелым металлам в линии дикого типа. Векторы, совместимые с дрожжами, могут использовать ориджин репликации двухмикронного кольца Broach и др. комбинацию CEN3 и ARS1 или другие средства для репликации как последовательности, которые приводят к включению подходящего фрагмента в геном хозяйской клетки. Контролирующие последовательности для дрожжевых векторов известны и включают промоторы для синтеза гликолитических ферментов (Hess и др., 1968, Holland и др. 1978), включая промотор 3-фосфоглицераткиназы Hitzeman, 1980). Могут также быть включены терминаторы, такие как полученные из гена енолазы (Holland, 1981) или из глицеральдегид-3-фосфатдегидрогеназы (GAP), см. примеры. Конкретно полезны контролирующие системы, содержащие промотор GAP или регулируемый промотор алкогольдегидрогеназы или их гибриды /см. примеры/, терминаторы, полученные из GAP, и, если желательна секреция, лидерные последовательности из  -фактора дрожжей. Кроме того, транскрипционный регуляторный район и район инициации транскрипции, которые операционно связанны, могут быть такими, которые не ассоциированны природно в организме дикого типа. Эти системы описаны в деталях в USSN 468598, 522909. 769197, 868639, 073381, 081302 и 139682, зарегистрированные 22 февраля 1983, 12 августа 1983, 29 июля 1985, 29 мая 1986, 13 июля 1987, 3 августа 1987 и 30 декабря 1987, соответственно все они приписываются настоящему представителю и включены здесь путем ссылок.
Линии клеток млекопитающих, доступные в качестве хозяев для экспрессии известны и включают многие бессмертные линии клеток, доступных из американского собрания типов культур, /АТСС/, включая клетки Hela, клетки яичников китайского хомячка /СНО/, клетки почки малого хомячка /ВНК/ и ряд других линий клеток. Удобные промоторы для клеток млекопитающих также известны и включают также вирусные промоторы, как из вируса обезьян 40 /SV40/, вируса саркомы Рауса /RSV/, аденовируса /ADV/ и вируса папилломы быка /BPV/. Клетки млекопитающих также могут требовать терминаторных последовательностей и последовательностей полиаденилирования; также может быть включена энхансерная последовательность, которая увеличивает экспрессию, и последовательность, вызывающие амплификацию гена, также могут быть желательны. Эти последовательности известны. Векторы, удобные для репликации в клетках млекопитающих, могут включать вирусные репликоны или последовательности, которые вызывают интеграцию подходящих последовательностей в хозяйский геном.
III.В Трансформации
Трансформация может осуществляться любым известным способом для введения полинуклеотидов в хозяйскую клетку, включая, например, упаковку полинуклеотида в вирус и трансдукцию хозяйской клетки вирусом и прямое поглощение полинуклеотида. Процедура трансформации зависит от трансформируемого хозяина. Например, трансформация S. cerevisiae вектором экспрессии, кодирующим ГО, обсуждается в разделе примеров, ниже. Бактериальная трансформация путем прямого поглощения в общем использует обработку хлоридами кальция или рубидия (Cohen (1972), Maniatis (1982)). Трансформация дрожжей путем прямого поглощения может быть проведена с использованием способа Hinnen и др. 1978. Трансформация млекопитающих путем прямого поглощения может быть проведена по способу кальций-фосфатного осадка (Graham и van der Eb (1978)) или с различными известными модификациями его.
III.С Конструирование вектора
Конструирование вектора использует методики, которые известны. Сайтспецифическое расщепление ДНК осуществлено обработкой удобными ферментами рестрикции при условиях, которые обычно сообщаются изготовителем этих коммерчески доступных ферментов. В общем, около 1 мкг плазмидных или последовательности ДНК расщепляли 1 ед фермента приблизительно в 20 мкл буферного раствора при инкубации при 37 -фактора дрожжей. Кроме того, транскрипционный регуляторный район и район инициации транскрипции, которые операционно связанны, могут быть такими, которые не ассоциированны природно в организме дикого типа. Эти системы описаны в деталях в USSN 468598, 522909. 769197, 868639, 073381, 081302 и 139682, зарегистрированные 22 февраля 1983, 12 августа 1983, 29 июля 1985, 29 мая 1986, 13 июля 1987, 3 августа 1987 и 30 декабря 1987, соответственно все они приписываются настоящему представителю и включены здесь путем ссылок.
Линии клеток млекопитающих, доступные в качестве хозяев для экспрессии известны и включают многие бессмертные линии клеток, доступных из американского собрания типов культур, /АТСС/, включая клетки Hela, клетки яичников китайского хомячка /СНО/, клетки почки малого хомячка /ВНК/ и ряд других линий клеток. Удобные промоторы для клеток млекопитающих также известны и включают также вирусные промоторы, как из вируса обезьян 40 /SV40/, вируса саркомы Рауса /RSV/, аденовируса /ADV/ и вируса папилломы быка /BPV/. Клетки млекопитающих также могут требовать терминаторных последовательностей и последовательностей полиаденилирования; также может быть включена энхансерная последовательность, которая увеличивает экспрессию, и последовательность, вызывающие амплификацию гена, также могут быть желательны. Эти последовательности известны. Векторы, удобные для репликации в клетках млекопитающих, могут включать вирусные репликоны или последовательности, которые вызывают интеграцию подходящих последовательностей в хозяйский геном.
III.В Трансформации
Трансформация может осуществляться любым известным способом для введения полинуклеотидов в хозяйскую клетку, включая, например, упаковку полинуклеотида в вирус и трансдукцию хозяйской клетки вирусом и прямое поглощение полинуклеотида. Процедура трансформации зависит от трансформируемого хозяина. Например, трансформация S. cerevisiae вектором экспрессии, кодирующим ГО, обсуждается в разделе примеров, ниже. Бактериальная трансформация путем прямого поглощения в общем использует обработку хлоридами кальция или рубидия (Cohen (1972), Maniatis (1982)). Трансформация дрожжей путем прямого поглощения может быть проведена с использованием способа Hinnen и др. 1978. Трансформация млекопитающих путем прямого поглощения может быть проведена по способу кальций-фосфатного осадка (Graham и van der Eb (1978)) или с различными известными модификациями его.
III.С Конструирование вектора
Конструирование вектора использует методики, которые известны. Сайтспецифическое расщепление ДНК осуществлено обработкой удобными ферментами рестрикции при условиях, которые обычно сообщаются изготовителем этих коммерчески доступных ферментов. В общем, около 1 мкг плазмидных или последовательности ДНК расщепляли 1 ед фермента приблизительно в 20 мкл буферного раствора при инкубации при 37 С в течение 1-2 часов. После инкубации с ферментом рестрикции белок удаляли экстракцией фенол-хлороформом и ДНК выделяли осаждением этанолом. Расщепленные фрагменты могут быть разделены с использованием метода электрофореза в полиакриламидном или агарозном геле в соответствии с общими процедурами, имеющимися в Methods in Ensymology /1980/ 65:499-560.
Фрагменты расщепления с липкими концами могут быть затуплены по концам с использованием ДНК-полимеразы E. coli (Klenow) в присутствии подходящих дезоксинуклеотидтрифосфатов /дНТФ/, присутствующих в смеси. Также может быть использована обработка нуклеазой S1, приводящая к гидролизу всех однонитевых участков ДНК.
Лигирование проводилось при стандартных буферных и температурных условиях с использованием ДНК-лигазы Т4 и АТФ; лигирование по липким концам требует меньше АТФ и лигазы, чем лигирование по тупым концам. Когда в качестве части лигируемой смеси использовались фрагменты вектора, они часто обрабатывались бактериальной щелочной фосфатазой /ВАР/ или щелочной фосфатазой из кишечника теленка для удаления 5-фосфата и т.о. предовращения религирования вектора; альтернативно для предотвращения лигирования может быть использовано расщепление нежелательного фрагмента ферментом ресткрикции.
Лигированные смеси трансформировали в удобные для клонирования хозяева, такие как E. coli, и успешные трансформанты селектировали по, например, устойчивости к антибиотикам и скринировали на правильную конструкцию.
III. Конструкция желательных последовательностей ДНК
Синтетические олигонуклеотиды могут быть получены с использованием автоматического олигонуклеотидного синтезатора, как описано Warner /91984/. Если необходимо, синтетические цепи могут быть мечены 32Р при обработке полинуклеотидкиназой в присутствии 32Р-ATC с использованием стандартных условий реакции.
Последовательности ДНК, включая выделенные из библиотек кДНК, могут быть модифицированы известными способами, включая, например, сайт-направленный мутагенез, как описано Zоller /1982/. Коротко, ДНК, которую надо модифицировать, пакуется в фаг в виде однонитевой последовательности и превращается в двунитевую ДНК при помощи ДНК-полимеразы с использованием в качестве праймера синтетического олигонуклеотида, комплементарного части модифицируемой ДНК и имеющего желаемую модификацию, внесенную в его собственную последовательность. Результирующая двунитевая ДНК трансформируется в хозяйские бактерии, поддерживающие фаг. Культуру трансформированных бактерий, которые содержат репликации каждой цепи фага, высевают на агар для получения бляшек. Теоретически 50% новых бляшек содержат фаг, имеющий мутированную последовательность, и другие 50% имеют исходную последовательность. Реплики бляшек гибридизуют с меченой синтетической пробой при температуре и условиях, которые позволяют гибридизацию с правильной цепью, но не позволяют с немодифицированной последовательностью. Последовательности, иднтифицированные гибридизацией, выделяют и клонируют.
III.Е. Гибридизация с пробой
Библиотеки ДНК могут быть анализированы с использованием процедуры Грюнштейна и Хогнесса /1975/. Кратко, в этой процедуре анализируемая ДНК иммобилизуется на нитроцеллюлозных фильтрах, денатурируется и прегибридизуется с буфером, содержащим 0-50% формамида, 0,75М NaCl, 75M цитрата Na, 0.02% /в/об/ каждого из: бычий сыворочный альбумин, поливинилпирролидон и фиколл; 50 мМ фосфат Na /рН 6.5/, 0.1% ДДС–Na и 100 мкг/мл денатурированной ДНК-носителя. Процент формамида в буфере, как и время и температурные условия прегибридизационной и последующей гибридизационной стадий, зависит от требуемой жесткости. Олигомерные пробы, которые менее жестких условий, в общем использовались с низким процентом формамида, пониженной температурой и удлиненными временами гибридизации. Пробы, содержащие более чем 30 или 40 нуклеотидов, как подученные из кДНК или геномных последовательностей, в общем применяются при более высокой температуре: например около 40-42 С в течение 1-2 часов. После инкубации с ферментом рестрикции белок удаляли экстракцией фенол-хлороформом и ДНК выделяли осаждением этанолом. Расщепленные фрагменты могут быть разделены с использованием метода электрофореза в полиакриламидном или агарозном геле в соответствии с общими процедурами, имеющимися в Methods in Ensymology /1980/ 65:499-560.
Фрагменты расщепления с липкими концами могут быть затуплены по концам с использованием ДНК-полимеразы E. coli (Klenow) в присутствии подходящих дезоксинуклеотидтрифосфатов /дНТФ/, присутствующих в смеси. Также может быть использована обработка нуклеазой S1, приводящая к гидролизу всех однонитевых участков ДНК.
Лигирование проводилось при стандартных буферных и температурных условиях с использованием ДНК-лигазы Т4 и АТФ; лигирование по липким концам требует меньше АТФ и лигазы, чем лигирование по тупым концам. Когда в качестве части лигируемой смеси использовались фрагменты вектора, они часто обрабатывались бактериальной щелочной фосфатазой /ВАР/ или щелочной фосфатазой из кишечника теленка для удаления 5-фосфата и т.о. предовращения религирования вектора; альтернативно для предотвращения лигирования может быть использовано расщепление нежелательного фрагмента ферментом ресткрикции.
Лигированные смеси трансформировали в удобные для клонирования хозяева, такие как E. coli, и успешные трансформанты селектировали по, например, устойчивости к антибиотикам и скринировали на правильную конструкцию.
III. Конструкция желательных последовательностей ДНК
Синтетические олигонуклеотиды могут быть получены с использованием автоматического олигонуклеотидного синтезатора, как описано Warner /91984/. Если необходимо, синтетические цепи могут быть мечены 32Р при обработке полинуклеотидкиназой в присутствии 32Р-ATC с использованием стандартных условий реакции.
Последовательности ДНК, включая выделенные из библиотек кДНК, могут быть модифицированы известными способами, включая, например, сайт-направленный мутагенез, как описано Zоller /1982/. Коротко, ДНК, которую надо модифицировать, пакуется в фаг в виде однонитевой последовательности и превращается в двунитевую ДНК при помощи ДНК-полимеразы с использованием в качестве праймера синтетического олигонуклеотида, комплементарного части модифицируемой ДНК и имеющего желаемую модификацию, внесенную в его собственную последовательность. Результирующая двунитевая ДНК трансформируется в хозяйские бактерии, поддерживающие фаг. Культуру трансформированных бактерий, которые содержат репликации каждой цепи фага, высевают на агар для получения бляшек. Теоретически 50% новых бляшек содержат фаг, имеющий мутированную последовательность, и другие 50% имеют исходную последовательность. Реплики бляшек гибридизуют с меченой синтетической пробой при температуре и условиях, которые позволяют гибридизацию с правильной цепью, но не позволяют с немодифицированной последовательностью. Последовательности, иднтифицированные гибридизацией, выделяют и клонируют.
III.Е. Гибридизация с пробой
Библиотеки ДНК могут быть анализированы с использованием процедуры Грюнштейна и Хогнесса /1975/. Кратко, в этой процедуре анализируемая ДНК иммобилизуется на нитроцеллюлозных фильтрах, денатурируется и прегибридизуется с буфером, содержащим 0-50% формамида, 0,75М NaCl, 75M цитрата Na, 0.02% /в/об/ каждого из: бычий сыворочный альбумин, поливинилпирролидон и фиколл; 50 мМ фосфат Na /рН 6.5/, 0.1% ДДС–Na и 100 мкг/мл денатурированной ДНК-носителя. Процент формамида в буфере, как и время и температурные условия прегибридизационной и последующей гибридизационной стадий, зависит от требуемой жесткости. Олигомерные пробы, которые менее жестких условий, в общем использовались с низким процентом формамида, пониженной температурой и удлиненными временами гибридизации. Пробы, содержащие более чем 30 или 40 нуклеотидов, как подученные из кДНК или геномных последовательностей, в общем применяются при более высокой температуре: например около 40-42 С, и высокой процентности, например 50%, формамида. После прегибридизации в буфер добавляли 5- С, и высокой процентности, например 50%, формамида. После прегибридизации в буфер добавляли 5- 32 Р-меченую, олигонуклеотидные пробы и фильтры инкубировали в этой смеси при условиях гибридизации. После отмывки фильтры подвергали авторадиографии для визуализации расположения радиоактивной пробы; ДНК в соответствующих местах исходных агаровых чашек использовалась как источник желаемой ДНК.
III. Проверка конструкции и секвенирование.
Для рутинного конструирования векторов лигированные смеси трансформировали в линию E. coli HB101 или другого удобного хозяйства и успешные трансформанты селектировали по устойчивости к актибиотикам или другим маркерам. Плазмиды из трансформантов получали затем в соответствии с методом Clewell и др. (1969), обычно после хлорамфеникольной амплификации Clewell /1972/. ДНК выделяли и анализировали, обычно рестриктным анализом и/или секвенированием. Секвенирование может быть по дидезокси-методу Сэнджера и др. №/1977/, как описано далее Мессингом и др. №/1981/, или по методу Максама и др. /1980/. Проблемы с компрессией полос, которые иногда наблюдаются в ГЦ-богатых районах, были разрешены применением Т-деазогуанозина согласно Barr др. /1986/.
IV. Примеры
Ниже описаны примеры настоящего изобретения, которые приведены только для иллюстративных целей, но не для ограничения области настоящего изобретения. В свете настоящего раскрытия множества воплощений в пределах формулы изобретения очевидны опытным экспериментатором. Набор процедур из, например, раздела IV может, если желательно, быть повторен, но нужды в этом нет, поскольку доступны методики конструирования желаемых нуклеотидных последовательностей на основе информации, обеспеченной изобретением. Экспрессия рассматривается на примере системы в Saccharomyces cerevisiae, однако доступны другие системы, как более полно рассматривается в разделе IIIА.
Все манипуляции с ДНК производились в соответствии со стандартными процедурами, если не указано другого. См. Maniatis и др. /1982/. Ферменты, кроме глюкозоксидазы, использовали в соответствии с рекомендациями изготовителя или указаниями поставщика. Ферменты, если не указано другого, получали от New England Biolabs или от Bethesda Reseach Zaboratories.
Дрожжи трансформировали и растили с использованием различных сред, включая селективные среды /дрожжевое азотное основание без лейцина/, среду YEPD, содержащую 1% /вес./об./ дрожжевого экстракта, 2% /вес./об./ пептона, 2% / вес./об./ глюкозы и другие, как описано ниже. В случае заливки сред в чашки они содержали 2% /вес./об./агара и для трансформации 3% верхний агар с IM сорбитолом.
Линии Е. coli, полезные для трансформации, включают Chi 1776; K12 линия 294 /АТСС №31446/; RR1 HB101 и D1210. Линии дрожжей, полезные для трансформации, включают AB110 и GRF180.
Линия дрожжей АВ110 имеет генотип Mat альфа, ura 3-52, leu 2-04 или как leu 2-3, так и leu 2-112, pep 4-3, his 4-580, cirо. Образeц этой линии, содержащий различные гетерологичные плазмиды, депонирован в ATCC 9 мая 1984 под приемным №20709. См. публ. EPON 164.556.
Линия дрожжей GRF 180 имеет генотип leu 2-3, leu 2-112, his 3-11, his 3-15, CAN, ciro. Эта линия может быть получена освобождением линии CRF 18 /полученной, как описано в Европейском патентном приложении №858701070.9/ публикация №0184575/ от ее эндогенной двухмиллимикронной плазмиды с использованием pCI/I или родственной плазмиды, как описано Erhard и Hollenberg /1983/.
Дрожжевой штамм GRF 181 легко получают из GRF 180, используя стандартное методики генетического манипулирования дрожжами. GRF 181 по существу представляет собой штамм GRF 180 с делетированным геном ura 3 (GRF 181 ura 3–). Он получается трансформацией штамма GRF 180 плазмидой, которая является his+ и содержит район гена ura 3 без самого структурного гена. Трансформированные дрожжевые клетки his+ отбирают и выращивают. Рекомбинация между эндогенным геном ura 3 и трансформирующим геном приводит к желаемому генотипу. Клетки ura 3– в дальнейшем отбираются добавлением 5-фтороротовой кислоты (5-FO), которая убивает клетки ura 3+. Дрожжевой штамм GRF 183 имеет генотип leu 2-3, leu 2-212, his 3-11, his 3-15, ura 3-Д, кех 2-Д, САN, cirо. Этот штамм идентичен штамму GRF 181 за исключением делеции кех 2, которая была интегрирована в кех 2 локус. Он может быть легко получен трансформацией линейной плазмидой р АВ 240 вышеупомянутого штамма GRF 181.
Активность ГО измеряли сочетанием пероксидазо-о-дианизидиновой системы с реакциями, катализируемыми ГО. Анализы на ГО, основанные на этой сочетанной системе, описаны в литературе, сопровождающей коммерческие препараты ГО, поставляемые Sigma Corporation и Worthington Corporation. В общем, реакция проводится в водном растворе в присутствии буфера при рН 5.0-6.0, 32 Р-меченую, олигонуклеотидные пробы и фильтры инкубировали в этой смеси при условиях гибридизации. После отмывки фильтры подвергали авторадиографии для визуализации расположения радиоактивной пробы; ДНК в соответствующих местах исходных агаровых чашек использовалась как источник желаемой ДНК.
III. Проверка конструкции и секвенирование.
Для рутинного конструирования векторов лигированные смеси трансформировали в линию E. coli HB101 или другого удобного хозяйства и успешные трансформанты селектировали по устойчивости к актибиотикам или другим маркерам. Плазмиды из трансформантов получали затем в соответствии с методом Clewell и др. (1969), обычно после хлорамфеникольной амплификации Clewell /1972/. ДНК выделяли и анализировали, обычно рестриктным анализом и/или секвенированием. Секвенирование может быть по дидезокси-методу Сэнджера и др. №/1977/, как описано далее Мессингом и др. №/1981/, или по методу Максама и др. /1980/. Проблемы с компрессией полос, которые иногда наблюдаются в ГЦ-богатых районах, были разрешены применением Т-деазогуанозина согласно Barr др. /1986/.
IV. Примеры
Ниже описаны примеры настоящего изобретения, которые приведены только для иллюстративных целей, но не для ограничения области настоящего изобретения. В свете настоящего раскрытия множества воплощений в пределах формулы изобретения очевидны опытным экспериментатором. Набор процедур из, например, раздела IV может, если желательно, быть повторен, но нужды в этом нет, поскольку доступны методики конструирования желаемых нуклеотидных последовательностей на основе информации, обеспеченной изобретением. Экспрессия рассматривается на примере системы в Saccharomyces cerevisiae, однако доступны другие системы, как более полно рассматривается в разделе IIIА.
Все манипуляции с ДНК производились в соответствии со стандартными процедурами, если не указано другого. См. Maniatis и др. /1982/. Ферменты, кроме глюкозоксидазы, использовали в соответствии с рекомендациями изготовителя или указаниями поставщика. Ферменты, если не указано другого, получали от New England Biolabs или от Bethesda Reseach Zaboratories.
Дрожжи трансформировали и растили с использованием различных сред, включая селективные среды /дрожжевое азотное основание без лейцина/, среду YEPD, содержащую 1% /вес./об./ дрожжевого экстракта, 2% /вес./об./ пептона, 2% / вес./об./ глюкозы и другие, как описано ниже. В случае заливки сред в чашки они содержали 2% /вес./об./агара и для трансформации 3% верхний агар с IM сорбитолом.
Линии Е. coli, полезные для трансформации, включают Chi 1776; K12 линия 294 /АТСС №31446/; RR1 HB101 и D1210. Линии дрожжей, полезные для трансформации, включают AB110 и GRF180.
Линия дрожжей АВ110 имеет генотип Mat альфа, ura 3-52, leu 2-04 или как leu 2-3, так и leu 2-112, pep 4-3, his 4-580, cirо. Образeц этой линии, содержащий различные гетерологичные плазмиды, депонирован в ATCC 9 мая 1984 под приемным №20709. См. публ. EPON 164.556.
Линия дрожжей GRF 180 имеет генотип leu 2-3, leu 2-112, his 3-11, his 3-15, CAN, ciro. Эта линия может быть получена освобождением линии CRF 18 /полученной, как описано в Европейском патентном приложении №858701070.9/ публикация №0184575/ от ее эндогенной двухмиллимикронной плазмиды с использованием pCI/I или родственной плазмиды, как описано Erhard и Hollenberg /1983/.
Дрожжевой штамм GRF 181 легко получают из GRF 180, используя стандартное методики генетического манипулирования дрожжами. GRF 181 по существу представляет собой штамм GRF 180 с делетированным геном ura 3 (GRF 181 ura 3–). Он получается трансформацией штамма GRF 180 плазмидой, которая является his+ и содержит район гена ura 3 без самого структурного гена. Трансформированные дрожжевые клетки his+ отбирают и выращивают. Рекомбинация между эндогенным геном ura 3 и трансформирующим геном приводит к желаемому генотипу. Клетки ura 3– в дальнейшем отбираются добавлением 5-фтороротовой кислоты (5-FO), которая убивает клетки ura 3+. Дрожжевой штамм GRF 183 имеет генотип leu 2-3, leu 2-212, his 3-11, his 3-15, ura 3-Д, кех 2-Д, САN, cirо. Этот штамм идентичен штамму GRF 181 за исключением делеции кех 2, которая была интегрирована в кех 2 локус. Он может быть легко получен трансформацией линейной плазмидой р АВ 240 вышеупомянутого штамма GRF 181.
Активность ГО измеряли сочетанием пероксидазо-о-дианизидиновой системы с реакциями, катализируемыми ГО. Анализы на ГО, основанные на этой сочетанной системе, описаны в литературе, сопровождающей коммерческие препараты ГО, поставляемые Sigma Corporation и Worthington Corporation. В общем, реакция проводится в водном растворе в присутствии буфера при рН 5.0-6.0,  -д-глюкозы, пероксидазы красных кровяных телец и о-дианизидина. Окисление краски перекисью водорода, образуемой в реакции, отслеживается по увеличению оптической плотности при 450U нм или 500 мн. Одна единица активности ГО определяется как такое количество фермента, которое освобождает 1 мкмоль перекиси водорода в минуту при стандартных условиях реакции.
IV.А. Получение, выделение и секвенирование кДНК, кодирующей ГО из А. niger.
В общем, кДНК, кодирующая ГО из А. niger, была получена скринированием библиотеки кДНК, сконструированной в -д-глюкозы, пероксидазы красных кровяных телец и о-дианизидина. Окисление краски перекисью водорода, образуемой в реакции, отслеживается по увеличению оптической плотности при 450U нм или 500 мн. Одна единица активности ГО определяется как такое количество фермента, которое освобождает 1 мкмоль перекиси водорода в минуту при стандартных условиях реакции.
IV.А. Получение, выделение и секвенирование кДНК, кодирующей ГО из А. niger.
В общем, кДНК, кодирующая ГО из А. niger, была получена скринированием библиотеки кДНК, сконструированной в  gt10, олигонуклеотидными пробами, которые были получены, основываясь на аминокислотной последовательности пептидных фрагментов очищенной ГО.
IV.А.1 Получение библиотеки кДНК, которая содержит ГО-кодирующие последовательности из А. niger.
В целях определения источника нуклеиновых кислот кодирующих ГО, штаммы А. niger, полученные из Американского Коллектора типов культур, скринировали на продукцию ГО. Одна линия, в частности А. niger 9029, была использована как источник мРНК, из которой могла быть приготовлена библиотека кДНК, поскольку было определено, что этот штамм образует и секретирует ГО в среду. В целях определения продуцирования ГО штамм растили на среде YEPD и ГО-активность определяли в среде культивирования. ГО-активность определяли сочетанием пероксидазо-о-дианизидиновой системы с системой ГО.
Присутствие ГО в среде культивирования подтверждено Вестернблот-анализом с использованием препарата кроличьих антител против ГО, которые были получены от Accurate Chemicals.
Библиотеку кДНК получали из поли/А+/РНК, которая была выделена из мицелия А. niger 9029, в логарифмической базе роста на среде YEPD. Сначала тотальную РНК выделяли по модифицированному методу Chirgwih и др. /1979/. Этот метод включает разрушение клеток в 4М гуанидинтиоцианата и 0.1М меркаптоэтаноле для денатурации белков и разрушения дисульфидных связей. РНК затем отделяли от ДНК и белков ультрацентрифугированием через слой 5.7M CsCl, как списано Glisin /1974/, за исключением того, что вместо бакет-ротора использовали вертикальный ротор /VTi50, Beckman/. Поли/А+/-фракцию РНК выделяли, как описано в Maniatis и др. /1982/, с использованием двух пропусканий через олиго-дТ-целлюлозу. Синтез кДНК из поли/А+/-РНК и создание библиотеки кДНК из поли/А+/-РНК А. niger 9029 в gt10, олигонуклеотидными пробами, которые были получены, основываясь на аминокислотной последовательности пептидных фрагментов очищенной ГО.
IV.А.1 Получение библиотеки кДНК, которая содержит ГО-кодирующие последовательности из А. niger.
В целях определения источника нуклеиновых кислот кодирующих ГО, штаммы А. niger, полученные из Американского Коллектора типов культур, скринировали на продукцию ГО. Одна линия, в частности А. niger 9029, была использована как источник мРНК, из которой могла быть приготовлена библиотека кДНК, поскольку было определено, что этот штамм образует и секретирует ГО в среду. В целях определения продуцирования ГО штамм растили на среде YEPD и ГО-активность определяли в среде культивирования. ГО-активность определяли сочетанием пероксидазо-о-дианизидиновой системы с системой ГО.
Присутствие ГО в среде культивирования подтверждено Вестернблот-анализом с использованием препарата кроличьих антител против ГО, которые были получены от Accurate Chemicals.
Библиотеку кДНК получали из поли/А+/РНК, которая была выделена из мицелия А. niger 9029, в логарифмической базе роста на среде YEPD. Сначала тотальную РНК выделяли по модифицированному методу Chirgwih и др. /1979/. Этот метод включает разрушение клеток в 4М гуанидинтиоцианата и 0.1М меркаптоэтаноле для денатурации белков и разрушения дисульфидных связей. РНК затем отделяли от ДНК и белков ультрацентрифугированием через слой 5.7M CsCl, как списано Glisin /1974/, за исключением того, что вместо бакет-ротора использовали вертикальный ротор /VTi50, Beckman/. Поли/А+/-фракцию РНК выделяли, как описано в Maniatis и др. /1982/, с использованием двух пропусканий через олиго-дТ-целлюлозу. Синтез кДНК из поли/А+/-РНК и создание библиотеки кДНК из поли/А+/-РНК А. niger 9029 в  gt10 проводили в соответствии с методом, описанным Huynh /1985/; синтез кДНК осуществляли обратной транскриптазой с использованием случайных праймеров. Сложность библиотеки была 1.6 gt10 проводили в соответствии с методом, описанным Huynh /1985/; синтез кДНК осуществляли обратной транскриптазой с использованием случайных праймеров. Сложность библиотеки была 1.6 106.
IV.А.2 Приготовление проб и скрининг библиотеки
Для получения проб, которые были бы удобны для скриниррования библиотеки в 106.
IV.А.2 Приготовление проб и скрининг библиотеки
Для получения проб, которые были бы удобны для скриниррования библиотеки в  gt10 на фаг, содержащий кДНК, кодирующую ГО /ГО–кДНК/, была определена аминокислотная последовательность олигопептидных фрагментов очищенной ГО. Этой программе последовали, поскольку, как ни странно, попытки получить аминокислотную последовательность всего полипептида были безуспешными и дали последовательность лишь первых 10 аминокислот.
Полученная коммерческая ГО была далее очищена электрофорезом в полиакриламидном геле в присутствии додецилсульфата Na /ДДС-Na/ при условиях, описанных Zaemmli /1970/. Белок был элюирован из геля и фрагментирован бромцианом /CNBr/ или расщеплением трипсином, каковые процедуры – стандартные методы в химии белков. Расщепление CNBr проводили в 70% муравьиной кислоте. Расщепление трипсином проводили после обработки ГО цитраконовым ангидридом, который специфически блокирует остатки Лиз, сводя специфичность трипсина к немодифицированным остаткам Арг. Белок обычно восстанавливали и карбоксеиметилировали с использованием меркаптоэтанола и иодуксусной кислоты до этих обработок для разрушения всех имеющихся дисульфидных связей.
Результирующие пептиды разделяли и очищали на ЖХВД. Был использован ряд способов. Применяли как нейтральное, так и кислые системы обращенных фаз с использованием ацетонитрильных градиентов. Сначала фрагменты разделяли по размерам использованием Bio–Gel Р-10 в 30% муравьиной кислоте или разделял и по заряду с использованием ионообменной хроматографии в буферных системах с 6М мочевиной; колонки ВЭЖХ Mono-S и Mono-Q использовали для дальнейшего разделения фрагментов для анализа последовательности. Чтобы убедиться в чистоте анализируемого пептида очистку на ЖХВД обычно проводили дважды, т.е. очищенный фрагмент подвергался дальнейшей очистке повторением процедуры ЖХВД. Аминокислотная последовательности пептидных фрагментов ГО определяли с использованием газофазного секвенатора (Applied Biosystems) в соответствии с указаниями производителя. Последовательности фрагментов, полученные из этого анализа, приведены на фиг. 1. На чертеже скобки обозначают неуверенность в последовательности, как прочитано с хроматограмм, за исключением остатков Арг или Мет, которые предположены из специфичности расщепляющего реагента /трипсина или CNBr/.
Олигонуклеотидные пробы приготовляли двумя способами. Пробы в 17-23 нуклеотида получали из районов наименьшей вырожденности. С другой стороны, уникальные более длинные пробы основывались на угадывании выбора кодонов. Пробы, полученные для скринирования библиотеки gt10 на фаг, содержащий кДНК, кодирующую ГО /ГО–кДНК/, была определена аминокислотная последовательность олигопептидных фрагментов очищенной ГО. Этой программе последовали, поскольку, как ни странно, попытки получить аминокислотную последовательность всего полипептида были безуспешными и дали последовательность лишь первых 10 аминокислот.
Полученная коммерческая ГО была далее очищена электрофорезом в полиакриламидном геле в присутствии додецилсульфата Na /ДДС-Na/ при условиях, описанных Zaemmli /1970/. Белок был элюирован из геля и фрагментирован бромцианом /CNBr/ или расщеплением трипсином, каковые процедуры – стандартные методы в химии белков. Расщепление CNBr проводили в 70% муравьиной кислоте. Расщепление трипсином проводили после обработки ГО цитраконовым ангидридом, который специфически блокирует остатки Лиз, сводя специфичность трипсина к немодифицированным остаткам Арг. Белок обычно восстанавливали и карбоксеиметилировали с использованием меркаптоэтанола и иодуксусной кислоты до этих обработок для разрушения всех имеющихся дисульфидных связей.
Результирующие пептиды разделяли и очищали на ЖХВД. Был использован ряд способов. Применяли как нейтральное, так и кислые системы обращенных фаз с использованием ацетонитрильных градиентов. Сначала фрагменты разделяли по размерам использованием Bio–Gel Р-10 в 30% муравьиной кислоте или разделял и по заряду с использованием ионообменной хроматографии в буферных системах с 6М мочевиной; колонки ВЭЖХ Mono-S и Mono-Q использовали для дальнейшего разделения фрагментов для анализа последовательности. Чтобы убедиться в чистоте анализируемого пептида очистку на ЖХВД обычно проводили дважды, т.е. очищенный фрагмент подвергался дальнейшей очистке повторением процедуры ЖХВД. Аминокислотная последовательности пептидных фрагментов ГО определяли с использованием газофазного секвенатора (Applied Biosystems) в соответствии с указаниями производителя. Последовательности фрагментов, полученные из этого анализа, приведены на фиг. 1. На чертеже скобки обозначают неуверенность в последовательности, как прочитано с хроматограмм, за исключением остатков Арг или Мет, которые предположены из специфичности расщепляющего реагента /трипсина или CNBr/.
Олигонуклеотидные пробы приготовляли двумя способами. Пробы в 17-23 нуклеотида получали из районов наименьшей вырожденности. С другой стороны, уникальные более длинные пробы основывались на угадывании выбора кодонов. Пробы, полученные для скринирования библиотеки  gt10, содержащей последовательности, кодирующие ГО из A. niger, приведены на фиг. 2. Чертеж показывает аминокислотную последовательность фрагментов и пробы, полученные из последовательностей. Также показан размер олигомерных проб и для более коротких проб степень вырожденности.
Библиотеку в gt10, содержащей последовательности, кодирующие ГО из A. niger, приведены на фиг. 2. Чертеж показывает аминокислотную последовательность фрагментов и пробы, полученные из последовательностей. Также показан размер олигомерных проб и для более коротких проб степень вырожденности.
Библиотеку в  gt10 скринировали на ГО-кДНК, содержащие клоны с использованием вышеозначенных проб. Пробы получали химическим синтезом согласно общепринятым процедурам с использованием фосфорамидитовой химии, как описано Urdea и др. /1983/. Синтетические пробы метили 32Р с использованием полинуклеотидкиназы Т4 в присутствии 32Р-АТФ. Способ мечения проб описан в Maniatis и др. /1982/.
Скрининг библиотеки gt10 скринировали на ГО-кДНК, содержащие клоны с использованием вышеозначенных проб. Пробы получали химическим синтезом согласно общепринятым процедурам с использованием фосфорамидитовой химии, как описано Urdea и др. /1983/. Синтетические пробы метили 32Р с использованием полинуклеотидкиназы Т4 в присутствии 32Р-АТФ. Способ мечения проб описан в Maniatis и др. /1982/.
Скрининг библиотеки  gt10 пробами в основном проводится, как описано Huynh /1985/. Фильтры гибридизовали в течение ночи при Ткомн с 100 000 расп/мин х мл каждой из проб long 6, long 7 и long 8 в 4хSSC, 50 мМ фосфате Na, рН 6.8, 2x растворе Денхардта, и 0,3 мг/мл озвученной ДНК спермы лосося. Затем их отмывали при 47 gt10 пробами в основном проводится, как описано Huynh /1985/. Фильтры гибридизовали в течение ночи при Ткомн с 100 000 расп/мин х мл каждой из проб long 6, long 7 и long 8 в 4хSSC, 50 мМ фосфате Na, рН 6.8, 2x растворе Денхардта, и 0,3 мг/мл озвученной ДНК спермы лосося. Затем их отмывали при 47 С в 3.0 М хлорида тетраметиламмония в соответствии с Wood и др. /1985/ и авторадиографировали 6 дней. Ни одна из коротких проб не была полезна для детектирования клонов, содержащих кДНК ГО. Библиотеку скринировали пробами long 6, long 7 и long 8 в виде смеси; после 6 дней экспозиции 4 светлых двойных позитива были получены из 4×105 скринированных фагов. После повторного скринирования смесью эти 4 клона оставались позитивными на кДНК ГО. Фаги затем были высеяны заново в 3 повторностях и скринированы тремя индивидуальными длинными пробами. 4 клона гибридизовались с пробами long 7 и long 8. Однако ни один из клонов не гибридизовался с long 6. Результат был удивительным, поскольку за исключением единственной нуклеотидной замены пробы long 7 и long 8 являются частями long 8 /см. фиг. 3/.
Присутствие в 4 позитивных клонах кДНК, которая связывается с пробами long 7 и long 8, было подтверждено Саузерн-блот анализом ДНК, ДНК, выделенная из каждого клона, обрабатывали ЕcoR1 и анализировали Саузерн-блот анализом, как описано Maniatis и др. /1982/, используя смесь проб long 7 и long 8. В каждом клоне только одна полоса гибридизовалась с пробами. Размеры кДНК в полосах были 0.9 т.п.н., 0.8 т.п.н., 0.7 т.п.н. в клонах 1-4 соответственно.
Свидетельства, что кДНК клона 4 перекрывается с таковой в трех остальных клонах было получено, поскольку вставка кДНК выделена из клона 4, гибридизовалась с вставками из клонов 1, 2 и 3 в жестких условиях. кДНК клона 4 была вырезана EcoRI, выделена электрофорезом в геле и мечена 32Р-ник-трансляцией. Способ ник-трансляции был, как описан, Manitis и др. /1982/. Остальные 3 клона были расщеплены ЕсоR1 и перенесены на нитроцеллюлозу после электрофореза в 1% агарозном геле. Никтранслированная проба клона 4 была денатурилована и гибридизована с Саузерн-блоком в условиях, описанных выше для скрининга библиотеки кДНК, за исключением того, что смесь содержала 50% формамида и гибридизацию проводили при 42 С в 3.0 М хлорида тетраметиламмония в соответствии с Wood и др. /1985/ и авторадиографировали 6 дней. Ни одна из коротких проб не была полезна для детектирования клонов, содержащих кДНК ГО. Библиотеку скринировали пробами long 6, long 7 и long 8 в виде смеси; после 6 дней экспозиции 4 светлых двойных позитива были получены из 4×105 скринированных фагов. После повторного скринирования смесью эти 4 клона оставались позитивными на кДНК ГО. Фаги затем были высеяны заново в 3 повторностях и скринированы тремя индивидуальными длинными пробами. 4 клона гибридизовались с пробами long 7 и long 8. Однако ни один из клонов не гибридизовался с long 6. Результат был удивительным, поскольку за исключением единственной нуклеотидной замены пробы long 7 и long 8 являются частями long 8 /см. фиг. 3/.
Присутствие в 4 позитивных клонах кДНК, которая связывается с пробами long 7 и long 8, было подтверждено Саузерн-блот анализом ДНК, ДНК, выделенная из каждого клона, обрабатывали ЕcoR1 и анализировали Саузерн-блот анализом, как описано Maniatis и др. /1982/, используя смесь проб long 7 и long 8. В каждом клоне только одна полоса гибридизовалась с пробами. Размеры кДНК в полосах были 0.9 т.п.н., 0.8 т.п.н., 0.7 т.п.н. в клонах 1-4 соответственно.
Свидетельства, что кДНК клона 4 перекрывается с таковой в трех остальных клонах было получено, поскольку вставка кДНК выделена из клона 4, гибридизовалась с вставками из клонов 1, 2 и 3 в жестких условиях. кДНК клона 4 была вырезана EcoRI, выделена электрофорезом в геле и мечена 32Р-ник-трансляцией. Способ ник-трансляции был, как описан, Manitis и др. /1982/. Остальные 3 клона были расщеплены ЕсоR1 и перенесены на нитроцеллюлозу после электрофореза в 1% агарозном геле. Никтранслированная проба клона 4 была денатурилована и гибридизована с Саузерн-блоком в условиях, описанных выше для скрининга библиотеки кДНК, за исключением того, что смесь содержала 50% формамида и гибридизацию проводили при 42 С в течение ночи. Фильтр затем отмывали при 60 С в течение ночи. Фильтр затем отмывали при 60 С в 0.1xSSС и авторадиографировали.
IV.А.3 Нуклеотидная последовательность кДНК ГО
кДНК в клонах 1-4 были оперелены по методу Sanger и др. /1977/. По сути, кДНК вырезали из клонов ЕсоRI и выделяли фракционированием по размеру с использованием гель-электрофореза. Есоl–фрагменты рестрикции субклонировали в векторе М13, mp18 и mp19 (Messing /1983/) и секвенировали с использованием дидезокси-метода терминации цепи, Sanger др. /1977/.
Нулкотидная последовательность ЕсоR1–фрагмента /приблизительно 700 п.н./ из клона 4 приведена на фиг. 4. Рестрикционная карта фрагмента показана на фиг. 4В-1. Нуклеотидная последовательность, как и кодированная в ней аминокислотная, показана на фиг. 4В. Положение сайтов рестрикции также указано на фиг. 4В. Фрагмент кДНК в клоне 4 состоит из 1 открытой рамки считывания. 2 из пептидных фрагментов, проанализированных анализом аминокислотной последовательности, кодированы в кДНК ГО клона 4, за исключением того, что 2 из 36 аминокислотных остатков изменены. Аминокислотные последовательности фрагментов показаны на фиг. 1.
Составная кДНК может быть сконструирована из нуклеотидных последовательностей кДНК в клонах 1 и 2, последний из которых, возможно, полноразмерный клон кДНК. Нуклеотидная последовательность составной кДНК приведена на фиг. 5. Фиг. 5А показывает рестриктную карту последовательности. Фиг. 5В показывает составную нуклеотидную последовательность, полученную из клонов, и указывает сайты рестрикции. Также на фиг. 5В показаны аминокислоты, кодированные последовательностью. Из последовательности может быть определено, что зрелый белок состоит из 583 аминокислот; аминокислотная последовательность содержит только 3 остатка Цистеина и 8 консенсусов сайта гликозилирования. В аминокислотной последовательности есть препропоследовательность из 22 аминокислот с единственным основным сайтом расщепления /Арг-Сер/ у начала зрелой последовательности.
Свидетельство того, что составная последовательность кДНК кодирует ГО, было получено сравнение аминокислотных последовательностей пептидных фрагментов из очищенной ГО /см. раздел IV.42/ с кодированными составной кДНК. Это сравнение приведено на фиг. 6, в котором выделенная аминокислотная последовательность обозначена поверх нуклеотидной последовательности. Аминокислотные последовательности, соответствующие последовательностям пепетидных фрагментов из очищенной ГО, подчеркнуты. Расхождения в выведенной последовательности и последовательности фрагментов из очищенной ГО также указаны. Из фиг. 6 можно видеть, что очень мало расхождений между последовательностями, выведенными из кДНК, и таковыми выделенных пептидов ГО.
На фиг. 6 также представлены данные о молекулярном весе полипептида, включающего сигнальный пептид, и о кодовом выборе в A. niger, основывающиеся на нуклеотидной последовательности, кодирующей ГО.
Из составной последовательности ДНК может быть предсказано, что зрелый негликозилированный полипептид ГО имеет массу 63300. Зрелый пептид содержит 8 сайтов консенсуса гликозилирования. Полагая 2 кД углевода на каждый сайт, мол. вес гликозилированного мономера ГО будет 79 кД. Это соответствует наблюдаемому молекулярному весу мономера ГО, который составляет 75 кД. Более того, аминокислотный состав, выведенный из последовательности кДНК, согласуется с аминокислотным составом, указанным в литературе. Указанный аминокислотный состав был подтвержден в отдельных экспериментах /не показано/. В дополнение, как показано ниже в секции IV, экспрессия кДНК активную дает глюкозоксидазу.
IV.В. Выделение и секвенирование геномных последовательностей, кодирующих ГО.
Олигонуклеотидные пробы, описанные выше в разделе IV.А.2, и ник-транслированные фрагменты кДНК ГО, выделенные, как описано в разделе IV.А.2, были использованы для выделения геномного клона А. niger из библиотеки А.niger на основе pBR322 в штамме E.coli ДН5 IV.В.1. Конструирование библиотеки А. niger и выделение геномных клонов, кодирующих ГО.
Геномную ДНК получали из клеток А. niger методу Boel и др. /1984/. ДНК /50 мкг/ обрабатывали Sau 3a при условиях, которые дают частичное расщепление /1 единица Sau 3a в объеме 1 мл при 37 С в 0.1xSSС и авторадиографировали.
IV.А.3 Нуклеотидная последовательность кДНК ГО
кДНК в клонах 1-4 были оперелены по методу Sanger и др. /1977/. По сути, кДНК вырезали из клонов ЕсоRI и выделяли фракционированием по размеру с использованием гель-электрофореза. Есоl–фрагменты рестрикции субклонировали в векторе М13, mp18 и mp19 (Messing /1983/) и секвенировали с использованием дидезокси-метода терминации цепи, Sanger др. /1977/.
Нулкотидная последовательность ЕсоR1–фрагмента /приблизительно 700 п.н./ из клона 4 приведена на фиг. 4. Рестрикционная карта фрагмента показана на фиг. 4В-1. Нуклеотидная последовательность, как и кодированная в ней аминокислотная, показана на фиг. 4В. Положение сайтов рестрикции также указано на фиг. 4В. Фрагмент кДНК в клоне 4 состоит из 1 открытой рамки считывания. 2 из пептидных фрагментов, проанализированных анализом аминокислотной последовательности, кодированы в кДНК ГО клона 4, за исключением того, что 2 из 36 аминокислотных остатков изменены. Аминокислотные последовательности фрагментов показаны на фиг. 1.
Составная кДНК может быть сконструирована из нуклеотидных последовательностей кДНК в клонах 1 и 2, последний из которых, возможно, полноразмерный клон кДНК. Нуклеотидная последовательность составной кДНК приведена на фиг. 5. Фиг. 5А показывает рестриктную карту последовательности. Фиг. 5В показывает составную нуклеотидную последовательность, полученную из клонов, и указывает сайты рестрикции. Также на фиг. 5В показаны аминокислоты, кодированные последовательностью. Из последовательности может быть определено, что зрелый белок состоит из 583 аминокислот; аминокислотная последовательность содержит только 3 остатка Цистеина и 8 консенсусов сайта гликозилирования. В аминокислотной последовательности есть препропоследовательность из 22 аминокислот с единственным основным сайтом расщепления /Арг-Сер/ у начала зрелой последовательности.
Свидетельство того, что составная последовательность кДНК кодирует ГО, было получено сравнение аминокислотных последовательностей пептидных фрагментов из очищенной ГО /см. раздел IV.42/ с кодированными составной кДНК. Это сравнение приведено на фиг. 6, в котором выделенная аминокислотная последовательность обозначена поверх нуклеотидной последовательности. Аминокислотные последовательности, соответствующие последовательностям пепетидных фрагментов из очищенной ГО, подчеркнуты. Расхождения в выведенной последовательности и последовательности фрагментов из очищенной ГО также указаны. Из фиг. 6 можно видеть, что очень мало расхождений между последовательностями, выведенными из кДНК, и таковыми выделенных пептидов ГО.
На фиг. 6 также представлены данные о молекулярном весе полипептида, включающего сигнальный пептид, и о кодовом выборе в A. niger, основывающиеся на нуклеотидной последовательности, кодирующей ГО.
Из составной последовательности ДНК может быть предсказано, что зрелый негликозилированный полипептид ГО имеет массу 63300. Зрелый пептид содержит 8 сайтов консенсуса гликозилирования. Полагая 2 кД углевода на каждый сайт, мол. вес гликозилированного мономера ГО будет 79 кД. Это соответствует наблюдаемому молекулярному весу мономера ГО, который составляет 75 кД. Более того, аминокислотный состав, выведенный из последовательности кДНК, согласуется с аминокислотным составом, указанным в литературе. Указанный аминокислотный состав был подтвержден в отдельных экспериментах /не показано/. В дополнение, как показано ниже в секции IV, экспрессия кДНК активную дает глюкозоксидазу.
IV.В. Выделение и секвенирование геномных последовательностей, кодирующих ГО.
Олигонуклеотидные пробы, описанные выше в разделе IV.А.2, и ник-транслированные фрагменты кДНК ГО, выделенные, как описано в разделе IV.А.2, были использованы для выделения геномного клона А. niger из библиотеки А.niger на основе pBR322 в штамме E.coli ДН5 IV.В.1. Конструирование библиотеки А. niger и выделение геномных клонов, кодирующих ГО.
Геномную ДНК получали из клеток А. niger методу Boel и др. /1984/. ДНК /50 мкг/ обрабатывали Sau 3a при условиях, которые дают частичное расщепление /1 единица Sau 3a в объеме 1 мл при 37 С в течение 50 мин/ и реакция была остановлена добавлением ЭДТА. Расщепленная ДНК прогоняли через препаративный 1% агарозный гель и выделяли ДНК размером 7-10 т.п.н. Эту ДНК лигировали в pBR322, линеаризованную BamHI, обработанную щелочной фосфатазой и выделенную из геля. Результирующую лигированную ДНК трансформировали в Е. coli и высеяли на 10 больших чашек. Всего было получено 340000 трансформантов. С каждой чашки отдельно выделяли плазмидную ДНК, дающую приблизительно 3500 рекобинантов, 60.000 колоний из одной порции рассеяли сделали дупликатные нитроцеллюлозные реплики. 600-нуклеотидный фрагмен Ncol–EcoRI из клона 2 кДНК был ник-транслирован и использован в качестве пробы при условиях, описанных выше. После авторадиографии было получено 4 потенциальных клона, один из которых 17А, был правильным, как показано позднее Саузерн-блотингом и секвенированием.
IV.В.2. Анализ длины фрагментов рестрикции геномной ДНК, кодирующей ГО.
Присутствие или отсутствие нитронов в геномных последовательностях может быть определено сравнением размеров фрагментов кДНК и геномной ДНК, полученных при рестрикции. Фрагменты анализировали методом Саузерна с использованием пробы, детектирующей последовательности, которые кодируют ГО.
Геномный клон 17а и клон кДНК рBRlambda 2А оба были расщеплены Ncol, которая режет 4 раза кДНК, давая конкретный паттерн небольших фрагментов. После анализа как в агарозных, так и в акриламидных гелях картина рестрикции Ncol оказалась одинаковой для обоих клонов. После этого ДНК клона 17a была расщеплена EcoRI, xhoI, SalI и HindIII; расщепление производилось одиночно и в парных комбинациях. Перевары подвергали электрофорезу в агарозных гелях и переносили на нитроцеллюлозные фильтры. Фильтры анализировали при помощи 600 п.н. Ncol–EcoRI-фрагмента из 5 С в течение 50 мин/ и реакция была остановлена добавлением ЭДТА. Расщепленная ДНК прогоняли через препаративный 1% агарозный гель и выделяли ДНК размером 7-10 т.п.н. Эту ДНК лигировали в pBR322, линеаризованную BamHI, обработанную щелочной фосфатазой и выделенную из геля. Результирующую лигированную ДНК трансформировали в Е. coli и высеяли на 10 больших чашек. Всего было получено 340000 трансформантов. С каждой чашки отдельно выделяли плазмидную ДНК, дающую приблизительно 3500 рекобинантов, 60.000 колоний из одной порции рассеяли сделали дупликатные нитроцеллюлозные реплики. 600-нуклеотидный фрагмен Ncol–EcoRI из клона 2 кДНК был ник-транслирован и использован в качестве пробы при условиях, описанных выше. После авторадиографии было получено 4 потенциальных клона, один из которых 17А, был правильным, как показано позднее Саузерн-блотингом и секвенированием.
IV.В.2. Анализ длины фрагментов рестрикции геномной ДНК, кодирующей ГО.
Присутствие или отсутствие нитронов в геномных последовательностях может быть определено сравнением размеров фрагментов кДНК и геномной ДНК, полученных при рестрикции. Фрагменты анализировали методом Саузерна с использованием пробы, детектирующей последовательности, которые кодируют ГО.
Геномный клон 17а и клон кДНК рBRlambda 2А оба были расщеплены Ncol, которая режет 4 раза кДНК, давая конкретный паттерн небольших фрагментов. После анализа как в агарозных, так и в акриламидных гелях картина рестрикции Ncol оказалась одинаковой для обоих клонов. После этого ДНК клона 17a была расщеплена EcoRI, xhoI, SalI и HindIII; расщепление производилось одиночно и в парных комбинациях. Перевары подвергали электрофорезу в агарозных гелях и переносили на нитроцеллюлозные фильтры. Фильтры анализировали при помощи 600 п.н. Ncol–EcoRI-фрагмента из 5 -половины кДНК и 1100 п.н. EcoRI-фрагмента из 3 -половины кДНК и 1100 п.н. EcoRI-фрагмента из 3 -половины геномной последовательности в клоне 17а. Эти пробы метили 32Р ник-трансляцией. Во всех случаях геномная карта была конгруэнтна карте кДНК.
В дополнение геномная ДНК из А.niger была расщеплена теми же ферментами, блоттирована и гибридизована с теми же пробами. Результаты дали ту же картину, которая наблюдалась с клоном 17а. Эти результаты показывают, что перестройки и/или делеции не произошли во время процедуры клонирования.
Анализ Саузерн-блоттингом показал, что фрагменты рестрикции, детектируемые пробами, имели одинаковый размер в кДНКах ГО, геномных клонах и в геномных последовательностях ДНК, выделенных из A. niger. Это дает основание для неожиданного результата, что геномная ДНК А. niger, кодирующая ГО, лишена интронных последовательностей.
IV.В.3. Нуклеотидная последовательность района промотора ГО.
Предполагалось, что район, фланкирующий 5 -половины геномной последовательности в клоне 17а. Эти пробы метили 32Р ник-трансляцией. Во всех случаях геномная карта была конгруэнтна карте кДНК.
В дополнение геномная ДНК из А.niger была расщеплена теми же ферментами, блоттирована и гибридизована с теми же пробами. Результаты дали ту же картину, которая наблюдалась с клоном 17а. Эти результаты показывают, что перестройки и/или делеции не произошли во время процедуры клонирования.
Анализ Саузерн-блоттингом показал, что фрагменты рестрикции, детектируемые пробами, имели одинаковый размер в кДНКах ГО, геномных клонах и в геномных последовательностях ДНК, выделенных из A. niger. Это дает основание для неожиданного результата, что геномная ДНК А. niger, кодирующая ГО, лишена интронных последовательностей.
IV.В.3. Нуклеотидная последовательность района промотора ГО.
Предполагалось, что район, фланкирующий 5 -конец последовательности, кодирующий ГО, содержит промоторные последовательности гена. Этот район и прилежащий район, кодирующий NH2-район ГО, были выделены в виде полинуклеотидного фрагмента из геномного клона ГО, и была определена нуклеотидная последовательность выделенного фрагмента.
Промоторный район гена ГО был выделен из геномного клона 17a /см. раздел IV.В.4 о получении геномных клонов/. Фрагмернт был вырезан из последовательностей вектора рВR322 расщеплением EcoRI и SalI, фрагмент размером около 609 п.н. был выделен гель-электрофорезом. Выделенный фрагмент был клонирован в векторы M13 и секвенирован по методу дидезокси-терминирования цепи /см. раздел IV.А.3./. Последовательность этого района показана на фиг. 7. Рестриктная карта последовательности показана на фиг.7А; последовательность и сайты рестрикции показаны на фиг. 7В. Также на фиг. 7B показана аминокислотная последовательность NH2-концевого района ГО, кодируемая в геномном клоне.
IV.С. Конструирование векторов для экспрессии кДНК ГО в дрожжах.
Было сконструировано 2 вектора экспрессии для продукции ГО в дрожжах. В этих векторах экспрессии последовательности, кодирующие ГО, операционно связаны с последовательностями для транскрипции и экспрессии полипептида ГО. Оба вектора содержат гибридный промотор ADH2/GAP для регулируемой экспрессии. Кроме того, либо лидерная последовательность -конец последовательности, кодирующий ГО, содержит промоторные последовательности гена. Этот район и прилежащий район, кодирующий NH2-район ГО, были выделены в виде полинуклеотидного фрагмента из геномного клона ГО, и была определена нуклеотидная последовательность выделенного фрагмента.
Промоторный район гена ГО был выделен из геномного клона 17a /см. раздел IV.В.4 о получении геномных клонов/. Фрагмернт был вырезан из последовательностей вектора рВR322 расщеплением EcoRI и SalI, фрагмент размером около 609 п.н. был выделен гель-электрофорезом. Выделенный фрагмент был клонирован в векторы M13 и секвенирован по методу дидезокси-терминирования цепи /см. раздел IV.А.3./. Последовательность этого района показана на фиг. 7. Рестриктная карта последовательности показана на фиг.7А; последовательность и сайты рестрикции показаны на фиг. 7В. Также на фиг. 7B показана аминокислотная последовательность NH2-концевого района ГО, кодируемая в геномном клоне.
IV.С. Конструирование векторов для экспрессии кДНК ГО в дрожжах.
Было сконструировано 2 вектора экспрессии для продукции ГО в дрожжах. В этих векторах экспрессии последовательности, кодирующие ГО, операционно связаны с последовательностями для транскрипции и экспрессии полипептида ГО. Оба вектора содержат гибридный промотор ADH2/GAP для регулируемой экспрессии. Кроме того, либо лидерная последовательность  -фактора S. cerevisiae, либо препропоследовательность ГО слиты с последовательностью, кодирующей зрелую ГО, для того, чтобы вызвать секрецию.
кДНК ГО из клона 2 /см. раздел IV.А.2/ была вырезана из -фактора S. cerevisiae, либо препропоследовательность ГО слиты с последовательностью, кодирующей зрелую ГО, для того, чтобы вызвать секрецию.
кДНК ГО из клона 2 /см. раздел IV.А.2/ была вырезана из  gt10 как HindIII – BglII-фрагмент. Образовавшийся фрагмент рестракции, который содержит некоторое количество фланкирующей ДНК gt10 как HindIII – BglII-фрагмент. Образовавшийся фрагмент рестракции, который содержит некоторое количество фланкирующей ДНК  gt10 был вставлен между Hind III и BamHI сайтами рBR322, что дало вектор pBR–lambda–GO2. Схема конструирования векторов экспрессии, использующие последовательности кДНК ГО в рBR-lambda-GO2, показаны на фиг. 8.
IV.С.1. Конструирование кассеты экспрессии в pAGSGO GO.
Кассета экспрессии, содержащаяся в плазмиде, реплицирующейся в E.coli, в которой последовательности, кодирующие ГО, операционно связаны с контролирующими последовательностями, которые включают гибридный промотор дрожжей ADH/GAP, терминатор GAP, секреторный сигнал, полученный из гена ГО А. niger, была сконструирована следующим образом.
ДНК рBR lambda-2a была расщеплена SalI, который режет приблизительно в 129 п.н. от N-конца ГО-кодирующей последовательности и режет 1 раз в рBR322. Синтетический буплекс, кодирующий N-конец зрелого ГО, был получен и лигирован с этим переваром. Последовательность деплекса была следующей:
5 gt10 был вставлен между Hind III и BamHI сайтами рBR322, что дало вектор pBR–lambda–GO2. Схема конструирования векторов экспрессии, использующие последовательности кДНК ГО в рBR-lambda-GO2, показаны на фиг. 8.
IV.С.1. Конструирование кассеты экспрессии в pAGSGO GO.
Кассета экспрессии, содержащаяся в плазмиде, реплицирующейся в E.coli, в которой последовательности, кодирующие ГО, операционно связаны с контролирующими последовательностями, которые включают гибридный промотор дрожжей ADH/GAP, терминатор GAP, секреторный сигнал, полученный из гена ГО А. niger, была сконструирована следующим образом.
ДНК рBR lambda-2a была расщеплена SalI, который режет приблизительно в 129 п.н. от N-конца ГО-кодирующей последовательности и режет 1 раз в рBR322. Синтетический буплекс, кодирующий N-конец зрелого ГО, был получен и лигирован с этим переваром. Последовательность деплекса была следующей:
5 AGATCTAATGGСATTGAAGCTTCCCTCCTGACTGATCCCAAGGATGTCT
ATTACCGTAACTTCGAAGGGAGGACTGACTAGGGTTCCTACAGA
CCGGCCGCACACGG 3 AGATCTAATGGСATTGAAGCTTCCCTCCTGACTGATCCCAAGGATGTCT
ATTACCGTAACTTCGAAGGGAGGACTGACTAGGGTTCCTACAGA
CCGGCCGCACACGG 3 GGCCGGCGTGCCAGCT
Сайт BglII был удобно помещен у N-конца зрелой ГО молчащей мутацией последовательности, кодирующей Арг-Сер. После лигиррования смесь была расщеплена BglII и PstI и 980 п.н. фрагмент, содержащий N-концевую половину кДНК ГО, был выделен гель-электрофорезом.
Фрагмент, содержащий С-концевой фрагмент кДНК ГО, был выделен вырезанием кДНК EcoRI, обработкой вырезанного фрагмента Кленовым и четырьмя дезоксинуклеотидтрифосфатами и лигированием синтетического клинкера с фрагментом. Линкер имел последовательность:
5
GGCCGGCGTGCCAGCT
Сайт BglII был удобно помещен у N-конца зрелой ГО молчащей мутацией последовательности, кодирующей Арг-Сер. После лигиррования смесь была расщеплена BglII и PstI и 980 п.н. фрагмент, содержащий N-концевую половину кДНК ГО, был выделен гель-электрофорезом.
Фрагмент, содержащий С-концевой фрагмент кДНК ГО, был выделен вырезанием кДНК EcoRI, обработкой вырезанного фрагмента Кленовым и четырьмя дезоксинуклеотидтрифосфатами и лигированием синтетического клинкера с фрагментом. Линкер имел последовательность:
5 -GAGATCTС-3 -GAGATCTС-3 Образовавшийся фрагмент был расщеплен BglII и PstI. После этой обработки фрагмент кДНК ГО размером 950 п.н. был выделен гель-электрофорезом.
Фрагмент 980 п.н. и фрагмент 950 п.н. были лигированы. Поскольку лигирование могло происходить по липким концам, полученным как от PstI, так и от BglII, лигированные фрагменты были обработаны BglII, что дало т.о. кДНК ГО, которая содержала липкие концы, могущие образовать сайты BglII.
Вектор рAGAP1 является производным рPGAP1, в котором регулируемый промотор алкогольдегидрогеназы-глицеральдегидрифосфатдегидрогеназы /ADH2-GAP/ замещен на промотор глицеральдегид-3-фосфатдегидрогеназы /GAPDH/. Плазмида pPGAP1 описана в Travis и др. /1985/, в публикации ЕРО №164555 и также в общепризнаном USSN 769197, зарегистриванном 29 июля 1985; эти ссылки включены здесь путем ссылок. В pAGAP1 промотор ADH2-GAP связан с терминатором GAP. Промотор – это 1200 п.н. BamHI-NcoI фрагмент, выделенный из pJS103. Конструкция этого промотора описана в USSN 139632, зарегистрированном 30 декабря 1987, который приписывается настоящему заявителю и который включен здесь путем ссылки. Терминатор GAP – это 900 п.н. BglII-BamHI фрагмент, полученный из pPGAP1. См. публикацию №164556. Фрагмент, связывающий промотор и терминатор: (BglII, former SalI site) (NcoI)
5′ СCATGGGAATTCGTTAGGTCGAGATСТСGАС 3 ‘
GGTACCCTTAAGCAATCCAGCTCTAGAGCTG
Сайты рестрикции, кодированные в последовательности, указаны в скобках. Этот фрагмент может быть замещен интересующим геном.
Для вставления сигнальной последовательности ГО был расщеплен NcoI и BglII, обработан фосфатазой и лигирован со следующим синтетическим дуплексом, кодирующим препропоследовательность ГО: (NcoI 5
Образовавшийся фрагмент был расщеплен BglII и PstI. После этой обработки фрагмент кДНК ГО размером 950 п.н. был выделен гель-электрофорезом.
Фрагмент 980 п.н. и фрагмент 950 п.н. были лигированы. Поскольку лигирование могло происходить по липким концам, полученным как от PstI, так и от BglII, лигированные фрагменты были обработаны BglII, что дало т.о. кДНК ГО, которая содержала липкие концы, могущие образовать сайты BglII.
Вектор рAGAP1 является производным рPGAP1, в котором регулируемый промотор алкогольдегидрогеназы-глицеральдегидрифосфатдегидрогеназы /ADH2-GAP/ замещен на промотор глицеральдегид-3-фосфатдегидрогеназы /GAPDH/. Плазмида pPGAP1 описана в Travis и др. /1985/, в публикации ЕРО №164555 и также в общепризнаном USSN 769197, зарегистриванном 29 июля 1985; эти ссылки включены здесь путем ссылок. В pAGAP1 промотор ADH2-GAP связан с терминатором GAP. Промотор – это 1200 п.н. BamHI-NcoI фрагмент, выделенный из pJS103. Конструкция этого промотора описана в USSN 139632, зарегистрированном 30 декабря 1987, который приписывается настоящему заявителю и который включен здесь путем ссылки. Терминатор GAP – это 900 п.н. BglII-BamHI фрагмент, полученный из pPGAP1. См. публикацию №164556. Фрагмент, связывающий промотор и терминатор: (BglII, former SalI site) (NcoI)
5′ СCATGGGAATTCGTTAGGTCGAGATСТСGАС 3 ‘
GGTACCCTTAAGCAATCCAGCTCTAGAGCTG
Сайты рестрикции, кодированные в последовательности, указаны в скобках. Этот фрагмент может быть замещен интересующим геном.
Для вставления сигнальной последовательности ГО был расщеплен NcoI и BglII, обработан фосфатазой и лигирован со следующим синтетическим дуплексом, кодирующим препропоследовательность ГО: (NcoI 5 ) САТGСАGACТCTCCTTGTCGAGCCTTGTGGTCTCCCTCGC
GTCTGAGAGGAACAGAGCTCGGAACACCAGAGGGAGCG
TGCGGCCCTGCCACACTACATCA 3 ) САТGСАGACТCTCCTTGTCGAGCCTTGTGGTCTCCCTCGC
GTCTGAGAGGAACAGAGCTCGGAACACCAGAGGGAGCG
TGCGGCCCTGCCACACTACATCA 3 (BglIII)
ACGCCGGGACGGTGTGATGTAGTCTAG
XhoI сайт был введен с использованием молчащих мутаций в целях скрининга. Образовавшаяся плазмида, pAGSGO, содержала BglII сайт ниже по ходу транскрипции от препропоследовательности, в который могла быть инсертирована последовательность кДНК ГО.
Вставление фрагмента кДНК ГО в pAGSGO было выполнено расщеплением плазмиды BglII и обработкой фосфатазой, затем лигированием кДНК ГО с линеаризованной плазмидой. Образовавшаяся плазмида была названа pAGSGO GO.
IV.С.2. Конструирование кассеты экспрессии в pAGalpha GO.
Конструирование кассеты экспрессии, содержащейся в плазмиде, реплицирующейся в E.coli, в которой последовательности, кодирующие ГО, операционно связаны с контролирующими последовательностями, которые включают дрожжевой гибридный промотор ADH2/GAP и дрожжевой (BglIII)
ACGCCGGGACGGTGTGATGTAGTCTAG
XhoI сайт был введен с использованием молчащих мутаций в целях скрининга. Образовавшаяся плазмида, pAGSGO, содержала BglII сайт ниже по ходу транскрипции от препропоследовательности, в который могла быть инсертирована последовательность кДНК ГО.
Вставление фрагмента кДНК ГО в pAGSGO было выполнено расщеплением плазмиды BglII и обработкой фосфатазой, затем лигированием кДНК ГО с линеаризованной плазмидой. Образовавшаяся плазмида была названа pAGSGO GO.
IV.С.2. Конструирование кассеты экспрессии в pAGalpha GO.
Конструирование кассеты экспрессии, содержащейся в плазмиде, реплицирующейся в E.coli, в которой последовательности, кодирующие ГО, операционно связаны с контролирующими последовательностями, которые включают дрожжевой гибридный промотор ADH2/GAP и дрожжевой  -фактор как секретоный сигнал, было сходно с конструированием pAGSGO GO /раздел IV.С.1./ за исключением следующего.
Плазмида, в которую был лигирован фрагмент кДНК ГО, была pCBR, которая сходна с рAGAP1 за исключением того, что -фактор как секретоный сигнал, было сходно с конструированием pAGSGO GO /раздел IV.С.1./ за исключением следующего.
Плазмида, в которую был лигирован фрагмент кДНК ГО, была pCBR, которая сходна с рAGAP1 за исключением того, что  -факторный лидер был вставлен между промотором и терминатором с уникальным BglII сайтом у двуосновного сайта процессинга /Лиз-Арг, или в однобуквенном коде К-Р/ для КЕХ2. Плазмида, образовавшаяся при инсерции фрагмента кДНК ГО в pCBR, названа pAGalpha GO.
IV.С.3. Конструирование дрожжевых векторов экспрессии, кодирующих ГО.
Дрожжевые векторы экспрессии, в которых последовательность ГО операционно связана с последовательностями, которые контролируют экспрессию и секрецию полипептида ГО, были сконструированы вырезанием BamHI кассет экспрессии из pAGGO GO и pAGalpha GO и вставлнием кассет экспрессии в уникальный BamHI сайт плазмиды рАВ24.
deltaRi была линеаризована расщеплением ClaI и лигирована с полной двухмикронной плазмидой, которая была линеаризована ClaI. Образовавшаяся плазмида pCBou была затем расщеплена XbaI и 8605 п.н. векторный фрагмент был выделен из геля. Этот выделенный XbaI фрагмент был лигирован с 4460 п.н. XbaI фрагментом, содержащим ген LEU2d, выделенным из pCТ/I; ориентация гена LEU2d в том же направлении, что ген URA3.
Для конструирования дрожжевых векторов экспрессии кассеты экспрессии вырезали из pAGSGO GO и pAGalpha GO расщеплением BamHI и плазмиду рАВ24 линеаризовали той же рестриктазой и обрабатывали фосфатазой. Вырезанные кассеты экспрессии выделяли гель-электрофорезом. Линеаризованная плазмида была лигирована с либо кассетой экспрессии из pAGSGO GO, что дало вектор pAB244GSGO GO, или с кассетой экспрессии из рАСalpha GO, что дало вектор рАВ24АGalpha GO.
IV.D. Экспрессия ГО в дрожжах с pAP24AGSGO GO и с рАВ24alpha GO-1.
Клоны двух из векторов экспрессии для продукции ГО были выделены, т.е. рАВ24АGSGO и рАB24AGalpha GO. Векторы были сконструированы, как описано в разделе IV.С. Оба вектора содержали гибридный промотор ADH2GAP для регулируемой транскрипции и либо лидер -факторный лидер был вставлен между промотором и терминатором с уникальным BglII сайтом у двуосновного сайта процессинга /Лиз-Арг, или в однобуквенном коде К-Р/ для КЕХ2. Плазмида, образовавшаяся при инсерции фрагмента кДНК ГО в pCBR, названа pAGalpha GO.
IV.С.3. Конструирование дрожжевых векторов экспрессии, кодирующих ГО.
Дрожжевые векторы экспрессии, в которых последовательность ГО операционно связана с последовательностями, которые контролируют экспрессию и секрецию полипептида ГО, были сконструированы вырезанием BamHI кассет экспрессии из pAGGO GO и pAGalpha GO и вставлнием кассет экспрессии в уникальный BamHI сайт плазмиды рАВ24.
deltaRi была линеаризована расщеплением ClaI и лигирована с полной двухмикронной плазмидой, которая была линеаризована ClaI. Образовавшаяся плазмида pCBou была затем расщеплена XbaI и 8605 п.н. векторный фрагмент был выделен из геля. Этот выделенный XbaI фрагмент был лигирован с 4460 п.н. XbaI фрагментом, содержащим ген LEU2d, выделенным из pCТ/I; ориентация гена LEU2d в том же направлении, что ген URA3.
Для конструирования дрожжевых векторов экспрессии кассеты экспрессии вырезали из pAGSGO GO и pAGalpha GO расщеплением BamHI и плазмиду рАВ24 линеаризовали той же рестриктазой и обрабатывали фосфатазой. Вырезанные кассеты экспрессии выделяли гель-электрофорезом. Линеаризованная плазмида была лигирована с либо кассетой экспрессии из pAGSGO GO, что дало вектор pAB244GSGO GO, или с кассетой экспрессии из рАСalpha GO, что дало вектор рАВ24АGalpha GO.
IV.D. Экспрессия ГО в дрожжах с pAP24AGSGO GO и с рАВ24alpha GO-1.
Клоны двух из векторов экспрессии для продукции ГО были выделены, т.е. рАВ24АGSGO и рАB24AGalpha GO. Векторы были сконструированы, как описано в разделе IV.С. Оба вектора содержали гибридный промотор ADH2GAP для регулируемой транскрипции и либо лидер  -фактора S. cerivisiae /pAB24alpha GO/, или препропоследовательность ГО, слитую с последовательностью, кодирующей зрелую ГО /рАВ24SGO GO/. Однако последовавший анализ нуклеотидных последовательностей, кодирующих ГО, выявил присутствие в этих клонах мутанных последовательностей.
IV.D 1. Экспрессия с pAB24alpha GO-10 с pAB24GO GO-1.
Штаммы дрожжей GRF 180 и АВ 110 трансформировали указанным клонами этих плазмид по методу Ainnen /1978/ и отбирали прототрофов по лейцину. Трансформанты инокулировали в лейцин-селективную среду, содержащую 8% глюкозы на 48 часов. Инокуляты были разведены до начальной А65О=0.05 в среде экспрессии УЕР, содержащей 2% глюкозы. Культуры растили при 30 -фактора S. cerivisiae /pAB24alpha GO/, или препропоследовательность ГО, слитую с последовательностью, кодирующей зрелую ГО /рАВ24SGO GO/. Однако последовавший анализ нуклеотидных последовательностей, кодирующих ГО, выявил присутствие в этих клонах мутанных последовательностей.
IV.D 1. Экспрессия с pAB24alpha GO-10 с pAB24GO GO-1.
Штаммы дрожжей GRF 180 и АВ 110 трансформировали указанным клонами этих плазмид по методу Ainnen /1978/ и отбирали прототрофов по лейцину. Трансформанты инокулировали в лейцин-селективную среду, содержащую 8% глюкозы на 48 часов. Инокуляты были разведены до начальной А65О=0.05 в среде экспрессии УЕР, содержащей 2% глюкозы. Культуры растили при 30 С, 300 об/мин, аликвоты отбирали каждые 24 часа. Клетки отделяли от среды роста центрифугированием в микроцентрифуге при 1400 об/мин, 1 мин, и определяли активность глюкозооксидазы, присутствующую в среде и в клеточных экстрактах, с использованием в качества стандарта глюкозооксидазы, полученной от Sigma. Клеточные экстракты были получены встряхиванием клеток со стеклянными шариками. То есть осадки клеток смешивали с равным объемом промытых кислотой стеклянных шариков в буфере лизиса, содержащем 10 мМ трис, pH 8, и встряхивали 5 х 1 мин, выдерживая 1 мин на льду между встряхиваниями. Нерастворимый клеточный дебрис удаляли центрифугированием в микроцентрифуге при 14000 об/мин при 4 С, 300 об/мин, аликвоты отбирали каждые 24 часа. Клетки отделяли от среды роста центрифугированием в микроцентрифуге при 1400 об/мин, 1 мин, и определяли активность глюкозооксидазы, присутствующую в среде и в клеточных экстрактах, с использованием в качества стандарта глюкозооксидазы, полученной от Sigma. Клеточные экстракты были получены встряхиванием клеток со стеклянными шариками. То есть осадки клеток смешивали с равным объемом промытых кислотой стеклянных шариков в буфере лизиса, содержащем 10 мМ трис, pH 8, и встряхивали 5 х 1 мин, выдерживая 1 мин на льду между встряхиваниями. Нерастворимый клеточный дебрис удаляли центрифугированием в микроцентрифуге при 14000 об/мин при 4 С. Результаты по активной глюкозооксидазе, экспрессированной после 72 часов роста, показаны в табл. 1. В таблице символ “nd” означает, что активность не была определена. С. Результаты по активной глюкозооксидазе, экспрессированной после 72 часов роста, показаны в табл. 1. В таблице символ “nd” означает, что активность не была определена.
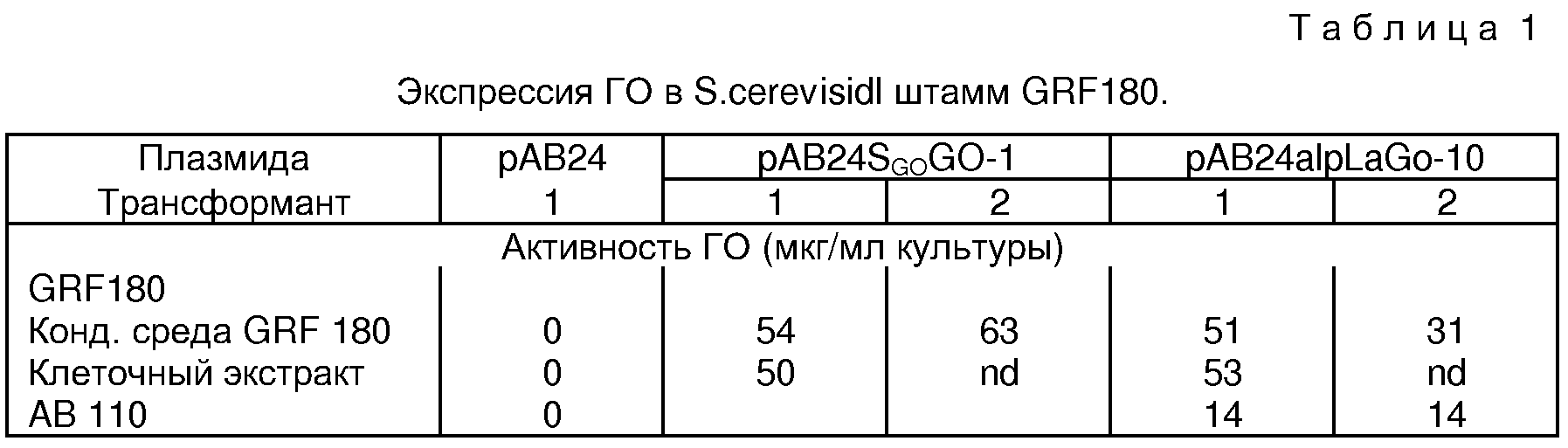 Результаты в табл. 1 указывают, что ГО, кодированная в векторах экспрессии, экспрессируется в дрожжах, и что высокие уровни активности ГО /более 25 мкг-мл/ секретировались в среду. Детектируемая активность не была обнаружена в контрольных трансформантах, трансформированных рАВ24. Помимо высокого уровня секретированной активности ГО лишь около 50% общей активности ГО секретируется, что предполагает, что общий синтез ГО в этих трансформантах очень высок, т.е. в некоторых случаях составляет более 100 мкг/мл. Более того, как ни удивительно, относительно дрожжевого
Результаты в табл. 1 указывают, что ГО, кодированная в векторах экспрессии, экспрессируется в дрожжах, и что высокие уровни активности ГО /более 25 мкг-мл/ секретировались в среду. Детектируемая активность не была обнаружена в контрольных трансформантах, трансформированных рАВ24. Помимо высокого уровня секретированной активности ГО лишь около 50% общей активности ГО секретируется, что предполагает, что общий синтез ГО в этих трансформантах очень высок, т.е. в некоторых случаях составляет более 100 мкг/мл. Более того, как ни удивительно, относительно дрожжевого  -фактора секреторный сигнал из A. niger представляется эффективной контролирующей последовательностью для секреции полипептида в S. cerevisiae.
С использованием сходной процедуры была сравнена экспрессия ГО, когда вектор был трансформирован в GRF 180 и AB110. Результаты этого сравнения показывают, что штамм GRF 180 предпочтительнее, чем штамм AВ110 как для общей экспрессии, так и для секреции ГО.
IV. D2. Характеристика экспрессированных полипептидов
IV. D2.A. Определение мутаций в экспрессированных полипептидах.
Определение мутаций в полипептидах, экспрессированных в разделе IV. D1, проводилось анализом последовательности ДНК N-концов генов ГО в кассетах экспрессии. Фрагменты, которые были секвенированы, были вырезаны расщеплением векторов Sal I и Sac I и образовавшиеся куски в 750 п.н. или 940 п.н., полученные из рАВ24SGO GO и pAB24alpha GO-10 соответственно, были выделены гель-электрофорезом. Образовавшиеся фрагменты были клонированы в M13mp18 и подвергнуты дидезоксисеквенированию. Последовательности были транслированы в аминокислоты, кодированные в них, и те были сравнены со сравнимыми последовательностями, кодированными в кДНК. Результаты анализа представлены в табл. 2, где аминокислотные последовательности обозначены в стандартном однобуквенном коде. -фактора секреторный сигнал из A. niger представляется эффективной контролирующей последовательностью для секреции полипептида в S. cerevisiae.
С использованием сходной процедуры была сравнена экспрессия ГО, когда вектор был трансформирован в GRF 180 и AB110. Результаты этого сравнения показывают, что штамм GRF 180 предпочтительнее, чем штамм AВ110 как для общей экспрессии, так и для секреции ГО.
IV. D2. Характеристика экспрессированных полипептидов
IV. D2.A. Определение мутаций в экспрессированных полипептидах.
Определение мутаций в полипептидах, экспрессированных в разделе IV. D1, проводилось анализом последовательности ДНК N-концов генов ГО в кассетах экспрессии. Фрагменты, которые были секвенированы, были вырезаны расщеплением векторов Sal I и Sac I и образовавшиеся куски в 750 п.н. или 940 п.н., полученные из рАВ24SGO GO и pAB24alpha GO-10 соответственно, были выделены гель-электрофорезом. Образовавшиеся фрагменты были клонированы в M13mp18 и подвергнуты дидезоксисеквенированию. Последовательности были транслированы в аминокислоты, кодированные в них, и те были сравнены со сравнимыми последовательностями, кодированными в кДНК. Результаты анализа представлены в табл. 2, где аминокислотные последовательности обозначены в стандартном однобуквенном коде.
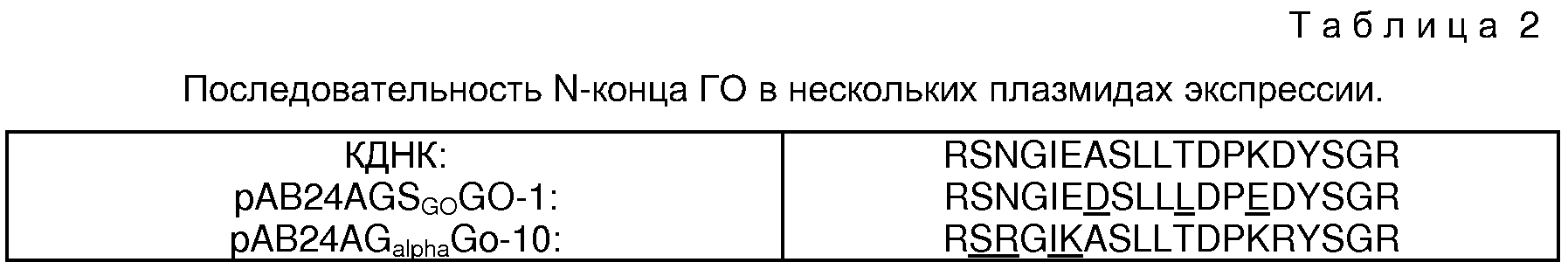 В табл. 2 первый остаток S – первый аминокислотный остаток зрелого полипептида. Аминокислотные последовательности, которые отличаются от кодированных в кДНК, подчеркнуты. Возможно, что эти мутации – результат нечистоты олигонуклеотидных линкеров, использованных в ходе конструирования кассет экспрессии.
IV.D.2.В. Анализ экспрессированных полипептидов ГО гель-электрофорезом в полиакриламидных гелях в присутсии ДДС-Na: влияние эндогликозидазы Н на молекулярный размер.
Предварительный анализ образцов среды из IV.D.1. позволил предположить, что в случае секреторных сигналов как ГО, так и
В табл. 2 первый остаток S – первый аминокислотный остаток зрелого полипептида. Аминокислотные последовательности, которые отличаются от кодированных в кДНК, подчеркнуты. Возможно, что эти мутации – результат нечистоты олигонуклеотидных линкеров, использованных в ходе конструирования кассет экспрессии.
IV.D.2.В. Анализ экспрессированных полипептидов ГО гель-электрофорезом в полиакриламидных гелях в присутсии ДДС-Na: влияние эндогликозидазы Н на молекулярный размер.
Предварительный анализ образцов среды из IV.D.1. позволил предположить, что в случае секреторных сигналов как ГО, так и  -фактора, продуцированная ГО была гипергликозилирована. Это было далее изучено анализом влияния эндогликозидазы Н /ЭндоН/ на молекулярный размер экспрессированных полипептидов. ЭндоН была получена от Bochringer–Mannheim и использована в соответствии с указаниями поставщика. Этот фермент катализирует дегликозилирование гликозилированных полипептидов.
Экспрессия ГО проводилась в трансформантах GRF 180, содержащих векторы экспрессии рАВ24GSGO GO-10 и рАB24AGalpha GO-1, как описано в разделе IV.D 1. После 72 часов роста в среде УЕР, содержащей 2% глюкозы, среды были собраны. Аликвоты приблизительно по 1 мл от каждой среды концентрировали в 10-20 раз центрифугированием с использованием мембран Centricon 10. Белки в концентрированных средах осаждали давлением половинного объема 50% ТХУ, содержащей 2% дезоксихолата в качестве носителя /ТХУ/ДОХ/. Белковые осадки растворяли в 50 мкл воды и половину каждого образца обрабатывали эндоН /1-2 млн. ед/. Оставщуюся часть образца инокулировали при тех же условиях, но в отсутствие ЭндоН. Для сравнения аутентичная глюкозооксидаза из А. niger была обработана тем же образом. После второго осаждения ТХУ/ДОХ для концентрирования образцов полипептида прогоняли в 8% полиакриламидном геле, содержащем ДДС-Na, при условиях, описанных Zaemmli /1970/, и полипептиды в геле визуализировали скрещиванием Кумасси Голубым.
Из гелей было определено, что ГО экспрессирована в дрожжах, гипергликозилирована, поскольку в отсутствии обработки ЭндоН полипептиды продвигаются меньше, чем стандартная ГО. Однако после обработки ЭндоН дрожжевые продукты движутся в виде дублета с кажущимся молекулярным весом 68-70 кДа; такой же дублет наблюдается у обработанной ЭндоН стандартной ГО.
В отсутствие обработки ЭндоН полипептид, экспрессированный и секретированный с вектора, содержащего лидер -фактора, продуцированная ГО была гипергликозилирована. Это было далее изучено анализом влияния эндогликозидазы Н /ЭндоН/ на молекулярный размер экспрессированных полипептидов. ЭндоН была получена от Bochringer–Mannheim и использована в соответствии с указаниями поставщика. Этот фермент катализирует дегликозилирование гликозилированных полипептидов.
Экспрессия ГО проводилась в трансформантах GRF 180, содержащих векторы экспрессии рАВ24GSGO GO-10 и рАB24AGalpha GO-1, как описано в разделе IV.D 1. После 72 часов роста в среде УЕР, содержащей 2% глюкозы, среды были собраны. Аликвоты приблизительно по 1 мл от каждой среды концентрировали в 10-20 раз центрифугированием с использованием мембран Centricon 10. Белки в концентрированных средах осаждали давлением половинного объема 50% ТХУ, содержащей 2% дезоксихолата в качестве носителя /ТХУ/ДОХ/. Белковые осадки растворяли в 50 мкл воды и половину каждого образца обрабатывали эндоН /1-2 млн. ед/. Оставщуюся часть образца инокулировали при тех же условиях, но в отсутствие ЭндоН. Для сравнения аутентичная глюкозооксидаза из А. niger была обработана тем же образом. После второго осаждения ТХУ/ДОХ для концентрирования образцов полипептида прогоняли в 8% полиакриламидном геле, содержащем ДДС-Na, при условиях, описанных Zaemmli /1970/, и полипептиды в геле визуализировали скрещиванием Кумасси Голубым.
Из гелей было определено, что ГО экспрессирована в дрожжах, гипергликозилирована, поскольку в отсутствии обработки ЭндоН полипептиды продвигаются меньше, чем стандартная ГО. Однако после обработки ЭндоН дрожжевые продукты движутся в виде дублета с кажущимся молекулярным весом 68-70 кДа; такой же дублет наблюдается у обработанной ЭндоН стандартной ГО.
В отсутствие обработки ЭндоН полипептид, экспрессированный и секретированный с вектора, содержащего лидер  -фактора дрожжей, имеет кажущейся М.в. 90-120 кДа. Материал, экспрессированный с этого вектора, имеет меньший М.в. и представляется менее гетерогенным, чем полипептид ГО, секретированный из дрожжей с использованием секреторной последовательности ГО. Это верно несмотря на то, что в лидерной последовательности от -фактора дрожжей, имеет кажущейся М.в. 90-120 кДа. Материал, экспрессированный с этого вектора, имеет меньший М.в. и представляется менее гетерогенным, чем полипептид ГО, секретированный из дрожжей с использованием секреторной последовательности ГО. Это верно несмотря на то, что в лидерной последовательности от  -фактора, если 3 дополнительных N-связанных сайта гликозилирования. Таким образом, секреция под контролем лидера -фактора, если 3 дополнительных N-связанных сайта гликозилирования. Таким образом, секреция под контролем лидера  -фактора может быть более эффективной. Кроме того, после обработки ЭндоН материал с кажущимся мол. весом, соответствующим таковому лидеру -фактора может быть более эффективной. Кроме того, после обработки ЭндоН материал с кажущимся мол. весом, соответствующим таковому лидеру  -фактора, слитого с ГО, был обнаружен в малом количестве или не обнаружен вообще; это предлагает, что процессинг этого слитого белка КЕХ2 весьма эффективен.
Необходимо отметить, что обнаружение того, что препропоследовательность ГО функционирует как секреторный сигнал в S. cerevisiae – удивительный результат.
IV.Е. Влияние ЭндоН на активность ГО.
Для определения влияния степени гликозилирования на активность ГО, фермент которой был экспрессирован в дрожжах и секретирован из них, как и фермент, полученный из А. niger, были обработаны ЭндоН. Определялось влияние удаления гликозильных групп на ферментативную активность ГО.
Секретированные полипептиды ГО, экспрессированные в дрожжах, были получены, и кондиционированные среды, содержащие белки, были концентрированы, как описано в разделе IV. После концентрирования каждый образец разделяли на 3 аликвоты. Одну аликвоту использовали для определения исходной активности ГО. Оставшиеся 2 аликвоты инкубировали при 37 -фактора, слитого с ГО, был обнаружен в малом количестве или не обнаружен вообще; это предлагает, что процессинг этого слитого белка КЕХ2 весьма эффективен.
Необходимо отметить, что обнаружение того, что препропоследовательность ГО функционирует как секреторный сигнал в S. cerevisiae – удивительный результат.
IV.Е. Влияние ЭндоН на активность ГО.
Для определения влияния степени гликозилирования на активность ГО, фермент которой был экспрессирован в дрожжах и секретирован из них, как и фермент, полученный из А. niger, были обработаны ЭндоН. Определялось влияние удаления гликозильных групп на ферментативную активность ГО.
Секретированные полипептиды ГО, экспрессированные в дрожжах, были получены, и кондиционированные среды, содержащие белки, были концентрированы, как описано в разделе IV. После концентрирования каждый образец разделяли на 3 аликвоты. Одну аликвоту использовали для определения исходной активности ГО. Оставшиеся 2 аликвоты инкубировали при 37 С в течение ночи в Х50 мкл раствора, содержащего 0,2 М цитрат Na, рН 6,0 12% ДДС-Na и 1 мМ фенилметилсульфонилфторид /ФМСФ/. Одна аликвота инкубировалась с ЭндоН, и другая инкубировалась без ЭндоН. После инкубации в каждом из 3 образцов определялась активность ГО. Кроме того, части аликвот осаждали ТХУ/ДОХ и канализировали электрофорезом в 8% полиакриламидном геле в присутствии ДДС-Na.
Результаты /не приведены/ были следующими 1 /активность ГО в полипептидах, секретированных из рекомбинантных дрожжей, как и таковых из А. niger, стабильна при 37 С в течение ночи в Х50 мкл раствора, содержащего 0,2 М цитрат Na, рН 6,0 12% ДДС-Na и 1 мМ фенилметилсульфонилфторид /ФМСФ/. Одна аликвота инкубировалась с ЭндоН, и другая инкубировалась без ЭндоН. После инкубации в каждом из 3 образцов определялась активность ГО. Кроме того, части аликвот осаждали ТХУ/ДОХ и канализировали электрофорезом в 8% полиакриламидном геле в присутствии ДДС-Na.
Результаты /не приведены/ были следующими 1 /активность ГО в полипептидах, секретированных из рекомбинантных дрожжей, как и таковых из А. niger, стабильна при 37 С в течение 20 часов в разбавленном ДДС-Na2/ обработка ЭндоН не инактивирует сколько-нибудь активность ГО, которая отличалась от активности необработанных образцов не более чем на 20%. 3/ГО, секретированная из дрожжей под контролем своей собственной препропоследовательности, намного сильнее гликозилированная, чем та, что секретированна под контролем последовательности С в течение 20 часов в разбавленном ДДС-Na2/ обработка ЭндоН не инактивирует сколько-нибудь активность ГО, которая отличалась от активности необработанных образцов не более чем на 20%. 3/ГО, секретированная из дрожжей под контролем своей собственной препропоследовательности, намного сильнее гликозилированная, чем та, что секретированна под контролем последовательности  -фактора. Кажущийся м.в. первой в пределах 100-200 кДа в то время, как таковой последней в пределах 75-150 кДа. 4/ГО не наблюдалось изменений в активности образцов /т.е., образцов, экспрессированных в дрожжах, или стандартной ГО из А. niger /после обработки ЭндоН. Поскольку конечный продукт после обработки ЭндоН – практически одинаковая молекула вплоть до углеводного содержания для разных ГО, можно сделать вывод, что гипергликозилирование продукта, экспрессированного в дрожжах, не влияет на ферментативную активность.
Результат, что активность ГО относительно независима от степени гликозилирования полипептида ГО, удивтителен. Для других белков отмечалось /например, тканевый активатор плазминогена/, что гипергликозилирование полипептида, экспрессированного в дрожжах, существенно снижало биологическую активность. V. Mackay, “Secretion of Heterologous Proteins in Jeast”, in BIOLOGICAL RESEARCH ON INDUSTRIAL YEASTS, vol. 11, pp. 27-36 (CRC Press, Boca Raton, Fla).
IV.F Конструирование дрожжевых векторов экспрессии, кодирующих ГО дикого типа, и экспрессия фермента дикого типа.
С целью конструирования векторов экспрессии глюкозооксидазы дикого типа Sal-BglII фрагменты величиной 1.9 т.п.н. из мутантных плазмид были выделены и лигированы с заново синтезированными олигомерами, кодирующими N-концевую последовательность. Последовательности олигомеров были показаны выше при конструировании кассет экспрессии. Фрагменты были расщеплены BglII и исправленный ген был вставлен в векторы экспрессии. Анализ последовательности ДНК вставок показал, что образовавшиеся векторы содержали правильные последовательности у N-конца.
Клоны каждого из этих векторов были выделены и названы pAB24АGSGO и рАВ24АGiGO в случае векторов, содержащих в качестве элементов контроля секреции препропоследовательность А. niger и последовательность -фактора. Кажущийся м.в. первой в пределах 100-200 кДа в то время, как таковой последней в пределах 75-150 кДа. 4/ГО не наблюдалось изменений в активности образцов /т.е., образцов, экспрессированных в дрожжах, или стандартной ГО из А. niger /после обработки ЭндоН. Поскольку конечный продукт после обработки ЭндоН – практически одинаковая молекула вплоть до углеводного содержания для разных ГО, можно сделать вывод, что гипергликозилирование продукта, экспрессированного в дрожжах, не влияет на ферментативную активность.
Результат, что активность ГО относительно независима от степени гликозилирования полипептида ГО, удивтителен. Для других белков отмечалось /например, тканевый активатор плазминогена/, что гипергликозилирование полипептида, экспрессированного в дрожжах, существенно снижало биологическую активность. V. Mackay, “Secretion of Heterologous Proteins in Jeast”, in BIOLOGICAL RESEARCH ON INDUSTRIAL YEASTS, vol. 11, pp. 27-36 (CRC Press, Boca Raton, Fla).
IV.F Конструирование дрожжевых векторов экспрессии, кодирующих ГО дикого типа, и экспрессия фермента дикого типа.
С целью конструирования векторов экспрессии глюкозооксидазы дикого типа Sal-BglII фрагменты величиной 1.9 т.п.н. из мутантных плазмид были выделены и лигированы с заново синтезированными олигомерами, кодирующими N-концевую последовательность. Последовательности олигомеров были показаны выше при конструировании кассет экспрессии. Фрагменты были расщеплены BglII и исправленный ген был вставлен в векторы экспрессии. Анализ последовательности ДНК вставок показал, что образовавшиеся векторы содержали правильные последовательности у N-конца.
Клоны каждого из этих векторов были выделены и названы pAB24АGSGO и рАВ24АGiGO в случае векторов, содержащих в качестве элементов контроля секреции препропоследовательность А. niger и последовательность  -фактора соответственно. Bектор рАВ24GSGO также назван GO2 /или pSGO)-2/; вектор рAB24EGO /рАВ24alpha GO/ также назван pEGO-1 (p-alpha-GO.1). Рестриктные карты pSGO и pEGO показаны на фиг. 11 и 12 соответственно.
IV. G. Экспрессия ГО дикого типа в дрожжах и характеристика экспрессированных полипептидов.
IV. G1. Экспрессия ГО в трансформантах S. cerevisiae.
Было определено количество активности ГО, экспрессированной S. cerevisia, трансформированных векторами экспрессии, содержащими последовательности, кодирующие ГО дикого типа.
Штаммы GRF 180, GRF 181 и GRF 183 были трансформированы клонированными векторами экспрессии в дрожках, либо рАВ24 GSGO либо рАВ24АGEGO. Трансформация проводилась по методу Hinnen /1970/ и отбирались лейциновые прототрофы. Инокуляционные культуры индивидуальных трансформантов получали выращиванием трансформантов в 2 мл лейцин-селективной среды, содержащей 8% глюкозы в течение 48 часов. Затем инокуляты разводили до А650=0.05 в неселективной среде и растили 96 часов при 30 -фактора соответственно. Bектор рАВ24GSGO также назван GO2 /или pSGO)-2/; вектор рAB24EGO /рАВ24alpha GO/ также назван pEGO-1 (p-alpha-GO.1). Рестриктные карты pSGO и pEGO показаны на фиг. 11 и 12 соответственно.
IV. G. Экспрессия ГО дикого типа в дрожжах и характеристика экспрессированных полипептидов.
IV. G1. Экспрессия ГО в трансформантах S. cerevisiae.
Было определено количество активности ГО, экспрессированной S. cerevisia, трансформированных векторами экспрессии, содержащими последовательности, кодирующие ГО дикого типа.
Штаммы GRF 180, GRF 181 и GRF 183 были трансформированы клонированными векторами экспрессии в дрожках, либо рАВ24 GSGO либо рАВ24АGEGO. Трансформация проводилась по методу Hinnen /1970/ и отбирались лейциновые прототрофы. Инокуляционные культуры индивидуальных трансформантов получали выращиванием трансформантов в 2 мл лейцин-селективной среды, содержащей 8% глюкозы в течение 48 часов. Затем инокуляты разводили до А650=0.05 в неселективной среде и растили 96 часов при 30 С при 300 об/мин. После выращивания клетки удаляли из кондиционированных сред центрифугированием в микроцентрифуге при 14000 об/мин в течение 1 мин и определяли активность ГО, присутствующую в среде.
Результаты активности глюкозооксидазы, экспрессированной в дрожжах с двух секторов экспрессии и секретированной в кондиционированную среду, представлены в табл. 3. В таблице активность ГО выражена в мкг/мл культуры. С при 300 об/мин. После выращивания клетки удаляли из кондиционированных сред центрифугированием в микроцентрифуге при 14000 об/мин в течение 1 мин и определяли активность ГО, присутствующую в среде.
Результаты активности глюкозооксидазы, экспрессированной в дрожжах с двух секторов экспрессии и секретированной в кондиционированную среду, представлены в табл. 3. В таблице активность ГО выражена в мкг/мл культуры.
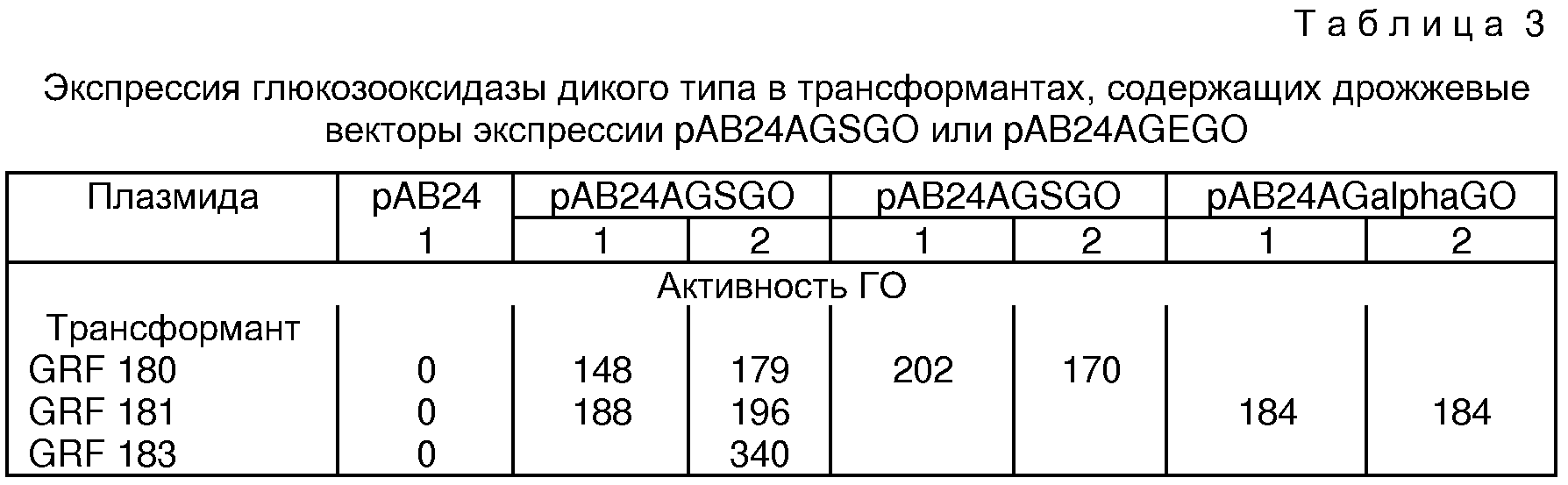 Сравнение результатов, показанных в табл. 3, с таковыми из табл. 1 предполагает, что либо ГО дикого типа, экспрессированная в дрожжах, имеет более высокую удельную активность, чем мутантные ГО, либо фермент экспрессируется на более высоких уровнях, чем мутанты.
IV. G2. Характеристика экспрессированных полипептидов электрофорезом в ДДС Na-полиакриламидных гелях: влияние ЭндоН.
Культуры дрожжевых трансформантов, содержащих векторы экспрессии рАВ24АGSGO и pAB24AGEGO растили, как описано в разделе IV.G1. После выращивания клетки удаляли центрифугированием и определяли активность ГО в кондиционированной среде. Среды от трансформантов, содержащих pAB24AGSGO и pAВ24AGSGO, имели активности ГО 190 мкг/мл и 260 мкг/мл соответственно.
Перед обработкой ЭндоН полипептиды ГО были частично очищены. Среды разводили в 10 раз 0.01 M ацетатом, рН 4.5, и пропускали через колонки ДЕАЕ-целлюлозы Fast Flaw (Pharmacia). После нанесения колонки промывали тем же буфером и затем элюировали ГО 0.1 M ацетатом, рН 3.7.
Полипептиды ГО, экспрессированной из дрожжей как до, так и после очистки, обрабатывали ЭндоН в течение ночи при 37
Сравнение результатов, показанных в табл. 3, с таковыми из табл. 1 предполагает, что либо ГО дикого типа, экспрессированная в дрожжах, имеет более высокую удельную активность, чем мутантные ГО, либо фермент экспрессируется на более высоких уровнях, чем мутанты.
IV. G2. Характеристика экспрессированных полипептидов электрофорезом в ДДС Na-полиакриламидных гелях: влияние ЭндоН.
Культуры дрожжевых трансформантов, содержащих векторы экспрессии рАВ24АGSGO и pAB24AGEGO растили, как описано в разделе IV.G1. После выращивания клетки удаляли центрифугированием и определяли активность ГО в кондиционированной среде. Среды от трансформантов, содержащих pAB24AGSGO и pAВ24AGSGO, имели активности ГО 190 мкг/мл и 260 мкг/мл соответственно.
Перед обработкой ЭндоН полипептиды ГО были частично очищены. Среды разводили в 10 раз 0.01 M ацетатом, рН 4.5, и пропускали через колонки ДЕАЕ-целлюлозы Fast Flaw (Pharmacia). После нанесения колонки промывали тем же буфером и затем элюировали ГО 0.1 M ацетатом, рН 3.7.
Полипептиды ГО, экспрессированной из дрожжей как до, так и после очистки, обрабатывали ЭндоН в течение ночи при 37 С. Условия расщепления были, как описано в разделе IV.Е, за исключением того, что были обработаны 50 млк – аликвоты образцов; контрольные образцы инкубировали при условиях расщепления в соответствии ЭндоН.
После инкубации образцы осаждали ТХУ, промывали 3 раза ацетоном для удаления ТХУ и количество, эквивалетное 12,5 мкл исходного объема каждого образца, наносили на 8% полиакриламидный гель. Электрофорез в геле проводился в присутствии ДДС-Na в восстанавливающих условиях, как описано Zaemmli /1970/. Полипептиды в геле определяли окрашиванием Кумасси Голубым.
Фотография геля приведена на фиг. 10; образцы на разных дорожках, как описано в табл. 4, которая также показывает количество ГО в образце. В таблице символ означает, что образец был обработан ЭндоН; символ означает, что образец был инкубирован при условиях обработки в отсутствие ЭндоН. Число в скобках после образца обозначает номер фракции при элюции с колонки ДЕАЕ-целлюлозы. В качестве контроля ГО из А. niger была подвергнута инкубации при условиях обработки в присутствии и в отсутствие ЭндоН. С. Условия расщепления были, как описано в разделе IV.Е, за исключением того, что были обработаны 50 млк – аликвоты образцов; контрольные образцы инкубировали при условиях расщепления в соответствии ЭндоН.
После инкубации образцы осаждали ТХУ, промывали 3 раза ацетоном для удаления ТХУ и количество, эквивалетное 12,5 мкл исходного объема каждого образца, наносили на 8% полиакриламидный гель. Электрофорез в геле проводился в присутствии ДДС-Na в восстанавливающих условиях, как описано Zaemmli /1970/. Полипептиды в геле определяли окрашиванием Кумасси Голубым.
Фотография геля приведена на фиг. 10; образцы на разных дорожках, как описано в табл. 4, которая также показывает количество ГО в образце. В таблице символ означает, что образец был обработан ЭндоН; символ означает, что образец был инкубирован при условиях обработки в отсутствие ЭндоН. Число в скобках после образца обозначает номер фракции при элюции с колонки ДЕАЕ-целлюлозы. В качестве контроля ГО из А. niger была подвергнута инкубации при условиях обработки в присутствии и в отсутствие ЭндоН.
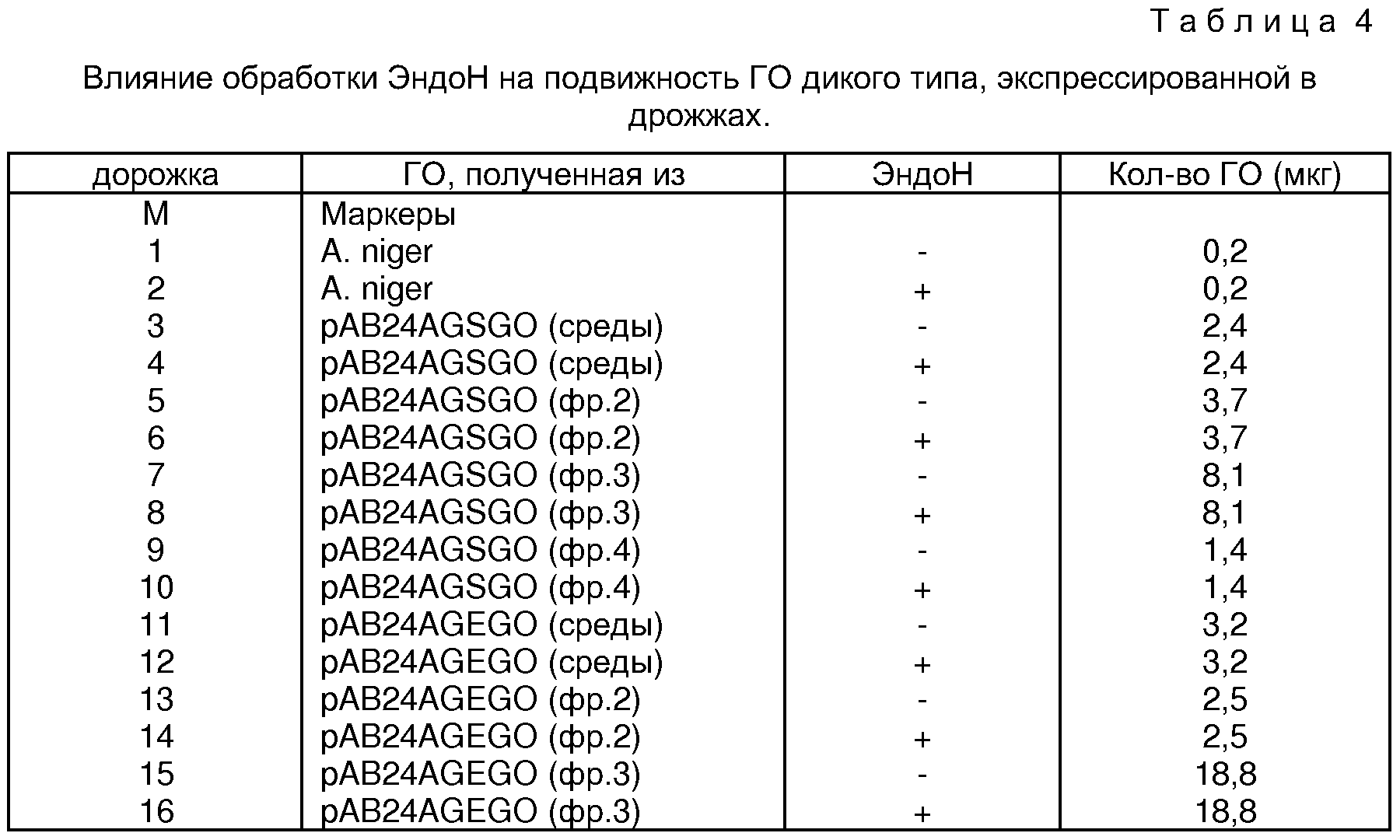 Результаты, показанные в геле на фиг. 10, подтверждают, что были произведены большие количества белка ГО. Поскольку эквивалент лишь 12 мкл дрожжевой среды был нанесен на дорожки 4 и 12 и много более 0.2 мкг фермента по сравнению со стандартным находится в геле, результаты по активности правильны и более чем 200 мг/л ГО секретируется и экспрессируется в дрожжевых системах.
IV. 3. Термостабильность полипептида, экспрессированного с pAB24AGSGO в сравнении с нативной ГО из A. niger.
Термостабильность очищенного рекомбинантного полипептида ГО, экспрессированного в дрожжах с рАВ24АGSGO нативной ГО, очищенной из A. niger, сравнивали путем исследований термоденатурации.
Рекомбинантный полипептид, экспрессированный с рАВ24АGSGO, как описано в разделе IV.G. 1, был очищен модификацией метода Pazur и Kleppe /1964/. Дрожжевые клетки удаляли центрифугированием и кондиционированную среду УЕР разводили в 10 раз 0.01 М ацетатом Na, рН 4.5. Этот материал наносили на колонку ДЕАЕ-сефарозы /20 мл/ Fast Flow (Pharmacia), уравновешенной тем же буфером. Эту колонку затем промывали 3 объемами уравновешивающего буфера и затем элюировали фермент 0,1 М ацетатом Na, рН 3.7. Фракции, содержащие активность ГО, объединяли и концентрировали ульрафильтрацией. Природная ГО, очищенная из А. niger, была получена от Sigma Corp. (Type 5). Как рекомбинантная, так и активная ГО были инкубированы в концентрации 0.1 мг/мл в 0.1 M цитрат-фосфатном буфере, рН 5.5, с использованием в основном условии, описанных в Malikkides и Weiland /1982/. Образцы фермента инкубировали при 65
Результаты, показанные в геле на фиг. 10, подтверждают, что были произведены большие количества белка ГО. Поскольку эквивалент лишь 12 мкл дрожжевой среды был нанесен на дорожки 4 и 12 и много более 0.2 мкг фермента по сравнению со стандартным находится в геле, результаты по активности правильны и более чем 200 мг/л ГО секретируется и экспрессируется в дрожжевых системах.
IV. 3. Термостабильность полипептида, экспрессированного с pAB24AGSGO в сравнении с нативной ГО из A. niger.
Термостабильность очищенного рекомбинантного полипептида ГО, экспрессированного в дрожжах с рАВ24АGSGO нативной ГО, очищенной из A. niger, сравнивали путем исследований термоденатурации.
Рекомбинантный полипептид, экспрессированный с рАВ24АGSGO, как описано в разделе IV.G. 1, был очищен модификацией метода Pazur и Kleppe /1964/. Дрожжевые клетки удаляли центрифугированием и кондиционированную среду УЕР разводили в 10 раз 0.01 М ацетатом Na, рН 4.5. Этот материал наносили на колонку ДЕАЕ-сефарозы /20 мл/ Fast Flow (Pharmacia), уравновешенной тем же буфером. Эту колонку затем промывали 3 объемами уравновешивающего буфера и затем элюировали фермент 0,1 М ацетатом Na, рН 3.7. Фракции, содержащие активность ГО, объединяли и концентрировали ульрафильтрацией. Природная ГО, очищенная из А. niger, была получена от Sigma Corp. (Type 5). Как рекомбинантная, так и активная ГО были инкубированы в концентрации 0.1 мг/мл в 0.1 M цитрат-фосфатном буфере, рН 5.5, с использованием в основном условии, описанных в Malikkides и Weiland /1982/. Образцы фермента инкубировали при 65 С, отбирали аликвоты при различных временах и разводили их в 10 раз в фосфатном буфере, рН 5.5. Ферментативная активность в разведенных образцах была затем определена с использованием в основном метода Kelley и Reddy /1986/ со следующими модификациями. Анализы проводили в объеме 1.0 мл в 0.1 М Na фосфатном буфере, рН 7.0, содержащем 0,2 мМ о-дианизидин (Sigma Corp.) 10 мкг пероксидазы красных кровяных телец лощади (Boehringer-Mannheim Corp.) и 9.5 мМ Д-глюкозы. Анализы начинали добавлением ГО /1-30 нг/, инкубировали при Ткомн 20 мин и затем останавливали добавлением 0.1 мл 4Н2SO4. Образовавшийся восстановленный о-дианизидин затем измеряли при 400 нм на спектрофотометре Shimazu Model UV-160 или при 405 нм на ELISA reader (Litertek Multiscan).
Количество фермента определяли в нг ГО стандартной кривой абсорбции по отношению к количеству фермента. Результаты изучения термостабильности показаны на фиг. 13, где процент оставшейся ферментативной активности обозначен против времени инкубации при повышенной температуре /темные квадратики – ГО, экспрессированная в дрожжах; темные треугольники – нативная ГО/.
Данные на фиг. 13 показывают, что константа псевдопервого порядка 0.04 мин-1 получена для падения активности природного фермента, в то время как фермент, экспрессированный в дрожжах, имел константу 0.012 мин-1. Таким образом, фермент, экспрессированный в дрожжах, который гипергликозилирован, существенно более термостабилен, чем природный фермент из А. niger.
IV. Оценка уровня мРНК ГО.
А. niger производит существенные количества ГО. Исследования, описанные выше, показали, что существенно больше чем 1 мг/л экспрессируется и секректируется при относительно низких плотностях клеток. Кроме того, белок был детектирован в грубых лизатах А. niger Вестерн-блоттингом, что предполагает, что фермент представлен более 0,1% тотального клеточного белка. Таким образом, можно ожидать, что относительно большие количества мРНК данного фермента должны присутствовать в А. niger в течение логарифмической и/или стационарной фаз роста. Для оценки детектируемости этих мРНК кДНК из клонов 1, 2 и 4 /описаны в разделе IV.А.2 и разделе IV.А.3/ были использованы в качестве проб для Норзерн-блоттов РНК, выделенной в логарифмической базе роста.
Норзерн-блоттинг РНК проводился, как описано далее, в основном как описано Maniatis и др. /1982/ Поли/А+/РНК /5 мкг/, выделенная из А. niger в логарифмической фазе роста, денатурировали глиоксалем и подвергали электрофорезу в 1% агарозном геле. РНК переносили на нитроцеллюлозный фильтр и анализировали ник-транслированным 1.1 т.п.н. EcoRI-фрагментом кДНК, используя условия, описанные выше для Саузерн-блоттинга. После гибридизации с пробой фильтры отмывали при 60 С, отбирали аликвоты при различных временах и разводили их в 10 раз в фосфатном буфере, рН 5.5. Ферментативная активность в разведенных образцах была затем определена с использованием в основном метода Kelley и Reddy /1986/ со следующими модификациями. Анализы проводили в объеме 1.0 мл в 0.1 М Na фосфатном буфере, рН 7.0, содержащем 0,2 мМ о-дианизидин (Sigma Corp.) 10 мкг пероксидазы красных кровяных телец лощади (Boehringer-Mannheim Corp.) и 9.5 мМ Д-глюкозы. Анализы начинали добавлением ГО /1-30 нг/, инкубировали при Ткомн 20 мин и затем останавливали добавлением 0.1 мл 4Н2SO4. Образовавшийся восстановленный о-дианизидин затем измеряли при 400 нм на спектрофотометре Shimazu Model UV-160 или при 405 нм на ELISA reader (Litertek Multiscan).
Количество фермента определяли в нг ГО стандартной кривой абсорбции по отношению к количеству фермента. Результаты изучения термостабильности показаны на фиг. 13, где процент оставшейся ферментативной активности обозначен против времени инкубации при повышенной температуре /темные квадратики – ГО, экспрессированная в дрожжах; темные треугольники – нативная ГО/.
Данные на фиг. 13 показывают, что константа псевдопервого порядка 0.04 мин-1 получена для падения активности природного фермента, в то время как фермент, экспрессированный в дрожжах, имел константу 0.012 мин-1. Таким образом, фермент, экспрессированный в дрожжах, который гипергликозилирован, существенно более термостабилен, чем природный фермент из А. niger.
IV. Оценка уровня мРНК ГО.
А. niger производит существенные количества ГО. Исследования, описанные выше, показали, что существенно больше чем 1 мг/л экспрессируется и секректируется при относительно низких плотностях клеток. Кроме того, белок был детектирован в грубых лизатах А. niger Вестерн-блоттингом, что предполагает, что фермент представлен более 0,1% тотального клеточного белка. Таким образом, можно ожидать, что относительно большие количества мРНК данного фермента должны присутствовать в А. niger в течение логарифмической и/или стационарной фаз роста. Для оценки детектируемости этих мРНК кДНК из клонов 1, 2 и 4 /описаны в разделе IV.А.2 и разделе IV.А.3/ были использованы в качестве проб для Норзерн-блоттов РНК, выделенной в логарифмической базе роста.
Норзерн-блоттинг РНК проводился, как описано далее, в основном как описано Maniatis и др. /1982/ Поли/А+/РНК /5 мкг/, выделенная из А. niger в логарифмической фазе роста, денатурировали глиоксалем и подвергали электрофорезу в 1% агарозном геле. РНК переносили на нитроцеллюлозный фильтр и анализировали ник-транслированным 1.1 т.п.н. EcoRI-фрагментом кДНК, используя условия, описанные выше для Саузерн-блоттинга. После гибридизации с пробой фильтры отмывали при 60 С в 1 х SSC. После одной недели авторадиографии не было детектировано полос. Контрольные эксперименты показали, что РНК была интактной и эффективно перенесена из геля на фильтр.
Результаты предполагают, что мРНК, кодирующая ГО, очень редки в клетках А. niger в логарифмической фазе роста. Этот результат удивителен, поскольку синтезируются столь большие количества белка ГО. Это может объяснить сложность получения нуклеотидной последовательности, кодирующей ГО, из библиотеки кДНК.
IV.1. Аналоги глюкозооксидазы, которые являются мутеинами.
IV.1.1. Конструирование векторов, кодирующих мутеины.
Мутированные последовательности, кодирующие глюкозооксидазу, в которых каждый из трех цистеиновых кодонов в положениях 164, 206 и 521 были замещены серинами, были получены с использованием сайт-направленного мутагенеза в основном по методу Eckstein, как описано в Laylor и др. /1985/.
Сначала было получено производное рАВ24АGSGO, в котором 3 С в 1 х SSC. После одной недели авторадиографии не было детектировано полос. Контрольные эксперименты показали, что РНК была интактной и эффективно перенесена из геля на фильтр.
Результаты предполагают, что мРНК, кодирующая ГО, очень редки в клетках А. niger в логарифмической фазе роста. Этот результат удивителен, поскольку синтезируются столь большие количества белка ГО. Это может объяснить сложность получения нуклеотидной последовательности, кодирующей ГО, из библиотеки кДНК.
IV.1. Аналоги глюкозооксидазы, которые являются мутеинами.
IV.1.1. Конструирование векторов, кодирующих мутеины.
Мутированные последовательности, кодирующие глюкозооксидазу, в которых каждый из трех цистеиновых кодонов в положениях 164, 206 и 521 были замещены серинами, были получены с использованием сайт-направленного мутагенеза в основном по методу Eckstein, как описано в Laylor и др. /1985/.
Сначала было получено производное рАВ24АGSGO, в котором 3 -нетранслируемая последовательность ГО была делетирована. Для этого 3 -нетранслируемая последовательность ГО была делетирована. Для этого 3 -половина гена ГО из клона 4 кДНК /описан на фиг. 4/ была субклонирована в М13mp19 как PstI-EcoRI фрагмент. Два сходных праймера были использованы для введения в общей сложности 7 мутаций у 3 -половина гена ГО из клона 4 кДНК /описан на фиг. 4/ была субклонирована в М13mp19 как PstI-EcoRI фрагмент. Два сходных праймера были использованы для введения в общей сложности 7 мутаций у 3 -конца гена ГО. Последовательности сходных праймеров были следующими /с подчеркнутыми мутациями, сайты рестрикции обозначены сверху последовательности праймера и аминокислоты, кодируемые в ней, в скобках ниже последовательности праймера/:
XHOI Bg1II
5 -конца гена ГО. Последовательности сходных праймеров были следующими /с подчеркнутыми мутациями, сайты рестрикции обозначены сверху последовательности праймера и аминокислоты, кодируемые в ней, в скобках ниже последовательности праймера/:
XHOI Bg1II
5 CGGATGCTATCCTCGAGGATTATGCTTCCATGCAGTAAGATCT 3 CGGATGCTATCCTCGAGGATTATGCTTCCATGCAGTAAGATCT 3 (D А I L Е D Y А S М Q stop).
Образовавшийся PstI–BglII фрагмент, заключающий 3-полонину кДНК ГO, был лигирован с BglII–PstI фрагментом из рАВ24АGSGO, представляющим собой 5
(D А I L Е D Y А S М Q stop).
Образовавшийся PstI–BglII фрагмент, заключающий 3-полонину кДНК ГO, был лигирован с BglII–PstI фрагментом из рАВ24АGSGO, представляющим собой 5 -половину гена, и они были лигированы в ту же плазмиду, обработанную BglII фосфатазой. Образовавшаяся плазмида – рSGO3.
Мутации, при которых кодоны Цис были заменены на кодоны Сер, были сделаны с использованием следующих праймеров:
GOC164S: 5 -половину гена, и они были лигированы в ту же плазмиду, обработанную BglII фосфатазой. Образовавшаяся плазмида – рSGO3.
Мутации, при которых кодоны Цис были заменены на кодоны Сер, были сделаны с использованием следующих праймеров:
GOC164S: 5 ATTAACACCATGGCTCGAGGCATTGAAGTA 3 ATTAACACCATGGCTCGAGGCATTGAAGTA 3 GOC206S: 5
GOC206S: 5 GGGGTCACCGGATCCGAAATCTTT 3 GGGGTCACCGGATCCGAAATCTTT 3 GOC521S: 5
GOC521S: 5 CGGCATCATGGAACTAGTACCCACGCC 3 CGGCATCATGGAACTAGTACCCACGCC 3 .
5-половина кассеты экспрессии из плазмиды рАВ24АGSGO была субклонирована в М13mp19 в виде AhaIII–PstI фрагмента. Первые 2 праймера (GOC164S и GOC206S) были использованы с этой матрицей; праймер GOC521S был использован на матрице, описанной выше, которая была использована для получения рSGO3. После клонирования праймеры были затем использованы как пробы для выделения бляшек, содержащих мутированные последовательности; вставки в позитивных бляшек были секвенированы целиком, чтобы убедиться, что были получены только желаемые мутации. Мутантные гены были затем реконструированы в кассеты экспрессии аналогично pSG03 за исключением того, что эти векторы содержали последовательности нуклеотидов с определенными мутациями. Векторы, содержащие мутации, в Цис 164, Цис 206 названы pSGO 3C164S, также назван C164S, pSGO3C206S (также назван C206S) и pSGO3C521S (также назван C521S) соответственно.
IV.1.2. Экспрессия векторов экспрессии, кодирующих мутеины ГО, в дрожжах.
Экспрессия мутеинов ГО, кодированных в pSGO3C164S, pSGO3C206S, pSGO3C521S и гена дикого типа в pSGO3 проводилось в трансформантах штамма дрожжей GRF 180. Трансформация и экспрессия были в основном описаны в разделе IV.D за исключением того, что указанные выше векторы били использованы. Влияние мутаций, меняющих природные остатки цистена в положениях 164, 206 и 521 на серины на экспрессию и/или секрецию и/или активность, показано в табл. 5. .
5-половина кассеты экспрессии из плазмиды рАВ24АGSGO была субклонирована в М13mp19 в виде AhaIII–PstI фрагмента. Первые 2 праймера (GOC164S и GOC206S) были использованы с этой матрицей; праймер GOC521S был использован на матрице, описанной выше, которая была использована для получения рSGO3. После клонирования праймеры были затем использованы как пробы для выделения бляшек, содержащих мутированные последовательности; вставки в позитивных бляшек были секвенированы целиком, чтобы убедиться, что были получены только желаемые мутации. Мутантные гены были затем реконструированы в кассеты экспрессии аналогично pSG03 за исключением того, что эти векторы содержали последовательности нуклеотидов с определенными мутациями. Векторы, содержащие мутации, в Цис 164, Цис 206 названы pSGO 3C164S, также назван C164S, pSGO3C206S (также назван C206S) и pSGO3C521S (также назван C521S) соответственно.
IV.1.2. Экспрессия векторов экспрессии, кодирующих мутеины ГО, в дрожжах.
Экспрессия мутеинов ГО, кодированных в pSGO3C164S, pSGO3C206S, pSGO3C521S и гена дикого типа в pSGO3 проводилось в трансформантах штамма дрожжей GRF 180. Трансформация и экспрессия были в основном описаны в разделе IV.D за исключением того, что указанные выше векторы били использованы. Влияние мутаций, меняющих природные остатки цистена в положениях 164, 206 и 521 на серины на экспрессию и/или секрецию и/или активность, показано в табл. 5.
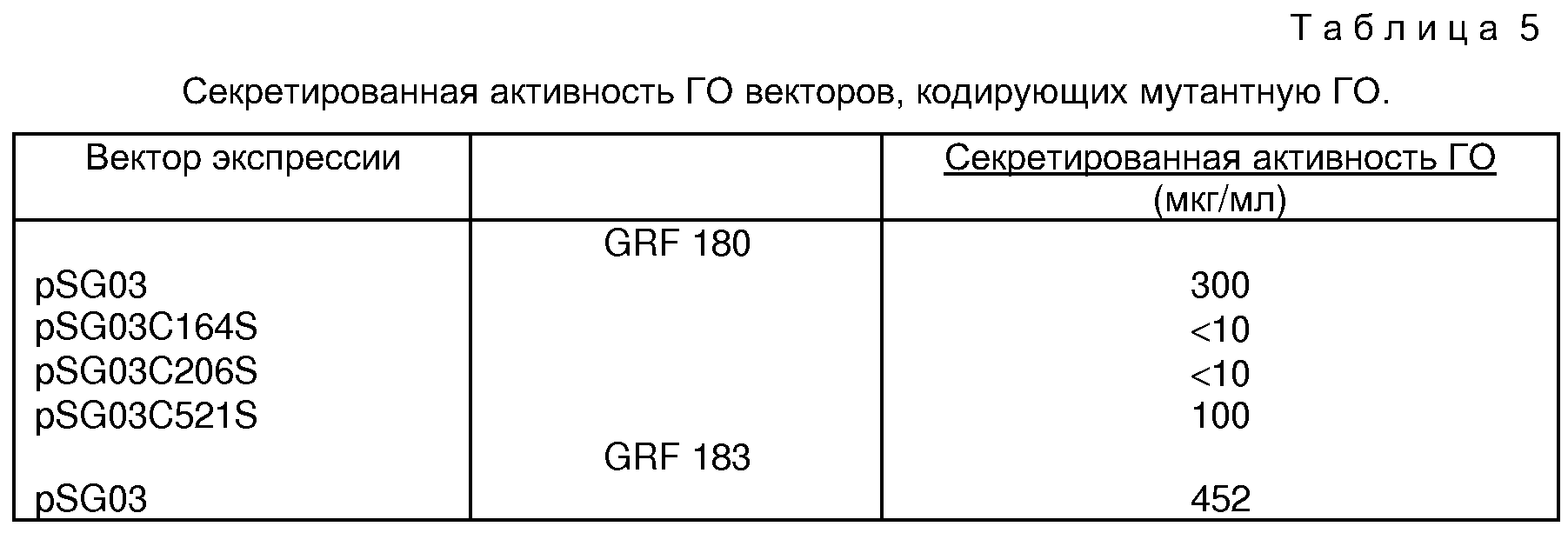 Как видно из результатов, секретированная активность ГО от экспрессии pSGO3С164S и рSGО3С206S не была детектирована. Уровень секретированной активности ГО, образовавшейся от экспрессии pSGO3C521S, был немного снижен относительно такового от экспрессии pSGO3. Из этих результатов сделан вывод, что Цис 164 и Цис 206 требуют для экспрессии /секреции/ и/или активности ГО.
IV.1.3. Термостабильность мутеина, кодированного и C521S.
Термостабильность полипептида, экспрессированного из дрожжей, трансформированных pSGO3C521S, сравнивали с таковой природной ГО из А. niger. Исследования термостабильности проводили в основном, как описано в разделе IV.G.3 Результаты, графически выраженные как % оставшейся активности после инкубации при повышенной температуре относительно времени, показаны на фиг. 14 /природный фермент – квадраты; pSGO3C521S кодированный полипептид – треугольники/. Основываясь на этих результатах, оценка константы инактивации дана менее чем 0.01 мин-1. Сравнение термостабильности этого мутеина с природной ГО из А. niger, как и с полипептидом, кодированным в pАВ24АGSGO указывают, что мутеин pSGO3C521S наиболее термостабилен из трех ферментов ГО.
IV. J Выделение геномной ДНК, кодирующей ГО из Penicillium.
Геномная ДНК, кодирующая ГО, била получена из P.amagasakiense следующим образом. P.amagasakiense /полученный из Американской Коллекции Типовых Культур/ растили на среде УЕР и выделяли ДНК в основном, как описано в Boel и др. /1984/.
Выделенную ДНК расщепляли различными рестриктазами, т.е. EcoRI Hind III, BamHI, SalI, PstI, XhoI и переносили на нитроцеллюлозу. Блок анализировали меченым со случайного праймера 1.9 т.п.н. BglII фрагментом гена ГО из A. niger, присутствующим в плазмиде рАB24АGSGO. Гибридизация проводилась в смеси, содержащей пробу в 20% формамида и 10% декстрансульфата, при 42
Как видно из результатов, секретированная активность ГО от экспрессии pSGO3С164S и рSGО3С206S не была детектирована. Уровень секретированной активности ГО, образовавшейся от экспрессии pSGO3C521S, был немного снижен относительно такового от экспрессии pSGO3. Из этих результатов сделан вывод, что Цис 164 и Цис 206 требуют для экспрессии /секреции/ и/или активности ГО.
IV.1.3. Термостабильность мутеина, кодированного и C521S.
Термостабильность полипептида, экспрессированного из дрожжей, трансформированных pSGO3C521S, сравнивали с таковой природной ГО из А. niger. Исследования термостабильности проводили в основном, как описано в разделе IV.G.3 Результаты, графически выраженные как % оставшейся активности после инкубации при повышенной температуре относительно времени, показаны на фиг. 14 /природный фермент – квадраты; pSGO3C521S кодированный полипептид – треугольники/. Основываясь на этих результатах, оценка константы инактивации дана менее чем 0.01 мин-1. Сравнение термостабильности этого мутеина с природной ГО из А. niger, как и с полипептидом, кодированным в pАВ24АGSGO указывают, что мутеин pSGO3C521S наиболее термостабилен из трех ферментов ГО.
IV. J Выделение геномной ДНК, кодирующей ГО из Penicillium.
Геномная ДНК, кодирующая ГО, била получена из P.amagasakiense следующим образом. P.amagasakiense /полученный из Американской Коллекции Типовых Культур/ растили на среде УЕР и выделяли ДНК в основном, как описано в Boel и др. /1984/.
Выделенную ДНК расщепляли различными рестриктазами, т.е. EcoRI Hind III, BamHI, SalI, PstI, XhoI и переносили на нитроцеллюлозу. Блок анализировали меченым со случайного праймера 1.9 т.п.н. BglII фрагментом гена ГО из A. niger, присутствующим в плазмиде рАB24АGSGO. Гибридизация проводилась в смеси, содержащей пробу в 20% формамида и 10% декстрансульфата, при 42 С в течение ночи. Фильтры затем отмывали при 50 С в течение ночи. Фильтры затем отмывали при 50 С раствором 1 х SSCО. 0.1% додецилсульфата натрия /ДДС-Na/ и авторадиографировали в течение ночи. Радиоавтографы показали единственную специфичную полосу на каждой дорожке, что указывало, что в геноме P.amagasakiense присутствует единственный ген с гомологией к гену ГО A. niger. В частности, наблюдались BamHI фрагмент и Hind III фрагмент размером 2.4 т.п.н. и 1.9 т.п.н. соответственно.
Для клонирования BamHI фрагмент 20 мкг ДНК Penicillium расщепляли рестриктазой, и фрагменты, разделенные электрофорезом и имеющие размер между 2.3-2.6 т.п.н., выделяли из геля. ДНК этого препарата была лигирована в pBR322, обработанную BamHI и фосфатазой. Трансформация аликвоты, лигированной плазмидной ДНК в E. coli, дала приблизительно 104 ампицилинустойчивых колоний, из которых 85% были предположительными рекомбинантами по контрольному фенотипу. Потенциально рекомбинантные колонии были перенесены дубликатно на нитроцеллюлозные фильтры и гибридизированы с описанной выше пробой ГО из pAB24AGSGO. Гибридизация проводилась при 37 С раствором 1 х SSCО. 0.1% додецилсульфата натрия /ДДС-Na/ и авторадиографировали в течение ночи. Радиоавтографы показали единственную специфичную полосу на каждой дорожке, что указывало, что в геноме P.amagasakiense присутствует единственный ген с гомологией к гену ГО A. niger. В частности, наблюдались BamHI фрагмент и Hind III фрагмент размером 2.4 т.п.н. и 1.9 т.п.н. соответственно.
Для клонирования BamHI фрагмент 20 мкг ДНК Penicillium расщепляли рестриктазой, и фрагменты, разделенные электрофорезом и имеющие размер между 2.3-2.6 т.п.н., выделяли из геля. ДНК этого препарата была лигирована в pBR322, обработанную BamHI и фосфатазой. Трансформация аликвоты, лигированной плазмидной ДНК в E. coli, дала приблизительно 104 ампицилинустойчивых колоний, из которых 85% были предположительными рекомбинантами по контрольному фенотипу. Потенциально рекомбинантные колонии были перенесены дубликатно на нитроцеллюлозные фильтры и гибридизированы с описанной выше пробой ГО из pAB24AGSGO. Гибридизация проводилась при 37 С с 10% формамида и с 10% декстрансульфата. Фильтры отмывали при 50 С с 10% формамида и с 10% декстрансульфата. Фильтры отмывали при 50 С в растворе 1 х SSC 0.1% ДДС-Na и авторадиографировали 3 дня. 6 потенциальных позитивных клона были идентифицированы, отобраны и плазмидная ДНК их выделена. 5 из этих клонов содержали BamHI вставки 2.3-2.6 т.п.н., последовавший Саузерн-блот анализ показал, что 3 из них одинаковы. Представительная плазмида, рестриктная карта которой показана на фиг. 15, была названа pBRpGOXA11.
Секвенирование BamHI вставки pBRpGOXA11 проводилось следующим образом.
Выделенную плазмидную ДНК расщепляли BamHI, выделяли фрагменты приблизительно в 2.5 т.п.н. и далее расщепляли Hind III. Смесь фрагментов далее лигировали в М13 и ДНК из потенциально рекомбинантных бляшек подвергали секвенированию. Получившаяся последовательность одного такого клона, рВRАII, показана на фиг. 16, где можно видеть, что открытая рамка считывания /ОPC/ несомненна на протяжении всего 445 пн фрагмента.
Сравнение аминокислот, кодированных в 445 пн фрагменте, полученном из вставки генома P. amagasakiense в pBRpGOXAll, с аминокислотной последовательностью ГО A. niger, кодированной в нуклеотидной последовательности, показанной на фиг. 5B, приведено на фиг. 17. На чертеже сопоставленные последовательности предполагают, что клон гипотетической ГО Penicillum начинается у аминокислоты 64 в последовательности А. niger. Кроме того, белки, судя по всему, идентичны на 52% на аминокислотном уровне.
Депозит биологических материалов
Полинуклеотидная конструкция, содержащая кДНК ГО клона 2, была депозирована Американским Коллектором Типов Культур /АТСС/, 12301 Parklawn Drive, Rockville, Maryland USA, и будет храниться на условиях Будапештского Договора. После принятия и издания настоящего приложения в виде патента Соединенных Штатов все ограничения доступности этого депозита будут окончательно отмечены; и доступ к этому депозиту будет возможен в продолжение неопределенного состояния вышеназванного приложения для лица, которое, как определит Комиссионер, будет иметь право, кроме того, по 37 CFR 1.14 и 35 USC 1.22. Депозит будет поддерживаться в течение тридцати /30/ лет с даты вклада, или в течение пяти /5/ лет после последнего требования депозита, или в течение времени действия патента США, если оно будет дольше. Приемный номер и дата депозита приведены ниже. С в растворе 1 х SSC 0.1% ДДС-Na и авторадиографировали 3 дня. 6 потенциальных позитивных клона были идентифицированы, отобраны и плазмидная ДНК их выделена. 5 из этих клонов содержали BamHI вставки 2.3-2.6 т.п.н., последовавший Саузерн-блот анализ показал, что 3 из них одинаковы. Представительная плазмида, рестриктная карта которой показана на фиг. 15, была названа pBRpGOXA11.
Секвенирование BamHI вставки pBRpGOXA11 проводилось следующим образом.
Выделенную плазмидную ДНК расщепляли BamHI, выделяли фрагменты приблизительно в 2.5 т.п.н. и далее расщепляли Hind III. Смесь фрагментов далее лигировали в М13 и ДНК из потенциально рекомбинантных бляшек подвергали секвенированию. Получившаяся последовательность одного такого клона, рВRАII, показана на фиг. 16, где можно видеть, что открытая рамка считывания /ОPC/ несомненна на протяжении всего 445 пн фрагмента.
Сравнение аминокислот, кодированных в 445 пн фрагменте, полученном из вставки генома P. amagasakiense в pBRpGOXAll, с аминокислотной последовательностью ГО A. niger, кодированной в нуклеотидной последовательности, показанной на фиг. 5B, приведено на фиг. 17. На чертеже сопоставленные последовательности предполагают, что клон гипотетической ГО Penicillum начинается у аминокислоты 64 в последовательности А. niger. Кроме того, белки, судя по всему, идентичны на 52% на аминокислотном уровне.
Депозит биологических материалов
Полинуклеотидная конструкция, содержащая кДНК ГО клона 2, была депозирована Американским Коллектором Типов Культур /АТСС/, 12301 Parklawn Drive, Rockville, Maryland USA, и будет храниться на условиях Будапештского Договора. После принятия и издания настоящего приложения в виде патента Соединенных Штатов все ограничения доступности этого депозита будут окончательно отмечены; и доступ к этому депозиту будет возможен в продолжение неопределенного состояния вышеназванного приложения для лица, которое, как определит Комиссионер, будет иметь право, кроме того, по 37 CFR 1.14 и 35 USC 1.22. Депозит будет поддерживаться в течение тридцати /30/ лет с даты вклада, или в течение пяти /5/ лет после последнего требования депозита, или в течение времени действия патента США, если оно будет дольше. Приемный номер и дата депозита приведены ниже.
 Этот депозит обеспечен в интересах опытных экспериментаторов. Это ни признание, что такой депозит требуется для практики настоящего изобретения, ни признание того, что эквивалентные воплощения не в силах опытных экспериментаторов ввиду настоящего раскрытия. Публичная доступность этого депозита – не подарок разрешения изготавливать или продавать депозированный материал под этим или другим патентом. Последовательность нуклеиновой кислоты депозированного материала включена в настоящее раскрытие ссылкой и контролируется, если противоречит любым последовательностям, описанным здесь.
Хотя предшествующее изобретение было описано в некоторых деталях с целью иллюстрации, очевидно, что изменения и модификации могут быть применены в пределах прилагаемой формулы изобретения опытными экспериментаторами.
Промышленная приложимость.
Обеспечение рекомбинантных поликлеотидов, кодирующих ГО, делает возможным методы, которые базируются на экспрессии полипептида в рекомбинантных системах. Эти методы и рекомбинантные системы особенно полезны, поскольку они позволяют получение больших количеств желаемого продукта. Они делают также возможными получение полипептидов в системах, не которых они могут быть проще и более экономично очищены, поскольку могут быть сконструированы векторы экспрессии, которые вызывают секрецию продукта в среду. Это увеличит доступность и/или снизит стоимость ГО для многих коммерческих целей, например для определения и оценки глюкозы в промышленных растворах в жидкостях тела, таких как кровь и моча.
Кроме того, способы, использующие рекомбинантные системы, кодирующие ГО, позволяют получение ГО в системах, которые совместимы с предназначением экспрессированного продукта. Например, ГО используется в обессахаривании яиц, в удалении кислорода из напитков, влажных пещевых продуктов, отдушек и герметически закрытых упаковок пищи. Получение полипептида ГО в дрожжах, использование которых в пищевых продуктах санкционировано, должно быть выгодно, поскольку нужда в жесткой очистке должна быть меньше, чем если полипептид производится из его природного источника, А. niger, который не разрешен для пищевых продуктов и который сильно аллергенен.
Более того, эти методы и рекомбинантные системы позволяют получение аналогов ГО и фрагментов ГО, которые могут найти коммерческое использование в процедурах определения. Например, слитые белки ГО могут действовать вместо меченых антител или коньюгатов в анализе сэндвич-типа. Молекула может быть слита с эпитопом, узнаваемым детектируемым антителом. Наличие комплекса антитело-эпитоп будет определяться детектированием ферментативной активности глюкозоксидазы. В сочетании с анализом пероксидазы красных кровяных телец лошади это даст колориметрическую процедуру детектирования присутствия антитела.
Слитые белки ГО могут также быть выигрышными в медицинских процедурах. Например, перекись водорода токсична для различных бактерий и клеток. Можно нацелить фермент на специфические патогены и/или сливанием ГО с антителами, узнающими эти специфические мишени.
Неактивные полипептиды, являющиеся фрагментами ГО или аналогами ГО, могут быть использованы для получения антител к ГО как поликлональных, так и моноклональных. Эти антитела полезны для очистки ГО и полипептидов, существенно сходных с ГО, иммуноаффинными методами.
Этот депозит обеспечен в интересах опытных экспериментаторов. Это ни признание, что такой депозит требуется для практики настоящего изобретения, ни признание того, что эквивалентные воплощения не в силах опытных экспериментаторов ввиду настоящего раскрытия. Публичная доступность этого депозита – не подарок разрешения изготавливать или продавать депозированный материал под этим или другим патентом. Последовательность нуклеиновой кислоты депозированного материала включена в настоящее раскрытие ссылкой и контролируется, если противоречит любым последовательностям, описанным здесь.
Хотя предшествующее изобретение было описано в некоторых деталях с целью иллюстрации, очевидно, что изменения и модификации могут быть применены в пределах прилагаемой формулы изобретения опытными экспериментаторами.
Промышленная приложимость.
Обеспечение рекомбинантных поликлеотидов, кодирующих ГО, делает возможным методы, которые базируются на экспрессии полипептида в рекомбинантных системах. Эти методы и рекомбинантные системы особенно полезны, поскольку они позволяют получение больших количеств желаемого продукта. Они делают также возможными получение полипептидов в системах, не которых они могут быть проще и более экономично очищены, поскольку могут быть сконструированы векторы экспрессии, которые вызывают секрецию продукта в среду. Это увеличит доступность и/или снизит стоимость ГО для многих коммерческих целей, например для определения и оценки глюкозы в промышленных растворах в жидкостях тела, таких как кровь и моча.
Кроме того, способы, использующие рекомбинантные системы, кодирующие ГО, позволяют получение ГО в системах, которые совместимы с предназначением экспрессированного продукта. Например, ГО используется в обессахаривании яиц, в удалении кислорода из напитков, влажных пещевых продуктов, отдушек и герметически закрытых упаковок пищи. Получение полипептида ГО в дрожжах, использование которых в пищевых продуктах санкционировано, должно быть выгодно, поскольку нужда в жесткой очистке должна быть меньше, чем если полипептид производится из его природного источника, А. niger, который не разрешен для пищевых продуктов и который сильно аллергенен.
Более того, эти методы и рекомбинантные системы позволяют получение аналогов ГО и фрагментов ГО, которые могут найти коммерческое использование в процедурах определения. Например, слитые белки ГО могут действовать вместо меченых антител или коньюгатов в анализе сэндвич-типа. Молекула может быть слита с эпитопом, узнаваемым детектируемым антителом. Наличие комплекса антитело-эпитоп будет определяться детектированием ферментативной активности глюкозоксидазы. В сочетании с анализом пероксидазы красных кровяных телец лошади это даст колориметрическую процедуру детектирования присутствия антитела.
Слитые белки ГО могут также быть выигрышными в медицинских процедурах. Например, перекись водорода токсична для различных бактерий и клеток. Можно нацелить фермент на специфические патогены и/или сливанием ГО с антителами, узнающими эти специфические мишени.
Неактивные полипептиды, являющиеся фрагментами ГО или аналогами ГО, могут быть использованы для получения антител к ГО как поликлональных, так и моноклональных. Эти антитела полезны для очистки ГО и полипептидов, существенно сходных с ГО, иммуноаффинными методами.
Формула изобретения 1. Рекомбинантный вектор, включающий полинуклеотидную последовательность, кодирующую полипептид, проявляющий активность глюкозооксидазы (ГО), с последовательностью, приведенной на фиг.5В, или его мутеин, содержащий Ser в положении Cys у аминокислотного остатка 521 последовательности, представленной на фиг.5В, и регуляторную последовательность, содержащую глицеральдегид-3-фосфатдегидрогеназаалкогольдегидрогеназа (ADH2/GAP) гибридный промотор дрожжей, глицеральдегид-3-фосфат (GAP) терминатор и регуляторную последовательность, обеспечивающую секрецию, которая выбрана из последовательности, кодирующей дрожжевой альфа-фактор и препропоследовательность ГО из А.niger. 2. Рекомбинантный вектор по п.1, который является вектором экспрессии, дополнительно содержащим регуляторные последовательности для экспрессии, оперативно связанные с последовательностью, кодирующей полипептид, обладающий ГО активностью. 3. Рекомбинантный вектор по п.2, где последовательности, обеспечивающие экспрессию кодирующей последовательности, обеспечивают экспрессию в дрожжах. 4. Рекомбинантный вектор по п.3, которой дополнительно содержит последовательность, обеспечивающую секрецию полипептида в среду. 5. Рекомбинантный вектор по п.1, который выбирают из группы, включающей: (i) вектор рАВ24АGSGOGO; (ii) вектор рАВ24АGalphaGO; (iii) вектор рАВ24АGSGO, иначе называемый рSGO-2; (iv) вектор рАВ24@GO, иначе называемый р@GO-1; (v) вектор pSGO3C521S. 6. Штамм Saccharomyces cerevisiae GRF180, трансформированный рSGO3C521S, продуцирующий полипептид, обладающий глюкозооксидазной активностью. 7. Способ получения рекомбинантного полипептида, обладающего глюкозооксидазной (ГО) активностью, где указанный способ включает культивирование трансформированных клеток, продуцирующих указанный полипептид, и последующее выделение и очистку целевого продукта, отличающийся тем, что трансформацию клеток осуществляют вектором, содержащим полинуклеотид, который кодирует полипептид по п.9, оперативно связанный с последовательностью, обеспечивающей экспрессию в указанных клетках. 8. Способ по п.7, где клетки представляют собой бактериальные клетки или клетки дрожжей. 9. Неприродный рекомбинантный полипептид, проявляющий ГО активность, причем указанный полипептид выбран из группы, состоящей из полипептида, представленного на фиг.5В, и его мутеина, который содержит серин в положении цистеина у аминокислотного остатка 521 последовательности, представленной на фиг.6, и дополнительно гипергликозилированный относительно природной ГО. 10. Полипептид по п.9, полученный способом по п.7. Приоритет по пунктам и признакам: 19.06.1989 – признак “мутеин, содержащий Ser в положении Суs у аминокислотного остатка 521” пп.1, 7, 9, признак “вектор рSGO3C521S” пп.5 и 6; 21.06.1988 – пп.1-10, кроме признака “мутеин, содержащий Ser в положении Cys у аминокислотного остатка 521” пп.1, 7, 9 и признака “вектор рSGO3C521S” пп.5 и 6. РИСУНКИ
PD4A – Изменение наименования обладателя патента СССР или патента Российской Федерации на изобретение
(73) Новое наименование патентообладателя:
Адрес для переписки:
Извещение опубликовано: 10.05.2008 БИ: 13/2008
|
||||||||||||||||||||||||||
