Патент на изобретение №2228335
|
||||||||||||||||||||||||||
(54) ЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ ПУРИНА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ
(57) Реферат: Изобретение относится к новым соединениям формул I и Ia во всех их стереоизомерных формах или их смесях во всех соотношениях и их фармацевтически приемлемым солям, обладающим антагонистической активностью в отношении рецептора витронектина. Соединения могут быть использованы в качестве ингибиторов резорбции костей остеокластами, роста опухоли или метастазирования опухоли и т.д. Изобретение также относится к способам получения соединений формул I и Ia и к фармацевтической композиции на их основе. В соединениях формул I и Ia обозначают: Х – водород, NR6R6′, фтор, хлор, бром, OR6, SR6, гидрокси-(C1-C6)-алкил-NH, (гидрокси-(C1-C6)алкил)2N, амино-(C1-C6)алкил-NH, (амино-(C1-C6)алкил)2N, гидрокси-(C1-C6)алкил-O, гидрокси-(C1-C6)алкил-S или NH-CO-R6; Y – водород, G – остаток формулы II -(CR1R2)n-A-(CR1R2)m-(CR1R3)i-(CR1R2)q-R4 (II); W – остаток формулы III -B-(CR1R2)r-A’-(CR1R2)s -(CR1R3)k-(CR1R2)t–D-E (III); Ga – остаток формулы IIа -(CR1R2)r-A’-(CR1R2)s-(CR1R3)k-(CR1R2)t–D-E (IIa); Wa – остаток формулы IIIa -B-(CR1R2)n-A-(CR1R2)m-(CR1R3)i-(CRaR2)q–R4 (IIIa); А, А’ – независимо друг от друга прямая связь, -C(O)NH- или NH-, RI, R2 – независимо друг от друга водород, фтор, хлор, циано, нитро, (C1-C10)алкил, (C3-C14)циклоалкил, (C3-C14)циклоалкил-(C1-C8)алкил, (C5-C14)арил, (C1-C8)арил-(C1-C8)алкил, R6-O-R7, R6-S(O)p-R7 или R6R6’N-R7, R3 – независимо друг от друга водород, фтор, хлор, циано, нитро, (C1-C18)алкил, (C3-C14)циклоалкил, (C3-C14)циклоалкил-(C1-C8)алкил, (C5-C14)арил, (C5-C14)арил-(C1-C8)-алкил, R6-O-R7, R6R6’N-R7, R6C(O)-O-R7, R6C(O)R7, R6OC(O)R7, R6N(R6’)C(O)OR7, R6S-(O)pN(R5)R7, R6(O)C(O)N(R5) R7, R6C(O)N(R5)R7, R6N(R6’)C(O)N(R5)R7, R6N(R6’)S(O)pN(R5)R7, R6S(O)pR7, R6SC(O)N(R5)R7, R6N(R6’)C(O)R7 или R6N(R6’)S(O)pR7, причем алкил может быть однократно или многократно ненасыщенным и при этом алкил или арил может быть однократно или многократно замещен фтором, хлором, бромом, циано, R6R6’N-R7, нитро, R6OC(O)R7, R6C(O)R7, R6N(R6’)C(O)-R7, R6N(R6’)S(O)pR7, R6 или R6-O-R7; R4 означает C(O)R8; R6, R6’, R5 независимо друг от друга – водород, (C1-С10)алкил, (C3-С14)циклоалкил, (C3-С14)циклоалкил-(C1-С8)алкил, (C5-С14)арил, (C5-С14)арил-(C1-С8)алкил, R7 независимо друг от друга -(C1-С4) алкилен или прямая связь; R8 – гидрокси, (C1-С8)алкокси, (C5-С14)арил-(C1-С8)алкокси, (C5-С14)арилокси, (C1-С8)алкилкарбонилокси-(C1-C4)алкокси, (C5-С14)арил-(C1-С8)алкилкарбонилокси-(C1-С8)алкокси, NR6R6’, (ди-((C1-С8)алкил)амино)карбонилметилокси, (ди((C5-С14)арил-(C1-С8)алкил)амино)карбонилметилокси, В означает простую связь, NH, CONH, пиперидинил, S или имидазол; D – прямая связь, -NR6-, -C(O)-NR6-, -NR6-C(O)-, -S(O)u-NR6-, -NR6C(O)-NR6-, -NR6-C(S)NR6-, -NR6-S(O)u-NR6-, -NR6-C-(O)O, -NR6-N=CR6-, -NR6-S(O)u, -(С5-С14)арил-СО-, -(C5-C14)-арил-S(O)u, -N=CR6– или -R6C=N-, или -R6С=N-NR6-, причем обозначающие D двухвалентные остатки через свободную связь на правой стороне связаны с группой Е, и Е означает водород, -NH-CH(=NH), -C(=NH)-NH2 или 5,6-членный ароматический или неароматический остаток, необязательно содержащий 1 или 2 атома азота, возможно замещенный оксогруппой, остатком R5 или R3, или возможно конденсированный с фенильной группой в виде бензимидазольного остатка, n – нуль, один, два, три, четыре или пять; m – нуль, один, два, три, четыре или пять; i – нуль или один; р – независимо друг от друга нуль, один или два; q – нуль, один или два; r – нуль, один, два, три, четыре, пять или шесть; s – нуль, один, два, три, четыре или пять; t – нуль, один, два, три, четыре или пять; k – нуль или один; u – один или два; во всех их стереоизомерных формах или их смесях во всех соотношениях и их фармацевтически приемлемые соли. 6 с. и 6 з.п. ф-лы, 1 табл. 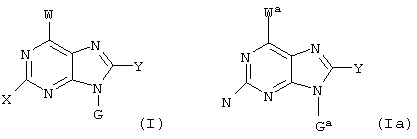 Предметом настоящего изобретения являются соединения формул I и Iа
Предметом настоящего изобретения являются соединения формул I и Iа
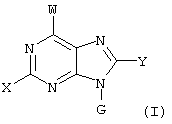 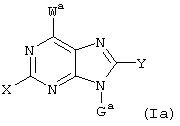 где X, Y, W, Wa, G и Ga имеют указанные ниже значения,
их физиологически приемлемые соли и пролекарственные средства, их получение, их применение и содержащие их фармацевтические препараты.
Соединения формулы I представляют ценные активные вещества лекарственных средств. В частности, они являются антагонистами витронектинового рецептора и применяются для лечения и профилактики заболеваний, которые основываются на взаимодействии между витронектиновыми рецепторами и их лигандами при клеточно-клеточных и клеточно-матричных процессах взаимодействия или которые могут препятствовать этому взаимодействию, облегчать его или устранять. Изобретение относится, между прочим, к применению соединений формулы I, их физиологически приемлемых солей и фармацевтических препаратов, содержащих такие соединения, в качестве лекарственных средств для предотвращения, смягчения или лечения заболеваний, которые, по меньшей мере, частично, обусловлены нежелательной степенью резорбции костей, ангиогенеза или пролиферации клеток гладкой мускулатуры сосудов, или для лечения и профилактики стремятся влиять на эти процессы. В частности, соединения формулы I применяют в качестве ингибиторов резорбции костей, ингибиторов роста опухоли и метастазирования опухоли, ингибиторов воспаления, для лечения или профилактики сердечно-сосудистых заболеваний, например, артериосклероза или остаточного эноза, или для лечения и профилактики нефропатий и ретинопатий, как, например, диабетической ретинопатии.
Соединения по изобретению формул I и Iа ингибируют резорбцию костей остеокластами. Заболевания костей, против которых можно применять соединения формулы I, представляют прежде всего остеопороз, гиперкальциемия, остеопения, например, вызванная метастазами, заболевания зубов, гиперпаратиреоз, периартикулярная эрозия при ревматоидном артрите и болезнь Педжета. Далее, соединения формулы I можно применять для смягчения, предотвращения или лечения заболеваний костей, которые вызваны лечением глюкокортикоидами, стероидами или кортикостероидами или недостатком половых гормонов. Все эти заболевания отличаются потерей кости, которая вызвана неравновесием между построением кости и разрушением костной ткани.
Кости человека подвергаются непрерывному динамическому процессу перестройки, который включает резорбцию кости и построение кости. Эти процессы управляются специализирующимися на этом типами клеток. Построение кости вызвано отложением костной матрицы остеокластами, резорбция кости вызвана разрушением костной ткани остеокластами. Большинство заболеваний костей основываются на нарушенном равновесии между образованием кости и резорбцией кости. Остеопороз отличается потерей костной матрицы. Активированные остеокласты представляют многоядерные клетки с диаметром от 400 мкм, которые разрушают костную матрицу. Активированные остеокласты отлагаются на поверхности костной матрицы и выделяют протеолитические энзимы и кислоты в так называемую “зону уплотнения”, область между их клеточной мембраной и костной матрицей. Кислое окружение и протеазы приводят к деструкции кости.
Исследования показали, что отложением остеокластов на костях управляют интегриновые рецепторы на поверхности клеток остеокластов. Интегрины представляют суперсемейство рецепторов, к которым принадлежат, между прочим, фибриногеновый рецептор
где X, Y, W, Wa, G и Ga имеют указанные ниже значения,
их физиологически приемлемые соли и пролекарственные средства, их получение, их применение и содержащие их фармацевтические препараты.
Соединения формулы I представляют ценные активные вещества лекарственных средств. В частности, они являются антагонистами витронектинового рецептора и применяются для лечения и профилактики заболеваний, которые основываются на взаимодействии между витронектиновыми рецепторами и их лигандами при клеточно-клеточных и клеточно-матричных процессах взаимодействия или которые могут препятствовать этому взаимодействию, облегчать его или устранять. Изобретение относится, между прочим, к применению соединений формулы I, их физиологически приемлемых солей и фармацевтических препаратов, содержащих такие соединения, в качестве лекарственных средств для предотвращения, смягчения или лечения заболеваний, которые, по меньшей мере, частично, обусловлены нежелательной степенью резорбции костей, ангиогенеза или пролиферации клеток гладкой мускулатуры сосудов, или для лечения и профилактики стремятся влиять на эти процессы. В частности, соединения формулы I применяют в качестве ингибиторов резорбции костей, ингибиторов роста опухоли и метастазирования опухоли, ингибиторов воспаления, для лечения или профилактики сердечно-сосудистых заболеваний, например, артериосклероза или остаточного эноза, или для лечения и профилактики нефропатий и ретинопатий, как, например, диабетической ретинопатии.
Соединения по изобретению формул I и Iа ингибируют резорбцию костей остеокластами. Заболевания костей, против которых можно применять соединения формулы I, представляют прежде всего остеопороз, гиперкальциемия, остеопения, например, вызванная метастазами, заболевания зубов, гиперпаратиреоз, периартикулярная эрозия при ревматоидном артрите и болезнь Педжета. Далее, соединения формулы I можно применять для смягчения, предотвращения или лечения заболеваний костей, которые вызваны лечением глюкокортикоидами, стероидами или кортикостероидами или недостатком половых гормонов. Все эти заболевания отличаются потерей кости, которая вызвана неравновесием между построением кости и разрушением костной ткани.
Кости человека подвергаются непрерывному динамическому процессу перестройки, который включает резорбцию кости и построение кости. Эти процессы управляются специализирующимися на этом типами клеток. Построение кости вызвано отложением костной матрицы остеокластами, резорбция кости вызвана разрушением костной ткани остеокластами. Большинство заболеваний костей основываются на нарушенном равновесии между образованием кости и резорбцией кости. Остеопороз отличается потерей костной матрицы. Активированные остеокласты представляют многоядерные клетки с диаметром от 400 мкм, которые разрушают костную матрицу. Активированные остеокласты отлагаются на поверхности костной матрицы и выделяют протеолитические энзимы и кислоты в так называемую “зону уплотнения”, область между их клеточной мембраной и костной матрицей. Кислое окружение и протеазы приводят к деструкции кости.
Исследования показали, что отложением остеокластов на костях управляют интегриновые рецепторы на поверхности клеток остеокластов. Интегрины представляют суперсемейство рецепторов, к которым принадлежат, между прочим, фибриногеновый рецептор  IIb IIb 3 на тромбоцитах и рецептор витронектина 3 на тромбоцитах и рецептор витронектина  v v 3. Рецептор витронектина 3. Рецептор витронектина  v v 3 представляет гликопротеин с постоянной мембраной, который экспримируется на поверхности ряда клеток, как клетки эндотелия, клетки гладкой мускулатуры сосудов, остеокласты и клетки опухоли. Рецептор витронектина 3 представляет гликопротеин с постоянной мембраной, который экспримируется на поверхности ряда клеток, как клетки эндотелия, клетки гладкой мускулатуры сосудов, остеокласты и клетки опухоли. Рецептор витронектина  v v 3, который экспримируется на мембране остеокластов, управляет процессом отложения на костях и резорбцией костей, следовательно способствует остеопорозу. При этом 3, который экспримируется на мембране остеокластов, управляет процессом отложения на костях и резорбцией костей, следовательно способствует остеопорозу. При этом  v v 3 связывается с протеинами костной матрицы, как остеопонтин, костный сиалопротеин и тромбоспонин, которые содержат мотив трипептида Arg-Gly-Asp (или RGD).
Horton и сотр. описывают RGD-пептиды и антивитронектиновый рецептор-антитело (23С6), которые ингибируют разрушение зуба остеокластами и миграцию остеокластов (Horton et al., Exp. Cell Res., 1991, 195, 368). Sato и др. описывают в J. Cell Biol., 1990, 111, 1713, эхистатин, RCD-пептид из змеиного яда, как потенциальный ингибитор резорбции костей в тканевой культуре и как ингибитор прикрепления остеокластов к костям. Fischer et al. (Endocrinology, 1993, 132, 1411) смогли показать на крысе, что эхистатин тормозит резорбцию костей также in vivo. Wayne et al. (J. Clin. Invest., 1997, 99, 2284) смогли показать на крысе in vivo ингибирование резорбции костей антагонистами витронектинового рецептора.
Витронектиновый рецептор 3 связывается с протеинами костной матрицы, как остеопонтин, костный сиалопротеин и тромбоспонин, которые содержат мотив трипептида Arg-Gly-Asp (или RGD).
Horton и сотр. описывают RGD-пептиды и антивитронектиновый рецептор-антитело (23С6), которые ингибируют разрушение зуба остеокластами и миграцию остеокластов (Horton et al., Exp. Cell Res., 1991, 195, 368). Sato и др. описывают в J. Cell Biol., 1990, 111, 1713, эхистатин, RCD-пептид из змеиного яда, как потенциальный ингибитор резорбции костей в тканевой культуре и как ингибитор прикрепления остеокластов к костям. Fischer et al. (Endocrinology, 1993, 132, 1411) смогли показать на крысе, что эхистатин тормозит резорбцию костей также in vivo. Wayne et al. (J. Clin. Invest., 1997, 99, 2284) смогли показать на крысе in vivo ингибирование резорбции костей антагонистами витронектинового рецептора.
Витронектиновый рецептор  v v 3 на человеческих клетках гладкой мускулатуры аорты стимулирует перемещение этих клеток в неоинтиму, что приводит, наконец, к артериосклерозу и к рестенозу после ангиопластики (Brown et al., Cardiovascular Res., 1994, 28, 1815).
Brooks et al. (Cell, 1994, 79, 1157; J. Clin. Invest., 96 (1995), 1815), а также Mitjans et al., J. Cell Science, 1995, 108, 2825) показали, что антитела против 3 на человеческих клетках гладкой мускулатуры аорты стимулирует перемещение этих клеток в неоинтиму, что приводит, наконец, к артериосклерозу и к рестенозу после ангиопластики (Brown et al., Cardiovascular Res., 1994, 28, 1815).
Brooks et al. (Cell, 1994, 79, 1157; J. Clin. Invest., 96 (1995), 1815), а также Mitjans et al., J. Cell Science, 1995, 108, 2825) показали, что антитела против  v v 3 или 3 или  v v 3-антагонистов могут вызывать уменьшение опухолей, причем они индуцируют апоптоз клеток кровеносных сосудов во время ангиогенеза. Cheresh et al. (Science, 1995, 270, 1500) описывают анти- 3-антагонистов могут вызывать уменьшение опухолей, причем они индуцируют апоптоз клеток кровеносных сосудов во время ангиогенеза. Cheresh et al. (Science, 1995, 270, 1500) описывают анти- v v 3-антитело или 3-антитело или  v v 3-антагонисты, которые ингибируют bFGF-индуцированные процессы ангиогенеза в глазу крысы, что приносит терапевтическую пользу при лечении ретинопатий.
Из ЕР-А-O 528586 и ЕР-А-O 528587 известны аминоалкильные или гетероциклические замещенные производные фенилаланина, из WO 95/32710 известны арильные производные в качестве ингибиторов резорбции костей остеокластами. В WO 95/28426 описаны RGD-пептиды как ингибиторы резорбции костей, ангиогенеза и рестеноза. В WO 96/00574 и WO 96/26190 описывают, среди прочего, бензодиазепины как антагонисты витронектинового рецептора или антагонисты интегринового рецептора. В WO 96/00730 описаны матрицы антагонистов фибриногенового рецептора, особенно бензодиазепины, которые связаны с содержащим азот 5-членным кольцом, в качестве антагонистов витронектинового рецептора. В ЕР-А-O 531883 описаны конденсированные 5-членные гетероциклы, которые тормозят связывание фибриногена тромбоцитами.
Предметом настоящего изобретения являются соединения формул I и Iа 3-антагонисты, которые ингибируют bFGF-индуцированные процессы ангиогенеза в глазу крысы, что приносит терапевтическую пользу при лечении ретинопатий.
Из ЕР-А-O 528586 и ЕР-А-O 528587 известны аминоалкильные или гетероциклические замещенные производные фенилаланина, из WO 95/32710 известны арильные производные в качестве ингибиторов резорбции костей остеокластами. В WO 95/28426 описаны RGD-пептиды как ингибиторы резорбции костей, ангиогенеза и рестеноза. В WO 96/00574 и WO 96/26190 описывают, среди прочего, бензодиазепины как антагонисты витронектинового рецептора или антагонисты интегринового рецептора. В WO 96/00730 описаны матрицы антагонистов фибриногенового рецептора, особенно бензодиазепины, которые связаны с содержащим азот 5-членным кольцом, в качестве антагонистов витронектинового рецептора. В ЕР-А-O 531883 описаны конденсированные 5-членные гетероциклы, которые тормозят связывание фибриногена тромбоцитами.
Предметом настоящего изобретения являются соединения формул I и Iа
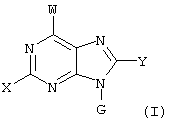 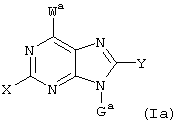 где X – водород, NR6R6’, фтор, хлор, бром, OR6, SR6, гидрокси-(C1-C6)алкил-NH, (гидрокси-(C1-C6)алкил)2N, (амино-(C1-C6)алкил-NH, (амино-(C1-C6)алкил)2N, гидрокси-(C1-C6)-алкил-O, гидрокси-(С1-С6)алкил-S или NH-CO-R6;
Y – R6, фтор, хлор, бром, циано, NR6R6’, OR6, SR6 или гидрокси-(C1-C6)алкил-NH;
G – остаток формулы II
-(CR1R2)n-A-(CR1R2)m-(CR1R3)i-(CR1R2)q-R4 (II)
W – остаток формулы III
-В-(CR1R2)r-A’-(CR1R2)s-(CR1R3)k-(CR1R2)t-D-E (III)
Ga – остаток формулы IIа
-(CR1R2)r-A’-(CR1R2)s-(CR1R3)k-(CR1R2)t-D-E (IIa)
Wa – остаток формулы IIIa
-B-(CR1R2)n-A-(CR1R2)m-(CR1R3)i-(CR1R2)q-R4 (IIIa)
A, A’ независимо друг от друга обозначают прямую связь, -C(O)NR5-, -NR5C(O)-, -С(О)-, -NR5-, -О-, -S-, -SO-, -SO2-, (С5-С14)-арилен, причем в арильном остатке от 1 до 5 атомов углерода могут быть замещены от 1 до 5 гетероатомами, (С2-С4)алкинилен, (С2-С4)алкенилен или двухвалентный остаток от 3- до 7-членного насыщенного или ненасыщенного кольца, которое может содержать один или два гетероатома, как, например, азот, серу или кислород и которое может быть замещено однократно или двукратно остатками из ряда =O, =S или R3;
R1, R2 независимо друг от друга обозначают водород, фтор, хлор, циано, нитро, (C1-C10)-алкил, (С3-С14)-циклоалкил, (С3-C14)циклоалкил-(C1-C8)алкил, (C5-C14)арил, (C5-С14)арил-(C1-C8)-алкил, R6-O-R7, R6-S(O)p-R7 или R6R6’N-R7;
R3 независимо друг от друга водород, фтор, хлор, циано, нитро, (C1-C18)алкил, (С3-С14)циклоалкил, (С3-С14)циклоалкил-(C1-C8)алкил, (С5-С14)арил, (C5-С14)арил-(C1-C8)алкил, R6-O-R7, R6R6’N-R7, R6C(O)-O-R7, R6C(O)R7, R6OC(O)R7, R6N(R6’)С(O)OR7, R6S-(O)pN(R5)R7, R6OC(O)N(R5)R7, R6C(O)N(R5)R7, R6N(R6’)С(O)N(R5)R7, R6N(R6’)S(O)pN(R5)R7, R6S(O)pR7, R6SC(O)N(R5)R7, R6N(R6’)С(O)R7 или R6N(R6’)S(O)pR7, причем алкил может быть однократно или многократно ненасыщенным и при этом алкил или арил может быть однократно или многократно замещен фтором, хлором, бромом, циано, R6R6’NR7, нитро, R6OC(O)R7, R6C(O)R7, R6N(R6’)С(О)-R7, R6N(R6’)S(O)pR7, R6 или R6-O-R7;
R4 обозначает C(O)R8, C(S)R8, S(O)pR8, P(O)R8R8’ или остаток от 4- до 8-членного насыщенного или ненасыщенного гетероцикла, который содержит 1,2,3 или 4 гетероатома из ряда N, О, S, как, например, тетразолил, имидазолил, пиразолил, оксазолил, тиадиазолил;
R5 – независимо друг от друга водород, (C1-С10)алкил, (С3-С14)-циклоалкил, (С3-С14)-циклоалкил(С1-С8)-алкил, (C5-C14)арил или (С5-С14)арил-(C1-C8)алкил;
R6, R6’ – независимо друг от друга водород, (C1-C18)алкил, (С3-С14)-циклоалкил, (С3-С14)-циклоалкил-(C1-C8)алкил, (С5-С14)-арил, где от 1 до 5 атомов углерода могут быть замещены гетероатомами, как N, О, S, или (C5-C14)арил-(C1-C8)алкил, где в арильной части от 1 до 5 атомов углерода могут быть замещены гетероат омами, как N, О, S, или R6 и R6’ образуют вместе с соединяющими их атомами циклическую систему, предпочтительно от 4- до 8-членную циклическую систему, которая, в случае необходимости, может содержать также дополнительные гетероатомы, предпочтительно один, два или три дополнительных гетероатома из ряда N, О, S, и которая может быть насыщенной или ненасыщенной, предпочтительно насыщенной, как, например, морфолин, тиоморфолин, пиперазин, пиперидин, пирролидин;
R7 – независимо друг от друга (C1-C4)алкилен или прямую связь;
R8, R8’ – независимо друг от друга гидрокси, (C1-C8)алкокси, (C5-C14)арил-(С1-С8)алкокси, (C5-C14)арилокси, (C1-C8)алкилкарбонилокси- (C1-C4)алкокси, (C5-C14)арил-(C1-C8)алкилкарбонилокси-(C1-C8)алкокси, NR6R6’, (ди-((C1-C8)алкил)амино)карбонилметилокси, (ди((C5-C14)арил(C1-C8)алкил)амино)карбонилметилокси, (C5-C14)ариламино, остаток аминокислоты, N-((C1-C4)алкил)пиперидин-4-илокси, 2-метилсульфонилэтокси, 1,3-тиазол-2-илметилокси, 3-пиридилметилокси, 2-(ди((C1-C4)алкил)амино)этокси или остаток Q–(CH3)3N+-CH2-CH2O-, где Q– обозначает физиологически приемлемый анион;
В – -О-, -S-, -NR5-, -NR5-C(O)-, -C(O)-NR5-, прямая связь или двухвалентный остаток от 3- до 7-членного насыщенного или ненасыщенного кольца, которое может содержать один или два гетероатома, как, например, азот, сера или кислород, и которое может быть замещено однократно или двукратно остатками из ряда =O, =S и R3;
D обозначает прямую связь, -NR6-, -C(O)-NR6-, -NR6-C-(O)-, -S(O)u-NR6-, -NR6-C(O)-NR6-, -NR6-C(S)-NR6-, -NR6-S(O)u-NR6-, -NR6-C(O)O-, -NR6-N=CR6-, -NR6-S(O)u-, -(C5-C14)арил-CO-, -(С5-С14)арил-S(O)u-, -N=CR6-, -R6C=N- или –R6C=N-NR6-, при этом обозначающие D двухвалентные остатки через свободную связь по правой стороне связаны с группой E;
E – водород, R6-C(=NR6)-NR6-, R6R6’N-C(=NR6)-, R6R6’N-C-(=N-R6)-NR6– или остаток от 4- до 11-членной, моноциклической или полициклической, ароматической или неароматической циклической системы, которая, в случае необходимости, может содержать 1,2,3 или 4 гетероатома из ряда N, О и S и может быть, в случае необходимости, однократно, двукратно или трехкратно замещена остатками из ряда R3, R5, =O, =S и R6R6’N-C(=NR6)-, как, например, следующие остатки:
где X – водород, NR6R6’, фтор, хлор, бром, OR6, SR6, гидрокси-(C1-C6)алкил-NH, (гидрокси-(C1-C6)алкил)2N, (амино-(C1-C6)алкил-NH, (амино-(C1-C6)алкил)2N, гидрокси-(C1-C6)-алкил-O, гидрокси-(С1-С6)алкил-S или NH-CO-R6;
Y – R6, фтор, хлор, бром, циано, NR6R6’, OR6, SR6 или гидрокси-(C1-C6)алкил-NH;
G – остаток формулы II
-(CR1R2)n-A-(CR1R2)m-(CR1R3)i-(CR1R2)q-R4 (II)
W – остаток формулы III
-В-(CR1R2)r-A’-(CR1R2)s-(CR1R3)k-(CR1R2)t-D-E (III)
Ga – остаток формулы IIа
-(CR1R2)r-A’-(CR1R2)s-(CR1R3)k-(CR1R2)t-D-E (IIa)
Wa – остаток формулы IIIa
-B-(CR1R2)n-A-(CR1R2)m-(CR1R3)i-(CR1R2)q-R4 (IIIa)
A, A’ независимо друг от друга обозначают прямую связь, -C(O)NR5-, -NR5C(O)-, -С(О)-, -NR5-, -О-, -S-, -SO-, -SO2-, (С5-С14)-арилен, причем в арильном остатке от 1 до 5 атомов углерода могут быть замещены от 1 до 5 гетероатомами, (С2-С4)алкинилен, (С2-С4)алкенилен или двухвалентный остаток от 3- до 7-членного насыщенного или ненасыщенного кольца, которое может содержать один или два гетероатома, как, например, азот, серу или кислород и которое может быть замещено однократно или двукратно остатками из ряда =O, =S или R3;
R1, R2 независимо друг от друга обозначают водород, фтор, хлор, циано, нитро, (C1-C10)-алкил, (С3-С14)-циклоалкил, (С3-C14)циклоалкил-(C1-C8)алкил, (C5-C14)арил, (C5-С14)арил-(C1-C8)-алкил, R6-O-R7, R6-S(O)p-R7 или R6R6’N-R7;
R3 независимо друг от друга водород, фтор, хлор, циано, нитро, (C1-C18)алкил, (С3-С14)циклоалкил, (С3-С14)циклоалкил-(C1-C8)алкил, (С5-С14)арил, (C5-С14)арил-(C1-C8)алкил, R6-O-R7, R6R6’N-R7, R6C(O)-O-R7, R6C(O)R7, R6OC(O)R7, R6N(R6’)С(O)OR7, R6S-(O)pN(R5)R7, R6OC(O)N(R5)R7, R6C(O)N(R5)R7, R6N(R6’)С(O)N(R5)R7, R6N(R6’)S(O)pN(R5)R7, R6S(O)pR7, R6SC(O)N(R5)R7, R6N(R6’)С(O)R7 или R6N(R6’)S(O)pR7, причем алкил может быть однократно или многократно ненасыщенным и при этом алкил или арил может быть однократно или многократно замещен фтором, хлором, бромом, циано, R6R6’NR7, нитро, R6OC(O)R7, R6C(O)R7, R6N(R6’)С(О)-R7, R6N(R6’)S(O)pR7, R6 или R6-O-R7;
R4 обозначает C(O)R8, C(S)R8, S(O)pR8, P(O)R8R8’ или остаток от 4- до 8-членного насыщенного или ненасыщенного гетероцикла, который содержит 1,2,3 или 4 гетероатома из ряда N, О, S, как, например, тетразолил, имидазолил, пиразолил, оксазолил, тиадиазолил;
R5 – независимо друг от друга водород, (C1-С10)алкил, (С3-С14)-циклоалкил, (С3-С14)-циклоалкил(С1-С8)-алкил, (C5-C14)арил или (С5-С14)арил-(C1-C8)алкил;
R6, R6’ – независимо друг от друга водород, (C1-C18)алкил, (С3-С14)-циклоалкил, (С3-С14)-циклоалкил-(C1-C8)алкил, (С5-С14)-арил, где от 1 до 5 атомов углерода могут быть замещены гетероатомами, как N, О, S, или (C5-C14)арил-(C1-C8)алкил, где в арильной части от 1 до 5 атомов углерода могут быть замещены гетероат омами, как N, О, S, или R6 и R6’ образуют вместе с соединяющими их атомами циклическую систему, предпочтительно от 4- до 8-членную циклическую систему, которая, в случае необходимости, может содержать также дополнительные гетероатомы, предпочтительно один, два или три дополнительных гетероатома из ряда N, О, S, и которая может быть насыщенной или ненасыщенной, предпочтительно насыщенной, как, например, морфолин, тиоморфолин, пиперазин, пиперидин, пирролидин;
R7 – независимо друг от друга (C1-C4)алкилен или прямую связь;
R8, R8’ – независимо друг от друга гидрокси, (C1-C8)алкокси, (C5-C14)арил-(С1-С8)алкокси, (C5-C14)арилокси, (C1-C8)алкилкарбонилокси- (C1-C4)алкокси, (C5-C14)арил-(C1-C8)алкилкарбонилокси-(C1-C8)алкокси, NR6R6’, (ди-((C1-C8)алкил)амино)карбонилметилокси, (ди((C5-C14)арил(C1-C8)алкил)амино)карбонилметилокси, (C5-C14)ариламино, остаток аминокислоты, N-((C1-C4)алкил)пиперидин-4-илокси, 2-метилсульфонилэтокси, 1,3-тиазол-2-илметилокси, 3-пиридилметилокси, 2-(ди((C1-C4)алкил)амино)этокси или остаток Q–(CH3)3N+-CH2-CH2O-, где Q– обозначает физиологически приемлемый анион;
В – -О-, -S-, -NR5-, -NR5-C(O)-, -C(O)-NR5-, прямая связь или двухвалентный остаток от 3- до 7-членного насыщенного или ненасыщенного кольца, которое может содержать один или два гетероатома, как, например, азот, сера или кислород, и которое может быть замещено однократно или двукратно остатками из ряда =O, =S и R3;
D обозначает прямую связь, -NR6-, -C(O)-NR6-, -NR6-C-(O)-, -S(O)u-NR6-, -NR6-C(O)-NR6-, -NR6-C(S)-NR6-, -NR6-S(O)u-NR6-, -NR6-C(O)O-, -NR6-N=CR6-, -NR6-S(O)u-, -(C5-C14)арил-CO-, -(С5-С14)арил-S(O)u-, -N=CR6-, -R6C=N- или –R6C=N-NR6-, при этом обозначающие D двухвалентные остатки через свободную связь по правой стороне связаны с группой E;
E – водород, R6-C(=NR6)-NR6-, R6R6’N-C(=NR6)-, R6R6’N-C-(=N-R6)-NR6– или остаток от 4- до 11-членной, моноциклической или полициклической, ароматической или неароматической циклической системы, которая, в случае необходимости, может содержать 1,2,3 или 4 гетероатома из ряда N, О и S и может быть, в случае необходимости, однократно, двукратно или трехкратно замещена остатками из ряда R3, R5, =O, =S и R6R6’N-C(=NR6)-, как, например, следующие остатки:
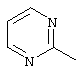 , , 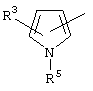 , , 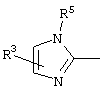 , , 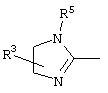 , ,
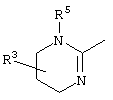 , , 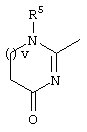 , , 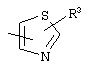 , , 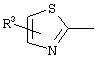 , ,
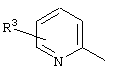 , , 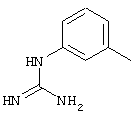 , , 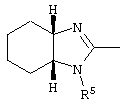 , ,
 , , , ,
 , ,  , ,
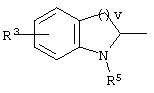 ,, ,,
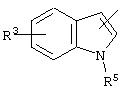 , , 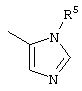 , , 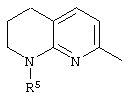 , ,
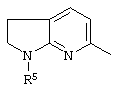 , , 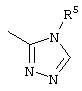 , , 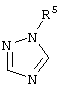 , , 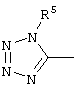 , ,
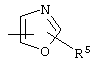 , , 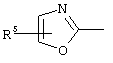 , , 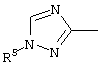 , , 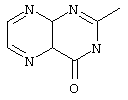 , ,
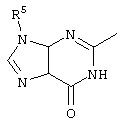 , , 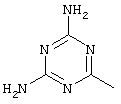 ;
n – нуль, один, два, три, четыре или пять;
m – нуль, один, два, три, четыре или пять;
i – нуль или один;
р – независимо друг от друга нуль, один или два;
q – нуль, один или два;
r – нуль, один, два, три, четыре, пять или шесть;
s – нуль, один, два, три, четыре или пять;
t – нуль, один, два, три, четыре или пять;
k – нуль или один;
u – один или два;
v – нуль, один, два или три;
во всех их стереоизомерных формах и смесях во всех отношениях и их физиологически приемлемые соли, а также их пролекарственные формы,
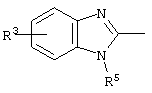
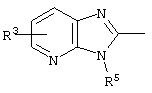
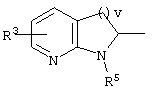
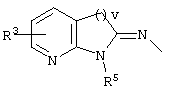
причем вместо показанного в формулах I и Iа остатка пурина может иметь место также остаток 3-деаза-пурина, остаток 7-деаза-пурина или остаток 7-деаза-8-аза-пурина.
Все остатки и индексы, которые могут неоднократно встречаться в соединениях формул I и Iа, например, появляющиеся в остатках G и W радикалы R1, R2 и R3 и встречающиеся в них радикалы R5, R6, R6’, R7 и индексы, а также все другие остатки и индексы, для которых это действительно, могут иметь соответственно независимо друг от друга указанные значения. Они могут быть одинаковыми или различными. Гетероатомы могут быть также в гетероциклах или заместители в остатках, которые могут неоднократно иметь место, независимо друг от друга имеют указанные значения и могут быть одинаковыми или различными.
Появляющиеся в заместителях алкильные остатки могут быть линейными или разветвленными, насыщенными или однократно или многократно ненасыщенными. Это действительно также, если они включают заместители или в качестве заместителей появляются другие остатки, например, в остатках алкокси, алкоксикарбонильных или алкильных остатках. Это справедливо соответственно и для двухвалентных алкиленовых остатков.
Примерами подходящих остатков (С1-С18)алкила являются метил, этил, пропил, бутил, пентил, гексил, гептил, октил, децил, ундецил, додецил, тридецил, гексадецил, октадецил, н-изомеры этих остатков, изопропил, изобутил, изопентил, неопентил, изогексил, 3-метилпентил, 2,3,4-триметилгексил, втор-бутил, трет-бутил, трет-пентил. Предпочтительными алкильными остатками являются метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил и трет-бутил.
Ненасыщенные алкильные остатки представляют собой, например, алкенильные остатки, как винил, 1-пропенил, аллил, бутенил, 3-метил-2-бутенил, или алкинильные остатки, как этинил, 1-пропинил или пропаргил. Алкениленовые остатки и алкиниленовые остатки могут быть линейными или разветвленными. Примерами алкениленовых остатков являются винилен или пропенилен, для остатков алкинилена – этинилен или пропинилен.
Остатки циклоалкила могут быть моноциклическими, бициклическими или трициклическими. Моноциклические циклоалкильные остатки представляют предпочтительно циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и циклооктил, далее, например, циклононил, циклодецил, циклоундецил, циклододецил или циклотетрадецил, которые, однако, все могут быть также замещены, например, (C1-C4)алкилом. В качестве примеров замещенных циклоалкильных остатков следует назвать 4-метилциклогексил и 2,3-диметилциклопентил.
Бициклические и трициклические циклоалкильные остатки могут быть не замещены или могут быть замещены в любых подходящих положениях одной или несколькими оксогруппами и/или одной или несколькими одинаковыми или различными группами (C1-C4)алкила, например, метильной группой или изопропильной группой, предпочтительно метильной группой. Свободная связь бициклического или трициклического остатка может находиться в любом положении молекулы, следовательно, остаток может быть связан через головной атом мостика или через атом в мостике. Свободная связь может находиться также в любом стереохимическом положении, например, в экзо-положении или в эндо-положении.
Примеры основной части бициклических систем представляют норборнан (=бицикло[2.2.1]гептан), бицикло[2.2.2]октан и бицикло[3.2.1]октан. Примером замещенной оксогруппой системы является камфора (=1,7,7-триметил-2-оксобицикло[2.2.1]гептан).
Примеры основной части трициклических систем представляют твистан (=трицикло[4.4.0.03,8]декан), адамантан (=трицикло[3.3.1.13,7]декан), норадамантан (=трицикло[3.3.1.03,7]нонан), трицикло[2.2.1.02,6]гептан, трицикло[5.3.2.04,9]додекан, трицикло[5.4.0.02,9]ундекан или трицикло[5.5.1.03,11]тридекан.
(С5-С14)арил охватывает гетероциклические остатки (C5-С14)арила, в которых атомы углерода в кольце замещены гетероатомами, как азот, кислород или сера, и карбоциклические остатки (C6-C14)арила. Примерами карбоциклических остатков арила являются фенил, нафтил, бифенилил, антрил или флуоренил, при этом предпочитают 1-нафтил, 2-нафтил и особенно фенил. Остатки арила, особенно остатки фенила, могут быть замещены однократно или многократно, предпочтительно однократно, двукратно или трехкратно, одинаковыми или различными остатками из ряда (C1-C8)алкил, особенно (C1-C4)алкил, (C1-C8)-алкокси, особенно (С1-С4)алкокси, галоген, как фтор, хлор и бром, нитро, амино, трифторметил, гидрокси, метилендиокси, циан, гидроксикарбонил, аминокарбонил, (C1-C4)алкоксикарбонил, фенил, фенокси, бензил, бензилокси, (R9O)2P(O)-, (R9O)2-Р(O)-O- или тетразолил, причем R9 обозначает водород, (C1-С10)алкил, (С6-С14)арил или (C6-C14)арил-(C1-C8)алкил. Это действительно для соответствующих остатков арилена.
В монозамещенных остатках фенила заместитель может находиться в 2-положении, 3-положении или 4-положении, причем предпочитают 3-положение и 4-положение. Если фенил замещен двукратно, заместители могут находиться в 1,2-, 1,3- или 1,4-положении друг к другу. Что касается места связывания, заместители могут находиться в 2,3-положении, 2,4-положении, 2,5-положении, 2,6-положении, 3,4-положении или 3,5-положении. Предпочтительно, в двукратно замещенных остатках фенила оба заместителя расположены в 3-положении и 4-положении относительно места связывания.
Арильные или ариленовые группы могут представлять также моноциклические или полициклические ароматические системы, где 1,2,3,4 или 5 атомов углерода в кольце замещены гетероатомами, как, например, 2-пиридил, 3-пиридил, 4-пиридил, пирролил, фурил, тиенил, имидазолил, пиразолил, оксазолил, изоксазолил, тиазолил, изотиазолил, тетразолил, пиридил, пиразинил, пиримидинил, индолил, изоиндолил, индазолил, фталазинил, хинолил, изохинолил, хиноксалинил, хиназолинил, циннолинил, ;
n – нуль, один, два, три, четыре или пять;
m – нуль, один, два, три, четыре или пять;
i – нуль или один;
р – независимо друг от друга нуль, один или два;
q – нуль, один или два;
r – нуль, один, два, три, четыре, пять или шесть;
s – нуль, один, два, три, четыре или пять;
t – нуль, один, два, три, четыре или пять;
k – нуль или один;
u – один или два;
v – нуль, один, два или три;
во всех их стереоизомерных формах и смесях во всех отношениях и их физиологически приемлемые соли, а также их пролекарственные формы,
причем вместо показанного в формулах I и Iа остатка пурина может иметь место также остаток 3-деаза-пурина, остаток 7-деаза-пурина или остаток 7-деаза-8-аза-пурина.
Все остатки и индексы, которые могут неоднократно встречаться в соединениях формул I и Iа, например, появляющиеся в остатках G и W радикалы R1, R2 и R3 и встречающиеся в них радикалы R5, R6, R6’, R7 и индексы, а также все другие остатки и индексы, для которых это действительно, могут иметь соответственно независимо друг от друга указанные значения. Они могут быть одинаковыми или различными. Гетероатомы могут быть также в гетероциклах или заместители в остатках, которые могут неоднократно иметь место, независимо друг от друга имеют указанные значения и могут быть одинаковыми или различными.
Появляющиеся в заместителях алкильные остатки могут быть линейными или разветвленными, насыщенными или однократно или многократно ненасыщенными. Это действительно также, если они включают заместители или в качестве заместителей появляются другие остатки, например, в остатках алкокси, алкоксикарбонильных или алкильных остатках. Это справедливо соответственно и для двухвалентных алкиленовых остатков.
Примерами подходящих остатков (С1-С18)алкила являются метил, этил, пропил, бутил, пентил, гексил, гептил, октил, децил, ундецил, додецил, тридецил, гексадецил, октадецил, н-изомеры этих остатков, изопропил, изобутил, изопентил, неопентил, изогексил, 3-метилпентил, 2,3,4-триметилгексил, втор-бутил, трет-бутил, трет-пентил. Предпочтительными алкильными остатками являются метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил и трет-бутил.
Ненасыщенные алкильные остатки представляют собой, например, алкенильные остатки, как винил, 1-пропенил, аллил, бутенил, 3-метил-2-бутенил, или алкинильные остатки, как этинил, 1-пропинил или пропаргил. Алкениленовые остатки и алкиниленовые остатки могут быть линейными или разветвленными. Примерами алкениленовых остатков являются винилен или пропенилен, для остатков алкинилена – этинилен или пропинилен.
Остатки циклоалкила могут быть моноциклическими, бициклическими или трициклическими. Моноциклические циклоалкильные остатки представляют предпочтительно циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и циклооктил, далее, например, циклононил, циклодецил, циклоундецил, циклододецил или циклотетрадецил, которые, однако, все могут быть также замещены, например, (C1-C4)алкилом. В качестве примеров замещенных циклоалкильных остатков следует назвать 4-метилциклогексил и 2,3-диметилциклопентил.
Бициклические и трициклические циклоалкильные остатки могут быть не замещены или могут быть замещены в любых подходящих положениях одной или несколькими оксогруппами и/или одной или несколькими одинаковыми или различными группами (C1-C4)алкила, например, метильной группой или изопропильной группой, предпочтительно метильной группой. Свободная связь бициклического или трициклического остатка может находиться в любом положении молекулы, следовательно, остаток может быть связан через головной атом мостика или через атом в мостике. Свободная связь может находиться также в любом стереохимическом положении, например, в экзо-положении или в эндо-положении.
Примеры основной части бициклических систем представляют норборнан (=бицикло[2.2.1]гептан), бицикло[2.2.2]октан и бицикло[3.2.1]октан. Примером замещенной оксогруппой системы является камфора (=1,7,7-триметил-2-оксобицикло[2.2.1]гептан).
Примеры основной части трициклических систем представляют твистан (=трицикло[4.4.0.03,8]декан), адамантан (=трицикло[3.3.1.13,7]декан), норадамантан (=трицикло[3.3.1.03,7]нонан), трицикло[2.2.1.02,6]гептан, трицикло[5.3.2.04,9]додекан, трицикло[5.4.0.02,9]ундекан или трицикло[5.5.1.03,11]тридекан.
(С5-С14)арил охватывает гетероциклические остатки (C5-С14)арила, в которых атомы углерода в кольце замещены гетероатомами, как азот, кислород или сера, и карбоциклические остатки (C6-C14)арила. Примерами карбоциклических остатков арила являются фенил, нафтил, бифенилил, антрил или флуоренил, при этом предпочитают 1-нафтил, 2-нафтил и особенно фенил. Остатки арила, особенно остатки фенила, могут быть замещены однократно или многократно, предпочтительно однократно, двукратно или трехкратно, одинаковыми или различными остатками из ряда (C1-C8)алкил, особенно (C1-C4)алкил, (C1-C8)-алкокси, особенно (С1-С4)алкокси, галоген, как фтор, хлор и бром, нитро, амино, трифторметил, гидрокси, метилендиокси, циан, гидроксикарбонил, аминокарбонил, (C1-C4)алкоксикарбонил, фенил, фенокси, бензил, бензилокси, (R9O)2P(O)-, (R9O)2-Р(O)-O- или тетразолил, причем R9 обозначает водород, (C1-С10)алкил, (С6-С14)арил или (C6-C14)арил-(C1-C8)алкил. Это действительно для соответствующих остатков арилена.
В монозамещенных остатках фенила заместитель может находиться в 2-положении, 3-положении или 4-положении, причем предпочитают 3-положение и 4-положение. Если фенил замещен двукратно, заместители могут находиться в 1,2-, 1,3- или 1,4-положении друг к другу. Что касается места связывания, заместители могут находиться в 2,3-положении, 2,4-положении, 2,5-положении, 2,6-положении, 3,4-положении или 3,5-положении. Предпочтительно, в двукратно замещенных остатках фенила оба заместителя расположены в 3-положении и 4-положении относительно места связывания.
Арильные или ариленовые группы могут представлять также моноциклические или полициклические ароматические системы, где 1,2,3,4 или 5 атомов углерода в кольце замещены гетероатомами, как, например, 2-пиридил, 3-пиридил, 4-пиридил, пирролил, фурил, тиенил, имидазолил, пиразолил, оксазолил, изоксазолил, тиазолил, изотиазолил, тетразолил, пиридил, пиразинил, пиримидинил, индолил, изоиндолил, индазолил, фталазинил, хинолил, изохинолил, хиноксалинил, хиназолинил, циннолинил,  -карболинил или бенз-аннелированное, циклопента-, циклогекса- или циклогепта-аннелированное производное этих остатков. Эти гетероциклы могут быть замещены одинаковыми заместителями, как вышеназванные карбоциклические арильные системы.
В ряду этих арильных групп и соответствующих ариленовых групп предпочтительны моноциклические или бициклические ароматические системы с 1, 2 или 3 гетероатомами из ряда N, О, S, которые не замещены или могут быть замещены 1, 2 или 3 заместителями из ряда (C1-C6)алкил, (C1-C6)алкокси, фтор, хлор, нитро, амино, трифторметил, гидрокси, (С1-С4)алкоксикарбонил, фенил, фенокси, бензилокси и бензил.
При этом особенно предпочтительны моноциклические или бициклические ароматические от 5- до 10-циклические системы с 1-3 гетероатомами из ряда N, О, S, которые могут быть замещены 1-2 заместителями из ряда (C1-C4)алкил, (C1-C4)алкокси, фенил, фенокси, бензил и бензилокси.
Примеры насыщенных и ненасыщенных колец, предпочтительно от 3- до 7-членных насыщенных или ненасыщенных колец, которые могут содержать один или два гетероатома, как, например, азот, серу или кислород, и могут быть замещены, в случае необходимости, однократно или двукратно через =O, =S или R3, представляют собой циклопропан, циклобутан, циклопентан, циклогексан, циклогептан, циклопентен, циклогексен, циклогептен, тетрагидропиран, 1,4-диоксациклогексан, морфолин, тиоморфолин, пиперазин, пиперидин, пирролидин, дигидроизоксазол, тетрагидроизоксазол, 1,3-диоксолан, 1,2-дитиолан, 2,3-дигидрофуран, 2,5-дигидрофуран, тетрагидрофуран, 2,3-дигидротиофен, 2,5-дигидротиофен, 2-имидазолин, 3-имидазолин, 4-имидазолин, 2-оксазолин, 3-оксазолин, 4-оксазолин, 2-тиазолин, 3-тиазолин, 4-тиазолин, тиазолидин, -карболинил или бенз-аннелированное, циклопента-, циклогекса- или циклогепта-аннелированное производное этих остатков. Эти гетероциклы могут быть замещены одинаковыми заместителями, как вышеназванные карбоциклические арильные системы.
В ряду этих арильных групп и соответствующих ариленовых групп предпочтительны моноциклические или бициклические ароматические системы с 1, 2 или 3 гетероатомами из ряда N, О, S, которые не замещены или могут быть замещены 1, 2 или 3 заместителями из ряда (C1-C6)алкил, (C1-C6)алкокси, фтор, хлор, нитро, амино, трифторметил, гидрокси, (С1-С4)алкоксикарбонил, фенил, фенокси, бензилокси и бензил.
При этом особенно предпочтительны моноциклические или бициклические ароматические от 5- до 10-циклические системы с 1-3 гетероатомами из ряда N, О, S, которые могут быть замещены 1-2 заместителями из ряда (C1-C4)алкил, (C1-C4)алкокси, фенил, фенокси, бензил и бензилокси.
Примеры насыщенных и ненасыщенных колец, предпочтительно от 3- до 7-членных насыщенных или ненасыщенных колец, которые могут содержать один или два гетероатома, как, например, азот, серу или кислород, и могут быть замещены, в случае необходимости, однократно или двукратно через =O, =S или R3, представляют собой циклопропан, циклобутан, циклопентан, циклогексан, циклогептан, циклопентен, циклогексен, циклогептен, тетрагидропиран, 1,4-диоксациклогексан, морфолин, тиоморфолин, пиперазин, пиперидин, пирролидин, дигидроизоксазол, тетрагидроизоксазол, 1,3-диоксолан, 1,2-дитиолан, 2,3-дигидрофуран, 2,5-дигидрофуран, тетрагидрофуран, 2,3-дигидротиофен, 2,5-дигидротиофен, 2-имидазолин, 3-имидазолин, 4-имидазолин, 2-оксазолин, 3-оксазолин, 4-оксазолин, 2-тиазолин, 3-тиазолин, 4-тиазолин, тиазолидин,  -тиапиран, -тиапиран,  -пиран, -пиран,  -пиран.
Указанный R8 и/или R8’ остаток аминокислоты получают обычным путем для химии пептидов, удаляя от аминогруппы аминокислоты атом водорода. При этом через полученную свободную связь на аминогруппе остаток аминокислоты связывают затем, например, с СО-группой в группе CO-R8. Аминокислоты могут быть природными или неприродными. Предпочитают -пиран.
Указанный R8 и/или R8’ остаток аминокислоты получают обычным путем для химии пептидов, удаляя от аминогруппы аминокислоты атом водорода. При этом через полученную свободную связь на аминогруппе остаток аминокислоты связывают затем, например, с СО-группой в группе CO-R8. Аминокислоты могут быть природными или неприродными. Предпочитают  -аминокислоты. Аминокислоты могут существовать в различных стереохимических формах, например, как D- или L-аминокислоты, и в единой стереохимической форме или в форме смесей стереоизомеров. В качестве аминокислот следует назвать, например, (ср. Houben-Weyl, Методы органической химии, том XV/1 и 2, издание Георг Тиме, Штуттгарт, 1974):
Aad, Abu, -аминокислоты. Аминокислоты могут существовать в различных стереохимических формах, например, как D- или L-аминокислоты, и в единой стереохимической форме или в форме смесей стереоизомеров. В качестве аминокислот следует назвать, например, (ср. Houben-Weyl, Методы органической химии, том XV/1 и 2, издание Георг Тиме, Штуттгарт, 1974):
Aad, Abu,  Abu, ABz, 2ABz, Abu, ABz, 2ABz,  Aca, Ach, Acp, Adpd, Ahb, Aib, Aca, Ach, Acp, Adpd, Ahb, Aib,  Aib, Ala, Aib, Ala,  Ala, Ala,  Ala, Alg, All, Ama, Amt, Ape, Apm, Apr, Arg, Asn, Asp, Asu, Aze, Azi, Bai, Bph, Can, Cit, Cys, (Cys)2, Cyta, Daad, Dab, Dadd, Dap, Dapm, Dasu, Djen, Dpa, Dtc, Fel, Gln, Glu, Gly, Guv, hAla, hArg, hCys, hGln, hGlu, His, hIle, hLeu, hLys, hMet, hPhe, hPro, hSer, hThr, hTrp, hTyr, Hyl, Hyp, 3Нyр, Ile, Ise, Iva, Kyn, Lant, Lcn, Leu, Lsg, Lys, Ala, Alg, All, Ama, Amt, Ape, Apm, Apr, Arg, Asn, Asp, Asu, Aze, Azi, Bai, Bph, Can, Cit, Cys, (Cys)2, Cyta, Daad, Dab, Dadd, Dap, Dapm, Dasu, Djen, Dpa, Dtc, Fel, Gln, Glu, Gly, Guv, hAla, hArg, hCys, hGln, hGlu, His, hIle, hLeu, hLys, hMet, hPhe, hPro, hSer, hThr, hTrp, hTyr, Hyl, Hyp, 3Нyр, Ile, Ise, Iva, Kyn, Lant, Lcn, Leu, Lsg, Lys,  Lys, Lys,  Lys, Met, Mim, Min, nArg, Nle, Nva, Oly, Orn, Pan, Pec, Pen, Phe, Phg, Pic, Pro, Lys, Met, Mim, Min, nArg, Nle, Nva, Oly, Orn, Pan, Pec, Pen, Phe, Phg, Pic, Pro,  Рro, Pse, Pya, Pyr, Pza, Qin, Ros, Sar, Sec, Sem, Ser, Thi, Рro, Pse, Pya, Pyr, Pza, Qin, Ros, Sar, Sec, Sem, Ser, Thi,  Thi, Thr, Thy, Thx, Tia, Tle, Tly, Trp, Trta, Tyr, Val,
трет-бутилглицин (Tbg), неопентилглицин (Npg), циклогексилглицин (Chg), циклогексилаланин (Cha), 2-тиенилаланин (Thia), 2,2-дифениламиноуксусная кислота, 2-(п-толил)-2-фениламиноуксусная кислота, 2-(п-хлорфенил)аминоуксусная кислота;
далее:
пирролидин-2-карбоновая кислота; пиперидин-2-карбоновая кислота; 1,2,3,4-тетрагидроизохинолин-3-карбоновая кислота; декагидроизохинолин-3-карбоновая кислота; октагидроиндол-2-карбоновая кислота; декагидрохинолин-2-карбоновая кислота; октагидроциклопента[b]пиррол-2-карбоновая кислота; 2-азабицикло[2.2.2]октан-3-карбоновая кислота; 2-азабицикло[2.2.1]гептан-3-карбоновая кислота; 2-азабицикло[3.1.0]гексан-3-карбоновая кислота; 2-азаспиро[4.4]нонан-3-карбоновая кислота; 2-азаспиро[4.5]декан-3-карбоновая кислота; спиро(бицикло[2.2.1]гептан)-2,3-пирролидин-5-карбоновая кислота; спиро(бицикло[2.2.2]октан)-2,3-пирролидин-5-карбоновая кислота; 2-азатрицикло[4.3.0.16,9]декан-3-карбоновая кислота; декагидроциклогепта[b]пиррол-2-карбоновая кислота; декагидроциклоокта[с]пиррол-2-карбоновая кислота; октагидроциклопента[с]пиррол-2-карбоновая кислота; октагидроизоиндол-1-карбоновая кислота; 2,3,3а,4,6а-гексагидроциклопента[b]пиррол-2-карбоновая кислота; 2,3,3а,4,5,7а-гексагидроиндол-2-карбоновая кислота; тетрагидротиазол-4-карбоновая кислота; изоксазолидин-3-карбоновая кислота; пиразолидин-3-карбоновая кислота; гидроксипирролидин-2-карбоновая кислота; все в случае необходимости могут быть замещены (см. следующие формулы): Thi, Thr, Thy, Thx, Tia, Tle, Tly, Trp, Trta, Tyr, Val,
трет-бутилглицин (Tbg), неопентилглицин (Npg), циклогексилглицин (Chg), циклогексилаланин (Cha), 2-тиенилаланин (Thia), 2,2-дифениламиноуксусная кислота, 2-(п-толил)-2-фениламиноуксусная кислота, 2-(п-хлорфенил)аминоуксусная кислота;
далее:
пирролидин-2-карбоновая кислота; пиперидин-2-карбоновая кислота; 1,2,3,4-тетрагидроизохинолин-3-карбоновая кислота; декагидроизохинолин-3-карбоновая кислота; октагидроиндол-2-карбоновая кислота; декагидрохинолин-2-карбоновая кислота; октагидроциклопента[b]пиррол-2-карбоновая кислота; 2-азабицикло[2.2.2]октан-3-карбоновая кислота; 2-азабицикло[2.2.1]гептан-3-карбоновая кислота; 2-азабицикло[3.1.0]гексан-3-карбоновая кислота; 2-азаспиро[4.4]нонан-3-карбоновая кислота; 2-азаспиро[4.5]декан-3-карбоновая кислота; спиро(бицикло[2.2.1]гептан)-2,3-пирролидин-5-карбоновая кислота; спиро(бицикло[2.2.2]октан)-2,3-пирролидин-5-карбоновая кислота; 2-азатрицикло[4.3.0.16,9]декан-3-карбоновая кислота; декагидроциклогепта[b]пиррол-2-карбоновая кислота; декагидроциклоокта[с]пиррол-2-карбоновая кислота; октагидроциклопента[с]пиррол-2-карбоновая кислота; октагидроизоиндол-1-карбоновая кислота; 2,3,3а,4,6а-гексагидроциклопента[b]пиррол-2-карбоновая кислота; 2,3,3а,4,5,7а-гексагидроиндол-2-карбоновая кислота; тетрагидротиазол-4-карбоновая кислота; изоксазолидин-3-карбоновая кислота; пиразолидин-3-карбоновая кислота; гидроксипирролидин-2-карбоновая кислота; все в случае необходимости могут быть замещены (см. следующие формулы):
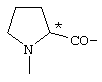 ; ; 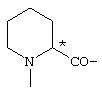 ; ; 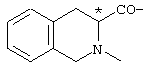 ; ; 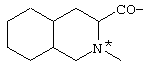 ; ;
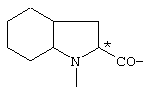 ; ; 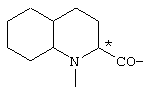 ; ; 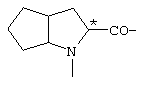 ; ;
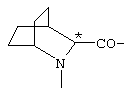 ; ; 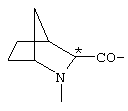 ; ; 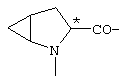 ; ;
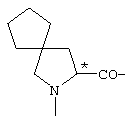 ; ; 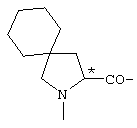 ; ; 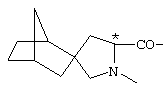 ; ;
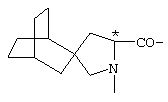 ; ; 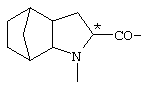 ; ; 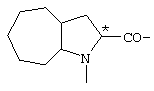 ; ;
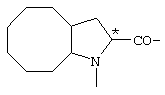 ; ; 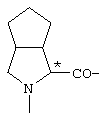 ; ; 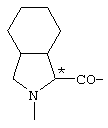 ; ; 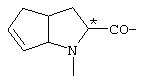 ; ;
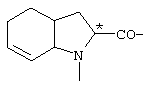 ; ; 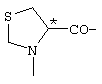 ; ; 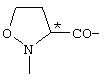 ; ; 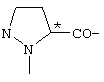 ; ;
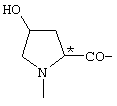 .
Лежащие в основе вышеназванных остатков гетероциклы известны, например, из патентов US-A-4 344 949; US-А-4-374 847; US-А-4 350 704; ЕР-А 29 488; ЕР-А 31 741; ЕР-А 46 953; ЕР-А 49 605; ЕР-А 49 658; ЕР-А 50 800; ЕР-А 51 020; ЕР-А 52 870; ЕР-А 79 022; ЕР-А 84 164; ЕР-А 89 637; ЕР-А 90 341; ЕР-А 90 362; ЕР-А 105 102; ЕР-А 109 020; ЕР-А 111 873; ЕР-А 271 865 и ЕР-А 344 682.
Далее, аминокислоты могут быть представлены в виде эфиров или амидов, как, например, метиловый эфир, этиловый эфир, изопропиловый эфир, изобутиловый эфир, трет-бутиловый эфир, бензиловый эфир, незамещенный амид, метиламид, этиламид, семикарбазид или .
Лежащие в основе вышеназванных остатков гетероциклы известны, например, из патентов US-A-4 344 949; US-А-4-374 847; US-А-4 350 704; ЕР-А 29 488; ЕР-А 31 741; ЕР-А 46 953; ЕР-А 49 605; ЕР-А 49 658; ЕР-А 50 800; ЕР-А 51 020; ЕР-А 52 870; ЕР-А 79 022; ЕР-А 84 164; ЕР-А 89 637; ЕР-А 90 341; ЕР-А 90 362; ЕР-А 105 102; ЕР-А 109 020; ЕР-А 111 873; ЕР-А 271 865 и ЕР-А 344 682.
Далее, аминокислоты могут быть представлены в виде эфиров или амидов, как, например, метиловый эфир, этиловый эфир, изопропиловый эфир, изобутиловый эфир, трет-бутиловый эфир, бензиловый эфир, незамещенный амид, метиламид, этиламид, семикарбазид или  -амино(С2-С8)алкиламид.
Функциональные группы аминокислот могут быть защищены. Пригодными защитными группами являются группы, как, например, уретановые защитные группы, карбоксильные защитные группы и защитные группы боковых цепей, описанные у Hubbuch, Kontakte (Merk), 1979, №3, s. 14-23, и у Bullesbach, Kontakte (Merk), 1980, №1, s. 23-35. Особенно следует назвать Aloe, Pyoc, Fmoc, Tcboc, Z, Воc, Ddz, Врос, Adoc, Msc, Moc, Z(NO2), Z(Haln), Bobz, Iboc, Adpoc, Mboc, Acm, трет-бутил, OBzl, ONbzl, OMbzl, Bzl, Mob, Pic, Trt.
Соединения по изобретению формул I и Ia существуют, в случае необходимости, как E/Z-изомеры. Как чистые Е-изомеры и чистые Z-изомеры, так и смеси E/Z-изомеров во всех отношениях представляют предмет настоящего изобретения. Соединения формул I и Iа могут содержать оптически активные атомы углерода, которые независимо друг от друга могут иметь R- или S-конфигурации. Они могут существовать в форме чистых энантиомеров или чистых диастереомеров, или в форме смесей энантиомеров, например, в форме рацематов или смесей диастереомеров. Как чистые энантиомеры и смеси энантиомеров во всех отношениях, так и диастереомеры и смеси диастереомеров во всех отношениях представляют предмет настоящего изобретения. Диастереомеры, включая E/Z-изомеры, можно разделять, например, хроматографией на отдельные изомеры. Рацематы можно, например, хроматографией разделять на хиральные фазы или расщеплением рацемата на оба энантиомера. При наличии подвижных атомов водорода настоящее изобретение включает также таутомерные формы соединений формул I и Iа.
Физиологически переносимые соли соединений формул I и Iа представляют собой предпочтительно фармацевтически применяемые или нетоксичные, физиологически используемые соли.
Из соединений формул I и Iа, которые содержат кислые группы, например, карбокси, получают такие соли, например, соли щелочного металла или щелочноземельного металла, как, например, соли натрия, соли калия, соли магния и соли кальция, а также соли с физиологически приемлемыми ионами четвертичного аммония и кислые аддитивные соли с аммиаком и физиологически приемлемыми органическими аминами, как, например, триэтиламин, этаноламин или трис-(2-гидроксиэтил)амин.
Соединения формул I и Iа, которые содержат основные группы, например, одну или несколько аминогрупп, амидиногрупп или гуанидиногрупп, образуют кислые аддитивные соли, например, с неорганическими кислотами, как соляная кислота, серная кислота или фосфорная кислота, или с органическими карбоновыми кислотами и сульфокислотами, как уксусная кислота, лимонная кислота, бензойная кислота, малеиновая кислота, фумаровая кислота, винная кислота, метансульфокислота или п-толуолсульфокислота.
Физиологически приемлемый анион Q–, который содержится в соединениях формул I и Iа, если R8 и/или R8’ обозначает остаток 2-триметиламмоний-этокси, представляет предпочтительно одновалентный анион или эквивалент многовалентного аниона нетоксичной, физиологически применяемой, особенно также фармацевтически применяемой, неорганической или органической кислоты, например, анион или эквивалент аниона одной из вышеназванных кислот, применяемых для образования кислых аддитивных солей. Следовательно, Q– может обозначать, например, один из анионов (или эквивалент аниона) из ряда хлорид, сульфат, фосфат, ацетат, цитрат, бензоат, малеат, фумарат, тартрат, метансульфонат и п-толуолсульфонат.
Соли можно получать обычными, известными специалисту, способами из соединений формул I и Iа, например, реакцией соединений формулы I и Iа с неорганической или органической кислотой или основанием в растворителе или диспергаторе, или также катионообменом или анионообменом из других солей. Настоящее изобретение включает также все соли соединений формул I и Iа, которые из-за ограниченной физиологической переносимости непригодны непосредственно для применения в лекарственных средствах, но используются, например, как промежуточные продукты для осуществления других химических модификаций соединений формул I и Iа как исходный материал для получения физиологически приемлемых солей.
Настоящее изобретение включает, кроме того, все сольваты соединений формул I и Iа, например, гидраты или аддукты со спиртами, а также производные соединений формул I и Iа, например, эфиры, пролекарственные формы и метаболиты, которые действуют как соединения формул I и Iа. Предметом изобретения являются особенно пролекарственные формы соединений формул I и Iа, которые при физиологических условиях превращаются в соединения формул I и Iа. Подходящие пролекарственные формы для соединений формул I и Iа, а также модифицированые химическим путем производные соединений формул I и Iа, желательно с улучшенными свойствами, специалисту известны. Более подробные данные о пролекарствах находятся, например, в Fleisher et al., Advanced Drug Delivery Reviews, 19 (1996), 115-130; Design of Prodrugs, H.Bundgaard, Ed., Elsevier, 1985; H.Bundgaard, Drugs of the Future, 16 (1991), 443; Saulnier et al., Bioorg. Med. Chem. Lett., 4 (1994); Safadi et al., Pharmaceutical Res., 10 (1993), 1350. Как пролекарства соединений формул I и Iа специально принимают во внимание эфирные пролекарственные формы кислотных групп, например, группы карбоновой кислоты, предпочтительно R4, обозначающей СООН-группу, а также ациловые пролекарственные формы и карбаматные пролекарственные формы ацилируемых азотсодержащих групп, как аминогруппы, амидиногруппы или гуанидиногруппы, особенно обозначающих Е групп R6-C(=NR6)-NR6-, R6R6’N-C(=NR6)-, R6R6’N-C-(=NR6)-NR6 и от 4- до 11-членной, моноциклической или полициклической, ароматической или неароматической циклической системы. В ациловых пролекарственных формах или карбаматных пролекарственных формах однократно или многократно, например, двукратно, в этих группах находящийся на атоме азота атом водорода замещен ацильной или карбаматной группой. В качестве ацильных и карбаматных групп для ациловых пролекарственных форм и карбаматных пролекарственных форм принимают во внимание, например, группы R6-CO и R6O-CO, в которых R6 имеет вышеуказанные значения, следовательно, водород, (C1-C18)алкил, (С3-С14)циклоалкил, (С3-С14)циклоалкил-(C1-C8)алкил, (C5-C14)арил, где 1-5 атомов углерода могут быть замещены гетероатомами, как N, О, S, или (С5-С14)арил-(C1-C8)алкил, где в арильной части 1-5 атомов углерода могут быть замещены гетероатомами, как N, О, S, причем комбинации значений заместителей, которые в отдельном случае приводят к нестабильным соединениям, например, к нестабильным свободным карбаминовым кислотам, не принимаются во внимание. Получение этих пролекарственных форм можно осуществлять обычными, известными специалисту, способами для изготовления ациламинов и карбаматов.
Далее, настоящее изобретение не ограничивается соединениями по формулам I и Iа с основным остатком пурина, а включает также такие соединения, которые вместо показанного в формулах I и Iа основного остатка пурина имеют остаток 3-деаза-пурина, остаток 7-деаза-пурина или остаток 7-деаза-8-аза-пурина, следовательно, соединения формул Ib и Ic, Id и Iе, а также If и Ig. -амино(С2-С8)алкиламид.
Функциональные группы аминокислот могут быть защищены. Пригодными защитными группами являются группы, как, например, уретановые защитные группы, карбоксильные защитные группы и защитные группы боковых цепей, описанные у Hubbuch, Kontakte (Merk), 1979, №3, s. 14-23, и у Bullesbach, Kontakte (Merk), 1980, №1, s. 23-35. Особенно следует назвать Aloe, Pyoc, Fmoc, Tcboc, Z, Воc, Ddz, Врос, Adoc, Msc, Moc, Z(NO2), Z(Haln), Bobz, Iboc, Adpoc, Mboc, Acm, трет-бутил, OBzl, ONbzl, OMbzl, Bzl, Mob, Pic, Trt.
Соединения по изобретению формул I и Ia существуют, в случае необходимости, как E/Z-изомеры. Как чистые Е-изомеры и чистые Z-изомеры, так и смеси E/Z-изомеров во всех отношениях представляют предмет настоящего изобретения. Соединения формул I и Iа могут содержать оптически активные атомы углерода, которые независимо друг от друга могут иметь R- или S-конфигурации. Они могут существовать в форме чистых энантиомеров или чистых диастереомеров, или в форме смесей энантиомеров, например, в форме рацематов или смесей диастереомеров. Как чистые энантиомеры и смеси энантиомеров во всех отношениях, так и диастереомеры и смеси диастереомеров во всех отношениях представляют предмет настоящего изобретения. Диастереомеры, включая E/Z-изомеры, можно разделять, например, хроматографией на отдельные изомеры. Рацематы можно, например, хроматографией разделять на хиральные фазы или расщеплением рацемата на оба энантиомера. При наличии подвижных атомов водорода настоящее изобретение включает также таутомерные формы соединений формул I и Iа.
Физиологически переносимые соли соединений формул I и Iа представляют собой предпочтительно фармацевтически применяемые или нетоксичные, физиологически используемые соли.
Из соединений формул I и Iа, которые содержат кислые группы, например, карбокси, получают такие соли, например, соли щелочного металла или щелочноземельного металла, как, например, соли натрия, соли калия, соли магния и соли кальция, а также соли с физиологически приемлемыми ионами четвертичного аммония и кислые аддитивные соли с аммиаком и физиологически приемлемыми органическими аминами, как, например, триэтиламин, этаноламин или трис-(2-гидроксиэтил)амин.
Соединения формул I и Iа, которые содержат основные группы, например, одну или несколько аминогрупп, амидиногрупп или гуанидиногрупп, образуют кислые аддитивные соли, например, с неорганическими кислотами, как соляная кислота, серная кислота или фосфорная кислота, или с органическими карбоновыми кислотами и сульфокислотами, как уксусная кислота, лимонная кислота, бензойная кислота, малеиновая кислота, фумаровая кислота, винная кислота, метансульфокислота или п-толуолсульфокислота.
Физиологически приемлемый анион Q–, который содержится в соединениях формул I и Iа, если R8 и/или R8’ обозначает остаток 2-триметиламмоний-этокси, представляет предпочтительно одновалентный анион или эквивалент многовалентного аниона нетоксичной, физиологически применяемой, особенно также фармацевтически применяемой, неорганической или органической кислоты, например, анион или эквивалент аниона одной из вышеназванных кислот, применяемых для образования кислых аддитивных солей. Следовательно, Q– может обозначать, например, один из анионов (или эквивалент аниона) из ряда хлорид, сульфат, фосфат, ацетат, цитрат, бензоат, малеат, фумарат, тартрат, метансульфонат и п-толуолсульфонат.
Соли можно получать обычными, известными специалисту, способами из соединений формул I и Iа, например, реакцией соединений формулы I и Iа с неорганической или органической кислотой или основанием в растворителе или диспергаторе, или также катионообменом или анионообменом из других солей. Настоящее изобретение включает также все соли соединений формул I и Iа, которые из-за ограниченной физиологической переносимости непригодны непосредственно для применения в лекарственных средствах, но используются, например, как промежуточные продукты для осуществления других химических модификаций соединений формул I и Iа как исходный материал для получения физиологически приемлемых солей.
Настоящее изобретение включает, кроме того, все сольваты соединений формул I и Iа, например, гидраты или аддукты со спиртами, а также производные соединений формул I и Iа, например, эфиры, пролекарственные формы и метаболиты, которые действуют как соединения формул I и Iа. Предметом изобретения являются особенно пролекарственные формы соединений формул I и Iа, которые при физиологических условиях превращаются в соединения формул I и Iа. Подходящие пролекарственные формы для соединений формул I и Iа, а также модифицированые химическим путем производные соединений формул I и Iа, желательно с улучшенными свойствами, специалисту известны. Более подробные данные о пролекарствах находятся, например, в Fleisher et al., Advanced Drug Delivery Reviews, 19 (1996), 115-130; Design of Prodrugs, H.Bundgaard, Ed., Elsevier, 1985; H.Bundgaard, Drugs of the Future, 16 (1991), 443; Saulnier et al., Bioorg. Med. Chem. Lett., 4 (1994); Safadi et al., Pharmaceutical Res., 10 (1993), 1350. Как пролекарства соединений формул I и Iа специально принимают во внимание эфирные пролекарственные формы кислотных групп, например, группы карбоновой кислоты, предпочтительно R4, обозначающей СООН-группу, а также ациловые пролекарственные формы и карбаматные пролекарственные формы ацилируемых азотсодержащих групп, как аминогруппы, амидиногруппы или гуанидиногруппы, особенно обозначающих Е групп R6-C(=NR6)-NR6-, R6R6’N-C(=NR6)-, R6R6’N-C-(=NR6)-NR6 и от 4- до 11-членной, моноциклической или полициклической, ароматической или неароматической циклической системы. В ациловых пролекарственных формах или карбаматных пролекарственных формах однократно или многократно, например, двукратно, в этих группах находящийся на атоме азота атом водорода замещен ацильной или карбаматной группой. В качестве ацильных и карбаматных групп для ациловых пролекарственных форм и карбаматных пролекарственных форм принимают во внимание, например, группы R6-CO и R6O-CO, в которых R6 имеет вышеуказанные значения, следовательно, водород, (C1-C18)алкил, (С3-С14)циклоалкил, (С3-С14)циклоалкил-(C1-C8)алкил, (C5-C14)арил, где 1-5 атомов углерода могут быть замещены гетероатомами, как N, О, S, или (С5-С14)арил-(C1-C8)алкил, где в арильной части 1-5 атомов углерода могут быть замещены гетероатомами, как N, О, S, причем комбинации значений заместителей, которые в отдельном случае приводят к нестабильным соединениям, например, к нестабильным свободным карбаминовым кислотам, не принимаются во внимание. Получение этих пролекарственных форм можно осуществлять обычными, известными специалисту, способами для изготовления ациламинов и карбаматов.
Далее, настоящее изобретение не ограничивается соединениями по формулам I и Iа с основным остатком пурина, а включает также такие соединения, которые вместо показанного в формулах I и Iа основного остатка пурина имеют остаток 3-деаза-пурина, остаток 7-деаза-пурина или остаток 7-деаза-8-аза-пурина, следовательно, соединения формул Ib и Ic, Id и Iе, а также If и Ig.
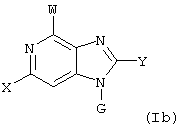 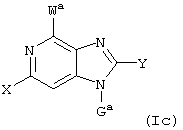
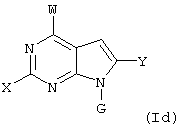 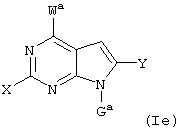
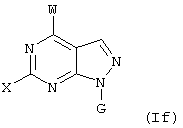 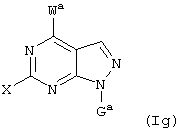 Все вышеизложенные и нижеследующие данные о соединениях формул I и Iа действительны для соединений формул Ib и Iс, Id и Ie, If и Ig соответственно. Если речь идет о соединениях формул I и Ia, то они включают, поскольку нет других указаний, также деаза-аналоги и деаза-аза-аналоги формул Ib и Ic, Id и Ie, If и Ig. Предпочтительно в соединениях по изобретению присутствует действительно показанный в формулах I и Iа пуриновый остаток, в котором в 3-положении и в 7-положении имеются атомы азота и в 8-положении – атом углерода со связанной с ним группой Y.
В соединениях формул I и Ia X обозначает предпочтительно водород, NR6R6’, гидрокси-(C1-C6)алкил или NH-CO-R6, особенно предпочтительно водород, NR6R6’ или NH-CO-R6, еще предпочтительнее водород или NH2. Y обозначает предпочтительно водород, R4 обозначает предпочтительно C(O)R8. Предпочитают также соединения по изобретению формул I и Iа, в которых R3 обозначает R6R6’N-R7, R6OC(О)N(R5)R7, R6S(О)pN(R5)R7, R6C(O)N(R5)R7 или R6N(R6’)C(O)N(R5)R7, причем p здесь обозначает 1 или 2, предпочтительны соединения, в которых R3 обозначает R6OC(O)N(R5)R7 или R6S(O)pN(R5)R7 (с p=1 или 2), при этом особенно предпочитают соединения, в которых R3 содержит липофильный остаток, например, соединения, в которых R6 и/или R6’, например, в группе R6OC(O)N(R5)R7 обозначает (C4-C14)алкил, (С5-С14)арил-(C1-C4)алкил, например, бензил, (С5-С14)циклоалкил или (C5-C14)циклоалкил-(C1-C4)алкил, причем предпочтительные остатки циклоалкила представляют здесь особенно предпочтительно 1-адамантил и 2-адамантил.
Предпочтительную группу соединений согласно изобретению образуют соединения формулы I и Iа, где
X – водород, NH2, ОН или NH-CO-R6;
Y – водород;
G – остаток формулы II
-(CR1R2)n-A-(CR1R2)m-(CR1R3)i-(CR1R2)q-R4 (II);
W – остаток формулы III
B-(CRlR2)r-A’-(CRlR2)s-(CRlR3)k-(CRlR2)t-D-E- (III);
Ga – остаток формулы IIа
-(CR1R2)r-A’-(CR1R2)s-(CR1R3)k-(CR1R2)t-D-E- (IIа);
Wa – остаток формулы IIIa
В-(CR1R2)n-A-(CR1R2)m-(CR1R3)i-(CR1R2)q-R4 (IIIa);
А, А’ – независимо друг от друга прямую связь, -C(O)NR5-, -NR5C(O)-, -С(О)-, -NR5-, -О-, -S-, -SO-, -SO2-, (C5-C14)apилен, причем в остатке арила 1-5 атомов углерода могут быть замещены 1-5 гетероатомами, (С2-С4)алкинилен, (С2-С4)алкенилен или двухвалентный остаток от 3- до 7-членного насыщенного или ненасыщенного кольца, которое может содержать один или два гетероатома, как, например, азот, серу или кислород, и которое может быть замещено однократно или двукратно =O, =S или R3;
R1, R2 – независимо друг от друга Н, фтор, хлор, CN, нитро, (С1-С10)алкил, (С3-С14)циклоалкил, (С3-С12)циклоалкил-(С3-С8)алкил, (С5-С14)арил, (С5-С14)арил-(С1-С8)алкил, R6-O-R7, R6-S(O)p-R7 или R6R6’N-R7;
R3 – независимо друг от друга Н, фтор, хлор, CN, нитро, (C1-C14)алкил, (С3-С14)циклоалкил, (С3-С14)циклоалкил-(C1-C8)алкил, (C5-C14)арил, (С5-С14)арил-(C1-C8)алкил, R6-O-R7, R6-S(O)n-R7, R6R6’N-R7, R6CO2R7, R6COR7, R6OC(O)R7, R6N(R5)С(O)OR7, R6S-(O)pN(R5)R7, R6OC(O)N(R5)R7, R6C(O)N(R5)R7, R6N(R5)С(O)N(R5)R7, R6N(R5)S(O)pN(R5)R7, R6S(O)pR7, R6SC(O)N(R5)R7, R6C(O)R6, R6N(R5)-C(O)R7 или R6N(R5)S(O)pR7, причем алкил может быть однократно или многократно ненасыщенным и причем алкил или арил может быть замещен однократно или многократно фтором, хлором, бромом, CN, R6N(R5)R7, R6R6’NR7, нитро, R6OC(O)R7, R6C(O)R7, R6N(R5)C(O)R7, R6N(R5)S(O)pR7, R6, R6-O-R7;
R4 – C(O)R8, C(S)R8, S(O)pR8, POR8R8’, L- или D-аминокислоту или от 4- до 8-членный, насыщенный или ненасыщенный гетероцикл, который содержит 1,2,3 или 4 гетероатома из ряда N, О, S, как, например, тетразолил, имидазолил, пиразолил, оксазолил, тиадиазолил;
R5 – Н, (C1-С10)алкил, (С3-С14)циклоалкил, (С3-С14)циклоалкил-(C1-C8)алкил, (С5-С14)арил или (C5-C14)арил-(C1-C8)алкил;
R6, R6’ – независимо друг от друга Н, (C1-C8)алкил, (С3-С14)циклоалкил, (C3-C14)циклоалкил-(C1-C8)алкил, (C5-C14)арил, причем 1-5 атомов углерода могут быть замещены гетероатомами, или (C5-C14)арил-(C1-C8)алкил, причем в части арила 1-5 атомов углерода могут быть замещены гетероатомами, или R6 и R6’ образуют вместе с соединяющими их атомами циклическую систему, которая, в случае необходимости, может содержать также другие гетероатомы из ряда N, S, О, как, например, морфолин, пиперазин, пиперидин, пирролидин;
R7 обозначает независимо друг от друга (C1-C14)алкилен или прямую связь;
R8, R8’ – независимо друг от друга ОН, (С1-С8)алкокси, (C5-C14)арил-(C1-C8)алкокси, (С5-С14)арилокси, (C1-C8)алкилкарбонилокси-(C1-C4)алкокси, (C5-C14)арил-(C1-C8)алкилкарбонилокси-(C1-C6)алкокси, NR6R6’, (С1-С8)диалкиламинокарбонилметилокси, (С5-С14)арил-(C1-C8)диалкиламинокарбонилметилокси, (С5-С14)-ариламино или L- или D-аминокислота;
В обозначает О, S, -NR5-C(O)-, -C(O)-NR5, прямую связь или двухвалентный остаток от 3- до 7-членного насыщенного или ненасыщенного кольца, которое может содержать один или два гетероатома, как, например, азот, сера или кислород, и которое может быть замещено однократно или двукратно =O, =S или R3;
D обозначает прямую связь, -NR6-, -C(O)-NR6-, -NR6-C(O)-SO2NR6-, -NR6-C(O)-NR6, -NR6-C(S)-NR6-, -NR6-S(O)u-NR6-, -NR6-C(O)O-, -NR6-N=CR6-, -NR6-S(O)u-, -(C5-C14)арил-СО-, -(C5-C14)-арил-S(O)u-, -N=CR6-, -R6C=N- или –R6C=N-NR6;
E – водород, R6-C(=NR6)NR6-, R6R6’N-C(=NR6)-, R6R6’N-C(=NR6)-NR6– или от 4- до 11-членную, моно- или полициклическую, ароматическую или неароматическую систему, которая, в случае необходимости, может содержать 1-4 гетероатома из ряда N, О и S, и, в случае необходимости, может быть замещена однократно-трехкратно R3, R5, =O, =S или R6R6’N-C(=NR6)-, как, например, остатки, указанные в вышеназванном определении E с их структурными формулами;
n – нуль, один, два, три, четыре или пять;
m – нуль, один, два, три, четыре или пять;
i – нуль или один;
p – независимо друг от друга нуль, один или два;
q – независимо друг от друга нуль, один или два;
r – нуль, один, два, три, четыре, пять или шесть;
s – нуль, один, два, три, четыре или пять;
t – нуль, один, два, три, четыре или пять;
k – нуль или один;
u – один или два;
v – в вышеназванных для Е остатках числа нуль, один, два или три;
во всех их стереоизомерных формах и смесях во всех отношениях, и их физиологически переносимые соли, причем в эту группу предпочтительных соединений не включены аналоги с 3-деаза-пуриновым остатком, 7-деаза-пуриновым остатком или 7-деаза-8-аза-пуриновым остатком.
Другую группу предпочтительных соединений образуют соединения формул I и Iа, где
X – водород, NR6R6’, гидрокси(C1-C6)алкил-NH или NH-CO-R6;
Y – водород;
G – остаток формулы II
-(CR1R2)n-A-(CR1R2)m-(CR1R3)i-(CR1R2)q-R4 (II);
W – остаток формулы III
B-(CRlR2)r-A’-(CRlR2)s-(CRlR3)k-(CRlR2)t-D-E- (III);
Ga – остаток формулы IIа
-(CR1R2)r-A’-(CR1R2)s-(CR1R3)k-(CR1R2)t-D-E- (IIа);
Wa – остаток формулы IIIa
В-(CR1R2)n-A-(CR1R2)m-(CR1R3)i-(CR1R2)q-R4 (IIIa);
А, А’ обозначают независимо друг от друга прямую связь, -C(O)NR5-, -NR5C(O)-, -С(О)-, -NR5-, -О-, -S-, -SO-, -SO2-, (С2-С4)алкинилен, (С2-С4)алкенилен или (С5-С14)арилен, причем в остатке арила 1-3 атома углерода могут быть замещены одним-тремя гетероатомами из ряда О, N, S;
R1, R2 – независимо друг от друга водород, фтор, циано, (С1-С4)алкил, (С5-С6)арил, (C5-C6)арил-(C1-C4)алкил, R6-O-R7 или R6R6’N-R7;
R3 – независимо друг от друга водород, (C1-C18)алкил, (С3-C14)циклоалкил, (С3-С14)циклоалкил-(C1-C8)алкил, (C5-C14)арил, (C5-C14)арил-(C1-C8)алкил, R6R6’N-R7, R6C(O)R7, R6S(О)pN(R5)R7, R6OC(O)N(R5)R7, R6C(O)N(R5)R7, R6N(R6’)С(О)N(R5)R7, R6N(R6’)S(О)рN(R5)R7 или R6N(R6’)C(O)R7, причем алкил может быть однократно или многократно ненасыщенным и причем алкил или арил может быть однократно или многократно замещен фтором, хлором, бромом, циано, R6R6’NR7, нитро, R6OC(O)R7, R6C(O)R7, R6N(R6’)C(O)R7, R6N(R6’)S(O)pR7, R6, R6OR7;
R4 – C(O)R8;
R5 – независимо друг от друга водород или (C1-C4)алкил;
R6, R6’ – независимо друг от друга водород, (C1-C18)алкил, (С3-C14)циклоалкил, (С3-С14)циклоалкил-(C1-C8)алкил, (C5-C14)-арил, где 1-3 атома углерода могут быть замещены 1-3 гетероатомами из ряда N, S, О, или (С5-С14)арил-(C1-C8)алкил, причем в арильной части 1-3 атома углерода могут быть замещены 1-3 гетероатомами из ряда N, S, О, или R6 и R6’ образуют вместе со связывающими их атомами циклическую систему, которая, в случае необходимости, может содержать также дополнительные гетероатомы из ряда N, S, О, как, например, морфолин, пиперазин, пиперидин, пирролидин;
R7 – независимо друг от друга (С1-С2)алкилен или прямая связь;
R8 – независимо друг от друга гидрокси, (C1-C4)алкокси, (С5-С14)арил-(C1-C4)алкокси, (С5-С14)арилокси, (С1-С8)алкилкарбонилокси- (C1-C4)алкокси, (С5-С14)арил-(C1-C4)алкилкарбонилокси-(C1-C4)алкокси или остаток аминокислоты;
В обозначает -О-, -S-, -NR5– прямую связь или двухвалентный остаток от 3- до 7-членного насыщенного или ненасыщенного кольца, которое может содержать один или два гетероатома, как, например, азот, серу или кислород, и которое может быть замещено однократно или двукратно остатками из ряда =O, =S или R3;
D обозначает прямую связь, -NR6-, -C(O)-NR6-, -NR6-C(O)-NR6-C(O)-NR6-, -NR6-C(O)O-, -NR6-N=CR6-, -R6C=N-NR6-, -N=CR6– или –R6C=N-, причем обозначающие D двухвалентные остатки через свободную связь на правой стороне связаны с группой E;
E – водород, R6-C(=NR6)NR6’-, R6R6’N-C(=NR6’)-, R6R6’N-C(=N-R6’)-NR6– или остаток из ряда
Все вышеизложенные и нижеследующие данные о соединениях формул I и Iа действительны для соединений формул Ib и Iс, Id и Ie, If и Ig соответственно. Если речь идет о соединениях формул I и Ia, то они включают, поскольку нет других указаний, также деаза-аналоги и деаза-аза-аналоги формул Ib и Ic, Id и Ie, If и Ig. Предпочтительно в соединениях по изобретению присутствует действительно показанный в формулах I и Iа пуриновый остаток, в котором в 3-положении и в 7-положении имеются атомы азота и в 8-положении – атом углерода со связанной с ним группой Y.
В соединениях формул I и Ia X обозначает предпочтительно водород, NR6R6’, гидрокси-(C1-C6)алкил или NH-CO-R6, особенно предпочтительно водород, NR6R6’ или NH-CO-R6, еще предпочтительнее водород или NH2. Y обозначает предпочтительно водород, R4 обозначает предпочтительно C(O)R8. Предпочитают также соединения по изобретению формул I и Iа, в которых R3 обозначает R6R6’N-R7, R6OC(О)N(R5)R7, R6S(О)pN(R5)R7, R6C(O)N(R5)R7 или R6N(R6’)C(O)N(R5)R7, причем p здесь обозначает 1 или 2, предпочтительны соединения, в которых R3 обозначает R6OC(O)N(R5)R7 или R6S(O)pN(R5)R7 (с p=1 или 2), при этом особенно предпочитают соединения, в которых R3 содержит липофильный остаток, например, соединения, в которых R6 и/или R6’, например, в группе R6OC(O)N(R5)R7 обозначает (C4-C14)алкил, (С5-С14)арил-(C1-C4)алкил, например, бензил, (С5-С14)циклоалкил или (C5-C14)циклоалкил-(C1-C4)алкил, причем предпочтительные остатки циклоалкила представляют здесь особенно предпочтительно 1-адамантил и 2-адамантил.
Предпочтительную группу соединений согласно изобретению образуют соединения формулы I и Iа, где
X – водород, NH2, ОН или NH-CO-R6;
Y – водород;
G – остаток формулы II
-(CR1R2)n-A-(CR1R2)m-(CR1R3)i-(CR1R2)q-R4 (II);
W – остаток формулы III
B-(CRlR2)r-A’-(CRlR2)s-(CRlR3)k-(CRlR2)t-D-E- (III);
Ga – остаток формулы IIа
-(CR1R2)r-A’-(CR1R2)s-(CR1R3)k-(CR1R2)t-D-E- (IIа);
Wa – остаток формулы IIIa
В-(CR1R2)n-A-(CR1R2)m-(CR1R3)i-(CR1R2)q-R4 (IIIa);
А, А’ – независимо друг от друга прямую связь, -C(O)NR5-, -NR5C(O)-, -С(О)-, -NR5-, -О-, -S-, -SO-, -SO2-, (C5-C14)apилен, причем в остатке арила 1-5 атомов углерода могут быть замещены 1-5 гетероатомами, (С2-С4)алкинилен, (С2-С4)алкенилен или двухвалентный остаток от 3- до 7-членного насыщенного или ненасыщенного кольца, которое может содержать один или два гетероатома, как, например, азот, серу или кислород, и которое может быть замещено однократно или двукратно =O, =S или R3;
R1, R2 – независимо друг от друга Н, фтор, хлор, CN, нитро, (С1-С10)алкил, (С3-С14)циклоалкил, (С3-С12)циклоалкил-(С3-С8)алкил, (С5-С14)арил, (С5-С14)арил-(С1-С8)алкил, R6-O-R7, R6-S(O)p-R7 или R6R6’N-R7;
R3 – независимо друг от друга Н, фтор, хлор, CN, нитро, (C1-C14)алкил, (С3-С14)циклоалкил, (С3-С14)циклоалкил-(C1-C8)алкил, (C5-C14)арил, (С5-С14)арил-(C1-C8)алкил, R6-O-R7, R6-S(O)n-R7, R6R6’N-R7, R6CO2R7, R6COR7, R6OC(O)R7, R6N(R5)С(O)OR7, R6S-(O)pN(R5)R7, R6OC(O)N(R5)R7, R6C(O)N(R5)R7, R6N(R5)С(O)N(R5)R7, R6N(R5)S(O)pN(R5)R7, R6S(O)pR7, R6SC(O)N(R5)R7, R6C(O)R6, R6N(R5)-C(O)R7 или R6N(R5)S(O)pR7, причем алкил может быть однократно или многократно ненасыщенным и причем алкил или арил может быть замещен однократно или многократно фтором, хлором, бромом, CN, R6N(R5)R7, R6R6’NR7, нитро, R6OC(O)R7, R6C(O)R7, R6N(R5)C(O)R7, R6N(R5)S(O)pR7, R6, R6-O-R7;
R4 – C(O)R8, C(S)R8, S(O)pR8, POR8R8’, L- или D-аминокислоту или от 4- до 8-членный, насыщенный или ненасыщенный гетероцикл, который содержит 1,2,3 или 4 гетероатома из ряда N, О, S, как, например, тетразолил, имидазолил, пиразолил, оксазолил, тиадиазолил;
R5 – Н, (C1-С10)алкил, (С3-С14)циклоалкил, (С3-С14)циклоалкил-(C1-C8)алкил, (С5-С14)арил или (C5-C14)арил-(C1-C8)алкил;
R6, R6’ – независимо друг от друга Н, (C1-C8)алкил, (С3-С14)циклоалкил, (C3-C14)циклоалкил-(C1-C8)алкил, (C5-C14)арил, причем 1-5 атомов углерода могут быть замещены гетероатомами, или (C5-C14)арил-(C1-C8)алкил, причем в части арила 1-5 атомов углерода могут быть замещены гетероатомами, или R6 и R6’ образуют вместе с соединяющими их атомами циклическую систему, которая, в случае необходимости, может содержать также другие гетероатомы из ряда N, S, О, как, например, морфолин, пиперазин, пиперидин, пирролидин;
R7 обозначает независимо друг от друга (C1-C14)алкилен или прямую связь;
R8, R8’ – независимо друг от друга ОН, (С1-С8)алкокси, (C5-C14)арил-(C1-C8)алкокси, (С5-С14)арилокси, (C1-C8)алкилкарбонилокси-(C1-C4)алкокси, (C5-C14)арил-(C1-C8)алкилкарбонилокси-(C1-C6)алкокси, NR6R6’, (С1-С8)диалкиламинокарбонилметилокси, (С5-С14)арил-(C1-C8)диалкиламинокарбонилметилокси, (С5-С14)-ариламино или L- или D-аминокислота;
В обозначает О, S, -NR5-C(O)-, -C(O)-NR5, прямую связь или двухвалентный остаток от 3- до 7-членного насыщенного или ненасыщенного кольца, которое может содержать один или два гетероатома, как, например, азот, сера или кислород, и которое может быть замещено однократно или двукратно =O, =S или R3;
D обозначает прямую связь, -NR6-, -C(O)-NR6-, -NR6-C(O)-SO2NR6-, -NR6-C(O)-NR6, -NR6-C(S)-NR6-, -NR6-S(O)u-NR6-, -NR6-C(O)O-, -NR6-N=CR6-, -NR6-S(O)u-, -(C5-C14)арил-СО-, -(C5-C14)-арил-S(O)u-, -N=CR6-, -R6C=N- или –R6C=N-NR6;
E – водород, R6-C(=NR6)NR6-, R6R6’N-C(=NR6)-, R6R6’N-C(=NR6)-NR6– или от 4- до 11-членную, моно- или полициклическую, ароматическую или неароматическую систему, которая, в случае необходимости, может содержать 1-4 гетероатома из ряда N, О и S, и, в случае необходимости, может быть замещена однократно-трехкратно R3, R5, =O, =S или R6R6’N-C(=NR6)-, как, например, остатки, указанные в вышеназванном определении E с их структурными формулами;
n – нуль, один, два, три, четыре или пять;
m – нуль, один, два, три, четыре или пять;
i – нуль или один;
p – независимо друг от друга нуль, один или два;
q – независимо друг от друга нуль, один или два;
r – нуль, один, два, три, четыре, пять или шесть;
s – нуль, один, два, три, четыре или пять;
t – нуль, один, два, три, четыре или пять;
k – нуль или один;
u – один или два;
v – в вышеназванных для Е остатках числа нуль, один, два или три;
во всех их стереоизомерных формах и смесях во всех отношениях, и их физиологически переносимые соли, причем в эту группу предпочтительных соединений не включены аналоги с 3-деаза-пуриновым остатком, 7-деаза-пуриновым остатком или 7-деаза-8-аза-пуриновым остатком.
Другую группу предпочтительных соединений образуют соединения формул I и Iа, где
X – водород, NR6R6’, гидрокси(C1-C6)алкил-NH или NH-CO-R6;
Y – водород;
G – остаток формулы II
-(CR1R2)n-A-(CR1R2)m-(CR1R3)i-(CR1R2)q-R4 (II);
W – остаток формулы III
B-(CRlR2)r-A’-(CRlR2)s-(CRlR3)k-(CRlR2)t-D-E- (III);
Ga – остаток формулы IIа
-(CR1R2)r-A’-(CR1R2)s-(CR1R3)k-(CR1R2)t-D-E- (IIа);
Wa – остаток формулы IIIa
В-(CR1R2)n-A-(CR1R2)m-(CR1R3)i-(CR1R2)q-R4 (IIIa);
А, А’ обозначают независимо друг от друга прямую связь, -C(O)NR5-, -NR5C(O)-, -С(О)-, -NR5-, -О-, -S-, -SO-, -SO2-, (С2-С4)алкинилен, (С2-С4)алкенилен или (С5-С14)арилен, причем в остатке арила 1-3 атома углерода могут быть замещены одним-тремя гетероатомами из ряда О, N, S;
R1, R2 – независимо друг от друга водород, фтор, циано, (С1-С4)алкил, (С5-С6)арил, (C5-C6)арил-(C1-C4)алкил, R6-O-R7 или R6R6’N-R7;
R3 – независимо друг от друга водород, (C1-C18)алкил, (С3-C14)циклоалкил, (С3-С14)циклоалкил-(C1-C8)алкил, (C5-C14)арил, (C5-C14)арил-(C1-C8)алкил, R6R6’N-R7, R6C(O)R7, R6S(О)pN(R5)R7, R6OC(O)N(R5)R7, R6C(O)N(R5)R7, R6N(R6’)С(О)N(R5)R7, R6N(R6’)S(О)рN(R5)R7 или R6N(R6’)C(O)R7, причем алкил может быть однократно или многократно ненасыщенным и причем алкил или арил может быть однократно или многократно замещен фтором, хлором, бромом, циано, R6R6’NR7, нитро, R6OC(O)R7, R6C(O)R7, R6N(R6’)C(O)R7, R6N(R6’)S(O)pR7, R6, R6OR7;
R4 – C(O)R8;
R5 – независимо друг от друга водород или (C1-C4)алкил;
R6, R6’ – независимо друг от друга водород, (C1-C18)алкил, (С3-C14)циклоалкил, (С3-С14)циклоалкил-(C1-C8)алкил, (C5-C14)-арил, где 1-3 атома углерода могут быть замещены 1-3 гетероатомами из ряда N, S, О, или (С5-С14)арил-(C1-C8)алкил, причем в арильной части 1-3 атома углерода могут быть замещены 1-3 гетероатомами из ряда N, S, О, или R6 и R6’ образуют вместе со связывающими их атомами циклическую систему, которая, в случае необходимости, может содержать также дополнительные гетероатомы из ряда N, S, О, как, например, морфолин, пиперазин, пиперидин, пирролидин;
R7 – независимо друг от друга (С1-С2)алкилен или прямая связь;
R8 – независимо друг от друга гидрокси, (C1-C4)алкокси, (С5-С14)арил-(C1-C4)алкокси, (С5-С14)арилокси, (С1-С8)алкилкарбонилокси- (C1-C4)алкокси, (С5-С14)арил-(C1-C4)алкилкарбонилокси-(C1-C4)алкокси или остаток аминокислоты;
В обозначает -О-, -S-, -NR5– прямую связь или двухвалентный остаток от 3- до 7-членного насыщенного или ненасыщенного кольца, которое может содержать один или два гетероатома, как, например, азот, серу или кислород, и которое может быть замещено однократно или двукратно остатками из ряда =O, =S или R3;
D обозначает прямую связь, -NR6-, -C(O)-NR6-, -NR6-C(O)-NR6-C(O)-NR6-, -NR6-C(O)O-, -NR6-N=CR6-, -R6C=N-NR6-, -N=CR6– или –R6C=N-, причем обозначающие D двухвалентные остатки через свободную связь на правой стороне связаны с группой E;
E – водород, R6-C(=NR6)NR6’-, R6R6’N-C(=NR6’)-, R6R6’N-C(=N-R6’)-NR6– или остаток из ряда
 , ,  , ,  , , 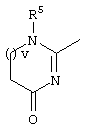 , ,
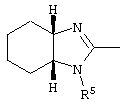 , , 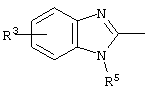 , , 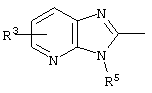 , ,
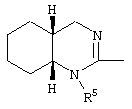 , , 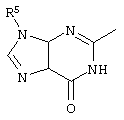 ,
который, в случае необходимости, может быть замещен однократно-трехкратно остатками из ряда R3, R5, =O, =S и R6R6’N-C(=NR6)-;
n – один, два, три или четыре;
m – нуль или один;
i – нуль или один;
q – нуль или один;
p – независимо друг от друга нуль, один или два;
r – нуль, один, два, три, четыре или пять;
s – нуль, один или два;
t – нуль, один или два;
k – нуль или один;
v – нуль, один, два или три;
во всех их стереоизомерных формах и смесях во всех отношениях, их физиологически переносимые соли, а также их пролекарственные формы.
Особенно предпочитают соединения формул I и Iа, где
X – водород, NR6R6’ или NH-CO-R6;
Y – водород;
G – остаток формулы II
-(CR1R2)n-A-(CR1R2)m-(CR1R3)i-(CR1R2)q-R4 (II);
W – остаток формулы III
B-(CRlR2)r-A’-(CRlR2)s-(CRlR3)k-(CRlR2)t-D-E- (III);
Ga – остаток формулы IIа
-(CR1R2)r-A’-(CR1R2)s-(CR1R3)k-(CR1R2)t-D-E- (IIа);
Wa – остаток формулы IIIa
В-(CR1R2)n-A-(CR1R2)m-(CR1R3)i-(CR1R2)q-R4 (IIIa);
A, A’ – независимо друг от друга прямая связь, -C(O)NR5-, -NR5C(O)- или (С5-С6)арилен, причем в арильной части 1-2 атома углерода могут быть замещены атомами азота;
R1, R2 – водород;
R3 – независимо друг от друга водород, (C1-С10)алкил, (С3-С14)циклоалкил, (С3-С14)циклоалкил-(C1-C8)алкил, (С5-С14)арил, (C5-C14)арил-(C1-C8)алкил, R6R6’N-R7, R6OC(O)N(R5)R7, R6C(O)N(R5)R7, R6N(R6’)C(O)N(R5)R7, R6C(O)R7 или R6N(R6’)С(О)R7, причем алкил может быть однократно или многократно ненасыщенным и причем алкил или арил может быть замещен однократно или многократно фтором, хлором, бромом, циано, R6R6’NR7, R6C(O)R7, R6N(R6’)C(O)R7, R6 или R6OR7;
R4 – C(O)R8;
R5 – независимо друг от друга водород или (C1-C4)алкил;
R6, R6’ – независимо друг от друга водород, (C1-C8)алкил, (С3-С12)циклоалкил, (С3-С12)циклоалкил-(C1-C8)алкил, (C5-C14)-арил, где один-три атома углерода могут быть замещены 1-3 гетероатомами из ряда N, S, О, или (C5-C14)арил-(C1-C8)алкил, где в арильной части 1-3 атома углерода могут быть замещены 1-3 гетероатомами из ряда N, S, О;
R7 обозначает прямую связь;
R8 – независимо друг от друга гидрокси, (С1-С4)алкокси, (C5-C14)арил-(C1-C4)алкокси, (C5-C14)арилокси, (C1-C8)алкилкарбонилокси- (C1-C4)алкокси, (С5-С14)арил-(C1-C4)алкилкарбонилокси-(C1-C4)алкокси или остаток аминокислоты;
B обозначает -О-, -S-, -NR5-, прямую связь или двухвалентный остаток от 3- до 7-членного насыщенного или ненасыщенного кольца, которое может содержать один или два гетероатома, как, например, азот, сера или кислород, и которое может быть замещено однократно или двукратно остатками из ряда =O, =S или R3;
D обозначает прямую связь, -NR6-, -C(O)-NR6– или -NR6-С(O)-;
E – водород, R6-C(=NR6)-NR6’-, R6R6’N-C(=NR6’)-, R6R6’N-C-(=NR6’)-NR6– или остаток из ряда ,
который, в случае необходимости, может быть замещен однократно-трехкратно остатками из ряда R3, R5, =O, =S и R6R6’N-C(=NR6)-;
n – один, два, три или четыре;
m – нуль или один;
i – нуль или один;
q – нуль или один;
p – независимо друг от друга нуль, один или два;
r – нуль, один, два, три, четыре или пять;
s – нуль, один или два;
t – нуль, один или два;
k – нуль или один;
v – нуль, один, два или три;
во всех их стереоизомерных формах и смесях во всех отношениях, их физиологически переносимые соли, а также их пролекарственные формы.
Особенно предпочитают соединения формул I и Iа, где
X – водород, NR6R6’ или NH-CO-R6;
Y – водород;
G – остаток формулы II
-(CR1R2)n-A-(CR1R2)m-(CR1R3)i-(CR1R2)q-R4 (II);
W – остаток формулы III
B-(CRlR2)r-A’-(CRlR2)s-(CRlR3)k-(CRlR2)t-D-E- (III);
Ga – остаток формулы IIа
-(CR1R2)r-A’-(CR1R2)s-(CR1R3)k-(CR1R2)t-D-E- (IIа);
Wa – остаток формулы IIIa
В-(CR1R2)n-A-(CR1R2)m-(CR1R3)i-(CR1R2)q-R4 (IIIa);
A, A’ – независимо друг от друга прямая связь, -C(O)NR5-, -NR5C(O)- или (С5-С6)арилен, причем в арильной части 1-2 атома углерода могут быть замещены атомами азота;
R1, R2 – водород;
R3 – независимо друг от друга водород, (C1-С10)алкил, (С3-С14)циклоалкил, (С3-С14)циклоалкил-(C1-C8)алкил, (С5-С14)арил, (C5-C14)арил-(C1-C8)алкил, R6R6’N-R7, R6OC(O)N(R5)R7, R6C(O)N(R5)R7, R6N(R6’)C(O)N(R5)R7, R6C(O)R7 или R6N(R6’)С(О)R7, причем алкил может быть однократно или многократно ненасыщенным и причем алкил или арил может быть замещен однократно или многократно фтором, хлором, бромом, циано, R6R6’NR7, R6C(O)R7, R6N(R6’)C(O)R7, R6 или R6OR7;
R4 – C(O)R8;
R5 – независимо друг от друга водород или (C1-C4)алкил;
R6, R6’ – независимо друг от друга водород, (C1-C8)алкил, (С3-С12)циклоалкил, (С3-С12)циклоалкил-(C1-C8)алкил, (C5-C14)-арил, где один-три атома углерода могут быть замещены 1-3 гетероатомами из ряда N, S, О, или (C5-C14)арил-(C1-C8)алкил, где в арильной части 1-3 атома углерода могут быть замещены 1-3 гетероатомами из ряда N, S, О;
R7 обозначает прямую связь;
R8 – независимо друг от друга гидрокси, (С1-С4)алкокси, (C5-C14)арил-(C1-C4)алкокси, (C5-C14)арилокси, (C1-C8)алкилкарбонилокси- (C1-C4)алкокси, (С5-С14)арил-(C1-C4)алкилкарбонилокси-(C1-C4)алкокси или остаток аминокислоты;
B обозначает -О-, -S-, -NR5-, прямую связь или двухвалентный остаток от 3- до 7-членного насыщенного или ненасыщенного кольца, которое может содержать один или два гетероатома, как, например, азот, сера или кислород, и которое может быть замещено однократно или двукратно остатками из ряда =O, =S или R3;
D обозначает прямую связь, -NR6-, -C(O)-NR6– или -NR6-С(O)-;
E – водород, R6-C(=NR6)-NR6’-, R6R6’N-C(=NR6’)-, R6R6’N-C-(=NR6’)-NR6– или остаток из ряда
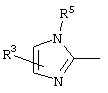 , , 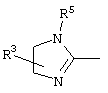 , , 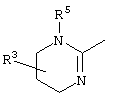 , ,
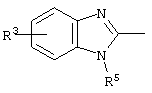 , , 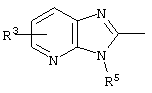 ,
который, в случае необходимости, может быть замещен однократно-трехкратно остатками из ряда R3, R5, =O, =S и R6R6’N-C-(=NR6);
r – нуль, один, два, три, четыре или пять;
s – нуль или один;
t – нуль или один;
k – нуль или один;
n – один, два, три или четыре;
m – нуль или один;
i – нуль или один;
q – один или два;
во всех их стереоизомерных формах и смесях во всех отношениях, их физиологически переносимые соли и их пролекарственные формы.
Далее, особенно предпочитают соединения формулы I, где
X – водород, NR6R6’ или NH-CO-R6;
Y – водород;
G – остаток формулы II
-(CR1R2)n-A-(CR1R2)m-(CR1R3)i-(CR1R2)q-R4 (II);
W – остаток формулы III
B-(CRlR2)r-A’-(CRlR2)s-(CRlR3)k-(CRlR2)t-D-E- (III);
А, А’ – прямая связь;
R1, R2 – независимо друг от друга водород, (C1-C4)алкил, (С5-С6)арил или (C5-C6)арил-(C1-C4)алкил;
R3 – независимо друг от друга водород, (C1-C18)алкил, (С3-С14)циклоалкил, (С3-С14)циклоалкил-(C1-C8)алкил, (C5-C14)арил, (C5-C14)арил-(C1-C8)алкил, R6R6’N-R7, R6OC(O)N(R5)R7, R6SO2N(R5)R7, R6C(O)N(R5)R7, R6N(R6’)C(O)N(R5)R7, R6C(O)R7 или R6N(R6’)C(O)R7, причем алкил может быть однократно или многократно ненасыщенным и причем алкил или арил может быть замещен однократно или многократно фтором, хлором, бромом, циано, R6R6’NR7, R6C(O)R7, R6N(R6’)C(O)R7, R6 или R6OR7;
R4 – C(O)R8;
R5 – независимо друг от друга водород или (С1-С4)алкил;
R6, R6’ – независимо друг от друга водород, (C1-C18)алкил, (C3-C12)циклоалкил, (С3-C12)циклоалкил-(C1-C8)алкил, (С5-С14)-арил, где 1-3 атома углерода могут быть замещены 1-3 гетероатомами из ряда N, S, О, или (C5-C14)арил-(C1-C8)алкил, где в остатках арила 1-3 атома углерода могут быть замещены 1-3 гетероатомами из ряда N, S, О, и причем также 6 и R6’ могут образовывать вместе со связывающими их атомами циклическую систему, которая, в случае необходимости, может содержать также дополнительные, особенно один, два или три гетероатома из ряда N, S, О;
R7 – прямая связь;
R8 независимо друг от друга гидрокси, (С1-С4)алкокси, (С5-С14)арил-(С1-С4)алкокси, (C5-C14)арилокси, (C1-C8)алкилкарбонилокси- (C1-C4)алкокси или (C5-C14)арил-(C1-C4)алкилкарбонилокси-(C1-C4)алкокси;
В – 1,4-пиперидиндиил или 1,4-пиперазиндиил, причем в случае 1,4-пиперидиндиил-остатка атом азота пиперидина связан с пуриновым остатком;
D – прямая связь, -NR6-, -C(O)-NR6– или –NR6-C(O)-;
E – водород, R6-C(=NR6)-NR6’-, R6R6’N-C(=NR6’)-, R6R6’N-C(=NR6’)-NR6– или остаток из ряда ,
который, в случае необходимости, может быть замещен однократно-трехкратно остатками из ряда R3, R5, =O, =S и R6R6’N-C-(=NR6);
r – нуль, один, два, три, четыре или пять;
s – нуль или один;
t – нуль или один;
k – нуль или один;
n – один, два, три или четыре;
m – нуль или один;
i – нуль или один;
q – один или два;
во всех их стереоизомерных формах и смесях во всех отношениях, их физиологически переносимые соли и их пролекарственные формы.
Далее, особенно предпочитают соединения формулы I, где
X – водород, NR6R6’ или NH-CO-R6;
Y – водород;
G – остаток формулы II
-(CR1R2)n-A-(CR1R2)m-(CR1R3)i-(CR1R2)q-R4 (II);
W – остаток формулы III
B-(CRlR2)r-A’-(CRlR2)s-(CRlR3)k-(CRlR2)t-D-E- (III);
А, А’ – прямая связь;
R1, R2 – независимо друг от друга водород, (C1-C4)алкил, (С5-С6)арил или (C5-C6)арил-(C1-C4)алкил;
R3 – независимо друг от друга водород, (C1-C18)алкил, (С3-С14)циклоалкил, (С3-С14)циклоалкил-(C1-C8)алкил, (C5-C14)арил, (C5-C14)арил-(C1-C8)алкил, R6R6’N-R7, R6OC(O)N(R5)R7, R6SO2N(R5)R7, R6C(O)N(R5)R7, R6N(R6’)C(O)N(R5)R7, R6C(O)R7 или R6N(R6’)C(O)R7, причем алкил может быть однократно или многократно ненасыщенным и причем алкил или арил может быть замещен однократно или многократно фтором, хлором, бромом, циано, R6R6’NR7, R6C(O)R7, R6N(R6’)C(O)R7, R6 или R6OR7;
R4 – C(O)R8;
R5 – независимо друг от друга водород или (С1-С4)алкил;
R6, R6’ – независимо друг от друга водород, (C1-C18)алкил, (C3-C12)циклоалкил, (С3-C12)циклоалкил-(C1-C8)алкил, (С5-С14)-арил, где 1-3 атома углерода могут быть замещены 1-3 гетероатомами из ряда N, S, О, или (C5-C14)арил-(C1-C8)алкил, где в остатках арила 1-3 атома углерода могут быть замещены 1-3 гетероатомами из ряда N, S, О, и причем также 6 и R6’ могут образовывать вместе со связывающими их атомами циклическую систему, которая, в случае необходимости, может содержать также дополнительные, особенно один, два или три гетероатома из ряда N, S, О;
R7 – прямая связь;
R8 независимо друг от друга гидрокси, (С1-С4)алкокси, (С5-С14)арил-(С1-С4)алкокси, (C5-C14)арилокси, (C1-C8)алкилкарбонилокси- (C1-C4)алкокси или (C5-C14)арил-(C1-C4)алкилкарбонилокси-(C1-C4)алкокси;
В – 1,4-пиперидиндиил или 1,4-пиперазиндиил, причем в случае 1,4-пиперидиндиил-остатка атом азота пиперидина связан с пуриновым остатком;
D – прямая связь, -NR6-, -C(O)-NR6– или –NR6-C(O)-;
E – водород, R6-C(=NR6)-NR6’-, R6R6’N-C(=NR6’)-, R6R6’N-C(=NR6’)-NR6– или остаток из ряда
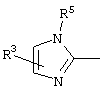 , , 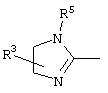 , , 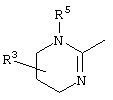 , ,
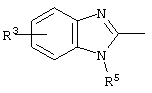 , , 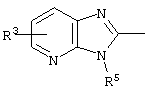 ,
который, в случае необходимости, может быть замещен однократно-трехкратно остатками из ряда R3, R5, =O, =S и R6R6’N-C(=NR6)-;
r – нуль, один или два;
s – нуль или один;
t – нуль или один;
k – нуль или один;
n – нуль, один или два;
m – нуль или один;
i – нуль или один;
q – нуль или один;
во всех их стереоизомерных формах и смесях во всех отношениях, их физиологически переносимые соли и их пролекарственные формы.
Особенно предпочитают соединения формулы I, где
X – водород;
Y – водород;
G – остаток формулы II
-(CR1R2)n-A-(CR1R2)m-(CR1R3)i-(CR1R2)q-R4 (II);
W – остаток формулы III
B-(CRlR2)r-A’-(CRlR2)s-(CRlR3)k-(CRlR2)t-D-E- (III);
А, А’ – прямую связь;
R1, R2 – независимо друг от друга водород или (С1-C2)алкил, особенно водород;
R3 – R6R6’N-R7, R6OC(O)N(R5)R7, R6SO2N(R5)R7, R6C(О)N(R5)R7 или R6N(R6’)C(O)N(R5)R7, особенно предпочтительно R6OC(O)N(R5)R7;
R4 – C(O)R8;
R5 – водород или (С1-С2)алкил, особенно предпочтительно водород;
R6, R6’ – независимо друг от друга водород, (C1-C18)алкил, (С3-С12)циклоалкил, (С3-С12)циклоалкил-(С1-С8)алкил, (C5-C14)-арил, где 1-3 атома углерода могут быть замещены 1-3 гетероатомами из ряда N, S, О, или (С5-С14)арил-(C1-C8)алкил, где в остатках арила 1-3 атома углерода могут быть замещены 1-3 гетероатомами из ряда N, S, О, и причем также 6 и R6’ могут образовывать вместе со связывающими их атомами циклическую систему, которая, в случае необходимости, может содержать также дополнительные, особенно один, два или три, гетероатома из ряда N, S, О;
R7 – прямая связь;
R8 – гидрокси, (C1-C4)алкокси, (C5-C14)арил-(C1-C4)алкокси, (С5-С14)арилокси, (С1-С8)алкилкарбонилокси-(С1-С4)алкокси или (C5-C14)арил-(C1-C4)алкилкарбонилокси-(C1-C4)алкокси, особенно предпочтительно гидрокси или (C1-C4)алкокси;
В – 1,4-пиперидиндиил, причем атом азота пиперидина связан с пуриновым остатком;
D – -NR6– или -C(O)-NR6-, причем в группе -C(O)-NR6– атом азота связан с группой E;
E – R6R6’N-C(=NR6)- или остаток из ряда ,
который, в случае необходимости, может быть замещен однократно-трехкратно остатками из ряда R3, R5, =O, =S и R6R6’N-C(=NR6)-;
r – нуль, один или два;
s – нуль или один;
t – нуль или один;
k – нуль или один;
n – нуль, один или два;
m – нуль или один;
i – нуль или один;
q – нуль или один;
во всех их стереоизомерных формах и смесях во всех отношениях, их физиологически переносимые соли и их пролекарственные формы.
Особенно предпочитают соединения формулы I, где
X – водород;
Y – водород;
G – остаток формулы II
-(CR1R2)n-A-(CR1R2)m-(CR1R3)i-(CR1R2)q-R4 (II);
W – остаток формулы III
B-(CRlR2)r-A’-(CRlR2)s-(CRlR3)k-(CRlR2)t-D-E- (III);
А, А’ – прямую связь;
R1, R2 – независимо друг от друга водород или (С1-C2)алкил, особенно водород;
R3 – R6R6’N-R7, R6OC(O)N(R5)R7, R6SO2N(R5)R7, R6C(О)N(R5)R7 или R6N(R6’)C(O)N(R5)R7, особенно предпочтительно R6OC(O)N(R5)R7;
R4 – C(O)R8;
R5 – водород или (С1-С2)алкил, особенно предпочтительно водород;
R6, R6’ – независимо друг от друга водород, (C1-C18)алкил, (С3-С12)циклоалкил, (С3-С12)циклоалкил-(С1-С8)алкил, (C5-C14)-арил, где 1-3 атома углерода могут быть замещены 1-3 гетероатомами из ряда N, S, О, или (С5-С14)арил-(C1-C8)алкил, где в остатках арила 1-3 атома углерода могут быть замещены 1-3 гетероатомами из ряда N, S, О, и причем также 6 и R6’ могут образовывать вместе со связывающими их атомами циклическую систему, которая, в случае необходимости, может содержать также дополнительные, особенно один, два или три, гетероатома из ряда N, S, О;
R7 – прямая связь;
R8 – гидрокси, (C1-C4)алкокси, (C5-C14)арил-(C1-C4)алкокси, (С5-С14)арилокси, (С1-С8)алкилкарбонилокси-(С1-С4)алкокси или (C5-C14)арил-(C1-C4)алкилкарбонилокси-(C1-C4)алкокси, особенно предпочтительно гидрокси или (C1-C4)алкокси;
В – 1,4-пиперидиндиил, причем атом азота пиперидина связан с пуриновым остатком;
D – -NR6– или -C(O)-NR6-, причем в группе -C(O)-NR6– атом азота связан с группой E;
E – R6R6’N-C(=NR6)- или остаток из ряда
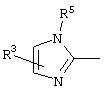 , , 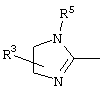 , , 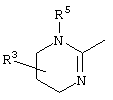 , ,
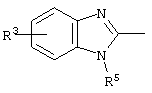 , , 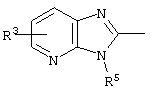 ,
который, в случае необходимости, может быть замещен однократно-трехкратно остатками из ряда R3, R5, =O, =S и R6R6’N-C(=NR6)-;
r – нуль или одну;
s – нуль;
t – нуль;
k – нуль;
n – один;
m – нуль;
i – один;
q – нуль;
во всех их стереоизомерных формах и смесях во всех отношениях, их физиологически переносимые соли и их пролекарственные формы.
Специально предпочтительные соединения по изобретению представляют соединения формулы I ,
который, в случае необходимости, может быть замещен однократно-трехкратно остатками из ряда R3, R5, =O, =S и R6R6’N-C(=NR6)-;
r – нуль или одну;
s – нуль;
t – нуль;
k – нуль;
n – один;
m – нуль;
i – один;
q – нуль;
во всех их стереоизомерных формах и смесях во всех отношениях, их физиологически переносимые соли и их пролекарственные формы.
Специально предпочтительные соединения по изобретению представляют соединения формулы I
  где R3 обозначает R6R6’N-R7, R6OC(O)N(R5)R7, R6SO2N(R5)R7, R6C(O)N(R5)R7 или R6N(R6’)C(O)N(R5)R7, особенно предпочтительно R6OC(O)N(R5)R7, и Rh обозначает группу карбоновой кислоты СООН или производное карбоновой кислоты, например, эфир, как, например, (С1-С4)алкиловый эфир, следовательно, например, группу СОО-(С1-С4)алкил;
во всех их стереоизомерных формах и смесях во всех отношениях, их физиологически переносимые соли и их пролекарственные формы. В соединениях формулы Ih, в которых 7 обозначает прямую связь, стереохимический центр (h) в формуле Ih имеет S-конфигурацию. Соединения формулы Ih, в которых R7 обозначает прямую связь, можно назвать как замещенные, в случае необходимости, по 2-аминогруппе 2-амино-3-(6-(4-(1,4,5,6-тетрагидропиримидин-2-ил-карбамоил)пиперидин-1-ил)пурин-9-ил)пропионовую кислоту и ее производные, например ее эфиры. Особенно предпочитают 2S-бензилоксикарбониламино-3-(6-(4-(1,4,5,6-тетрагидропиримидин-2-ил-карбамоил)пиперидин-1-ил)пурин-9-ил)пропионовую кислоту формулы Ik, ее физиологически переносимые соли и ее пролекарственные формы.
Соединения формулы I и Iа обычно можно получать, например, в ходе конвергентного синтеза путем связывания двух или нескольких фрагментов, которые можно образовывать ретросинтезом из формул I и Iа. При получении соединений формул I и Iа обычно в ходе синтеза может быть выгодным или необходимым применение функциональных групп, которые на соответствующей стадии синтеза могли бы приводить к нежелательным реакциям или к побочным реакциям в виде предварительных стадий, которые позднее переводят в желательные функциональные группы, или временное блокирование функциональных групп по методу защитных групп соответствующего синтеза, что известно специалисту (Green, Wuts, Protective Groups in Organic Synthesis, Wiley, 1991).
Предметом настоящего изобретения являются также способы синтеза соединений формулы I, которые отличаются тем, что осуществляют одну или несколько из следующих стадий синтеза соединений формулы I.
a1). Соединение формулы IV
где R3 обозначает R6R6’N-R7, R6OC(O)N(R5)R7, R6SO2N(R5)R7, R6C(O)N(R5)R7 или R6N(R6’)C(O)N(R5)R7, особенно предпочтительно R6OC(O)N(R5)R7, и Rh обозначает группу карбоновой кислоты СООН или производное карбоновой кислоты, например, эфир, как, например, (С1-С4)алкиловый эфир, следовательно, например, группу СОО-(С1-С4)алкил;
во всех их стереоизомерных формах и смесях во всех отношениях, их физиологически переносимые соли и их пролекарственные формы. В соединениях формулы Ih, в которых 7 обозначает прямую связь, стереохимический центр (h) в формуле Ih имеет S-конфигурацию. Соединения формулы Ih, в которых R7 обозначает прямую связь, можно назвать как замещенные, в случае необходимости, по 2-аминогруппе 2-амино-3-(6-(4-(1,4,5,6-тетрагидропиримидин-2-ил-карбамоил)пиперидин-1-ил)пурин-9-ил)пропионовую кислоту и ее производные, например ее эфиры. Особенно предпочитают 2S-бензилоксикарбониламино-3-(6-(4-(1,4,5,6-тетрагидропиримидин-2-ил-карбамоил)пиперидин-1-ил)пурин-9-ил)пропионовую кислоту формулы Ik, ее физиологически переносимые соли и ее пролекарственные формы.
Соединения формулы I и Iа обычно можно получать, например, в ходе конвергентного синтеза путем связывания двух или нескольких фрагментов, которые можно образовывать ретросинтезом из формул I и Iа. При получении соединений формул I и Iа обычно в ходе синтеза может быть выгодным или необходимым применение функциональных групп, которые на соответствующей стадии синтеза могли бы приводить к нежелательным реакциям или к побочным реакциям в виде предварительных стадий, которые позднее переводят в желательные функциональные группы, или временное блокирование функциональных групп по методу защитных групп соответствующего синтеза, что известно специалисту (Green, Wuts, Protective Groups in Organic Synthesis, Wiley, 1991).
Предметом настоящего изобретения являются также способы синтеза соединений формулы I, которые отличаются тем, что осуществляют одну или несколько из следующих стадий синтеза соединений формулы I.
a1). Соединение формулы IV
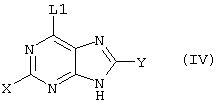 где L1 обозначает обычную, известную специалисту удаляемую группу, например, хлор, бром, иод, OTos или OMes, предпочтительно хлор или бром, и
X и Y определены, как указано выше, однако функциональные группы, в случае необходимости, могут существовать также в форме предварительных стадий или могут быть временно защищены защитной группой,
подвергают взаимодействию с соединением формулы V
L2-(CR1R2)n-A-(CR1R2)m-(CR1R3)i-(CR1R2)q-R10 (V)
где R1, R2, R3, A, n, m, i, и q определены, как указано выше,
R10, как указано выше, обозначает группу R4, однако, в случае необходимости, защищен защитной группой, например, R4=COOH с трет-бутил, метил- или этилзащитной группой,
L2 – гидрокси или известная специалисту удаляемая группа,
до получения соединения формулы VI
где L1 обозначает обычную, известную специалисту удаляемую группу, например, хлор, бром, иод, OTos или OMes, предпочтительно хлор или бром, и
X и Y определены, как указано выше, однако функциональные группы, в случае необходимости, могут существовать также в форме предварительных стадий или могут быть временно защищены защитной группой,
подвергают взаимодействию с соединением формулы V
L2-(CR1R2)n-A-(CR1R2)m-(CR1R3)i-(CR1R2)q-R10 (V)
где R1, R2, R3, A, n, m, i, и q определены, как указано выше,
R10, как указано выше, обозначает группу R4, однако, в случае необходимости, защищен защитной группой, например, R4=COOH с трет-бутил, метил- или этилзащитной группой,
L2 – гидрокси или известная специалисту удаляемая группа,
до получения соединения формулы VI
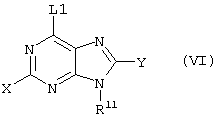 где R11 обозначает -(CR1R2)n-A-(CR1R2)m-(CR1R3)i-(CR1R2)q-R10 и остальные остатки имеют вышеуказанные значения,
причем взаимодействие осуществляют известными специалисту методами (см. литературный источник в J. March, Advanced Organic Chemistry, Fourth Edition, Wiley, 1992). Предпочтительно работают в подходящем органическом растворителе или разбавителе, например: DCM, СНСl3, THF, диэтиловый эфир, н-гептан, н-гексан, н-пентан, циклогексан, диизопропиловый эфир, метил-трет-бутиловый эфир, ацетонитрил, DMF, DMSO, диоксан, толуол, бензол, этиловый эфир уксусной кислоты или смесь этих растворителей, в случае необходимости, при добавлении такого основания, как, например, бутиллитий, литийдиизопропиламид (LDA), гидрид натрия, амид натрия, трет-бутилат калия, СаСО3, Сs2СО3, триэтиламин, диизопропилэтиламин или комплексные основания (амид натрия/R12ONa, причем R12 обозначает (C2-С6)алкил или СН3СН2ОСН2СН2). Для L2=OH можно проводить взаимодействие, например, в описанных для реакции Митсунобу условиях (Hughes, Organic Reactions 42 (1992) 335-656), например, взаимодействием с трифенилфосфином и DEAD в THF.
а2). Соединение формулы VI подвергают взаимодействию с соединением формулы VII
Н-В-(CR1R2)r-А’-(CR1R2)s-(CR1R3)k-(CR1R2)t-R13 (VII)
где R13 обозначает -D-E или группу R14, которая может превращаться в D-E и которая, в случае необходимости, обеспечена подходящими защитными группами, для которых действительны вышеуказанные значения. R14 обозначает, например, защищенную, в случае необходимости, аминогруппу -NHR6, причем в качестве защитной группы можно применять, например, Вос-защитную группу, защищенный эфир карбоновой кислоты, альдегид -С(O)Н, кетогруппу -C(O)R6 или защищенную меркаптогруппу.
При этом получают соединение формулы VIII
где R11 обозначает -(CR1R2)n-A-(CR1R2)m-(CR1R3)i-(CR1R2)q-R10 и остальные остатки имеют вышеуказанные значения,
причем взаимодействие осуществляют известными специалисту методами (см. литературный источник в J. March, Advanced Organic Chemistry, Fourth Edition, Wiley, 1992). Предпочтительно работают в подходящем органическом растворителе или разбавителе, например: DCM, СНСl3, THF, диэтиловый эфир, н-гептан, н-гексан, н-пентан, циклогексан, диизопропиловый эфир, метил-трет-бутиловый эфир, ацетонитрил, DMF, DMSO, диоксан, толуол, бензол, этиловый эфир уксусной кислоты или смесь этих растворителей, в случае необходимости, при добавлении такого основания, как, например, бутиллитий, литийдиизопропиламид (LDA), гидрид натрия, амид натрия, трет-бутилат калия, СаСО3, Сs2СО3, триэтиламин, диизопропилэтиламин или комплексные основания (амид натрия/R12ONa, причем R12 обозначает (C2-С6)алкил или СН3СН2ОСН2СН2). Для L2=OH можно проводить взаимодействие, например, в описанных для реакции Митсунобу условиях (Hughes, Organic Reactions 42 (1992) 335-656), например, взаимодействием с трифенилфосфином и DEAD в THF.
а2). Соединение формулы VI подвергают взаимодействию с соединением формулы VII
Н-В-(CR1R2)r-А’-(CR1R2)s-(CR1R3)k-(CR1R2)t-R13 (VII)
где R13 обозначает -D-E или группу R14, которая может превращаться в D-E и которая, в случае необходимости, обеспечена подходящими защитными группами, для которых действительны вышеуказанные значения. R14 обозначает, например, защищенную, в случае необходимости, аминогруппу -NHR6, причем в качестве защитной группы можно применять, например, Вос-защитную группу, защищенный эфир карбоновой кислоты, альдегид -С(O)Н, кетогруппу -C(O)R6 или защищенную меркаптогруппу.
При этом получают соединение формулы VIII
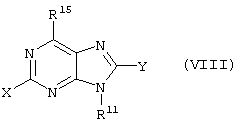 где R15 обозначает -В-(CR1R2)r-A’-(CR1R2)s-(CR1R3)k-(CR1R2)t-R13, и в остальном действительны вышеуказанные значения.
Взаимодействие осуществляют известными специалисту методами (см. J. March, Advanced Organic Chemistry, Fourth Edition, Wiley, 1992), предпочтительно в подходящем органическом растворителе или разбавителе, например: DCM, СНСl3, THF, диэтиловый эфир, н-гептан, н-гексан, н-пентан, циклогексан, диизопропиловый эфир, метил-трет-бутиловый эфир, ацетонитрил, DMF, DMSO, диоксан, толуол, бензол, этиловый эфир уксусной кислоты или смеси этих растворителей, в случае необходимости при добавке основания, как, например, бутиллитий, диизопропиламид лития (LDA), гидрид натрия, амид натрия, трет-бутилат калия, СаСО3, Сs2CO3, триэтиламин, диизопропилэтиламин или комплексные основания (амид натрия/R12ONa, причем R12 обозначает (С2-С6)алкил или СН3СН2ОСH2СН2), причем для B=NR6 в качестве основания может служить также избыток VII.
a3). В случае необходимости, защитные группы в соединении формулы VIII заменяют известными методами (Green, Wuts, Protective Groups in Organic Synthesis, Wiley, 1991) на R13 и/или R10. Если, например, R13 обозначает защищенную Воc аминогруппу, то Вос-группу можно, например, удалить взаимодействием с трифторуксусной кислотой.
а4). После этого, в случае необходимости, R13 в соединении формулы VIII превращают известными методами в группу D-Е, например, по одному из следующих способов.
а4.1). Взаимодействием соединений с R13=NHR6 с 1Н-пиразол-1-карбоксамидином или цианамидом получают гуанидин (см. Bernatowicz et al., J. Org. Chem., 57 (1992), 2497).
а4.2). Взаимодействием соединений с R13=NHR6 с моноциклом или полициклом типа
где R15 обозначает -В-(CR1R2)r-A’-(CR1R2)s-(CR1R3)k-(CR1R2)t-R13, и в остальном действительны вышеуказанные значения.
Взаимодействие осуществляют известными специалисту методами (см. J. March, Advanced Organic Chemistry, Fourth Edition, Wiley, 1992), предпочтительно в подходящем органическом растворителе или разбавителе, например: DCM, СНСl3, THF, диэтиловый эфир, н-гептан, н-гексан, н-пентан, циклогексан, диизопропиловый эфир, метил-трет-бутиловый эфир, ацетонитрил, DMF, DMSO, диоксан, толуол, бензол, этиловый эфир уксусной кислоты или смеси этих растворителей, в случае необходимости при добавке основания, как, например, бутиллитий, диизопропиламид лития (LDA), гидрид натрия, амид натрия, трет-бутилат калия, СаСО3, Сs2CO3, триэтиламин, диизопропилэтиламин или комплексные основания (амид натрия/R12ONa, причем R12 обозначает (С2-С6)алкил или СН3СН2ОСH2СН2), причем для B=NR6 в качестве основания может служить также избыток VII.
a3). В случае необходимости, защитные группы в соединении формулы VIII заменяют известными методами (Green, Wuts, Protective Groups in Organic Synthesis, Wiley, 1991) на R13 и/или R10. Если, например, R13 обозначает защищенную Воc аминогруппу, то Вос-группу можно, например, удалить взаимодействием с трифторуксусной кислотой.
а4). После этого, в случае необходимости, R13 в соединении формулы VIII превращают известными методами в группу D-Е, например, по одному из следующих способов.
а4.1). Взаимодействием соединений с R13=NHR6 с 1Н-пиразол-1-карбоксамидином или цианамидом получают гуанидин (см. Bernatowicz et al., J. Org. Chem., 57 (1992), 2497).
а4.2). Взаимодействием соединений с R13=NHR6 с моноциклом или полициклом типа
 в котором L3 представляет нуклеофильно замещаемую удаляемую группу, как, например, галоген или SH, SСН3, SОСН3, SО2СН3 или HN-NO2,
получают соединения с конечной группой
в котором L3 представляет нуклеофильно замещаемую удаляемую группу, как, например, галоген или SH, SСН3, SОСН3, SО2СН3 или HN-NO2,
получают соединения с конечной группой
 (относительно способа см., например, A.F.Mckay et al., J. Med. Chem., 6 (1963), 587; M.N. Buchman et al., J. Am. Chem. Soc., 71 (1949), 766; F. Jung et al., J. Med. Chem., 34 (1991), 1110, или G. Sorba et al., Eur. J. Med. Chem., 21 (1986), 391).
а4.3). Взаимодействием соединений с R13=NHR6 с соединениями типа
(относительно способа см., например, A.F.Mckay et al., J. Med. Chem., 6 (1963), 587; M.N. Buchman et al., J. Am. Chem. Soc., 71 (1949), 766; F. Jung et al., J. Med. Chem., 34 (1991), 1110, или G. Sorba et al., Eur. J. Med. Chem., 21 (1986), 391).
а4.3). Взаимодействием соединений с R13=NHR6 с соединениями типа
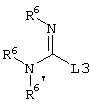 в которых L3 представляет нуклеофильно замещаемую удаляемую группу, как, например, галоген или SH, SСН3, SОСН3, SО2СН3 или HN-NO2,
получают соединения с конечной группой
в которых L3 представляет нуклеофильно замещаемую удаляемую группу, как, например, галоген или SH, SСН3, SОСН3, SО2СН3 или HN-NO2,
получают соединения с конечной группой
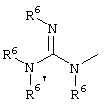 (относительно способа см., например, Miller, Synthesis, 1986, 777, или Brimble, J. Chem. Soc., Perkin Trans., 1 (1990), 311).
а4.4). Взаимодействием соединений с R13=NHR6 с моноциклом или полициклом типа
(относительно способа см., например, Miller, Synthesis, 1986, 777, или Brimble, J. Chem. Soc., Perkin Trans., 1 (1990), 311).
а4.4). Взаимодействием соединений с R13=NHR6 с моноциклом или полициклом типа
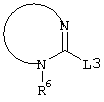 в котором L3 представляет нуклеофильно замещаемую удаляемую группу, как, например, SСН3,
получают соединения с конечной группой
в котором L3 представляет нуклеофильно замещаемую удаляемую группу, как, например, SСН3,
получают соединения с конечной группой
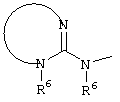 (относительно способа см., например, T.Hiroki et al., Synthesis (1984), 703, или М.Purkayastha et al., Indian J. Chem. Sect., B30 (1991), 646).
a4.5). Соединения, в которых -D-E обозначает остаток аминогуанидилимина типа
(относительно способа см., например, T.Hiroki et al., Synthesis (1984), 703, или М.Purkayastha et al., Indian J. Chem. Sect., B30 (1991), 646).
a4.5). Соединения, в которых -D-E обозначает остаток аминогуанидилимина типа
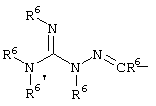 или циклического аминогуанидилимина типа
или циклического аминогуанидилимина типа
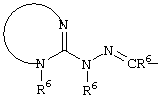 можно получать, например, конденсацией соединений формулы
можно получать, например, конденсацией соединений формулы
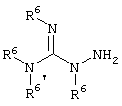 или или 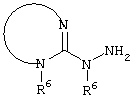 с кетонами или альдегидами типа O=C(R6)- или соответствующими ацеталями или кеталями общепринятыми в литературе способами, например, аналогично N.Desideri et al., Arch. Pharm., 325 (1992), 773-777, или A.Alves et al., Eur. Chem. Chim. Ther., 21 (1986), 297-304, причем вышеуказанные аминогуанидинилимины, в случае необходимости, можно получать в виде смеси E/Z-изомеров, которые можно разделять общепринятыми в хроматографии способами.
а4.6). Соединения, в которых -D-E обозначает R6-C(=NR6)-NR6-N=C(R6)- или содержащий моноцикл или полицикл, остаток типа
с кетонами или альдегидами типа O=C(R6)- или соответствующими ацеталями или кеталями общепринятыми в литературе способами, например, аналогично N.Desideri et al., Arch. Pharm., 325 (1992), 773-777, или A.Alves et al., Eur. Chem. Chim. Ther., 21 (1986), 297-304, причем вышеуказанные аминогуанидинилимины, в случае необходимости, можно получать в виде смеси E/Z-изомеров, которые можно разделять общепринятыми в хроматографии способами.
а4.6). Соединения, в которых -D-E обозначает R6-C(=NR6)-NR6-N=C(R6)- или содержащий моноцикл или полицикл, остаток типа
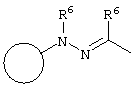 можно получать аналогично а4.5).
а4.7). Соединения, в которых -D- обозначает -S(O)2NR6, можно получать, например, окислением соединений с R13=SH известными из литературы способами (ср. Houben-Weyl, Методы органической химии, том Е12/2, издание Георг Тиме, Штуттгарт, 1985, стр. 1058 и на следующих страницах) до получения сульфокислот (R13=SО3Н), из которых затем, например, непосредственно или через соответствующие галогениды сульфокислоты получают связыванием амидной связи соединения с D- = -S(O)2-NR6-, причем чувствительные к окислению группы в молекуле, например, аминогруппы, амидиногруппы или гуанидиногруппы, если требуется, перед осуществлением окисления защищают подходящими защитными группами.
а4.8). Соединения, в которых -D- обозначает -S(O)NR6, можно получать, например, переводом соединений с R13=SH в соответствующий сульфид и затем окислением при помощи мета-хлорпербензойной кислоты до сульфиновых кислот (R13=SO2H) (ср. Houben-Weyl, Методы органической химии, том Е11/1, Георг Тиме издание, Штуттгарт, 1985, стр. 618 и следующая страница), из которых известными из литературы методами можно получать соответствующие амиды сульфиновой кислоты. Обычно можно использовать также и другие известные из литературы методы для получения соединений формул I и Iа с -D- = S(O)uNR6– (u=1, 2) (ср. Houben-Weyl, Методы органической химии, том E11/1, издание Георг Тиме, Штуттгарт, 1985, стр. 618 и следующие страницы, или том 11/2, Штуттгарт, 1985, стр. 1055 и следующие страницы).
а4.9). Соединения, в которых -D-E- обозначает R6R6’N-C(=NR6)-NR6-C(O)- или остаток циклического ацилгуанидина типа
можно получать аналогично а4.5).
а4.7). Соединения, в которых -D- обозначает -S(O)2NR6, можно получать, например, окислением соединений с R13=SH известными из литературы способами (ср. Houben-Weyl, Методы органической химии, том Е12/2, издание Георг Тиме, Штуттгарт, 1985, стр. 1058 и на следующих страницах) до получения сульфокислот (R13=SО3Н), из которых затем, например, непосредственно или через соответствующие галогениды сульфокислоты получают связыванием амидной связи соединения с D- = -S(O)2-NR6-, причем чувствительные к окислению группы в молекуле, например, аминогруппы, амидиногруппы или гуанидиногруппы, если требуется, перед осуществлением окисления защищают подходящими защитными группами.
а4.8). Соединения, в которых -D- обозначает -S(O)NR6, можно получать, например, переводом соединений с R13=SH в соответствующий сульфид и затем окислением при помощи мета-хлорпербензойной кислоты до сульфиновых кислот (R13=SO2H) (ср. Houben-Weyl, Методы органической химии, том Е11/1, Георг Тиме издание, Штуттгарт, 1985, стр. 618 и следующая страница), из которых известными из литературы методами можно получать соответствующие амиды сульфиновой кислоты. Обычно можно использовать также и другие известные из литературы методы для получения соединений формул I и Iа с -D- = S(O)uNR6– (u=1, 2) (ср. Houben-Weyl, Методы органической химии, том E11/1, издание Георг Тиме, Штуттгарт, 1985, стр. 618 и следующие страницы, или том 11/2, Штуттгарт, 1985, стр. 1055 и следующие страницы).
а4.9). Соединения, в которых -D-E- обозначает R6R6’N-C(=NR6)-NR6-C(O)- или остаток циклического ацилгуанидина типа
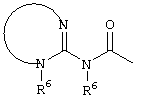 можно получать, например, взаимодействием соединения, в котором R13 обозначает -C(O)-L4 и L4 обозначает легко нуклеофильно замещаемую удаляемую группу с гуанидином (производным) типа
можно получать, например, взаимодействием соединения, в котором R13 обозначает -C(O)-L4 и L4 обозначает легко нуклеофильно замещаемую удаляемую группу с гуанидином (производным) типа
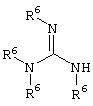 или с циклическим гуанидином (производным) типа
или с циклическим гуанидином (производным) типа
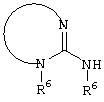 Вышеназванные активированные производные кислоты с группой L4(O)С-, где L4 может обозначать, например, алкоксигруппу, предпочтительно метоксигруппу, феноксигруппу, фенилтиогруппу, метилтиогруппу, 2-пиридилтиогруппу или азотистый гетероцикл, предпочтительно 1-имидазолил, предпочтительно получают известным способом из исходных хлорангидридов карбоновой кислоты (L4=Cl), которые, в свою очередь, можно получать снова известным способом из исходных карбоновых кислот, например, с хлористым тионилом. Наряду с хлорангидридами карбоновой кислоты (L4=Cl) можно получать также другие активированные производные кислоты с группой типа L4(O)C- известным способом непосредственно из исходных карбоновых кислот (L4=ОН), как, например, метиловые сложные эфиры (L4=ОСН3), обработкой при помощи газообразной НСl в метаноле, имидазолиды (L4=1-имидазолил) обработкой при помощи карбонилдиимидазола (ср. Staab, Angew. Chem., Int. Ed. Engl., 1, 351-367, (1962)), или смешанные ангидриды (L4=C2H5OC(O)O или ТоsО) с Сl-СООС2Н5 или хлористым тозилом в присутствии триэтиламина в инертном растворителе. Активирование карбоновых кислот можно проводить также с карбодиимидами, как дициклогексилкарбодиимид (DCCI), или с О-((циано(этоксикарбонил)метилен)амино)-1,1,3,3-тетраметилуроний-тетрафторборатом (“ТОТУ”) (Konig et al., Proc. 21st Europ. Peptide Symp., 1990 (Eds. Giralt, Andreu), Escom, Leiden, 1991, стр. 143) и другие обычные в химии пептидов активирующие реагенты (ряд подходящих методов для получения активированных производных карбоновой кислоты указаны в литературных источниках в J. March, Advanced Organic Chemistry, Third Edition (John Wiley & Sons, 1985), стр. 350). Взаимодействие активированного производного карбоновой кислоты с группой типа L4(O)C- с соответствующим гуанидином (производным) происходит, предпочтительно, известным способом в протонном или апротонном полярном, инертном органическом растворителе, причем взаимодействие метилового эфира (L4=OMe) с соответствующими гуанидинами преимущественно осуществляют в метаноле, изопропаноле или THF при температурах от 20
Вышеназванные активированные производные кислоты с группой L4(O)С-, где L4 может обозначать, например, алкоксигруппу, предпочтительно метоксигруппу, феноксигруппу, фенилтиогруппу, метилтиогруппу, 2-пиридилтиогруппу или азотистый гетероцикл, предпочтительно 1-имидазолил, предпочтительно получают известным способом из исходных хлорангидридов карбоновой кислоты (L4=Cl), которые, в свою очередь, можно получать снова известным способом из исходных карбоновых кислот, например, с хлористым тионилом. Наряду с хлорангидридами карбоновой кислоты (L4=Cl) можно получать также другие активированные производные кислоты с группой типа L4(O)C- известным способом непосредственно из исходных карбоновых кислот (L4=ОН), как, например, метиловые сложные эфиры (L4=ОСН3), обработкой при помощи газообразной НСl в метаноле, имидазолиды (L4=1-имидазолил) обработкой при помощи карбонилдиимидазола (ср. Staab, Angew. Chem., Int. Ed. Engl., 1, 351-367, (1962)), или смешанные ангидриды (L4=C2H5OC(O)O или ТоsО) с Сl-СООС2Н5 или хлористым тозилом в присутствии триэтиламина в инертном растворителе. Активирование карбоновых кислот можно проводить также с карбодиимидами, как дициклогексилкарбодиимид (DCCI), или с О-((циано(этоксикарбонил)метилен)амино)-1,1,3,3-тетраметилуроний-тетрафторборатом (“ТОТУ”) (Konig et al., Proc. 21st Europ. Peptide Symp., 1990 (Eds. Giralt, Andreu), Escom, Leiden, 1991, стр. 143) и другие обычные в химии пептидов активирующие реагенты (ряд подходящих методов для получения активированных производных карбоновой кислоты указаны в литературных источниках в J. March, Advanced Organic Chemistry, Third Edition (John Wiley & Sons, 1985), стр. 350). Взаимодействие активированного производного карбоновой кислоты с группой типа L4(O)C- с соответствующим гуанидином (производным) происходит, предпочтительно, известным способом в протонном или апротонном полярном, инертном органическом растворителе, причем взаимодействие метилового эфира (L4=OMe) с соответствующими гуанидинами преимущественно осуществляют в метаноле, изопропаноле или THF при температурах от 20 С до температуры кипения этих растворителей. При взаимодействии соединений с группой L4(O)C- с обессоленными гуанидинами предпочтительно работают в апротонных инертных растворителях, как THF, диметоксиэтан, диоксан, причем можно применять также воду при использовании основания, как, например, NaOH, в качестве растворителя при взаимодействии соединений с группой L4(O)C- с гуанидинами. Если L4=Cl, работают обычно при добавлении улавливателей кислоты, например, в форме избыточного гуанидина (производного), для связывания галоидоводородной кислоты.
а4.10). Соединения, в которых -D-E обозначает R6-C-(=NR6)-NR6-C(O)-, или содержащий моноцикл или полицикл остаток типа С до температуры кипения этих растворителей. При взаимодействии соединений с группой L4(O)C- с обессоленными гуанидинами предпочтительно работают в апротонных инертных растворителях, как THF, диметоксиэтан, диоксан, причем можно применять также воду при использовании основания, как, например, NaOH, в качестве растворителя при взаимодействии соединений с группой L4(O)C- с гуанидинами. Если L4=Cl, работают обычно при добавлении улавливателей кислоты, например, в форме избыточного гуанидина (производного), для связывания галоидоводородной кислоты.
а4.10). Соединения, в которых -D-E обозначает R6-C-(=NR6)-NR6-C(O)-, или содержащий моноцикл или полицикл остаток типа
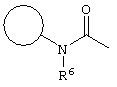 можно получать аналогично а4.9).
а4.11). Соединения, в которых -D-E представляет остаток сульфонилгуанидина или сульфоксилгуанидина типа R6R6’N-C(=N-R6)-NR6-S(O)u– (u=1, 2).
можно получать аналогично а4.9).
а4.11). Соединения, в которых -D-E представляет остаток сульфонилгуанидина или сульфоксилгуанидина типа R6R6’N-C(=N-R6)-NR6-S(O)u– (u=1, 2).
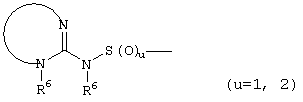 можно получать известными из литературы способами реакцией соединений формул R6R6’N-C(=NR6)-NHR6 или
можно получать известными из литературы способами реакцией соединений формул R6R6’N-C(=NR6)-NHR6 или
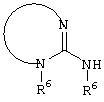 с соединениями, в которых R13 обозначает S(O)u-L5 (u=1, 2) и L5 обозначает, например, Сl или NH2, например, аналогично S.Birtwell et al., J. Chem. Soc., (1946), 491, или Houben Weyl, Методы органической химии, том Е4, изд. Георг Тиме, Штуттгарт 1983, стр. 620 и на следующих страницах.
а4.12). Соединения, в которых -D-E обозначает R6-C(=NR6)NR6-S(O)u– (u=1, 2) или содержащий моноцикл или полицикл остаток типа
с соединениями, в которых R13 обозначает S(O)u-L5 (u=1, 2) и L5 обозначает, например, Сl или NH2, например, аналогично S.Birtwell et al., J. Chem. Soc., (1946), 491, или Houben Weyl, Методы органической химии, том Е4, изд. Георг Тиме, Штуттгарт 1983, стр. 620 и на следующих страницах.
а4.12). Соединения, в которых -D-E обозначает R6-C(=NR6)NR6-S(O)u– (u=1, 2) или содержащий моноцикл или полицикл остаток типа
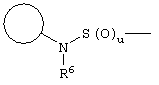 можно получать аналогично а4.11).
а4.13). Соединения, в которых -D- обозначает –NR6-C(O)-, можно получать, например, взаимодействием соединения с R13 = -NHR6 с подходящим производным угольной кислоты, предпочтительно с фосгеном, дифосгеном (трихлорметиловый эфир хлормуравьиной кислоты), трифосгеном (бис-трихлорметиловый эфир угольной кислоты), этиловым эфиром хлормуравьиной кислоты, изобутиловым эфиром хлормуравьиной кислоты, бис-(1-гидрокси-1-Н-бензолтриазолил)карбонатом или N,N’-карбонилдиимидазолом, в инертном, относительно применяемых реагентов, растворителе, предпочтительно DMF, THF или толуол, при температурах между -20
можно получать аналогично а4.11).
а4.13). Соединения, в которых -D- обозначает –NR6-C(O)-, можно получать, например, взаимодействием соединения с R13 = -NHR6 с подходящим производным угольной кислоты, предпочтительно с фосгеном, дифосгеном (трихлорметиловый эфир хлормуравьиной кислоты), трифосгеном (бис-трихлорметиловый эфир угольной кислоты), этиловым эфиром хлормуравьиной кислоты, изобутиловым эфиром хлормуравьиной кислоты, бис-(1-гидрокси-1-Н-бензолтриазолил)карбонатом или N,N’-карбонилдиимидазолом, в инертном, относительно применяемых реагентов, растворителе, предпочтительно DMF, THF или толуол, при температурах между -20 С и точкой кипения растворителя, предпочтительно между 0 и 60 С и точкой кипения растворителя, предпочтительно между 0 и 60 С, сначала до соединения, в котором R13 обозначает С, сначала до соединения, в котором R13 обозначает
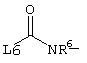 причем L6, в зависимости от применяемого производного угольной кислоты, обозначает, например, гидроксигруппу, галоген, как, например, хлор, этокси, изобутокси, бензотриазол-1-окси или 1-имидазолил. Последующее взаимодействие этих производных с R6R6’N-C(=NR6)-NR6’H или R6-C(=NR6)-NHR6 или с содержащим моноцикл или полицикл соединением типа
причем L6, в зависимости от применяемого производного угольной кислоты, обозначает, например, гидроксигруппу, галоген, как, например, хлор, этокси, изобутокси, бензотриазол-1-окси или 1-имидазолил. Последующее взаимодействие этих производных с R6R6’N-C(=NR6)-NR6’H или R6-C(=NR6)-NHR6 или с содержащим моноцикл или полицикл соединением типа
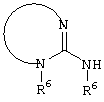 или или 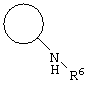 происходит затем, как описано выше, для получения ацилгуанидина (производных в а4.9).
а.4.14). Соединения формулы I, в которых -D-E представляет остаток бис-аминотриазола или остаток бис-аминооксадиазола, можно получать, например, по P.J.Garett et al., Теtrahedron, 49 (1993), 165, или R.Lee Webb et al., J. Heterocyclic Chem., 24 (1987), 275.
а4.15). Соединения формулы I, в которых -D-E представляет группу мочевины или группу тиомочевины, можно синтезировать известными способами, которые описаны, например, в C.Ferri, Реакции органического синтеза, изд. Георг Тиме, Штуттгарт 1978, например, взаимодействием соответствующих анионов с изоцианатами или изотиоцианатами.
а.5). После превращения R13 в соединении формулы VIII к группе D-E, в случае необходимости, отщепляют еще другие удаляемые защитные группы известными способами (см. Green, Wuts, см.выше).
а.6). В случае необходимости, полученные соединения формулы I переводят в соли, особенно в фармацевтически применяемые или нетоксичные, физиологически переносимые соли и/или пролекарственные формы.
Далее, предметом настоящего изобретения являются также способы синтеза соединений формулы Iа, которые отличаются тем, что осуществляют одну или несколько из следующих стадий синтеза соединений формулы Iа.
b1). Соединение формулы IV подвергают взаимодействию с соединением формулы IX
L2-(CR1R2)r-А’-(CR1R2)s-(CR1R3)k-(CR1R2)t-R13 (IX)
где R1, R2, R3, A’, r, s, k, t, R13 и L2 определены выше, до получения соединения формулы X
происходит затем, как описано выше, для получения ацилгуанидина (производных в а4.9).
а.4.14). Соединения формулы I, в которых -D-E представляет остаток бис-аминотриазола или остаток бис-аминооксадиазола, можно получать, например, по P.J.Garett et al., Теtrahedron, 49 (1993), 165, или R.Lee Webb et al., J. Heterocyclic Chem., 24 (1987), 275.
а4.15). Соединения формулы I, в которых -D-E представляет группу мочевины или группу тиомочевины, можно синтезировать известными способами, которые описаны, например, в C.Ferri, Реакции органического синтеза, изд. Георг Тиме, Штуттгарт 1978, например, взаимодействием соответствующих анионов с изоцианатами или изотиоцианатами.
а.5). После превращения R13 в соединении формулы VIII к группе D-E, в случае необходимости, отщепляют еще другие удаляемые защитные группы известными способами (см. Green, Wuts, см.выше).
а.6). В случае необходимости, полученные соединения формулы I переводят в соли, особенно в фармацевтически применяемые или нетоксичные, физиологически переносимые соли и/или пролекарственные формы.
Далее, предметом настоящего изобретения являются также способы синтеза соединений формулы Iа, которые отличаются тем, что осуществляют одну или несколько из следующих стадий синтеза соединений формулы Iа.
b1). Соединение формулы IV подвергают взаимодействию с соединением формулы IX
L2-(CR1R2)r-А’-(CR1R2)s-(CR1R3)k-(CR1R2)t-R13 (IX)
где R1, R2, R3, A’, r, s, k, t, R13 и L2 определены выше, до получения соединения формулы X
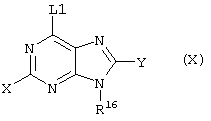 где R16 обозначает -(CR1R2)r-A’-(CR1R2)s-(CR1R3)k-(CR1R2)t-R13,
L1, X и Y определены выше, и в остальном действительны указанные значения.
Взаимодействие осуществляют известными специалисту методами (см. литературный источник в J. March, Advanced Organic Chemistry, Fourth Edition, Wiley, 1992), предпочтительно в подходящем органическом растворителе или разбавителе, например: DCM, СНСl3, THF, диэтиловый эфир, н-гептан, н-гексан, н-пентан, циклогексан, диизопропиловый эфир, метил-трет-бутиловый эфир, ацетонитрил, DMF, DMSO, диоксан, толуол, бензол, этиловый эфир уксусной кислоты или смеси этих растворителей, в случае необходимости при добавлении основания, например: бутиллитий, литийдиизопропиламид (LDA), гидрид натрия, амид натрия, трет-бутилат калия, СаСО3, СsСО3, триэтиламин, диизопропилэтиламин, или комплексных оснований (амид натрия/-R12ONa, причем R12 обозначает (С2-С6)алкил или СН3СН2ОСН2СН2). Для L2=OH взаимодействие можно осуществлять, например, в описанных для реакции Митсунобу условиях (Hughes, Organic Reactions, 42 (1992), 335-656), например, взаимодействием с трифенилфосфином и DEAD в THF.
b2). Соединение формулы X подвергают взаимодействию с соединением формулы XI
Н-В-(CR1R2)n-A-(CR1R2)m-(CR1R3)i-(CR1R2)q-R10 (XI)
в которой R1, R2, R3, R10, А, В, n, m, i и q определены выше, до получения соединения формулы XII
где R16 обозначает -(CR1R2)r-A’-(CR1R2)s-(CR1R3)k-(CR1R2)t-R13,
L1, X и Y определены выше, и в остальном действительны указанные значения.
Взаимодействие осуществляют известными специалисту методами (см. литературный источник в J. March, Advanced Organic Chemistry, Fourth Edition, Wiley, 1992), предпочтительно в подходящем органическом растворителе или разбавителе, например: DCM, СНСl3, THF, диэтиловый эфир, н-гептан, н-гексан, н-пентан, циклогексан, диизопропиловый эфир, метил-трет-бутиловый эфир, ацетонитрил, DMF, DMSO, диоксан, толуол, бензол, этиловый эфир уксусной кислоты или смеси этих растворителей, в случае необходимости при добавлении основания, например: бутиллитий, литийдиизопропиламид (LDA), гидрид натрия, амид натрия, трет-бутилат калия, СаСО3, СsСО3, триэтиламин, диизопропилэтиламин, или комплексных оснований (амид натрия/-R12ONa, причем R12 обозначает (С2-С6)алкил или СН3СН2ОСН2СН2). Для L2=OH взаимодействие можно осуществлять, например, в описанных для реакции Митсунобу условиях (Hughes, Organic Reactions, 42 (1992), 335-656), например, взаимодействием с трифенилфосфином и DEAD в THF.
b2). Соединение формулы X подвергают взаимодействию с соединением формулы XI
Н-В-(CR1R2)n-A-(CR1R2)m-(CR1R3)i-(CR1R2)q-R10 (XI)
в которой R1, R2, R3, R10, А, В, n, m, i и q определены выше, до получения соединения формулы XII
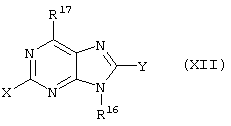 где R16, X и Y определены выше,
R17 обозначает В-(CR1R2)n-A-(CR1R2)m-(CR1R3)i-(CR1R2)q-R10 и в остальном действительны указанные значения.
b3). Для дальнейшего синтеза соединений формулы Iа действуют аналогично стадиям а3)-а6) при синтезе соединений формулы I.
В способе синтеза соединений формулы I можно осуществлять также стадию а2) перед a1). В способе синтеза соединений формулы Iа можно осуществлять стадию b2) также перед b1).
Введение заместителя-углерода в 6-положнение пуринового остатка можно осуществлять, например, сочетанием по Штилле, как, например, описано в Langli et al., Tetrahedron, 52 (1996), 5625; Gundersen, Tetrahedron Lett., 35 (1994), 3153, или сочетанием по Хекке, как, например, описано в Koyama et al., Nucleic Acid Res., Symp. Ser., 11 (1982), 41.
Заместитель X в положении 2 пуринового остатка можно вводить также в конце синтеза соединений формул I и Iа известными способами, как, например, описано в D.A.Nugiel, J. Org. Chem., 62 (1997), 201-203; N.S.Gray, Tetrahedron Lett., 38 (1997), 1161, и в цитированной там литературе.
Обозначающий Y заместитель можно вводить в 8-положение известными способами, как, например, описано в E.J.Reist и др., J. Org. Chem., 33 (1968), 1600; J.L.Kelley et al., J. Med. Chem., 33 (1990), 196, или E.Vanotti et al., Eur. J. Chem., 29 (1994), 287.
Соединения по изобретению формул I и Iа и их физиологически приемлемые соли можно назначать животному, предпочтительно млекопитающему, особенно человеку, в качестве лекарственных средств как таковых, в смесях друг с другом или в форме фармацевтических препаратов, которые допускают энтеральное и парентеральное применение и которые в качестве активных компонентов содержат эффективную дозу, по меньшей мере, одного соединения формулы I или формулы Iа или их соль или их лекарственные формы наряду с обычными фармацевтически приемлемыми веществами-носителями и/или дополнительными веществами. Фармацевтические препараты содержат обычно около 0,5-90 вес.% терапевтически эффективных соединений.
Лекарственные средства можно назначать орально, например, в форме пилюль, таблеток, таблеток в оболочке, драже, гранулятов, твердых и мягких желатиновых капсул, растворов, сиропов, эмульсий, суспензий или аэрозольных смесей. Но назначение может быть также ректальным, например, в форме свечей, или парентеральным, например, в форме растворов для инъекций или растворов для внутривенного введения, микрокапсул или палочек, через кожу, например, в форме мазей или настоек, или через нос, например, в форме жидкости для носа.
Получение фармацевтических препаратов осуществляют известным способом, причем применяют фармацевтически инертные неорганические или органические вещества-носители. Для получения пилюль, таблеток, драже и твердых желатиновых капсул можно применять, например, лактозу, кукурузный крахмал или его производные, тальк, стеариновую кислоту или ее соли и т.д. Вещества-носители для мягких желатиновых капсул и свечи представляют, например, жиры, воски, полутвердые и жидкие многоатомные спирты, природные или отвержденные масла и т.д. В качестве веществ-носителей для получения растворов и сиропов применяют, например, воду, сахарозу, инвертный сахар, глюкозу, многоатомные спирты и т.д. В качестве веществ-носителей для получения растворов для инъекций применяют также воду, спирты, глицерин, многоатомные спирты, растительные масла и т.д. Как вещества-носители для микрокапсул, имплантатов или палочек используют смешанные полимеризаты из гликолевой кислоты и молочной кислоты.
Фармацевтические препараты наряду с активными веществами и веществами-носителями могут содержать также еще дополнительные вещества, как, например, наполнители, разбавители, разбрызгивающие вещества, связующие, мягчители, смачиватели, стабилизаторы, эмульгаторы, консерванты, сладкие вещества, красящие вещества, вкусовые или ароматические вещества, загустители, растворители, буферные вещества, затем разбавители или агенты растворения или средства для получения эффекта депо, а также соли для изменения осмотического давления, средства для покрытия или антиоксиданты. Они могут содержать также два или несколько соединений формул I или Iа и/или их физиологически приемлемые соли, далее, наряду, по меньшей мере, с одним соединением формул I или Iа или с одной его солью, они могут содержать одно или несколько других терапевтически эффективных веществ.
Доза может изменяться в широких пределах и в каждом отдельном случае может подбираться индивидуально. При оральном назначении суточная доза составляет, в общем, около 0,01 до 100 мг/кг, предпочтительно от 0,1 до 5 мг/кг, особенно предпочтительно от 0,3 до 0,5 мг/кг веса тела для достижения эффективных результатов. При внутривенном применении суточная доза составляет, в общем, также около 0,01 до 100 мг/кг, предпочтительно от 0,05 до 10 мг/кг веса тела. Суточная доза, особенно при применении более значительных количеств, может быть разделена, например, на несколько, 2, 3 или 4, отдельных назначений. В случае необходимости, в зависимости от индивидуального состояния, может потребоваться отклонение от указанной суточной дозы вверх или вниз.
Кроме того, в качестве активных веществ для лекарственных средств соединения формул I и Iа можно применять также для диагностических целей, например, при диагностике in vitro, и как вспомогательные средства при биохимических исследованиях, при которых добиваются ингибирования витронектинового рецептора или влияния на клеточно-клеточные или клеточно-матричные взаимодействия. Далее, они являются промежуточными продуктами для получения других соединений, особенно других активных веществ для лекарственных средств, которые получают из соединений формул I и Iа, например, изменением или введением остатков или групп.
Используемые сокращения:
АсОН – уксусная кислота
Воc – трет-бутоксикарбонил
DCCI – дициклогексилкарбодиимид
DCM – дихлорметан
DEAD – диэтилазодикарбоксилат
DIPEA – диизопропилэтиламин
DMF – диметилформамид
DMSO – диметилсульфоксид
ЕЕ – этилацетат
HOOBt – 3-гидрокси-4-окси-3,4-дигидро-1,2,3-бензотриазин
МеОН – метанол
Меs – метилсульфонил
RT – комнатная температура
Tf – трифторметилсульфонил
THF – тетрагидрофуран
Тоs – п-толуолсульфонил
Z – бензилоксикарбонил
Примеры
Соединения формул I и Iа, которые в 6-положении пуринового остатка содержат аминогруппу, не являющуюся составной частью кольца, можно считать также производными аденина (=6-аминопурин) и называть соединения как таковые. Заместители
где R16, X и Y определены выше,
R17 обозначает В-(CR1R2)n-A-(CR1R2)m-(CR1R3)i-(CR1R2)q-R10 и в остальном действительны указанные значения.
b3). Для дальнейшего синтеза соединений формулы Iа действуют аналогично стадиям а3)-а6) при синтезе соединений формулы I.
В способе синтеза соединений формулы I можно осуществлять также стадию а2) перед a1). В способе синтеза соединений формулы Iа можно осуществлять стадию b2) также перед b1).
Введение заместителя-углерода в 6-положнение пуринового остатка можно осуществлять, например, сочетанием по Штилле, как, например, описано в Langli et al., Tetrahedron, 52 (1996), 5625; Gundersen, Tetrahedron Lett., 35 (1994), 3153, или сочетанием по Хекке, как, например, описано в Koyama et al., Nucleic Acid Res., Symp. Ser., 11 (1982), 41.
Заместитель X в положении 2 пуринового остатка можно вводить также в конце синтеза соединений формул I и Iа известными способами, как, например, описано в D.A.Nugiel, J. Org. Chem., 62 (1997), 201-203; N.S.Gray, Tetrahedron Lett., 38 (1997), 1161, и в цитированной там литературе.
Обозначающий Y заместитель можно вводить в 8-положение известными способами, как, например, описано в E.J.Reist и др., J. Org. Chem., 33 (1968), 1600; J.L.Kelley et al., J. Med. Chem., 33 (1990), 196, или E.Vanotti et al., Eur. J. Chem., 29 (1994), 287.
Соединения по изобретению формул I и Iа и их физиологически приемлемые соли можно назначать животному, предпочтительно млекопитающему, особенно человеку, в качестве лекарственных средств как таковых, в смесях друг с другом или в форме фармацевтических препаратов, которые допускают энтеральное и парентеральное применение и которые в качестве активных компонентов содержат эффективную дозу, по меньшей мере, одного соединения формулы I или формулы Iа или их соль или их лекарственные формы наряду с обычными фармацевтически приемлемыми веществами-носителями и/или дополнительными веществами. Фармацевтические препараты содержат обычно около 0,5-90 вес.% терапевтически эффективных соединений.
Лекарственные средства можно назначать орально, например, в форме пилюль, таблеток, таблеток в оболочке, драже, гранулятов, твердых и мягких желатиновых капсул, растворов, сиропов, эмульсий, суспензий или аэрозольных смесей. Но назначение может быть также ректальным, например, в форме свечей, или парентеральным, например, в форме растворов для инъекций или растворов для внутривенного введения, микрокапсул или палочек, через кожу, например, в форме мазей или настоек, или через нос, например, в форме жидкости для носа.
Получение фармацевтических препаратов осуществляют известным способом, причем применяют фармацевтически инертные неорганические или органические вещества-носители. Для получения пилюль, таблеток, драже и твердых желатиновых капсул можно применять, например, лактозу, кукурузный крахмал или его производные, тальк, стеариновую кислоту или ее соли и т.д. Вещества-носители для мягких желатиновых капсул и свечи представляют, например, жиры, воски, полутвердые и жидкие многоатомные спирты, природные или отвержденные масла и т.д. В качестве веществ-носителей для получения растворов и сиропов применяют, например, воду, сахарозу, инвертный сахар, глюкозу, многоатомные спирты и т.д. В качестве веществ-носителей для получения растворов для инъекций применяют также воду, спирты, глицерин, многоатомные спирты, растительные масла и т.д. Как вещества-носители для микрокапсул, имплантатов или палочек используют смешанные полимеризаты из гликолевой кислоты и молочной кислоты.
Фармацевтические препараты наряду с активными веществами и веществами-носителями могут содержать также еще дополнительные вещества, как, например, наполнители, разбавители, разбрызгивающие вещества, связующие, мягчители, смачиватели, стабилизаторы, эмульгаторы, консерванты, сладкие вещества, красящие вещества, вкусовые или ароматические вещества, загустители, растворители, буферные вещества, затем разбавители или агенты растворения или средства для получения эффекта депо, а также соли для изменения осмотического давления, средства для покрытия или антиоксиданты. Они могут содержать также два или несколько соединений формул I или Iа и/или их физиологически приемлемые соли, далее, наряду, по меньшей мере, с одним соединением формул I или Iа или с одной его солью, они могут содержать одно или несколько других терапевтически эффективных веществ.
Доза может изменяться в широких пределах и в каждом отдельном случае может подбираться индивидуально. При оральном назначении суточная доза составляет, в общем, около 0,01 до 100 мг/кг, предпочтительно от 0,1 до 5 мг/кг, особенно предпочтительно от 0,3 до 0,5 мг/кг веса тела для достижения эффективных результатов. При внутривенном применении суточная доза составляет, в общем, также около 0,01 до 100 мг/кг, предпочтительно от 0,05 до 10 мг/кг веса тела. Суточная доза, особенно при применении более значительных количеств, может быть разделена, например, на несколько, 2, 3 или 4, отдельных назначений. В случае необходимости, в зависимости от индивидуального состояния, может потребоваться отклонение от указанной суточной дозы вверх или вниз.
Кроме того, в качестве активных веществ для лекарственных средств соединения формул I и Iа можно применять также для диагностических целей, например, при диагностике in vitro, и как вспомогательные средства при биохимических исследованиях, при которых добиваются ингибирования витронектинового рецептора или влияния на клеточно-клеточные или клеточно-матричные взаимодействия. Далее, они являются промежуточными продуктами для получения других соединений, особенно других активных веществ для лекарственных средств, которые получают из соединений формул I и Iа, например, изменением или введением остатков или групп.
Используемые сокращения:
АсОН – уксусная кислота
Воc – трет-бутоксикарбонил
DCCI – дициклогексилкарбодиимид
DCM – дихлорметан
DEAD – диэтилазодикарбоксилат
DIPEA – диизопропилэтиламин
DMF – диметилформамид
DMSO – диметилсульфоксид
ЕЕ – этилацетат
HOOBt – 3-гидрокси-4-окси-3,4-дигидро-1,2,3-бензотриазин
МеОН – метанол
Меs – метилсульфонил
RT – комнатная температура
Tf – трифторметилсульфонил
THF – тетрагидрофуран
Тоs – п-толуолсульфонил
Z – бензилоксикарбонил
Примеры
Соединения формул I и Iа, которые в 6-положении пуринового остатка содержат аминогруппу, не являющуюся составной частью кольца, можно считать также производными аденина (=6-аминопурин) и называть соединения как таковые. Заместители
  которые связаны на атоме азота аминогруппы в 6-положении аденина, при этом принципе наименования рассматривают с добавкой N6. Заместители, которые связаны с атомом азота кольца в 9-положении, снабжены добавкой N9. В названии заместителя в начале указано, через какое положение в заместителе заместитель при выбранном принципе наименования связан с атомом азота N6 или N9. Соответствующее условие действительно для соединений, которые называют N9-замещенными производными пурина.
Пример 1. N6-(1-(5-Гуанидинопентил))-N9-(3-(2S-(бензилоксикарбониламино)пропионовая кислота))аденин.
1а) N9-(3-(2S-Бензилоксикарбониламино)-трет-бутилпропионат))-6-хлорпурин.
2,63 г (17 ммоль) 6-хлорпурина и 4,46 г (16,5 ммоль) трифенилфосфина суспендируют в атмосфере аргона в 50 мл абсолютного THF. К этой смеси добавляют при RT 2,56 мл (16,3 ммоль) DEAD и перемешивают 15 минут при RT, при этом получают прозрачный раствор. К этому раствору добавляют 3,78 г (12,8 ммоль) N-бензилоксикарбонил-L-серин-трет-бутилового эфира (полученного по M.Schultz, H.Kunz, Tetrahedron: Asymmetry 4 (1993), 1205-1220), растворенного в 50 мл абсолютного ТНF, в течение 1,5 часа. После этого перемешивают еще 2 часа при RT. Растворитель выпаривают, остаток растирают с эфиром и хроматографируют на силикагеле (толуол:ЕЕ от 98:2 до 7:3), при этом получают 2,85 г (51%) чистого продукта.
1H-NMR (200 МГц, DMSO):
которые связаны на атоме азота аминогруппы в 6-положении аденина, при этом принципе наименования рассматривают с добавкой N6. Заместители, которые связаны с атомом азота кольца в 9-положении, снабжены добавкой N9. В названии заместителя в начале указано, через какое положение в заместителе заместитель при выбранном принципе наименования связан с атомом азота N6 или N9. Соответствующее условие действительно для соединений, которые называют N9-замещенными производными пурина.
Пример 1. N6-(1-(5-Гуанидинопентил))-N9-(3-(2S-(бензилоксикарбониламино)пропионовая кислота))аденин.
1а) N9-(3-(2S-Бензилоксикарбониламино)-трет-бутилпропионат))-6-хлорпурин.
2,63 г (17 ммоль) 6-хлорпурина и 4,46 г (16,5 ммоль) трифенилфосфина суспендируют в атмосфере аргона в 50 мл абсолютного THF. К этой смеси добавляют при RT 2,56 мл (16,3 ммоль) DEAD и перемешивают 15 минут при RT, при этом получают прозрачный раствор. К этому раствору добавляют 3,78 г (12,8 ммоль) N-бензилоксикарбонил-L-серин-трет-бутилового эфира (полученного по M.Schultz, H.Kunz, Tetrahedron: Asymmetry 4 (1993), 1205-1220), растворенного в 50 мл абсолютного ТНF, в течение 1,5 часа. После этого перемешивают еще 2 часа при RT. Растворитель выпаривают, остаток растирают с эфиром и хроматографируют на силикагеле (толуол:ЕЕ от 98:2 до 7:3), при этом получают 2,85 г (51%) чистого продукта.
1H-NMR (200 МГц, DMSO):  =1,30 (s, 9H, С(СН3)3); 4,48-4,73 (m, 3H, N9-CH2CH(NHZ)); 4,98 (s, 2H, CH2-арил); 7,19-7,40 (m, 5H, арил-Н); 7,87 (d, 1H, NH); 8,61+8,77 (2s, 2H, С6-Н+С8-Н).
MS (FAB): m/e=432,1 (100%; (M+H)+; 376,0 (60).
1b) N6-(1-(5-трет-Бутилоксикарбониламино)пентил))-N9-(3-(2S-(бензилоксикарбониламино)-трет-бутилпропионат))аденин.
К раствору 431 мг (1 ммоль) N9-(3-(2S-(бензилоксикарбониламино)-трет-бутилпропионат))-6-хлорпурина (пример 1а) и 404 мг (2 ммоль) 5-(трет-бутилоксикарбониламино)-1-пентиламина в 5 мл абсолютного DMF добавляют 0,170 мл (1 ммоль) DIPEA и 5 мг иодида калия и перемешивают смесь 72 часа при 40 =1,30 (s, 9H, С(СН3)3); 4,48-4,73 (m, 3H, N9-CH2CH(NHZ)); 4,98 (s, 2H, CH2-арил); 7,19-7,40 (m, 5H, арил-Н); 7,87 (d, 1H, NH); 8,61+8,77 (2s, 2H, С6-Н+С8-Н).
MS (FAB): m/e=432,1 (100%; (M+H)+; 376,0 (60).
1b) N6-(1-(5-трет-Бутилоксикарбониламино)пентил))-N9-(3-(2S-(бензилоксикарбониламино)-трет-бутилпропионат))аденин.
К раствору 431 мг (1 ммоль) N9-(3-(2S-(бензилоксикарбониламино)-трет-бутилпропионат))-6-хлорпурина (пример 1а) и 404 мг (2 ммоль) 5-(трет-бутилоксикарбониламино)-1-пентиламина в 5 мл абсолютного DMF добавляют 0,170 мл (1 ммоль) DIPEA и 5 мг иодида калия и перемешивают смесь 72 часа при 40 С. Растворитель выпаривают и остаток хроматографируют на силикагеле (толуол:ЕЕ от 7:3 до 1:2), при этом получают 190 мг (32%) чистого продукта.
MS (FAB): m/e=598,3 (100%; (М+Н)+).
1с) N6-(1-(5-аминопентил))-N9-(3-(2-(бензилоксикарбониламино)пропионовая кислота))аденин.
190 мг (0,32 ммоль) N6-(1-(5-(трет-бутилоксикарбониламино)пентил-N9-(3-(2S-(бензилоксикарбониламино)-трет-бутилпропионат))аденина (пример 1b) растворяют в 2 мл 90%-ной трифторуксусной кислоты и перемешивают 2 часа при RT. Выпаривают досуха и остаток 2 раза выпаривают с уксусной кислотой. После этого растворяют в воде и сушат вымораживанием. Выход 134 мг (95%).
MS (ES+): m/e=442,3 (20%; (М+Н)+), 308,2 (35).
1d) N6-(1-(5-Гуанидинопентил))-N9-(3-(2S-(бензилоксикарбониламино)пропионовая кислота))аденин.
34 мг (0,077 ммоль) N6-(1-(5-аминопентил))-N9-(3-(2S-(бензилоксикарбониламино)пропионовая кислота))аденина (пример 1с) растворяют в 1,5 мл воды и 0,5 мл DMF и смешивают с 0,033 мл (0,193 ммоль) DIPEA и 13,5 мг (0,092 ммоль) 1Н-пиразол-1-карбоксамидин-гидрохлорида и перемешивают 40 часов при RT. После этого выпаривают растворитель, остаток поглощают в воде и сушат вымораживанием. Для дальнейшей очистки хроматоргафируют на силикагеле (DCM:метанол:уксусная кислота:вода 15:15:1:1). Выход 70%.
MS (FAB): m/e=484,2 (100%; (М+Н)+).
Пример 2. N6-(1-(4-Гуaнидинобутил))-N9-(3-(2S-(бeнзилoксикарбониламино)пропионовая кислота))аденин.
2а) N6-(1-(4-(трет-бутилоксикарбониламино)бутил))-N9-(3-(2S-бензилоксикарбониламино)-трет-бутилпропионат))аденин
Синтез аналогично 1b из 431 мг (1 ммоль) N9-(3-(2S-(бензилоксикарбониламино)-трет-бутилпропионат))-6-хлорпурина (пример 1а) и 376 мг (2 ммоль) 4-(трет-бутилоксикарбониламино)-1-бутиламина. Выход 214 мг (37%).
1H-NMR (200 МГц, DMSO): С. Растворитель выпаривают и остаток хроматографируют на силикагеле (толуол:ЕЕ от 7:3 до 1:2), при этом получают 190 мг (32%) чистого продукта.
MS (FAB): m/e=598,3 (100%; (М+Н)+).
1с) N6-(1-(5-аминопентил))-N9-(3-(2-(бензилоксикарбониламино)пропионовая кислота))аденин.
190 мг (0,32 ммоль) N6-(1-(5-(трет-бутилоксикарбониламино)пентил-N9-(3-(2S-(бензилоксикарбониламино)-трет-бутилпропионат))аденина (пример 1b) растворяют в 2 мл 90%-ной трифторуксусной кислоты и перемешивают 2 часа при RT. Выпаривают досуха и остаток 2 раза выпаривают с уксусной кислотой. После этого растворяют в воде и сушат вымораживанием. Выход 134 мг (95%).
MS (ES+): m/e=442,3 (20%; (М+Н)+), 308,2 (35).
1d) N6-(1-(5-Гуанидинопентил))-N9-(3-(2S-(бензилоксикарбониламино)пропионовая кислота))аденин.
34 мг (0,077 ммоль) N6-(1-(5-аминопентил))-N9-(3-(2S-(бензилоксикарбониламино)пропионовая кислота))аденина (пример 1с) растворяют в 1,5 мл воды и 0,5 мл DMF и смешивают с 0,033 мл (0,193 ммоль) DIPEA и 13,5 мг (0,092 ммоль) 1Н-пиразол-1-карбоксамидин-гидрохлорида и перемешивают 40 часов при RT. После этого выпаривают растворитель, остаток поглощают в воде и сушат вымораживанием. Для дальнейшей очистки хроматоргафируют на силикагеле (DCM:метанол:уксусная кислота:вода 15:15:1:1). Выход 70%.
MS (FAB): m/e=484,2 (100%; (М+Н)+).
Пример 2. N6-(1-(4-Гуaнидинобутил))-N9-(3-(2S-(бeнзилoксикарбониламино)пропионовая кислота))аденин.
2а) N6-(1-(4-(трет-бутилоксикарбониламино)бутил))-N9-(3-(2S-бензилоксикарбониламино)-трет-бутилпропионат))аденин
Синтез аналогично 1b из 431 мг (1 ммоль) N9-(3-(2S-(бензилоксикарбониламино)-трет-бутилпропионат))-6-хлорпурина (пример 1а) и 376 мг (2 ммоль) 4-(трет-бутилоксикарбониламино)-1-бутиламина. Выход 214 мг (37%).
1H-NMR (200 МГц, DMSO):  =1,30 (s, 9H, С(СН3)3); 1,38 (s, 9H, С(СН3)3); 1,41 (m, 2H, CH2); 1,57 (m, 2H, CH2); 3,46 (m, 2H, CH2-NH-Boc); 2,92 (t, 2H, C2-NH-CH2); 4,31-4,58 (m, 3H, N1-CH2-CH(NHZ)); 5,01 (s, 2H, CH2-арил); 6,99 (t, 1H, С2-NH); 7,10-7,38 (m, 5H, арил-Н); 7,75 (m, 1H, NH-Boc); 7,91 (d, 1H, NH-Z); 8,02+8,20 (2s, 2H, C6-H+C8-H).
MS (ES+): m/e=584,3 (100%; (М+Н)+).
2b) N6-(1-(4-Аминобутил))-N9-(3-(2S-(бензилоксикарбониламино)пропионовая кислота))аденин.
Синтез аналогично примеру 1с из N6-(1-(4-трет-бутилоксикарбониламино)бутил)-N9-(3-(2S-(бензилоксикарбониламино)-трет-бутилпропионат))аденина (пример 2а). Выход 96%.
MS (ES+): m/e=428,8 (100%; (М+Н)+), 294,1 (70).
2c) N6-(1-(4-Гуанидинобутил))-N9-(3-(2S- (бензилоксикарбониламино)пропионовая кислота))аденин.
Синтез аналогично примеру 1d из N6-(1-(4-аминобутил))-N9-(3-(2S-(бензилоксикарбониламино)пропионовая кислота))аденина (пример 2b). Выход 76%.
MS (ES+): m/e=470,1 (20%; (М+Н)+).
Пример 3. N6-(1-(3-Гуанидинопропил))-N9-(3-(2S-(бензилоксикарбониламино)пропионовая кислота))аденин.
3а) N6-(1-(3-(трет-Бутилоксикарбониламино)пропил))-N9-(3-(2S-(бензилоксикарбониламино)-трет-бутилпропионат))аденин.
Синтез аналогично 1b из 60 мг (0,14 ммоль) N9-(3-(2S-(бензилоксикарбониламино)-трет-бутилпропионат))-6-хлорпурина (пример 1а) и 30 мг (0,17 ммоль) 3-(трет-бутилоксикарбониламино)-1-пропиламина. Выход 30 мг (38%).
1H-NMR (200 МГц, DMSO): =1,30 (s, 9H, С(СН3)3); 1,38 (s, 9H, С(СН3)3); 1,41 (m, 2H, CH2); 1,57 (m, 2H, CH2); 3,46 (m, 2H, CH2-NH-Boc); 2,92 (t, 2H, C2-NH-CH2); 4,31-4,58 (m, 3H, N1-CH2-CH(NHZ)); 5,01 (s, 2H, CH2-арил); 6,99 (t, 1H, С2-NH); 7,10-7,38 (m, 5H, арил-Н); 7,75 (m, 1H, NH-Boc); 7,91 (d, 1H, NH-Z); 8,02+8,20 (2s, 2H, C6-H+C8-H).
MS (ES+): m/e=584,3 (100%; (М+Н)+).
2b) N6-(1-(4-Аминобутил))-N9-(3-(2S-(бензилоксикарбониламино)пропионовая кислота))аденин.
Синтез аналогично примеру 1с из N6-(1-(4-трет-бутилоксикарбониламино)бутил)-N9-(3-(2S-(бензилоксикарбониламино)-трет-бутилпропионат))аденина (пример 2а). Выход 96%.
MS (ES+): m/e=428,8 (100%; (М+Н)+), 294,1 (70).
2c) N6-(1-(4-Гуанидинобутил))-N9-(3-(2S- (бензилоксикарбониламино)пропионовая кислота))аденин.
Синтез аналогично примеру 1d из N6-(1-(4-аминобутил))-N9-(3-(2S-(бензилоксикарбониламино)пропионовая кислота))аденина (пример 2b). Выход 76%.
MS (ES+): m/e=470,1 (20%; (М+Н)+).
Пример 3. N6-(1-(3-Гуанидинопропил))-N9-(3-(2S-(бензилоксикарбониламино)пропионовая кислота))аденин.
3а) N6-(1-(3-(трет-Бутилоксикарбониламино)пропил))-N9-(3-(2S-(бензилоксикарбониламино)-трет-бутилпропионат))аденин.
Синтез аналогично 1b из 60 мг (0,14 ммоль) N9-(3-(2S-(бензилоксикарбониламино)-трет-бутилпропионат))-6-хлорпурина (пример 1а) и 30 мг (0,17 ммоль) 3-(трет-бутилоксикарбониламино)-1-пропиламина. Выход 30 мг (38%).
1H-NMR (200 МГц, DMSO):  =1,28 (s, 9H, С(СН3)3); 1,36 (s, 9H, С(СН3)3); 1,68 (m, 2H, CH2-CH2-CH2); 1,41 (m, 2H, СН2); 2,98 (t, 2H, C2-NH-CH2); 3,46 (t, 2H, CH2-NH-Boc); 4,29-4,59 (m, 3Н, N1-СН2-СН(NHZ)); 5,00 (s, 2H, СН2-арил); 6,82 (t, 1H, C2-NH); 7,21-7,40 (m, 5H, арил-Н); 7,72 (m, 1H, NH-Boc); 7,91 (d, 1H, NHZ); 8,03+8,20 (2s, 2H, С6-Н+С8-Н).
MS (ES+): m/e=570,3 (100%; (М+Н)+).
3b) N6-(1-(3-Аминопропил))-N9-(3-(2S-(бензилоксикарбониламино)пропионовая кислота))аденин.
Синтез аналогично примеру 1с из N6-(1-(3-(трет-бутилоксикарбониламино)пропил))-N9-(3-(2S-(бензилоксикарбониламино)-трет-бутилпропионат)аденина (пример 3а). Выход 100%.
MS (ES+): m/e=414,2 (100%; (М+Н)+), 280,1 (30).
3c) N6-(1-(3-Гуанидинопропил))-N9-(3-(2S-(бензилоксикарбониламино)пропионовая кислота))аденин.
Синтез аналогично примеру 1d из N6-(1-(3-аминопропил))-N9-(3-(2S-(бензилоксикарбониламино)пропионовая кислота))аденина (пример 3b). Выход 66%.
MS (ES+): m/e=456,3 (20%; (М+Н)+), 130,1 (100).
Пример 4. N6-(1-(4-(4,5-Дигидро-1Н-имидазол-2-иламино)бутил))-N9-(3-(2S-(бензилоксикарбониламино)пропионовая кислота))аденин.
153 мг (0,36 ммоль) N6-(1-(4-aминoбyтил))-N9-(3-(2S-(бензилоксикарбониламино)пропионовая кислота))аденина (пример 2b) и 88 мг (0,36 ммоль) 2-(метилмеркапто)-2-имидазолин-гидроиодида растворяют в 2 мл воды и при помощи 1н. NaOH устанавливают рН 9,0. Перемешивают 100 часов при 50 =1,28 (s, 9H, С(СН3)3); 1,36 (s, 9H, С(СН3)3); 1,68 (m, 2H, CH2-CH2-CH2); 1,41 (m, 2H, СН2); 2,98 (t, 2H, C2-NH-CH2); 3,46 (t, 2H, CH2-NH-Boc); 4,29-4,59 (m, 3Н, N1-СН2-СН(NHZ)); 5,00 (s, 2H, СН2-арил); 6,82 (t, 1H, C2-NH); 7,21-7,40 (m, 5H, арил-Н); 7,72 (m, 1H, NH-Boc); 7,91 (d, 1H, NHZ); 8,03+8,20 (2s, 2H, С6-Н+С8-Н).
MS (ES+): m/e=570,3 (100%; (М+Н)+).
3b) N6-(1-(3-Аминопропил))-N9-(3-(2S-(бензилоксикарбониламино)пропионовая кислота))аденин.
Синтез аналогично примеру 1с из N6-(1-(3-(трет-бутилоксикарбониламино)пропил))-N9-(3-(2S-(бензилоксикарбониламино)-трет-бутилпропионат)аденина (пример 3а). Выход 100%.
MS (ES+): m/e=414,2 (100%; (М+Н)+), 280,1 (30).
3c) N6-(1-(3-Гуанидинопропил))-N9-(3-(2S-(бензилоксикарбониламино)пропионовая кислота))аденин.
Синтез аналогично примеру 1d из N6-(1-(3-аминопропил))-N9-(3-(2S-(бензилоксикарбониламино)пропионовая кислота))аденина (пример 3b). Выход 66%.
MS (ES+): m/e=456,3 (20%; (М+Н)+), 130,1 (100).
Пример 4. N6-(1-(4-(4,5-Дигидро-1Н-имидазол-2-иламино)бутил))-N9-(3-(2S-(бензилоксикарбониламино)пропионовая кислота))аденин.
153 мг (0,36 ммоль) N6-(1-(4-aминoбyтил))-N9-(3-(2S-(бензилоксикарбониламино)пропионовая кислота))аденина (пример 2b) и 88 мг (0,36 ммоль) 2-(метилмеркапто)-2-имидазолин-гидроиодида растворяют в 2 мл воды и при помощи 1н. NaOH устанавливают рН 9,0. Перемешивают 100 часов при 50 С. После этого рН раствора доводят при помощи 1н. НСl до 1,5, выпаривают растворитель и остаток хроматографируют несколько раз на силикагеле (DCM:MeOH от 9:1 до 1:2 соответственно с 0,1% АсОН, 0,1% Н2О), затем DCM:MeOH:Н2О:АсОН 8:2:0,4:0,4. Выход 7 мг (4%).
MS (FAB): m/e=496,2 (М+Н+, 100%); 518,2 (M+Na+, 50).
Пример 5. N6-(1-(3-Гуанидинопропил))-N9-(4-(2S-бeнзилoксикарбониламино)масляная кислота))аденин.
5а) N9-(4-(2S-(Бензилоксикарбониламино)масляная кислота-трет-бутиловый эфир)-6-хлорпурин.
Синтез аналогично примеру 1а из 6-хлорпурина и N-бензилоксикарбонил-L-гомо-серин-трет-бутилового эфира. Выход 24%.
1H-NMR (200 МГц, DMSO): С. После этого рН раствора доводят при помощи 1н. НСl до 1,5, выпаривают растворитель и остаток хроматографируют несколько раз на силикагеле (DCM:MeOH от 9:1 до 1:2 соответственно с 0,1% АсОН, 0,1% Н2О), затем DCM:MeOH:Н2О:АсОН 8:2:0,4:0,4. Выход 7 мг (4%).
MS (FAB): m/e=496,2 (М+Н+, 100%); 518,2 (M+Na+, 50).
Пример 5. N6-(1-(3-Гуанидинопропил))-N9-(4-(2S-бeнзилoксикарбониламино)масляная кислота))аденин.
5а) N9-(4-(2S-(Бензилоксикарбониламино)масляная кислота-трет-бутиловый эфир)-6-хлорпурин.
Синтез аналогично примеру 1а из 6-хлорпурина и N-бензилоксикарбонил-L-гомо-серин-трет-бутилового эфира. Выход 24%.
1H-NMR (200 МГц, DMSO):  =1,34 (s, 9H, С(СН3)3); 2,08-2,43 (m, 2H, N-CH2-CH2-CH); 3,81-3,93 (m, 1Н, CH-NHZ); 4,39 (t, 2H, N9-CH2); 5,02 (s, 2H, СН2-арил); 7,26-7,42 (m, 5Н, арил-Н); 7,87 (d, 1H, NH); 8,63+8,75 (2s, 2Н, С6-Н+С8-Н).
MS (FAB): m/e=446,1 (100%; (М+Н)+); 390,1 (65).
5b) N6-(1-(3-(трет-Бутилоксикарбониламино)пропил))-N9-(4-(2S-(бензилоксикарбониламино)масляная кислота-трет-бутиловый эфир)аденин.
Синтез аналогично 1b из 50 мг (0,11 ммоль) N9-(4-(2S-(бензилоксикарбониламино)масляная кислота-трет-бутиловый эфир))-6-хлорпурина (пример 5а) и 38 мг (0,22 ммоль) 3-(трет-бутилоксикарбониламино)-1-пропиламина. Выход 26 мг (41%).
MS (ES+): m/e=584,3 (100%; (М+Н)+).
5c) N6-(1-(3-Аминопропил))-N9-(4-(2-(бензилоксикарбониламино)масляная кислота))аденин.
Синтез аналогично примеру 1с из N6-(1-(3-(трет-бутилоксикарбониламино)пропил)-N9-(4-(2S-(бензилоксикарбониламино)масляная кислота-трет-бутиловый эфир))аденина (пример 5b). Выход 94%.
MS (FAB): m/e=428,3 (100%; (М+Н)+).
5d) N6-(1-(3-Гуанидинопропил))-N9-(4-(2S-(бензилоксикарбониламино)масляная кислота))аденин.
Синтез аналогично примеру 1d из N6-(1-(3-аминопропил))-N9-(3-(2S-(бензилоксикарбониламино)масляная кислота))аденина (пример 5с). Выход 71%.
MS (FAB): m/e=470,3 (70%; (М+Н)+).
5е) N-Бензилоксикарбонил-L-гомосерин.
6 г (50,4 ммоль) L-гомосерина окисляют в значительной степени в 50 мл DMF и при 0 =1,34 (s, 9H, С(СН3)3); 2,08-2,43 (m, 2H, N-CH2-CH2-CH); 3,81-3,93 (m, 1Н, CH-NHZ); 4,39 (t, 2H, N9-CH2); 5,02 (s, 2H, СН2-арил); 7,26-7,42 (m, 5Н, арил-Н); 7,87 (d, 1H, NH); 8,63+8,75 (2s, 2Н, С6-Н+С8-Н).
MS (FAB): m/e=446,1 (100%; (М+Н)+); 390,1 (65).
5b) N6-(1-(3-(трет-Бутилоксикарбониламино)пропил))-N9-(4-(2S-(бензилоксикарбониламино)масляная кислота-трет-бутиловый эфир)аденин.
Синтез аналогично 1b из 50 мг (0,11 ммоль) N9-(4-(2S-(бензилоксикарбониламино)масляная кислота-трет-бутиловый эфир))-6-хлорпурина (пример 5а) и 38 мг (0,22 ммоль) 3-(трет-бутилоксикарбониламино)-1-пропиламина. Выход 26 мг (41%).
MS (ES+): m/e=584,3 (100%; (М+Н)+).
5c) N6-(1-(3-Аминопропил))-N9-(4-(2-(бензилоксикарбониламино)масляная кислота))аденин.
Синтез аналогично примеру 1с из N6-(1-(3-(трет-бутилоксикарбониламино)пропил)-N9-(4-(2S-(бензилоксикарбониламино)масляная кислота-трет-бутиловый эфир))аденина (пример 5b). Выход 94%.
MS (FAB): m/e=428,3 (100%; (М+Н)+).
5d) N6-(1-(3-Гуанидинопропил))-N9-(4-(2S-(бензилоксикарбониламино)масляная кислота))аденин.
Синтез аналогично примеру 1d из N6-(1-(3-аминопропил))-N9-(3-(2S-(бензилоксикарбониламино)масляная кислота))аденина (пример 5с). Выход 71%.
MS (FAB): m/e=470,3 (70%; (М+Н)+).
5е) N-Бензилоксикарбонил-L-гомосерин.
6 г (50,4 ммоль) L-гомосерина окисляют в значительной степени в 50 мл DMF и при 0 С смешивают частями с 12,56 г (50,4 ммоль) N-(бензилоксикарбонилокси)сукцинимида. Перемешивают 1 час при 0 С смешивают частями с 12,56 г (50,4 ммоль) N-(бензилоксикарбонилокси)сукцинимида. Перемешивают 1 час при 0 С, затем 48 часов при RT. Отгоняют растворитель и распределяют остаток между ЕЕ и насыщенным раствором NaCl. Органическую фазу промывают насыщенным раствором NaCl, 5%-ным раствором лимонной кислоты и еще раз насыщенным раствором NaCl, сушат, фильтруют и концентрируют. Кристаллический остаток размешивают в эфире, отсасывают, промывают эфиром и пентаном. Выход 9,55 г (75%).
1H-NMR (200 МГц, DMSO): С, затем 48 часов при RT. Отгоняют растворитель и распределяют остаток между ЕЕ и насыщенным раствором NaCl. Органическую фазу промывают насыщенным раствором NaCl, 5%-ным раствором лимонной кислоты и еще раз насыщенным раствором NaCl, сушат, фильтруют и концентрируют. Кристаллический остаток размешивают в эфире, отсасывают, промывают эфиром и пентаном. Выход 9,55 г (75%).
1H-NMR (200 МГц, DMSO):  =1,61-1,95 (m, 2H, CH2-CH2-OH); 3,42 (m, 2H, CH2-OH); 4,08 (m, 1H, CH-NH-Z); 4,57 (s, широкий, 1Н, ОН); 5,02 (s, 2H, CH2-Ph); 7,32 (m, 5H, арил-Н); 7,49 (d, 1H, NH-Z).
MS (Cl+): m/e=236,1 (M+H+-H2O, 20%); 192,1 (50); 91,0 (100).
5f) N-Бензилоксикарбонил-L-гомосерин-трет-бутиловый эфир.
3,8 г (15 ммоль) Z-L-гомосерина и 3,42 г (15 ммоль) бензилтриэтиламмонийхлорида в атмосфере аргона растворяют в 110 мл N-метил-2-пирролидона и смешивают по очереди с 53,9 г (390 ммоль) К2СО3 и 98,7 г (720 ммоль) трет-бутилбромида. Перемешивают 22 часа при 55 =1,61-1,95 (m, 2H, CH2-CH2-OH); 3,42 (m, 2H, CH2-OH); 4,08 (m, 1H, CH-NH-Z); 4,57 (s, широкий, 1Н, ОН); 5,02 (s, 2H, CH2-Ph); 7,32 (m, 5H, арил-Н); 7,49 (d, 1H, NH-Z).
MS (Cl+): m/e=236,1 (M+H+-H2O, 20%); 192,1 (50); 91,0 (100).
5f) N-Бензилоксикарбонил-L-гомосерин-трет-бутиловый эфир.
3,8 г (15 ммоль) Z-L-гомосерина и 3,42 г (15 ммоль) бензилтриэтиламмонийхлорида в атмосфере аргона растворяют в 110 мл N-метил-2-пирролидона и смешивают по очереди с 53,9 г (390 ммоль) К2СО3 и 98,7 г (720 ммоль) трет-бутилбромида. Перемешивают 22 часа при 55 С. Реакционную смесь выливают в 1,5 л ледяной воды, экстрагируют дважды толуолом, органическую фазу промывают два раза насыщенным раствором NaCl, сушат, фильтруют и концентрируют. Продукт для дальнейшей очистки хроматографируют на силикагеле (н-гептан:ЕЕ от 7:3 до 1:1). Выход 2,0 г (43,1%).
1H-NMR (200 МГц, CDCl3): С. Реакционную смесь выливают в 1,5 л ледяной воды, экстрагируют дважды толуолом, органическую фазу промывают два раза насыщенным раствором NaCl, сушат, фильтруют и концентрируют. Продукт для дальнейшей очистки хроматографируют на силикагеле (н-гептан:ЕЕ от 7:3 до 1:1). Выход 2,0 г (43,1%).
1H-NMR (200 МГц, CDCl3):  =1,45 (s, 9H, tBu); 1,51-1,74+2,03-2,26 (m, 2H, CH2-CH2-OH); 3,01 (s, широкий, 1Н, ОН); 3,70 (m, 2H, СН2-ОН); 4,41 (m, 1H, CH-NH-Z); 5,12 (s, 2H, CH2-Ph); 5,60 (d, 1H, NH-Z); 7,36 (m, 5H, арил-Н).
MS (Cl+): m/e=310,3 (M+H+, 50%); 254,2 (100).
Пример 6. N6-(1-(4-Гуанидинобутил))-N9-(4-(2S-бензилоксикарбониламино)масляная кислота))аденин.
6а) N6-(1-(4-(трет-Бутилоксикарбониламино)бутил)-N9-(4-(2S-(бензилоксикарбониламино)масляная кислота-трет-бутиловый эфир)аденин.
Синтез аналогично 1b из 50 мг (0,11 ммоль) N9-(4-(2S-(бензилоксикарбониламино)масляная кислота-трет-бутиловый эфир))-6-хлорпурина (пример 5а) и 41 мг (0,22 ммоль) 4-(трет-бутилоксикарбониламино)-1-бутиламина.
Выход 38 мг (58%).
MS (ES+): m/е=598,3 (100%; (М+Н)+).
6b) N6-(1-(4-Аминобутил))-N9-(4-(2-(бензилоксикарбониламино)масляная кислота))аденин.
Синтез аналогично примеру 1с из N6-(1-(4-(трет-бутилоксикарбониламино)бутил)-N9-(4-(2S-(бензилоксикарбониламино)масляная кислота-трет-бутиловый эфир))аденина (пример 6а). Выход 100%.
MS (FAB): m/e=442,3 (100%; (М+Н)+).
6c) N6-(1-(4-Гуанидинобутил))-N9-(4-(2S-бензилоксикарбониламино)масляная кислота))аденин.
Синтез аналогично примеру 1d из N6-(1-(4-аминобутил))-N9-(3- (2S-(бензилоксикарбониламино)масляная кислота))аденина (пример 6b). Выход 65%.
MS (ES+): m/e=484,3 (5%; (М+Н)+), 350,2 (10), 333,2 (5), 130,0 (100).
Пример 7. N6-(1-(3-Гуанидинопропил))-N9-(3-пропионовая кислота)аденин.
7а) N9-(3-Пропионовая кислота-трет-бутиловый эфир)-6-хлорпурин.
15,45 г (0,1 мол) 6-хлорпурина, 43,5 мл (0,3 мол) трет-бутилакрилата и 1,34 мл (7 ммоль) 5,22 н. метанолата натрия (в МеОН) растворяют в 400 мл абсолютного МеОН и при повторной добавке 2,6 мл (14 ммоль) 5,22 н. метанолата натрия (в МеОН) кипятят 4,5 часа при флегмообразовании. Для переработки отсасывают, выпаривают растворитель и хроматографируют остаток на силикагеле (+10% Н2О) (толуол:ЕЕ от 3:1). Выход 1,35 г (5%).
1Н-NMR (200 МГц, DMSO): =1,45 (s, 9H, tBu); 1,51-1,74+2,03-2,26 (m, 2H, CH2-CH2-OH); 3,01 (s, широкий, 1Н, ОН); 3,70 (m, 2H, СН2-ОН); 4,41 (m, 1H, CH-NH-Z); 5,12 (s, 2H, CH2-Ph); 5,60 (d, 1H, NH-Z); 7,36 (m, 5H, арил-Н).
MS (Cl+): m/e=310,3 (M+H+, 50%); 254,2 (100).
Пример 6. N6-(1-(4-Гуанидинобутил))-N9-(4-(2S-бензилоксикарбониламино)масляная кислота))аденин.
6а) N6-(1-(4-(трет-Бутилоксикарбониламино)бутил)-N9-(4-(2S-(бензилоксикарбониламино)масляная кислота-трет-бутиловый эфир)аденин.
Синтез аналогично 1b из 50 мг (0,11 ммоль) N9-(4-(2S-(бензилоксикарбониламино)масляная кислота-трет-бутиловый эфир))-6-хлорпурина (пример 5а) и 41 мг (0,22 ммоль) 4-(трет-бутилоксикарбониламино)-1-бутиламина.
Выход 38 мг (58%).
MS (ES+): m/е=598,3 (100%; (М+Н)+).
6b) N6-(1-(4-Аминобутил))-N9-(4-(2-(бензилоксикарбониламино)масляная кислота))аденин.
Синтез аналогично примеру 1с из N6-(1-(4-(трет-бутилоксикарбониламино)бутил)-N9-(4-(2S-(бензилоксикарбониламино)масляная кислота-трет-бутиловый эфир))аденина (пример 6а). Выход 100%.
MS (FAB): m/e=442,3 (100%; (М+Н)+).
6c) N6-(1-(4-Гуанидинобутил))-N9-(4-(2S-бензилоксикарбониламино)масляная кислота))аденин.
Синтез аналогично примеру 1d из N6-(1-(4-аминобутил))-N9-(3- (2S-(бензилоксикарбониламино)масляная кислота))аденина (пример 6b). Выход 65%.
MS (ES+): m/e=484,3 (5%; (М+Н)+), 350,2 (10), 333,2 (5), 130,0 (100).
Пример 7. N6-(1-(3-Гуанидинопропил))-N9-(3-пропионовая кислота)аденин.
7а) N9-(3-Пропионовая кислота-трет-бутиловый эфир)-6-хлорпурин.
15,45 г (0,1 мол) 6-хлорпурина, 43,5 мл (0,3 мол) трет-бутилакрилата и 1,34 мл (7 ммоль) 5,22 н. метанолата натрия (в МеОН) растворяют в 400 мл абсолютного МеОН и при повторной добавке 2,6 мл (14 ммоль) 5,22 н. метанолата натрия (в МеОН) кипятят 4,5 часа при флегмообразовании. Для переработки отсасывают, выпаривают растворитель и хроматографируют остаток на силикагеле (+10% Н2О) (толуол:ЕЕ от 3:1). Выход 1,35 г (5%).
1Н-NMR (200 МГц, DMSO):  =1,29 (s, 9H, С(СН3)3); 2,95 (t, 2H, СН2С(О)); 4,50 (t, 2H, N-СН2); 8,70+8,79 (2s, 2H, С6-Н+С8-Н).
MS (ES+): m/e=283,1 (70%; (М+Н)+); 227,0 (100).
7b) N6-(1-(3-трет-Бутилоксикарбониламино)пропил))-N9-(3-пропионовая кислота-трет-бутиловый эфир)аденин.
Синтез аналогично 1b из 282 мг (1,0 ммоль) N3-(3-пропионовая кислота-трет-бутиловый эфир)-6-хлорпурина (пример 7а) и 209 мг (1,2 ммоль) 3-(трет-бутилоксикарбониламино)-1-пропиламина. Выход 160 мг (38%).
MS (ES+): m/e=421,2 (100%; (М+Н)+), 365,2 (60), 321,2 (50), 265,1 (30).
7c) N6-(1-(3-Аминопропил))-N9-(3-пропионовая кислота)аденин.
Синтез аналогично примеру 1с из N6-(1-(3-(трет-бутилоксикарбониламино)пропил))-N9-(3-пропионовая кислота-трет-бутиловый эфир)аденина (пример 7b). Выход 100%.
1H-NMR (200 МГц, DMSO): =1,29 (s, 9H, С(СН3)3); 2,95 (t, 2H, СН2С(О)); 4,50 (t, 2H, N-СН2); 8,70+8,79 (2s, 2H, С6-Н+С8-Н).
MS (ES+): m/e=283,1 (70%; (М+Н)+); 227,0 (100).
7b) N6-(1-(3-трет-Бутилоксикарбониламино)пропил))-N9-(3-пропионовая кислота-трет-бутиловый эфир)аденин.
Синтез аналогично 1b из 282 мг (1,0 ммоль) N3-(3-пропионовая кислота-трет-бутиловый эфир)-6-хлорпурина (пример 7а) и 209 мг (1,2 ммоль) 3-(трет-бутилоксикарбониламино)-1-пропиламина. Выход 160 мг (38%).
MS (ES+): m/e=421,2 (100%; (М+Н)+), 365,2 (60), 321,2 (50), 265,1 (30).
7c) N6-(1-(3-Аминопропил))-N9-(3-пропионовая кислота)аденин.
Синтез аналогично примеру 1с из N6-(1-(3-(трет-бутилоксикарбониламино)пропил))-N9-(3-пропионовая кислота-трет-бутиловый эфир)аденина (пример 7b). Выход 100%.
1H-NMR (200 МГц, DMSO):  =1,88 (t, 2H, CH2-CH2-CH2-); 2,80-2,93 (m, 4H, NH-CH2+CH2-C(O)); 3,56 (m, 2H, CH2-NH2); 4,38 (t, 2H, N9-CH2); 7,72 (s, широкий, 2Н, NH2); 7,95 (t, 1H, NH); 8,15+8,23 (2S, 2H, C6-H+C8-H).
MS (ES+): m/e=265,1 (100%; (М+Н)+; 248,1 (40), 176,0 (30).
7d) N6-(1-(3-Гуанидинопропил)-N9-(3-пропионовая кислота)аденин.
Синтез аналогично примеру 1d из N6-(1-(3-аминопропил))-N9-(3-пропионовая кислота)аденина (пример 7с). Выход 41%.
1H-NMR (200 МГц, D2O): =1,88 (t, 2H, CH2-CH2-CH2-); 2,80-2,93 (m, 4H, NH-CH2+CH2-C(O)); 3,56 (m, 2H, CH2-NH2); 4,38 (t, 2H, N9-CH2); 7,72 (s, широкий, 2Н, NH2); 7,95 (t, 1H, NH); 8,15+8,23 (2S, 2H, C6-H+C8-H).
MS (ES+): m/e=265,1 (100%; (М+Н)+; 248,1 (40), 176,0 (30).
7d) N6-(1-(3-Гуанидинопропил)-N9-(3-пропионовая кислота)аденин.
Синтез аналогично примеру 1d из N6-(1-(3-аминопропил))-N9-(3-пропионовая кислота)аденина (пример 7с). Выход 41%.
1H-NMR (200 МГц, D2O):  =1,95 (t, 2H, СН2-СН2-СН2-); 2,71 (t, 2H, СН2-С(О)); 3,24 (t, 2Н, Gua-CH2); 3,65 (m, 2H, CH2-NH2); 4,40 (t, 2H, N9-CH2); 8,00+8,15 (2s, 2Н, С6-Н+С8-Н).
MS (ES+): m/e=307,1 (100%; (М+Н)+), 290,1 (30).
Пример 8. N6-(1-(4-Гуaнидинoбутил))-N9-(3-пpoпионовая кислота)аденин.
8a) N6-(1-(4-(трет-Бутилоксикарбониламино)бутил))-N9-(3-пропионовая кислота-трет-бутиловый эфир)аденин.
Синтез аналогично 1b из 141 мг (0,5 ммоль) N9-(3-пропионовая кислота-трет-бутиловый эфир)-6-хлорпурина (пример 7а) и 104 мг (0,55 ммоль) 4-(трет-бутилоксикарбониламино)-1-бутиламина. Выход 130 мг (60%).
1H-NMR (200 МГц, DMSO): =1,95 (t, 2H, СН2-СН2-СН2-); 2,71 (t, 2H, СН2-С(О)); 3,24 (t, 2Н, Gua-CH2); 3,65 (m, 2H, CH2-NH2); 4,40 (t, 2H, N9-CH2); 8,00+8,15 (2s, 2Н, С6-Н+С8-Н).
MS (ES+): m/e=307,1 (100%; (М+Н)+), 290,1 (30).
Пример 8. N6-(1-(4-Гуaнидинoбутил))-N9-(3-пpoпионовая кислота)аденин.
8a) N6-(1-(4-(трет-Бутилоксикарбониламино)бутил))-N9-(3-пропионовая кислота-трет-бутиловый эфир)аденин.
Синтез аналогично 1b из 141 мг (0,5 ммоль) N9-(3-пропионовая кислота-трет-бутиловый эфир)-6-хлорпурина (пример 7а) и 104 мг (0,55 ммоль) 4-(трет-бутилоксикарбониламино)-1-бутиламина. Выход 130 мг (60%).
1H-NMR (200 МГц, DMSO):  =1,32 (s, 9Н, С(СН3)3); 1,35 (s, 9H, С(СН3)3); 1,40 (t, 2H, CH2); 1,57 (t, 2H, CH2); 2,84 (t, 2H, -CH2-C(O)); 2,95 (t, 2H, C2-NH-CH2); 3,45 (m, 2H, CH2-NH-Boc); 4,34 (t, 2H, N9-CH2); 6,78 (t, 1H, C2-NH); 7,70 (m, 1H, NH-Boc); 8,08+8,19 (2s, 2H, C6-H+C8-H).
MS (ES+): m/e=435,2 (100%; (М+Н)+), 379,2 (20), 335,2 (55), 279,1 (50).
8b) N6-(1-(4-Аминобутил))-N9-(3-пропионовая кислота)аденин.
Синтез аналогично примеру 1с из N6-(1-(4-(трет-бутилоксикарбониламино)бутил)-N9-(3-пропионовая кислота-трет-бутиловый эфир)аденина (пример 8а). Выход 100%.
1H-NMR (200 МГц, DMSO): =1,32 (s, 9Н, С(СН3)3); 1,35 (s, 9H, С(СН3)3); 1,40 (t, 2H, CH2); 1,57 (t, 2H, CH2); 2,84 (t, 2H, -CH2-C(O)); 2,95 (t, 2H, C2-NH-CH2); 3,45 (m, 2H, CH2-NH-Boc); 4,34 (t, 2H, N9-CH2); 6,78 (t, 1H, C2-NH); 7,70 (m, 1H, NH-Boc); 8,08+8,19 (2s, 2H, C6-H+C8-H).
MS (ES+): m/e=435,2 (100%; (М+Н)+), 379,2 (20), 335,2 (55), 279,1 (50).
8b) N6-(1-(4-Аминобутил))-N9-(3-пропионовая кислота)аденин.
Синтез аналогично примеру 1с из N6-(1-(4-(трет-бутилоксикарбониламино)бутил)-N9-(3-пропионовая кислота-трет-бутиловый эфир)аденина (пример 8а). Выход 100%.
1H-NMR (200 МГц, DMSO):  =1,50-1,70 (m, 4H, -СН2-СН2-); 2,74-2,91 (m, 4H, NH-CH2+CH2-C(О)); 3,50 (m, 2H, CH2-NH2); 4,36 (t, 2H, N9-CH2); 7,64 (s, широкий, 2H, NH2); 7,90 (t, 1H, NH); 8,11+8,21 (2s, 2H, C6-H+C8-H).
MS (FAB): m/e=279,2 (100%; (M+H)+).
8c) N6-(1-(4-Гуанидинобутил))-N9-(3-пропионовая кислота)аденин.
Синтез аналогично примеру 1d из N6-(1-(4-аминобутил))-N9-(3-пропионовая кислота)аденина (пример 8b). Выход 65%.
MS (ES+): m/e=321,1 (100%; (М+Н)+).
Пример 9. N6-(1-(5-Гуанидинопентил))-N9-(3-пропионовая кислота)аденин.
9а) N6-(1-(5-(трет-Бутилоксикарбониламино)бутил))-N9-(3-пропионовая кислота-трет-бутиловый эфир)аденин.
Синтез аналогично 1b из 282 мг (1,0 ммоль) N9-(3-пропионовая кислота-трет-бутиловый эфир)-6-хлорпурина (пример 7а) и 243 мг (1,2 ммоль) 5-(трет-бутилоксикарбониламино)-1-пентиламина. Выход 219 мг (41%).
MS (ES+): m/e=449,3 (100%; (М+Н)+).
9b) N6-(1-(5-Аминопентил))-N9-(3-пропионовая кислота)аденин.
Синтез аналогично примеру 1с из N6-(1-(5-(трет-бутилоксикарбониламино)пентил))-N9-(3-пропионовая кислота-трет-бутиловый эфир)аденина (пример 9а). Выход 100%.
1H-NMR (200 МГц, DMSO): =1,50-1,70 (m, 4H, -СН2-СН2-); 2,74-2,91 (m, 4H, NH-CH2+CH2-C(О)); 3,50 (m, 2H, CH2-NH2); 4,36 (t, 2H, N9-CH2); 7,64 (s, широкий, 2H, NH2); 7,90 (t, 1H, NH); 8,11+8,21 (2s, 2H, C6-H+C8-H).
MS (FAB): m/e=279,2 (100%; (M+H)+).
8c) N6-(1-(4-Гуанидинобутил))-N9-(3-пропионовая кислота)аденин.
Синтез аналогично примеру 1d из N6-(1-(4-аминобутил))-N9-(3-пропионовая кислота)аденина (пример 8b). Выход 65%.
MS (ES+): m/e=321,1 (100%; (М+Н)+).
Пример 9. N6-(1-(5-Гуанидинопентил))-N9-(3-пропионовая кислота)аденин.
9а) N6-(1-(5-(трет-Бутилоксикарбониламино)бутил))-N9-(3-пропионовая кислота-трет-бутиловый эфир)аденин.
Синтез аналогично 1b из 282 мг (1,0 ммоль) N9-(3-пропионовая кислота-трет-бутиловый эфир)-6-хлорпурина (пример 7а) и 243 мг (1,2 ммоль) 5-(трет-бутилоксикарбониламино)-1-пентиламина. Выход 219 мг (41%).
MS (ES+): m/e=449,3 (100%; (М+Н)+).
9b) N6-(1-(5-Аминопентил))-N9-(3-пропионовая кислота)аденин.
Синтез аналогично примеру 1с из N6-(1-(5-(трет-бутилоксикарбониламино)пентил))-N9-(3-пропионовая кислота-трет-бутиловый эфир)аденина (пример 9а). Выход 100%.
1H-NMR (200 МГц, DMSO):  =1,39 (m, 2H, CH2); 1,50-1,67 (m, 4H, 2 =1,39 (m, 2H, CH2); 1,50-1,67 (m, 4H, 2 CH2); 2,79 (dt, 2H, NH-CH2); 2,89 (m, 2H, СН2-С(О)); 3,48 (m, 2H, CH2-NH2); 4,37 (t, 2H, N9-CH2); 7,67 (s, широкий, 2H, NH2); 8,04 (t, 1H, NH); 8,13+8,25 (2s, 2H, C6-H+C8-H).
MS (ES+): m/e=293,1 (100%; (M+H)+).
9c) N6-(1-(5-Гуанидинопентил))-N9-(3-пропионовая кислота)аденин.
Синтез аналогично примеру 1d из N6-(1-(5-аминопентил))-N9-(3-пропионовая кислота)аденина (пример 9b). Выход 37%.
1H-NMR (200 МГц, DMSO): CH2); 2,79 (dt, 2H, NH-CH2); 2,89 (m, 2H, СН2-С(О)); 3,48 (m, 2H, CH2-NH2); 4,37 (t, 2H, N9-CH2); 7,67 (s, широкий, 2H, NH2); 8,04 (t, 1H, NH); 8,13+8,25 (2s, 2H, C6-H+C8-H).
MS (ES+): m/e=293,1 (100%; (M+H)+).
9c) N6-(1-(5-Гуанидинопентил))-N9-(3-пропионовая кислота)аденин.
Синтез аналогично примеру 1d из N6-(1-(5-аминопентил))-N9-(3-пропионовая кислота)аденина (пример 9b). Выход 37%.
1H-NMR (200 МГц, DMSO):  =1,38-1,79 (m, 6H, 3 =1,38-1,79 (m, 6H, 3 СН2); 2,80 (t, 2H, NH-СН2); 3,12 (m, 2H, CH2-C(O)); 3,58 (m, 2H, CH2-Gua); 4,43 (t, 2H, N9-CH2); 8,07+8,21 (2s, 2H, C6-H+C8-H).
MS (FAB): m/e=335,2 (100%; (M+H)+).
Пример 10. N6-(2-Уксусная кислота)-N9-(1-(5-аминопентил))аденин.
10а) N6-(трет-Бутиловый эфир-2-уксусной кислоты)аденин.
155 мг (1 ммоль) 6-хлорпурина и 420 мг (2 ммоль) гидрохлорида трет-бутилового эфира глицина (80%) растворяют в 5 мл абсолютного DMF и смешивают с 0,17 мл DIPEA и с иодидом калия на кончике шпателя и перемешивают 6 часов при 50 СН2); 2,80 (t, 2H, NH-СН2); 3,12 (m, 2H, CH2-C(O)); 3,58 (m, 2H, CH2-Gua); 4,43 (t, 2H, N9-CH2); 8,07+8,21 (2s, 2H, C6-H+C8-H).
MS (FAB): m/e=335,2 (100%; (M+H)+).
Пример 10. N6-(2-Уксусная кислота)-N9-(1-(5-аминопентил))аденин.
10а) N6-(трет-Бутиловый эфир-2-уксусной кислоты)аденин.
155 мг (1 ммоль) 6-хлорпурина и 420 мг (2 ммоль) гидрохлорида трет-бутилового эфира глицина (80%) растворяют в 5 мл абсолютного DMF и смешивают с 0,17 мл DIPEA и с иодидом калия на кончике шпателя и перемешивают 6 часов при 50 С. Растворитель выпаривают и остаток хроматографируют на силикагеле (толуол:ЕЕ от 1:1 до 1:2). Выход 76 мг (31%).
MS (ES+): 250,0 (М+Н, 10%); 193,9 (95); 163,9 (100).
10b) N6-(2-Уксусная кислота)-N9-(1-(5-(трет-бутилоксикарбониламино)пентил))аденин.
75 мг (0,3 ммоль) N6-(2-уксусная кислота-трет-бутиловый эфир)аденина (пример 10а), 214 мг (0,6 ммоль) (5-(трет-бутил-оксикарбониламино)пентил)эфир 4-толуолсульфокислоты и 42 мг (0,3 ммоль) К2СО3 растворяют в 6 мл абсолютного DMF и перемешивают 5 дней при RT. Растворитель выпаривают и остаток хроматографируют на силикагеле (толуол:ЕЕ от 7:3 до 1:2). Выход 92 мг (71%).
MS (ES+): 435,3 (М+Н, 25%); 349,3 (100).
10c) N6-(2-Уксусная кислота)-N9-(1-(5-аминопентил))аденин.
Синтез аналогично примеру 1с из N6-(2-Уксусная кислота)-N9-(1-(5-(трет-бутилоксикарбониламино)пентил))аденина (пример 10b). Выход 93%.
MS (ES+): m/e=279,2 (15%; (М+Н)+, 249,1 (100).
Пример 11. N6-(2-(N-(2-Аминоэтил)ацетамид))-N9-(2-уксусная кислота)аденин.
11а) N9-(трет-Бутиловый эфир-2-уксусной кислоты)аденин.
6,76 г (0,05 мол) аденина суспендируют в 300 мл абсолютного DMF в атмосфере N2, после этого добавляют 2,4 г (0,06 мол) дисперсии NaH и перемешивают 2 часа при RT. В течение 30 минут прикапывают 14,7 мл (0,1 мол) трет-бутилового эфира бромуксусной кислоты, при этом образуется прозрачный раствор. Перемешивают еще 5 часов при RT. Растворитель выпаривают, остаток перемешивают с 500 мл воды, отсасывают и кристаллизуют из этанола. Выход 5,1 г (41%).
1Н-NMR (200 МГц, DMSO): С. Растворитель выпаривают и остаток хроматографируют на силикагеле (толуол:ЕЕ от 1:1 до 1:2). Выход 76 мг (31%).
MS (ES+): 250,0 (М+Н, 10%); 193,9 (95); 163,9 (100).
10b) N6-(2-Уксусная кислота)-N9-(1-(5-(трет-бутилоксикарбониламино)пентил))аденин.
75 мг (0,3 ммоль) N6-(2-уксусная кислота-трет-бутиловый эфир)аденина (пример 10а), 214 мг (0,6 ммоль) (5-(трет-бутил-оксикарбониламино)пентил)эфир 4-толуолсульфокислоты и 42 мг (0,3 ммоль) К2СО3 растворяют в 6 мл абсолютного DMF и перемешивают 5 дней при RT. Растворитель выпаривают и остаток хроматографируют на силикагеле (толуол:ЕЕ от 7:3 до 1:2). Выход 92 мг (71%).
MS (ES+): 435,3 (М+Н, 25%); 349,3 (100).
10c) N6-(2-Уксусная кислота)-N9-(1-(5-аминопентил))аденин.
Синтез аналогично примеру 1с из N6-(2-Уксусная кислота)-N9-(1-(5-(трет-бутилоксикарбониламино)пентил))аденина (пример 10b). Выход 93%.
MS (ES+): m/e=279,2 (15%; (М+Н)+, 249,1 (100).
Пример 11. N6-(2-(N-(2-Аминоэтил)ацетамид))-N9-(2-уксусная кислота)аденин.
11а) N9-(трет-Бутиловый эфир-2-уксусной кислоты)аденин.
6,76 г (0,05 мол) аденина суспендируют в 300 мл абсолютного DMF в атмосфере N2, после этого добавляют 2,4 г (0,06 мол) дисперсии NaH и перемешивают 2 часа при RT. В течение 30 минут прикапывают 14,7 мл (0,1 мол) трет-бутилового эфира бромуксусной кислоты, при этом образуется прозрачный раствор. Перемешивают еще 5 часов при RT. Растворитель выпаривают, остаток перемешивают с 500 мл воды, отсасывают и кристаллизуют из этанола. Выход 5,1 г (41%).
1Н-NMR (200 МГц, DMSO):  =1,42 (s, 9H, tBu); 4,95 (s, 2H, N9-CH2); 7,22 (s, широкий, 2H, N6H2); 8,10+8,15 (2s, 2Н, С6-Н+С8-Н).
MS (ES+): m/e=250,1 (M+H+, 65%), 194,0 (100).
11b) N6-(Этиловый эфир-2-уксусной кислоты)-N9-(трет-бутиловый эфир-2-уксусной кислоты)аденин.
978 мг (3 ммоль) NaH и 250 мг (1 ммоль) N9-(трет-бутиловый эфир-2-уксусной кислоты)аденина (пример 11а) суспендируют в 10 мл абсолютного DMF и прикапывают в течение 10 минут 0,12 мл этилового эфира хлоруксусной кислоты. После этого перемешивают 6 часов при 50 =1,42 (s, 9H, tBu); 4,95 (s, 2H, N9-CH2); 7,22 (s, широкий, 2H, N6H2); 8,10+8,15 (2s, 2Н, С6-Н+С8-Н).
MS (ES+): m/e=250,1 (M+H+, 65%), 194,0 (100).
11b) N6-(Этиловый эфир-2-уксусной кислоты)-N9-(трет-бутиловый эфир-2-уксусной кислоты)аденин.
978 мг (3 ммоль) NaH и 250 мг (1 ммоль) N9-(трет-бутиловый эфир-2-уксусной кислоты)аденина (пример 11а) суспендируют в 10 мл абсолютного DMF и прикапывают в течение 10 минут 0,12 мл этилового эфира хлоруксусной кислоты. После этого перемешивают 6 часов при 50 С, затем добавляют еще раз одинаковое количество СsСО3 и перемешивают 6 часов при 50 С, затем добавляют еще раз одинаковое количество СsСО3 и перемешивают 6 часов при 50 С. Растворитель выпаривают и остаток распределяют между водой и ЕЕ. Органическую фазу сушат и концентрируют. Выход 16%.
1H-NMR (200 МГц, DMSO): С. Растворитель выпаривают и остаток распределяют между водой и ЕЕ. Органическую фазу сушат и концентрируют. Выход 16%.
1H-NMR (200 МГц, DMSO):  =1,20 (t, 3H, СН2-СН3); 1,41- (s, 9H, tBu); 4,00-4,28 (m, 4H, СН2-СН3+N6-СН2); 4,98 (s, 2H, N9-CH2); 8,09 (s, широкий, 1Н, N6-H); 8,15+8,21 (2s, 2H, C6-H+C8-H).
MS (ES+): m/e=336,3 (M+H+, 100%); 280,3 (60).
11c) N6-(2-Уксусная кислота)-N9-(2-уксусная кислота-трет-бутиловый эфир)аденин.
249 мг (0,74 ммоль) N6-(этиловый эфир-2-уксусной кислоты)-N9-(трет-бутиловый эфир-2-уксусной кислоты)аденина (пример 11b) растворяют в 6 мл диоксана:воды:триэтиламина и перемешивают 4 дня при RT. Растворитель выпаривают и остаток хроматографируют на силикагеле (DCM:MeOH 95:5 до 90:10). Выход 36%.
MS (ES+): m/e=308,3 (М+Н+, 100%).
11d) N6-(2-(N-(2-трет-Бутилоксикарбониламиноэтил)ацетамид))-N9-(трет-бутиловый эфир-2-уксусной кислоты)аденин.
80 мг (0,26 ммоль) N6-(2-уксусная кислота)-N9-(трет-бутиловый эфир-2-уксусной кислоты)аденина (пример 11с), 42 мг (0,26 ммоль) 2-трет-бутилоксикарбониламиноэтиламина растворяют в атмосфере аргона в 5 мл абсолютного DMF и при 0 =1,20 (t, 3H, СН2-СН3); 1,41- (s, 9H, tBu); 4,00-4,28 (m, 4H, СН2-СН3+N6-СН2); 4,98 (s, 2H, N9-CH2); 8,09 (s, широкий, 1Н, N6-H); 8,15+8,21 (2s, 2H, C6-H+C8-H).
MS (ES+): m/e=336,3 (M+H+, 100%); 280,3 (60).
11c) N6-(2-Уксусная кислота)-N9-(2-уксусная кислота-трет-бутиловый эфир)аденин.
249 мг (0,74 ммоль) N6-(этиловый эфир-2-уксусной кислоты)-N9-(трет-бутиловый эфир-2-уксусной кислоты)аденина (пример 11b) растворяют в 6 мл диоксана:воды:триэтиламина и перемешивают 4 дня при RT. Растворитель выпаривают и остаток хроматографируют на силикагеле (DCM:MeOH 95:5 до 90:10). Выход 36%.
MS (ES+): m/e=308,3 (М+Н+, 100%).
11d) N6-(2-(N-(2-трет-Бутилоксикарбониламиноэтил)ацетамид))-N9-(трет-бутиловый эфир-2-уксусной кислоты)аденин.
80 мг (0,26 ммоль) N6-(2-уксусная кислота)-N9-(трет-бутиловый эфир-2-уксусной кислоты)аденина (пример 11с), 42 мг (0,26 ммоль) 2-трет-бутилоксикарбониламиноэтиламина растворяют в атмосфере аргона в 5 мл абсолютного DMF и при 0 С смешивают с 85 мг (0,26 ммоль) ТОТУ и 0,13 мл (0,78 ммоль) DIPEA и перемешивают 10 минут при 0 С смешивают с 85 мг (0,26 ммоль) ТОТУ и 0,13 мл (0,78 ммоль) DIPEA и перемешивают 10 минут при 0 С и 2,5 часа при RT. Разбавляют при помощи ЕЕ до 100 мл, затем промывают насыщенным раствором гидрокарбоната калия, сушат и концентрируют. Хроматографируют на силикагеле (DCM:MeOH от 98:2 до 90:10). Выход 5%.
MS (ES+): m/e=450,3 (М+Н+, 100%).
11e) N6-(2-(N-(2-Аминоэтил)ацетамид))-N9-(2-уксусная кислота)аденин.
Синтез аналогично примеру 1с из N6-(2-(N-(2-трет-бутилоксикарбониламиноэтил)ацетамид))-N9-(трет-бутиловый эфир-2-уксусной кислоты)аденина (пример 11d). Выход 80%.
MS (ES+): m/e=293,1 (100%) (М+Н)+).
Пример 12. N6-(4-(2S-(Бензилоксикарбониламино)масляная кислота))-N9-(1-(3-гуанидинилпропил))аденин.
12а) N9-(1-(3-(трет-Бутилоксикарбониламино)пропил))-6-хлорпурин.
154,6 мг (1 ммоль) 6-хлорпурина растворяют в 2,5 мл абсолютного DMF и при перемешивании смешивают с 331,7 мг (2,4 ммоль) К2СО3 и 285,8 мг (1,2 ммоль) N-(3-трет-бутиловый эфир бромпропил)карбамидной кислоты. Перемешивают 11 часов при RT, выпаривают растворитель, поглощают остаток в ЕЕ и дважды промывают насыщенным раствором NаНСО3, затем раствором NaCl, сушат, фильтруют и концентрируют. Остаток хроматографируют на силикагеле (ЕЕ:н-гептан 8:2). Выход 267 мг (86%).
1H-NMR (200 МГц, DMSO): С и 2,5 часа при RT. Разбавляют при помощи ЕЕ до 100 мл, затем промывают насыщенным раствором гидрокарбоната калия, сушат и концентрируют. Хроматографируют на силикагеле (DCM:MeOH от 98:2 до 90:10). Выход 5%.
MS (ES+): m/e=450,3 (М+Н+, 100%).
11e) N6-(2-(N-(2-Аминоэтил)ацетамид))-N9-(2-уксусная кислота)аденин.
Синтез аналогично примеру 1с из N6-(2-(N-(2-трет-бутилоксикарбониламиноэтил)ацетамид))-N9-(трет-бутиловый эфир-2-уксусной кислоты)аденина (пример 11d). Выход 80%.
MS (ES+): m/e=293,1 (100%) (М+Н)+).
Пример 12. N6-(4-(2S-(Бензилоксикарбониламино)масляная кислота))-N9-(1-(3-гуанидинилпропил))аденин.
12а) N9-(1-(3-(трет-Бутилоксикарбониламино)пропил))-6-хлорпурин.
154,6 мг (1 ммоль) 6-хлорпурина растворяют в 2,5 мл абсолютного DMF и при перемешивании смешивают с 331,7 мг (2,4 ммоль) К2СО3 и 285,8 мг (1,2 ммоль) N-(3-трет-бутиловый эфир бромпропил)карбамидной кислоты. Перемешивают 11 часов при RT, выпаривают растворитель, поглощают остаток в ЕЕ и дважды промывают насыщенным раствором NаНСО3, затем раствором NaCl, сушат, фильтруют и концентрируют. Остаток хроматографируют на силикагеле (ЕЕ:н-гептан 8:2). Выход 267 мг (86%).
1H-NMR (200 МГц, DMSO):  =1,37 (s, 9H, tBu); 2,00 (tt, 2H, СН2-СН2-СН2); 2,95 (dt, 2Н, СН2-NH); 4,30 (t, 2Н, N9-CH2); 6,91 (t, широкий, 1H, NH); 8,70+8,78 (2s, 2Н, С6-Н+С8-Н).
MS (ES+): m/e=312,2 (100%; (М+Н)+); 256,1 (20).
12b) N6-(4-(2S-(Бензилоксикарбониламино)масляная кислота))-N9-(1-(3-(трет-бутилоксикарбониламино)пропил))аденин.
370 мг (1,19 ммоль) N9-(1-(3-(трет-бутилоксикарбониламино)пропил))-6-хлорпурина (пример 12а) растворяют в 10 мл абсолютного DMF и 5 мл DIPEA. При комнатной температуре добавляют 449 мг (1,8 ммоль) 2S-бензилоксикарбониламино-4-аминомасляной кислоты и перемешивают 50 часов при 65 =1,37 (s, 9H, tBu); 2,00 (tt, 2H, СН2-СН2-СН2); 2,95 (dt, 2Н, СН2-NH); 4,30 (t, 2Н, N9-CH2); 6,91 (t, широкий, 1H, NH); 8,70+8,78 (2s, 2Н, С6-Н+С8-Н).
MS (ES+): m/e=312,2 (100%; (М+Н)+); 256,1 (20).
12b) N6-(4-(2S-(Бензилоксикарбониламино)масляная кислота))-N9-(1-(3-(трет-бутилоксикарбониламино)пропил))аденин.
370 мг (1,19 ммоль) N9-(1-(3-(трет-бутилоксикарбониламино)пропил))-6-хлорпурина (пример 12а) растворяют в 10 мл абсолютного DMF и 5 мл DIPEA. При комнатной температуре добавляют 449 мг (1,8 ммоль) 2S-бензилоксикарбониламино-4-аминомасляной кислоты и перемешивают 50 часов при 65 С. Растворитель выпаривают и распределяют остаток между ЕЕ и насыщенным раствором NaCl (20% KHSO4). Органическую фазу промывают водой, сушат, фильтруют и концентрируют. Остаток хроматографируют на силикагеле (ЕЕ:МеОН 8:2). Выход 331 мг (53%).
1H-NMR (200 МГц, DMSO): С. Растворитель выпаривают и распределяют остаток между ЕЕ и насыщенным раствором NaCl (20% KHSO4). Органическую фазу промывают водой, сушат, фильтруют и концентрируют. Остаток хроматографируют на силикагеле (ЕЕ:МеОН 8:2). Выход 331 мг (53%).
1H-NMR (200 МГц, DMSO):  =1,39 (s, 9H, tBu); 1,73-2,21 (m, 2H, CH2-CH(NH-Z)); 1,90 (m, 2H, CH2-CH2-CH2); 2,92 (dt, 2H, CH2-NH-Boc); 3,15 (dt, 2H, N6-CH2); 3,88-4,10 (m, 1H, CH-NHZ); 4,14 (t, 2H, N9-CH2); 5,03 (s, 2H, CH2-Ph); 6,91 (t, широкий, 1Н, NH-Boc); 7,37 (s, 5H, Ar-H); 7,55-7,81 (m, 2H, NH-Z+N6H-CH2); 8,13+8,19 (2s, 2Н, С6-Н+С8-Н).
MS (ES+): m/e=528,2 (100%; (М+Н)+).
12c) N6-(4-(2S-(Бензилоксикарбониламино)масляная кислота))-N9-(1-(3-аминопропил))аденин.
30 мг (0,06 ммоль) N6-(3-(2S-(бензилоксикарбониламино)пропионовой кислоты))-N9-(1-(3-(трет-бутилоксикарбониламино)пропил))аденина (пример 12b) растворяют в 2 мл 90%-ной трифторуксусной кислоты, перемешивают 70 минут при RT, концентрируют и остаток размешивают несколько раз с эфиром. Остаток растворяют в воде и сушат вымораживанием. Выход 100%.
MS (ES+): m/e=428,2 (100%; (М+Н)+); 294,1 (90).
12d) N6-(4-(2S-(Бензилоксикарбониламино)масляная кислота))-N9-(1-(3-гуанидинилпропил))аденин.
Синтез аналогично примеру 1d из N6-(3-(2S- (бензилоксикарбониламино)пропионовая кислота))-N9-(1-(3-аминопропил))аденина (пример 12c). Выход 77%.
MS (ES+): m/e=470,3 (25%; (М+Н)+; 336,2 (100).
Пример 13. N6-(4-(2S-(Бензилоксикарбониламино)масляная кислота))-N9-(1-(3-(4,5-дигидро-1Н-имидазол-2-иламино)пропил))аденин.
Синтез аналогично примеру 4 из N6-(3-(2S-(бензилоксикарбониламино)пропионовой кислоты))-N9-(1-(3-аминопропил))аденина (пример 12c). Выход 63%.
NS (ES+): m/e=496,3 (100%; (М+Н)+).
Пример 14. N6-(3-(2S-(Бензилоксикарбониламино)пропионовая кислота))-N9-(1-(5-гуанидинилпентил))аденин.
14а) N9-(1-(5-(трет-Бутилоксикарбониламино)пентил))-6-хлорпурин.
Синтез аналогично примеру 12а из 6-хлорпурина и трет-бутилового эфира N-(5-тозилоксипентил)карбамидной кислоты. Выход 66%.
1Н-NMR (200 МГц, DMSO): =1,39 (s, 9H, tBu); 1,73-2,21 (m, 2H, CH2-CH(NH-Z)); 1,90 (m, 2H, CH2-CH2-CH2); 2,92 (dt, 2H, CH2-NH-Boc); 3,15 (dt, 2H, N6-CH2); 3,88-4,10 (m, 1H, CH-NHZ); 4,14 (t, 2H, N9-CH2); 5,03 (s, 2H, CH2-Ph); 6,91 (t, широкий, 1Н, NH-Boc); 7,37 (s, 5H, Ar-H); 7,55-7,81 (m, 2H, NH-Z+N6H-CH2); 8,13+8,19 (2s, 2Н, С6-Н+С8-Н).
MS (ES+): m/e=528,2 (100%; (М+Н)+).
12c) N6-(4-(2S-(Бензилоксикарбониламино)масляная кислота))-N9-(1-(3-аминопропил))аденин.
30 мг (0,06 ммоль) N6-(3-(2S-(бензилоксикарбониламино)пропионовой кислоты))-N9-(1-(3-(трет-бутилоксикарбониламино)пропил))аденина (пример 12b) растворяют в 2 мл 90%-ной трифторуксусной кислоты, перемешивают 70 минут при RT, концентрируют и остаток размешивают несколько раз с эфиром. Остаток растворяют в воде и сушат вымораживанием. Выход 100%.
MS (ES+): m/e=428,2 (100%; (М+Н)+); 294,1 (90).
12d) N6-(4-(2S-(Бензилоксикарбониламино)масляная кислота))-N9-(1-(3-гуанидинилпропил))аденин.
Синтез аналогично примеру 1d из N6-(3-(2S- (бензилоксикарбониламино)пропионовая кислота))-N9-(1-(3-аминопропил))аденина (пример 12c). Выход 77%.
MS (ES+): m/e=470,3 (25%; (М+Н)+; 336,2 (100).
Пример 13. N6-(4-(2S-(Бензилоксикарбониламино)масляная кислота))-N9-(1-(3-(4,5-дигидро-1Н-имидазол-2-иламино)пропил))аденин.
Синтез аналогично примеру 4 из N6-(3-(2S-(бензилоксикарбониламино)пропионовой кислоты))-N9-(1-(3-аминопропил))аденина (пример 12c). Выход 63%.
NS (ES+): m/e=496,3 (100%; (М+Н)+).
Пример 14. N6-(3-(2S-(Бензилоксикарбониламино)пропионовая кислота))-N9-(1-(5-гуанидинилпентил))аденин.
14а) N9-(1-(5-(трет-Бутилоксикарбониламино)пентил))-6-хлорпурин.
Синтез аналогично примеру 12а из 6-хлорпурина и трет-бутилового эфира N-(5-тозилоксипентил)карбамидной кислоты. Выход 66%.
1Н-NMR (200 МГц, DMSO):  =1,11-1,48 (m, 4H, 2 =1,11-1,48 (m, 4H, 2 CH2); 1,35 (s, 9H, tBu); 1,87 (tt, 2H, CH2); 2,97 (dt, 2H, CH2-NHBoc); 4,28 (t, 2H, N9-CH2); 6,72 (t, широкий, 1H, NH); 8,71+8,78 (2s, 2H, C6-H+C8-H).
MS (ES+): m/e=340,2 (100%; (M+H)+); 284,1 (50).
14b) N6-(3-(2S-(Бензилоксикарбониламино)пропионовая кислота))-N9-(1-(5-(трет-бутилоксикарбониламино)пентил))аденин.
Синтез аналогично примеру 12b из N6-(1-(5-(трет-бутилоксикарбониламино(пентил))-6-хлорпурина и 2S-бензилоксикарбониламино-3-аминопропионовой кислоты. Выход 23%.
1H-NMR (200 МГц, DMSO): CH2); 1,35 (s, 9H, tBu); 1,87 (tt, 2H, CH2); 2,97 (dt, 2H, CH2-NHBoc); 4,28 (t, 2H, N9-CH2); 6,72 (t, широкий, 1H, NH); 8,71+8,78 (2s, 2H, C6-H+C8-H).
MS (ES+): m/e=340,2 (100%; (M+H)+); 284,1 (50).
14b) N6-(3-(2S-(Бензилоксикарбониламино)пропионовая кислота))-N9-(1-(5-(трет-бутилоксикарбониламино)пентил))аденин.
Синтез аналогично примеру 12b из N6-(1-(5-(трет-бутилоксикарбониламино(пентил))-6-хлорпурина и 2S-бензилоксикарбониламино-3-аминопропионовой кислоты. Выход 23%.
1H-NMR (200 МГц, DMSO):  =1,10-1,49 (m, 4H, 2 =1,10-1,49 (m, 4H, 2 СН2); 1,36 (s, 9H, tBu); 1,62-1,88 (m, 2H, CH2); 2,87 (dt, 2H, CH2-NHBoc); 3,68-4,98 (m, 5H, N9-CH2+CH2-CH-NHZ); 5,00 (s, 2H, CH2-Ph); 6,75 (t, широкий, 1H, NH); 8,02+8,20 (2s, 2H, C6-H+C8-H).
MS (FAB): m/e=542,3 (100%; (M+H)+).
14c) N6-(3-(2S-(Бензилоксикарбониламино)пропионовая кислота))-N9-(1-(5-аминопентил))аденин.
Синтез аналогично примеру 12с из N6-(3-(2S-(бензилоксикарбониламино)пропионовой кислоты))-N9-(1-(5-(трет-бутилоксикарбониламино)пентил))аденина (пример 14b). Выход 100%.
1H-NMR (200 МГц, DMSO): СН2); 1,36 (s, 9H, tBu); 1,62-1,88 (m, 2H, CH2); 2,87 (dt, 2H, CH2-NHBoc); 3,68-4,98 (m, 5H, N9-CH2+CH2-CH-NHZ); 5,00 (s, 2H, CH2-Ph); 6,75 (t, широкий, 1H, NH); 8,02+8,20 (2s, 2H, C6-H+C8-H).
MS (FAB): m/e=542,3 (100%; (M+H)+).
14c) N6-(3-(2S-(Бензилоксикарбониламино)пропионовая кислота))-N9-(1-(5-аминопентил))аденин.
Синтез аналогично примеру 12с из N6-(3-(2S-(бензилоксикарбониламино)пропионовой кислоты))-N9-(1-(5-(трет-бутилоксикарбониламино)пентил))аденина (пример 14b). Выход 100%.
1H-NMR (200 МГц, DMSO):  =1,18-1,40+1,44-1,65+1,71-1,93 (2m, 6H, 3 =1,18-1,40+1,44-1,65+1,71-1,93 (2m, 6H, 3 СН2); 2,77 (dt, 2H, CH2-NHBoc); 3,64-4,35 (m, 5Н, N9-CH2+CH2CH-NHZ); 5,00 (s, 2Н, CH2-Ph); 7,66 (m, 3H, NH+3); 8,20+8,24 (2s, 2H, C6-H+C8-H).
MS (ES+): m/e=442,3 (40%; (М+Н)+); 308,2 (100).
14d) N6-(3-(2S-(Бензилоксикарбониламино)пропионовая кислота))-N9-(1-(5-гуанидинилпентил))аденин.
Синтез аналогично примеру 1d из N6-(3-(2S-(бензилоксикарбониламино)пропионовой кислоты))-N9-(1-(5-аминопентил))аденина (пример 14c). Выход 90%.
MS (ES+): m/e=484,3 (70%; (М+Н)+); 350,2 (60).
Пример 15. N6-(3-(2S-(Бензилоксикарбониламино)пропионовая кислота))-N9-(1-(5-(4,5-дигидро-1H-имидазол-2-иламино)пентил))аденин.
Синтез аналогично примеру 4 из N6-(3-(2S-(бензилоксикарбониламино)пропионовой кислоты)-N9-(1-(5-аминопентил))аденина (пример 14c). Выход 75%.
MS (ES+): m/e=510,3 (40%; (М+Н)+); 376,2 (100).
Пример 16. N6-(3-(2S-(Бензилоксикарбониламино)пропионовая кислота))-N9-(1-(3-гуанидинилпропил))аденин.
16а) N6-(3-(2S-(Бензилоксикарбониламино)пропионовая кислота))-N9-(1-(3-(трет-бутилоксикарбониламино)пропил))аденин.
Синтез аналогично примеру 12b из N9-(1-(3-(трет-бутилоксикарбониламинопропил))-6-хлорпурина (пример 12а) и 2S-бензилоксикарбониламино-3-аминопропионовой кислоты. Выход 27%.
1H-NMR (200 МГц, DMSO): СН2); 2,77 (dt, 2H, CH2-NHBoc); 3,64-4,35 (m, 5Н, N9-CH2+CH2CH-NHZ); 5,00 (s, 2Н, CH2-Ph); 7,66 (m, 3H, NH+3); 8,20+8,24 (2s, 2H, C6-H+C8-H).
MS (ES+): m/e=442,3 (40%; (М+Н)+); 308,2 (100).
14d) N6-(3-(2S-(Бензилоксикарбониламино)пропионовая кислота))-N9-(1-(5-гуанидинилпентил))аденин.
Синтез аналогично примеру 1d из N6-(3-(2S-(бензилоксикарбониламино)пропионовой кислоты))-N9-(1-(5-аминопентил))аденина (пример 14c). Выход 90%.
MS (ES+): m/e=484,3 (70%; (М+Н)+); 350,2 (60).
Пример 15. N6-(3-(2S-(Бензилоксикарбониламино)пропионовая кислота))-N9-(1-(5-(4,5-дигидро-1H-имидазол-2-иламино)пентил))аденин.
Синтез аналогично примеру 4 из N6-(3-(2S-(бензилоксикарбониламино)пропионовой кислоты)-N9-(1-(5-аминопентил))аденина (пример 14c). Выход 75%.
MS (ES+): m/e=510,3 (40%; (М+Н)+); 376,2 (100).
Пример 16. N6-(3-(2S-(Бензилоксикарбониламино)пропионовая кислота))-N9-(1-(3-гуанидинилпропил))аденин.
16а) N6-(3-(2S-(Бензилоксикарбониламино)пропионовая кислота))-N9-(1-(3-(трет-бутилоксикарбониламино)пропил))аденин.
Синтез аналогично примеру 12b из N9-(1-(3-(трет-бутилоксикарбониламинопропил))-6-хлорпурина (пример 12а) и 2S-бензилоксикарбониламино-3-аминопропионовой кислоты. Выход 27%.
1H-NMR (200 МГц, DMSO):  =1,37 (s, 9H, tBu); 1,90 (m, 2H, CH2-CH2-CH2); 2,92 (dt, 2H, CH2-NHBoc); 3,86 (m, широкий, 2Н, CH2-CH(NH-Z)); 4,13 (t, 2H, N9-CH2); 4,40 (m, 1H, CH-NHZ); 5,01 (s, 2H, CH2-Ph); 6,92 (t, широкий, 1Н, NH-Boc); 7,33 (s, 5H, Ar-H); 7,55-7,75 (m, 2H, NH-Z+N6H-CH2); 8,16+8,22 (2s, 2H, С6-Н+С8-Н).
MS (ES+): m/e=514,3 (100%; (М+Н)+).
16b) N6-(3-(2S-(Бензилоксикарбониламино)пропионовая кислота))-N9-(1-(3-аминопропил))аденин.
Синтез аналогично примеру 12с из N6-(3-(2S-(бензилоксикарбониламино)пропионовой кислоты))-N9-(1-(3-(трет-бутилоксикарбониламино)пропил))аденина (пример 16а). Выход 100%.
MS (ES+): m/e=414,2 (100%; (М+Н)+); 280,2 (70).
16c) N6-(3-(2S-(Бензилоксикарбониламино)пропионовая кислота))-N9-(1-(3-гуанидинилпропил))аденин.
Синтез аналогично примеру 1d из N6-(3-(2S-(бензилоксикарбониламино)пропионовой кислоты))-N9-(1-(3-аминопропил))аденина (пример 16b). Выход 98%.
МS (ES+): m/e=456,3 (40%; (М+Н)+); 322,2 (100).
Пример 17. N6-(3-(2S-(Бензилоксикарбониламино)пропионовая кислота))-N9-(1-(4-гуанидинилбутил))аденин.
17а) N9-(1-(4-трет-Бутилоксикарбониламино)бутил))-6-хлорпурин.
Синтез аналогично примеру 12а из 6-хлорпурина и трет-бутилового эфира N-(4-тозилоксибутил)карбамидной кислоты. Выход 66%.
1H-NMR (200 МГц, DMSO): =1,37 (s, 9H, tBu); 1,90 (m, 2H, CH2-CH2-CH2); 2,92 (dt, 2H, CH2-NHBoc); 3,86 (m, широкий, 2Н, CH2-CH(NH-Z)); 4,13 (t, 2H, N9-CH2); 4,40 (m, 1H, CH-NHZ); 5,01 (s, 2H, CH2-Ph); 6,92 (t, широкий, 1Н, NH-Boc); 7,33 (s, 5H, Ar-H); 7,55-7,75 (m, 2H, NH-Z+N6H-CH2); 8,16+8,22 (2s, 2H, С6-Н+С8-Н).
MS (ES+): m/e=514,3 (100%; (М+Н)+).
16b) N6-(3-(2S-(Бензилоксикарбониламино)пропионовая кислота))-N9-(1-(3-аминопропил))аденин.
Синтез аналогично примеру 12с из N6-(3-(2S-(бензилоксикарбониламино)пропионовой кислоты))-N9-(1-(3-(трет-бутилоксикарбониламино)пропил))аденина (пример 16а). Выход 100%.
MS (ES+): m/e=414,2 (100%; (М+Н)+); 280,2 (70).
16c) N6-(3-(2S-(Бензилоксикарбониламино)пропионовая кислота))-N9-(1-(3-гуанидинилпропил))аденин.
Синтез аналогично примеру 1d из N6-(3-(2S-(бензилоксикарбониламино)пропионовой кислоты))-N9-(1-(3-аминопропил))аденина (пример 16b). Выход 98%.
МS (ES+): m/e=456,3 (40%; (М+Н)+); 322,2 (100).
Пример 17. N6-(3-(2S-(Бензилоксикарбониламино)пропионовая кислота))-N9-(1-(4-гуанидинилбутил))аденин.
17а) N9-(1-(4-трет-Бутилоксикарбониламино)бутил))-6-хлорпурин.
Синтез аналогично примеру 12а из 6-хлорпурина и трет-бутилового эфира N-(4-тозилоксибутил)карбамидной кислоты. Выход 66%.
1H-NMR (200 МГц, DMSO):  =1,30 (m, 2H, CH2); 1,35 (s, 9H, tBu); 1,86 (tt, 2H, CH2); 2,93 (dt, 2H, CH2-NHBoc); 4,31 (t, 2H, N2-CH2); 6,79 (t, широкий, 1Н, NH); 8,72+8,78 (2s, 2H, C6-H+C8-H).
MS (ES+): m/e=326,2 (80%; (M+H)+); 270,1 (100).
17b) N6-(3-(2S-(Бензилоксикарбониламино)пропионовая кислота))-N9-(1-(4-(трет-бутилоксикарбониламино)бутил))аденин.
Синтез аналогично примеру 12b из N9-(1-(4-тpeт-бутилоксикарбониламино)бутил))-6-хлорпурина (пример 17а) и 2S-бензилоксикарбониламино-3-аминопропионовой кислоты. Выход 33%.
1Н-NMR (200 МГц, DMSO): =1,30 (m, 2H, CH2); 1,35 (s, 9H, tBu); 1,86 (tt, 2H, CH2); 2,93 (dt, 2H, CH2-NHBoc); 4,31 (t, 2H, N2-CH2); 6,79 (t, широкий, 1Н, NH); 8,72+8,78 (2s, 2H, C6-H+C8-H).
MS (ES+): m/e=326,2 (80%; (M+H)+); 270,1 (100).
17b) N6-(3-(2S-(Бензилоксикарбониламино)пропионовая кислота))-N9-(1-(4-(трет-бутилоксикарбониламино)бутил))аденин.
Синтез аналогично примеру 12b из N9-(1-(4-тpeт-бутилоксикарбониламино)бутил))-6-хлорпурина (пример 17а) и 2S-бензилоксикарбониламино-3-аминопропионовой кислоты. Выход 33%.
1Н-NMR (200 МГц, DMSO):  =1,30 (m, 2H, CH2); 1,35 (s, 9H, tBu); 1,75 (m, 2H, CH2); 2,91 (dt, 2H, CH2-NHBoc); 3,71-4,34 (m, 5H, CH2-CH(NH-Z)+N9-CH2); 5,01 (s, 2H, CH2-Ph); 6,89 (t, широкий, 1Н, NH-Boc); 7,35 (s, 5H, Ar-H); 7,46-7,73 (m, 2H, NH-Z+N6H-CH2); 8,10 (широкий)+8,20 (2s, 2H, С6-Н+С8-Н).
MS (FAB): m/e=528,4 (100%; (М+Н)+).
17с) N6-(3-(2S-(Бензилоксикарбониламино)пропионовая кислота))-N9-(1-(4-аминобутил))аденин.
Синтез аналогично примеру 12с из N6-(3-(2S-(бензилоксикарбониламино)пропионовая кислота))-N9-(1-(4-трет-бутилоксикарбониламинобутил))аденина (пример 17b). Выход 100%.
1H-NMR (200 МГц, DMSO): =1,30 (m, 2H, CH2); 1,35 (s, 9H, tBu); 1,75 (m, 2H, CH2); 2,91 (dt, 2H, CH2-NHBoc); 3,71-4,34 (m, 5H, CH2-CH(NH-Z)+N9-CH2); 5,01 (s, 2H, CH2-Ph); 6,89 (t, широкий, 1Н, NH-Boc); 7,35 (s, 5H, Ar-H); 7,46-7,73 (m, 2H, NH-Z+N6H-CH2); 8,10 (широкий)+8,20 (2s, 2H, С6-Н+С8-Н).
MS (FAB): m/e=528,4 (100%; (М+Н)+).
17с) N6-(3-(2S-(Бензилоксикарбониламино)пропионовая кислота))-N9-(1-(4-аминобутил))аденин.
Синтез аналогично примеру 12с из N6-(3-(2S-(бензилоксикарбониламино)пропионовая кислота))-N9-(1-(4-трет-бутилоксикарбониламинобутил))аденина (пример 17b). Выход 100%.
1H-NMR (200 МГц, DMSO):  =1,48 (m, 2H, СН2); 1,87 (m, 2H, СН2); 2,80 (dt, 2H, CH2-NH2); 3,69-4,02 (m, 2H, CH2-CH (NH-Z)); 4,20 (t, 2H, N9-CH2); 4,36 (m, 1H, CH(NH-Z)); 5,01 (s, 2H, СН2-Ph); 7,33 (s, 5H, Ar-H); 7,64 (s, широкий, 4H, NH+3+N6H-CH2); 8,10 (широкий)+8,20 (2s, 2Н, С6-Н+С8-Н).
MS (ES+): m/e=428,3 (50%; (М+Н)+); 294,2 (100).
17d) N6-(3-(2S-(Бензилоксикарбониламино)пропионовая кислота))-N9-(1-(4-гуaнидинилбутил))аденин.
Синтез аналогично примеру 1d из N6-(3-(2S-(бензилоксикарбониламино)пропионовой кислоты))-N9-(1-(4-аминобутил))аденина (пример 17с). Выход 78%.
MS (ES+): m/e=470,2 (50%; (М+Н)+); 336,2 (100).
Пример 18. N6-(3-(2S-(Бензилоксикарбониламино)пропионовая кислота))-N9-(1-(4-(4,5-дигидро-1H-имидазол-2-ил)амино)бутил))аденин.
Синтез аналогично примеру 4 из N6-(3-(2S-(бензилоксикарбониламино)пропионовой кислоты))-N9-(1-(4-аминобутил))аденина (пример 17с). Выход 41%.
MS (ES+): m/e=496,3 (60%; (М+Н)+; 362,2 (100).
Пример 19. 2S-Бензилоксикарбониламино-3-(6-(4-(1,4,5,6-тетрагидропиримидин-2-илкарбамоил)пиперидин-1-ил)пурин-9-ил)пропионовая кислота.
19а) трет-Бутиловый эфир 2S-бензилоксикарбониламино-3-(6-(4-карбокси-пиперидин-1-ил)пурин-9-ил)пропионовой кислоты.
260 мг (0,6 ммоль) трет-бутилового эфира 2S-бензилоксикарбониламино-3-(6-хлорпурин-9-ил)пропионовой кислоты (пример 1а), 116,3 мг (0,9 ммоль) пиперидин-4-карбоновой кислоты и 310 мг (2,4 ммоль) DIPEA в 4 мл абсолютного DMF перемешивают 16 часов при 60 =1,48 (m, 2H, СН2); 1,87 (m, 2H, СН2); 2,80 (dt, 2H, CH2-NH2); 3,69-4,02 (m, 2H, CH2-CH (NH-Z)); 4,20 (t, 2H, N9-CH2); 4,36 (m, 1H, CH(NH-Z)); 5,01 (s, 2H, СН2-Ph); 7,33 (s, 5H, Ar-H); 7,64 (s, широкий, 4H, NH+3+N6H-CH2); 8,10 (широкий)+8,20 (2s, 2Н, С6-Н+С8-Н).
MS (ES+): m/e=428,3 (50%; (М+Н)+); 294,2 (100).
17d) N6-(3-(2S-(Бензилоксикарбониламино)пропионовая кислота))-N9-(1-(4-гуaнидинилбутил))аденин.
Синтез аналогично примеру 1d из N6-(3-(2S-(бензилоксикарбониламино)пропионовой кислоты))-N9-(1-(4-аминобутил))аденина (пример 17с). Выход 78%.
MS (ES+): m/e=470,2 (50%; (М+Н)+); 336,2 (100).
Пример 18. N6-(3-(2S-(Бензилоксикарбониламино)пропионовая кислота))-N9-(1-(4-(4,5-дигидро-1H-имидазол-2-ил)амино)бутил))аденин.
Синтез аналогично примеру 4 из N6-(3-(2S-(бензилоксикарбониламино)пропионовой кислоты))-N9-(1-(4-аминобутил))аденина (пример 17с). Выход 41%.
MS (ES+): m/e=496,3 (60%; (М+Н)+; 362,2 (100).
Пример 19. 2S-Бензилоксикарбониламино-3-(6-(4-(1,4,5,6-тетрагидропиримидин-2-илкарбамоил)пиперидин-1-ил)пурин-9-ил)пропионовая кислота.
19а) трет-Бутиловый эфир 2S-бензилоксикарбониламино-3-(6-(4-карбокси-пиперидин-1-ил)пурин-9-ил)пропионовой кислоты.
260 мг (0,6 ммоль) трет-бутилового эфира 2S-бензилоксикарбониламино-3-(6-хлорпурин-9-ил)пропионовой кислоты (пример 1а), 116,3 мг (0,9 ммоль) пиперидин-4-карбоновой кислоты и 310 мг (2,4 ммоль) DIPEA в 4 мл абсолютного DMF перемешивают 16 часов при 60 С. После этого добавляют остальные 310 мг DIPEA и еще раз перемешивают 24 часа при 60 С. После этого добавляют остальные 310 мг DIPEA и еще раз перемешивают 24 часа при 60 С. Растворитель выпаривают и остаток распределяют между ЕЕ и водой. Органическую фазу еще раз промывают раствором KHSO4/K2SO4, затем раствором NaCl, сушат, фильтруют и концентрируют. Остаток хроматографируют на силикагеле (ЕЕ). Выход 219 мг (69%).
MS (ES+): m/e=525,3 (100% (М+Н)+).
19b) трет-Бутиловый эфир 2S-бензилоксикарбониламино-3-(6-(4-(1,4,5,6-тетрагидропиримидин-2-илкарбамоил)пиперидин-1-ил)пурин-9-ил)пропионовой кислоты.
126 мг (0,24 ммоль) трет-бутилового эфира 2S-бензилоксикарбониламино-3-(6-(4-карбоксипиперидин-1-ил)пурин-9-ил)пропионовой кислоты (пример 19а), 39,3 мг (0,29 ммоль) 2-амино-1,4,5,6-тетрагидропиримидин-гидрохлорида, 86,6 мг (0,264 ммоль) ТОТУ (O-((этоксикарбонил)цианометиленамино)-N,N,N’,N’-тетраметилуроний-тетрафторбората (W. С. Растворитель выпаривают и остаток распределяют между ЕЕ и водой. Органическую фазу еще раз промывают раствором KHSO4/K2SO4, затем раствором NaCl, сушат, фильтруют и концентрируют. Остаток хроматографируют на силикагеле (ЕЕ). Выход 219 мг (69%).
MS (ES+): m/e=525,3 (100% (М+Н)+).
19b) трет-Бутиловый эфир 2S-бензилоксикарбониламино-3-(6-(4-(1,4,5,6-тетрагидропиримидин-2-илкарбамоил)пиперидин-1-ил)пурин-9-ил)пропионовой кислоты.
126 мг (0,24 ммоль) трет-бутилового эфира 2S-бензилоксикарбониламино-3-(6-(4-карбоксипиперидин-1-ил)пурин-9-ил)пропионовой кислоты (пример 19а), 39,3 мг (0,29 ммоль) 2-амино-1,4,5,6-тетрагидропиримидин-гидрохлорида, 86,6 мг (0,264 ммоль) ТОТУ (O-((этоксикарбонил)цианометиленамино)-N,N,N’,N’-тетраметилуроний-тетрафторбората (W. et al., Proceedings of the 21st European Peptide Symposium 1990, E.Giralt, D.Andreu, Eds., ESCOM, Leiden, s. 143) и 124 мг DIPEA добавляют по очереди к 3 мл абсолютного DMF. Перемешивают 3 часа при RT, после этого добавляют остальные 28 мг DIPEA и перемешивают 12 часов при RT. Реакционную смесь доводят при помощи ледяной уксусной кислоты/толуола (1:1) до рН 6, реакционный раствор сгущают, остаток распределяют между ЕЕ и насыщенным раствором NаНСО3, органическую фазу промывают при помощи NaCl, сушат и сгущают. Остаток хроматографируют на силикагеле (ЕЕ:МеОН:ТЕА 85:15:1,5). Выход 70 мг.
MS (ES+): m/e=606,4 (60%; (М+Н)+); 416,3 (40); 275,7 (100).
19с) 2S-Бензилоксикарбониламино-3-(6-(4-(1,4,5,6-тетрагидропиримидин-2-илкарбамоил)-пиперидин-1-ил)пурин-9-ил)пропионовая кислота.
80 мг трет-бутилового эфира 2S-бензилоксикарбониламино-3-(6-(4-(1,4,5,6-тетрагидропиримидин-2-илкарбамоил)пиперидин-1-ил)пурин-9-ил)пропионовой кислоты (пример 19b) растворяют в 16 мл предварительно охлажденной 95%-ной трифторуксусной кислоты и перемешивают сначала 30 минут при 0 et al., Proceedings of the 21st European Peptide Symposium 1990, E.Giralt, D.Andreu, Eds., ESCOM, Leiden, s. 143) и 124 мг DIPEA добавляют по очереди к 3 мл абсолютного DMF. Перемешивают 3 часа при RT, после этого добавляют остальные 28 мг DIPEA и перемешивают 12 часов при RT. Реакционную смесь доводят при помощи ледяной уксусной кислоты/толуола (1:1) до рН 6, реакционный раствор сгущают, остаток распределяют между ЕЕ и насыщенным раствором NаНСО3, органическую фазу промывают при помощи NaCl, сушат и сгущают. Остаток хроматографируют на силикагеле (ЕЕ:МеОН:ТЕА 85:15:1,5). Выход 70 мг.
MS (ES+): m/e=606,4 (60%; (М+Н)+); 416,3 (40); 275,7 (100).
19с) 2S-Бензилоксикарбониламино-3-(6-(4-(1,4,5,6-тетрагидропиримидин-2-илкарбамоил)-пиперидин-1-ил)пурин-9-ил)пропионовая кислота.
80 мг трет-бутилового эфира 2S-бензилоксикарбониламино-3-(6-(4-(1,4,5,6-тетрагидропиримидин-2-илкарбамоил)пиперидин-1-ил)пурин-9-ил)пропионовой кислоты (пример 19b) растворяют в 16 мл предварительно охлажденной 95%-ной трифторуксусной кислоты и перемешивают сначала 30 минут при 0 С, затем 30 минут при RT. Трифторуксусную кислоту центрифугируют, остаток трижды выпаривают с толуолом, размешивают в этаноле/эфире (1:2), промывают эфиром и сушат в вакууме. Выход 59 мг.
MS (ES+): m/e=550,3 (60%; (M+H)+); 416,3 (100).
Пример 20. 2S-Бензилоксикарбониламино-3-(1-(9-(2-гуанидиноэтил)-9Н-пурин-6-ил)-1Н-имидазол-4-ил)пропионовая кислота.
20а) N9-(1-(2-(трет-Бутилоксикарбониламино)этил))-6-хлорпурин.
Синтез проводят аналогично примеру 12а из 6-хлорпурина и трет-бутилового эфира N-(2-тозилоксиэтил)карбамидной кислоты. Выход 36%.
1Н-NMR (200 МГц, DMSO): С, затем 30 минут при RT. Трифторуксусную кислоту центрифугируют, остаток трижды выпаривают с толуолом, размешивают в этаноле/эфире (1:2), промывают эфиром и сушат в вакууме. Выход 59 мг.
MS (ES+): m/e=550,3 (60%; (M+H)+); 416,3 (100).
Пример 20. 2S-Бензилоксикарбониламино-3-(1-(9-(2-гуанидиноэтил)-9Н-пурин-6-ил)-1Н-имидазол-4-ил)пропионовая кислота.
20а) N9-(1-(2-(трет-Бутилоксикарбониламино)этил))-6-хлорпурин.
Синтез проводят аналогично примеру 12а из 6-хлорпурина и трет-бутилового эфира N-(2-тозилоксиэтил)карбамидной кислоты. Выход 36%.
1Н-NMR (200 МГц, DMSO):  =1,24 (s, 9H, tBu); 3,40 (dt, 2H, CH2-NHBoc); 4,35 (t, 2H, N9-CH2); 6,91 (t, широкий, 1H, NH); 8,60+8,78 (2s, 2H, C6-H+C8-H).
MS (FAB): m/e=298,2 (100%; (M+H)+).
20b) 2S-Бензилоксикарбониламино-3-(1-(9-(2-(трет-бутилоксикарбониламино)этил)-9Н-пурин-6-ил)-1Н-имидазол-4-ил)пропионовая кислота.
Синтез проводят аналогично примеру 12b из N9-(1-(2-трет-бутилоксикарбониламино)этил))-6-хлорпурина (пример 21а) и N =1,24 (s, 9H, tBu); 3,40 (dt, 2H, CH2-NHBoc); 4,35 (t, 2H, N9-CH2); 6,91 (t, широкий, 1H, NH); 8,60+8,78 (2s, 2H, C6-H+C8-H).
MS (FAB): m/e=298,2 (100%; (M+H)+).
20b) 2S-Бензилоксикарбониламино-3-(1-(9-(2-(трет-бутилоксикарбониламино)этил)-9Н-пурин-6-ил)-1Н-имидазол-4-ил)пропионовая кислота.
Синтез проводят аналогично примеру 12b из N9-(1-(2-трет-бутилоксикарбониламино)этил))-6-хлорпурина (пример 21а) и N -Z-L-гистидина. Выход 33%.
MS (ES+): m/e=551,3 (100%; (M+N)+).
20с) 3-(1-(9-(2-Аминоэтил)-9Н-пурин-6-ил)-1Н-имидазол-4-ил)-2S-бензилоксикарбониламинопропионовая кислота.
Синтез проводят аналогично примеру 12с из 2S-бензилоксикарбониламино-3-(1-(9-(2-(трет-бутилоксикарбониламино)этил)-9Н-пурин-6-ил)-1Н-имидазол-4-ил)пропионовой кислоты (пример 20b). Выход 100%.
MS (ES+): m/e=451,3 (70%; (М+Н)+).
1H-NMR (200 МГц, DMSO): -Z-L-гистидина. Выход 33%.
MS (ES+): m/e=551,3 (100%; (M+N)+).
20с) 3-(1-(9-(2-Аминоэтил)-9Н-пурин-6-ил)-1Н-имидазол-4-ил)-2S-бензилоксикарбониламинопропионовая кислота.
Синтез проводят аналогично примеру 12с из 2S-бензилоксикарбониламино-3-(1-(9-(2-(трет-бутилоксикарбониламино)этил)-9Н-пурин-6-ил)-1Н-имидазол-4-ил)пропионовой кислоты (пример 20b). Выход 100%.
MS (ES+): m/e=451,3 (70%; (М+Н)+).
1H-NMR (200 МГц, DMSO):  =2,87-3,15 (m, 2H, Im-CH2); 3,38-3,51 (m, 2H, CH2-NH2); 4,36 (m, 1H, CH-NHZ); 4,60 (t, 2H, N9-CH2); 5,00 (s, 2H, CH2-Ph); 7,28 (s, 5H, арил-Н); 7,62 (d, 1H, NH-Z); 8,23+9,05 (2S, 2H, Im-H); 8,71+8,88 (2s, 2H, C6-H+C8-H).
20d) 2S-Бензилоксикарбониламино-3-(1-(9-(2-гуанидиноэтил)-9Н-пурин-6-ил)-1Н-имидазол-4-ил)пропионовая кислота.
Синтез проводят аналогично примеру 1d из 3-(1-(9-(2-аминоэтил)-9Н-пурин-6-ил)-1Н-имидазол-4-ил)-2S-бензилоксикарбониламинопропионовой кислоты (пример 20с). Выход 38%.
MS (ES+): m/e=493,3 ((М+Н)+).
Пример 21. 2Н-Бензилоксикарбониламино-3-(6-(N-(4-гуанидиноциклогексил)амино)пурин-9-ил)пропионовая кислота.
21а) N9-(3-(2R-(Бензилоксикарбониламино)-трет-бутилпропионат))-6-хлорпурин.
Синтез проводят аналогично примеру 1а из 6-хлорпурина и N-бензилоксикарбонил-D-серин-трет-бутилового эфира.
MS (FAB): m/e=432,2 (100%; (М+Н)+); 376,1 (30).
21b) трет-Бутиловый эфир 2R-бензилоксикарбониламино-3-(6-(N-(4-(трет-бутилоксикарбониламино)циклогексил)амино)пурин-9-ил)пропионовой кислоты.
Синтез проводят аналогично примеру 1b из 4-амино-1-(трет-бутилоксикарбониламино)циклогексана и N9-(3-(2R-бензилоксикарбониламино)-трет-бутилпропионат))-6-хлорпурина (пример 21а). Выход 55%.
MS (FAB): m/e=610,3 (100%; (М+Н)+).
21с) 3-(6-(N-(4-Аминоциклогексил)амино)пурин-9-ил)-2R-бензилоксикарбониламинопропионовая кислота.
Синтез проводят аналогично примеру 1с из трет-бутилового эфира 2R-бензилоксикарбониламино-3-(6-(N-(4-(трет-бутилоксикарбониламино)циклогексил)аминопурин-9-ил)пропионовой кислоты (пример 21b). Выход 200%.
MS (ES+): m/e=454,2 (50%, (М+Н)+).
21d) 2R-Бензилоксикарбониламино-3-(6-(N-(4-гуанидиноциклогексил)амино)пурин-9-ил)пропионовая кислота.
Синтез проводили аналогично примеру 1d из 3-(6-(N-(4-аминоциклогексил)амино)пурин-9-ил)-2R-бензилоксикарбониламинопропионовой кислоты (пример 21с). Выход 80%.
MS (ES+): m/e=496,3 (50%, (М+Н)+).
Пример 22. 2R-Бензилоксикарбониламино-3-(6-(N-(3-гуанидинометилбензил)амино)пурин-9-ил)пропионовая кислота.
22а) трет-Бутиловый эфир 2R-бензилоксикарбониламино-3-(6-N-(3-трет-бутилоксикарбониламинометилбензил)амино)пурин-9-ил)пропионовой кислоты.
Синтез проводят аналогично примеру 1b из 3-аминометил-1-(трет-бутилоксикарбониламинометил)бензола и 9-(3-(2R-(бензилоксикарбониламино)-трет-бутил-пропионат)-6-хлорпурина (пример 21а). Выход 51%.
MS (ES+): m/e=632,3 (100%; (М+Н)+).
22b) 3-(6-(N-(3-Аминометилбензил)амино)пурин-9-ил)-2R-бензилоксикарбониламинопропионовая кислота.
Синтез проводят аналогично примеру 1с из трет-бутилового эфира 2R-бензилоксикарбониламино-3-(6-(N-(3-трет-бутилоксикарбониламинометилбензил)амино)пурин-9-ил)пропионовой кислоты (пример 22а). Выход 100%.
MS (ES+): m/e=476,2 ((M+H)+, 50%); 342,2 (70).
22с) 2R-Бензилоксикарбониламино-3-(6-(N-(3-гуанидинометилбензил)амино)пурин-9-ил)пропионовая кислота.
Синтез проводят аналогично примеру 1d из 3-(6-(N-(3-аминометилбензил)амино)пурин-9-ил)-2R-бензилоксикарбониламинопропионовой кислоты (пример 22b). Выход 30%.
MS (ES+): m/e=518,3 (М+Н)+, 20%.
Пример 23. 3-(6-((4-(Бензимидазол-2-иламино)бутил)амино)пурин-9-ил)-2S-бензилоксикарбониламинопронионовая кислота.
23а) 1-(4-трет-Бутилоксикарбониламинобутил)-3-(2-нитрофенил)тиомочевина.
В 0,97 г (5,15 ммоль) 4-(трет-бутилоксикарбониламинобутил)-1-амина в 25 мл абсолютного DMF прикалывают при 0 =2,87-3,15 (m, 2H, Im-CH2); 3,38-3,51 (m, 2H, CH2-NH2); 4,36 (m, 1H, CH-NHZ); 4,60 (t, 2H, N9-CH2); 5,00 (s, 2H, CH2-Ph); 7,28 (s, 5H, арил-Н); 7,62 (d, 1H, NH-Z); 8,23+9,05 (2S, 2H, Im-H); 8,71+8,88 (2s, 2H, C6-H+C8-H).
20d) 2S-Бензилоксикарбониламино-3-(1-(9-(2-гуанидиноэтил)-9Н-пурин-6-ил)-1Н-имидазол-4-ил)пропионовая кислота.
Синтез проводят аналогично примеру 1d из 3-(1-(9-(2-аминоэтил)-9Н-пурин-6-ил)-1Н-имидазол-4-ил)-2S-бензилоксикарбониламинопропионовой кислоты (пример 20с). Выход 38%.
MS (ES+): m/e=493,3 ((М+Н)+).
Пример 21. 2Н-Бензилоксикарбониламино-3-(6-(N-(4-гуанидиноциклогексил)амино)пурин-9-ил)пропионовая кислота.
21а) N9-(3-(2R-(Бензилоксикарбониламино)-трет-бутилпропионат))-6-хлорпурин.
Синтез проводят аналогично примеру 1а из 6-хлорпурина и N-бензилоксикарбонил-D-серин-трет-бутилового эфира.
MS (FAB): m/e=432,2 (100%; (М+Н)+); 376,1 (30).
21b) трет-Бутиловый эфир 2R-бензилоксикарбониламино-3-(6-(N-(4-(трет-бутилоксикарбониламино)циклогексил)амино)пурин-9-ил)пропионовой кислоты.
Синтез проводят аналогично примеру 1b из 4-амино-1-(трет-бутилоксикарбониламино)циклогексана и N9-(3-(2R-бензилоксикарбониламино)-трет-бутилпропионат))-6-хлорпурина (пример 21а). Выход 55%.
MS (FAB): m/e=610,3 (100%; (М+Н)+).
21с) 3-(6-(N-(4-Аминоциклогексил)амино)пурин-9-ил)-2R-бензилоксикарбониламинопропионовая кислота.
Синтез проводят аналогично примеру 1с из трет-бутилового эфира 2R-бензилоксикарбониламино-3-(6-(N-(4-(трет-бутилоксикарбониламино)циклогексил)аминопурин-9-ил)пропионовой кислоты (пример 21b). Выход 200%.
MS (ES+): m/e=454,2 (50%, (М+Н)+).
21d) 2R-Бензилоксикарбониламино-3-(6-(N-(4-гуанидиноциклогексил)амино)пурин-9-ил)пропионовая кислота.
Синтез проводили аналогично примеру 1d из 3-(6-(N-(4-аминоциклогексил)амино)пурин-9-ил)-2R-бензилоксикарбониламинопропионовой кислоты (пример 21с). Выход 80%.
MS (ES+): m/e=496,3 (50%, (М+Н)+).
Пример 22. 2R-Бензилоксикарбониламино-3-(6-(N-(3-гуанидинометилбензил)амино)пурин-9-ил)пропионовая кислота.
22а) трет-Бутиловый эфир 2R-бензилоксикарбониламино-3-(6-N-(3-трет-бутилоксикарбониламинометилбензил)амино)пурин-9-ил)пропионовой кислоты.
Синтез проводят аналогично примеру 1b из 3-аминометил-1-(трет-бутилоксикарбониламинометил)бензола и 9-(3-(2R-(бензилоксикарбониламино)-трет-бутил-пропионат)-6-хлорпурина (пример 21а). Выход 51%.
MS (ES+): m/e=632,3 (100%; (М+Н)+).
22b) 3-(6-(N-(3-Аминометилбензил)амино)пурин-9-ил)-2R-бензилоксикарбониламинопропионовая кислота.
Синтез проводят аналогично примеру 1с из трет-бутилового эфира 2R-бензилоксикарбониламино-3-(6-(N-(3-трет-бутилоксикарбониламинометилбензил)амино)пурин-9-ил)пропионовой кислоты (пример 22а). Выход 100%.
MS (ES+): m/e=476,2 ((M+H)+, 50%); 342,2 (70).
22с) 2R-Бензилоксикарбониламино-3-(6-(N-(3-гуанидинометилбензил)амино)пурин-9-ил)пропионовая кислота.
Синтез проводят аналогично примеру 1d из 3-(6-(N-(3-аминометилбензил)амино)пурин-9-ил)-2R-бензилоксикарбониламинопропионовой кислоты (пример 22b). Выход 30%.
MS (ES+): m/e=518,3 (М+Н)+, 20%.
Пример 23. 3-(6-((4-(Бензимидазол-2-иламино)бутил)амино)пурин-9-ил)-2S-бензилоксикарбониламинопронионовая кислота.
23а) 1-(4-трет-Бутилоксикарбониламинобутил)-3-(2-нитрофенил)тиомочевина.
В 0,97 г (5,15 ммоль) 4-(трет-бутилоксикарбониламинобутил)-1-амина в 25 мл абсолютного DMF прикалывают при 0 С 0,928 г (5,15 ммоль) 2-нитрофенилизотиоцианата в 5 мл абсолютного DMF. После этого перемешивают 1 час при 0 С 0,928 г (5,15 ммоль) 2-нитрофенилизотиоцианата в 5 мл абсолютного DMF. После этого перемешивают 1 час при 0 С. Растворитель отгоняют и остаток хроматографируют на силикагеле (ЕЕ:н-гептан от 1:2 до 1:1). Выход 1,8 г (95%).
MS (ES+): m/e=369,2 (М+Н)+, 100%.
23b) 3-(2-Аминофенил)-1-(4-трет-бутилоксикарбониламинобутил)тиомочевина.
1,78 г (4,8 ммоль) 1-(4-трет-бутилоксикарбониламинобутил)-3-(2-нитрофенил)тиомочевины (пример 23а) растворяют в 120 мл метанола и гидрируют при RT 3 часа посредством 1 г Pd/C (1 бар). Катализатор отфильтровывают, фильтрат сгущают и хроматографируют на силикагеле (ЕЕ:н-гептан 1:1). Выход 1,4 г.
23с) 4-(Бензимидазол-2-иламино)-1-(трет-бутилоксикарбониламино)бутан.
К 1,4 г (4,14 ммоль) 3-(2-аминофенил)-1-(4-трет-бутилоксикарбониламинобутил)тиомочевины (пример 23b) в 30 мл этанола добавляют 1,79 г (8,28 ммоль) желтой окиси ртути и 27 мг серного цвета и нагревают реакционную смесь 3 часа до 50-55 С. Растворитель отгоняют и остаток хроматографируют на силикагеле (ЕЕ:н-гептан от 1:2 до 1:1). Выход 1,8 г (95%).
MS (ES+): m/e=369,2 (М+Н)+, 100%.
23b) 3-(2-Аминофенил)-1-(4-трет-бутилоксикарбониламинобутил)тиомочевина.
1,78 г (4,8 ммоль) 1-(4-трет-бутилоксикарбониламинобутил)-3-(2-нитрофенил)тиомочевины (пример 23а) растворяют в 120 мл метанола и гидрируют при RT 3 часа посредством 1 г Pd/C (1 бар). Катализатор отфильтровывают, фильтрат сгущают и хроматографируют на силикагеле (ЕЕ:н-гептан 1:1). Выход 1,4 г.
23с) 4-(Бензимидазол-2-иламино)-1-(трет-бутилоксикарбониламино)бутан.
К 1,4 г (4,14 ммоль) 3-(2-аминофенил)-1-(4-трет-бутилоксикарбониламинобутил)тиомочевины (пример 23b) в 30 мл этанола добавляют 1,79 г (8,28 ммоль) желтой окиси ртути и 27 мг серного цвета и нагревают реакционную смесь 3 часа до 50-55 С. Отсасывают и промывают этанолом. Сгущают фильтрат и хроматографируют продукт на силикагеле (DCM:метанол 9:5, затем 9:1). Выход 43%.
MS (ES+): m/e=305,2 ((М+Н)+, 100%).
23d) 4-(Бензимидазол-2-иламино)-1-аминобутан.
198 мг (0,65 ммоль) 4-(бензимидазол-2-иламино)-1-(трет-бутилоксикарбониламино)бутана (пример 23с) растворяют при 0 С. Отсасывают и промывают этанолом. Сгущают фильтрат и хроматографируют продукт на силикагеле (DCM:метанол 9:5, затем 9:1). Выход 43%.
MS (ES+): m/e=305,2 ((М+Н)+, 100%).
23d) 4-(Бензимидазол-2-иламино)-1-аминобутан.
198 мг (0,65 ммоль) 4-(бензимидазол-2-иламино)-1-(трет-бутилоксикарбониламино)бутана (пример 23с) растворяют при 0 С в 20 мл 95%-ной трифторуксусной кислоты и перемешивают 2 часа при 0 С в 20 мл 95%-ной трифторуксусной кислоты и перемешивают 2 часа при 0 С, после этого сгущают при RT в течение 30 минут. Остаток трижды выпаривают с толуолом, после этого размешивают эфиром, промывают пентаном и сушат в вакууме. Выход 100%.
MS (ES+): m/e=205,2 ((М+Н)+, 100%).
23е) трет-Бутиловый эфир 3-(6-((4-(бензимидазол-2-иламино)бутил)амино)пурин-9-ил)-2S-бензилоксикарбониламинопропионовой кислоты.
Синтез проводят аналогично примеру 1b из 4-(бензимидазол-2-иламино)-1-аминобутана (пример 23d) и N9-(3-(2S-(бензилоксикарбониламино)-трет-бутилпропионат))-6-хлорпурина (пример 1a). Выход 32%.
MS (ES+): m/e=600,3 (100%; (М+Н)+).
23f) 3-(6-((4-Бензимидазол-2-иламино)бутил)амино)пурин-9-ил)-2S-бензилоксикарбониламинопропионовая кислота.
Синтез проводят аналогично примеру 1с из трет-бутилового эфира 3-(6-((4-(бензимидазол-2-иламино)бутил)амино)пурин-9-ил)-2S-бензилоксикарбониламинопропионовой кислоты (пример 23е). Выход 100%.
MS (ES+): m/e=544,2 ((М+Н)+, 70%).
Пример 24. 2S-Бензилоксикарбониламино-3-(6-(4-((4,5-дигидро-1Н-имидазол-2-иламино)метил)пиперидин-1-ил)пурин-9-ил)пропионовая кислота.
24а) трет-Бутиловый эфир 3-(6-(4-(аминометил)пиперидин-1-ил)пурин-9-ил)-2S-бензилоксикарбониламинопропионовой кислоты.
Синтез проводят аналогично примеру 1b из 4-(аминометил)пиперидина и N9-(3-(2S-(бензилоксикарбониламино)-трет-бутилпропионат))-6-хлорпурина (пример 1a). Выход 96,4%.
MS (ES+): m/e=510,3 (100%; (М+Н)+).
24b) 3-(6-(4-(Аминометил)пиперидин-1-ил)пурин-9-ил)-2S-бензилоксикарбониламинопропионовая кислота.
Синтез проводят аналогично примеру 1с из трет-бутилового эфира 3-(6-(4-(аминометил)пиперидин-1-ил)пурин-9-ил)-2S-бензилоксикарбонилпропионовой кислоты (пример 24 а). Выход 100%.
MS (ES+): m/e=454,3 ((М+Н)+, 30%).
24с) 2S-Бензилоксикарбониламино-3-(6-(4-((4,5-дигидро-1Н-имидазол-2-иламино)метил)пиперидин-1-ил)пурин-9-ил)пропионовая кислота.
Синтез проводят аналогично примеру 4 из 3-(6-(4-аминометил)пиперидин-1-ил)пурин-9-ил)-2S-бензилоксикарбониламинопропионовой кислоты (пример 24b). Выход 95%.
MS (ES+): m/e=522,3 ((М+Н)+, 40%).
Пример 25. 2R-Бензилоксикарбониламино-3-(6-(4-((4,5-дигидро-1Н-имидазол-2-иламино)метил)пиперидин-1-ил)пурин-9-ил)пропионовая кислота.
Синтез проводят аналогично примеру 24 на основе N9-(3-(2R-(бензилоксикарбониламино)-трет-бутилпропионат))-6-хлорпурина (пример 21а).
MS (ES+): m/e=522,3 ((М+Н)+, 20%).
Пример 26. 2S-Бензилоксикарбониламино-3-(6-(4-гуанидинометил)пиперидин-1-ил)пурин-9-ил)пропионовая кислота.
Синтез проводят аналогично примеру 1d из 3-(6-(4-(аминометил)пиперидин-1-ил)пурин-9-ил)-2S-бензилоксикарбониламинопропионовой кислоты (пример 24b). Выход 74%.
MS (ES+): m/e=496,3 ((М+Н)+, 40%).
Пример 27. 2S-Бензилоксикарбониламино-3-(6-(3-(3-бензилуреидо)-фенилсульфанил)пурин-9-ил)пропионовая кислота.
27а) трет-Бутиловый эфир 3-(6-(3-аминофенилсульфанил)пурин-9-ил)-2S-бeнзилoкcикapбoнилaминoпpoпиoнoвoй кислоты.
0,602 ммоль 3-меркаптоанилина перемешивают в течение 12 часов вместе с 0,602 ммоль N9-(3-(2S-(бензилоксикарбониламино)-трет-бутилпропионат))-6-хлорпурина (пример 1а) в DMF и DIPEA. Реакционный раствор сгущают, остаток распределяют между ЕЕ и насыщенным раствором NаНСО3, фазы разделяют, органическую фазу промывают полунасыщенным раствором NаНСО3 и раствором NaCl, сушат, сгущают и хроматографируют продукт на силикагеле (ЕЕ:гептан 1:1). Выход 190 мг.
MS (ES+): m/e=521,3 ((М+Н)+, 100%).
27b) трет-Бутиловый эфир 2S-бензилоксикарбониламино-3-(6-(3-(3-бензилуреидо)фенилсульфанил)пурин-9-ил)пропионовой кислоты.
К 180 мг трет-бутилового эфира 3-(6-(3-аминофенилсульфанил)пурин-9-ил)-2S-бензилоксикарбониламинопропионовой кислоты (пример 27а) в 3 мл абсолютного ацетонитрила добавляют при помощи шприца 46,1 мг бензилизоцианата в 1 мл ацетонитрила. Смесь перемешивают 48 часов при RT, сгущают и остаток хроматографируют на силикагеле (DCM:EE от 7:3 до 1:1). Выход 205 мг.
MS (ES+): m/e=654,4 ((М+Н)+, 100%).
27c) 2S-Бензилоксикарбониламино-3-(6-(3-(3-бензилуреидо)фенилсульфанил)пурин-9-ил)пропионовая кислота.
Синтез проводят аналогично примеру 1с из трет-бутилового эфира 2S-бензилоксикарбониламино-3-(6-(3-(3-бензилуреидо)фенилсульфанил)пурин-9-ил)пропионовой кислоты (пример 27b). Выход 100%.
MS (ES+): m/e=598,4 ((М+Н)+, 100%).
Пример 28. 2S-Неопентилоксикарбониламино-3-(6-(4-(1,4,5,6-тетрагидропиримидин-2-илкарбамоил)пиперидин-1-ил)пурин-9-ил)пропионовая кислота.
28а) трет-Бутиловый эфир 2S-амино-3-(6-(4-карбоксипиперидин-1-ил)пурин-9-ил)пропионовой кислоты.
1,7 г трет-Бутилового эфира 2S-бензилоксикарбониламино-3-(6-(4-карбоксипиперидин-1-ил)пурин-9-ил)пропионовой кислоты (пример 19а) растворяют в 200 мл АсОН и гидрируют на Pd/C при давлении H2 1 атм. Катализатор отфильтровывают, растворитель отгоняют и остаток подвергают лиофилизации. Выход 100%.
MS (ES+): m/e=391,3 ((М+Н)+, 100%).
28b) трет-Бутиловый эфир 2S-неопентилоксикарбониламино-3-6-(4-карбокси-пиперидин-1-ил)пурин-9-ил)пропионовой кислоты.
390 мг (1 ммоль) трет-бутилового эфира 2S-амино-3-(6-(4-карбоксипиперидин-1-ил)пурин-9-)пропионовой кислоты (пример 20а) в 4 мл DMF смешивают при 0 С, после этого сгущают при RT в течение 30 минут. Остаток трижды выпаривают с толуолом, после этого размешивают эфиром, промывают пентаном и сушат в вакууме. Выход 100%.
MS (ES+): m/e=205,2 ((М+Н)+, 100%).
23е) трет-Бутиловый эфир 3-(6-((4-(бензимидазол-2-иламино)бутил)амино)пурин-9-ил)-2S-бензилоксикарбониламинопропионовой кислоты.
Синтез проводят аналогично примеру 1b из 4-(бензимидазол-2-иламино)-1-аминобутана (пример 23d) и N9-(3-(2S-(бензилоксикарбониламино)-трет-бутилпропионат))-6-хлорпурина (пример 1a). Выход 32%.
MS (ES+): m/e=600,3 (100%; (М+Н)+).
23f) 3-(6-((4-Бензимидазол-2-иламино)бутил)амино)пурин-9-ил)-2S-бензилоксикарбониламинопропионовая кислота.
Синтез проводят аналогично примеру 1с из трет-бутилового эфира 3-(6-((4-(бензимидазол-2-иламино)бутил)амино)пурин-9-ил)-2S-бензилоксикарбониламинопропионовой кислоты (пример 23е). Выход 100%.
MS (ES+): m/e=544,2 ((М+Н)+, 70%).
Пример 24. 2S-Бензилоксикарбониламино-3-(6-(4-((4,5-дигидро-1Н-имидазол-2-иламино)метил)пиперидин-1-ил)пурин-9-ил)пропионовая кислота.
24а) трет-Бутиловый эфир 3-(6-(4-(аминометил)пиперидин-1-ил)пурин-9-ил)-2S-бензилоксикарбониламинопропионовой кислоты.
Синтез проводят аналогично примеру 1b из 4-(аминометил)пиперидина и N9-(3-(2S-(бензилоксикарбониламино)-трет-бутилпропионат))-6-хлорпурина (пример 1a). Выход 96,4%.
MS (ES+): m/e=510,3 (100%; (М+Н)+).
24b) 3-(6-(4-(Аминометил)пиперидин-1-ил)пурин-9-ил)-2S-бензилоксикарбониламинопропионовая кислота.
Синтез проводят аналогично примеру 1с из трет-бутилового эфира 3-(6-(4-(аминометил)пиперидин-1-ил)пурин-9-ил)-2S-бензилоксикарбонилпропионовой кислоты (пример 24 а). Выход 100%.
MS (ES+): m/e=454,3 ((М+Н)+, 30%).
24с) 2S-Бензилоксикарбониламино-3-(6-(4-((4,5-дигидро-1Н-имидазол-2-иламино)метил)пиперидин-1-ил)пурин-9-ил)пропионовая кислота.
Синтез проводят аналогично примеру 4 из 3-(6-(4-аминометил)пиперидин-1-ил)пурин-9-ил)-2S-бензилоксикарбониламинопропионовой кислоты (пример 24b). Выход 95%.
MS (ES+): m/e=522,3 ((М+Н)+, 40%).
Пример 25. 2R-Бензилоксикарбониламино-3-(6-(4-((4,5-дигидро-1Н-имидазол-2-иламино)метил)пиперидин-1-ил)пурин-9-ил)пропионовая кислота.
Синтез проводят аналогично примеру 24 на основе N9-(3-(2R-(бензилоксикарбониламино)-трет-бутилпропионат))-6-хлорпурина (пример 21а).
MS (ES+): m/e=522,3 ((М+Н)+, 20%).
Пример 26. 2S-Бензилоксикарбониламино-3-(6-(4-гуанидинометил)пиперидин-1-ил)пурин-9-ил)пропионовая кислота.
Синтез проводят аналогично примеру 1d из 3-(6-(4-(аминометил)пиперидин-1-ил)пурин-9-ил)-2S-бензилоксикарбониламинопропионовой кислоты (пример 24b). Выход 74%.
MS (ES+): m/e=496,3 ((М+Н)+, 40%).
Пример 27. 2S-Бензилоксикарбониламино-3-(6-(3-(3-бензилуреидо)-фенилсульфанил)пурин-9-ил)пропионовая кислота.
27а) трет-Бутиловый эфир 3-(6-(3-аминофенилсульфанил)пурин-9-ил)-2S-бeнзилoкcикapбoнилaминoпpoпиoнoвoй кислоты.
0,602 ммоль 3-меркаптоанилина перемешивают в течение 12 часов вместе с 0,602 ммоль N9-(3-(2S-(бензилоксикарбониламино)-трет-бутилпропионат))-6-хлорпурина (пример 1а) в DMF и DIPEA. Реакционный раствор сгущают, остаток распределяют между ЕЕ и насыщенным раствором NаНСО3, фазы разделяют, органическую фазу промывают полунасыщенным раствором NаНСО3 и раствором NaCl, сушат, сгущают и хроматографируют продукт на силикагеле (ЕЕ:гептан 1:1). Выход 190 мг.
MS (ES+): m/e=521,3 ((М+Н)+, 100%).
27b) трет-Бутиловый эфир 2S-бензилоксикарбониламино-3-(6-(3-(3-бензилуреидо)фенилсульфанил)пурин-9-ил)пропионовой кислоты.
К 180 мг трет-бутилового эфира 3-(6-(3-аминофенилсульфанил)пурин-9-ил)-2S-бензилоксикарбониламинопропионовой кислоты (пример 27а) в 3 мл абсолютного ацетонитрила добавляют при помощи шприца 46,1 мг бензилизоцианата в 1 мл ацетонитрила. Смесь перемешивают 48 часов при RT, сгущают и остаток хроматографируют на силикагеле (DCM:EE от 7:3 до 1:1). Выход 205 мг.
MS (ES+): m/e=654,4 ((М+Н)+, 100%).
27c) 2S-Бензилоксикарбониламино-3-(6-(3-(3-бензилуреидо)фенилсульфанил)пурин-9-ил)пропионовая кислота.
Синтез проводят аналогично примеру 1с из трет-бутилового эфира 2S-бензилоксикарбониламино-3-(6-(3-(3-бензилуреидо)фенилсульфанил)пурин-9-ил)пропионовой кислоты (пример 27b). Выход 100%.
MS (ES+): m/e=598,4 ((М+Н)+, 100%).
Пример 28. 2S-Неопентилоксикарбониламино-3-(6-(4-(1,4,5,6-тетрагидропиримидин-2-илкарбамоил)пиперидин-1-ил)пурин-9-ил)пропионовая кислота.
28а) трет-Бутиловый эфир 2S-амино-3-(6-(4-карбоксипиперидин-1-ил)пурин-9-ил)пропионовой кислоты.
1,7 г трет-Бутилового эфира 2S-бензилоксикарбониламино-3-(6-(4-карбоксипиперидин-1-ил)пурин-9-ил)пропионовой кислоты (пример 19а) растворяют в 200 мл АсОН и гидрируют на Pd/C при давлении H2 1 атм. Катализатор отфильтровывают, растворитель отгоняют и остаток подвергают лиофилизации. Выход 100%.
MS (ES+): m/e=391,3 ((М+Н)+, 100%).
28b) трет-Бутиловый эфир 2S-неопентилоксикарбониламино-3-6-(4-карбокси-пиперидин-1-ил)пурин-9-ил)пропионовой кислоты.
390 мг (1 ммоль) трет-бутилового эфира 2S-амино-3-(6-(4-карбоксипиперидин-1-ил)пурин-9-)пропионовой кислоты (пример 20а) в 4 мл DMF смешивают при 0 С с 230 мг (1 ммоль) N-(неопентилоксикарбонилокси)сукцинимида и 0,17 мл DIPEA и после медленного нагревания перемешивают 12 часов при RT. Реакционную смесь сгущают и остаток хроматографируют (Lobar-С, DСМ:МеОН:АсОН:Н2О 90:10:1:1). Выход 540 мг.
MS (ES+): m/e=505,4 ((М+Н)+, 100%).
28с) трет-Бутиловый эфир 2S-неопентилоксикарбониламино-3-(6- (4-(1,4,5,6-тетрагидропиримидин-2-илкарбамоил)пиперидин-1-ил)пурин-9-ил)пропионовой кислоты.
505 мг (1 ммоль) трет-бутилового эфира 2S-неопентилоксикарбониламино-3-(6-(4-карбоксипиперидин-1-ил)пурин-9-ил)пропионовой кислоты (пример 20b) растворяют в 10 мл ацетонитрила, смешивают с 250 мг DCCl и 184 мг пентафторфенола и после этого перемешивают 30 минут при RT. Фильтруют, сгущают маточный раствор, поглощают в 5 мл DMF, смешивают с 200 мг 2-амино-1,4,5,6-тетрагидропиримидина и перемешивают 12 часов при RT. Растворитель отгоняют в вакууме и остаток хроматографируют (Lobar-C, DCM:MeOH:AcOH:H2O 98:8:0,8:0,8). Выход 270 мг.
MS (ES+): m/e=586,5 ((М+Н)+, 100%).
28d) 2S-Неопентилоксикарбониламино-3-(6-(4-(1,4,5,6-тетрагидропиримидин-2-илкарбамоил)пиперидин-1-ил)пурин-9-ил)пропионовая кислота.
Синтез проводят аналогично примеру 19с из трет-бутилового эфира 2S-неопентилоксикарбониламино-3-(6-(4-(1,4,5,6-тетрагидропиримидин-2-илкарбамоил)пиперидин-1-ил)пурин-9-ил)пропионовой кислоты (пример 28с). Выход 94%.
MS (ES+): m/e=530,4 ((М+Н)+, 20%).
Пример 29. 2S-(1-Адамантилметилоксикарбониламино)-3-(6-(4-(1,4,5,6-тетрагидропиримидин-2-илкарбамоил)пиперидин-1-ил)пурин-9-ил)пропионовая кислота.
29а) трет-Бутиловый эфир 2S-(1-адамантилметилоксикарбониламино)-3-(6-(4-карбоксипиперидин-1-ил)пурин-9-ил)пропионовой кислоты.
Синтез проводят аналогично примеру 28b из N-(1-адамантилметилоксикарбонилокси)сукцинимида и трет-бутилового эфира 2S-амино-3-(6-(4-карбоксипиперидин-1-ил)пурин-9-ил)пропионовой кислоты (пример 28а). Выход 85%.
MS (ES+): m/e=583/4 ((М+Н)+, 100%).
29b) трет-Бутиловый эфир 2S-(1-адамантилметилоксикарбониламино)-3-(6-(4-(1,4,5,6-тетрагидропиримидин-2-илкарбамоил)пиперидин-1-ил)пурин-9-ил)пропионовой кислоты.
Синтез проводили аналогично примеру 28с из трет-бутилового эфира 2S-(1-адамантилметилоксикарбониламино)-3-(6-(4-карбоксипиперидин-1-ил)пурин-9-ил)пропионовой кислоты (пример 29а). Выход 75%.
MS (ES+): m/e=664,5 ((М+Н)+, 30%).
29с) 2S-(1-Адамантилметилоксикарбониламино)-3-(6-(4-(1,4,5,6-тетрагидропиримидин-2-илкарбамоил)пиперидин-1-ил)пурин-9-ил)пропионовая кислота.
Синтез проводят аналогично примеру 19с из трет-бутилового эфира 2S-(1-адамантилметилоксикарбониламино)-3-(6-(4-(1,4,5,6-тетрагидропиримидин-2-илкарбамоил)пиперидин-1-ил)пурин-9-ил)пропионовой кислоты (пример 29b). Выход 100%.
MS (ES+): m/e=608,4 ((М+Н)+, 10%).
Фармакологическое исследование.
В качестве тест-метода, по которому можно определять, например, антагонистическое действие соединений по изобретению на витронектиновый рецептор С с 230 мг (1 ммоль) N-(неопентилоксикарбонилокси)сукцинимида и 0,17 мл DIPEA и после медленного нагревания перемешивают 12 часов при RT. Реакционную смесь сгущают и остаток хроматографируют (Lobar-С, DСМ:МеОН:АсОН:Н2О 90:10:1:1). Выход 540 мг.
MS (ES+): m/e=505,4 ((М+Н)+, 100%).
28с) трет-Бутиловый эфир 2S-неопентилоксикарбониламино-3-(6- (4-(1,4,5,6-тетрагидропиримидин-2-илкарбамоил)пиперидин-1-ил)пурин-9-ил)пропионовой кислоты.
505 мг (1 ммоль) трет-бутилового эфира 2S-неопентилоксикарбониламино-3-(6-(4-карбоксипиперидин-1-ил)пурин-9-ил)пропионовой кислоты (пример 20b) растворяют в 10 мл ацетонитрила, смешивают с 250 мг DCCl и 184 мг пентафторфенола и после этого перемешивают 30 минут при RT. Фильтруют, сгущают маточный раствор, поглощают в 5 мл DMF, смешивают с 200 мг 2-амино-1,4,5,6-тетрагидропиримидина и перемешивают 12 часов при RT. Растворитель отгоняют в вакууме и остаток хроматографируют (Lobar-C, DCM:MeOH:AcOH:H2O 98:8:0,8:0,8). Выход 270 мг.
MS (ES+): m/e=586,5 ((М+Н)+, 100%).
28d) 2S-Неопентилоксикарбониламино-3-(6-(4-(1,4,5,6-тетрагидропиримидин-2-илкарбамоил)пиперидин-1-ил)пурин-9-ил)пропионовая кислота.
Синтез проводят аналогично примеру 19с из трет-бутилового эфира 2S-неопентилоксикарбониламино-3-(6-(4-(1,4,5,6-тетрагидропиримидин-2-илкарбамоил)пиперидин-1-ил)пурин-9-ил)пропионовой кислоты (пример 28с). Выход 94%.
MS (ES+): m/e=530,4 ((М+Н)+, 20%).
Пример 29. 2S-(1-Адамантилметилоксикарбониламино)-3-(6-(4-(1,4,5,6-тетрагидропиримидин-2-илкарбамоил)пиперидин-1-ил)пурин-9-ил)пропионовая кислота.
29а) трет-Бутиловый эфир 2S-(1-адамантилметилоксикарбониламино)-3-(6-(4-карбоксипиперидин-1-ил)пурин-9-ил)пропионовой кислоты.
Синтез проводят аналогично примеру 28b из N-(1-адамантилметилоксикарбонилокси)сукцинимида и трет-бутилового эфира 2S-амино-3-(6-(4-карбоксипиперидин-1-ил)пурин-9-ил)пропионовой кислоты (пример 28а). Выход 85%.
MS (ES+): m/e=583/4 ((М+Н)+, 100%).
29b) трет-Бутиловый эфир 2S-(1-адамантилметилоксикарбониламино)-3-(6-(4-(1,4,5,6-тетрагидропиримидин-2-илкарбамоил)пиперидин-1-ил)пурин-9-ил)пропионовой кислоты.
Синтез проводили аналогично примеру 28с из трет-бутилового эфира 2S-(1-адамантилметилоксикарбониламино)-3-(6-(4-карбоксипиперидин-1-ил)пурин-9-ил)пропионовой кислоты (пример 29а). Выход 75%.
MS (ES+): m/e=664,5 ((М+Н)+, 30%).
29с) 2S-(1-Адамантилметилоксикарбониламино)-3-(6-(4-(1,4,5,6-тетрагидропиримидин-2-илкарбамоил)пиперидин-1-ил)пурин-9-ил)пропионовая кислота.
Синтез проводят аналогично примеру 19с из трет-бутилового эфира 2S-(1-адамантилметилоксикарбониламино)-3-(6-(4-(1,4,5,6-тетрагидропиримидин-2-илкарбамоил)пиперидин-1-ил)пурин-9-ил)пропионовой кислоты (пример 29b). Выход 100%.
MS (ES+): m/e=608,4 ((М+Н)+, 10%).
Фармакологическое исследование.
В качестве тест-метода, по которому можно определять, например, антагонистическое действие соединений по изобретению на витронектиновый рецептор  v v 3, ниже описывается ингибирование связывания кистрина витронектиновым рецептором (VnR) человека ( 3, ниже описывается ингибирование связывания кистрина витронектиновым рецептором (VnR) человека ( v v 3-ELISA-тест; тест-метод при распечатке результатов теста обозначается сокращенно “K/VnR”).
Очистка кистрина.
Кистрин очищают методами Dennis и др., как описано в Proc. Natl. Acad. Sci. USA, 1989, 87, 2471-2475, и PROTEINS: Structure, Function and Genetics, 1993, 15, 312-321.
Очистка витронектинового рецептора человека 3-ELISA-тест; тест-метод при распечатке результатов теста обозначается сокращенно “K/VnR”).
Очистка кистрина.
Кистрин очищают методами Dennis и др., как описано в Proc. Natl. Acad. Sci. USA, 1989, 87, 2471-2475, и PROTEINS: Structure, Function and Genetics, 1993, 15, 312-321.
Очистка витронектинового рецептора человека  v v 3.
Витронектиновый рецептор человека получают из плаценты человека по методу Pytela et al., Methods Enzymol., 1987, 144, 475. Витронектиновый рецептор 3.
Витронектиновый рецептор человека получают из плаценты человека по методу Pytela et al., Methods Enzymol., 1987, 144, 475. Витронектиновый рецептор  v v 3 человека можно получить также из некоторых клеточных линий (например, из 293 клеток эмбриональной почечной клеточной линии человека), которые сопереносятся с ДНК-последовательностями для обоих подразделений 3 человека можно получить также из некоторых клеточных линий (например, из 293 клеток эмбриональной почечной клеточной линии человека), которые сопереносятся с ДНК-последовательностями для обоих подразделений  v и v и  3 витронектинового рецептора. Подразделения экстрагируют октилглюкозидом и затем хроматографируют на Конканавалине А, гепарин-сефарозе и S-300.
Моноклональные антитела.
Мышиные моноклональные антитела, специфичные для подразделения 3 витронектинового рецептора. Подразделения экстрагируют октилглюкозидом и затем хроматографируют на Конканавалине А, гепарин-сефарозе и S-300.
Моноклональные антитела.
Мышиные моноклональные антитела, специфичные для подразделения  3 витронектинового рецептора, получают по методу Newman et al., Blood, 1985, 227-232, или по подобному способу.
Получали кроличий конъюгат Fab 2 антимышиного Fc на пероксидазе хрена (антимышиный Fс HRP) от фирмы Pel Freeze (каталог №715 305-1).
ELISA-тест.
Способность вещества ингибировать связывание кистрина с витронектиновым рецептором может быть установлена при помощи ELISA-теста. Для этой цели 96-луночные микротитрационные планшеты покрывают раствором кистрина (0,002 мг/мл) по методу Dennis et аl., как описано в PROTEINS: Structure, Function and Genetics, 1993, 15, 312-321. Затем планшеты промывают два раза при помощи PBS/0,05% Твин-20 и блокируют инкубированием (60 минут) с альбумином сыворотки крови крупного рогатого скота (BSA, 0,5%, RIA класс качества или лучше) в Трис-НСl (50 мМ), NaCl (100 мМ), MgCl2 (1 мМ), CaCl2 (1 мМ), MnCl2 (1 мМ), рН 7. Готовят растворы известных ингибиторов и известных тест-веществ в концентрациях от 2 3 витронектинового рецептора, получают по методу Newman et al., Blood, 1985, 227-232, или по подобному способу.
Получали кроличий конъюгат Fab 2 антимышиного Fc на пероксидазе хрена (антимышиный Fс HRP) от фирмы Pel Freeze (каталог №715 305-1).
ELISA-тест.
Способность вещества ингибировать связывание кистрина с витронектиновым рецептором может быть установлена при помощи ELISA-теста. Для этой цели 96-луночные микротитрационные планшеты покрывают раствором кистрина (0,002 мг/мл) по методу Dennis et аl., как описано в PROTEINS: Structure, Function and Genetics, 1993, 15, 312-321. Затем планшеты промывают два раза при помощи PBS/0,05% Твин-20 и блокируют инкубированием (60 минут) с альбумином сыворотки крови крупного рогатого скота (BSA, 0,5%, RIA класс качества или лучше) в Трис-НСl (50 мМ), NaCl (100 мМ), MgCl2 (1 мМ), CaCl2 (1 мМ), MnCl2 (1 мМ), рН 7. Готовят растворы известных ингибиторов и известных тест-веществ в концентрациях от 2 10-12 до 2 10-12 до 2 10-6 моль/л в буферном растворе для анализа (BSA, 0,5%, RIA-класс качества или лучше) в Трис-НСl (50 мМ), NaCl (100 мМ), MgCl2 (1 мМ), CaCl2 (1 мМ), MnCl2 (1 мМ), рН 7). Блокированные пластины освобождают и соответственно 0,025 мл этого раствора, содержащего определенную концентрацию от 2 10-6 моль/л в буферном растворе для анализа (BSA, 0,5%, RIA-класс качества или лучше) в Трис-НСl (50 мМ), NaCl (100 мМ), MgCl2 (1 мМ), CaCl2 (1 мМ), MnCl2 (1 мМ), рН 7). Блокированные пластины освобождают и соответственно 0,025 мл этого раствора, содержащего определенную концентрацию от 2 10-12 до 2 10-12 до 2 10-6 мол/л) или известного ингибитора или тест-вещества, подают в каждую лунку. 0,025 мл раствора витронектинового рецептора в буферном тест-растворе (0,03 мг/мл) капают из пипетки в каждую лунку планшета и планшет инкубируют на устройстве для встряхивания 60-180 минут при комнатной температуре. В это время готовят раствор (6 мл/планшет) мышиного моноклонального антитела, специфичного для 10-6 мол/л) или известного ингибитора или тест-вещества, подают в каждую лунку. 0,025 мл раствора витронектинового рецептора в буферном тест-растворе (0,03 мг/мл) капают из пипетки в каждую лунку планшета и планшет инкубируют на устройстве для встряхивания 60-180 минут при комнатной температуре. В это время готовят раствор (6 мл/планшет) мышиного моноклонального антитела, специфичного для  3-субъединицы витронектинового рецептора, в аналитическом буферном растворе (0,0015 мг/мл). К этому раствору добавляют второе антитело кролика (0,001 мл маточного раствора/6 мл мышиного моноклонального раствора анти- 3-субъединицы витронектинового рецептора, в аналитическом буферном растворе (0,0015 мг/мл). К этому раствору добавляют второе антитело кролика (0,001 мл маточного раствора/6 мл мышиного моноклонального раствора анти- 3-антитела), которое представляет конъюгат антимышиного Fc HRP-антитела, и эту смесь из мышиного антитела-анти- 3-антитела), которое представляет конъюгат антимышиного Fc HRP-антитела, и эту смесь из мышиного антитела-анти- 3 и кроличьего конъюгата антимышиного Fc HRP-антитела инкубируют во время инкубации рецептор-ингибитор. Тест-пластины четыре раза промывают РВS-раствором, который содержит 0,05% Твин-20, и капают из пипетки соответственно 0,05 мл/лунка смеси антител в каждую лунку планшета и инкубируют 60-180 минут. Планшет промывают четыре раза при помощи PBS/0,05% Твин-20 и затем выделяют при помощи 0,05 мл/лунка PBS-раствора, который содержит 0,67 мг/мл о-фенилендиамина и 0,012% H2O2. Как альтернативу этому можно применять о-фенилендиамин в буферном растворе (рН 5), который содержит Nа3РO4 и лимонную кислоту. Цветное проявление останавливают при помощи 1н. H2SO4 (0,05 мл/лунка). Абсорбцию измеряют для каждой лунки при 492-405 нм и данные оценивают стандартными методами.
В таблице приведены полученные тест-результаты. 3 и кроличьего конъюгата антимышиного Fc HRP-антитела инкубируют во время инкубации рецептор-ингибитор. Тест-пластины четыре раза промывают РВS-раствором, который содержит 0,05% Твин-20, и капают из пипетки соответственно 0,05 мл/лунка смеси антител в каждую лунку планшета и инкубируют 60-180 минут. Планшет промывают четыре раза при помощи PBS/0,05% Твин-20 и затем выделяют при помощи 0,05 мл/лунка PBS-раствора, который содержит 0,67 мг/мл о-фенилендиамина и 0,012% H2O2. Как альтернативу этому можно применять о-фенилендиамин в буферном растворе (рН 5), который содержит Nа3РO4 и лимонную кислоту. Цветное проявление останавливают при помощи 1н. H2SO4 (0,05 мл/лунка). Абсорбцию измеряют для каждой лунки при 492-405 нм и данные оценивают стандартными методами.
В таблице приведены полученные тест-результаты.
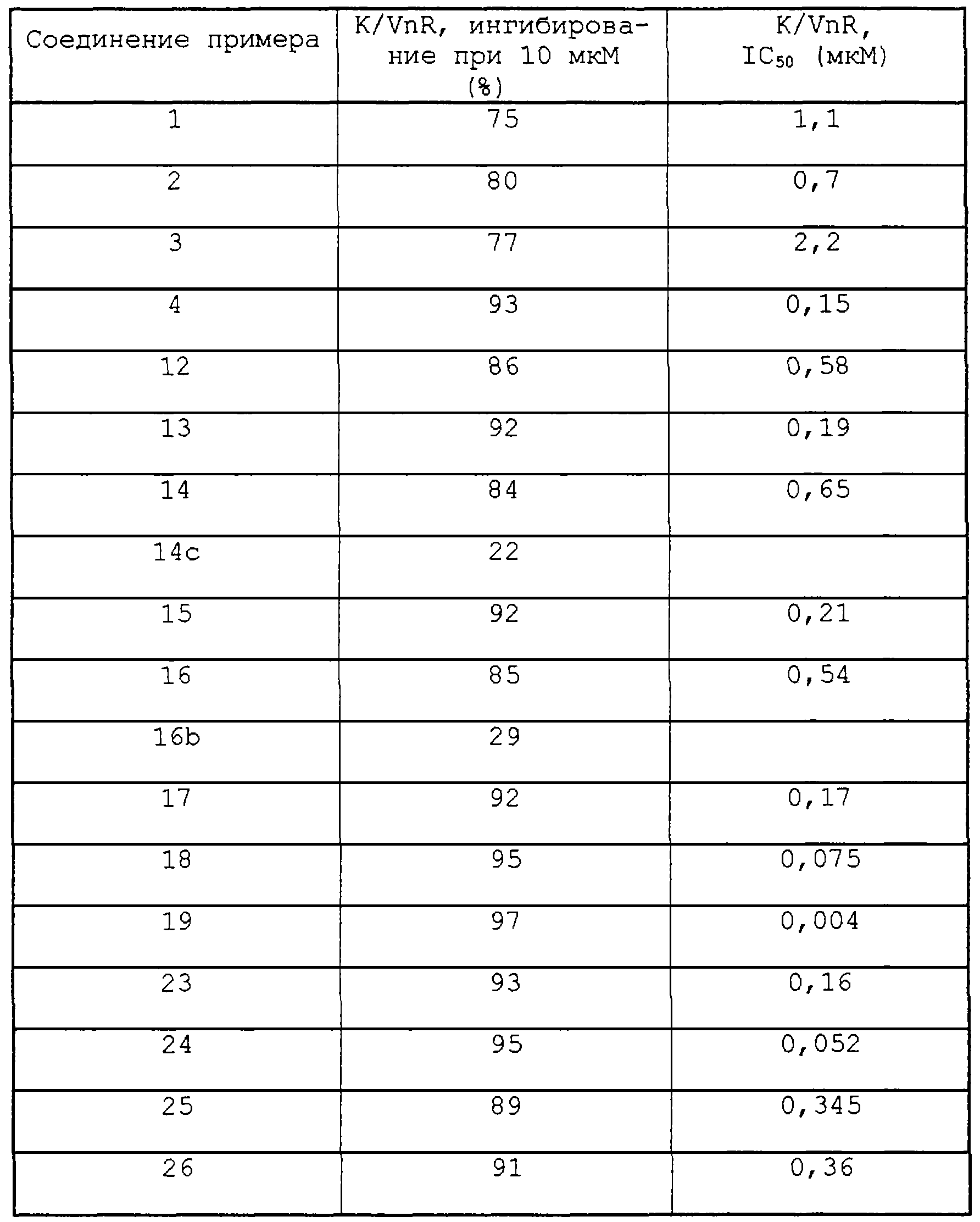 Соединения настоящего изобретения характеризуются средней степенью токсичности.
Соединения настоящего изобретения характеризуются средней степенью токсичности.
Формула изобретения 1. Соединения формул I и Ia, 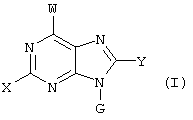 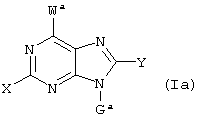 где Х – водород, NR6R6’, фтор, хлор, бром, OR6, SR6, гидрокси- (C1-C6) -алкил-NH, (гидрокси-(C1-C6)алкил)2N, амино-(C1-C6) алкил-NH, (амино-(C1-C6) алкил)2N, гидрокси-(C1-C6)-алкил-O, гидрокси-(C1-C6)алкил-S или NH-CO-R6;
Y – водород,
G – остаток формулы II
-(СR1R2)n-A-(СR1R2)m-(СR1R3)i-(СR1R2)q-R4 (II)
W – остаток формулы III
-B-(СR1R2)r-A’-(СR1R2)s-(СR1R3)k-(СR1R2)t–D-E (III)
Ga – остаток формулы IIа
-(СR1R2)r-A’-(СR1R2)s-(СR1R3)k-(СR1R2)t–D-E (IIa)
Wa – остаток формулы IIIa
-B-(СR1R2)n-A-(СR1R2)m-(СR1R3)i-(СRaR2)q–R4 (IIIa)
А, А’ независимо друг от друга – прямая связь, -C(O)NH- или NH-;
R1,R2 независимо друг от друга – водород, фтор, хлор, циано, нитро, (C1-C10)-алкил, (C3-C14)-циклоалкил, (C3-C14)циклоалкил-(C1-C8)алкил, (C5-C14) арил, (C1-C8) арил- (C1-C8) -алкил, R6-O-R7, R6-S(O)p-R7 или R6R6’N-R7;
R3 независимо друг от друга – водород, фтор, хлор, циано, нитро, (C1-C18)алкил, (C3-C14)-циклоалкил, (C3-C14)циклоалкил-(C1-C8) алкил, (C5-C14)арил, (C5-C14)арил-(C1-C8)-алкил, R6-O-R7, R6R6’N-R7, R6C(O)-O-R7, R6C(O)R7, R6OC(O)R7, R6N(R6’)C(O)OR7, R6S-(O)pN(R5)R7, R6(O)C(O)N(R5)R7, R6C(O)N(R5)R7, R6N(R6’)C(O)N(R5)R7, R6N(R6’)S(O)pN(R5)R7, R6S(O)pR7, R6SC(O)N(R5)R7, R6N(R6’)C(O)R7 или R6N(R6’)S(O)pR7,
причем алкил может быть однократно или многократно ненасыщенным и при этом алкил или арил может быть однократно или многократно замещен фтором, хлором, бромом, циано, R6R6’N-R7, нитро, R6OC(O)R7, R6C(O)R7, R6N(R6’)C(O)-R7, R6N(R6’) S(O)pR7, R6 или R6-O-R7;
R4 означает C(O)R8;
R6, R6’,R5 независимо друг от друга – водород, (C1-С10)алкил, (C3-С14)-циклоалкил, (C3-С14)циклоалкил-(C1-С8)алкил, (C5-С14)-арил, (C5-С14)арил-(C1-С8)-алкил;
R7 независимо друг от друга – (C1-С4) алкилен или прямая связь;
R8 – гидрокси, (C1-С8)алкокси, (C5-С14)арил-(C1-С8)-алкокси, (C5-С14)-арилокси, (C1-С8)-алкилкарбонилокси-(C1-C4)алкокси, (C5-С14)-арил- (C1-С8)-алкилкарбонилокси-(C1-С8)-алкокси, NR6R6’, (ди-((C1-С8)-aлкил)амино)карбонилметилокси, (ди((C5-С14)-арил-(C1-С8)-алкил)амино)карбонилметилокси,
В означает простую связь, NH, CONH, пиперидинил, S или имидазол;
D – прямая связь, -NR6-, -C(O)-NR6-, -NR6-C(O)-, -S(O)u-NR6-, -NR6C(O)-NR6-, -NR6-C(S)NR6-, -NR6-S(O)u-NR6-, -NR6-C-(O)O, -NR6-N=CR6-, -NR6-S(O)u, -(С5-С14)арил-СО-, -(C5-C14)-арил-S(O)u, -N=CR6-, или -R6C=N-, или -R6С=N-NR6-, причем обозначающие D двухвалентные остатки через свободную связь на правой стороне связаны с группой Е,
Е означает водород, -NH-CH(=NH), -C(=NH)-NH2 или 5,6-членный ароматический или неароматический остаток, необязательно содержащий 1 или 2 атома азота, возможно замещенный оксогруппой, остатком R5 или R3, или возможно конденсированный с фенильной группой в виде бензимидазольного остатка;
n = 0, 1, 2, 3, 4 или 5;
m = 0, 1, 2, 3, 4 или 5;
i = 0 или 1;
р = 0, 1 или 2, независимо друг от друга;
q = 0, 1 или 2;
r = 0, 1, 2, 3, 4, 5 или 6;
s = 0, 1, 2, 3, 4 или 5;
t = 0, 1, 2, 3, 4 или 5;
k = 0 или 1;
u = 1 или 2;
во всех их стереоизомерных формах или их смесях во всех соотношениях и их фармацевтически приемлемые соли.
2. Соединения формул I или Iа по п.1, где Х – водород, NR6R6’, гидрокси-(C1-С6)алкил-NH или NH-CO-R6; Y – водород; G остаток формулы II
-(СR1R2)n-A-(СR1R2)m-(СR1R3)i-(СR1R2)q-R4 (II)
W остаток формулы III
-B-(СR1R2)r-A’-(СR1R2)s-(СR1R3)k-(СR1R2)t–D-E (III)
Ga остаток формулы IIа
-(СR1R2)r-A’-(СR1R2)s-(СR1R3)k-(СR1R2)t–D-E (IIa)
Wa остаток формулы IIIa
-B-(СR1R2)n-A-(СR1R2)m-(СR1R3)i-(СRaR2)q–R4 (IIIa)
А, А’ независимо друг от друга – прямая связь, -C(O)NH- или NH-; R1, R2 независимо друг от друга – водород, фтор, циано, (C1-C4)-алкил, (С5-С6)арил, (C5-C6)арил-(C1-C4)-алкил, R6-O-R7 или R6R6’N-R7; R3 независимо друг от друга – водород, (C1-C18)алкил, (С3-С14)-циклоалкил, (С3–14)циклоалкил-(C1-C8)алкил, (C5-C14)арил, (C5-С14)арил-(С1-С8)-алкил, R6R6’N-R7, R6C(O)R7, R6S(O)pN(R5)R7, R6OC(O)N(R5)R7, R6C(О)N(R5)R7, R6N(R6’)C(O)N(R5)R7, R6N(R6’)S(O)pN(R5)R7 или R6N(R6’)С(О)R7, причем алкил может быть однократно или многократно ненасыщенным и при этом алкил или арил может быть однократно или многократно замещен фтором, хлором, бромом, циано, R6R6’NR7, нитро, R6OC(O)R7, R6COR7, R6N(R6’)С(О)R7, R6N(R6’)S(O)pR7, R6 или R6-O-R7; R4 означает C(O)R8; R5 означает водород или (C1-C4)алкил; R6, R6’ независимо друг от друга – водород, (C1-C10)алкил,(С3-С14)-циклоалкил, (С3-С14)циклоалкил-(C1-C8)алкил, (C5-C14)-арил; R7 независимо друг от друга – (C1-C2)алкилен или прямая связь; R8 – гидрокси, (C1-C4)алкокси, (C5-C14)арил-(C1-C4)-алкокси, (C5-C14)-арилокси,(C1-C8)-алкил-карбонилокси-(C1-C4)-алкокси, (C5-C14)-арил-(C1-C4)-алкилкарбонилокси-(C1-C4)-алкокси; В означает простую связь, NH, CONH, пиперидинил, S или имидазол; D – прямая связь, -NR6-, -C(O)-NR6-, -NR6-C(O)-, -NR6-C(O)-NR6-, -NR6-C(O)O-, -NR6-N=CR6, -N=CR6-, -R6C=N- или -R6C=N-NR6-, причем обозначающие D двухвалентные остатки через свободную связь на правой стороне связаны с группой Е; Е означает -NH-CH(=NH), -C(=NH)-NH2 или остаток из ряда
где Х – водород, NR6R6’, фтор, хлор, бром, OR6, SR6, гидрокси- (C1-C6) -алкил-NH, (гидрокси-(C1-C6)алкил)2N, амино-(C1-C6) алкил-NH, (амино-(C1-C6) алкил)2N, гидрокси-(C1-C6)-алкил-O, гидрокси-(C1-C6)алкил-S или NH-CO-R6;
Y – водород,
G – остаток формулы II
-(СR1R2)n-A-(СR1R2)m-(СR1R3)i-(СR1R2)q-R4 (II)
W – остаток формулы III
-B-(СR1R2)r-A’-(СR1R2)s-(СR1R3)k-(СR1R2)t–D-E (III)
Ga – остаток формулы IIа
-(СR1R2)r-A’-(СR1R2)s-(СR1R3)k-(СR1R2)t–D-E (IIa)
Wa – остаток формулы IIIa
-B-(СR1R2)n-A-(СR1R2)m-(СR1R3)i-(СRaR2)q–R4 (IIIa)
А, А’ независимо друг от друга – прямая связь, -C(O)NH- или NH-;
R1,R2 независимо друг от друга – водород, фтор, хлор, циано, нитро, (C1-C10)-алкил, (C3-C14)-циклоалкил, (C3-C14)циклоалкил-(C1-C8)алкил, (C5-C14) арил, (C1-C8) арил- (C1-C8) -алкил, R6-O-R7, R6-S(O)p-R7 или R6R6’N-R7;
R3 независимо друг от друга – водород, фтор, хлор, циано, нитро, (C1-C18)алкил, (C3-C14)-циклоалкил, (C3-C14)циклоалкил-(C1-C8) алкил, (C5-C14)арил, (C5-C14)арил-(C1-C8)-алкил, R6-O-R7, R6R6’N-R7, R6C(O)-O-R7, R6C(O)R7, R6OC(O)R7, R6N(R6’)C(O)OR7, R6S-(O)pN(R5)R7, R6(O)C(O)N(R5)R7, R6C(O)N(R5)R7, R6N(R6’)C(O)N(R5)R7, R6N(R6’)S(O)pN(R5)R7, R6S(O)pR7, R6SC(O)N(R5)R7, R6N(R6’)C(O)R7 или R6N(R6’)S(O)pR7,
причем алкил может быть однократно или многократно ненасыщенным и при этом алкил или арил может быть однократно или многократно замещен фтором, хлором, бромом, циано, R6R6’N-R7, нитро, R6OC(O)R7, R6C(O)R7, R6N(R6’)C(O)-R7, R6N(R6’) S(O)pR7, R6 или R6-O-R7;
R4 означает C(O)R8;
R6, R6’,R5 независимо друг от друга – водород, (C1-С10)алкил, (C3-С14)-циклоалкил, (C3-С14)циклоалкил-(C1-С8)алкил, (C5-С14)-арил, (C5-С14)арил-(C1-С8)-алкил;
R7 независимо друг от друга – (C1-С4) алкилен или прямая связь;
R8 – гидрокси, (C1-С8)алкокси, (C5-С14)арил-(C1-С8)-алкокси, (C5-С14)-арилокси, (C1-С8)-алкилкарбонилокси-(C1-C4)алкокси, (C5-С14)-арил- (C1-С8)-алкилкарбонилокси-(C1-С8)-алкокси, NR6R6’, (ди-((C1-С8)-aлкил)амино)карбонилметилокси, (ди((C5-С14)-арил-(C1-С8)-алкил)амино)карбонилметилокси,
В означает простую связь, NH, CONH, пиперидинил, S или имидазол;
D – прямая связь, -NR6-, -C(O)-NR6-, -NR6-C(O)-, -S(O)u-NR6-, -NR6C(O)-NR6-, -NR6-C(S)NR6-, -NR6-S(O)u-NR6-, -NR6-C-(O)O, -NR6-N=CR6-, -NR6-S(O)u, -(С5-С14)арил-СО-, -(C5-C14)-арил-S(O)u, -N=CR6-, или -R6C=N-, или -R6С=N-NR6-, причем обозначающие D двухвалентные остатки через свободную связь на правой стороне связаны с группой Е,
Е означает водород, -NH-CH(=NH), -C(=NH)-NH2 или 5,6-членный ароматический или неароматический остаток, необязательно содержащий 1 или 2 атома азота, возможно замещенный оксогруппой, остатком R5 или R3, или возможно конденсированный с фенильной группой в виде бензимидазольного остатка;
n = 0, 1, 2, 3, 4 или 5;
m = 0, 1, 2, 3, 4 или 5;
i = 0 или 1;
р = 0, 1 или 2, независимо друг от друга;
q = 0, 1 или 2;
r = 0, 1, 2, 3, 4, 5 или 6;
s = 0, 1, 2, 3, 4 или 5;
t = 0, 1, 2, 3, 4 или 5;
k = 0 или 1;
u = 1 или 2;
во всех их стереоизомерных формах или их смесях во всех соотношениях и их фармацевтически приемлемые соли.
2. Соединения формул I или Iа по п.1, где Х – водород, NR6R6’, гидрокси-(C1-С6)алкил-NH или NH-CO-R6; Y – водород; G остаток формулы II
-(СR1R2)n-A-(СR1R2)m-(СR1R3)i-(СR1R2)q-R4 (II)
W остаток формулы III
-B-(СR1R2)r-A’-(СR1R2)s-(СR1R3)k-(СR1R2)t–D-E (III)
Ga остаток формулы IIа
-(СR1R2)r-A’-(СR1R2)s-(СR1R3)k-(СR1R2)t–D-E (IIa)
Wa остаток формулы IIIa
-B-(СR1R2)n-A-(СR1R2)m-(СR1R3)i-(СRaR2)q–R4 (IIIa)
А, А’ независимо друг от друга – прямая связь, -C(O)NH- или NH-; R1, R2 независимо друг от друга – водород, фтор, циано, (C1-C4)-алкил, (С5-С6)арил, (C5-C6)арил-(C1-C4)-алкил, R6-O-R7 или R6R6’N-R7; R3 независимо друг от друга – водород, (C1-C18)алкил, (С3-С14)-циклоалкил, (С3–14)циклоалкил-(C1-C8)алкил, (C5-C14)арил, (C5-С14)арил-(С1-С8)-алкил, R6R6’N-R7, R6C(O)R7, R6S(O)pN(R5)R7, R6OC(O)N(R5)R7, R6C(О)N(R5)R7, R6N(R6’)C(O)N(R5)R7, R6N(R6’)S(O)pN(R5)R7 или R6N(R6’)С(О)R7, причем алкил может быть однократно или многократно ненасыщенным и при этом алкил или арил может быть однократно или многократно замещен фтором, хлором, бромом, циано, R6R6’NR7, нитро, R6OC(O)R7, R6COR7, R6N(R6’)С(О)R7, R6N(R6’)S(O)pR7, R6 или R6-O-R7; R4 означает C(O)R8; R5 означает водород или (C1-C4)алкил; R6, R6’ независимо друг от друга – водород, (C1-C10)алкил,(С3-С14)-циклоалкил, (С3-С14)циклоалкил-(C1-C8)алкил, (C5-C14)-арил; R7 независимо друг от друга – (C1-C2)алкилен или прямая связь; R8 – гидрокси, (C1-C4)алкокси, (C5-C14)арил-(C1-C4)-алкокси, (C5-C14)-арилокси,(C1-C8)-алкил-карбонилокси-(C1-C4)-алкокси, (C5-C14)-арил-(C1-C4)-алкилкарбонилокси-(C1-C4)-алкокси; В означает простую связь, NH, CONH, пиперидинил, S или имидазол; D – прямая связь, -NR6-, -C(O)-NR6-, -NR6-C(O)-, -NR6-C(O)-NR6-, -NR6-C(O)O-, -NR6-N=CR6, -N=CR6-, -R6C=N- или -R6C=N-NR6-, причем обозначающие D двухвалентные остатки через свободную связь на правой стороне связаны с группой Е; Е означает -NH-CH(=NH), -C(=NH)-NH2 или остаток из ряда
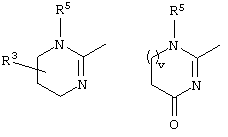 n = 1, 2, 3 или 4; m = 0 или 1; i = 0 или 1; р = 0, 1 или 2,независимо друг от друга; q = 0 или 1; r = 0, 1, 2, 3, 4 или 5; s = 0, 1 или 2; t = 0, 1 или 2; k = 0 или 1; v = 0, 1, 2 или 3, во всех их стереоизомерных формах или их смесях во всех соотношениях и их фармацевтически приемлемые соли.
3. Соединения формул I и Iа по п.1 и/или 2, где X – водород, NR6R6’ или NH-CO-R6; Y – водород; G – остаток формулы II
-(СR1R2)n-A-(СR1R2)m-(СR1R3)i-(СR1R2)q-R4 (II)
W – остаток формулы III
B-(СR1R2)r-A’-(СR1R2)s-(СR1R3)k-(СR1R2)t–D-E (III)
Ga – остаток формулы IIа
-(СR1R2)r-A’-(СR1R2)s-(СR1R3)k-(СR1R2)t–D-E (IIa)
Wa – остаток формулы IIIa
B-(СR1R2)n-A-(СR1R2)m-(СR1R3)i-(СRaR2)q–R4 (IIIa) А, А’ независимо друг от друга – прямая связь, -C(O)NH- или -NH-; R1, R2 – водород; R3 независимо друг от друга – водород, (C1-С10)алкил, (С3-С14)-циклоалкил, (С3–14)циклоалкил-(C1-C8)алкил, (C5-C14)арил, (C5-С14)арил-(С1-С8)-алкил, R6R6’N-R7, R6OC(O)N(R5)R7, R6C(O)N(R5)R7, R6N(R6’)C(O)(R5)R7, R6C(O)R7, или R6N(R6’)С(О)R7, причем алкил может быть однократно или многократно ненасыщенным и при этом алкил или арил может быть однократно или многократно замещен фтором, хлором, бромом, циано, R6R6’NR7, R6OC(O)R7, R6N(R6’)C(O)R7, R6 или R6OR7; R4 означает C(O)R8; R5 означает водород или (C1-C4)алкил, R6, R6’ независимо друг от друга – водород, (C1-C8)-алкил, (С3-С12)-циклоалкил, (С3-С12)циклоалкил-(C1-C8)-алкил, (C5-C14)-арил; R7 – прямая связь; R8 – гидрокси, (C1-C4)алкокси, (C5-C14)арил-(C1-C4)-алкокси, (C5-C14)-арилокси, (C1-С6)-алкилкарбонилокси-(C1-C4)алкокси, (C5-C14)-арил-(C1-C4)-алкилкарбонилокси-(C1-C4)-алкокси, В означает прямую связь, NH, CONH; D – прямая связь, -NR6-, -C(O)-NR6– или -NR6-C(O)-; Е означает -NH-CH(=NH), -C(=NH)-NH2 или остаток из ряда
n = 1, 2, 3 или 4; m = 0 или 1; i = 0 или 1; р = 0, 1 или 2,независимо друг от друга; q = 0 или 1; r = 0, 1, 2, 3, 4 или 5; s = 0, 1 или 2; t = 0, 1 или 2; k = 0 или 1; v = 0, 1, 2 или 3, во всех их стереоизомерных формах или их смесях во всех соотношениях и их фармацевтически приемлемые соли.
3. Соединения формул I и Iа по п.1 и/или 2, где X – водород, NR6R6’ или NH-CO-R6; Y – водород; G – остаток формулы II
-(СR1R2)n-A-(СR1R2)m-(СR1R3)i-(СR1R2)q-R4 (II)
W – остаток формулы III
B-(СR1R2)r-A’-(СR1R2)s-(СR1R3)k-(СR1R2)t–D-E (III)
Ga – остаток формулы IIа
-(СR1R2)r-A’-(СR1R2)s-(СR1R3)k-(СR1R2)t–D-E (IIa)
Wa – остаток формулы IIIa
B-(СR1R2)n-A-(СR1R2)m-(СR1R3)i-(СRaR2)q–R4 (IIIa) А, А’ независимо друг от друга – прямая связь, -C(O)NH- или -NH-; R1, R2 – водород; R3 независимо друг от друга – водород, (C1-С10)алкил, (С3-С14)-циклоалкил, (С3–14)циклоалкил-(C1-C8)алкил, (C5-C14)арил, (C5-С14)арил-(С1-С8)-алкил, R6R6’N-R7, R6OC(O)N(R5)R7, R6C(O)N(R5)R7, R6N(R6’)C(O)(R5)R7, R6C(O)R7, или R6N(R6’)С(О)R7, причем алкил может быть однократно или многократно ненасыщенным и при этом алкил или арил может быть однократно или многократно замещен фтором, хлором, бромом, циано, R6R6’NR7, R6OC(O)R7, R6N(R6’)C(O)R7, R6 или R6OR7; R4 означает C(O)R8; R5 означает водород или (C1-C4)алкил, R6, R6’ независимо друг от друга – водород, (C1-C8)-алкил, (С3-С12)-циклоалкил, (С3-С12)циклоалкил-(C1-C8)-алкил, (C5-C14)-арил; R7 – прямая связь; R8 – гидрокси, (C1-C4)алкокси, (C5-C14)арил-(C1-C4)-алкокси, (C5-C14)-арилокси, (C1-С6)-алкилкарбонилокси-(C1-C4)алкокси, (C5-C14)-арил-(C1-C4)-алкилкарбонилокси-(C1-C4)-алкокси, В означает прямую связь, NH, CONH; D – прямая связь, -NR6-, -C(O)-NR6– или -NR6-C(O)-; Е означает -NH-CH(=NH), -C(=NH)-NH2 или остаток из ряда
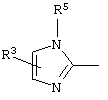 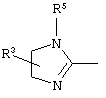 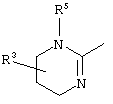 r = 0, 1, 2, 3, 4 или 5; s = 0, или 1; t = 0, или 1; k = 0, или 1; n = 0, 1, 2, 3 или 4; m = 0, или 1; i = 0, или 1; q = 0, или 1, во всех их стереоизомерных формах или их смесях во всех соотношениях и их фармацевтически приемлемые соли.
4. Соединения формулы I по п.1 и/или 2, где Х – водород, NR6R6’ или NH-CO-R6; Y – водород; G – остаток формулы II
-(СR1R2)n-A-(СR1R2)m-(СR1R3)i-(СR1R2)q-R4 (II)
W остаток формулы III
-B-(СR1R2)r-A’-(СR1R2)s-(СR1R3)k-(СR1R2)t–D-E (III)
А, А’ – прямая связь; R1, R2 – водород, (C1-C4)-алкил, (С5-С6)-арил или (C5-С6)-арил-(C1-C4)алкил; R3 независимо друг от друга – водород, (C1-C18)алкил, (С3-С14)-циклоалкил, (С3–14)циклоалкил-(C1-C8)алкил, (C5-C14)арил, (С5-С14)арил-(С1-С8)-алкил; R6R6’N-R7, R6OC(O)N(R5)R7, R6SO2N(R5)R7, R6C(O)N(R5)R7, R6N(R6’)С(O)N(R5)R7, R6C(O)R7 или R6N(R6’)C(O)R7, причем алкил может быть однократно или многократно ненасыщенным и при этом алкил или арил может быть однократно или многократно замещен фтором, хлором, бромом, циано, R6R6’NR7, R6C(O)R7, R6N(R6’)С(O)R7, R6 или R6OR7; R4 означает C(O)R8; R5 означает водород или (C1-C4)алкил; R6, R6’ независимо друг от друга – водород, (C1-C18)-алкил, (С3-С12)-циклоалкил, (С3-С12)циклоалкил-(C1-C8)-алкил, (C5-C14)-арил, где 1-3 атома углерода могут быть замещены 1-3 гетероатомами из ряда N, S, О, или (C5-C14)арил-(C1-C8)алкил, где в арильных остатках 1-3 атома углерода могут быть замещены 1-3 гетероатомами из ряда N, S, О, и при этом также R6 и R6’ совместно со связывающими их атомами образуют циклическую систему, которая может содержать также дополнительные гетероатомы из ряда N, S, О; R7 – прямая связь; R8-гидрокси, (С1-С4)алкокси, (С5-С14)арил-(C1-C4)-алкокси, (С5-С14)-арилокси, (C1-C8)-алкилкарбонилокси-(C1-C4)алкокси или (C5-C14)-арил-(C1-C4)-алкилкарбонилокси-(C1-C4)-алкокси; В означает пиперидинил; D – прямая связь, -NR6-, -C(O)-NR6– или -NR6C(O)-; E означает -NH-CH(=NH), -C(=NH)-NH2 или остаток из ряда
r = 0, 1, 2, 3, 4 или 5; s = 0, или 1; t = 0, или 1; k = 0, или 1; n = 0, 1, 2, 3 или 4; m = 0, или 1; i = 0, или 1; q = 0, или 1, во всех их стереоизомерных формах или их смесях во всех соотношениях и их фармацевтически приемлемые соли.
4. Соединения формулы I по п.1 и/или 2, где Х – водород, NR6R6’ или NH-CO-R6; Y – водород; G – остаток формулы II
-(СR1R2)n-A-(СR1R2)m-(СR1R3)i-(СR1R2)q-R4 (II)
W остаток формулы III
-B-(СR1R2)r-A’-(СR1R2)s-(СR1R3)k-(СR1R2)t–D-E (III)
А, А’ – прямая связь; R1, R2 – водород, (C1-C4)-алкил, (С5-С6)-арил или (C5-С6)-арил-(C1-C4)алкил; R3 независимо друг от друга – водород, (C1-C18)алкил, (С3-С14)-циклоалкил, (С3–14)циклоалкил-(C1-C8)алкил, (C5-C14)арил, (С5-С14)арил-(С1-С8)-алкил; R6R6’N-R7, R6OC(O)N(R5)R7, R6SO2N(R5)R7, R6C(O)N(R5)R7, R6N(R6’)С(O)N(R5)R7, R6C(O)R7 или R6N(R6’)C(O)R7, причем алкил может быть однократно или многократно ненасыщенным и при этом алкил или арил может быть однократно или многократно замещен фтором, хлором, бромом, циано, R6R6’NR7, R6C(O)R7, R6N(R6’)С(O)R7, R6 или R6OR7; R4 означает C(O)R8; R5 означает водород или (C1-C4)алкил; R6, R6’ независимо друг от друга – водород, (C1-C18)-алкил, (С3-С12)-циклоалкил, (С3-С12)циклоалкил-(C1-C8)-алкил, (C5-C14)-арил, где 1-3 атома углерода могут быть замещены 1-3 гетероатомами из ряда N, S, О, или (C5-C14)арил-(C1-C8)алкил, где в арильных остатках 1-3 атома углерода могут быть замещены 1-3 гетероатомами из ряда N, S, О, и при этом также R6 и R6’ совместно со связывающими их атомами образуют циклическую систему, которая может содержать также дополнительные гетероатомы из ряда N, S, О; R7 – прямая связь; R8-гидрокси, (С1-С4)алкокси, (С5-С14)арил-(C1-C4)-алкокси, (С5-С14)-арилокси, (C1-C8)-алкилкарбонилокси-(C1-C4)алкокси или (C5-C14)-арил-(C1-C4)-алкилкарбонилокси-(C1-C4)-алкокси; В означает пиперидинил; D – прямая связь, -NR6-, -C(O)-NR6– или -NR6C(O)-; E означает -NH-CH(=NH), -C(=NH)-NH2 или остаток из ряда
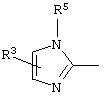 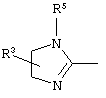 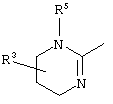 r = 0, 1, 2, 3, 4 или 5; s = 0, или 1; t = 0, или 1; k = 0, или 1; n = 0, 1, 2, 3 или 4; m = 0, или 1; i = 0, или 1; q = 0 или 1, во всех их стереоизомерных формах или их смесях во всех соотношениях и их фармацевтически приемлемые соли.
5. Соединения формулы I по одному или нескольким из пп.1-4, где Х – водород; Y – водород; G остаток формулы II
-(СR1R2)n-A-(СR1R2)m-(СR1R3)i-(СR1R2)q-R4 (II)
W остаток формулы III
-B-(СR1R2)r-A’-(СR1R2)s-(СR1R3)k-(СR1R2)t–D-E (III)
А, А’ – прямая связь; R1, R2 независимо друг от друга – водород, (C1-C2)-алкил; R3 – R6R6’N-R7, R6OC(O)N(R6)R7, R6SO2N(R5)R7 R6C(О)N(R5)R7 или R5N(R6’)C(O)N(R5)R7; R4 – C(O)R8; R5 – водород или (C1-C2)алкил; R6, R6’ независимо друг от друга – водород, (C1-C10)-алкил, (С3-С12)-циклоалкил, (С3-С12)циклоалкил-(C1-C8)-алкил, (C5-C14)-арил; R7 – прямая связь; R8 – гидрокси, (C1-C4)алкокси, (C5-C14)арил-(C1-C4)-алкокси, (C5-C14)-арилокси, (C1-C8)-алкилкарбонилокси-(C1-C4)алкокси или (C5-C14)-арил-(C1-C14)-алкилкарбонилокси-(C1-C4)-алкокси; В означает пиперидинил; D – -N-R6– или -C(O)-NR6-, причем в группе -C(O)-NR6– атом азота связан с группой Е; Е означает -NH-CH(=NH) или остаток из ряда
r = 0, 1, 2, 3, 4 или 5; s = 0, или 1; t = 0, или 1; k = 0, или 1; n = 0, 1, 2, 3 или 4; m = 0, или 1; i = 0, или 1; q = 0 или 1, во всех их стереоизомерных формах или их смесях во всех соотношениях и их фармацевтически приемлемые соли.
5. Соединения формулы I по одному или нескольким из пп.1-4, где Х – водород; Y – водород; G остаток формулы II
-(СR1R2)n-A-(СR1R2)m-(СR1R3)i-(СR1R2)q-R4 (II)
W остаток формулы III
-B-(СR1R2)r-A’-(СR1R2)s-(СR1R3)k-(СR1R2)t–D-E (III)
А, А’ – прямая связь; R1, R2 независимо друг от друга – водород, (C1-C2)-алкил; R3 – R6R6’N-R7, R6OC(O)N(R6)R7, R6SO2N(R5)R7 R6C(О)N(R5)R7 или R5N(R6’)C(O)N(R5)R7; R4 – C(O)R8; R5 – водород или (C1-C2)алкил; R6, R6’ независимо друг от друга – водород, (C1-C10)-алкил, (С3-С12)-циклоалкил, (С3-С12)циклоалкил-(C1-C8)-алкил, (C5-C14)-арил; R7 – прямая связь; R8 – гидрокси, (C1-C4)алкокси, (C5-C14)арил-(C1-C4)-алкокси, (C5-C14)-арилокси, (C1-C8)-алкилкарбонилокси-(C1-C4)алкокси или (C5-C14)-арил-(C1-C14)-алкилкарбонилокси-(C1-C4)-алкокси; В означает пиперидинил; D – -N-R6– или -C(O)-NR6-, причем в группе -C(O)-NR6– атом азота связан с группой Е; Е означает -NH-CH(=NH) или остаток из ряда
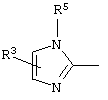 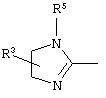 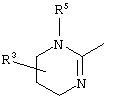 r = 0 или 1; s = 0; t = 0; k = 0; n = 1; m = 1; i = 1; q = 0, во всех их стереоизомерных формах или их смесях во всех соотношениях и их фармацевтически приемлемые соли.
6. Соединения формулы Ih
r = 0 или 1; s = 0; t = 0; k = 0; n = 1; m = 1; i = 1; q = 0, во всех их стереоизомерных формах или их смесях во всех соотношениях и их фармацевтически приемлемые соли.
6. Соединения формулы Ih
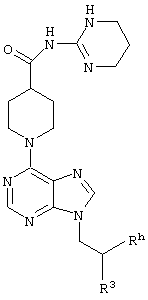 где R3 обозначает R6R6’N-R7, R6OC(O)N(R5)R7, R6SO2N(R5)R7, R6C(O)N(R5)R7 или R6N(R6’)C(O)N(R5)R7;
Rh обозначает группу карбоновой кислоты СООН,
во всех их стереоизомерных формах или их смесях во всех соотношениях и их фармацевтически приемлемые соли.
7. 2S-Бензилоксикарбониламино-3-(6-(4-(1,4,5,6-тетрагидропиримидин-2-илкарбамоил)-пиперидин-1-ил)-пурин-9-ил)пропионовая кислота и ее физиологически приемлемые соли.
8. Способ получения соединения формулы I по одному или нескольким пп.1-7, отличающийся тем, что для получения соединения формулы I соединение формулы IV
где R3 обозначает R6R6’N-R7, R6OC(O)N(R5)R7, R6SO2N(R5)R7, R6C(O)N(R5)R7 или R6N(R6’)C(O)N(R5)R7;
Rh обозначает группу карбоновой кислоты СООН,
во всех их стереоизомерных формах или их смесях во всех соотношениях и их фармацевтически приемлемые соли.
7. 2S-Бензилоксикарбониламино-3-(6-(4-(1,4,5,6-тетрагидропиримидин-2-илкарбамоил)-пиперидин-1-ил)-пурин-9-ил)пропионовая кислота и ее физиологически приемлемые соли.
8. Способ получения соединения формулы I по одному или нескольким пп.1-7, отличающийся тем, что для получения соединения формулы I соединение формулы IV
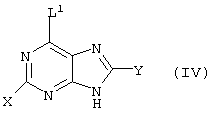 где L1 обозначает удаляемую группу;
Х и Y имеют значения, указанные в пп.1-7, но функциональные группы могут существовать в защищенной форме,
последовательно подвергают взаимодействию с соединением формулы V
L2-(СR1R2)n-A-(СR1R2)m-(СR1R3)i-(СR1R2)q-R10 (V)
и с соединением формулы VII
HB-(СR1R2)r-A’-(СR1R2)s-(СR1R3)k-(СR1R2)t–R13 (VII)
до получения соединения формулы VIII
где L1 обозначает удаляемую группу;
Х и Y имеют значения, указанные в пп.1-7, но функциональные группы могут существовать в защищенной форме,
последовательно подвергают взаимодействию с соединением формулы V
L2-(СR1R2)n-A-(СR1R2)m-(СR1R3)i-(СR1R2)q-R10 (V)
и с соединением формулы VII
HB-(СR1R2)r-A’-(СR1R2)s-(СR1R3)k-(СR1R2)t–R13 (VII)
до получения соединения формулы VIII
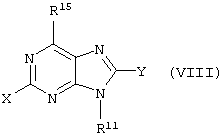 при этом в формулах V, VII и VIII L2 обозначает удаляемую группу;
R11 обозначает –(СR1R2)n-A-(СR1R2)m -(СR1R3)i -(СR1R2)q -R10;
R15 обозначает -B-(СR1R2)r-A’-(СR1R2)s -(СR1R3)k -(СR1R2)t –R13;
R10 имеет указанные в пп.1-7 для R4 значения, причем обозначающие R4 группы могут существовать также в защищенной форме;
R13 имеет указанные в пп.1-7 значения группы D-E, причем содержащиеся в D-E группы могут существовать также в защищенной форме, или R13 обозначает группу, которая может быть превращена в группу -D-E;
R1, R2, R3, А, А’, В, X, Y, n, m, i, q, r, s, k и t имеют указанные в пп.1-7 значения,
и затем в случае необходимости группы R10 и R13 переводят в группы R4 и D-E.
9. Способ получения соединения формулы Iа по одному или нескольким пп.1-7, отличающийся тем, что для получения соединения формулы Iа соединение формулы IV последовательно подвергают взаимодействию с соединением формулы IX
L2-(CR1R2)r-A’-(СR1R2)s-(СR1R3)k-(СR1R2)t–R13 (IX)
и с соединением формулы XI
HB-(CR1R2)n-A-(СR1R2)m-(СR1R3)i-(СR1R2)q–R10 (XI)
до получения соединения формулы XII
при этом в формулах V, VII и VIII L2 обозначает удаляемую группу;
R11 обозначает –(СR1R2)n-A-(СR1R2)m -(СR1R3)i -(СR1R2)q -R10;
R15 обозначает -B-(СR1R2)r-A’-(СR1R2)s -(СR1R3)k -(СR1R2)t –R13;
R10 имеет указанные в пп.1-7 для R4 значения, причем обозначающие R4 группы могут существовать также в защищенной форме;
R13 имеет указанные в пп.1-7 значения группы D-E, причем содержащиеся в D-E группы могут существовать также в защищенной форме, или R13 обозначает группу, которая может быть превращена в группу -D-E;
R1, R2, R3, А, А’, В, X, Y, n, m, i, q, r, s, k и t имеют указанные в пп.1-7 значения,
и затем в случае необходимости группы R10 и R13 переводят в группы R4 и D-E.
9. Способ получения соединения формулы Iа по одному или нескольким пп.1-7, отличающийся тем, что для получения соединения формулы Iа соединение формулы IV последовательно подвергают взаимодействию с соединением формулы IX
L2-(CR1R2)r-A’-(СR1R2)s-(СR1R3)k-(СR1R2)t–R13 (IX)
и с соединением формулы XI
HB-(CR1R2)n-A-(СR1R2)m-(СR1R3)i-(СR1R2)q–R10 (XI)
до получения соединения формулы XII
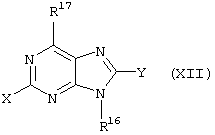 причем в формулах IX, XI и XII
остаток R16 обозначает –(CR1R2)r-A’-(СR1R2)s-(СR1R3)k-(СR1R2)t–R13;
остаток R17 обозначает -B-(CR1R2)n-A-(СR1R2)m-(СR1R3)i-(СR1R2)q–R10;
R1, R2, R3, R10, R13, A, A’, B, X, Y, L2, n, m, i, q, r, s, k и t определены, как указано для формул V, VII и VIII, и затем в случае необходимости группы 10 и R13 переводят в группу R4 и D-E.
10. Соединения формул I и Iа по одному или нескольким пп.1-7 и/или их физиологически приемлемые соли, обладающие антагонистической активностью в отношении рецептора витронектина.
11. Соединения формул I и Iа по одному или нескольким пп.1-7 и/или их физиологически приемлемые соли в качестве ингибиторов резорбции костей остеокластами, в качестве ингибиторов роста опухоли или метастазирования опухоли, в качестве ингибиторов воспаления, для терапии или профилактики сердечно-сосудистых заболеваний, для терапии или профилактики нефропатий или ретинопатии или в качестве антагонистов витронектинового рецептора для терапии или профилактики заболеваний, которые вызваны взаимодействием между витронектиновыми рецепторами и их лигандами при клеточно-клеточных или клеточно-матричных процессах взаимодействия.
12. Фармацевтический препарат, обладающий антагонистической активностью в отношении рецептора витронектина, содержащий по меньшей мере одно соединение формул (I) или (Iа) по одному или нескольким пп.1-7 и/или их физиологически приемлемые соли наряду с фармацевтически приемлемыми носителями и/или добавками.
причем в формулах IX, XI и XII
остаток R16 обозначает –(CR1R2)r-A’-(СR1R2)s-(СR1R3)k-(СR1R2)t–R13;
остаток R17 обозначает -B-(CR1R2)n-A-(СR1R2)m-(СR1R3)i-(СR1R2)q–R10;
R1, R2, R3, R10, R13, A, A’, B, X, Y, L2, n, m, i, q, r, s, k и t определены, как указано для формул V, VII и VIII, и затем в случае необходимости группы 10 и R13 переводят в группу R4 и D-E.
10. Соединения формул I и Iа по одному или нескольким пп.1-7 и/или их физиологически приемлемые соли, обладающие антагонистической активностью в отношении рецептора витронектина.
11. Соединения формул I и Iа по одному или нескольким пп.1-7 и/или их физиологически приемлемые соли в качестве ингибиторов резорбции костей остеокластами, в качестве ингибиторов роста опухоли или метастазирования опухоли, в качестве ингибиторов воспаления, для терапии или профилактики сердечно-сосудистых заболеваний, для терапии или профилактики нефропатий или ретинопатии или в качестве антагонистов витронектинового рецептора для терапии или профилактики заболеваний, которые вызваны взаимодействием между витронектиновыми рецепторами и их лигандами при клеточно-клеточных или клеточно-матричных процессах взаимодействия.
12. Фармацевтический препарат, обладающий антагонистической активностью в отношении рецептора витронектина, содержащий по меньшей мере одно соединение формул (I) или (Iа) по одному или нескольким пп.1-7 и/или их физиологически приемлемые соли наряду с фармацевтически приемлемыми носителями и/или добавками.
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 20.12.2006
Извещение опубликовано: 20.08.2010 БИ: 23/2010
|
||||||||||||||||||||||||||
