Патент на изобретение №2228331
|
||||||||||||||||||||||||||
(54) НИТРАТНЫЕ СОЛИ ГЕТЕРОЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ НА ИХ ОСНОВЕ
(57) Реферат: Изобретение относится к новым нитратным солям гетероциклических соединений формул (А) и (В), где R – водород, алкоксил, R1 – алкил, алкоксил, R2 – водород, алкил, R3 – алкил, алкоксил, Х обозначает N-R11 или кислород, R11 означает свободную валентность, Y означает N-R16, серу или алкил, R16 означает водород; другие значения радикалов представлены в описании изобретения. Соединения формул (А) и (В) и композиции на их основе обладают противоязвенной активностью и могут быть использованы в медицине. 4 с. и 3 з.п. ф-лы, 2 табл. 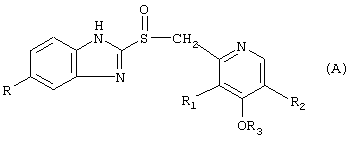
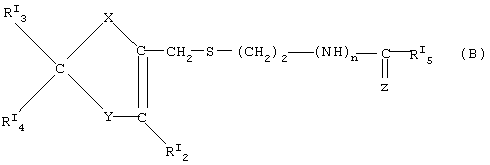 Настоящее изобретение относится к композициям, используемым в терапии и для предотвращения язвенных рецидивов и главным образом диспепсий. Более конкретно данное изобретение относится к композициям, обладающим улучшенной желудочно-защитной активностью в сочетании со способностью ингибировать высококислотную секрецию.
Продукты, известные в данной области техники и коммерчески доступные, являются соединениями, обладающими антисекреторной активностью (ингибирование кислотной секреции). Смотри, например, “New Guide to Medicine & Drugs” Brit. Medical Assoc. Editor, 1997, стр.108-109. Известные продукты, обладающие повышенным терапевтическим действием, показывают высокую антисекреторную активность и используются как в экстренной терапии, так и в долгосрочной терапии. Недостатком этих продуктов является то, что они во время своего присутствия обладают плохой желудочно-защитной активностью. С практической точки зрения это означает, что защита желудка не является оптимальной и причиняет беспокойства, прежде всего при долгосрочной терапии. В этом случае отмечено наличие частых рецидивов из-за ослабления слизистой оболочки желудка.
В данной области техники известно, что для преодоления этих неудобств к вышеупомянутым лекарственным препаратам добавляют другие противоязвенные препараты, обладающие желудочно-защитным действием: простагландины, соли висмута (например, цитрат висмута) и антибиотики. При таком подходе достигается ремиссия язвенной патологии. Однако вышеупомянутые сочетания не являются удовлетворительными в основном из-за их толерантности. Например, хорошо известно, что простагландины вызывают побочные эффекты (диарею) в отношении кишечного тракта; соли висмута часто вызывают тошноту и изжогу. Антибиотики вызывают нежелательные желудочно-кишечные эффекты.
Ощущалась потребность в доступных композициях, активных в лечении язв и желудочной диспепсии, имеющих улучшенные терапевтические характеристики и толерантность, общую и местную, в частности, имеющих улучшенную желудочно-защитную активность в сочетании с высокой антисекреторной активностью.
Заявитель неожиданно и с удивлением обнаружил фармацевтические противоязвенные композиции, имеющие вышеупомянутые требуемые свойства.
Объектом настоящего изобретения являются фармацевтические композиции, содержащие в качестве основного компонента нитратные соли одного или более компонентов, выбранных из следующих классов соединений:
Настоящее изобретение относится к композициям, используемым в терапии и для предотвращения язвенных рецидивов и главным образом диспепсий. Более конкретно данное изобретение относится к композициям, обладающим улучшенной желудочно-защитной активностью в сочетании со способностью ингибировать высококислотную секрецию.
Продукты, известные в данной области техники и коммерчески доступные, являются соединениями, обладающими антисекреторной активностью (ингибирование кислотной секреции). Смотри, например, “New Guide to Medicine & Drugs” Brit. Medical Assoc. Editor, 1997, стр.108-109. Известные продукты, обладающие повышенным терапевтическим действием, показывают высокую антисекреторную активность и используются как в экстренной терапии, так и в долгосрочной терапии. Недостатком этих продуктов является то, что они во время своего присутствия обладают плохой желудочно-защитной активностью. С практической точки зрения это означает, что защита желудка не является оптимальной и причиняет беспокойства, прежде всего при долгосрочной терапии. В этом случае отмечено наличие частых рецидивов из-за ослабления слизистой оболочки желудка.
В данной области техники известно, что для преодоления этих неудобств к вышеупомянутым лекарственным препаратам добавляют другие противоязвенные препараты, обладающие желудочно-защитным действием: простагландины, соли висмута (например, цитрат висмута) и антибиотики. При таком подходе достигается ремиссия язвенной патологии. Однако вышеупомянутые сочетания не являются удовлетворительными в основном из-за их толерантности. Например, хорошо известно, что простагландины вызывают побочные эффекты (диарею) в отношении кишечного тракта; соли висмута часто вызывают тошноту и изжогу. Антибиотики вызывают нежелательные желудочно-кишечные эффекты.
Ощущалась потребность в доступных композициях, активных в лечении язв и желудочной диспепсии, имеющих улучшенные терапевтические характеристики и толерантность, общую и местную, в частности, имеющих улучшенную желудочно-защитную активность в сочетании с высокой антисекреторной активностью.
Заявитель неожиданно и с удивлением обнаружил фармацевтические противоязвенные композиции, имеющие вышеупомянутые требуемые свойства.
Объектом настоящего изобретения являются фармацевтические композиции, содержащие в качестве основного компонента нитратные соли одного или более компонентов, выбранных из следующих классов соединений:
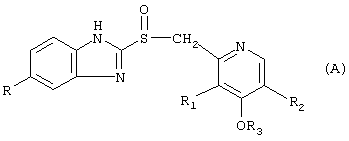
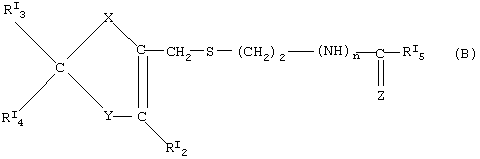 где в (А) классе соединений:
R=Н, ОСН3, OCHF2;
R1=СН3, ОСН3;
R2=Н, СН3;
R3=СН3, СН2-СF3, (СН2)3-ОСН3;
где в (В) классе соединений:
RI3, RI4 равны или отличны друг от друга и означают соответственно свободную валентность, водород, -N=C(NH2)2, -СН2-N(СН3)2;
Y=S,N-RI6,CRI7RI8;
X=O, S, N-RI1;
RI2=Н,СН3;
n=0,1;
Z=N-CN, N-SO2NH2, CH-NO2 или
где в (А) классе соединений:
R=Н, ОСН3, OCHF2;
R1=СН3, ОСН3;
R2=Н, СН3;
R3=СН3, СН2-СF3, (СН2)3-ОСН3;
где в (В) классе соединений:
RI3, RI4 равны или отличны друг от друга и означают соответственно свободную валентность, водород, -N=C(NH2)2, -СН2-N(СН3)2;
Y=S,N-RI6,CRI7RI8;
X=O, S, N-RI1;
RI2=Н,СН3;
n=0,1;
Z=N-CN, N-SO2NH2, CH-NO2 или
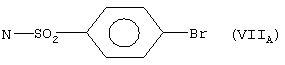 RI5=H, -NH-СН3, NH2;
RI6, RI7, RI8, RI1 равны или отличны друг от друга и означают водород, свободную валентность.
Предпочтительные нитратные соли предшественников формулы (А) являются следующими:
когда R=ОСН3, R1=СН3, R2=СН3, R3=СН3, это остаток омепразола;
как в омепразоле, но с R=OCHF2, R1=ОСН3, R2=Н, это остаток пантопразола;
как в омепразоле, но с R=Н, R2=Н, R3=(СН2)3-ОСН3, это остаток рабепрозола;
как в рабепрозоле, но с R3=СН2-СF3, это остаток лансопразола.
В (А) класс соединений включены также те соединения, которые содержат внутримолекулярное кольцо, полученные обработкой предшественников в кислой водной среде (“A Textbook of Drug Design and Development”, Hardwood Academic Publisher, 1991, p.140):
RI5=H, -NH-СН3, NH2;
RI6, RI7, RI8, RI1 равны или отличны друг от друга и означают водород, свободную валентность.
Предпочтительные нитратные соли предшественников формулы (А) являются следующими:
когда R=ОСН3, R1=СН3, R2=СН3, R3=СН3, это остаток омепразола;
как в омепразоле, но с R=OCHF2, R1=ОСН3, R2=Н, это остаток пантопразола;
как в омепразоле, но с R=Н, R2=Н, R3=(СН2)3-ОСН3, это остаток рабепрозола;
как в рабепрозоле, но с R3=СН2-СF3, это остаток лансопразола.
В (А) класс соединений включены также те соединения, которые содержат внутримолекулярное кольцо, полученные обработкой предшественников в кислой водной среде (“A Textbook of Drug Design and Development”, Hardwood Academic Publisher, 1991, p.140):
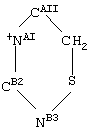 где NAI и СAII означают соответственно атомы азота и углерода в положениях 1 и 2 пиридинового кольца формулы А, и СB2 и NB3 означают соответственно атомы углерода и азота во 2 и в 3 положениях имидазольного кольца (1 положением имидазольного кольца является протонированный азот).
Предпочтительные нитратные соли предшественников формулы (В) являются следующими:
когда в (В) формуле Х=N-RI1 где RI1 означает свободную валентность, Y=N-RI6 где RI6=Н, RI3=H, RI4 означает свободную валентность и образует с RI1 двойную связь, RI2=СН3, n=1, RI5=-NH-СН3, Z=N-CN, это остаток циметидина;
когда Х=N-RI1 где RI1 означает свободную валентность, Y=S, RI3=-N=C(NH2)2, RI4 означает свободную валентность и образует с RI1 двойную связь, RI2=Н, n=l, RI5=Н, Z=(VIIA), это остаток эбротидина;
как в эбротидине, но с n=0, RI5=NH2 и Z=N-SO2NH2, это остаток фамотидина;
как в эбротидине, но с RI3=-CH2-N(CH3)2, RI5=-NH-СН3 и Z=CH-NO2, это остаток низатидина;
как в низатидине, но с Х, означающим кислород, Y=CRI7RI8, где RI7 является водородом и RI8 означает свободную валентность, RI4 означает свободную валентность и образует с RI8 двойную связь, это остаток ранитидина.
В композициях согласно настоящему изобретению могут также использоваться изомеры соединений, соответствующих классам (А) и (В).
В композициях согласно настоящему изобретению соли соединений вышеупомянутых классов содержат, по крайней мере, один моль иона нитрата/моль соединений. Предпочтительно соотношение между молями нитратных ионов и предшественника равно одному. Соли, имеющие более высокое молярное соотношение, получают, когда в молекуле присутствуют другие основные аминогруппы в достаточном количестве, чтобы образовать соль.
Предшественники солей, соответствующие вышеупомянутым классам, получают согласно способам, описанным в “The Merck Index 12a Ed.” (1996), полностью включенным в данное описание в качестве ссылки.
Соли настоящего изобретения могут быть получены согласно одному из следующих способов.
Когда вещество, из которого получают соль, доступно как свободное основание или как растворимая соответствующая соль в органическом растворителе, который предпочтительно не содержит гидроксильных групп, например ацетонитрил, этилацетат, тетрагидрофуран и т.д., соль получают растворением вещества в растворителе при концентрации, предпочтительно равной или выше чем 10% мас./об., добавлением количества концентрированной азотной кислоты, соответствующего молям образующих соль аминогрупп, присутствующих в этом соединении. Азотную кислоту предпочтительно разбавляют в том же растворителе. Предпочтительно во время или после добавления смесь охлаждают до температуры в пределах 20
где NAI и СAII означают соответственно атомы азота и углерода в положениях 1 и 2 пиридинового кольца формулы А, и СB2 и NB3 означают соответственно атомы углерода и азота во 2 и в 3 положениях имидазольного кольца (1 положением имидазольного кольца является протонированный азот).
Предпочтительные нитратные соли предшественников формулы (В) являются следующими:
когда в (В) формуле Х=N-RI1 где RI1 означает свободную валентность, Y=N-RI6 где RI6=Н, RI3=H, RI4 означает свободную валентность и образует с RI1 двойную связь, RI2=СН3, n=1, RI5=-NH-СН3, Z=N-CN, это остаток циметидина;
когда Х=N-RI1 где RI1 означает свободную валентность, Y=S, RI3=-N=C(NH2)2, RI4 означает свободную валентность и образует с RI1 двойную связь, RI2=Н, n=l, RI5=Н, Z=(VIIA), это остаток эбротидина;
как в эбротидине, но с n=0, RI5=NH2 и Z=N-SO2NH2, это остаток фамотидина;
как в эбротидине, но с RI3=-CH2-N(CH3)2, RI5=-NH-СН3 и Z=CH-NO2, это остаток низатидина;
как в низатидине, но с Х, означающим кислород, Y=CRI7RI8, где RI7 является водородом и RI8 означает свободную валентность, RI4 означает свободную валентность и образует с RI8 двойную связь, это остаток ранитидина.
В композициях согласно настоящему изобретению могут также использоваться изомеры соединений, соответствующих классам (А) и (В).
В композициях согласно настоящему изобретению соли соединений вышеупомянутых классов содержат, по крайней мере, один моль иона нитрата/моль соединений. Предпочтительно соотношение между молями нитратных ионов и предшественника равно одному. Соли, имеющие более высокое молярное соотношение, получают, когда в молекуле присутствуют другие основные аминогруппы в достаточном количестве, чтобы образовать соль.
Предшественники солей, соответствующие вышеупомянутым классам, получают согласно способам, описанным в “The Merck Index 12a Ed.” (1996), полностью включенным в данное описание в качестве ссылки.
Соли настоящего изобретения могут быть получены согласно одному из следующих способов.
Когда вещество, из которого получают соль, доступно как свободное основание или как растворимая соответствующая соль в органическом растворителе, который предпочтительно не содержит гидроксильных групп, например ацетонитрил, этилацетат, тетрагидрофуран и т.д., соль получают растворением вещества в растворителе при концентрации, предпочтительно равной или выше чем 10% мас./об., добавлением количества концентрированной азотной кислоты, соответствующего молям образующих соль аминогрупп, присутствующих в этом соединении. Азотную кислоту предпочтительно разбавляют в том же растворителе. Предпочтительно во время или после добавления смесь охлаждают до температуры в пределах 20 -0 -0 С. Продукт обычно выделяют фильтрацией и промывают растворителем.
Когда наоборот вещество не очень растворимо или доступно как не очень растворимая соль в вышеупомянутых растворителях, могут использоваться соответствующие смеси с гидроксилированными растворителями. Примерами таких растворителей являются метиловый спирт, этиловый спирт и вода. Осаждение может быть ускорено путем разбавления таким образом полученной смеси после добавления азотной кислоты неполярным растворителем.
Когда исходный продукт образует соль с соляной кислотой, можно получить соль с азотной кислотой, добавляя непосредственно нитрат серебра к раствору соединения. После отфильтровывания хлорида серебра раствор концентрируют и охлаждают для получения нитратной соли.
Когда исходным продуктом является соль, можно высвобождать соответствующее основание обработкой насыщенным раствором карбоната или бикарбоната натрия или калия или разбавленным раствором гидроксида натрия или калия. Основание затем экстрагируют подходящим органическим растворителем (например, галогенированными растворителями, сложными эфирами, простыми эфирами), который затем обезвоживают. Органический растворитель выпаривают и затем действуют согласно предшествующим способам получения, растворяя основание в ацетонитриле или в других вышеупомянутых растворителях.
С удивлением было обнаружено, что композиции настоящего изобретения позволяют всесторонне улучшить по сравнению с известными вышеупомянутыми сочетаниями фармакотоксикологическую ситуацию предшественников, увеличивая терапевтическую эффективность и их общую и местную толерантность при лечении язвы и желудочного расстройства в сочетании с улучшенной желудочно-защитной активностью.
Из композиций настоящего изобретения составляются соответствующие фармацевтические композиции в соответствии с хорошо известными методиками в данной области совместно со стандартными наполнителями, смотри, например, том “Remington’s Pharmaceutical Sciences 15a Ed.”
Дозы солей настоящего изобретения являются стандартными дозами их предшественников (А) и (В) классов.
Также объектом настоящего изобретения являются композиции, полученные объединением одной или более нитратных солей соединений (А) и (В) классов, или их фармацевтические композиции со стандартными желудочно-защитными свойствами. В качестве примеров могут быть упомянуты простагландины, соли висмута, антибиотики, активные в отношении патогенных микроорганизмов в желудочно-кишечной слизистой оболочке. С удивлением было обнаружено, что желудочно-защитная активность композиций согласно настоящему изобретению очень высока. Это позволяет избежать нежелательных воздействий известных гастропротекторов, когда они используются в комбинации с соединениями или фармацевтическими составами настоящего изобретения. Действительно было обнаружено, что количество известных гастропротекторов в комбинации настоящего изобретения ниже по сравнению с известными количествами и не вызывает нежелательных эффектов. Специалист в данной области техники способен легко определить максимальное количество стандартных гастропротекторов, которые объединяются с фармацевтическими композициями настоящего изобретения, так как это соответствует отсутствию типичных побочных эффектов известных гастропротекторов. В любом случае количество стандартных гастропротекторов, которое используется в комбинации, ниже, чем то количество, которое используется в комбинациях, описанных на данном уровне техники.
Следующие примеры представлены в целях иллюстрации данного изобретения и не должны рассматриваться как ограничивающие его.
Пример 1.
Получение нитрата циметидина.
10 г циметидина растворяют в 100 мл смеси ацетонитрила/тетрагидрофурана/воды 1:1:2 (состав по объему), охлажденной до +4 С. Продукт обычно выделяют фильтрацией и промывают растворителем.
Когда наоборот вещество не очень растворимо или доступно как не очень растворимая соль в вышеупомянутых растворителях, могут использоваться соответствующие смеси с гидроксилированными растворителями. Примерами таких растворителей являются метиловый спирт, этиловый спирт и вода. Осаждение может быть ускорено путем разбавления таким образом полученной смеси после добавления азотной кислоты неполярным растворителем.
Когда исходный продукт образует соль с соляной кислотой, можно получить соль с азотной кислотой, добавляя непосредственно нитрат серебра к раствору соединения. После отфильтровывания хлорида серебра раствор концентрируют и охлаждают для получения нитратной соли.
Когда исходным продуктом является соль, можно высвобождать соответствующее основание обработкой насыщенным раствором карбоната или бикарбоната натрия или калия или разбавленным раствором гидроксида натрия или калия. Основание затем экстрагируют подходящим органическим растворителем (например, галогенированными растворителями, сложными эфирами, простыми эфирами), который затем обезвоживают. Органический растворитель выпаривают и затем действуют согласно предшествующим способам получения, растворяя основание в ацетонитриле или в других вышеупомянутых растворителях.
С удивлением было обнаружено, что композиции настоящего изобретения позволяют всесторонне улучшить по сравнению с известными вышеупомянутыми сочетаниями фармакотоксикологическую ситуацию предшественников, увеличивая терапевтическую эффективность и их общую и местную толерантность при лечении язвы и желудочного расстройства в сочетании с улучшенной желудочно-защитной активностью.
Из композиций настоящего изобретения составляются соответствующие фармацевтические композиции в соответствии с хорошо известными методиками в данной области совместно со стандартными наполнителями, смотри, например, том “Remington’s Pharmaceutical Sciences 15a Ed.”
Дозы солей настоящего изобретения являются стандартными дозами их предшественников (А) и (В) классов.
Также объектом настоящего изобретения являются композиции, полученные объединением одной или более нитратных солей соединений (А) и (В) классов, или их фармацевтические композиции со стандартными желудочно-защитными свойствами. В качестве примеров могут быть упомянуты простагландины, соли висмута, антибиотики, активные в отношении патогенных микроорганизмов в желудочно-кишечной слизистой оболочке. С удивлением было обнаружено, что желудочно-защитная активность композиций согласно настоящему изобретению очень высока. Это позволяет избежать нежелательных воздействий известных гастропротекторов, когда они используются в комбинации с соединениями или фармацевтическими составами настоящего изобретения. Действительно было обнаружено, что количество известных гастропротекторов в комбинации настоящего изобретения ниже по сравнению с известными количествами и не вызывает нежелательных эффектов. Специалист в данной области техники способен легко определить максимальное количество стандартных гастропротекторов, которые объединяются с фармацевтическими композициями настоящего изобретения, так как это соответствует отсутствию типичных побочных эффектов известных гастропротекторов. В любом случае количество стандартных гастропротекторов, которое используется в комбинации, ниже, чем то количество, которое используется в комбинациях, описанных на данном уровне техники.
Следующие примеры представлены в целях иллюстрации данного изобретения и не должны рассматриваться как ограничивающие его.
Пример 1.
Получение нитрата циметидина.
10 г циметидина растворяют в 100 мл смеси ацетонитрила/тетрагидрофурана/воды 1:1:2 (состав по объему), охлажденной до +4 С. Постепенно добавляют 10 мл ацетонитрила, содержащего 2,5 мл 70% азотной кислоты. Раствор разбавляют этиловым эфиром, поддерживая температуру при +4 С. Постепенно добавляют 10 мл ацетонитрила, содержащего 2,5 мл 70% азотной кислоты. Раствор разбавляют этиловым эфиром, поддерживая температуру при +4 С, до начала выпадения продукта в осадок. После нескольких часов покоя выпавшее твердое вещество фильтруют, промывают этиловым эфиром и высушивают. Получают 12,1 г соли мононитрат циметидина, имеющей т. пл. 158 С, до начала выпадения продукта в осадок. После нескольких часов покоя выпавшее твердое вещество фильтруют, промывают этиловым эфиром и высушивают. Получают 12,1 г соли мононитрат циметидина, имеющей т. пл. 158 -159 -159 С (с разложением).
1Н-ЯМР (D2O): 8,55 (1Н, s), 3,83 (2Н, s), 3,32 (2Н, s), 2,77 (3Н, s), 2,68 (2Н, t), 2,32 (3Н, s).
Элементный анализ:
Рассч. (%) С 38,09 Н 5,43 N 31,09 S 10,17
Обнаруж. (%) С 37,99 Н 5,41 N 31,16 S 10,25
Пример 2.
Получение нитрата ранитидина.
5 г гидрохлорида ранитидина растворяют в 140 мл смеси ацетонитрила/метилового спирта 6:1 при +20 С (с разложением).
1Н-ЯМР (D2O): 8,55 (1Н, s), 3,83 (2Н, s), 3,32 (2Н, s), 2,77 (3Н, s), 2,68 (2Н, t), 2,32 (3Н, s).
Элементный анализ:
Рассч. (%) С 38,09 Н 5,43 N 31,09 S 10,17
Обнаруж. (%) С 37,99 Н 5,41 N 31,16 S 10,25
Пример 2.
Получение нитрата ранитидина.
5 г гидрохлорида ранитидина растворяют в 140 мл смеси ацетонитрила/метилового спирта 6:1 при +20 С. Добавляют 4,2 г порошка нитрата серебра. Осадок хлорида серебра фильтруют, этот осадок промывают раствором ацетонитрила/метилового спирта 6:1, органические фазы объединяют вместе, высушивают и обрабатывают для получения сухого остатка. Получают 3,5 г аморфного твердого вещества, соответствующего мононитрату ранитидина.
1Н-ЯМР (D2O): 6,70 (1Н, d), 6,40 (1H, d), 4,34 (2H, s), 3,83 (2Н, s), 3,43 (2Н, t), 2,93 (2Н, m), 2,87 (9Н, s).
Элементный анализ:
Рассч. (%) С 41,37 Н 6,14 N 18,56 S 8,50
Обнаруж. (%) С 41,12 Н 6,20 N 18,44 S 8,38
ФАРМАКОЛОГИЧЕСКИЕ ТЕСТЫ
Пример 3.
Острая токсичность.
Однократную дозу, равную 100 мг/кг, соответственно нитратных солей циметидина и ранитидина, полученных согласно предыдущим примерам, давали группе из 10 крыс, весящих каждая 20 г, через канюлю оральным путем в карбоксиметил-целлюлозной водной суспензии 2% мас./об.
За животными наблюдали в течение 14 дней. Ни в одной из групп животных не было отмечено симптомов токсичности.
Пример 4.
Противоязвенная активность.
Противоязвенную активность оценивали согласно экспериментальной модели, описанной в статье A. Robert и соавт. “Cytoprotection by prostaglandins in rats. Prevention of gastric necrosis produced by alcohol, HCl, NaOH, hypertonic NaCl and thermal injury” (Цитозащита посредством простагландинов в крысах. Предотвращение некроза желудка, вызванного алкоголем, HCl, NaOH, гипертоническим NaCl и термическим повреждением) Gastroenterology 77, 433-43, 1979.
5 группам по 10 крыс каждая, желудок которых оставался пустым с предшествующей ночи, за 15 минут до введения абсолютного этилового спирта (1 мл) оральным путем вводили:
– 5 мл/кг 2% водной суспензии карбоксиметилцеллюлозы.
– 50 мг/кг циметидина в 5 мл/кг 2% водной суспензии карбоксиметилцеллюлозы.
– 62,5 мг/кг нитрата циметидина (что соответствует 50 мг/кг циметидина) в 5 мл/кг 2% водной суспензии карбоксиметилцеллюлозы.
– 50 мг/кг ранитидина в 5 мл/кг 2% водной суспензии карбоксиметилцеллюлозы.
– 60 мг/кг нитрата ранитидина (что соответствует 60 мг/кг ранитидина) в 5 мл/кг 2% водной суспензии карбоксиметилцеллюлозы.
Час спустя животных убивали и оценивали степень поражения желудка. Результаты представлены в таблице I, и они показывают, что нитратные соли циметидина и ранитидина обладают улучшенной желудочно-защитной активностью по сравнению с соответствующими исходными продуктами. С. Добавляют 4,2 г порошка нитрата серебра. Осадок хлорида серебра фильтруют, этот осадок промывают раствором ацетонитрила/метилового спирта 6:1, органические фазы объединяют вместе, высушивают и обрабатывают для получения сухого остатка. Получают 3,5 г аморфного твердого вещества, соответствующего мононитрату ранитидина.
1Н-ЯМР (D2O): 6,70 (1Н, d), 6,40 (1H, d), 4,34 (2H, s), 3,83 (2Н, s), 3,43 (2Н, t), 2,93 (2Н, m), 2,87 (9Н, s).
Элементный анализ:
Рассч. (%) С 41,37 Н 6,14 N 18,56 S 8,50
Обнаруж. (%) С 41,12 Н 6,20 N 18,44 S 8,38
ФАРМАКОЛОГИЧЕСКИЕ ТЕСТЫ
Пример 3.
Острая токсичность.
Однократную дозу, равную 100 мг/кг, соответственно нитратных солей циметидина и ранитидина, полученных согласно предыдущим примерам, давали группе из 10 крыс, весящих каждая 20 г, через канюлю оральным путем в карбоксиметил-целлюлозной водной суспензии 2% мас./об.
За животными наблюдали в течение 14 дней. Ни в одной из групп животных не было отмечено симптомов токсичности.
Пример 4.
Противоязвенная активность.
Противоязвенную активность оценивали согласно экспериментальной модели, описанной в статье A. Robert и соавт. “Cytoprotection by prostaglandins in rats. Prevention of gastric necrosis produced by alcohol, HCl, NaOH, hypertonic NaCl and thermal injury” (Цитозащита посредством простагландинов в крысах. Предотвращение некроза желудка, вызванного алкоголем, HCl, NaOH, гипертоническим NaCl и термическим повреждением) Gastroenterology 77, 433-43, 1979.
5 группам по 10 крыс каждая, желудок которых оставался пустым с предшествующей ночи, за 15 минут до введения абсолютного этилового спирта (1 мл) оральным путем вводили:
– 5 мл/кг 2% водной суспензии карбоксиметилцеллюлозы.
– 50 мг/кг циметидина в 5 мл/кг 2% водной суспензии карбоксиметилцеллюлозы.
– 62,5 мг/кг нитрата циметидина (что соответствует 50 мг/кг циметидина) в 5 мл/кг 2% водной суспензии карбоксиметилцеллюлозы.
– 50 мг/кг ранитидина в 5 мл/кг 2% водной суспензии карбоксиметилцеллюлозы.
– 60 мг/кг нитрата ранитидина (что соответствует 60 мг/кг ранитидина) в 5 мл/кг 2% водной суспензии карбоксиметилцеллюлозы.
Час спустя животных убивали и оценивали степень поражения желудка. Результаты представлены в таблице I, и они показывают, что нитратные соли циметидина и ранитидина обладают улучшенной желудочно-защитной активностью по сравнению с соответствующими исходными продуктами.
 Пример 5.
Получение соединений нитратной соли с остатком омепразола
6 г омепразола растворяли в 180 мл органического раствора с составом (рассчитано по объему) ацетонитрил/метанол/тетрагидрофуран 1/1/3. Полученный раствор охлаждали до температуры 0
Пример 5.
Получение соединений нитратной соли с остатком омепразола
6 г омепразола растворяли в 180 мл органического раствора с составом (рассчитано по объему) ацетонитрил/метанол/тетрагидрофуран 1/1/3. Полученный раствор охлаждали до температуры 0 С. 10 мл органического раствора азотной кислоты, полученного смешиванием в 10 мл объемной колбы кратного количества ацетонитрила с 1,22 мл 65% азотной кислоты и затем, смешивая с объемом органического растворителя, добавляли каплями при постоянном перемешивании, сохраняя при этом температуру при 0 С. 10 мл органического раствора азотной кислоты, полученного смешиванием в 10 мл объемной колбы кратного количества ацетонитрила с 1,22 мл 65% азотной кислоты и затем, смешивая с объемом органического растворителя, добавляли каплями при постоянном перемешивании, сохраняя при этом температуру при 0 С. Раствор затем перемешивали в течение часа, затем полученный осадок фильтровали. Полученный остаток промывали этиловым эфиром и просушивали. Получали 6,64 г соли мононитрата омепразола.
т.р.: 162-164 С. Раствор затем перемешивали в течение часа, затем полученный осадок фильтровали. Полученный остаток промывали этиловым эфиром и просушивали. Получали 6,64 г соли мононитрата омепразола.
т.р.: 162-164 С
1HNMR (DMSO): 9,12 (1H, d), 7,66 (1H, dd), 7,22 (1H, d), 7,04 (1H, m), 4,60 (2H, s), 4,26 (3H, s), 3,85 (3H, s), 2,54 (6H, s).
Анализ С, H, N, S:
Рассчитано (%) С 49,97 H 4,93 N 13,77 S 7,85
Получено (%) С 49,98 H 4,96 N 13,79 S 7,84
Фармакологический пример противоязвенной активности.
Противоязвенный эксперимент выполняли в соответствии с примером 4.
Омепразол вводили 10 крысам дозами 50 мг/кг в 5 мл/кг карбоксиметилцеллюлозы в водной суспензии 2% w/v.
Нитратная соль вводилась дозами 59 мг/кг соответственно в 50 мг/кг омепразола в 5 мл/кг карбоксиметилцеллюлозы в водной суспензии 2% w/v.
Результаты представлены в таблице II.
Повреждение желудка выражено в правой колонне таблицы в % от количества крыс, показывающих поражение желудка из 10 крыс этой группы.
Данные в таблице показывают, что нитратная соль с остатком омепразола имеет улучшенную желудочно-защитную активность по сравнению с омепразолом. С
1HNMR (DMSO): 9,12 (1H, d), 7,66 (1H, dd), 7,22 (1H, d), 7,04 (1H, m), 4,60 (2H, s), 4,26 (3H, s), 3,85 (3H, s), 2,54 (6H, s).
Анализ С, H, N, S:
Рассчитано (%) С 49,97 H 4,93 N 13,77 S 7,85
Получено (%) С 49,98 H 4,96 N 13,79 S 7,84
Фармакологический пример противоязвенной активности.
Противоязвенный эксперимент выполняли в соответствии с примером 4.
Омепразол вводили 10 крысам дозами 50 мг/кг в 5 мл/кг карбоксиметилцеллюлозы в водной суспензии 2% w/v.
Нитратная соль вводилась дозами 59 мг/кг соответственно в 50 мг/кг омепразола в 5 мл/кг карбоксиметилцеллюлозы в водной суспензии 2% w/v.
Результаты представлены в таблице II.
Повреждение желудка выражено в правой колонне таблицы в % от количества крыс, показывающих поражение желудка из 10 крыс этой группы.
Данные в таблице показывают, что нитратная соль с остатком омепразола имеет улучшенную желудочно-защитную активность по сравнению с омепразолом.
 Примеры фармацевтических композиций
Таблетка, содержащая нитрат ранитидина:
Нитрат ранитидина 360 мг
Микрогранулят целлюлозы 260 мг
Стеарат магния 4 мг
Гидроксипропилметилцеллюлоза 15 мг
Двуокись титана 6 мг
Таблетка, содержащая нитрат циметидина
Нитрат циметидина 240 мг
Микрогранулят целлюлозы 50 мг
Кукурузный крахмал 10 мг
Поливинилпирролидон 10 мг
Сульфат натрия 1 мг
Карбоксиметиловый крахмал 10 мг
Стеарат магния 1 мг
Таблетка, содержащая нитрат омепразола
Нитрат омепразола 100 мг
Микрогранулят целлюлозы 240 мг
Стеарат магния 2 мг
Гидроксипропилметилцеллюлоза 30 мг
Двуокись титана 4 мг
Приготовление порошка, содержащего нитрат циметидина + соли висмута (смешивается в воде перед употреблением).
Нитрат циметидина 380 мг
Алюминат висмута 450 мг
Трагакантный клей 500 мг
Карбоксиметилцеллюлоза натрия 100 мг
Арома 50 мг
Сахароза: добавляется до 5 г
Примеры фармацевтических композиций
Таблетка, содержащая нитрат ранитидина:
Нитрат ранитидина 360 мг
Микрогранулят целлюлозы 260 мг
Стеарат магния 4 мг
Гидроксипропилметилцеллюлоза 15 мг
Двуокись титана 6 мг
Таблетка, содержащая нитрат циметидина
Нитрат циметидина 240 мг
Микрогранулят целлюлозы 50 мг
Кукурузный крахмал 10 мг
Поливинилпирролидон 10 мг
Сульфат натрия 1 мг
Карбоксиметиловый крахмал 10 мг
Стеарат магния 1 мг
Таблетка, содержащая нитрат омепразола
Нитрат омепразола 100 мг
Микрогранулят целлюлозы 240 мг
Стеарат магния 2 мг
Гидроксипропилметилцеллюлоза 30 мг
Двуокись титана 4 мг
Приготовление порошка, содержащего нитрат циметидина + соли висмута (смешивается в воде перед употреблением).
Нитрат циметидина 380 мг
Алюминат висмута 450 мг
Трагакантный клей 500 мг
Карбоксиметилцеллюлоза натрия 100 мг
Арома 50 мг
Сахароза: добавляется до 5 г
Формула изобретения 1. Нитратные соли гетероциклических соединений формул (А) и (В), выбранных из следующих классов соединений: 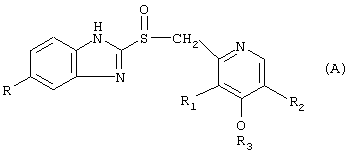
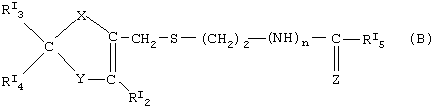 где в соединениях формулы (А)
R – ОСН3, R1 – СН3, R2 – СН3, R3 – СН3;
R – ОСНF2, R1 – ОСН3, R2 – Н, R3 – СН3;
R – Н, R1 – СН3, R2 – Н, R3 – (СН2)3-ОСН3;
R – Н, R1 – СН3, R2 – Н, R3 – (СН2)3-ОСН3;
R – Н, R1 – СН3, R2 – Н, R3 – СН2-СF3;
где в формуле (В)
Х – N-RI1, где RI1 означает свободную валентность; Y – N-RI6, где RI6 – Н, RI3 – Н, RI4 означает свободную валентность и образует с RI1 двойную связь, RI2 – СН3, n = 1, RI5 – -NН-СН3, Z – N-CN;
Х – N-RI1, где RI1 означает свободную валентность, Y-S;
RI3 – N=С(NН2)2, RI4 означает свободную валентность и образует с RI1 двойную связь, RI2 – Н, n=1, RI5 – Н, Z – (VIIа):
где в соединениях формулы (А)
R – ОСН3, R1 – СН3, R2 – СН3, R3 – СН3;
R – ОСНF2, R1 – ОСН3, R2 – Н, R3 – СН3;
R – Н, R1 – СН3, R2 – Н, R3 – (СН2)3-ОСН3;
R – Н, R1 – СН3, R2 – Н, R3 – (СН2)3-ОСН3;
R – Н, R1 – СН3, R2 – Н, R3 – СН2-СF3;
где в формуле (В)
Х – N-RI1, где RI1 означает свободную валентность; Y – N-RI6, где RI6 – Н, RI3 – Н, RI4 означает свободную валентность и образует с RI1 двойную связь, RI2 – СН3, n = 1, RI5 – -NН-СН3, Z – N-CN;
Х – N-RI1, где RI1 означает свободную валентность, Y-S;
RI3 – N=С(NН2)2, RI4 означает свободную валентность и образует с RI1 двойную связь, RI2 – Н, n=1, RI5 – Н, Z – (VIIа):
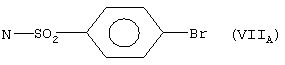 Х – N-RI1, где RI1 означает свободную валентность, Y – S, RI3 – -N=C(NН2)2, RI4 означает свободную валентность и образует с RI1 двойную связь, RI2 – Н, n=0, RI5 – NН2 и Z – N-SO2NН2;
X – N-RI1, где RI1 означает свободную валентность, Y – S, RI3 – -СН2-N(СН3)2,
RI4 означает свободную валентность и образует с RI1 двойную связь, RI2 – Н, n=1,
RI3 – -NH-СН3, Z – СН-NO2;
Х означает кислород, Y – СRI7RI8, где RI7 означает водород и RI8 означает свободную валентность, RI3 – -СH2-N (СН3)2, RI4 означает свободную валентность и образует с RI7 двойную связь, RI2 – Н, n=1, RI5 – -NH-СН3, Z – СН-NO2.
2. Фармацевтическая композиция нитратных солей, обладающая противоязвенной активностью и содержащая в качестве активного вещества соединение по п.1.
3. Фармацевтическая композиция нитратных солей, обладающая противоязвенной активностью и содержащая в качестве активного вещества соединение по п.1 и стандартный гастропротектор.
4. Композиция по пп.2 и 3, где стандартные гастропротекторы выбирают из простагландинов, солей висмута и антибиотиков.
5. Способ получения нитратных солей по п.1, отличающийся тем, что, если вещество, которое образует соль, доступно как свободное основание или как растворимая соль в органическом растворителе, который не содержит гидроксильных групп, нитратную соль получают растворением исходного вещества в растворителе с последующим добавлением такого количества молей концентрированной азотной кислоты, которое соответствует числу аминогрупп в соединении, охлаждением реакционной смеси до 20-0
Х – N-RI1, где RI1 означает свободную валентность, Y – S, RI3 – -N=C(NН2)2, RI4 означает свободную валентность и образует с RI1 двойную связь, RI2 – Н, n=0, RI5 – NН2 и Z – N-SO2NН2;
X – N-RI1, где RI1 означает свободную валентность, Y – S, RI3 – -СН2-N(СН3)2,
RI4 означает свободную валентность и образует с RI1 двойную связь, RI2 – Н, n=1,
RI3 – -NH-СН3, Z – СН-NO2;
Х означает кислород, Y – СRI7RI8, где RI7 означает водород и RI8 означает свободную валентность, RI3 – -СH2-N (СН3)2, RI4 означает свободную валентность и образует с RI7 двойную связь, RI2 – Н, n=1, RI5 – -NH-СН3, Z – СН-NO2.
2. Фармацевтическая композиция нитратных солей, обладающая противоязвенной активностью и содержащая в качестве активного вещества соединение по п.1.
3. Фармацевтическая композиция нитратных солей, обладающая противоязвенной активностью и содержащая в качестве активного вещества соединение по п.1 и стандартный гастропротектор.
4. Композиция по пп.2 и 3, где стандартные гастропротекторы выбирают из простагландинов, солей висмута и антибиотиков.
5. Способ получения нитратных солей по п.1, отличающийся тем, что, если вещество, которое образует соль, доступно как свободное основание или как растворимая соль в органическом растворителе, который не содержит гидроксильных групп, нитратную соль получают растворением исходного вещества в растворителе с последующим добавлением такого количества молей концентрированной азотной кислоты, которое соответствует числу аминогрупп в соединении, охлаждением реакционной смеси до 20-0 С во время добавления азотной кислоты и выделением продукта фильтрацией.
6. Способ по п.5, отличающийся тем, что для повышения растворимости свободного основания или соли в растворителе последний используют в смеси с гидроксилированным растворителем и после добавления азотной кислоты осаждение продукта может быть ускорено путем разбавления полученной смеси неполярным растворителем.
7. Способ по пп.5 и 6, отличающийся тем, что, если исходное соединение образует соль с соляной кислотой, соль азотной кислоты получают непосредственным добавлением нитрата серебра к раствору соединения, фильтрованием хлорида серебра с последующим концентрированием раствора и его охлаждением. С во время добавления азотной кислоты и выделением продукта фильтрацией.
6. Способ по п.5, отличающийся тем, что для повышения растворимости свободного основания или соли в растворителе последний используют в смеси с гидроксилированным растворителем и после добавления азотной кислоты осаждение продукта может быть ускорено путем разбавления полученной смеси неполярным растворителем.
7. Способ по пп.5 и 6, отличающийся тем, что, если исходное соединение образует соль с соляной кислотой, соль азотной кислоты получают непосредственным добавлением нитрата серебра к раствору соединения, фильтрованием хлорида серебра с последующим концентрированием раствора и его охлаждением.
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 26.02.2007
Извещение опубликовано: 20.07.2010 БИ: 20/2010
|
||||||||||||||||||||||||||
