Патент на изобретение №2228327
|
||||||||||||||||||||||||||
(54) СПОСОБ ПОЛУЧЕНИЯ 4,4-ДИМЕТИЛ-1-(П-ХЛОРФЕНИЛ)-ПЕНТАН-3-ОНА
(57) Реферат: Изобретение относится к способу получения 4,4-диметил-1-(п-хлорфенил)пентан-3-она, который является промежуточным продуктом для получения пестицидов и фармацевтических продуктов, в том числе тебуконазола. Способ заключается в конденсации пинаколина с п-хлорбензальдегидом в среде водного бутилового спирта в присутствии щелочи и проведении процесса гидрирования в расплаве полученного 4,4-диметил-1(п-хлорфенил)пент-1-ен-3она в присутствии катализатора Ni-Re. Способ позволяет проводить процесс гидрирования с большей скоростью и при меньшем расходе катализатора, снизить образование побочных продуктов. 3 з.п. ф-лы, 1 табл. Изобретение относится к способу получения 4,4-диметил-1-(п-хлорфенил)-пентан-3-она формулы 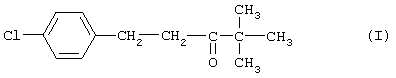 который является промежуточным продуктом для получения действующих веществ известных пестицидов и фармацевтических продуктов, в том числе тебуконазола (II),
который является промежуточным продуктом для получения действующих веществ известных пестицидов и фармацевтических продуктов, в том числе тебуконазола (II),
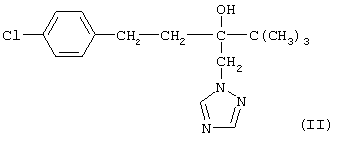 действующего вещества фунгицидных препаратов Folicur
действующего вещества фунгицидных препаратов Folicur и Raxil и Raxil (торговые марки фирмы Bayer A.G.) (см. ЕР 0040345, US Pat. №4723984, DE-OS 3018865, DE-OS 3018866, DE-OS 333341), а также пестицидов, описанных в патенте Японии №62-238272, кл. С 07 D 233/60, A 01 N 43/50.
Известно, что 4,4-диметил-1-(п-хлорфенил)-пентан-3-он может быть получен каталитическим гидрированием 4,4-диметил-1-(п-хлорфенил)пент-1-ен-3-она, который, в свою очередь, получают конденсацией п-хлорбензальдегида и пинаколина в щелочной среде в присутствии растворителя, чаще всего метанола или этанола по следующей схеме: (торговые марки фирмы Bayer A.G.) (см. ЕР 0040345, US Pat. №4723984, DE-OS 3018865, DE-OS 3018866, DE-OS 333341), а также пестицидов, описанных в патенте Японии №62-238272, кл. С 07 D 233/60, A 01 N 43/50.
Известно, что 4,4-диметил-1-(п-хлорфенил)-пентан-3-он может быть получен каталитическим гидрированием 4,4-диметил-1-(п-хлорфенил)пент-1-ен-3-она, который, в свою очередь, получают конденсацией п-хлорбензальдегида и пинаколина в щелочной среде в присутствии растворителя, чаще всего метанола или этанола по следующей схеме:
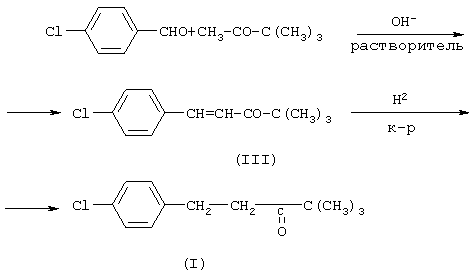 Конденсация п-хлорбензальдегида и пинаколина описана, например, в заявках DE-OS 3237476, DE-OS 3921167, ЕР 0062722, европейской заявке №0486409. Во всех случаях в качестве растворителей используют метанол или этанол, основания – водный или спиртовой раствор NaOH или КОН. Недостатки: невысокий выход целевого продукта (III), сложная процедура его выделения, длительное время реакции, а также использование большого количества растворителя. По способу, описанному в заявке DE-OS 3921167, конденсацию проводят в атмосфере азота, что позволяет повысить температуру реакции, значительно сократить время проведения процесса и увеличить выход продукта (III). Однако использование в реакции большого количества метанола (на 1+1 исходных реагентов более 10 молей метанола), являющегося высокотоксичным веществом, ограничивают или делают невозможным применение способа в производственных условиях.
В заявке DE-OS 2737489 описан способ, при котором п-хлорбензальдегид и пинаколин взаимодействуют в присутствии NaOH при t не выше 25
Конденсация п-хлорбензальдегида и пинаколина описана, например, в заявках DE-OS 3237476, DE-OS 3921167, ЕР 0062722, европейской заявке №0486409. Во всех случаях в качестве растворителей используют метанол или этанол, основания – водный или спиртовой раствор NaOH или КОН. Недостатки: невысокий выход целевого продукта (III), сложная процедура его выделения, длительное время реакции, а также использование большого количества растворителя. По способу, описанному в заявке DE-OS 3921167, конденсацию проводят в атмосфере азота, что позволяет повысить температуру реакции, значительно сократить время проведения процесса и увеличить выход продукта (III). Однако использование в реакции большого количества метанола (на 1+1 исходных реагентов более 10 молей метанола), являющегося высокотоксичным веществом, ограничивают или делают невозможным применение способа в производственных условиях.
В заявке DE-OS 2737489 описан способ, при котором п-хлорбензальдегид и пинаколин взаимодействуют в присутствии NaOH при t не выше 25 С в метаноле. Сам процесс и выделение продукта (выход 67,4%) занимают более 48 часов.
Для гидрирования двойной связи пентенон (III) растворяют в этилацетате, добавляют примерно 26 вес.% Ni/Re и пропускают водород в течение 12-14 часов. Недостатком процесса является слишком большое количество катализатора и длительное время протекания процесса. В этом способе продукт конденсации (III) выделяют, очищают и только потом гидрируют.
Гидрирование С=С связей в С в метаноле. Сам процесс и выделение продукта (выход 67,4%) занимают более 48 часов.
Для гидрирования двойной связи пентенон (III) растворяют в этилацетате, добавляют примерно 26 вес.% Ni/Re и пропускают водород в течение 12-14 часов. Недостатком процесса является слишком большое количество катализатора и длительное время протекания процесса. В этом способе продукт конденсации (III) выделяют, очищают и только потом гидрируют.
Гидрирование С=С связей в  , , -ненасыщенных кетонах, к которым относится и 4,4-диметил-1-(п-хлорфенил)пент-1-ен-3-он, содержащий к тому же подвижный хлор, в присутствии Ni-содержащих катализаторов сопровождается побочными процессами, такими как дехлорирование, гидрирование карбонильной группы и присоединение ROH к двойной связи, если в качестве растворителя используют спирт.
В заявке DE-OS 3824625 показано, что побочных процессов можно избежать полностью или частично путем добавления к катализатору или в реакционную смесь небольших количеств (0,002-0,1 вес. частей на 1 вес. часть катализатора) органических серусодержащих соединений R3-S(=O)n-R4, n=0, 1, чаще всего бис-(2-гидроксиэтил)сульфида.
В заявке DE-OS 19505938 и US Pat. №5639917 описан непрерывный метод гидрирования 1-(4-хлорфенил)-4,4-диметил-пент-1-ен-3-она в спиртовом растворе при давлении 200-300 бар и t=80-160 -ненасыщенных кетонах, к которым относится и 4,4-диметил-1-(п-хлорфенил)пент-1-ен-3-он, содержащий к тому же подвижный хлор, в присутствии Ni-содержащих катализаторов сопровождается побочными процессами, такими как дехлорирование, гидрирование карбонильной группы и присоединение ROH к двойной связи, если в качестве растворителя используют спирт.
В заявке DE-OS 3824625 показано, что побочных процессов можно избежать полностью или частично путем добавления к катализатору или в реакционную смесь небольших количеств (0,002-0,1 вес. частей на 1 вес. часть катализатора) органических серусодержащих соединений R3-S(=O)n-R4, n=0, 1, чаще всего бис-(2-гидроксиэтил)сульфида.
В заявке DE-OS 19505938 и US Pat. №5639917 описан непрерывный метод гидрирования 1-(4-хлорфенил)-4,4-диметил-пент-1-ен-3-она в спиртовом растворе при давлении 200-300 бар и t=80-160 С в присутствии твердого катализатора в виде спрессованных частиц порошков элементов VIII и соседних групп периодической системы или их смесей или сплавов без носителей. Катализатор из спрессованного Ni-порошка также модифицируют добавлением 0,2 вес.% бис-(2-гидроксиэтил)сульфида. Для этого способа требуются специальная аппаратура и нестандартные катализаторы.
Во всех вышеприведенных способах полученный в результате конденсации пинаколина и п-хлорбензальдегида 4,4-диметил-1-(п-хлорфенил)пент-1-ен-3-он выделяют в виде твердого вещества, очищают и только потом во второй отдельной операции проводят его гидрирование.
Известны также такие способы получения 4,4-диметил-1-(п-хлорфенил)пентан-3-она, когда полученный в результате конденсации пинаколина и п-хлорбензальдегида 4,4-диметил-1-(п-хлорфенил)-пент-1-ен-3-он гидрируют без его выделения из реакционной смеси.
В заявке DE-OS 3824518 описан способ получения вышеупомянутого пентанона конденсацией пинаколина и п-хлорбензальдегида в присутствии концентрированного водного NaOH в среде метанола с последующим гидрированием полученного непредельного кетона без его выделения из реакционной смеси после добавления Ni-Re катализатора при повышенном давлении и температуре. По завершении гидрирования катализатор отфильтровывают, спирт отгоняют, добавляют воду. Из органического слоя получают целевой продукт. В реакцию берут 1-1,1 моль пинаколина на 1 моль п-хлор-бензальдегида, неорганическое основание (NaOH) – в количестве 10-15 эквивалент%, считая на п-хлорбензальдегид. Количество спирта такое, чтобы смесь была жидкой. Это достигается при 20-80 вес.% спирта по отношению ко всей реакционной смеси, температура на стадии конденсации предпочтительно 60-75 С в присутствии твердого катализатора в виде спрессованных частиц порошков элементов VIII и соседних групп периодической системы или их смесей или сплавов без носителей. Катализатор из спрессованного Ni-порошка также модифицируют добавлением 0,2 вес.% бис-(2-гидроксиэтил)сульфида. Для этого способа требуются специальная аппаратура и нестандартные катализаторы.
Во всех вышеприведенных способах полученный в результате конденсации пинаколина и п-хлорбензальдегида 4,4-диметил-1-(п-хлорфенил)пент-1-ен-3-он выделяют в виде твердого вещества, очищают и только потом во второй отдельной операции проводят его гидрирование.
Известны также такие способы получения 4,4-диметил-1-(п-хлорфенил)пентан-3-она, когда полученный в результате конденсации пинаколина и п-хлорбензальдегида 4,4-диметил-1-(п-хлорфенил)-пент-1-ен-3-он гидрируют без его выделения из реакционной смеси.
В заявке DE-OS 3824518 описан способ получения вышеупомянутого пентанона конденсацией пинаколина и п-хлорбензальдегида в присутствии концентрированного водного NaOH в среде метанола с последующим гидрированием полученного непредельного кетона без его выделения из реакционной смеси после добавления Ni-Re катализатора при повышенном давлении и температуре. По завершении гидрирования катализатор отфильтровывают, спирт отгоняют, добавляют воду. Из органического слоя получают целевой продукт. В реакцию берут 1-1,1 моль пинаколина на 1 моль п-хлор-бензальдегида, неорганическое основание (NaOH) – в количестве 10-15 эквивалент%, считая на п-хлорбензальдегид. Количество спирта такое, чтобы смесь была жидкой. Это достигается при 20-80 вес.% спирта по отношению ко всей реакционной смеси, температура на стадии конденсации предпочтительно 60-75 С. Количество катализатора (Ni-Re) 1-10 вес.%, предпочтительно 4-6 вес.%, к катализатору добавляют тиодигликоль в количестве 6-10 вес.%, считая на катализатор, давление водорода предпочтительно 100-300 бар, температура 80-120 С. Количество катализатора (Ni-Re) 1-10 вес.%, предпочтительно 4-6 вес.%, к катализатору добавляют тиодигликоль в количестве 6-10 вес.%, считая на катализатор, давление водорода предпочтительно 100-300 бар, температура 80-120 С. Целевой продукт очищают перегонкой, выход 91%, чистота 96%.
В DE Pat. №4004031 описан способ получения 1-(4-хлорфенил)-4,4-диметил-пентан-3-она взаимодействием пинаколина и 4-хлорбензальдегида в присутствии водного NaOH, ксилола или толуола при t=100-125 С. Целевой продукт очищают перегонкой, выход 91%, чистота 96%.
В DE Pat. №4004031 описан способ получения 1-(4-хлорфенил)-4,4-диметил-пентан-3-она взаимодействием пинаколина и 4-хлорбензальдегида в присутствии водного NaOH, ксилола или толуола при t=100-125 С с последующим гидрированием образующегося 1-(4-хлорфенил)-4,4-диметил-пентен-1-ен-3-она без его выделения в присутствии Ni-Re и также в присутствии ксилола или толуола (давление 5-15 бар, t=75-100 С с последующим гидрированием образующегося 1-(4-хлорфенил)-4,4-диметил-пентен-1-ен-3-она без его выделения в присутствии Ni-Re и также в присутствии ксилола или толуола (давление 5-15 бар, t=75-100 С). В данном способе на 1 моль п-хлорбензальдегида берется 1-3 моля пинаколина. Выход продукта (I) 90,3%, чистота 97%. Недостатком является необходимость использования разбавленных растворов реагентов, избытка пинаколина, а также дополнительной процедуры переливания продукта конденсации в ксилольном растворе из одного реактора в другой.
В Международной заявке WO 00/44703 описан новый способ получения 1-(4-хлорфенил)-4,4-диметилпентан-3-она путем алкилирования пинаколина п-хлорбензилхлоридом, причем пинаколин является не только реагентом, но и растворителем. Алкилирование проводят либо в присутствии сильного основания, либо в присутствии катализатора межфазного переноса. Для реакции необходим 10-50-кратный избыток пинаколина. Пока этот способ пригоден лишь для применения в лабораторных условиях. При увеличении масштабов процесса возникают трудности с получением индивидуального целевого продукта, т.е. увеличивается количество побочных продуктов.
Сущность настоящего изобретения состоит в усовершенствовании описанных выше методов получения 4,4-диметил-1-(4-хлорфенил)-пентан-3-она, включающих конденсацию пинаколина и п-хлорбензальдегида в среде органического растворителя в присутствии концентрированного водного раствора NaOH с последующим гидрированием полученного непредельного кетона без его выделения в присутствии катализатора Ni-Re при повышенной температуре и давлении.
Отличительными признаками способа в соответствии с настоящим изобретением являются проведение конденсации в среде водного бутилового спирта (16% объемных воды), а также проведение гидрирования полученного непредельного кетона в отсутствие растворителя, т.е. в его расплаве, с использованием минимального количества катализатора Ni-Re, а именно 0,4-1 вес.% от веса кетона (III). Конденсацию проводят с использованием эквимолярных количеств пинаколина и п-хлорбензальдегида при t=75-80 С). В данном способе на 1 моль п-хлорбензальдегида берется 1-3 моля пинаколина. Выход продукта (I) 90,3%, чистота 97%. Недостатком является необходимость использования разбавленных растворов реагентов, избытка пинаколина, а также дополнительной процедуры переливания продукта конденсации в ксилольном растворе из одного реактора в другой.
В Международной заявке WO 00/44703 описан новый способ получения 1-(4-хлорфенил)-4,4-диметилпентан-3-она путем алкилирования пинаколина п-хлорбензилхлоридом, причем пинаколин является не только реагентом, но и растворителем. Алкилирование проводят либо в присутствии сильного основания, либо в присутствии катализатора межфазного переноса. Для реакции необходим 10-50-кратный избыток пинаколина. Пока этот способ пригоден лишь для применения в лабораторных условиях. При увеличении масштабов процесса возникают трудности с получением индивидуального целевого продукта, т.е. увеличивается количество побочных продуктов.
Сущность настоящего изобретения состоит в усовершенствовании описанных выше методов получения 4,4-диметил-1-(4-хлорфенил)-пентан-3-она, включающих конденсацию пинаколина и п-хлорбензальдегида в среде органического растворителя в присутствии концентрированного водного раствора NaOH с последующим гидрированием полученного непредельного кетона без его выделения в присутствии катализатора Ni-Re при повышенной температуре и давлении.
Отличительными признаками способа в соответствии с настоящим изобретением являются проведение конденсации в среде водного бутилового спирта (16% объемных воды), а также проведение гидрирования полученного непредельного кетона в отсутствие растворителя, т.е. в его расплаве, с использованием минимального количества катализатора Ni-Re, а именно 0,4-1 вес.% от веса кетона (III). Конденсацию проводят с использованием эквимолярных количеств пинаколина и п-хлорбензальдегида при t=75-80 С, а гидрирование при t=90-140 С, а гидрирование при t=90-140 С и давлении от 2 до 100 бар. Выход продукта 94%, чистота по ГЖХ – 98%.
Наиболее близким к настоящему изобретению является способ по заявке DE-OS 3824518. По этому способу и конденсацию и гидрирование проводят в среде метанола, который присутствует в больших количествах. И хотя в заявке-прототипе указано, что метанол является предпочтительным растворителем, именно решение задачи замены метанола из-за его высокой токсичности на другой растворитель привело к созданию более простого, экономичного, компактного и безопасного процесса, составляющего основу настоящего изобретения. Оказалось, что наилучшим растворителем для реакции конденсации пинаколина и п-хлорбензальдегида является водный бутиловый спирт, содержащий 16 объемных процентов воды (в таком соотношении бутиловый спирт и вода образуют нерасслаивающийся раствор).
Для реакции на 1+1 моль исходных веществ берут менее 1 моля водного бутанола и 10-15 эквивалент% NaOH или другого щелочного агента. В процессе реакции смесь остается жидкой, но по окончании реакции при охлаждении осаждается кристаллический продукт, который практически не содержит примесей и может быть подвергнут гидрированию в расплавленном (жидком) состоянии после добавления катализатора Ni-Re.
Специальными опытами установлено, что в одинаковых условиях гидрирование непредельного кетона (III), полученного в водном бутаноле, протекает в 2 раза быстрее, чем гидрирование непредельного кетона, полученного в метаноле, при том что в первом случае брали в 2 раза меньше катализатора. Оказалось, что полученный в водном бутаноле непредельный кетон можно гидрировать с большой скоростью, даже если количество катализатора составляет от 0,4 до 1 вес.% по отношению к кетону. Выделение конечного продукта (пентанона (I)) также не представляет трудностей, так как предельный кетон (I) является жидким при комнатной температуре, и небольшое количество катализатора легко отфильтровывается. Процесс гидрирования осуществляется в отсутствие тиодигликолей, ибо реакция протекает без заметного образования пробочных продуктов.
Методом ГЖХ-МС установлено, что содержание дехлорированного продукта в полученном 1-(4-хлорфенил)-4,4-диметилпентаноне не превышает 1,2%, а содержание продукта конденсации (III) – не более 0,8%. Продукт восстановления карбонильной группы отсутствует.
Далее следуют примеры, иллюстрирующие, но не ограничивающие изобретение.
ПРИМЕРЫ
Пример 1
Смесь 420 г (95%) пинаколина, 242 г водного бутанола (16% объемных воды) и 46 г 45% водного NaOH нагревают в атмосфере инертного газа при перемешивании до 60 С и давлении от 2 до 100 бар. Выход продукта 94%, чистота по ГЖХ – 98%.
Наиболее близким к настоящему изобретению является способ по заявке DE-OS 3824518. По этому способу и конденсацию и гидрирование проводят в среде метанола, который присутствует в больших количествах. И хотя в заявке-прототипе указано, что метанол является предпочтительным растворителем, именно решение задачи замены метанола из-за его высокой токсичности на другой растворитель привело к созданию более простого, экономичного, компактного и безопасного процесса, составляющего основу настоящего изобретения. Оказалось, что наилучшим растворителем для реакции конденсации пинаколина и п-хлорбензальдегида является водный бутиловый спирт, содержащий 16 объемных процентов воды (в таком соотношении бутиловый спирт и вода образуют нерасслаивающийся раствор).
Для реакции на 1+1 моль исходных веществ берут менее 1 моля водного бутанола и 10-15 эквивалент% NaOH или другого щелочного агента. В процессе реакции смесь остается жидкой, но по окончании реакции при охлаждении осаждается кристаллический продукт, который практически не содержит примесей и может быть подвергнут гидрированию в расплавленном (жидком) состоянии после добавления катализатора Ni-Re.
Специальными опытами установлено, что в одинаковых условиях гидрирование непредельного кетона (III), полученного в водном бутаноле, протекает в 2 раза быстрее, чем гидрирование непредельного кетона, полученного в метаноле, при том что в первом случае брали в 2 раза меньше катализатора. Оказалось, что полученный в водном бутаноле непредельный кетон можно гидрировать с большой скоростью, даже если количество катализатора составляет от 0,4 до 1 вес.% по отношению к кетону. Выделение конечного продукта (пентанона (I)) также не представляет трудностей, так как предельный кетон (I) является жидким при комнатной температуре, и небольшое количество катализатора легко отфильтровывается. Процесс гидрирования осуществляется в отсутствие тиодигликолей, ибо реакция протекает без заметного образования пробочных продуктов.
Методом ГЖХ-МС установлено, что содержание дехлорированного продукта в полученном 1-(4-хлорфенил)-4,4-диметилпентаноне не превышает 1,2%, а содержание продукта конденсации (III) – не более 0,8%. Продукт восстановления карбонильной группы отсутствует.
Далее следуют примеры, иллюстрирующие, но не ограничивающие изобретение.
ПРИМЕРЫ
Пример 1
Смесь 420 г (95%) пинаколина, 242 г водного бутанола (16% объемных воды) и 46 г 45% водного NaOH нагревают в атмосфере инертного газа при перемешивании до 60 С и при этой температуре в токе инертного газа прибавляют 576 г (98%) 4-хлорбензальдегида в течение 30 мин. Затем реакционную смесь перемешивают 2 часа при 75-80 С и при этой температуре в токе инертного газа прибавляют 576 г (98%) 4-хлорбензальдегида в течение 30 мин. Затем реакционную смесь перемешивают 2 часа при 75-80 С, охлаждают до 10-15 С, охлаждают до 10-15 С и полученную суспензию фильтруют. ГЖХ-анализ пробы осадка показывает содержание 99,9% продукта конденсации. После этого к осадку добавляют влажный катализатор Ni-Re (в расчете на 8 г сухого Ni/Re) и при температуре 110 С и полученную суспензию фильтруют. ГЖХ-анализ пробы осадка показывает содержание 99,9% продукта конденсации. После этого к осадку добавляют влажный катализатор Ni-Re (в расчете на 8 г сухого Ni/Re) и при температуре 110 С и давлении 80 бар пропускают водород в течение 35 минут. Далее катализатор отфильтровывают и получают 831 г 1-(4-хлорфенил)4,4-диметилпентан-3-она (97,4% чистоты по ГЖХ). Выход – 94,2% от теоретического.
Пример 2
По примеру 1, отличающийся тем, что гидрирование проводят в присутствии 6 г катализатора Ni-Re при температуре 90 С и давлении 80 бар пропускают водород в течение 35 минут. Далее катализатор отфильтровывают и получают 831 г 1-(4-хлорфенил)4,4-диметилпентан-3-она (97,4% чистоты по ГЖХ). Выход – 94,2% от теоретического.
Пример 2
По примеру 1, отличающийся тем, что гидрирование проводят в присутствии 6 г катализатора Ni-Re при температуре 90 С и давлении 90 бар в течение 50 мин. Получают 883 г 1-(4-хлорфенил)-4,4-диметилпентан-3-она (98% чистоты по ГЖХ). Выход – 93,9% от теоретического.
Пример 3
По примеру 1, отличающийся тем, что гидрирование проводят в присутствии 6 г катализатора Ni-Re при температуре 120 С и давлении 90 бар в течение 50 мин. Получают 883 г 1-(4-хлорфенил)-4,4-диметилпентан-3-она (98% чистоты по ГЖХ). Выход – 93,9% от теоретического.
Пример 3
По примеру 1, отличающийся тем, что гидрирование проводят в присутствии 6 г катализатора Ni-Re при температуре 120 С и давлении 50 бар в течение 60 мин. Получают 882 г 1-(4-хлорфенил)-4,4-диметилпентан-3-она (98,0% чистоты по ГЖХ). Выход – 93,8% от теоретического.
Пример 4
По примеру 1, отличающийся тем, что гидрирование проводят в присутствии 5 г катализатора Ni-Re при температуре 100 С и давлении 50 бар в течение 60 мин. Получают 882 г 1-(4-хлорфенил)-4,4-диметилпентан-3-она (98,0% чистоты по ГЖХ). Выход – 93,8% от теоретического.
Пример 4
По примеру 1, отличающийся тем, что гидрирование проводят в присутствии 5 г катализатора Ni-Re при температуре 100 С и давлении 30 бар в течение 80 мин. Получают 891 г 1-(4-хлорфенил)-4,4-диметилпентан-3-она (97,2% чистоты по ГЖХ). Выход – 94,0% от теоретического.
Пример 5
По примеру 1, отличающийся тем, что гидрирование проводят в присутствии катализатора Ni-Re при температуре 140 С и давлении 30 бар в течение 80 мин. Получают 891 г 1-(4-хлорфенил)-4,4-диметилпентан-3-она (97,2% чистоты по ГЖХ). Выход – 94,0% от теоретического.
Пример 5
По примеру 1, отличающийся тем, что гидрирование проводят в присутствии катализатора Ni-Re при температуре 140 С и давлении 6 бар в течение 360 мин. Получают 895 г 1-(4-хлорфенил)-4,4-диметилпентан-3-она (96,5% чистоты по ГЖХ). Выход – 93,7% от теоретического. С и давлении 6 бар в течение 360 мин. Получают 895 г 1-(4-хлорфенил)-4,4-диметилпентан-3-она (96,5% чистоты по ГЖХ). Выход – 93,7% от теоретического.

Формула изобретения 1. Способ получения 4,4-диметил-1-(п-хлорфенил)пентан-3-она, включающий конденсацию пинаколина и п-хлорбензальдегида в присутствии щелочи в среде алифатического спирта с последующим гидрированием полученного 4,4-диметил-1-(п-хлорфенил)пент-1-ен-3-она в присутствии катализатора Ni-Re при повышенной температуре и давлении водорода, отличающийся тем, что в качестве алифатического спирта используют водный бутиловый спирт, а процесс гидрирования проводят в расплавленном 4,4-диметил-1-(п-хлорфенил)пент-1-ен-3-оне. 2. Способ по п.1, отличающийся тем, что водный бутиловый спирт содержит 16 об.% воды. 3. Способ по п.1, отличающийся тем, что Ni-Re добавляют в количестве 0,4-1% от количества непредельного кетона. 4. Способ по п.1, отличающийся тем, что процесс гидрирования проводят при температуре 90-140  С и давлении 2-100 бар. С и давлении 2-100 бар.
|
||||||||||||||||||||||||||
