Патент на изобретение №2228178
|
||||||||||||||||||||||||||
(54) ИММУНОДЕПРЕССАНТ
(57) Реферат: Предложено: применение трис-(2-гидроксиэтил)аммониевой соли 1-бензилиндолил-3-тиоуксусной кислоты в качестве иммунодепрессанта, ранее известной как стабилизатор клеточных мембран. Изобретение расширяет арсенал средств заявленного назначения. 3 табл. Изобретение относится к новым биологически активным веществам из класса алканкарбоновых кислот и может быть использовано в медицине и биологии в качестве основы для создания лекарственных препаратов. Известен ряд иммунодепрессантов, полученных из растительного сырья. Например, известно применение густого экстракта корня солодки в качестве иммунодепрессанта (патент РФ № 2003340, А 61 К 35/78, 1993). Недостатком данного иммунодепрессанта является необходимость тестирования каждой партии сырья и узкий диапазон терапевтической дозы препарата. От указанного недостатка свободны иммунодепрессанты синтетической природы. Известен синтетический иммунодепрессант – азатиаприн (М.Д. Машковский. Лекарственные средства. Ч.2, М.: Медицина, 1987, стр. 175-177) Недостатком этого иммунодепрессанта является угнетающее влияние на кроветворение. С целью расширения арсенала синтетических средств, обладающих иммунодепрессивными свойствами, предлагается использовать трис-(2-гидроксиэтил)аммониевую соль 1-бензилиндолил-3-тиоуксусной кислоты в качестве иммунодепрессанта. Трис-(2-гидроксиэтил)аммониевая соль 1-бензилиндолил-3-тиоуксусной кислоты обладает свойствами стабилизатора клеточных мембран (Клиническая эффективность и безопасность цефалоспориновых антибиотиков производства ООО “АБОЛмед”. Сб. трудов НИИКИ, АГМУ и МКБ, Новосибирск, 2002, стр. 179). Сущность изобретения заключается в том, что было изучено влияние трис-(2-гидроксиэтил)аммониевой соли 1-бензилиндолил-3-тиоуксусной кислоты на первичный и вторичный гуморальный и клеточный иммунный ответ у мышей (in vivo), а также влияние трис-(2-гидроксиэтил)аммониевой соли 1-бензилиндолил-3-тиоуксусной кислоты на пролиферацию спленоцитов мышей in vitro. В работе использовали здоровых половозрелых животных мышей-гибридов (CBA  C57BL/6)F1 (CBF1) обоего пола, 8-10 недельного возраста, массой тела 18-20 г. Разброс в группах по исходной массе тела не превышал ±10%. Контрольные и опытные животные одного возраста получены одновременно из одного питомника (“Рассвет”, г. Томск). До и в период эксперимента контрольные и опытные животные содержались в виварии в одинаковых условиях: стандартных пластиковых клетках с мелкой древесной стружкой (не более 10 особей) на стандартном рационе. Все исследования проводились в одно и то же время суток (утром).
Данные обрабатывались по непараметрическому критерию U Вилкоксона-Манна-Уитни.
Пример 1. Количество IgM и IgG антителообразующих клеток (АОК) in vivo
Опытной группе животных соединение вводили в дозе 30 мг/кг (1/100 LD50) внутрибрюшинно ежедневно в течение 5 дней в объеме 0,5 мл. Контрольным животным в таком же объеме и режиме вводили растворитель (воду). В день последнего введения соединения животных иммунизировали внутривенно эритроцитами барана (ЭБ) в дозе 0,5 C57BL/6)F1 (CBF1) обоего пола, 8-10 недельного возраста, массой тела 18-20 г. Разброс в группах по исходной массе тела не превышал ±10%. Контрольные и опытные животные одного возраста получены одновременно из одного питомника (“Рассвет”, г. Томск). До и в период эксперимента контрольные и опытные животные содержались в виварии в одинаковых условиях: стандартных пластиковых клетках с мелкой древесной стружкой (не более 10 особей) на стандартном рационе. Все исследования проводились в одно и то же время суток (утром).
Данные обрабатывались по непараметрическому критерию U Вилкоксона-Манна-Уитни.
Пример 1. Количество IgM и IgG антителообразующих клеток (АОК) in vivo
Опытной группе животных соединение вводили в дозе 30 мг/кг (1/100 LD50) внутрибрюшинно ежедневно в течение 5 дней в объеме 0,5 мл. Контрольным животным в таком же объеме и режиме вводили растворитель (воду). В день последнего введения соединения животных иммунизировали внутривенно эритроцитами барана (ЭБ) в дозе 0,5 107/мышь. Количество IgM АОК в селезенке мышей оценивали на 4-е сутки после иммунизации по количеству локальных зон гемолиза в полужидкой среде модифицированным методом (Cunningham, 1968). Влияние соединения оценивали на индуктивную фазу IgM антителообразования. Для определения IgG АОК (Cunningham, 1968; Dresser, Wortis, 1965) первичную иммунизацию проводили внутрибрюшинно, вторичную – внутривенно в дозе 0,5 107/мышь. Количество IgM АОК в селезенке мышей оценивали на 4-е сутки после иммунизации по количеству локальных зон гемолиза в полужидкой среде модифицированным методом (Cunningham, 1968). Влияние соединения оценивали на индуктивную фазу IgM антителообразования. Для определения IgG АОК (Cunningham, 1968; Dresser, Wortis, 1965) первичную иммунизацию проводили внутрибрюшинно, вторичную – внутривенно в дозе 0,5 107 ЭБ/мышь. Для оценивания величины гуморального иммунного ответа подсчитывали количество IgG АОК в селезенке мышей на пике иммунного ответа методом локального гемолиза. Клетки селезенки инкубировали 2 часа при 39 107 ЭБ/мышь. Для оценивания величины гуморального иммунного ответа подсчитывали количество IgG АОК в селезенке мышей на пике иммунного ответа методом локального гемолиза. Клетки селезенки инкубировали 2 часа при 39 С в камерах с ЭБ, комплементом морской свинки и кроличьей антисывороткой против мышиного IgG (разведение в 2000 раз). Зоны гемолиза подсчитывали под увеличением С в камерах с ЭБ, комплементом морской свинки и кроличьей антисывороткой против мышиного IgG (разведение в 2000 раз). Зоны гемолиза подсчитывали под увеличением  42. 42.
 Как видно из данных таблицы 1, соединение достоверно ингибирует первичный и вторичный гуморальный иммунный ответ.
Пример 2. Реакция гиперчувствительности замедленного типа (ГЗТ) in vivo
Опытной группе животных соединение вводили в дозе 30 мг/кг (1/100 LD50) внутрибрюшинно ежедневно в течение 5 дней в объеме 0,5 мл. В день последнего введения соединения мышей сенсибилизировали внутрибрюшинным введением 0,25% ЭБ в объеме 0,5 мл; на 4-е сутки после сенсибилизации вводили разрешающую дозу антигена под подошвенный апоневроз правой задней лапы (50% ЭБ в объеме 50 мкл). В контрлатеральную лапу вводили растворитель в том же объеме. Контрольным животным в таком же объеме и режиме вводили растворитель соединения (воду). Реакцию ГЗТ оценивали по методике локальной ГЗТ (Crowle, 1975). Учет реакции производили через 24 часа после введения разрешающей дозы ЭБ, величину отека оценивали штангенциркулем. Результаты выражали в процентах или абсолютных значениях.
Как видно из данных таблицы 1, соединение достоверно ингибирует первичный и вторичный гуморальный иммунный ответ.
Пример 2. Реакция гиперчувствительности замедленного типа (ГЗТ) in vivo
Опытной группе животных соединение вводили в дозе 30 мг/кг (1/100 LD50) внутрибрюшинно ежедневно в течение 5 дней в объеме 0,5 мл. В день последнего введения соединения мышей сенсибилизировали внутрибрюшинным введением 0,25% ЭБ в объеме 0,5 мл; на 4-е сутки после сенсибилизации вводили разрешающую дозу антигена под подошвенный апоневроз правой задней лапы (50% ЭБ в объеме 50 мкл). В контрлатеральную лапу вводили растворитель в том же объеме. Контрольным животным в таком же объеме и режиме вводили растворитель соединения (воду). Реакцию ГЗТ оценивали по методике локальной ГЗТ (Crowle, 1975). Учет реакции производили через 24 часа после введения разрешающей дозы ЭБ, величину отека оценивали штангенциркулем. Результаты выражали в процентах или абсолютных значениях.
 Как видно из данных таблицы 2, трис-(2-гидроксиэтил)аммониевая соль 1-бензилиндолил-3-тиоуксусной кислоты на 28% подавляет Г3Т.
Пример 3. Спонтанная, Con А- PWM-индуцированная пролиферация клеток селезенки
Клетки селезенки мышей культивировали в круглодонных планшетах для иммунологических реакций (“Linbro”) при +37
Как видно из данных таблицы 2, трис-(2-гидроксиэтил)аммониевая соль 1-бензилиндолил-3-тиоуксусной кислоты на 28% подавляет Г3Т.
Пример 3. Спонтанная, Con А- PWM-индуцированная пролиферация клеток селезенки
Клетки селезенки мышей культивировали в круглодонных планшетах для иммунологических реакций (“Linbro”) при +37 С в атмосфере 5% CO2 и 95% воздуха. Абсолютное количество клеток, вносимых в лунку, составляло 200000. Клетки стимулировали митогенами конканавалином А (Con A, Sigma) или митогеном лаконоса (PWM, Sigma). Концентрации митогенов подбирались предварительным титрованием и использовались в оптимальной дозе, что составило для Con A 2 мкг/мл, а для PWM – 1 мкг/мл. Соединение в трех дозах вносили в лунки одновременно с митогенами. Пролиферативную активность клеток оценивали по включению Н3-тимидина в ДНК делящихся клеток. Метку вносили за 16 час до конца культивирования по 1 мкКи в каждую лунку планшета. Для этого основной раствор Н3-тимидина сначала растворяли в среде RPMI-1640 до концентрации 100 мкКи/мл, а затем по 10 мкл раствора добавляли в каждую лунку планшета. По окончании инкубации клетки собирали на стеклянно-волокнистые фильтры (“Flow Lab”) с помощью аппарата Harvester (“Titertek”). Фильтры высушивали и помещали во флаконы для сцинтилляционного счета и радиоактивность подсчитывали в толуольном сцинтилляторе (4 г дифенилоксазола, 0,1 г дифенил-оксазолилбензола на 1 л толуола) в жидкостном сцинтилляционном счетчике “Delta” (США). Результаты выражали в имп/мин включенного тимидина на 2 С в атмосфере 5% CO2 и 95% воздуха. Абсолютное количество клеток, вносимых в лунку, составляло 200000. Клетки стимулировали митогенами конканавалином А (Con A, Sigma) или митогеном лаконоса (PWM, Sigma). Концентрации митогенов подбирались предварительным титрованием и использовались в оптимальной дозе, что составило для Con A 2 мкг/мл, а для PWM – 1 мкг/мл. Соединение в трех дозах вносили в лунки одновременно с митогенами. Пролиферативную активность клеток оценивали по включению Н3-тимидина в ДНК делящихся клеток. Метку вносили за 16 час до конца культивирования по 1 мкКи в каждую лунку планшета. Для этого основной раствор Н3-тимидина сначала растворяли в среде RPMI-1640 до концентрации 100 мкКи/мл, а затем по 10 мкл раствора добавляли в каждую лунку планшета. По окончании инкубации клетки собирали на стеклянно-волокнистые фильтры (“Flow Lab”) с помощью аппарата Harvester (“Titertek”). Фильтры высушивали и помещали во флаконы для сцинтилляционного счета и радиоактивность подсчитывали в толуольном сцинтилляторе (4 г дифенилоксазола, 0,1 г дифенил-оксазолилбензола на 1 л толуола) в жидкостном сцинтилляционном счетчике “Delta” (США). Результаты выражали в имп/мин включенного тимидина на 2 105 клеток, представлены средние данные по триплету. 105 клеток, представлены средние данные по триплету.
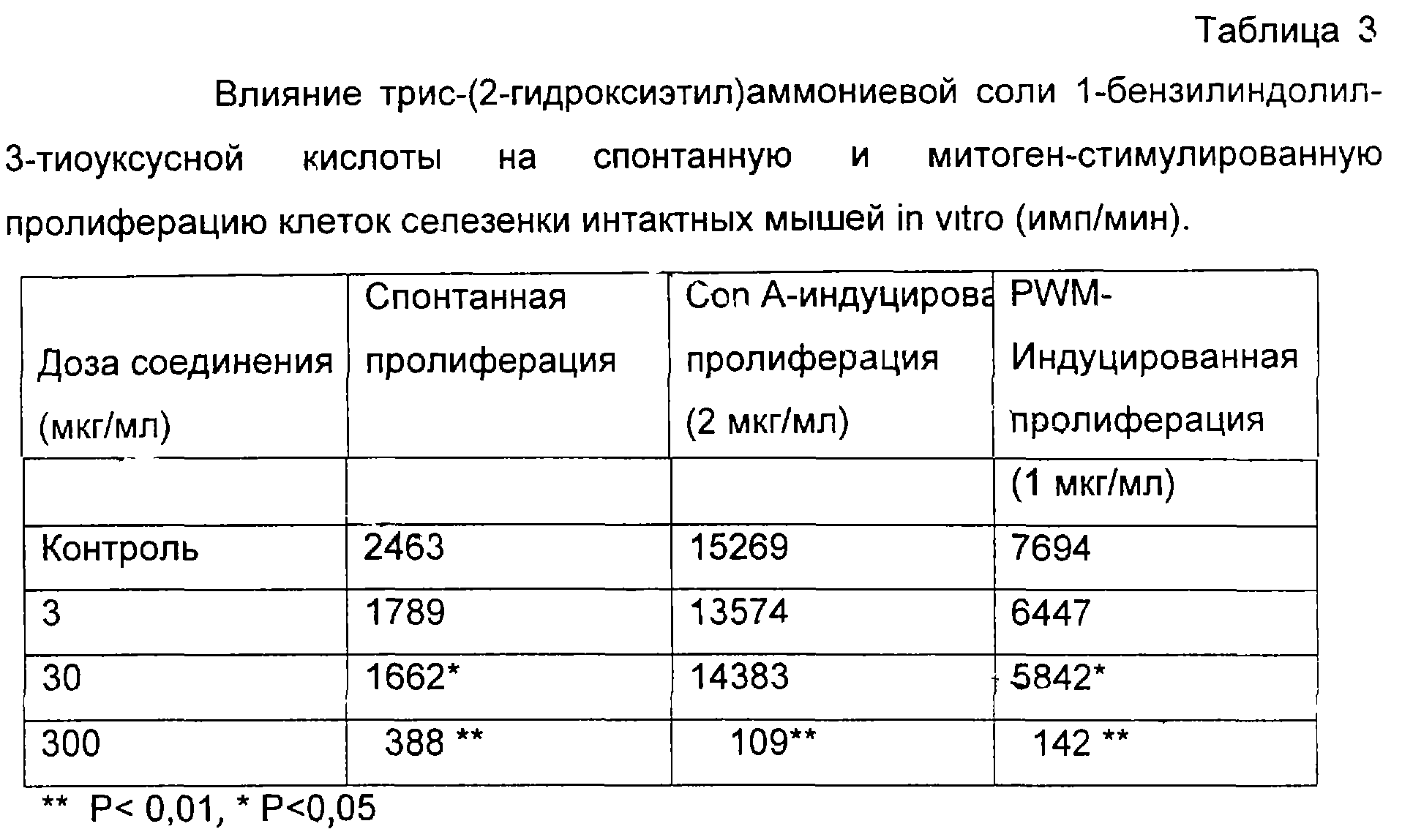 Как видно из данных, соединение проявляет выраженные дозозависимые ингибирующие свойства на спонтанную и митоген-стимулированную пролиферацию интактных клеток селезенки мышей.
Оценивая в целом результаты можно отметить, что по свойствам подавлять первичный и вторичный гуморальный иммунный ответ, ГЗТ in vivo, спонтанную и стимулированную пролиферацию клеток in vitro, трис-(2-гидроксиэтил)аммониевая соль 1-бензилиндолил-3-тиоуксусной кислоты может быть отнесена к иммунодепрессантам.
Приведенные примеры иллюстрируют наличие у трис-(2-гидроксиэтил)аммониевой соли 1-бензилиндолил-3-тиоуксусной кислоты иммунодепрессивных свойств, что позволит в будущем создавать на ее основе лекарственные средства для лечения аутоиммунных, лимфопролиферативных и аллергических заболеваний.
Как видно из данных, соединение проявляет выраженные дозозависимые ингибирующие свойства на спонтанную и митоген-стимулированную пролиферацию интактных клеток селезенки мышей.
Оценивая в целом результаты можно отметить, что по свойствам подавлять первичный и вторичный гуморальный иммунный ответ, ГЗТ in vivo, спонтанную и стимулированную пролиферацию клеток in vitro, трис-(2-гидроксиэтил)аммониевая соль 1-бензилиндолил-3-тиоуксусной кислоты может быть отнесена к иммунодепрессантам.
Приведенные примеры иллюстрируют наличие у трис-(2-гидроксиэтил)аммониевой соли 1-бензилиндолил-3-тиоуксусной кислоты иммунодепрессивных свойств, что позволит в будущем создавать на ее основе лекарственные средства для лечения аутоиммунных, лимфопролиферативных и аллергических заболеваний.
Формула изобретения Применение трис-(2-гидроксиэтил)аммониевой соли 1-бензилиндолил-3-тиоуксусной кислоты в качестве иммунодепрессанта. |
||||||||||||||||||||||||||
