Патент на изобретение №2228148
|
||||||||||||||||||||||||||
(54) СПОСОБ ПОСЛЕОПЕРАЦИОННОГО ОБЕЗБОЛИВАНИЯ БОЛЬНЫХ С ПАКРЕОНЕКРОЗОМ ПОСЛЕ ОМЕНТОБУРСОСТОМИИ С МНОГОКРАТНЫМИ ПРОГРАММИРОВАННЫМИ САНАЦИОННЫМИ РЕЛАПАРОТОМИЯМИ
(57) Реферат: Изобретение относится к медицине, к хирургии, анестезиологии и реаниматологии и может быть использовано для послеоперационного обезболивания больных с панкреонекрозом после оментобурсостомии с многократными программированными санационными релапаротомиями. Данный способ лечения включает эпидуральную анальгезию, нестероидные противовоспалительные средства, опиаты, даларгин, спазмолитики, адъювантную терапию, при этом обезболивание подразделяют на 4 этапа с учетом порядка и количества санационных релапаротомий, причем обезболивание на каждом этапе производят с учетом назначений на предыдущих этапах, синергизма и пролонгации обезболивающего действия, степени интенсивности болевого синдрома на этапах хирургического лечения. Заявленное изобретение позволяет эффективно купировать болевой синдром при сохранении функциональной активности пациентов. 3 табл. Настоящее изобретение относится к анестезиологии и реаниматологии, а именно к способам послеоперационного обезболивания больных с панкреонекрозом после оментобурсостомии с многократными программированными санационнными релапаротомиями, включающий эпидуральную анальгезию, нестероидные противовоспалительные средства, опиаты, даларгин, спазмолитики, адъювантную терапию. 1. Известно, что: – послеоперационное обезболивание у хирургических больных, перенесших обширные оперативные вмешательства, является важнейшим компонентом интенсивной терапии послеоперационного периода. Современное представление о механизмах болевого синдрома отводит ведущую роль в модуляции боли биологически активным веществам – медиаторам (серотонину, цитокинам, субстанции Р, лейкотриенам, простагландинам), выделяющимся в месте повреждения тканей и стимулирущих полимодальные ноцицепторы. В ряду хирургических патологий наиболее проблемными являются хирургические больные, прооперированные по поводу деструктивных панкреатитов. Среди способов хирургических вмешательств при панкреонекрозе наиболее тяжелыми являются оментобурсостомия с последующими плановыми санационными релапаротомиями. Продолжительность этапных хирургических вмешательств достигает от 21 до 43 дней. Основным симптомом острого панкреатита является боль. Боли носят интенсивный характер, без светлых промежутков. Иногда больные даже теряют сознание. В ряде ситуаций резкий болевой синдром может приводить к явлениям коллапса и шока: профузный пот, снижение артериального давления, тахикардия с ослаблением пульса. Болевой синдром поддерживается четырьмя источниками болевой импульсации – кожным, глубоким соматическим, висцеральным и гуморальным, а они, в свою очередь, вызывают рефлекторный сосудистый спазм, образуя порочный круг, ведущий в конечном итоге к общей и органной гиподинамии и развитию разного рода осложнений: мышечная слабость, нарушение пищеварения, парез кишечника, нарушение бронхиальной проводимости, гиповентиляция, тахикардия, аритмии сердца, гиповолемия, секвестрация эритроцитов, тромбозы и эмболии, олигурия, спазм сфинктеров полых органов, ателектазы и пневмония. Купирование болевого синдрома на этапах лечения деструктивных панкреатитов проводится с учетом основных факторов медиации боли, степени выраженности системной воспалительной реакции на конкретный период лечения больных. Оно должно быть малотоксичным, не оказывать выраженного депримирующего действия на жизненно важные органы и системы организма. Считается, что наркотические анальгетики являются основным средством лечения сильных болевых синдромов [1]. После обширных внутриполостных хирургических вмешательств для достижения адекватного обезболивания нередко требуется использование опиоидов в дозах, вызывающих выраженный седативный эффект, угнетение дыхания, тошноту, рвоту, парез ЖКТ, дисфункцию желче- и мочевыводящих путей. Это негативно сказывается на состоянии оперированных больных, затрудняет их активизацию, способствует развитию респираторных, тромбоэмболических и других осложнений. Учитывая, что хирургическое лечение деструктивных панкреатитов требует частых санационных релапаротомий, вопрос о толерантности и зависимости от наркотических анальгетиков становится актуальным. В этой связи требуется дополнительно к опиатам применять лекарственные препараты других фармакологических групп, способных потенцировать обезболивающий эффект наркотических анальгетиков. Наиболее патогенетически обоснованным является применение анальгетиков с противовоспалительным действием [2]. См: [1]. Порядок и сроки назначения наркотических анальгетиков. Методические указания №2001/129. МЗРФ МНИОИ им. П.А. Герцена. Автор: профессор Н.А.Осипова. Учреждение-разработчик: Московский научно-исследовательский онкологический институт им. П.А. Герцена. /Типография ООО “ЛАКУС”. 107140, г. Москва, Леснорядский пер., д.18, стр.1./ Москва, 2001 г., стр.3-4; 10-12. [2]. Клиническая анестезиология. /Оборудование и мониторинг. Регионарная анестезия. Лечение боли. Дж. Эдвард Морган – мл., Мэгид С. Михаил. /Перевод с английского под ред. Академика РАМН А.А. Бунятяна, канд. Мед. наук А.М. Цейтлина./ Department of Anesthesiology University of Southern California School of Medicine Los Angeles/. Издательство Бином, Москва, 2001 г., стр.170-172. II. Также известно, что: – основными свойствами нестероидных противовоспалительных препаратов являются противовоспалительное, жаропонижающее, анальгетическое. Кроме того, нестероидные противовоспалительные препараты последнего поколения (кеторол, диклофенак, ксифокам и другие) отличаются опиоид-сберегающим эффектом. В то же время ульцерогенный характер нестероидных противовоспалительных препаратов не позволяет их пролонгированное использование в послеоперационном периоде у хирургических больных на этапах лечения панкреонекрозов свыше 5-7 дней. Необходим прерывистый курс назначения нестероидных противовоспалительных препаратов в зависимости от выраженности системной воспалительной реакции. Кеторолак трометамин заметно выделяется в данной группе нестероидных противовоспалительных препаратов своей аналгетической активностью. Основа механизма аналгетического и противовоспалительного действия – угнетение синтеза простагландинов в травматизированных тканях. Кеторолак, ингибируя циклооксигеназу, препятствует образованию медиаторов боли, таких как брадикинин, гистамин, субстанция Р и др. Он не связывается с опиоидными рецепторами. Кеторолак назначают в суточной дозе 90-120 мг в сочетании с опиоидным анальгетиком, назначенным “по – показаниям”. См: Фармакотерапия острой боли. Р.Н. Лебедева, В.В. Никода. РНЦХ РАМН /М., Издательство “Аир Арт”, 1998 г., стр.44-47; 66. III. Также известно, что: – эпидуральная аналгезия по своему механизму действия способна предотвратить влияние трех компонентов болевой импульсации: кожного, глубокого соматического и висцерального. Симпатолитические эффекты эпидуральной аналгезии способствуют снятию рефлекторного вазоспазма, усилению кишечной перистальтики, увеличению перфузии органов и тканей, что наиболее важно у хирургических больных с панкреонекрозом [1]. Эпидуральная анестезия местными анестетиками благоприятно сказывалось на супрессии эндокринных и обменных сдвигов, вызванных операцией [2]. Применение продленной перидуральной анестезии в лечении острого панкреатита не только эффективно тормозит пусковой механизм патофизиологического процесса, но, воздействуя на многие звенья патогенеза, позволяет значительно сократить количество фармакологических средств, уменьшить их дозировку, снизить отрицательные эффекты полипрогмазии, не уменьшая эффективности лечения [3]. У больных с панкреатитом эпидуральная аналгезия полностью купирует болевой синдром, снимает висцеральный вазоспазм, спазм сфинктера Одди, панкреатических и желчных протоков, за счет чего увеличивается перфузия поджелудочной железы, ускоряется нормализация амилазы крови и мочи. Пункция и катетеризация эпидурального пространства проводится на уровне Th 7-8. Доза вводимого анестетика определяется необходимостью блокады 7-8 сегментов спинного мозга (Th 5-12) из расчета 1,2-2,0 мл/сегм. Обычно используют 6-10 мл 2% раствора лидокаина или анекаин 25 мг  4 раза/сут [1].
См: [1]. Спинномозговая и эпидуральная анестезия. В.А. Корячкин, В.И. Страшнов /Кафедра анестезиологии, реаниматологии и интенсивной терапии Санкт-Петербургского Государственного Медицинского Университета им. акад. И.П. Павлова/ СПб.: Изд-во ООО “Санкт-Петербургское медицинское издательство”, 2000 г., стр.73-75; 70.
[2]. Послеоперационная боль. Под редакцией Ф.Майкла Ферранте, М.Д., Тимоти Р. ВейдБонкора, М.Д., Перевод с английского проф. М.А. Карачунского, к.м.н. У.В. Мельниковой. /Department of Anesthesia Harvard Medical School, Pain Management Center Department of Anesthesia Brigham and Women 4 раза/сут [1].
См: [1]. Спинномозговая и эпидуральная анестезия. В.А. Корячкин, В.И. Страшнов /Кафедра анестезиологии, реаниматологии и интенсивной терапии Санкт-Петербургского Государственного Медицинского Университета им. акад. И.П. Павлова/ СПб.: Изд-во ООО “Санкт-Петербургское медицинское издательство”, 2000 г., стр.73-75; 70.
[2]. Послеоперационная боль. Под редакцией Ф.Майкла Ферранте, М.Д., Тимоти Р. ВейдБонкора, М.Д., Перевод с английского проф. М.А. Карачунского, к.м.н. У.В. Мельниковой. /Department of Anesthesia Harvard Medical School, Pain Management Center Department of Anesthesia Brigham and Women s Hospital Boston, Massachusetts./ Москва, Медицина, 1998 г., стр.94-95; 557.
[3]. Регионарная анестезия – возвращение в будущее. (Сборник материалов научно-практической конференции по проблемам регионарной анестезии). Москва, 2001 г., статья: “Продленная перидуральная анестезия в комплексной терапии острого панкреатита” Ввозный К.П., Мишустин И.В., Образцова Е.Н. ГКБ “Электроника”, отделение анестезиологии и реаниматологии, г. Воронеж (зав. отделением С.Л. Автомонов), стр.69-70.
IV. Также известно, что:
– гуморальный компонент болевой импульсации при панкреонекрозе может быть купирован радом других ингибиторов биологически активных веществ.
С этой целью используется пептидный препарат даларгин, который тормозит внутриклеточные процессы синтеза панкреатических ферментов, снижает базальную и стимулированную секрецию поджелудочной железы, угнетает синтез кининов, устраняет расстройства внутриорганной микрогемолимфоциркуляции, отграничивает очаги некроза [1].
Радиоиммунным методом установлено, что период Т 1/2 даларгина in vivo равен 2 мин. Дополнительные исследования с использованием метода ядерного магнитного резонанса уточнили фармакокинетику даларгина: период Т 1/2 в плазме крови составляет 14 мин. При распаде даларгина в организме образуются вещества, способные связываться с опиоидными рецепторами. Радиорецепторные исследования показали, что даларгин является агонистом опиатных рецепторов. Он имеет высокую аффинность к дельта-рецепторам, меньшую – к мю-рецепторам и не связывается с каппа- и сигма-рецепторами [2].
По имеющимся данным даларгин вводят в дозе 75 мкг на 1 кг массы тела на 20 мл физиологического раствора в течение 4-6 дней, 2-3 раза внутривенно [1].
Сандостатин – длительно действующий синтетический октапептид, который обладает радом преимуществ по сравнению с естественным соматостатином: подавляет желудочную секрецию, образование ферментов поджелудочной железы. Показано, что соматостатин и его синтетический аналог октреотид ацетат (сандостатин) являются сильнейшими ингибиторами базальной и стимулированной секреции поджелудочной железы, желудка и тонкой кишки, регуляторами активности иммунной системы и цитокиногенеза, спланхнического кровотока, что наряду с цитопротективным эффектом препаратов обусловливает их патогенетическое применение в лечении больных с панкреонекрозом. Сандостатин используют в суточной дозе 300-600 мкг/сут при трехкратном подкожном или внутривенном введении. Терапия препаратами соматостатина является обоснованным методом профилактики и патогенетического лечения деструктивного панкреатита у больных с высоким риском развития экстраабдоминальных (сердечно-легочных, почечных, стресс-кровотечений) системных осложнений в ранние сроки заболевания [4].
Ингибирование ферментов достигается внутривенным или внутричревным введением: контрикала, трасилола, гордокса. Ингибиторы протеаз ингибируют активность протеолитических ферментов, образуя с ними стойкие комплексы. Данные препараты подавляют образование кининов и аутолиз путем инактивации трипсина, каллекреина, химотрипсина и плазмина, ингибируют фибринолиз, тормозят активность каллекреина в ткани железы, угнетают общую метаболическую активность паренхимы железы, активно влияют на микроциркуляцию и насыщение кислородом тканей, ингибируют ферменты непосредственно в поджелудочной железе [1], [3]. Для ликвидации энзимной токсинемии применяют ингибиторы протеаз: контрикал до 150 тыс. КИЕ/сут; гордокс до 500-700 тыс. КИЕ/сут и др. Таким образом, положительный клинический эффект ингибиторов обусловлен только инактивацией ферментов, циркулирующих в крови и лимфе больного панкреатитом. Однако широкое применение их сдерживается высокой стоимостью препаратов [3].
См: [1] “Актуальные вопросы клинической медицины”. Сборник научных работ, посвященных 20-летию городской Клинической больницы №15 города Москвы. Под ред. проф. Е.М. Евсикова, статья: “Панкреонекроз. Выбор лечения в зависимости от причины и стадии заболевания”. Нестеренко Ю.А., Лаптев В.В., Михайлусов С.В., Шаповальнц С.Г., Бурова В.А., Гридчик И.Е., Захаренко Н.В., Тронин Р.Ю., Иманалиев М.Р./Издательство Институт молодежи, 111395, Москва, ул. Юности, 5/1/, Москва, 2001 г., стр.250-252.
[2] “Регуляторные пептиды в лечении хирургических заболеваний органов брюшной полости”. В.А. Пенин. Московский ордена Трудового Красного Знамени медицинский стоматологический институт им. Н.А. Семашко./Типография Воениздата./Москва, 1992 г., стр.5-9; 18, 20-23.
[3] “Панкреонекроз” (клиника, диагностика, лечение). Ю.А. Нестеренко, С.Г. Шаповальнц, В.В. Лаптев. Городская Клиническая больница №15 города Москвы. /Орехово-Зуевская типография, г. Орехово-Зуево, Московская обл., ул. Дзержинского, д. 1/, Москва, 1994 г., стр.127-129; 152-155.
[4] “Острый панкреатит. Пособие для врачей”. Под редакцией акад. В.С. Савельева, М.И. Филимонов, Б.Р. Гельфанд, С.З. Бурневич, Б.Б. Орлов, Е.Ц. Цыденжапов. Российский Государственный Медицинский Университет. Кафедра факультетской хирургии с курсом анестезиологии-реаниматологии и курсом сердечно-сосудистой хирургии ФУВ. /Издательство НЦССХ им. А.Н. Бакулева РАМН/ Москва, 2000 г., стр.33.
Целью изобретения является обезболивание при сохранении функциональной активности пациентов, использование минимального арсенала взаимопотенцирующих анальгетических средств различной направленности действия и сокращение потребности в опиатах вплоть до их исключения.
Эта цель достигается тем, что обезболивание подразделяют на этапы с учетом порядка и количества санационных релапаротомий, причем обезболивание на каждом этапе производят с учетом назначений на предыдущих этапах, синергизма и пролонгации обезболивающего действия, степени интенсивности болевого синдрома на этапах хирургического лечения: на первом этапе – от оментобурсостомии до I-й санационной релапаротомии, – проводят непрерывную инфузию даларгина в дозе 0,6-0,8 мг/кг/сут в сочетании с нестероидными противовоспалительными средствами, ингибиторами протеаз, спазмолитиками, при необходимости опиаты; на втором этапе – от первой санационной релапаротомии – до II-III-й санационной релапаротомии – добавляют эпидуральную анальгезию местными анестетиками, исключая нестероидные противовоспалительные средства; на III-м этапе – от второй-третьей до четвертой-шестой санационной релапаротомии, – отказываются от наркотических анальгетиков и ингибиторов протеаз; на IV-м этапе – после шестой санационной релапаротомии и при последующих санационных релапаротомиях – обезболивание обеспечивают исключительно внутримышечным введением даларгина в дозе 0,25-0,3 мг/кг/сут и нестероидными противовоспалительными средствами.
Сущность настоящего изобретения поясняется следующим конкретными примерами:
Пример 1
Больная С., 86 лет, поступила в 6 хир. отделение 4 гор. б-цы 8.11.01. с клиническим диагнозом: “геморрагический панкреонекроз”.
Анамнез болезни: заболела остро 7.11.01 г., когда появились боли в животе, постепенно усиливающиеся.
Этиология: хронический калькулезный холецистит. Нарушение диеты.
Пациентка обследована в стационаре: 1) 9.11.01. УЗИ брюшной полости: диффузные изменения печени, хронический калькулезный холецистит. Острый панкреатит. Умеренное количество жидкости в брюшной полости.
2) 9.11.01, Лапароскопическое дренирование брюшной полости. Диагноз: смешанный панкреонекроз.
После лечебно-диагностической лапароскопии больная переведена в ОРИТ 9.11.2001 г. для предоперационной подготовки.
При поступлении в ОРИТ у больной сохранялся выраженный болевой синдром, который оценивался по ВАШ в 5,0 баллов; балл аналгезии составлял 3,5 балла. Тип гемодинамики – гипокинетический. При анализе КЩС выявлены сдвиги в сторону компенсированного метаболического ацидоза. У больной отмечалось превалирование активности симпатоадреналовой системы: индекс Кердо = +18, тяжесть состояния оценивалась по интегральным шкалам: АРАСНЕ II 11 баллов (15% прогнозируемая летальность), Ranson – 2 балла (<1% прогнозируемая летальность).
Больной была назначена разработанная в нашей клинике схема комплексной послеоперационной аналгезии (СКПА): даларгин в дозе 0,6 мг/кг/сут + кеторол 30 мг/2 раза/сут + октреотид 0,1 мг/сут + контрикал 30 мг s Hospital Boston, Massachusetts./ Москва, Медицина, 1998 г., стр.94-95; 557.
[3]. Регионарная анестезия – возвращение в будущее. (Сборник материалов научно-практической конференции по проблемам регионарной анестезии). Москва, 2001 г., статья: “Продленная перидуральная анестезия в комплексной терапии острого панкреатита” Ввозный К.П., Мишустин И.В., Образцова Е.Н. ГКБ “Электроника”, отделение анестезиологии и реаниматологии, г. Воронеж (зав. отделением С.Л. Автомонов), стр.69-70.
IV. Также известно, что:
– гуморальный компонент болевой импульсации при панкреонекрозе может быть купирован радом других ингибиторов биологически активных веществ.
С этой целью используется пептидный препарат даларгин, который тормозит внутриклеточные процессы синтеза панкреатических ферментов, снижает базальную и стимулированную секрецию поджелудочной железы, угнетает синтез кининов, устраняет расстройства внутриорганной микрогемолимфоциркуляции, отграничивает очаги некроза [1].
Радиоиммунным методом установлено, что период Т 1/2 даларгина in vivo равен 2 мин. Дополнительные исследования с использованием метода ядерного магнитного резонанса уточнили фармакокинетику даларгина: период Т 1/2 в плазме крови составляет 14 мин. При распаде даларгина в организме образуются вещества, способные связываться с опиоидными рецепторами. Радиорецепторные исследования показали, что даларгин является агонистом опиатных рецепторов. Он имеет высокую аффинность к дельта-рецепторам, меньшую – к мю-рецепторам и не связывается с каппа- и сигма-рецепторами [2].
По имеющимся данным даларгин вводят в дозе 75 мкг на 1 кг массы тела на 20 мл физиологического раствора в течение 4-6 дней, 2-3 раза внутривенно [1].
Сандостатин – длительно действующий синтетический октапептид, который обладает радом преимуществ по сравнению с естественным соматостатином: подавляет желудочную секрецию, образование ферментов поджелудочной железы. Показано, что соматостатин и его синтетический аналог октреотид ацетат (сандостатин) являются сильнейшими ингибиторами базальной и стимулированной секреции поджелудочной железы, желудка и тонкой кишки, регуляторами активности иммунной системы и цитокиногенеза, спланхнического кровотока, что наряду с цитопротективным эффектом препаратов обусловливает их патогенетическое применение в лечении больных с панкреонекрозом. Сандостатин используют в суточной дозе 300-600 мкг/сут при трехкратном подкожном или внутривенном введении. Терапия препаратами соматостатина является обоснованным методом профилактики и патогенетического лечения деструктивного панкреатита у больных с высоким риском развития экстраабдоминальных (сердечно-легочных, почечных, стресс-кровотечений) системных осложнений в ранние сроки заболевания [4].
Ингибирование ферментов достигается внутривенным или внутричревным введением: контрикала, трасилола, гордокса. Ингибиторы протеаз ингибируют активность протеолитических ферментов, образуя с ними стойкие комплексы. Данные препараты подавляют образование кининов и аутолиз путем инактивации трипсина, каллекреина, химотрипсина и плазмина, ингибируют фибринолиз, тормозят активность каллекреина в ткани железы, угнетают общую метаболическую активность паренхимы железы, активно влияют на микроциркуляцию и насыщение кислородом тканей, ингибируют ферменты непосредственно в поджелудочной железе [1], [3]. Для ликвидации энзимной токсинемии применяют ингибиторы протеаз: контрикал до 150 тыс. КИЕ/сут; гордокс до 500-700 тыс. КИЕ/сут и др. Таким образом, положительный клинический эффект ингибиторов обусловлен только инактивацией ферментов, циркулирующих в крови и лимфе больного панкреатитом. Однако широкое применение их сдерживается высокой стоимостью препаратов [3].
См: [1] “Актуальные вопросы клинической медицины”. Сборник научных работ, посвященных 20-летию городской Клинической больницы №15 города Москвы. Под ред. проф. Е.М. Евсикова, статья: “Панкреонекроз. Выбор лечения в зависимости от причины и стадии заболевания”. Нестеренко Ю.А., Лаптев В.В., Михайлусов С.В., Шаповальнц С.Г., Бурова В.А., Гридчик И.Е., Захаренко Н.В., Тронин Р.Ю., Иманалиев М.Р./Издательство Институт молодежи, 111395, Москва, ул. Юности, 5/1/, Москва, 2001 г., стр.250-252.
[2] “Регуляторные пептиды в лечении хирургических заболеваний органов брюшной полости”. В.А. Пенин. Московский ордена Трудового Красного Знамени медицинский стоматологический институт им. Н.А. Семашко./Типография Воениздата./Москва, 1992 г., стр.5-9; 18, 20-23.
[3] “Панкреонекроз” (клиника, диагностика, лечение). Ю.А. Нестеренко, С.Г. Шаповальнц, В.В. Лаптев. Городская Клиническая больница №15 города Москвы. /Орехово-Зуевская типография, г. Орехово-Зуево, Московская обл., ул. Дзержинского, д. 1/, Москва, 1994 г., стр.127-129; 152-155.
[4] “Острый панкреатит. Пособие для врачей”. Под редакцией акад. В.С. Савельева, М.И. Филимонов, Б.Р. Гельфанд, С.З. Бурневич, Б.Б. Орлов, Е.Ц. Цыденжапов. Российский Государственный Медицинский Университет. Кафедра факультетской хирургии с курсом анестезиологии-реаниматологии и курсом сердечно-сосудистой хирургии ФУВ. /Издательство НЦССХ им. А.Н. Бакулева РАМН/ Москва, 2000 г., стр.33.
Целью изобретения является обезболивание при сохранении функциональной активности пациентов, использование минимального арсенала взаимопотенцирующих анальгетических средств различной направленности действия и сокращение потребности в опиатах вплоть до их исключения.
Эта цель достигается тем, что обезболивание подразделяют на этапы с учетом порядка и количества санационных релапаротомий, причем обезболивание на каждом этапе производят с учетом назначений на предыдущих этапах, синергизма и пролонгации обезболивающего действия, степени интенсивности болевого синдрома на этапах хирургического лечения: на первом этапе – от оментобурсостомии до I-й санационной релапаротомии, – проводят непрерывную инфузию даларгина в дозе 0,6-0,8 мг/кг/сут в сочетании с нестероидными противовоспалительными средствами, ингибиторами протеаз, спазмолитиками, при необходимости опиаты; на втором этапе – от первой санационной релапаротомии – до II-III-й санационной релапаротомии – добавляют эпидуральную анальгезию местными анестетиками, исключая нестероидные противовоспалительные средства; на III-м этапе – от второй-третьей до четвертой-шестой санационной релапаротомии, – отказываются от наркотических анальгетиков и ингибиторов протеаз; на IV-м этапе – после шестой санационной релапаротомии и при последующих санационных релапаротомиях – обезболивание обеспечивают исключительно внутримышечным введением даларгина в дозе 0,25-0,3 мг/кг/сут и нестероидными противовоспалительными средствами.
Сущность настоящего изобретения поясняется следующим конкретными примерами:
Пример 1
Больная С., 86 лет, поступила в 6 хир. отделение 4 гор. б-цы 8.11.01. с клиническим диагнозом: “геморрагический панкреонекроз”.
Анамнез болезни: заболела остро 7.11.01 г., когда появились боли в животе, постепенно усиливающиеся.
Этиология: хронический калькулезный холецистит. Нарушение диеты.
Пациентка обследована в стационаре: 1) 9.11.01. УЗИ брюшной полости: диффузные изменения печени, хронический калькулезный холецистит. Острый панкреатит. Умеренное количество жидкости в брюшной полости.
2) 9.11.01, Лапароскопическое дренирование брюшной полости. Диагноз: смешанный панкреонекроз.
После лечебно-диагностической лапароскопии больная переведена в ОРИТ 9.11.2001 г. для предоперационной подготовки.
При поступлении в ОРИТ у больной сохранялся выраженный болевой синдром, который оценивался по ВАШ в 5,0 баллов; балл аналгезии составлял 3,5 балла. Тип гемодинамики – гипокинетический. При анализе КЩС выявлены сдвиги в сторону компенсированного метаболического ацидоза. У больной отмечалось превалирование активности симпатоадреналовой системы: индекс Кердо = +18, тяжесть состояния оценивалась по интегральным шкалам: АРАСНЕ II 11 баллов (15% прогнозируемая летальность), Ranson – 2 балла (<1% прогнозируемая летальность).
Больной была назначена разработанная в нашей клинике схема комплексной послеоперационной аналгезии (СКПА): даларгин в дозе 0,6 мг/кг/сут + кеторол 30 мг/2 раза/сут + октреотид 0,1 мг/сут + контрикал 30 мг  2 раза/сут + баралгин 5 мл 2 раза/сут + баралгин 5 мл  4 раза/сут. Через 12 ч от начала применения СКПА у больной отмечен позитивный терапевтический эффект аналгезии, характеризующейся снижением интенсивности болевого синдрома и улучшением функциональных методов оценки ноцицепции. На 2-е сутки от момента поступления в ОРИТ ликвидированы явления панкреатогенной токсемии. В отсроченном порядке больной выполнена оментобурсостомия: 12.11.01. Интраоперационно: стеатонекроз, в области малого сальника, корня мезоколон. Грубые некрозы в области головки и хвоста черного цвета.
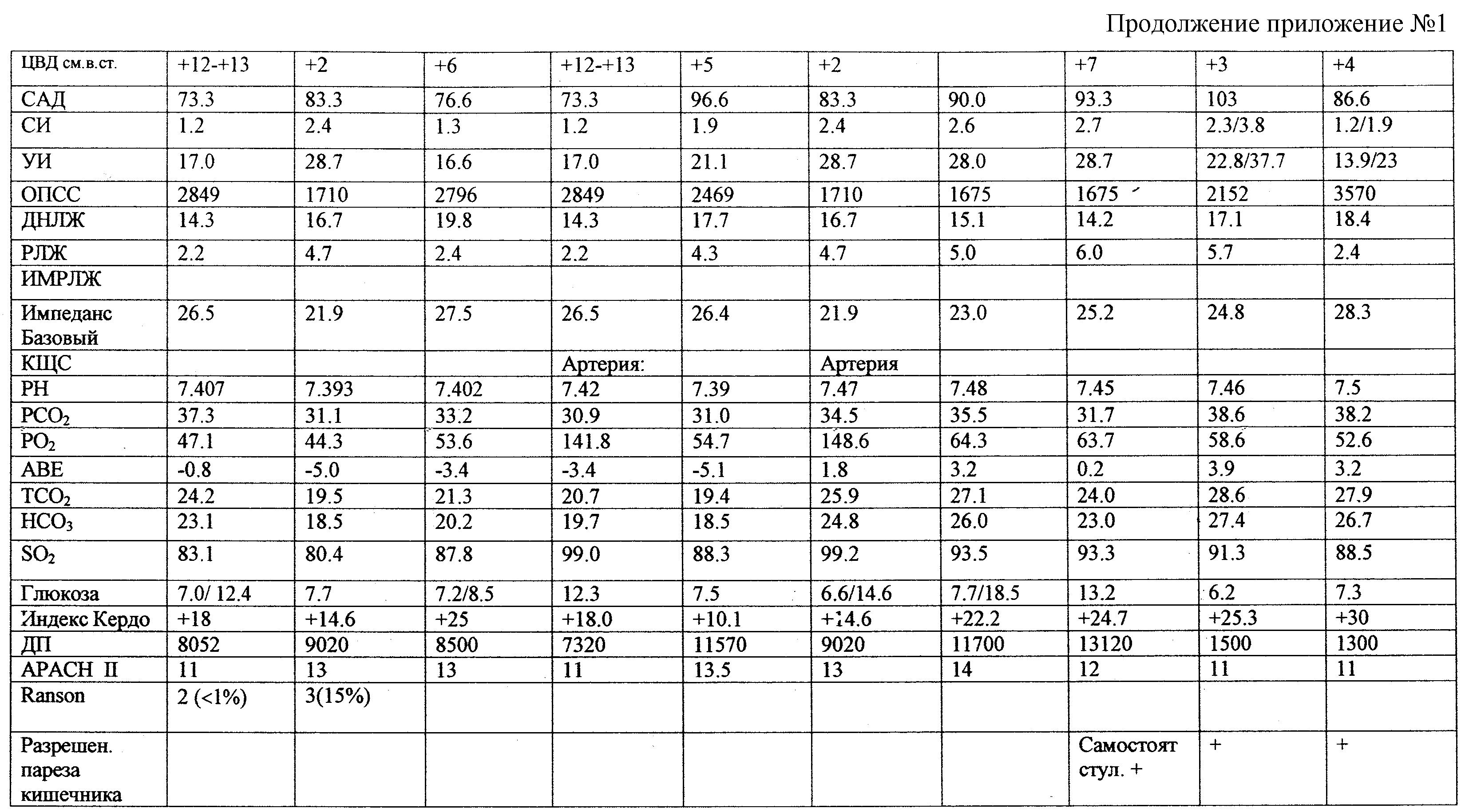
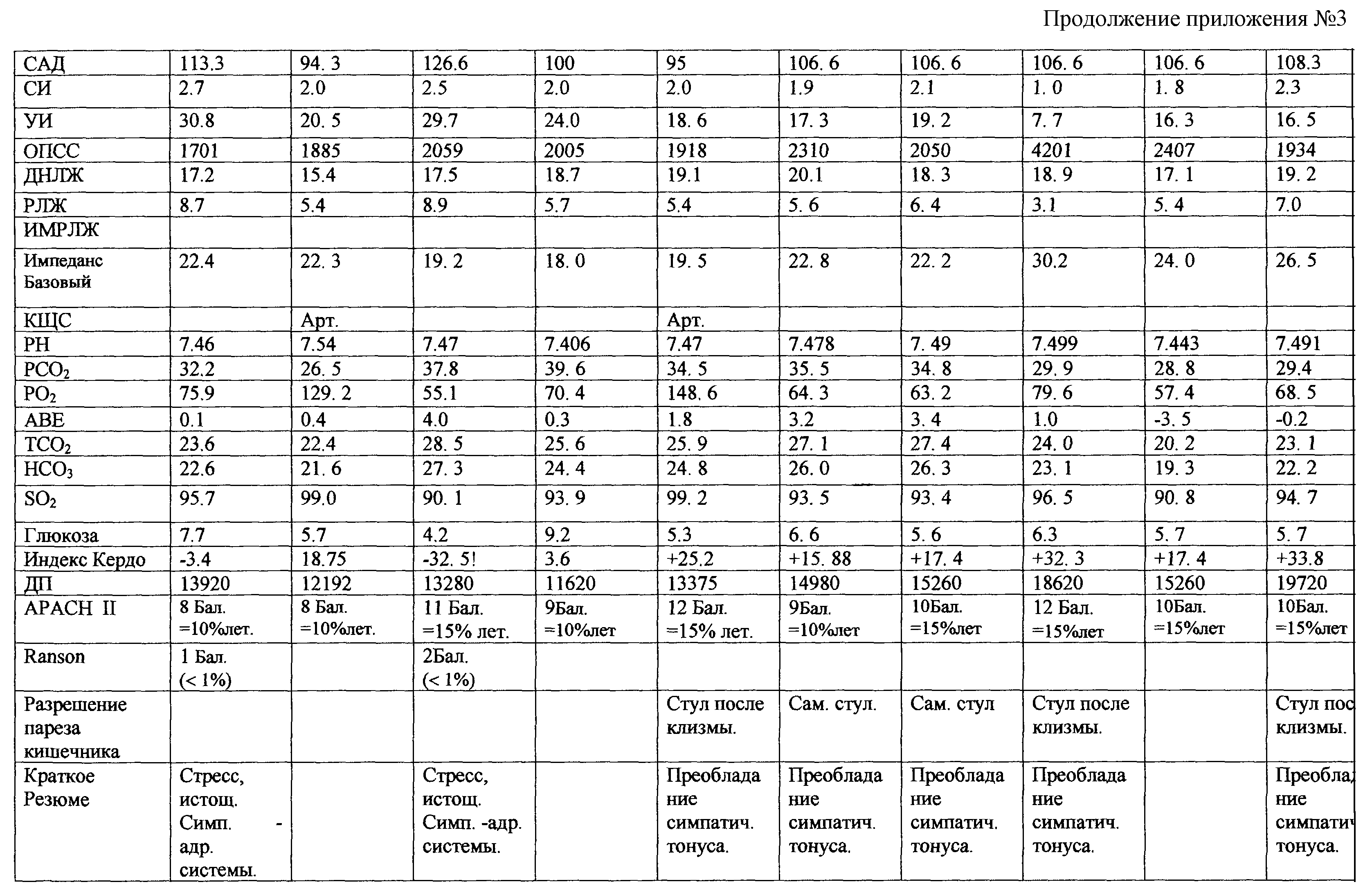
После оперативного вмешательства, в условиях отделения реанимации, больной продолжена инфузионно-корригирующая терапия, с назначением полного парентерального питания и продолжением этапной СКПА. Изменения в состоянии больной, уровень аналгезии, ответная реакция сердечно-сосудистой системы и гомеостаза в целом представлены в таблице “Карта послеоперационного обезболивания в ОРИТ” (приложение №1).
Необходимо отметить, что на данном этапе удовлетворительный уровень аналгезии: ВАШ=2,5-3,0 балла; балл аналгезии = 4-4,5 балла, хорошие показатели сенсометрии: Т.П.=1,25-2,5 мА; БП=5-10 мА и выше обеспечивался за счет второго этапа СКПА: эпидуральной аналгезии: анекаин 25 мг 4 раза/сут. Через 12 ч от начала применения СКПА у больной отмечен позитивный терапевтический эффект аналгезии, характеризующейся снижением интенсивности болевого синдрома и улучшением функциональных методов оценки ноцицепции. На 2-е сутки от момента поступления в ОРИТ ликвидированы явления панкреатогенной токсемии. В отсроченном порядке больной выполнена оментобурсостомия: 12.11.01. Интраоперационно: стеатонекроз, в области малого сальника, корня мезоколон. Грубые некрозы в области головки и хвоста черного цвета.
После оперативного вмешательства, в условиях отделения реанимации, больной продолжена инфузионно-корригирующая терапия, с назначением полного парентерального питания и продолжением этапной СКПА. Изменения в состоянии больной, уровень аналгезии, ответная реакция сердечно-сосудистой системы и гомеостаза в целом представлены в таблице “Карта послеоперационного обезболивания в ОРИТ” (приложение №1).
Необходимо отметить, что на данном этапе удовлетворительный уровень аналгезии: ВАШ=2,5-3,0 балла; балл аналгезии = 4-4,5 балла, хорошие показатели сенсометрии: Т.П.=1,25-2,5 мА; БП=5-10 мА и выше обеспечивался за счет второго этапа СКПА: эпидуральной аналгезии: анекаин 25 мг  4 раза/сут + даларгин 0,6 мг/кг/сут + октреотид 0,1 мг/сут + контрикал 30 мг 4 раза/сут + даларгин 0,6 мг/кг/сут + октреотид 0,1 мг/сут + контрикал 30 мг  2 раза/сут. Введения наркотических анальгетиков не потребовалось.
За время наблюдения в ОРИТ больной было выполнено несколько программированных санационных релапаротомий. 16.11.01 – санационная релапаротомия I. /Интраоперационно: остаются некрозы головки pancreas, c переходом на малый сальник, в хвосте – свежих некрозов нет/; 21.11.01 – санационная релапаротомия II.
На третьем этапе – от первой санационной релапаротомии до второй санационной релапаротомии (16.11.2001 – 21.11.2001 г.) разработанной в нашей клинике схемы комплексной послеоперационной аналгезии (СКПА) удовлетворительный уровень аналгезии: ВАШ: 2,5-3,0 баллов; балл аналгезии: 4 балла; стабильные показатели сенсометрии: ТП=1,5-2 мА, БП=10 мА и выше обеспечивались за счет: эпидуральной аналгезии – анекаин 25 мг 2 раза/сут. Введения наркотических анальгетиков не потребовалось.
За время наблюдения в ОРИТ больной было выполнено несколько программированных санационных релапаротомий. 16.11.01 – санационная релапаротомия I. /Интраоперационно: остаются некрозы головки pancreas, c переходом на малый сальник, в хвосте – свежих некрозов нет/; 21.11.01 – санационная релапаротомия II.
На третьем этапе – от первой санационной релапаротомии до второй санационной релапаротомии (16.11.2001 – 21.11.2001 г.) разработанной в нашей клинике схемы комплексной послеоперационной аналгезии (СКПА) удовлетворительный уровень аналгезии: ВАШ: 2,5-3,0 баллов; балл аналгезии: 4 балла; стабильные показатели сенсометрии: ТП=1,5-2 мА, БП=10 мА и выше обеспечивались за счет: эпидуральной аналгезии – анекаин 25 мг  4 раза/сут + даларгин 0,6 мг/кг/сут + баралгин 5 мл 4 раза/сут + даларгин 0,6 мг/кг/сут + баралгин 5 мл  4 раза/сут. 21.11.2001 года эпид. катетер удален.
На четвертом этапе после второй санационной релапаротомии и при последующих санационных релапаротомиях: с 22.11.2001 года анестезия обеспечивалась в/м введением даларгина в дозе 5 мг 4 раза/сут. 21.11.2001 года эпид. катетер удален.
На четвертом этапе после второй санационной релапаротомии и при последующих санационных релапаротомиях: с 22.11.2001 года анестезия обеспечивалась в/м введением даларгина в дозе 5 мг  4 раза/сут и кеторола 30 мг 4 раза/сут и кеторола 30 мг  2 раза/сут.
Клинико-лабораторная динамика эффективности послеоперационного обезболивания на этапах программированных релапаротомий у больной Степановой Л.С. представлена в таблице “Карта послеоперационного обезболивания в ОРИТ”, см. приложение №1.
22.11.01, после 13-ти дневного пребывания в ОРИТ пациентка переведена в 6 хирур. отд. в удовлетворительном состоянии. Выписана домой 28.12.01 г., состояние при выписке вполне удовлетворительное.
Пример 2
Больная П., 58 лет, поступила в 6 хир. отделение 4 гор. б-цы 25.01.02 с диагнозом: “инфицированный панкреонекроз”.
Анамнез болезни: в течение 2-х недель боли в правом подреберье. Усиление болей в течение последних 3-х дней (22.01.02 – 25.01.02), подъем температуры до 38,5 2 раза/сут.
Клинико-лабораторная динамика эффективности послеоперационного обезболивания на этапах программированных релапаротомий у больной Степановой Л.С. представлена в таблице “Карта послеоперационного обезболивания в ОРИТ”, см. приложение №1.
22.11.01, после 13-ти дневного пребывания в ОРИТ пациентка переведена в 6 хирур. отд. в удовлетворительном состоянии. Выписана домой 28.12.01 г., состояние при выписке вполне удовлетворительное.
Пример 2
Больная П., 58 лет, поступила в 6 хир. отделение 4 гор. б-цы 25.01.02 с диагнозом: “инфицированный панкреонекроз”.
Анамнез болезни: в течение 2-х недель боли в правом подреберье. Усиление болей в течение последних 3-х дней (22.01.02 – 25.01.02), подъем температуры до 38,5 С; ознобы, тошнота, рвота.
Этиология: хронический калькулезный холецистит. Нарушение диеты.
Объективно: пальпируется инфильтрат в правом подреберье.
Больная поступила в ОРИТ после выполненной в отсроченном порядке оментобурсостомии 28.01.02. При поступлении в ОРИТ у больной сохранялся выраженный болевой синдром, который оценивался по ВАШ в 4,5 баллов; балл аналгезии составлял 4 балла. Тип гемодинамики – нормокинетический. При анализе КЩС сдвигов в сторону компенсированного метаболического ацидоза или алкалоза не выявлено. У больной отмечалось превалирование активности симпатоадреналовой системы: индекс Кердо = +26, тяжесть состояния оценивалась по интегральным шкалам: АРАСНЕ II – 13 баллов (10% прогнозируемая летальность); Ranson – 2 балла (<1% прогнозируемой летальности), через 48 ч – 3 балла (15% прогнозируемая летальность).
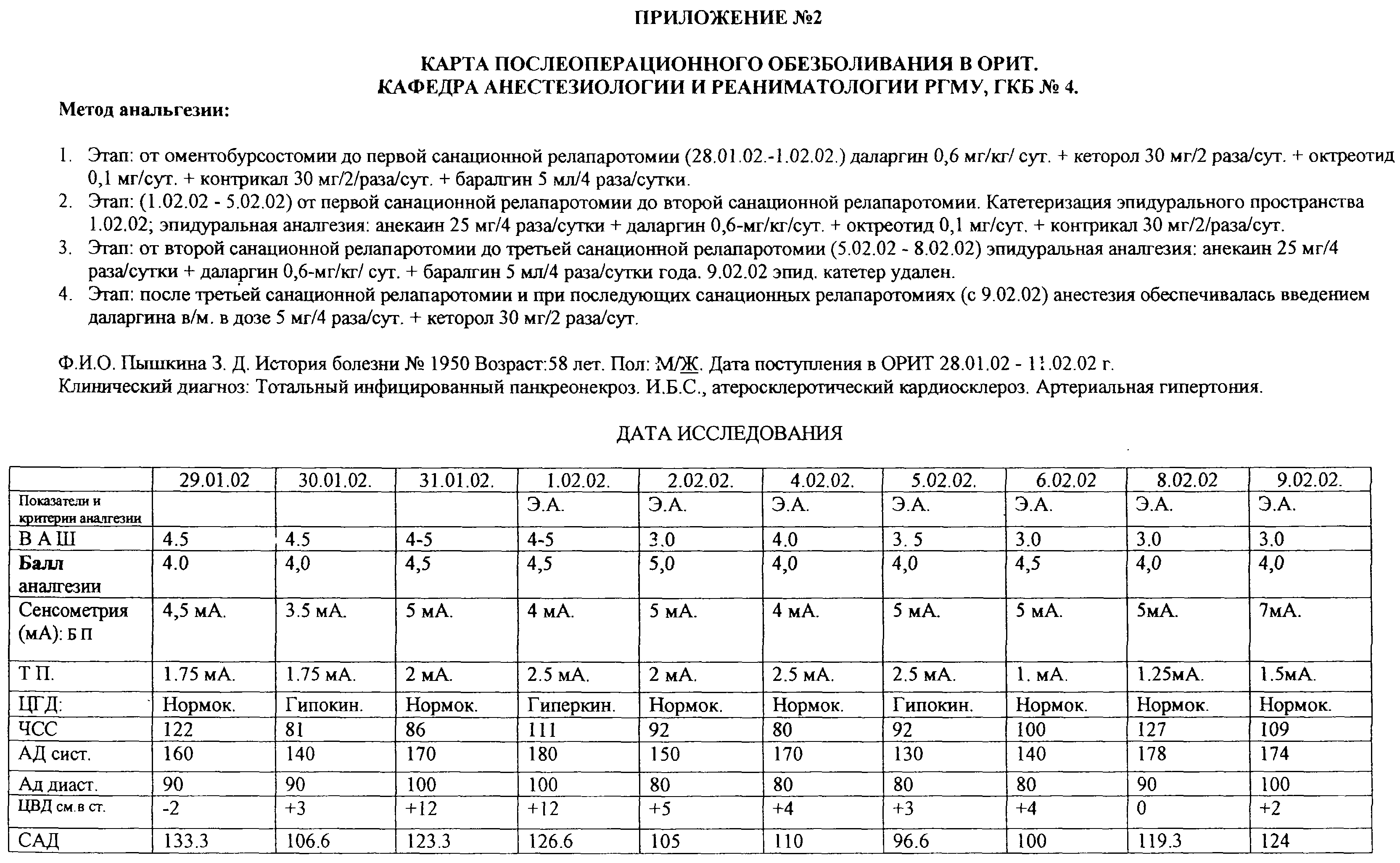
Послеоперационное обезболивание на этапах программированных релапаротомий у больной Пышкиной З.Д. представлено в таблице “Карта послеоперационного обезболивания в ОРИТ”, см. приложение №2.
Больной была назначена разработанная в нашей клинике схема комплексной послеоперационной аналгезии (СКПА): даларгин в дозе 0,6 мг/кг/сут + кеторол 30 мг/2 раза/сут + октреотид 0,1 мг/сут + контрикал 30 мг С; ознобы, тошнота, рвота.
Этиология: хронический калькулезный холецистит. Нарушение диеты.
Объективно: пальпируется инфильтрат в правом подреберье.
Больная поступила в ОРИТ после выполненной в отсроченном порядке оментобурсостомии 28.01.02. При поступлении в ОРИТ у больной сохранялся выраженный болевой синдром, который оценивался по ВАШ в 4,5 баллов; балл аналгезии составлял 4 балла. Тип гемодинамики – нормокинетический. При анализе КЩС сдвигов в сторону компенсированного метаболического ацидоза или алкалоза не выявлено. У больной отмечалось превалирование активности симпатоадреналовой системы: индекс Кердо = +26, тяжесть состояния оценивалась по интегральным шкалам: АРАСНЕ II – 13 баллов (10% прогнозируемая летальность); Ranson – 2 балла (<1% прогнозируемой летальности), через 48 ч – 3 балла (15% прогнозируемая летальность).
Послеоперационное обезболивание на этапах программированных релапаротомий у больной Пышкиной З.Д. представлено в таблице “Карта послеоперационного обезболивания в ОРИТ”, см. приложение №2.
Больной была назначена разработанная в нашей клинике схема комплексной послеоперационной аналгезии (СКПА): даларгин в дозе 0,6 мг/кг/сут + кеторол 30 мг/2 раза/сут + октреотид 0,1 мг/сут + контрикал 30 мг  2 раза/сут + баралгин 5 мл 2 раза/сут + баралгин 5 мл  4 раза/сут. Через 12 ч от начала применения СКПА у больной отмечен позитивный терапевтический эффект аналгезии, характеризующейся снижением интенсивности болевого синдрома и улучшением функциональных методов оценки ноцицепции. На 2-е сутки от момента поступления в ОРИТ ликвидированы явления панкреатогенной токсемии.
Необходимо отметить, что на данном этапе удовлетворительный уровень аналгезии: ВАШ=4,0-4,5 баллов; балл аналгезии = 4-4,5 балла, хорошие показатели сенсометрии: Т.П.= 1,75-2,5 мА; БП = 3,5-5 мА обеспечивался за счет первого этапа СКПА.
За время наблюдения в ОРИТ больной было выполнено несколько программированных санационных релапаротомий: 1.02.02 – санационная релапаротомия I; 5.02.02 – санационная релапаротомия II; 8.02.02 – санационная релапаротомия III.
После оперативного вмешательства, в условиях отделения реанимации, больной продолжена инфузионно-корригирующая терапия, с назначением полного парентерального питания и продолжением этапной СКПА.
На втором этапе от первой санационной релапаротомии до второй санационной релапаротомии (1.02.02 – 5.02.02 г.) разработанной в нашей клинике схемы комплексной послеоперационной аналгезии (СКПА) удовлетворительный уровень аналгезии: ВАШ: 3,0-3,5 баллов; балл аналгезии: 4-5 баллов; стабильные показатели сенсометрии: Т.П. = 2-2,5 мА; БП = 4-5 мА обеспечивался за счет эпидуральной аналгезии: анекаин 25 мг 4 раза/сут. Через 12 ч от начала применения СКПА у больной отмечен позитивный терапевтический эффект аналгезии, характеризующейся снижением интенсивности болевого синдрома и улучшением функциональных методов оценки ноцицепции. На 2-е сутки от момента поступления в ОРИТ ликвидированы явления панкреатогенной токсемии.
Необходимо отметить, что на данном этапе удовлетворительный уровень аналгезии: ВАШ=4,0-4,5 баллов; балл аналгезии = 4-4,5 балла, хорошие показатели сенсометрии: Т.П.= 1,75-2,5 мА; БП = 3,5-5 мА обеспечивался за счет первого этапа СКПА.
За время наблюдения в ОРИТ больной было выполнено несколько программированных санационных релапаротомий: 1.02.02 – санационная релапаротомия I; 5.02.02 – санационная релапаротомия II; 8.02.02 – санационная релапаротомия III.
После оперативного вмешательства, в условиях отделения реанимации, больной продолжена инфузионно-корригирующая терапия, с назначением полного парентерального питания и продолжением этапной СКПА.
На втором этапе от первой санационной релапаротомии до второй санационной релапаротомии (1.02.02 – 5.02.02 г.) разработанной в нашей клинике схемы комплексной послеоперационной аналгезии (СКПА) удовлетворительный уровень аналгезии: ВАШ: 3,0-3,5 баллов; балл аналгезии: 4-5 баллов; стабильные показатели сенсометрии: Т.П. = 2-2,5 мА; БП = 4-5 мА обеспечивался за счет эпидуральной аналгезии: анекаин 25 мг  4 раза/сут (катетеризация эпидурального пространства 1.02.02) + даларгин 0,6 мг/кг/сут + октреотид 0,1 мг/сут + контрикал 30 мг 4 раза/сут (катетеризация эпидурального пространства 1.02.02) + даларгин 0,6 мг/кг/сут + октреотид 0,1 мг/сут + контрикал 30 мг  2 раза/сут.
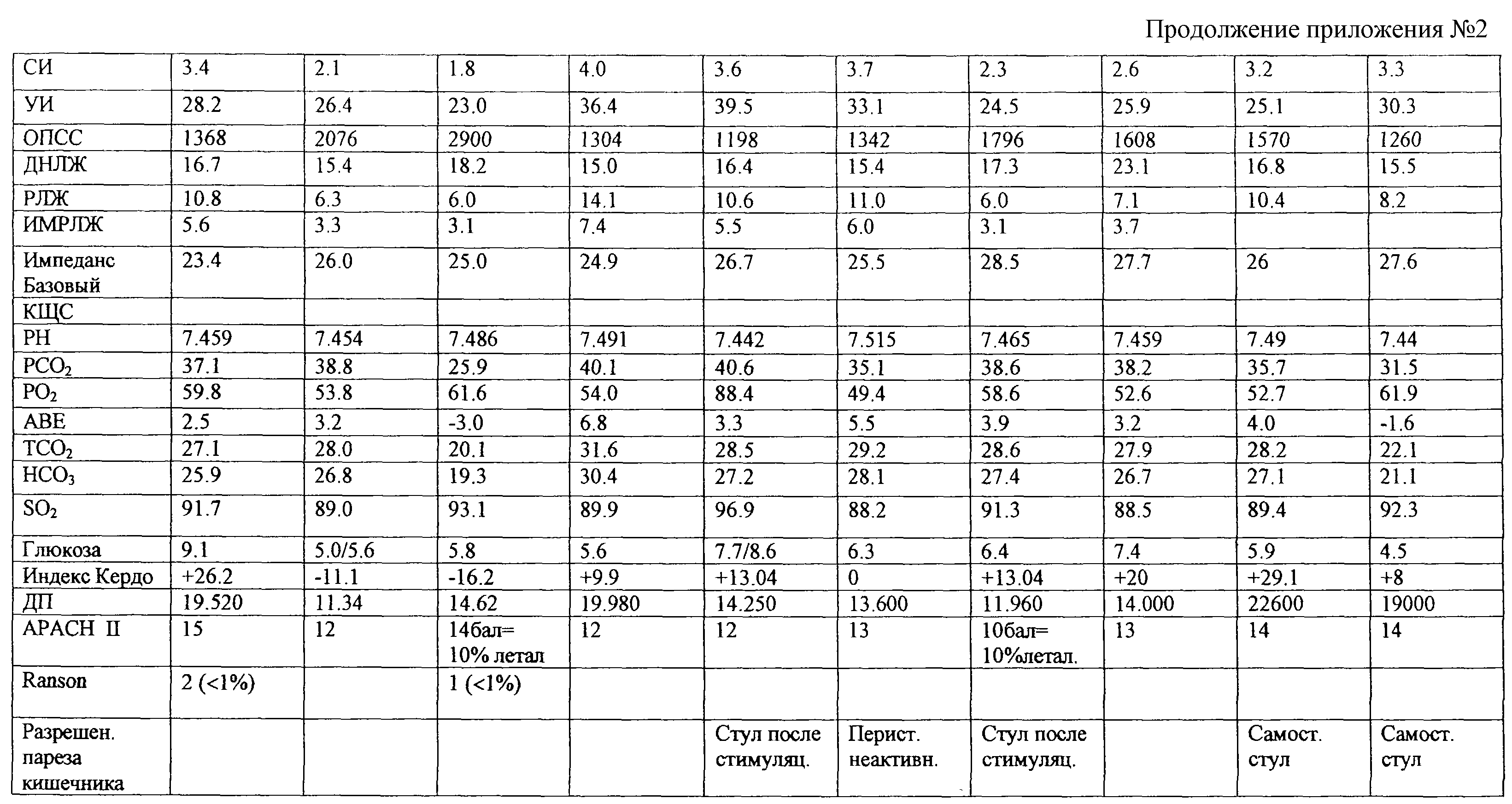
Изменения в состоянии больной, уровень аналгезии, ответная реакция сердечно-сосудистой системы и гомеостаза в целом представлены в таблице “Карта послеоперационного обезболивания в ОРИТ” (приложение №2).
На третьем этапе: от второй санационной релапаротомии до третьей санационной релапаротомии (5.02.02 – 8.02.02) разработанной в нашей клинике схемы комплексной послеоперационной аналгезии (СКПА) удовлетворительный уровень аналгезии: ВАШ: 3,0-3,5 баллов; балл аналгезии: 4-5 балла; стабильные показатели сенсометрии: Т.П.=1-2,5 мА; БП = 5 мА обеспечивались за счет эпидуральной аналгезии: анекаин – 25 мг 2 раза/сут.
Изменения в состоянии больной, уровень аналгезии, ответная реакция сердечно-сосудистой системы и гомеостаза в целом представлены в таблице “Карта послеоперационного обезболивания в ОРИТ” (приложение №2).
На третьем этапе: от второй санационной релапаротомии до третьей санационной релапаротомии (5.02.02 – 8.02.02) разработанной в нашей клинике схемы комплексной послеоперационной аналгезии (СКПА) удовлетворительный уровень аналгезии: ВАШ: 3,0-3,5 баллов; балл аналгезии: 4-5 балла; стабильные показатели сенсометрии: Т.П.=1-2,5 мА; БП = 5 мА обеспечивались за счет эпидуральной аналгезии: анекаин – 25 мг  4 раза/сут + даларгин 0,6 мг/кг/сут, 9.02.02 – эпид. катетер удален.
На четвертом этапе после третьей санационной релапаротомии и при последующих санационных релапаротомиях (с 9.02.02 г.) анестезия обеспечивалась в/м введением даларгина в дозе 5 мг 4 раза/сут + даларгин 0,6 мг/кг/сут, 9.02.02 – эпид. катетер удален.
На четвертом этапе после третьей санационной релапаротомии и при последующих санационных релапаротомиях (с 9.02.02 г.) анестезия обеспечивалась в/м введением даларгина в дозе 5 мг  4 раза/сут + кеторол 30 мг 4 раза/сут + кеторол 30 мг  2 раза/сут.
Клинико-лабораторная динамика эффективности послеоперационного обезболивания на этапах программированных релапаротомий у больной Пышкиной З.Д. представлена в таблице “Карта послеоперационного обезболивания в ОРИТ”, см. приложение №2.
На 14-е сутки переведена в 6 хир. отделение в удовлетворительном состоянии. 14.02.02 выписана домой.
Пример 3
Больной С., 21 год, поступил в 6 х./о. 4 ГКБ 14.10.01 с диагнозом: “отечная форма панкреатита”.
Анамнез болезни: боли в эпигастрии с 12.10.01 после злоупотребления алкоголем, тошнота, многократная рвота.
Этиология: злоупотребление алкоголем.
Обследования и сроки этапных релапаротомий: 1) 14.10.01. Лапароскопическое дренирование – дигноз: отечная форма панкреатита.
2) 16.10.01 – УЗИ брюшной полости: диффузные изменения печени, асцит, поджелудочная железа не визуализируется.
3) 17.10.01 – повторное УЗИ бр. полости: признаки острого панкреатита, асцит.
4) 19.10.01. Оментобурсостомия. Интраоперационно: субтотальный панкреонекроз. Флегмона забрюшинного пространства.
5) 19.10.01. Рентген грудной клетки: Левосторонний реактивный плеврит.
6) 22.10.01. Санационная релапаротомия I.
7) 25.1.01. Санационная релапаротомия II. Рентген грудной клетки – остаточные явления плеврита.
8) 30.10.01. Санационная релапаротомия III.
9) 2.11.01. Санационная релапаротомия IV – остаточные некрозы в хвосте pancreas, гноя в сальниковой сумке нет.
10) 9.11.01. Санационная релапаротомия V – ушивание лапаротомной раны.
11) 30.11.01 – выписан домой.
После повторного УЗИ брюшной полости 18.10.01 больной переведен в ОРИТ для предоперационной подготовки.
При поступлении в ОРИТ у больного сохранялся выраженный болевой синдром, который оценивался по ВАШ в 5,0 баллов; балл аналгезии составлял 3,5 балла. Тип гемодинамики – нормокинетический. Отмечалось выраженное истощение симпатоадреналовой системы с отрицательным значением индекса Кердо: -3,4. При анализе КЩС сдвигов в сторону компенсированного метаболического ацидоза или алкалоза не выявлено. Тяжесть состояния оценивалась по интегральным шкалам: АРАСНЕ II – 8 баллов (10% прогнозируемой летальности); Ranson – 1 балл (менее 1% прогнозируемой летальности), через 48 ч – 2 балла (менее 1% прогнозируемой летальности).
Больному была назначена разработанная в нашей клинике схема комплексной послеоперационной аналгезии (СКПА): даларгин в дозе 0,6 мг/кг/сут + кеторол 30 мг 2 раза/сут.
Клинико-лабораторная динамика эффективности послеоперационного обезболивания на этапах программированных релапаротомий у больной Пышкиной З.Д. представлена в таблице “Карта послеоперационного обезболивания в ОРИТ”, см. приложение №2.
На 14-е сутки переведена в 6 хир. отделение в удовлетворительном состоянии. 14.02.02 выписана домой.
Пример 3
Больной С., 21 год, поступил в 6 х./о. 4 ГКБ 14.10.01 с диагнозом: “отечная форма панкреатита”.
Анамнез болезни: боли в эпигастрии с 12.10.01 после злоупотребления алкоголем, тошнота, многократная рвота.
Этиология: злоупотребление алкоголем.
Обследования и сроки этапных релапаротомий: 1) 14.10.01. Лапароскопическое дренирование – дигноз: отечная форма панкреатита.
2) 16.10.01 – УЗИ брюшной полости: диффузные изменения печени, асцит, поджелудочная железа не визуализируется.
3) 17.10.01 – повторное УЗИ бр. полости: признаки острого панкреатита, асцит.
4) 19.10.01. Оментобурсостомия. Интраоперационно: субтотальный панкреонекроз. Флегмона забрюшинного пространства.
5) 19.10.01. Рентген грудной клетки: Левосторонний реактивный плеврит.
6) 22.10.01. Санационная релапаротомия I.
7) 25.1.01. Санационная релапаротомия II. Рентген грудной клетки – остаточные явления плеврита.
8) 30.10.01. Санационная релапаротомия III.
9) 2.11.01. Санационная релапаротомия IV – остаточные некрозы в хвосте pancreas, гноя в сальниковой сумке нет.
10) 9.11.01. Санационная релапаротомия V – ушивание лапаротомной раны.
11) 30.11.01 – выписан домой.
После повторного УЗИ брюшной полости 18.10.01 больной переведен в ОРИТ для предоперационной подготовки.
При поступлении в ОРИТ у больного сохранялся выраженный болевой синдром, который оценивался по ВАШ в 5,0 баллов; балл аналгезии составлял 3,5 балла. Тип гемодинамики – нормокинетический. Отмечалось выраженное истощение симпатоадреналовой системы с отрицательным значением индекса Кердо: -3,4. При анализе КЩС сдвигов в сторону компенсированного метаболического ацидоза или алкалоза не выявлено. Тяжесть состояния оценивалась по интегральным шкалам: АРАСНЕ II – 8 баллов (10% прогнозируемой летальности); Ranson – 1 балл (менее 1% прогнозируемой летальности), через 48 ч – 2 балла (менее 1% прогнозируемой летальности).
Больному была назначена разработанная в нашей клинике схема комплексной послеоперационной аналгезии (СКПА): даларгин в дозе 0,6 мг/кг/сут + кеторол 30 мг  2 раза/сут + октреотид 0,1 мг/сут + контрикал 30 мг 2 раза/сут + октреотид 0,1 мг/сут + контрикал 30 мг  2 раза/сут + баралгин 5 мл 2 раза/сут + баралгин 5 мл  4 раза/сут. Через 12 ч от начала применения СКПА у больного отмечен позитивный терапевтический эффект аналгезии, характеризующейся снижением интенсивности болевого синдрома и улучшения функциональных методов оценки ноцицепции. На 2-е сутки от момента поступления в ОРИТ ликвидированы явления панкреатогенной токсемии. В отсроченном порядке больному выполнена оментобурсостомия 19.10.01. Интраоперационно: субтотальный панкреонекроз. Флегмона забрюшинного пространства.
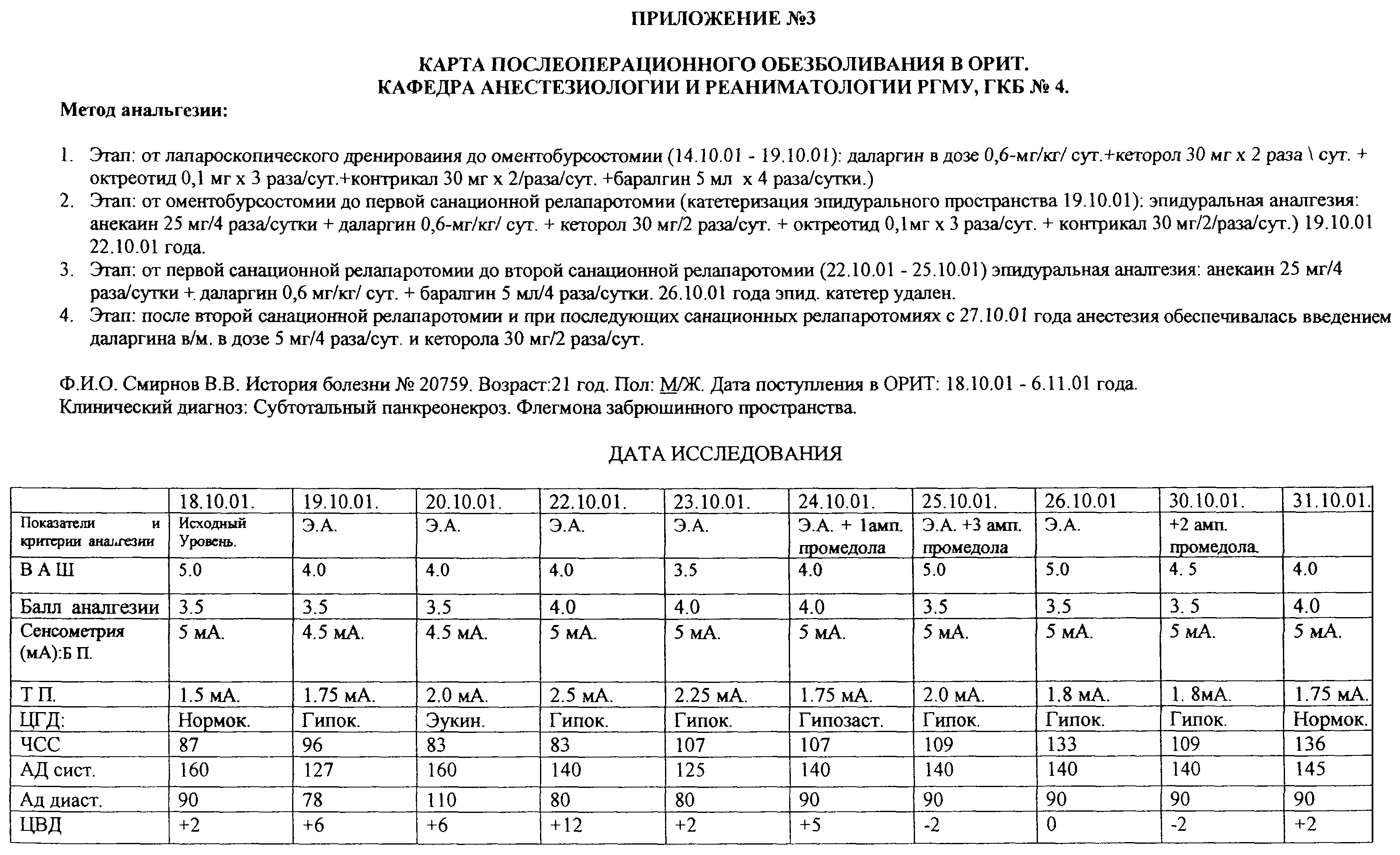
После оперативного вмешательства, в условиях отделения реанимации, больному продолжена инфузионно-корригирующая терапия, с назначением полного парентерального питания и продолжением этапной СКПА. Изменения в состоянии больного, уровень аналгезии, ответная реакция сердечно-сосудистой системы и гомеостаза в целом представлены в таблице “Карта послеоперационного обезболивания в ОРИТ” (приложение №3).
Необходимо отметить, что на данном этапе удовлетворительный уровень аналгезии: ВАШ = 4 балла; балл аналгезии = 3,5-4 балла; хорошие показатели сенсометрии: Т.П.=1,75-2,5 мА; БП=4,5-5 мА обеспечивался за счет второго этапа СКПА: эпидуральной аналгезии: анекаин 25 мг 4 раза/сут. Через 12 ч от начала применения СКПА у больного отмечен позитивный терапевтический эффект аналгезии, характеризующейся снижением интенсивности болевого синдрома и улучшения функциональных методов оценки ноцицепции. На 2-е сутки от момента поступления в ОРИТ ликвидированы явления панкреатогенной токсемии. В отсроченном порядке больному выполнена оментобурсостомия 19.10.01. Интраоперационно: субтотальный панкреонекроз. Флегмона забрюшинного пространства.
После оперативного вмешательства, в условиях отделения реанимации, больному продолжена инфузионно-корригирующая терапия, с назначением полного парентерального питания и продолжением этапной СКПА. Изменения в состоянии больного, уровень аналгезии, ответная реакция сердечно-сосудистой системы и гомеостаза в целом представлены в таблице “Карта послеоперационного обезболивания в ОРИТ” (приложение №3).
Необходимо отметить, что на данном этапе удовлетворительный уровень аналгезии: ВАШ = 4 балла; балл аналгезии = 3,5-4 балла; хорошие показатели сенсометрии: Т.П.=1,75-2,5 мА; БП=4,5-5 мА обеспечивался за счет второго этапа СКПА: эпидуральной аналгезии: анекаин 25 мг  4 раза/сут + даларгин 0,6 мг/кг/сут + октреотид 0,1 мг/сут + контрикал 30 мг 4 раза/сут + даларгин 0,6 мг/кг/сут + октреотид 0,1 мг/сут + контрикал 30 мг  2 раза/сут.
За время наблюдения в ОРИТ больному было выполнено несколько программированных санационных релапаротомий. 22.10.01 – санационная релапаротомия I /интраоперационно: остаются некрозы головки и хвоста pancreas, c переходом на малый сальник/. 25.10.01 – санационная релапаротомия II; 30.10.01 – санационная релапаротомия III; 2.11.01 – санационная релапаротомия IV: /интраоперационно: остаточные некрозы в хвосте pancreas, гноя в сальниковой сумке нет/.
На третьем этапе – от первой санационной релапаротомии до второй санационной релапаротомии (22.10.2001 – 25.10.2001 г.) разработанной в нашей клинике схемы комплексной послеоперационной аналгезии (СКПА) удовлетворительный уровень аналгезии: ВАШ: 3,5-5 баллов; балл аналгезии: 3,5-4 балла; стабильные показатели сенсометрии Т.П.= 1,75-2,25 мА; БП = 5 мА обеспечивался за счет эпидуральной аналгезии: анекаин 25 мг 2 раза/сут.
За время наблюдения в ОРИТ больному было выполнено несколько программированных санационных релапаротомий. 22.10.01 – санационная релапаротомия I /интраоперационно: остаются некрозы головки и хвоста pancreas, c переходом на малый сальник/. 25.10.01 – санационная релапаротомия II; 30.10.01 – санационная релапаротомия III; 2.11.01 – санационная релапаротомия IV: /интраоперационно: остаточные некрозы в хвосте pancreas, гноя в сальниковой сумке нет/.
На третьем этапе – от первой санационной релапаротомии до второй санационной релапаротомии (22.10.2001 – 25.10.2001 г.) разработанной в нашей клинике схемы комплексной послеоперационной аналгезии (СКПА) удовлетворительный уровень аналгезии: ВАШ: 3,5-5 баллов; балл аналгезии: 3,5-4 балла; стабильные показатели сенсометрии Т.П.= 1,75-2,25 мА; БП = 5 мА обеспечивался за счет эпидуральной аналгезии: анекаин 25 мг  4 раза/сут + даларгин 0,6 мг/кг/сут + баралгин 5 мл 4 раза/сут + даларгин 0,6 мг/кг/сут + баралгин 5 мл  4 раза/сут. 26.10.2001 г. эпид. катетер удален. На данном этапе дважды потребовалось введение наркотических анальгетиков: 24.10.01 – с целью премедикации перед планируемой этапной релапаротомией и в ближайшем послеоперационном периоде, после релапаротомий II.
На четвертом этапе после второй санационной релапаротомии и при последующих санационных релапаротомиях с 22.11.2001 г. анестезия обеспечивалась введением даларгина в/м в дозе 5 мг 4 раза/сут. 26.10.2001 г. эпид. катетер удален. На данном этапе дважды потребовалось введение наркотических анальгетиков: 24.10.01 – с целью премедикации перед планируемой этапной релапаротомией и в ближайшем послеоперационном периоде, после релапаротомий II.
На четвертом этапе после второй санационной релапаротомии и при последующих санационных релапаротомиях с 22.11.2001 г. анестезия обеспечивалась введением даларгина в/м в дозе 5 мг  4 раза/сут и кеторола 30 мг 4 раза/сут и кеторола 30 мг  2 раза/сут.
Клинико-лабораторная динамика эффективности послеоперационного обезболивания на этапах программированных релапаротомий у больного Смирнова В.В.; 21 года, представлена в таблице “Карта послеоперационного обезболивания в ОРИТ”, см. приложение №3.
Примечания к приложениям:
– Критерии анальгезии:
– ВАШ – Визуальная аналоговая шкала.
– Сенсометрия (в мА).
– БП – Болевой порог.
– ТП – Тактильный порог.
– Показатели гемодинамики:
– ЦВД – Центральное венозное давление.
– САД – Среднее артериальное давление.
– СИ – Сердечный индекс.
– УИ – ударный индекс.
– ОПСС – Общее периферическое сопротивление сосудов.
– ДНЛЖ – Диастолическое наполнение левого желудочка.
– РЛЖ – Работа левого желудочка.
– ИМРНЖ – Индекс механической работы левого желудочка.
– Показатели активности вегетативной нервной системы:
– ДП – Двойное произведение (АДсит х ЧСС).
– Системы оценки тяжести пациентов.
– АРАСН II
– Ranson
Заявленный способ не очевиден для специалистов, работающих в данной области:
1. Впервые в клинической практике применен этапный подход к послеоперационному обезболиванию у хирургических больных с деструктивными формами панкреонекроза, обусловленный современной хирургической тактикой, включающей: программируемый порядок, количество и обширность санационных релапаротомий при вышеуказанной патологии. Метод детально проанализирован у 35 тяжелейших больных.
2. Впервые этапный метод послеоперационного обезболивания направлен не столько на блокаду соматической и висцеральной ноцицепции, а в первую очередь на создание антистрессовой защиты, с учетом современных взглядов формирования боли и стресса.
3. Совершенно неожиданно выяснилось, что разработанный метод послеоперационного обезболивания практически полностью совпадает с фазами метаболического стресса, изученными Муром в 1968 г. Комбинированный метод послеоперационного обезболивания обладает достаточно мощной антистрессовой защитой, что характеризуется подавлением гуморальных и системных реакций организма в 1-ю (адренокортикоидную) фазу операционного стресса: отмечается нормализация показателей кислотно-щелочного состояния, снижение протеолитических ферментов, нормализация глюкозы крови и снижение гармонов стресса: кортизола.
4. Предлагаемый подход к послеоперационному обезболиванию выявил ранее казавшуюся неосуществимой возможность существенно сократить потребность в опиатах, вплоть до их полного исключения, сделать их анальгетиками резерва, сократить их общую токсичность на жизненно важные органы и системы.
5. Способ позволяет сохранить функциональную активность пациентов с учетом длительности пребывания в клинике, которая, как правило, составляет не менее 30-60 койко-дней, причем самый тяжелый этап от оментобурсостомии до 3-4 релапаротомии приходится на отделение реанимации и интенсивной терапии.
6. Совершенно неожиданно выяснилось, что разработанный способ послеоперационного обезболивания больных с панкреонекрозом позволяет повысить усвояемость нутриционной поддержки, нормализовать параметры азотистого баланса в ближайшее время послеоперационного периода и предотвратить катаболическую фазу стресса, улучшить репаративные процессы.
7. Способ позволяет добиться этиопатогенетического лечения боли, проводя антистрессовую защиту организма и ликвидируя метаболические нарушения на всех этапах санационных релапаротомий.
8. Длительные исследования в клинике лечения заболевания позволили снизить летальность до 10%, что казалось ранее недостижимым. 2 раза/сут.
Клинико-лабораторная динамика эффективности послеоперационного обезболивания на этапах программированных релапаротомий у больного Смирнова В.В.; 21 года, представлена в таблице “Карта послеоперационного обезболивания в ОРИТ”, см. приложение №3.
Примечания к приложениям:
– Критерии анальгезии:
– ВАШ – Визуальная аналоговая шкала.
– Сенсометрия (в мА).
– БП – Болевой порог.
– ТП – Тактильный порог.
– Показатели гемодинамики:
– ЦВД – Центральное венозное давление.
– САД – Среднее артериальное давление.
– СИ – Сердечный индекс.
– УИ – ударный индекс.
– ОПСС – Общее периферическое сопротивление сосудов.
– ДНЛЖ – Диастолическое наполнение левого желудочка.
– РЛЖ – Работа левого желудочка.
– ИМРНЖ – Индекс механической работы левого желудочка.
– Показатели активности вегетативной нервной системы:
– ДП – Двойное произведение (АДсит х ЧСС).
– Системы оценки тяжести пациентов.
– АРАСН II
– Ranson
Заявленный способ не очевиден для специалистов, работающих в данной области:
1. Впервые в клинической практике применен этапный подход к послеоперационному обезболиванию у хирургических больных с деструктивными формами панкреонекроза, обусловленный современной хирургической тактикой, включающей: программируемый порядок, количество и обширность санационных релапаротомий при вышеуказанной патологии. Метод детально проанализирован у 35 тяжелейших больных.
2. Впервые этапный метод послеоперационного обезболивания направлен не столько на блокаду соматической и висцеральной ноцицепции, а в первую очередь на создание антистрессовой защиты, с учетом современных взглядов формирования боли и стресса.
3. Совершенно неожиданно выяснилось, что разработанный метод послеоперационного обезболивания практически полностью совпадает с фазами метаболического стресса, изученными Муром в 1968 г. Комбинированный метод послеоперационного обезболивания обладает достаточно мощной антистрессовой защитой, что характеризуется подавлением гуморальных и системных реакций организма в 1-ю (адренокортикоидную) фазу операционного стресса: отмечается нормализация показателей кислотно-щелочного состояния, снижение протеолитических ферментов, нормализация глюкозы крови и снижение гармонов стресса: кортизола.
4. Предлагаемый подход к послеоперационному обезболиванию выявил ранее казавшуюся неосуществимой возможность существенно сократить потребность в опиатах, вплоть до их полного исключения, сделать их анальгетиками резерва, сократить их общую токсичность на жизненно важные органы и системы.
5. Способ позволяет сохранить функциональную активность пациентов с учетом длительности пребывания в клинике, которая, как правило, составляет не менее 30-60 койко-дней, причем самый тяжелый этап от оментобурсостомии до 3-4 релапаротомии приходится на отделение реанимации и интенсивной терапии.
6. Совершенно неожиданно выяснилось, что разработанный способ послеоперационного обезболивания больных с панкреонекрозом позволяет повысить усвояемость нутриционной поддержки, нормализовать параметры азотистого баланса в ближайшее время послеоперационного периода и предотвратить катаболическую фазу стресса, улучшить репаративные процессы.
7. Способ позволяет добиться этиопатогенетического лечения боли, проводя антистрессовую защиту организма и ликвидируя метаболические нарушения на всех этапах санационных релапаротомий.
8. Длительные исследования в клинике лечения заболевания позволили снизить летальность до 10%, что казалось ранее недостижимым.

Формула изобретения Способ послеоперационного обезболивания больных с пакреонекрозом после оментобурсостомии с многократными программированными санационными релапаротомиями, включающий эпидуральную анальгезию, нестероидные противовоспалительные средства, опиаты, даларгин, спазмолитики, адъювантную терапию, отличающийся тем, что обезболивание подразделяют на этапы с учетом порядка и количества санационных релапаротомий, причем обезболивание на каждом этапе производят с учетом назначений на предыдущих этапах, синергизма и пролонгации обезболивающего действия, степени интенсивности болевого синдрома на этапах хирургического лечения: на первом этапе – от оментобурсостомии до первой санационной релапаротомии – проводят непрерывную инфузию даларгина в дозе 0,6-0,8 мг/кг/сутки в сочетании с нестероидными противовоспалительными средствами, ингибиторами протеаз, спазмолитиками, при необходимости опиаты; на втором этапе – от первой санационной релапаротомии до второй-третьей санационной релапаротомии – добавляют эпидуральную анальгезию местными анестетиками, исключая нестероидные противовоспалительные средства; на третьем этапе – от второй-третьей до четвертой-шестой санационной релапаротомии, – исключают наркотические анальгетики и ингибиторы протеаз; на четвертом этапе – после шестой санационной релапаротомии и при последующих санационных релапаротомиях, обезболивание обеспечивают исключительно внутримышечным введением даларгина в дозе 0,25-0,3 мг/кг/сут и нестероидными противовоспалительными средствами. MM4A Досрочное прекращение действия патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 15.11.2005
Извещение опубликовано: 10.11.2006 БИ: 31/2006
|
||||||||||||||||||||||||||
