Патент на изобретение №2228135
|
||||||||||||||||||||||||||
(54) СПОСОБ ПРОГНОЗИРОВАНИЯ РАЗВИТИЯ ОСЛОЖНЕНИЙ ПРИ ОСТРОМ ИНФАРКТЕ МИОКАРДА
(57) Реферат: Изобретение относится к медицине и может быть использовано для прогнозирования развития осложнений при остром инфаркте миокарда. Осуществляют пропускание ультразвука, изменяющегося в интервале частот 3-20 МГц через слюну больных острым инфарктом миокарда на 1, 7, 15, 30 сутки, в которой при температуре 37  0,05 0,05 С измеряют относительное изменение скорости ультразвука в сравнении с дистиллированной водой. При уменьшении данного показателя при очередном измерении более чем в 1,5 раза по сравнению с предыдущим прогнозируют развитие осложнений в течение суток. Способ позволяет повысить эффективность прогнозирования развития осложнений при остром инфаркте миокарда.
Изобретение относится к медицине, в частности к кардиологии, и предназначено для прогнозирования развития осложнений у больных острым инфарктом миокарда (ИМ).
Интерес к проблеме ИМ на протяжении последних десятилетий не снижался, что связано с увеличивающимся распространением заболевания, высокой летальностью (6-21%) и инвалидизацией лиц трудоспособного возраста. Неблагоприятные исходы ИМ, как правило, связаны с развитием осложнений. Поэтому актуальным является их раннее прогнозирование для проведения адекватной терапии (3).
Известен способ диагностики заболеваний опухолевого происхождения внутренних органов (патент №2082318), основанный на исследовании пробы крови в сравнении с контролем путем пропускания ультразвука с изменяющейся частотой и измерением относительной скорости его прохождения. Данный способ является недорогим, доступным, не требует специальной подготовки исследуемого субстрата. Однако данный способ не использовался ранее для прогнозирования осложнений ИМ.
Целью предлагаемого способа является оперативное прогнозирование развития осложнений у больных ИМ.
Поставленная цель решается предлагаемым способом, включающим серийный анализ биологического объекта (на 1, 7, 15, 30 сутки от начала ИМ), определение его параметров по скорости прохождения ультразвука в сравнении с параметрами показателей, полученных путем параллельного пропускания ультразвука через дистиллированную воду (ДН2О), и прогнозирование развития осложнений в ближайшие 24 часа при уменьшении этой величины более чем в 1,5 раза при каждом последующем измерении по сравнению с предыдущим. В качестве биологического объекта берут слюну больных ИМ.
Установлено, что корректные измерения относительной скорости ультразвука в слюне и дистиллированной воде возможны при изменении частоты не менее чем на 1 МГц в любой части диапазона от 3 до 20 МГц (например, от 7,0 до 8,0 МГц) (2). Пьезоизлучатели устройств с высокочастотного генератора (например, типа Г4-164), управляемого микроЭВМ, преобразуют ВЧ-сигнал в ультразвуковой сигнал той же частоты, который распространяется в ДН2О, находящейся в акустической ячейке устройства (патент №2039978). Пьезоприемники преобразуют ультразвуковой сигнал в ВЧ-сигнал, который поступает на ВЧ-микровольтметр (например, типа ВЗ-57). Продетектированный ВЧ-сигнал с выхода ВЧ-микровольтметра поступает на вольтметр постоянного тока (например, В7-53), также управляемый микроЭВМ. В результате обработки данных, получаемых с пьезоприемника устройства для контроля биологических жидкостей, в памяти микроЭВМ фиксируются центральные частоты всех резонансных пиков в выбранном диапазоне частот (например, от 7,0 до 8,0 МГц) для дистиллированной воды. Затем в одну из акустических ячеек устройства заливается слюна (предварительно отцентрифугированная 10 минут при скорости в 3000 оборотов в минуту), и аналогично в памяти микроЭВМ фиксируются центральные частоты всех резонансных пиков в том же диапазоне от 7,0 до 8,0 МГц для слюны. Затем микроЭВМ вычисляет среднюю разность частотного расстояния между резонансными пиками /j+1,/ j и номера j выбранного резонансного пика по следующей формуле: С измеряют относительное изменение скорости ультразвука в сравнении с дистиллированной водой. При уменьшении данного показателя при очередном измерении более чем в 1,5 раза по сравнению с предыдущим прогнозируют развитие осложнений в течение суток. Способ позволяет повысить эффективность прогнозирования развития осложнений при остром инфаркте миокарда.
Изобретение относится к медицине, в частности к кардиологии, и предназначено для прогнозирования развития осложнений у больных острым инфарктом миокарда (ИМ).
Интерес к проблеме ИМ на протяжении последних десятилетий не снижался, что связано с увеличивающимся распространением заболевания, высокой летальностью (6-21%) и инвалидизацией лиц трудоспособного возраста. Неблагоприятные исходы ИМ, как правило, связаны с развитием осложнений. Поэтому актуальным является их раннее прогнозирование для проведения адекватной терапии (3).
Известен способ диагностики заболеваний опухолевого происхождения внутренних органов (патент №2082318), основанный на исследовании пробы крови в сравнении с контролем путем пропускания ультразвука с изменяющейся частотой и измерением относительной скорости его прохождения. Данный способ является недорогим, доступным, не требует специальной подготовки исследуемого субстрата. Однако данный способ не использовался ранее для прогнозирования осложнений ИМ.
Целью предлагаемого способа является оперативное прогнозирование развития осложнений у больных ИМ.
Поставленная цель решается предлагаемым способом, включающим серийный анализ биологического объекта (на 1, 7, 15, 30 сутки от начала ИМ), определение его параметров по скорости прохождения ультразвука в сравнении с параметрами показателей, полученных путем параллельного пропускания ультразвука через дистиллированную воду (ДН2О), и прогнозирование развития осложнений в ближайшие 24 часа при уменьшении этой величины более чем в 1,5 раза при каждом последующем измерении по сравнению с предыдущим. В качестве биологического объекта берут слюну больных ИМ.
Установлено, что корректные измерения относительной скорости ультразвука в слюне и дистиллированной воде возможны при изменении частоты не менее чем на 1 МГц в любой части диапазона от 3 до 20 МГц (например, от 7,0 до 8,0 МГц) (2). Пьезоизлучатели устройств с высокочастотного генератора (например, типа Г4-164), управляемого микроЭВМ, преобразуют ВЧ-сигнал в ультразвуковой сигнал той же частоты, который распространяется в ДН2О, находящейся в акустической ячейке устройства (патент №2039978). Пьезоприемники преобразуют ультразвуковой сигнал в ВЧ-сигнал, который поступает на ВЧ-микровольтметр (например, типа ВЗ-57). Продетектированный ВЧ-сигнал с выхода ВЧ-микровольтметра поступает на вольтметр постоянного тока (например, В7-53), также управляемый микроЭВМ. В результате обработки данных, получаемых с пьезоприемника устройства для контроля биологических жидкостей, в памяти микроЭВМ фиксируются центральные частоты всех резонансных пиков в выбранном диапазоне частот (например, от 7,0 до 8,0 МГц) для дистиллированной воды. Затем в одну из акустических ячеек устройства заливается слюна (предварительно отцентрифугированная 10 минут при скорости в 3000 оборотов в минуту), и аналогично в памяти микроЭВМ фиксируются центральные частоты всех резонансных пиков в том же диапазоне от 7,0 до 8,0 МГц для слюны. Затем микроЭВМ вычисляет среднюю разность частотного расстояния между резонансными пиками /j+1,/ j и номера j выбранного резонансного пика по следующей формуле:
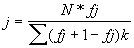 где N – число частотных расстояний между резонансными пиками в выбранном частотном диапазоне от 7,0 до 8,0 МГц.
Затем выбирают значения центральных частот резонансных пиков одного и того же номера для дистиллированной воды и слюны и вычисляются соответствующие скорости ультразвука по формуле:
где N – число частотных расстояний между резонансными пиками в выбранном частотном диапазоне от 7,0 до 8,0 МГц.
Затем выбирают значения центральных частот резонансных пиков одного и того же номера для дистиллированной воды и слюны и вычисляются соответствующие скорости ультразвука по формуле:
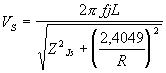 где Vs обозначает скорость ультразвука в каждой из исследованных сред: для дистиллированной воды s=(Н2О), для слюны s=s, R – радиус устройства для контроля биосред.
На основании результатов, полученных по данной формуле, вычисляют относительное изменение скорости ультразвука в слюне относительно дистиллированной воды, названный акустический показатель слюны (АПС):
где Vs обозначает скорость ультразвука в каждой из исследованных сред: для дистиллированной воды s=(Н2О), для слюны s=s, R – радиус устройства для контроля биосред.
На основании результатов, полученных по данной формуле, вычисляют относительное изменение скорости ультразвука в слюне относительно дистиллированной воды, названный акустический показатель слюны (АПС):
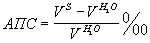 Выбор слюны в качестве объекта исследования объясняется тем, что наиболее оптимальным в качестве изучения микроциркуляции являются слюнные железы, ткань которых обильно снабжена сетью капилляров (2). Слюнные железы несут множество непищеварительных функций. В частности, большое значение имеет биохимический состав слюны (2). Но скорость прохождения ультразвука (УЗ) через такой биологический объект, как слюна, ранее не изучался ни у здоровых, ни у больных лиц.
Получаемая величина была названа “акустический показатель слюны” (АПС). Он измеряется в промиллях (‰). Первоначально величина АПС была определена у 31 здоровых лиц (15 мужчин и 16 женщин). В качестве здоровой нормы были использованы данные показателей слюны слушателей Военно-медицинского института ФПС России, как прошедших специальный отбор в соответствии с требованиями приказа для поступающих в высшие военные учебные заведения. АПС у здоровых лиц определялся трехкратно: с интервалом 1-2 дня и 3 месяца. Было найдено, что средние значения АПС у мужчин находились в пределах 1,7
Выбор слюны в качестве объекта исследования объясняется тем, что наиболее оптимальным в качестве изучения микроциркуляции являются слюнные железы, ткань которых обильно снабжена сетью капилляров (2). Слюнные железы несут множество непищеварительных функций. В частности, большое значение имеет биохимический состав слюны (2). Но скорость прохождения ультразвука (УЗ) через такой биологический объект, как слюна, ранее не изучался ни у здоровых, ни у больных лиц.
Получаемая величина была названа “акустический показатель слюны” (АПС). Он измеряется в промиллях (‰). Первоначально величина АПС была определена у 31 здоровых лиц (15 мужчин и 16 женщин). В качестве здоровой нормы были использованы данные показателей слюны слушателей Военно-медицинского института ФПС России, как прошедших специальный отбор в соответствии с требованиями приказа для поступающих в высшие военные учебные заведения. АПС у здоровых лиц определялся трехкратно: с интервалом 1-2 дня и 3 месяца. Было найдено, что средние значения АПС у мужчин находились в пределах 1,7 0,1‰, у женщин – 1,8 0,1‰, у женщин – 1,8 0,1‰. То есть различие между величиной АПС мужчин и женщин было недостоверным и за условную норму было принято среднее значение АПС, равное 1,76 0,1‰. То есть различие между величиной АПС мужчин и женщин было недостоверным и за условную норму было принято среднее значение АПС, равное 1,76 0,08‰.
Дополнительно была исследована возможность влияния на показатель АПС факта курения здоровых лиц. Однако на величину АПС курение, по нашим данным, не влияло.
У 33 больных ИМ (Q и не Q) с установленным диагнозом (критерии ВОЗ), сопоставимых по возрасту и полу, исследовали АПС в динамике на 1, 7, 15, 30 сутки заболевания. Установлено, что у всех больных ИМ в острый период среднее значение АПС было 2,82 0,08‰.
Дополнительно была исследована возможность влияния на показатель АПС факта курения здоровых лиц. Однако на величину АПС курение, по нашим данным, не влияло.
У 33 больных ИМ (Q и не Q) с установленным диагнозом (критерии ВОЗ), сопоставимых по возрасту и полу, исследовали АПС в динамике на 1, 7, 15, 30 сутки заболевания. Установлено, что у всех больных ИМ в острый период среднее значение АПС было 2,82 0,26‰ и достоверно отличалось от величины АПС здоровых (р=0,0006). При этом у 13 больных неосложненным ИМ значения АПС за все время наблюдения находились в диапазоне от 2,5 0,26‰ и достоверно отличалось от величины АПС здоровых (р=0,0006). При этом у 13 больных неосложненным ИМ значения АПС за все время наблюдения находились в диапазоне от 2,5 0,25‰ (в остром периоде) до 3,1 0,25‰ (в остром периоде) до 3,1 0,41‰ (в подостром периоде), достоверных различий между величинами АПС в динамике не было. У 20 больных с осложненным течением ИМ (летальный исход, рецидивирующий ИМ, развитие ургентных нарушений ритма и проводимости, ранняя постинфарктная стенокардия, острая сердечная недостаточность, тромбоз периферических артерий) величина АПС находилась в диапазоне от 3,1 0,41‰ (в подостром периоде), достоверных различий между величинами АПС в динамике не было. У 20 больных с осложненным течением ИМ (летальный исход, рецидивирующий ИМ, развитие ургентных нарушений ритма и проводимости, ранняя постинфарктная стенокардия, острая сердечная недостаточность, тромбоз периферических артерий) величина АПС находилась в диапазоне от 3,1 0,46‰ (в остром периоде) и 4,4 0,46‰ (в остром периоде) и 4,4 0,42‰ (в конце острого периода) до 2,73 0,42‰ (в конце острого периода) до 2,73 0,22‰ (в подострой стадии). При этом разница между величиной АПС в начале острого периода и его конце была достоверна (р=0,02), разница между величиной АПС конца острого периода и в подостром периоде тоже была достоверна (р=0,01) Величина АПС у больных с осложненным течением ИМ достоверно отличалась от величины АПС больных с неосложненным течением в конце острого периода (р=0,05). Резкое снижение величины АПС в 1,5 раза в конце острого периода или начале подострого периода было предвестником (предиктором) развития таких осложнений как рецидив ИМ, ургентные нарушения ритма и проводимости, тромбоз периферических артерий, летальный исход. При более постепенном снижении величины АПС на 1%о в течение недели развивались такие осложнения, как ранняя постинфарктная стенокардия.
Оценку точности результатов измерений проводили на ЭВМ с использованием пакетов программ Windows: MS Access, MS Excel с вычислением общепринятых показателей: средней арифметической величины (X), среднего квадратичного отклонения (S), ошибки средней арифметической (т), относительных величин (процентов). Степень значимости различия между показателями оценивалась по величине критерия Стьюдента (1 st) и по оценке уровня значимости (р). При этом учитывались существующие указания по статистической обработке данных клинических и лабораторных исследований.
Предлагаемый способ осуществляют следующим образом:
У больных ИМ утром натощак в течение 10 минут собирают слюну. Собранный материал в объеме 1 мл центрифугируют в пробирке при 3000 оборотах в минуту в течение 10 минут, например, на центрифуге ОПН-8. Затем в устройство для контроля биологических жидкостей (патент №2039978), где поддерживается температура 37 0,22‰ (в подострой стадии). При этом разница между величиной АПС в начале острого периода и его конце была достоверна (р=0,02), разница между величиной АПС конца острого периода и в подостром периоде тоже была достоверна (р=0,01) Величина АПС у больных с осложненным течением ИМ достоверно отличалась от величины АПС больных с неосложненным течением в конце острого периода (р=0,05). Резкое снижение величины АПС в 1,5 раза в конце острого периода или начале подострого периода было предвестником (предиктором) развития таких осложнений как рецидив ИМ, ургентные нарушения ритма и проводимости, тромбоз периферических артерий, летальный исход. При более постепенном снижении величины АПС на 1%о в течение недели развивались такие осложнения, как ранняя постинфарктная стенокардия.
Оценку точности результатов измерений проводили на ЭВМ с использованием пакетов программ Windows: MS Access, MS Excel с вычислением общепринятых показателей: средней арифметической величины (X), среднего квадратичного отклонения (S), ошибки средней арифметической (т), относительных величин (процентов). Степень значимости различия между показателями оценивалась по величине критерия Стьюдента (1 st) и по оценке уровня значимости (р). При этом учитывались существующие указания по статистической обработке данных клинических и лабораторных исследований.
Предлагаемый способ осуществляют следующим образом:
У больных ИМ утром натощак в течение 10 минут собирают слюну. Собранный материал в объеме 1 мл центрифугируют в пробирке при 3000 оборотах в минуту в течение 10 минут, например, на центрифуге ОПН-8. Затем в устройство для контроля биологических жидкостей (патент №2039978), где поддерживается температура 37 0,05 0,05 С, помещают дистиллированную воду (ДН2О). На устройство контроля подают сигнал частотой, изменяющейся на 1 МГц, из любой части диапазона от 3 до 20 МГц (например, от 7 до 8 МГц) с высокочастотного генератора (например, типа Г4-164), управляемого микроЭВМ. Установлено, что корректные измерения скорости ультразвука в слюне и дистиллированной воде возможны при изменении частоты не менее чем на 1 МГц в любой части диапазона от 3 до 20 МГц (например, от 7,0 до 8,0 МГц). Пьезоизлучатели устройства контроля преобразуют ВЧ-сигнал в ультразвуковой сигнал той же частоты, который распространяется в ДН2О, находящейся в акустической ячейке устройства (патент №2039978). Пьезоприемник преобразует ультразвуковой сигнал в ВЧ-сигнал, который поступает на ВЧ-микровольтметр (например, типа ВЗ-57). Продетектированный ВЧ-сигнал с выхода ВЧ-микровольтметра поступает на вольтметр постоянного тока (например, В7-53), также управляемый микроЭВМ. В результате обработки данных, получаемых с пьезоприемника устройства для контроля биологических жидкостей, в памяти микроЭВМ фиксируются центральные частоты всех резонансных пиков в выбранном диапазоне частот (например, от 7,0 до 8,0 МГц) для дистиллированной воды. Затем в одну из акустических ячеек устройства заливается слюна (предварительно отцентрифугированная 10 минут при скорости в 3000 оборотов в минуту), и аналогично в памяти микроЭВМ фиксируются центральные частоты всех резонансных пиков в том же диапазоне от 7,0 до 8,0 МГц для слюны. Затем микроЭВМ вычисляет среднюю разность частотного расстояния между резонансными пиками /j+1,/ j и номер j выбранного резонансного пика по следующей формуле: С, помещают дистиллированную воду (ДН2О). На устройство контроля подают сигнал частотой, изменяющейся на 1 МГц, из любой части диапазона от 3 до 20 МГц (например, от 7 до 8 МГц) с высокочастотного генератора (например, типа Г4-164), управляемого микроЭВМ. Установлено, что корректные измерения скорости ультразвука в слюне и дистиллированной воде возможны при изменении частоты не менее чем на 1 МГц в любой части диапазона от 3 до 20 МГц (например, от 7,0 до 8,0 МГц). Пьезоизлучатели устройства контроля преобразуют ВЧ-сигнал в ультразвуковой сигнал той же частоты, который распространяется в ДН2О, находящейся в акустической ячейке устройства (патент №2039978). Пьезоприемник преобразует ультразвуковой сигнал в ВЧ-сигнал, который поступает на ВЧ-микровольтметр (например, типа ВЗ-57). Продетектированный ВЧ-сигнал с выхода ВЧ-микровольтметра поступает на вольтметр постоянного тока (например, В7-53), также управляемый микроЭВМ. В результате обработки данных, получаемых с пьезоприемника устройства для контроля биологических жидкостей, в памяти микроЭВМ фиксируются центральные частоты всех резонансных пиков в выбранном диапазоне частот (например, от 7,0 до 8,0 МГц) для дистиллированной воды. Затем в одну из акустических ячеек устройства заливается слюна (предварительно отцентрифугированная 10 минут при скорости в 3000 оборотов в минуту), и аналогично в памяти микроЭВМ фиксируются центральные частоты всех резонансных пиков в том же диапазоне от 7,0 до 8,0 МГц для слюны. Затем микроЭВМ вычисляет среднюю разность частотного расстояния между резонансными пиками /j+1,/ j и номер j выбранного резонансного пика по следующей формуле:
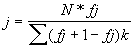 где N – число частотных расстояний между резонансными пиками в выбранном частотном диапазоне от 7,0 до 8,0 МГц.
Затем выбирают значения центральных частот резонансных пиков одного и того же номера для дистиллированной воды и слюны и вычисляются соответствующие скорости ультразвука по формуле:
где N – число частотных расстояний между резонансными пиками в выбранном частотном диапазоне от 7,0 до 8,0 МГц.
Затем выбирают значения центральных частот резонансных пиков одного и того же номера для дистиллированной воды и слюны и вычисляются соответствующие скорости ультразвука по формуле:
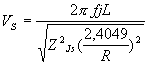 где Vs обозначает скорость ультразвука в каждой из исследованных сред: для дистиллированной воды s=(Н2О), для слюны s=s, R – радиус устройства для контроля биосред.
На основании результатов, полученных по данной формуле, вычисляют относительное изменение скорости ультразвука в слюне относительно дистиллированной воды, названный акустический показатель слюны (АПС):
где Vs обозначает скорость ультразвука в каждой из исследованных сред: для дистиллированной воды s=(Н2О), для слюны s=s, R – радиус устройства для контроля биосред.
На основании результатов, полученных по данной формуле, вычисляют относительное изменение скорости ультразвука в слюне относительно дистиллированной воды, названный акустический показатель слюны (АПС):
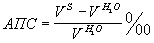 АПС измеряется в промиллях. Каждое последующее значение сравнивают с предыдущим. При уменьшении величины АПС в 1,5 раза и более прогнозируют развитие осложнений в течение 24 часов.
Конкретные примеры использования предлагаемого способа
Пример 1
Выписка из истории болезни №1691. Больная Т., 71 года, находилась на стационарном лечении в больнице №33 с 15.02.02 г. по 13.03.02 г. с диагнозом: ИБС. Острый Q инфаркт миокарда. Killip I. H II A. (NYHA III). Артериальная гипертензия третьей степени, риск 4. Ожирение алиментарно-конституционального генеза третьей степени. Больная доставлена в стационар КСП в 18 часов с жалобами на боли в левой половине грудной клетки. При поступлении состояние средней тяжести. В легких дыхание везикулярное, ЧД=22 в минуту. Тоны сердца приглушены, ритмичные, ЧСС 78 в минуту, АД 180/100 мм рт.ст. На ЭКГ картина острого Q инфаркта миокарда в области передней стенки. АПС – 2,78‰. Больной проводилась стандартная терапия, тромболитики не вводились. Острый период протекал без осложнений, АПС в конце острого периода – 2,24‰. Подострый период протекал без осложнений, на ЭКГ типичная динамика острого Q инфаркта миокарда в области передней стенки, кардиоспецифические ферменты нормальные. АПС при выписке – 2,03‰. Заключение: у больной с неосложненным течением Q инфаркта миокарда АПС изменялся в динамике незначительно.
Пример 2
Выписка из истории болезни №1297. Больная X., 73 лет, находилась на стационарном лечении в больнице №33 с 05.02.02 г. по 20.03.02 г. с диагнозом: ИБС: острый Q инфаркт миокарда в области задней стенки. Killip II. Постинфарктный кардиосклероз (1983, 1999 г.) Н II Б (NYHA III). Гипертоническая болезнь 3 стадии, осложненное течение, риск 4. Больная доставлена в стационар КСП в 15 часов 25 минут с выраженным приступом ангинозной боли, который появился утром и длился на момент госпитализации в течение 4 часов. При поступлении: состояние тяжелое, кожные покровы бледные, влажные, цианоз губ, акроцианоз, в легких с обеих сторон в нижних отделах – влажные хрипы, ЧД – 28 в 1 мин, тоны сердца глухие, ритмичные, ЧСС=78 в мин, АД=140/70 мм рт.ст. На ЭКГ- картина острого заднего инфаркта миокарда (зубец QS во II, III, avF отведениях, там же подъем сегмента ST на 4 мм). Ангинозный статус был купирован введением наркотических анальгетиков. АПС при поступлении – 4,5‰. Во время острого периода инфаркта миокарда дважды наблюдался рецидив ангинозных болей, которые купировались введением наркотических анальгетиков. Лечение проводилось согласно утвержденным стандартам, тромболитики не вводились. АПС в конце острого периода – 5,2‰. В течение первой недели подострого периода больная чувствовала себя хорошо, жалоб не предъявляла, на ЭКГ сохранялся зубец QS во II, III, avf отведениях, уменьшился подъем сегмента ST с 4 до 2 мм. Однако АПС в динамике на 15 сутки снизился до 2,29‰. На следующие после этого анализа сутки у больной внезапно появились: одышка, ЧД=28 в 1 мин, влажные хрипы в нижних отделах легких, стали нарастать отеки нижних конечностей. То есть клинически у больной развились и в динамике стали прогрессировать явления сердечной недостаточности, что потребовало срочной коррекции лечения с увеличением дозы ингибиторов ангиотензинпревращающего фермента и мочегонных препаратов. На ЭКГ сохранялся подъем сегмента ST на 2 мм во II, III, avf отведениях, здесь же зубец QS. При проведении ЭХО-кардиоскопии впервые у больной диагностирована аневризма левого желудочка, ФВ – 30%. АПС при выписке – 3,59‰. Заключение: у больной с осложненным течением Q инфаркта миокарда АПС в динамике снизился более чем в 1,5 раза, что явилось предиктором развития осложнения.
Источники информации.
1. Клемин А.В. Скорость и коэффициент затухания ультразвука в тканях внутренних органов млекопитающих. Дисс. канд. биол. наук. Москва, 1981.
2. Комарова Л.Г., Алексеева О.П. Новые представления о функции слюнных желез в организме (клинико-биохимический аспект) II Монография. – Н. Новгород. – 1994. – 96 с.
3. Сыркин А.Л. Инфаркт миокарда. – М.: Медицина, 1998, – 304 с.
АПС измеряется в промиллях. Каждое последующее значение сравнивают с предыдущим. При уменьшении величины АПС в 1,5 раза и более прогнозируют развитие осложнений в течение 24 часов.
Конкретные примеры использования предлагаемого способа
Пример 1
Выписка из истории болезни №1691. Больная Т., 71 года, находилась на стационарном лечении в больнице №33 с 15.02.02 г. по 13.03.02 г. с диагнозом: ИБС. Острый Q инфаркт миокарда. Killip I. H II A. (NYHA III). Артериальная гипертензия третьей степени, риск 4. Ожирение алиментарно-конституционального генеза третьей степени. Больная доставлена в стационар КСП в 18 часов с жалобами на боли в левой половине грудной клетки. При поступлении состояние средней тяжести. В легких дыхание везикулярное, ЧД=22 в минуту. Тоны сердца приглушены, ритмичные, ЧСС 78 в минуту, АД 180/100 мм рт.ст. На ЭКГ картина острого Q инфаркта миокарда в области передней стенки. АПС – 2,78‰. Больной проводилась стандартная терапия, тромболитики не вводились. Острый период протекал без осложнений, АПС в конце острого периода – 2,24‰. Подострый период протекал без осложнений, на ЭКГ типичная динамика острого Q инфаркта миокарда в области передней стенки, кардиоспецифические ферменты нормальные. АПС при выписке – 2,03‰. Заключение: у больной с неосложненным течением Q инфаркта миокарда АПС изменялся в динамике незначительно.
Пример 2
Выписка из истории болезни №1297. Больная X., 73 лет, находилась на стационарном лечении в больнице №33 с 05.02.02 г. по 20.03.02 г. с диагнозом: ИБС: острый Q инфаркт миокарда в области задней стенки. Killip II. Постинфарктный кардиосклероз (1983, 1999 г.) Н II Б (NYHA III). Гипертоническая болезнь 3 стадии, осложненное течение, риск 4. Больная доставлена в стационар КСП в 15 часов 25 минут с выраженным приступом ангинозной боли, который появился утром и длился на момент госпитализации в течение 4 часов. При поступлении: состояние тяжелое, кожные покровы бледные, влажные, цианоз губ, акроцианоз, в легких с обеих сторон в нижних отделах – влажные хрипы, ЧД – 28 в 1 мин, тоны сердца глухие, ритмичные, ЧСС=78 в мин, АД=140/70 мм рт.ст. На ЭКГ- картина острого заднего инфаркта миокарда (зубец QS во II, III, avF отведениях, там же подъем сегмента ST на 4 мм). Ангинозный статус был купирован введением наркотических анальгетиков. АПС при поступлении – 4,5‰. Во время острого периода инфаркта миокарда дважды наблюдался рецидив ангинозных болей, которые купировались введением наркотических анальгетиков. Лечение проводилось согласно утвержденным стандартам, тромболитики не вводились. АПС в конце острого периода – 5,2‰. В течение первой недели подострого периода больная чувствовала себя хорошо, жалоб не предъявляла, на ЭКГ сохранялся зубец QS во II, III, avf отведениях, уменьшился подъем сегмента ST с 4 до 2 мм. Однако АПС в динамике на 15 сутки снизился до 2,29‰. На следующие после этого анализа сутки у больной внезапно появились: одышка, ЧД=28 в 1 мин, влажные хрипы в нижних отделах легких, стали нарастать отеки нижних конечностей. То есть клинически у больной развились и в динамике стали прогрессировать явления сердечной недостаточности, что потребовало срочной коррекции лечения с увеличением дозы ингибиторов ангиотензинпревращающего фермента и мочегонных препаратов. На ЭКГ сохранялся подъем сегмента ST на 2 мм во II, III, avf отведениях, здесь же зубец QS. При проведении ЭХО-кардиоскопии впервые у больной диагностирована аневризма левого желудочка, ФВ – 30%. АПС при выписке – 3,59‰. Заключение: у больной с осложненным течением Q инфаркта миокарда АПС в динамике снизился более чем в 1,5 раза, что явилось предиктором развития осложнения.
Источники информации.
1. Клемин А.В. Скорость и коэффициент затухания ультразвука в тканях внутренних органов млекопитающих. Дисс. канд. биол. наук. Москва, 1981.
2. Комарова Л.Г., Алексеева О.П. Новые представления о функции слюнных желез в организме (клинико-биохимический аспект) II Монография. – Н. Новгород. – 1994. – 96 с.
3. Сыркин А.Л. Инфаркт миокарда. – М.: Медицина, 1998, – 304 с.
Формула изобретения Способ прогнозирования развития осложнений при остром инфаркте миокарда, включающий пропускание ультразвука, изменяющегося в интервале частот 3-20 МГц, через биологическую жидкость, отличающийся тем, что в качестве биологической жидкости используют слюну больных острым инфарктом миокарда на 1, 7, 15, 30 сутки, в которой при температуре (37  0,05) 0,05) С измеряют относительное изменение скорости ультразвука в сравнении с дистиллированной водой и при уменьшении данного показателя при очередном измерении более чем в 1,5 раза, по сравнению с предыдущим, прогнозируют развитие осложнений в течение суток. С измеряют относительное изменение скорости ультразвука в сравнении с дистиллированной водой и при уменьшении данного показателя при очередном измерении более чем в 1,5 раза, по сравнению с предыдущим, прогнозируют развитие осложнений в течение суток.
|
||||||||||||||||||||||||||
