Патент на изобретение №2227301
|
||||||||||||||||||||||||||
(54) СПОСОБ ОПРЕДЕЛЕНИЯ РАННИХ КРИТЕРИЕВ РАЗВИТИЯ ГИПЕРКОАГУЛЯЦИИ В ПРОЦЕССЕ ЛЕЧЕНИЯ БОЛЬНЫХ ОСТРЫМ ЛЕЙКОЗОМ
(57) Реферат: Изобретение относится к медицине и касается методов исследования системы свертывания крови у больных острым лейкозом в процессе-полихимиотерапии. Способ включает определение растворимых фибринмономерных комплексов (РФМК) и Д-димеров в крови, а также уровни фибриногена, промтромбинового индекса (%-ПИ), продуктов деградации фибриноген-фибрина (ПДФ) в этаноловом тесте, плазминогена, времени Хагеман-зависимого эуглобулинового лизиса и количество тромбоцитов и при уровне фибриногена 4,21±0,2 г/л, протромбинового индекса 91,9±1,3%, растворимых фибринмономерных комплексов в ортофенан-тролиновом 188,0±13,9 мкг/л и продуктов деградации фибриноген-фибрина 1-2 у.ед. этаноловом тестах, Д-димеров более 500 нг/мл, плазминогена 123,0±8,9%, времени Хагеман-зависимого эуглобулинового лизиса 27±4,2 мин и количестве тромбоцитов в крови 128±19,7  109/л устанавливают стадию пре-ДВС. Технический результат – способ обеспечивает раннее и достоверное определение пре-ДВС синдрома у больных острым лейкозом. 3 табл.
Изобретение относится к медицине и касается установления комплекса методов исследования системы свертывания крови и уровня их результатов, свидетельствующих о наличии гиперкоагуляции и возможном переходе этого состояния в ДВС-синдром у больных острым лейкозом (ОЛ) в процессе полихимиотерапии (ПХТ).
В настоящее время существует достаточно сведений о том, что процесс внутрисосудистого свертывания крови происходит постоянно (6) и его, по мнению И.Н.Бокарева (4, 5), следует особо выделить, обозначив термином ПВС (постоянное внутрисосудистое свертывание). Этот же автор рекомендует оценивать интенсивность процесса по 4 степеням. III степень ПВС – это состояние гиперкоагуляции или пре-ДВС, IV – ДВС-синдром. Различия в степени повышения внутрисосудистого свертывания крови могут нарастать постепенно и лишь на определенном этапе приводить к развитию выраженной клинической картины ДВС-синдрома. Вместе с тем эти изменения могут быть и молниеносными. Большинство сведений литературы, относящихся к этой стороне проблемы, касаются развития ДВС-синдрома у больных не гематологического профиля (1, 8, 9). Значительное количество геморрагических и тромботических осложнений у пациентов острым лейкозом вызываются нарушениями системы свертывания крови как в результате самого лейкозного процесса, так и применения цитостатических препаратов, активной гормоно- и антибиотикотерапии, а также присоединения инфекции (2, 12). Все это определяет актуальность диагностики и профилактики гиперкоагуляции у больных острым лейкозом, поэтому необходимо определить четкие ранние диагностические критерии гиперкоагуляции у этих больных, при которых необходимо проводить профилактику развития ДВС-синдрома.
В качестве прототипов нами использованы публикации H.Wada, N.Sakuragawa, Y.Mori et al. (1999) и H.Wada, N.Sakuragawa, H.Shiku (1998). Существенным недостатком их является то, что приведен комплекс методов, используемых для диагностики возможного развития ДВС-синдрома у больных острым лейкозом, однако четко не указаны уровни результатов, при которых возникает реальная угроза развития клинической картины ДВС-синдрома. Результаты оценки коагуляции представлены за 7-1 сутки до развития ДВС. При этом отдельные показатели коагуляции или комплекс их за 7, 5, 3, 1 сутки до развития ДВС-синдрома изменялись разнопланово и трактовка их была дана так, что трудно ориентироваться, в какое время может возникнуть ДВС-синдром. Кроме того, прототипы не предусматривают характерных и четких показателей клинической картины состояния пре-ДВС (гиперкоагуляции, III степени ПВС) у больных ОЛ. Вместе с тем важно определить четкие ранние диагностические критерии наличия пре-ДВС, как лабораторные, так и клинические, включающие не только комплекс рекомендуемых методов, но и уровни их результатов, при которых не только возможно, но и необходимо проводить своевременную профилактику развития ДВС-синдрома у больных острым лейкозом.
Целью настоящего изобретения является раннее достоверное определение состояния пре-ДВС у больных острым лейкозом путем выбора комплекса методов исследования гемостаза, уровня их результатов и характерных для этого состояния клинических проявлений.
Поставленная цель достигается тем, что при исследовании в динамике состояния гемостаза у больных острым лейкозом в период индукции и консолидации ремиссии использовали ряд методов: определение концентрации фибриногена по Р.А.Рутберг (3); протромбиновое время в секундах по Квику выражали в виде протромбинового индекса (%-ПИ) по общепринятой формуле (3); активированное парциальное тромбопластиновое время (АПТВ) выражали в виде индекса как отношение АПТВ исследуемой плазмы в секундах к таковому контрольной (3); время лизиса эуглобулиновой фракции, активированное каолином (Хагеман-зависимый эуглобулиновый лизис – ФА) по методу Г.Ф.Еремина и А.П.Архипова (3); активность плазминогена с применением хромогенных субстратов (3); количество растворимых фибринмономерных комплексов (РФМК) в фенатролиновом тесте по методу А.П.Момота с соавт. (3); продукты деградации фибриногена/фибрина (ПДФ) в этаноловом тесте по Godal et al. (3). Тест считается качественным (положительный или отрицательный), но в связи с различной интенсивностью образования хлопьев или геля при положительном результате использовали градацию, обозначаемую в условных единицах (у.ед.): 1 у.ед. – наличие мелкой зернистости и хлопьев, 2 у.ед. – наличие рыхлого сгустка или крупных хлопьев, 3 у.ед. – наличие плотного сгустка, 4 у.ед. – наличие геля; в норме тест отрицательный (плазма прозрачная, слегка опалесцирующая); определение Д-димеров методом латексной агглютинации наборами фирмы “Organon Teknika” (Нидерланды); активность антитромбина III (ATIII в % методом Марберта и Винтер-штейна в модификации Ю.Л.Кацадзе и М.А.Котовщиковой (7); количество тромбоцитов определяли с помощью фазово-контрастной микроскопии; плазму крови больных, получавших гепарин, и при взятии крови из катетеризированной вены перед определением концентрации фибриногена, активности АТШ, индекса АПТВ и %-ПИ обрабатывали сорбентом с целью удаления гепарина, используя “Гепасорб 1” и “Гепасорб 2” фирмы “Технология – стандарт”, Барнаул (3).
При выявлении у больных повышения концентрации фибриногена до 4,21±0,2 г/л, маркеров активации свертывающей системы и фибринолиза (РФМК до 188,0±13,9 мкг/л, ПДФ – 1 и 2 у.ед. и Д-димеров – более 500 нг/мл), уровня %-ПИ, равного 91,9±1,25%, при повышенных до 123±8,85% показателях плазминогена, а также удлинении времени Хагеман-зависимого лизиса эуглобулинового сгустка до 27±4,16 мин, при отсутствии потребления тромбоцитов с учетом клинических проявлений у пациентов диагностировали состояние гиперкоагуляции (ПВС III степени, пре-ДВС). Указанные выше лабораторные тесты при выявлении гиперкоагуляции следует выполнять не реже 2-3 раз в неделю на терапии индукции и консолидации ремиссии острого лейкоза. При присоединении инфекционных осложнений подобные исследования необходимо проводить ежедневно. Больным с выявленным состоянием гиперкоагуляции проводили комплекс мероприятий, направленных на профилактику ДВС-синдрома. Для состояния пре-ДВС характерны клинические проявления, значимо отличающиеся от таковых при развившемся ДВС-синдроме (см. далее раздел “Клинико-лабораторные исследования”).
Пример описания способа.
Больная Т., 49 лет, с острым миелобластным лейкозом, М2 вариант по FAB классификации. При постановке диагноза: кожный геморрагический синдром II типа в виде гематом на предплечье, кровоточивости десен. С 27.01.01 начата терапия индукции ремиссии по протоколу “7+3+Vp16”. OAK перед началом терапии: Нb-90 г/л, Le-7 109/л устанавливают стадию пре-ДВС. Технический результат – способ обеспечивает раннее и достоверное определение пре-ДВС синдрома у больных острым лейкозом. 3 табл.
Изобретение относится к медицине и касается установления комплекса методов исследования системы свертывания крови и уровня их результатов, свидетельствующих о наличии гиперкоагуляции и возможном переходе этого состояния в ДВС-синдром у больных острым лейкозом (ОЛ) в процессе полихимиотерапии (ПХТ).
В настоящее время существует достаточно сведений о том, что процесс внутрисосудистого свертывания крови происходит постоянно (6) и его, по мнению И.Н.Бокарева (4, 5), следует особо выделить, обозначив термином ПВС (постоянное внутрисосудистое свертывание). Этот же автор рекомендует оценивать интенсивность процесса по 4 степеням. III степень ПВС – это состояние гиперкоагуляции или пре-ДВС, IV – ДВС-синдром. Различия в степени повышения внутрисосудистого свертывания крови могут нарастать постепенно и лишь на определенном этапе приводить к развитию выраженной клинической картины ДВС-синдрома. Вместе с тем эти изменения могут быть и молниеносными. Большинство сведений литературы, относящихся к этой стороне проблемы, касаются развития ДВС-синдрома у больных не гематологического профиля (1, 8, 9). Значительное количество геморрагических и тромботических осложнений у пациентов острым лейкозом вызываются нарушениями системы свертывания крови как в результате самого лейкозного процесса, так и применения цитостатических препаратов, активной гормоно- и антибиотикотерапии, а также присоединения инфекции (2, 12). Все это определяет актуальность диагностики и профилактики гиперкоагуляции у больных острым лейкозом, поэтому необходимо определить четкие ранние диагностические критерии гиперкоагуляции у этих больных, при которых необходимо проводить профилактику развития ДВС-синдрома.
В качестве прототипов нами использованы публикации H.Wada, N.Sakuragawa, Y.Mori et al. (1999) и H.Wada, N.Sakuragawa, H.Shiku (1998). Существенным недостатком их является то, что приведен комплекс методов, используемых для диагностики возможного развития ДВС-синдрома у больных острым лейкозом, однако четко не указаны уровни результатов, при которых возникает реальная угроза развития клинической картины ДВС-синдрома. Результаты оценки коагуляции представлены за 7-1 сутки до развития ДВС. При этом отдельные показатели коагуляции или комплекс их за 7, 5, 3, 1 сутки до развития ДВС-синдрома изменялись разнопланово и трактовка их была дана так, что трудно ориентироваться, в какое время может возникнуть ДВС-синдром. Кроме того, прототипы не предусматривают характерных и четких показателей клинической картины состояния пре-ДВС (гиперкоагуляции, III степени ПВС) у больных ОЛ. Вместе с тем важно определить четкие ранние диагностические критерии наличия пре-ДВС, как лабораторные, так и клинические, включающие не только комплекс рекомендуемых методов, но и уровни их результатов, при которых не только возможно, но и необходимо проводить своевременную профилактику развития ДВС-синдрома у больных острым лейкозом.
Целью настоящего изобретения является раннее достоверное определение состояния пре-ДВС у больных острым лейкозом путем выбора комплекса методов исследования гемостаза, уровня их результатов и характерных для этого состояния клинических проявлений.
Поставленная цель достигается тем, что при исследовании в динамике состояния гемостаза у больных острым лейкозом в период индукции и консолидации ремиссии использовали ряд методов: определение концентрации фибриногена по Р.А.Рутберг (3); протромбиновое время в секундах по Квику выражали в виде протромбинового индекса (%-ПИ) по общепринятой формуле (3); активированное парциальное тромбопластиновое время (АПТВ) выражали в виде индекса как отношение АПТВ исследуемой плазмы в секундах к таковому контрольной (3); время лизиса эуглобулиновой фракции, активированное каолином (Хагеман-зависимый эуглобулиновый лизис – ФА) по методу Г.Ф.Еремина и А.П.Архипова (3); активность плазминогена с применением хромогенных субстратов (3); количество растворимых фибринмономерных комплексов (РФМК) в фенатролиновом тесте по методу А.П.Момота с соавт. (3); продукты деградации фибриногена/фибрина (ПДФ) в этаноловом тесте по Godal et al. (3). Тест считается качественным (положительный или отрицательный), но в связи с различной интенсивностью образования хлопьев или геля при положительном результате использовали градацию, обозначаемую в условных единицах (у.ед.): 1 у.ед. – наличие мелкой зернистости и хлопьев, 2 у.ед. – наличие рыхлого сгустка или крупных хлопьев, 3 у.ед. – наличие плотного сгустка, 4 у.ед. – наличие геля; в норме тест отрицательный (плазма прозрачная, слегка опалесцирующая); определение Д-димеров методом латексной агглютинации наборами фирмы “Organon Teknika” (Нидерланды); активность антитромбина III (ATIII в % методом Марберта и Винтер-штейна в модификации Ю.Л.Кацадзе и М.А.Котовщиковой (7); количество тромбоцитов определяли с помощью фазово-контрастной микроскопии; плазму крови больных, получавших гепарин, и при взятии крови из катетеризированной вены перед определением концентрации фибриногена, активности АТШ, индекса АПТВ и %-ПИ обрабатывали сорбентом с целью удаления гепарина, используя “Гепасорб 1” и “Гепасорб 2” фирмы “Технология – стандарт”, Барнаул (3).
При выявлении у больных повышения концентрации фибриногена до 4,21±0,2 г/л, маркеров активации свертывающей системы и фибринолиза (РФМК до 188,0±13,9 мкг/л, ПДФ – 1 и 2 у.ед. и Д-димеров – более 500 нг/мл), уровня %-ПИ, равного 91,9±1,25%, при повышенных до 123±8,85% показателях плазминогена, а также удлинении времени Хагеман-зависимого лизиса эуглобулинового сгустка до 27±4,16 мин, при отсутствии потребления тромбоцитов с учетом клинических проявлений у пациентов диагностировали состояние гиперкоагуляции (ПВС III степени, пре-ДВС). Указанные выше лабораторные тесты при выявлении гиперкоагуляции следует выполнять не реже 2-3 раз в неделю на терапии индукции и консолидации ремиссии острого лейкоза. При присоединении инфекционных осложнений подобные исследования необходимо проводить ежедневно. Больным с выявленным состоянием гиперкоагуляции проводили комплекс мероприятий, направленных на профилактику ДВС-синдрома. Для состояния пре-ДВС характерны клинические проявления, значимо отличающиеся от таковых при развившемся ДВС-синдроме (см. далее раздел “Клинико-лабораторные исследования”).
Пример описания способа.
Больная Т., 49 лет, с острым миелобластным лейкозом, М2 вариант по FAB классификации. При постановке диагноза: кожный геморрагический синдром II типа в виде гематом на предплечье, кровоточивости десен. С 27.01.01 начата терапия индукции ремиссии по протоколу “7+3+Vp16”. OAK перед началом терапии: Нb-90 г/л, Le-7 109/л Тr-150 109/л Тr-150 109/л. Коагулограмма: индекс АПТВ 1,07, %-ПИ 93%, ТВ 14,5 с (N-13,5), ФА 14,5 мин, фибриноген 4,5 г/л, ПДФ 1 у.ед., AT III 133%, РФМК 234 мкг/мл, D-димеры <500 нг/мл, плазминоген 159%. После проведения лечения по индукционному протоколу у больной усилился геморрагический синдром – на фоне адекватной заместительной терапии (Тr-40-60-130 109/л. Коагулограмма: индекс АПТВ 1,07, %-ПИ 93%, ТВ 14,5 с (N-13,5), ФА 14,5 мин, фибриноген 4,5 г/л, ПДФ 1 у.ед., AT III 133%, РФМК 234 мкг/мл, D-димеры <500 нг/мл, плазминоген 159%. После проведения лечения по индукционному протоколу у больной усилился геморрагический синдром – на фоне адекватной заместительной терапии (Тr-40-60-130 109/л). На 4-е сутки после окончания ПХТ на 15 день агранулоцитоза появилась лихорадка без видимых очагов инфекции с нестабильной гемодинамикой в течение суток, отмечено повышение креатинина до 129 мкмоль/л и мочевины до 8,4 ммоль/л. Показатели OAK в это время: Нb 77 г/л, Lе 0,6 109/л). На 4-е сутки после окончания ПХТ на 15 день агранулоцитоза появилась лихорадка без видимых очагов инфекции с нестабильной гемодинамикой в течение суток, отмечено повышение креатинина до 129 мкмоль/л и мочевины до 8,4 ммоль/л. Показатели OAK в это время: Нb 77 г/л, Lе 0,6 109/л, Тr 60 109/л, Тr 60 109/л. Коагулограмма: индекс АПТВ 0,73, %-ПИ 89%, ТВ 13,5 с (N 12 с), ФА 20 мин, фибриноген 6,5 г/л, ПДФ 3 у.ед., AT III 156% РФМК 280 мкг/мл, D-димеры >1000 нг/мл. При этом, несмотря на адекватную заместительную терапию тромбоконцентратом, у больной усилился кожный геморрагический синдром, отмечено носовое и обильное маточное кровотечение. Данные клиники и лабораторных исследований позволили констатировать о переходе ПВС III степени в ДВС.
У этой же больной перед проведением терапии консолидации не был диагностирован ПВС III степени по данным коагулограммы: индекс АПТВ 0,85, %-ПИ 97%, ТВ 12 с (N-13,4 с), ФА 13,6 мин, фибриноген 4,75 г/л, ПДФ 2 у.ед., АТIII 76%, РФМК 258 мкг/мл, плазминоген 173%, D-димеры 500-1000 нг/мл. В OAK: Hb 89 г/л, Le 1,9 109/л. Коагулограмма: индекс АПТВ 0,73, %-ПИ 89%, ТВ 13,5 с (N 12 с), ФА 20 мин, фибриноген 6,5 г/л, ПДФ 3 у.ед., AT III 156% РФМК 280 мкг/мл, D-димеры >1000 нг/мл. При этом, несмотря на адекватную заместительную терапию тромбоконцентратом, у больной усилился кожный геморрагический синдром, отмечено носовое и обильное маточное кровотечение. Данные клиники и лабораторных исследований позволили констатировать о переходе ПВС III степени в ДВС.
У этой же больной перед проведением терапии консолидации не был диагностирован ПВС III степени по данным коагулограммы: индекс АПТВ 0,85, %-ПИ 97%, ТВ 12 с (N-13,4 с), ФА 13,6 мин, фибриноген 4,75 г/л, ПДФ 2 у.ед., АТIII 76%, РФМК 258 мкг/мл, плазминоген 173%, D-димеры 500-1000 нг/мл. В OAK: Hb 89 г/л, Le 1,9 109/л, Тr 300 109/л, Тr 300 109/л. Больной был назначен гепарин в дозе 10000 ЕД/сут на 12 дней. Усиления геморрагического синдрома на ПХТ “7+3+Vp16” и после нее у больной не отмечено. Переливания тромбоцитов с заместительной целью не потребовались. Коагулограмма после гепаринотерапии: индекс АПТВ 1,3, %-ПИ 87%, ТВ 18 с (N-18 с), ФА 5,5 мин, фибриноген 4,0 г/л, ПДФ 1 у.ед., AT III 108%, РФМК 50 мкг/мл, D-димеры<500 нг/мл, плазминоген 108%. В OAK: Hb 80 г/л, Le 5,0 109/л. Больной был назначен гепарин в дозе 10000 ЕД/сут на 12 дней. Усиления геморрагического синдрома на ПХТ “7+3+Vp16” и после нее у больной не отмечено. Переливания тромбоцитов с заместительной целью не потребовались. Коагулограмма после гепаринотерапии: индекс АПТВ 1,3, %-ПИ 87%, ТВ 18 с (N-18 с), ФА 5,5 мин, фибриноген 4,0 г/л, ПДФ 1 у.ед., AT III 108%, РФМК 50 мкг/мл, D-димеры<500 нг/мл, плазминоген 108%. В OAK: Hb 80 г/л, Le 5,0 109/л, Тr 350 109/л, Тr 350 109/л (табл.1). 109/л (табл.1).
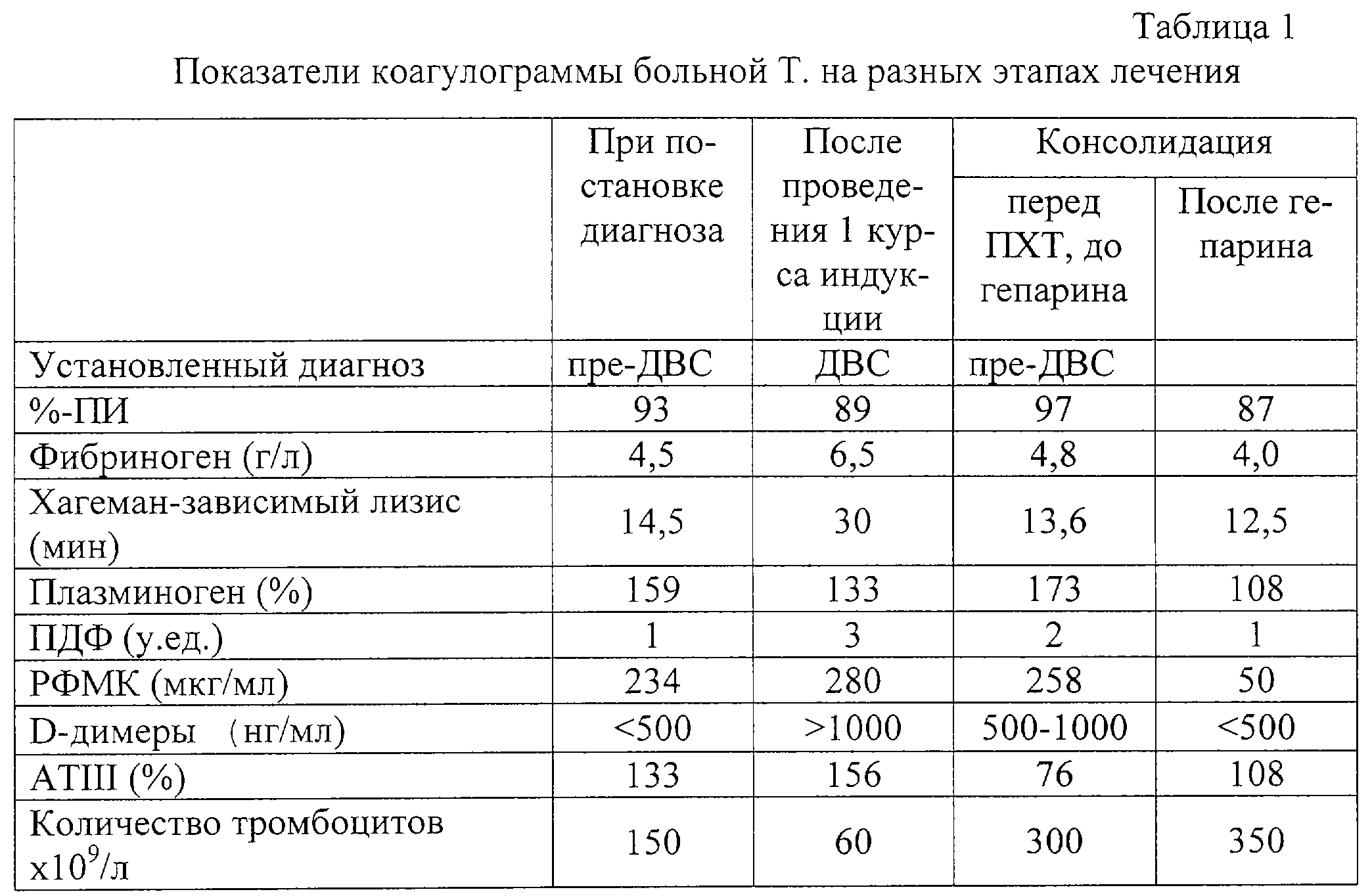 Клинико-лабораторные исследования.
Предлагаемые критерии диагностики состояния гиперкоагуляции (ПВС III степени, пре-ДВС) выведены по результатам исследования 61 больного острым лейкозом (возраст 47,0±1,7 лет). Терапию индукции и консолидации пациентам проводили по протоколу “7+3”. Рассчитывали средние значения показателей 9 тестов исследования гемостаза в следующих выборках: у 33 больных с гиперкоагуляционными сдвигами в коагулограмме, но без выраженных клинических признаков ДВС-синдрома и у 28 – с характерными клиническими проявлениями его. Группу сравнения для оценки показателей гемостаза составили 35 доноров.
Анализ результатов клинического состояния больных показал выраженные различия его в сравниваемых группах (табл.2).
Клинико-лабораторные исследования.
Предлагаемые критерии диагностики состояния гиперкоагуляции (ПВС III степени, пре-ДВС) выведены по результатам исследования 61 больного острым лейкозом (возраст 47,0±1,7 лет). Терапию индукции и консолидации пациентам проводили по протоколу “7+3”. Рассчитывали средние значения показателей 9 тестов исследования гемостаза в следующих выборках: у 33 больных с гиперкоагуляционными сдвигами в коагулограмме, но без выраженных клинических признаков ДВС-синдрома и у 28 – с характерными клиническими проявлениями его. Группу сравнения для оценки показателей гемостаза составили 35 доноров.
Анализ результатов клинического состояния больных показал выраженные различия его в сравниваемых группах (табл.2).
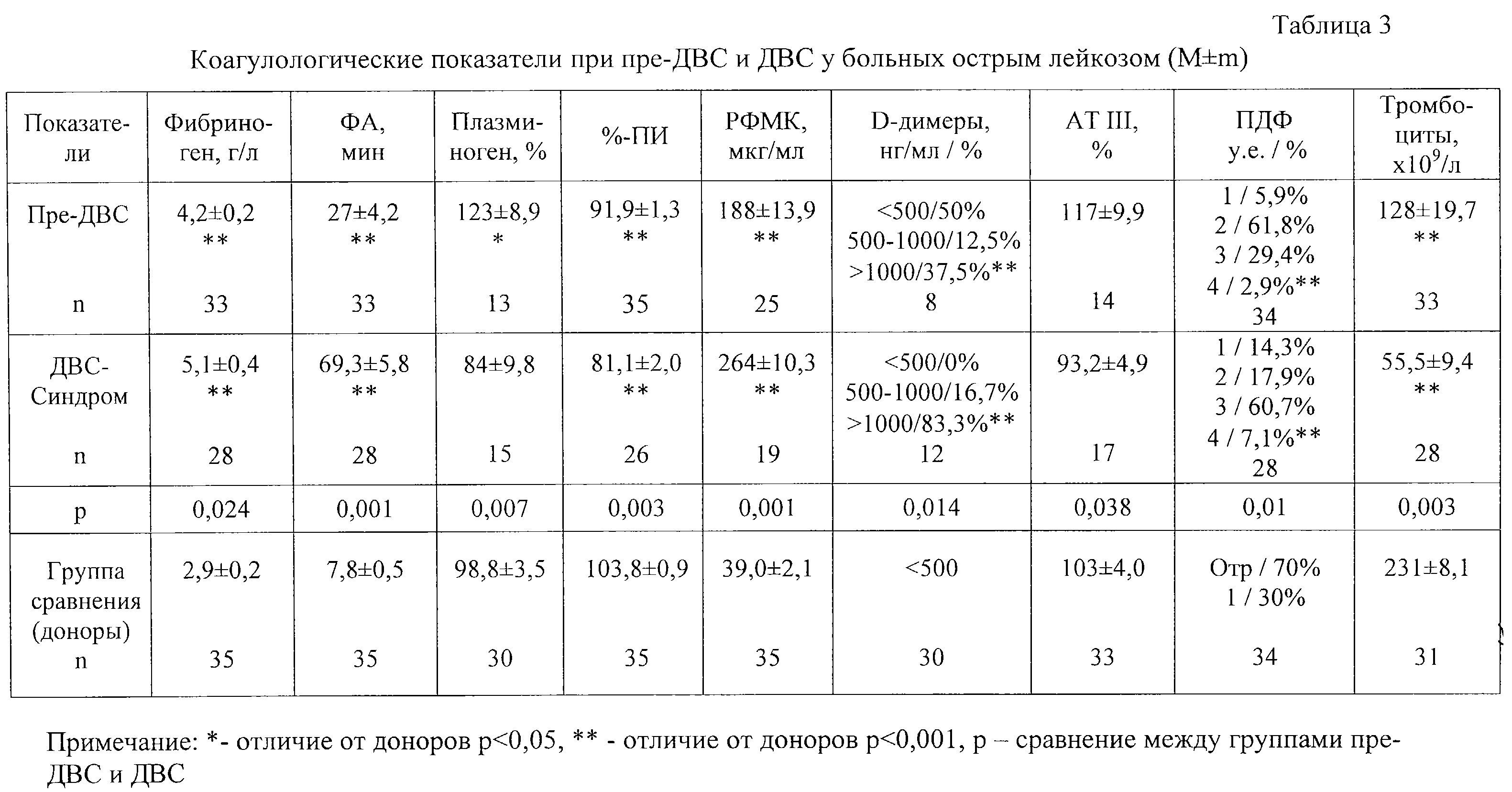
 При состоянии пре-ДВС у 50% больных отсутствовали очаги инфекции, а лихорадка более 38,5
При состоянии пре-ДВС у 50% больных отсутствовали очаги инфекции, а лихорадка более 38,5 С продолжительностью свыше 3-х дней была лишь у 25%. Геморрагический синдром отсутствовал у 35%, ГС I-II типов отмечен у 50% и III – лишь у 15% пациентов. При этом показатели гемостаза по отношению к таковым доноров характеризовались значимым повышением концентрации фибриногена, маркеров активации системы свертывания и фибринолиза (РФМК, ПДФ, Д-димеров), нормальной активностью ATIII и незначительно сниженным уровнем протромбинового индекса, а также выраженным удлинением времени каолин-зависимого лизиса эуглобулиновой фракции плазмы. Последний показатель подтверждает снижение потенциальной способности фибринолитической системы к активации плазминогена (табл.3).
У больных с ДВС-синдромом длительная лихорадка имела место в 100% случаев, причем у 21% лиц она сопровождалась нестабильной гемодинамикой (снижением артериального давления до <90/70 мм рт.ст.). В 45% наблюдений при ДВС-синдроме имел место бактериологически подтвержденный сепсис. Геморрагический синдром IV типа был у 31,6%, III – у 36,8% больных (см. табл.2). При ДВС было выявлено достоверно более выраженное, нежели при пре-ДВС, повышение маркеров внутрисосудистого свертывания крови, таких как РФМК, Д-димеры, а также фибриногена, снижение плазминогена, более выраженное удлинение времени лизиса эуглобулиновой фракции плазмы и снижение %-ПИ (см. табл.3). У всех больных с ДВС-синдромом отмечено также резкое снижение количества тромбоцитов.
Таким образом, разработанный способ позволяет выявить состояние гиперкоагуляции у больных ОЛ и предотвратить путем назначения профилактической терапии развитие тяжелых геморрагических и тромбоэмболических осложнений, нередко являющихся причиной гибели больных данной категории. Он найдет применение при контроле лечения больных острым лейкозом в клинико-диагностических и экспресс лабораториях специализированных лечебных учреждений и больниц, имеющих гематологические отделения или койки. Применяемые методы исследования доступны как по их выполнению, так и по материальным затратам. С продолжительностью свыше 3-х дней была лишь у 25%. Геморрагический синдром отсутствовал у 35%, ГС I-II типов отмечен у 50% и III – лишь у 15% пациентов. При этом показатели гемостаза по отношению к таковым доноров характеризовались значимым повышением концентрации фибриногена, маркеров активации системы свертывания и фибринолиза (РФМК, ПДФ, Д-димеров), нормальной активностью ATIII и незначительно сниженным уровнем протромбинового индекса, а также выраженным удлинением времени каолин-зависимого лизиса эуглобулиновой фракции плазмы. Последний показатель подтверждает снижение потенциальной способности фибринолитической системы к активации плазминогена (табл.3).
У больных с ДВС-синдромом длительная лихорадка имела место в 100% случаев, причем у 21% лиц она сопровождалась нестабильной гемодинамикой (снижением артериального давления до <90/70 мм рт.ст.). В 45% наблюдений при ДВС-синдроме имел место бактериологически подтвержденный сепсис. Геморрагический синдром IV типа был у 31,6%, III – у 36,8% больных (см. табл.2). При ДВС было выявлено достоверно более выраженное, нежели при пре-ДВС, повышение маркеров внутрисосудистого свертывания крови, таких как РФМК, Д-димеры, а также фибриногена, снижение плазминогена, более выраженное удлинение времени лизиса эуглобулиновой фракции плазмы и снижение %-ПИ (см. табл.3). У всех больных с ДВС-синдромом отмечено также резкое снижение количества тромбоцитов.
Таким образом, разработанный способ позволяет выявить состояние гиперкоагуляции у больных ОЛ и предотвратить путем назначения профилактической терапии развитие тяжелых геморрагических и тромбоэмболических осложнений, нередко являющихся причиной гибели больных данной категории. Он найдет применение при контроле лечения больных острым лейкозом в клинико-диагностических и экспресс лабораториях специализированных лечебных учреждений и больниц, имеющих гематологические отделения или койки. Применяемые методы исследования доступны как по их выполнению, так и по материальным затратам.
 ЛИТЕРАТУРА
1. Балуда В.П., Балуда М.В., Гольдберг А.П. и др. Претромботическое состояние. Тромбоз и его профилактика. – М.: Зеркало – М., 1999, 297 c.
3. Баркаган З.С., Момот А.П. Основные методы лабораторной диагностики нарушений системы гемостаза. Барнаул: Ньюадимед-АО, 1998, 127 c.
4. Бокарев И.Н. ДВС-синдром: проблемы клинической классификации и патогенетического лечения синдрома. Materia Medica. – 1997, N l, с.15-22.
5. Бокарев И.Н. Концептуальное решение проблемы ДВС – ПВС. Тромбозы, геморрагии, ДВС-синдром. Проблемы лечения. Материалы V Всерос. конф. – М., 2000, с.43-47.
6. Зубаиров Д.М. Молекулярные основы свертывания крови тромбообразования. – Казань: Фэн, 2000, 364 c.
7. Долгов В.В., Авдеева Н.А., Щетникович К.А. Методы исследования гемостаза. Пособие для врачей клин. лаб. диагностики. – М., 1996, 58 c.
8. Панченко Е.П., Добровольский А.Б. Активация системы гемостаза. Тромбозы в кардиологии. Механизмы развития и возможности терапии. – М.: Спорт и культура, 1999, гл.5, с.201-215.
9. Oliver A., Mayoral J.F., Montserrat I. et al. Prognostic value of coagulation and fibrinolysis activation markers in critically ill patients. Thromb. Haemost. – 1993, vol.69, N6, p.731.
10. Wada H., Sakuragawa N., Mori Y. et.al. Hemostatic molecular markers before the onset of disseminated intravascular coagulation. Am. J.Hematol. – 1999, vol.60. p.273-278.
1l. Wada H., Sakuragawa N., Shiku H. Hemostatic molecular markers before the onset of disseminated intravascular coagulation in leukemic patients. Semin. Thromb. Hemost. – 1998, vol.24, N 3, p.293-297.
12. Wada H., Gabazza B.C., Shiku H., Nobori Т. Диагноз и лечение ДВС-синдрома. Тромбоз, гемостаз и реология. – 2001, N 3, с.16-22.
ЛИТЕРАТУРА
1. Балуда В.П., Балуда М.В., Гольдберг А.П. и др. Претромботическое состояние. Тромбоз и его профилактика. – М.: Зеркало – М., 1999, 297 c.
3. Баркаган З.С., Момот А.П. Основные методы лабораторной диагностики нарушений системы гемостаза. Барнаул: Ньюадимед-АО, 1998, 127 c.
4. Бокарев И.Н. ДВС-синдром: проблемы клинической классификации и патогенетического лечения синдрома. Materia Medica. – 1997, N l, с.15-22.
5. Бокарев И.Н. Концептуальное решение проблемы ДВС – ПВС. Тромбозы, геморрагии, ДВС-синдром. Проблемы лечения. Материалы V Всерос. конф. – М., 2000, с.43-47.
6. Зубаиров Д.М. Молекулярные основы свертывания крови тромбообразования. – Казань: Фэн, 2000, 364 c.
7. Долгов В.В., Авдеева Н.А., Щетникович К.А. Методы исследования гемостаза. Пособие для врачей клин. лаб. диагностики. – М., 1996, 58 c.
8. Панченко Е.П., Добровольский А.Б. Активация системы гемостаза. Тромбозы в кардиологии. Механизмы развития и возможности терапии. – М.: Спорт и культура, 1999, гл.5, с.201-215.
9. Oliver A., Mayoral J.F., Montserrat I. et al. Prognostic value of coagulation and fibrinolysis activation markers in critically ill patients. Thromb. Haemost. – 1993, vol.69, N6, p.731.
10. Wada H., Sakuragawa N., Mori Y. et.al. Hemostatic molecular markers before the onset of disseminated intravascular coagulation. Am. J.Hematol. – 1999, vol.60. p.273-278.
1l. Wada H., Sakuragawa N., Shiku H. Hemostatic molecular markers before the onset of disseminated intravascular coagulation in leukemic patients. Semin. Thromb. Hemost. – 1998, vol.24, N 3, p.293-297.
12. Wada H., Gabazza B.C., Shiku H., Nobori Т. Диагноз и лечение ДВС-синдрома. Тромбоз, гемостаз и реология. – 2001, N 3, с.16-22.
Формула изобретения Способ определения ранних критериев развития гиперкоагуляции в стадии пре-ДВС в процессе лечения больных острым лейкозом путем клинического и лабораторного исследования, включающего определение растворимых фибрин-мономерных комплексов (РФМК) и Д-димеров в крови, отличающийся тем, что для установления стадии, предшествующей ДВС-синдрому, определяют уровни фибриногена, промтромбинового индекса (%-ПИ), продуктов деградации фибриноген-фибрина (ПДФ) в этаноловом тесте, плазминогена, времени Хагеман-зависимого эуглобулинового лизиса и количество тромбоцитов и при уровне фибриногена 4,21±0,2 г/л, протромбинового индекса 91,9±1,3%, растворимых фибрин-мономерных комплексов в ортофенантролиновом 188,0±13,9 мкг/л и продуктов деградации фибриноген-фибрина 1-2 у.ед. этаноловом тестах, Д-димеров более 500 нг/мл, плазминогена 123,0±8,9%, времени Хагеман-зависимого эуглобулинового лизиса 27,0±4,2 мин и количестве тромбоцитов в крови 128±19,7  109/л устанавливают стадию пре-ДВС. 109/л устанавливают стадию пре-ДВС.
MM4A Досрочное прекращение действия патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 08.06.2004
Извещение опубликовано: 20.05.2006 БИ: 14/2006
|
||||||||||||||||||||||||||
