Патент на изобретение №2227137
|
||||||||||||||||||||||||||
(54) СПОСОБ ПОЛУЧЕНИЯ
(57) Реферат: Изобретение относится к усовершенствованному способу получения  , , -диметилфенилуксусной кислоты без использования повышенного давления, в котором -диметилфенилуксусной кислоты без использования повышенного давления, в котором  , , -диметилбензилцианид в присутствии воды, гидроокиси натрия и С4-спирта и/или С5-спирта при температуре более 100 -диметилбензилцианид в присутствии воды, гидроокиси натрия и С4-спирта и/или С5-спирта при температуре более 100 С превращают в соответствующую соль карбоновой кислоты и затем получают С превращают в соответствующую соль карбоновой кислоты и затем получают  , , -диметилфенилуксусную кислоту путем добавления кислоты. Способ позволяет получить очищенный от примесей целевой продукт с высоким выходом – 97,3%. 7 з.п.ф-лы.
Известно получение -диметилфенилуксусную кислоту путем добавления кислоты. Способ позволяет получить очищенный от примесей целевой продукт с высоким выходом – 97,3%. 7 з.п.ф-лы.
Известно получение  , , -диметилфенилуксусной кислоты из -диметилфенилуксусной кислоты из  , , -диметилбензилцианида. Такое получение описано в Journal of Medical Chemistry, 1977, т.20, №8, с.1063. При этом нитрил 2-фенил-2-метилпропионовой кислоты ( -диметилбензилцианида. Такое получение описано в Journal of Medical Chemistry, 1977, т.20, №8, с.1063. При этом нитрил 2-фенил-2-метилпропионовой кислоты ( , , -диметилбензилцианид) в растворе КОН (5-кратный молярный избыток) и метанол перемешивают в автоклаве под давлением при температуре от 140 до 150 -диметилбензилцианид) в растворе КОН (5-кратный молярный избыток) и метанол перемешивают в автоклаве под давлением при температуре от 140 до 150 С в течение 20 часов, затем концентрируют реакционную смесь под уменьшенным давлением, разбавляют водой и подкисляют. Полученную в виде белого кристаллизата С в течение 20 часов, затем концентрируют реакционную смесь под уменьшенным давлением, разбавляют водой и подкисляют. Полученную в виде белого кристаллизата  , , -диметилфенилуксусную кислоту затем очищают с помощью дорогостоящего процесса очистки – фильтрации и перекристаллизации из этанола. При этом получают -диметилфенилуксусную кислоту затем очищают с помощью дорогостоящего процесса очистки – фильтрации и перекристаллизации из этанола. При этом получают  , , -диметилфенилуксусную кислоту с температурой плавления 80 -диметилфенилуксусную кислоту с температурой плавления 80 С. Теоретический выход составляет 90%.
Некоторые опыты, в которых нитрил 2-фенил-2-метилпропионовой кислоты ( С. Теоретический выход составляет 90%.
Некоторые опыты, в которых нитрил 2-фенил-2-метилпропионовой кислоты ( , , -диметилбензилцианид) подвергают взаимодействию в смеси бутанола, воды и КОН (3-кратный молярный избыток) при температуре около 125 -диметилбензилцианид) подвергают взаимодействию в смеси бутанола, воды и КОН (3-кратный молярный избыток) при температуре около 125 С более 22 часов, также не приводят к полному омылению введенного нитрила. Кроме того, находят также промежуточную стадию – соответствующий амид в количестве 2%. Присутствие этой промежуточной стадии требует дополнительной стадии очистки для получения С более 22 часов, также не приводят к полному омылению введенного нитрила. Кроме того, находят также промежуточную стадию – соответствующий амид в количестве 2%. Присутствие этой промежуточной стадии требует дополнительной стадии очистки для получения  , , -диметилфенилуксусной кислоты с большой степенью чистоты.
Некоторые опыты в смеси н-бутанола, воды и гидроокиси лития показали после 4-часового омыления при температуре около 100 -диметилфенилуксусной кислоты с большой степенью чистоты.
Некоторые опыты в смеси н-бутанола, воды и гидроокиси лития показали после 4-часового омыления при температуре около 100 C (противоток) только образование около 1% амида промежуточной стадии. Омыление до образования карбоновой кислоты не удалось обнаружить.
Далее некоторые опыты в 50%-ных водных растворах едкого калия и едкого натра (3-кратный молярный избыток) при 125 C (противоток) только образование около 1% амида промежуточной стадии. Омыление до образования карбоновой кислоты не удалось обнаружить.
Далее некоторые опыты в 50%-ных водных растворах едкого калия и едкого натра (3-кратный молярный избыток) при 125 С при сильном перемешивании показали через 20 часов реакции следующие результаты анализа:
Едкий калий: Нитрил 0,4%
Амид 51%
Карбоновая кислота 47%
Едкий натр: Нитрил 62%
Амид 34%
Карбоновая кислота 2,7%
Реакция омыления с более сильным основанием гидроокисью калия протекает намного быстрее, чем с более слабым основанием. Итак, приведены следующие скорости омыления: LiOH С при сильном перемешивании показали через 20 часов реакции следующие результаты анализа:
Едкий калий: Нитрил 0,4%
Амид 51%
Карбоновая кислота 47%
Едкий натр: Нитрил 62%
Амид 34%
Карбоновая кислота 2,7%
Реакция омыления с более сильным основанием гидроокисью калия протекает намного быстрее, чем с более слабым основанием. Итак, приведены следующие скорости омыления: LiOH , , -диметилфенилуксусной кислоты, в основном свободной от нитрила 2-фенил-2-метилпропионовой кислоты ( -диметилфенилуксусной кислоты, в основном свободной от нитрила 2-фенил-2-метилпропионовой кислоты ( , , -диметилбензилцианид) и амида 2-фенил-2-метилпропионовой кислоты путем модификации способа получения.
Задача решается тем, что взаимодействие -диметилбензилцианид) и амида 2-фенил-2-метилпропионовой кислоты путем модификации способа получения.
Задача решается тем, что взаимодействие  , , -диметилбензилцианида проводят в присутствии гидроокиси натрия, воды и С4– или С5-спирта при температуре более 100 -диметилбензилцианида проводят в присутствии гидроокиси натрия, воды и С4– или С5-спирта при температуре более 100 С (при нормальном давлении) и затем получают С (при нормальном давлении) и затем получают  , , -диметилфенилуксусную кислоту путем подкисления. Дополнительные стадии очистки больше не требуются.
Таким образом, изобретение касается способа получения соединения формулы I -диметилфенилуксусную кислоту путем подкисления. Дополнительные стадии очистки больше не требуются.
Таким образом, изобретение касается способа получения соединения формулы I
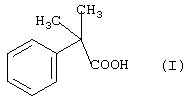 отличающегося тем, что соединение формулы II
отличающегося тем, что соединение формулы II
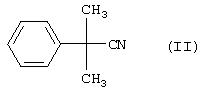 в присутствии воды, гидроокиси натрия и С4-спирта или С5-спирта при температуре более 100
в присутствии воды, гидроокиси натрия и С4-спирта или С5-спирта при температуре более 100 С превращают в соответствующую соль карбоновой кислоты и затем получают соединение формулы I путем добавления кислоты.
При получении соединения формулы I исходят из того, что сначала смешивают С4-спирт или С5-спирт, воду, гидроокись натрия и соединение формулы II ( С превращают в соответствующую соль карбоновой кислоты и затем получают соединение формулы I путем добавления кислоты.
При получении соединения формулы I исходят из того, что сначала смешивают С4-спирт или С5-спирт, воду, гидроокись натрия и соединение формулы II ( , , -диметилбензилцианид) и при перемешивании нагревают до температуры больше, чем 100 -диметилбензилцианид) и при перемешивании нагревают до температуры больше, чем 100 С. Можно также использовать смесь С4– и С5-спиртов.
После соответствующего времени реакции реакционную смесь охлаждают и посредством кислоты осаждают С. Можно также использовать смесь С4– и С5-спиртов.
После соответствующего времени реакции реакционную смесь охлаждают и посредством кислоты осаждают  , , -диметилфенилуксусную кислоту. Выделение -диметилфенилуксусную кислоту. Выделение  , , -диметилфенилуксусной кислоты происходит, к примеру, путем кристаллизации или экстракции. Кристаллизацию осуществляют путем охлаждения суспензии или дальнейшего выпаривания растворителя. Экстракцию осуществляют посредством добавления органических растворителей к -диметилфенилуксусной кислоты происходит, к примеру, путем кристаллизации или экстракции. Кристаллизацию осуществляют путем охлаждения суспензии или дальнейшего выпаривания растворителя. Экстракцию осуществляют посредством добавления органических растворителей к  , , -диметилфенилуксусной кислоте, например толуола.
Под термином С4– и C5-спирта понимают, например, н-бутанол, 2-метил-1-пропанол, н-пентанол, 2-пентанол, 3-пентанол, 2-метил-2-бутанол, 3-метил-2-бутанол, 2-метил-3-бутанол, 3-метил-1-бутанол или 2-метил-1-бутанол.
Под термином гидроокись натрия понимают едкий натр в твердой форме или в форме щелочи различной концентрации. Вода, присутствующая в щелочи, учитывается потом при расчете при приготовлении омыляющей смеси.
Подходящими кислотами являются, к примеру, соляная кислота, серная кислота, азотная кислота, или фосфорная кислота, или смеси кислот.
Предпочтительно для реакции омыления применяют на 100 молей соединения формулы II от 120 до 250 молей воды и от 150 до 300 молей гидроокиси натрия.
Применяемое количество С4– или C5-спирта составляет, в общем, от 0,5 до 1,5 кг на кг соединения формулы II, предпочтительно от 0,6 до 1,0 кг.
Время реакции составляет, в общем, от 2 до 6 часов в зависимости от состава смеси и выбранного интервала температур.
Температура реакции составляет в зависимости от применяемого С4– или C5-спирта от более чем 100 до 140 -диметилфенилуксусной кислоте, например толуола.
Под термином С4– и C5-спирта понимают, например, н-бутанол, 2-метил-1-пропанол, н-пентанол, 2-пентанол, 3-пентанол, 2-метил-2-бутанол, 3-метил-2-бутанол, 2-метил-3-бутанол, 3-метил-1-бутанол или 2-метил-1-бутанол.
Под термином гидроокись натрия понимают едкий натр в твердой форме или в форме щелочи различной концентрации. Вода, присутствующая в щелочи, учитывается потом при расчете при приготовлении омыляющей смеси.
Подходящими кислотами являются, к примеру, соляная кислота, серная кислота, азотная кислота, или фосфорная кислота, или смеси кислот.
Предпочтительно для реакции омыления применяют на 100 молей соединения формулы II от 120 до 250 молей воды и от 150 до 300 молей гидроокиси натрия.
Применяемое количество С4– или C5-спирта составляет, в общем, от 0,5 до 1,5 кг на кг соединения формулы II, предпочтительно от 0,6 до 1,0 кг.
Время реакции составляет, в общем, от 2 до 6 часов в зависимости от состава смеси и выбранного интервала температур.
Температура реакции составляет в зависимости от применяемого С4– или C5-спирта от более чем 100 до 140 С, предпочтительно от 110 до 130 С, предпочтительно от 110 до 130 С.
Побочный продукт – амид 2-фенил-2-метилпропионовой кислоты присутствует в выделенной С.
Побочный продукт – амид 2-фенил-2-метилпропионовой кислоты присутствует в выделенной  , , -диметилфенилуксусной кислоте в количестве менее 0,1% в пересчете на соединение формулы I. Остаточное содержание от исходного количества соединения формулы II ( -диметилфенилуксусной кислоте в количестве менее 0,1% в пересчете на соединение формулы I. Остаточное содержание от исходного количества соединения формулы II ( , , -диметилбензилцианида) в выделенной -диметилбензилцианида) в выделенной  , , -диметилфенилуксусной кислоте более не удалось обнаружить.
Исходные вещества для реакции омыления согласно изобретению получают по известным из литературы способам.
Продукт способа пригоден для получения большого количества последующих продуктов, например, для получения антиаллергически действующих лекарственных средств, таких как 4-[4-[4-(гидроксидифенил)-1-пиперидинил]-1-гидроксибутил]- -диметилфенилуксусной кислоте более не удалось обнаружить.
Исходные вещества для реакции омыления согласно изобретению получают по известным из литературы способам.
Продукт способа пригоден для получения большого количества последующих продуктов, например, для получения антиаллергически действующих лекарственных средств, таких как 4-[4-[4-(гидроксидифенил)-1-пиперидинил]-1-гидроксибутил]- , , -диметилфенилуксусная кислота (патент США 4254129).
Преимуществом является очень короткое время реакции, отказ от дополнительных стадий очистки, высокие выходы и высокая чистота получаемого продукта. Преимуществом способа согласно изобретению является в основном полное превращение до соединения формулы I и общее содержание побочного продукта менее 0,1%.
Пример 1.
Получение -диметилфенилуксусная кислота (патент США 4254129).
Преимуществом является очень короткое время реакции, отказ от дополнительных стадий очистки, высокие выходы и высокая чистота получаемого продукта. Преимуществом способа согласно изобретению является в основном полное превращение до соединения формулы I и общее содержание побочного продукта менее 0,1%.
Пример 1.
Получение  , , -диметилфенилуксусной кислоты
В аппарат с мешалкой поместили 150 г н-бутанола, 65 г воды, 150 г едкого натра и 221 г диметилбензилцианида (около 98,2%). Смесь нагрели при хорошем перемешивании до температуры 120-126 -диметилфенилуксусной кислоты
В аппарат с мешалкой поместили 150 г н-бутанола, 65 г воды, 150 г едкого натра и 221 г диметилбензилцианида (около 98,2%). Смесь нагрели при хорошем перемешивании до температуры 120-126 С, и при этой температуре проводили реакцию около 6 часов. Затем добавили 250 мл воды и перегонкой удалили н-бутанол из реакционной смеси. После добавления последующих 500 мл воды смесь охладили до 30-50 С, и при этой температуре проводили реакцию около 6 часов. Затем добавили 250 мл воды и перегонкой удалили н-бутанол из реакционной смеси. После добавления последующих 500 мл воды смесь охладили до 30-50 С. Путем добавления около 433 г примерно 30%-ной соляной кислоты осаждали свободную диметилфенилуксусную кислоту. Она могла быть или выделена, или экстрагирована из суспензии кристаллов. При выделении суспензию далее охладили, после завершения процесса кристаллизации отсосали и промыли холодной водой, свободной от ионов хлора.
После сушки в вакуумном сушильном шкафу выход составил 238,4 г (97,3% от теорет.). Содержание диметилфенилуксусной кислоты составило в соответствии с ВЭЖХ более 99,9% (содержание амида менее 0,1%).
Температура плавления полученной таким образом С. Путем добавления около 433 г примерно 30%-ной соляной кислоты осаждали свободную диметилфенилуксусную кислоту. Она могла быть или выделена, или экстрагирована из суспензии кристаллов. При выделении суспензию далее охладили, после завершения процесса кристаллизации отсосали и промыли холодной водой, свободной от ионов хлора.
После сушки в вакуумном сушильном шкафу выход составил 238,4 г (97,3% от теорет.). Содержание диметилфенилуксусной кислоты составило в соответствии с ВЭЖХ более 99,9% (содержание амида менее 0,1%).
Температура плавления полученной таким образом  , , -диметилфенилуксусной кислоты составляла по регистрационному методу дифференциальной сканирующей калориметрии как минимум 81,5 -диметилфенилуксусной кислоты составляла по регистрационному методу дифференциальной сканирующей калориметрии как минимум 81,5 С.
Пример 2
Альтернативно С.
Пример 2
Альтернативно  , , -диметилфенилуксусная кислота может быть экстрагирована органическим растворителем (например, толуолом). При этом образовавшаяся -диметилфенилуксусная кислота может быть экстрагирована органическим растворителем (например, толуолом). При этом образовавшаяся  , , -диметилфенилуксусная кислота переходит в органическую фазу более чем на 99%; водную фазу отделяют. Органическая фаза может потом непосредственно использоваться для последующих реакций (например, этерификации).
ВЭЖХ-определение
Приготовление проб.
10 мг вещества растворяют в 10 мл смеси ацетонитрила и воды (4:6).
Колонка: Высота 0,15 м
Диаметр 4,6 мм
Стационарная фаза: стирол-бутадиен-фенил на кизельгеле,
5 мкм, Zorbax®
Подвижная фаза: 30% ацетонитрил
70% фосфатный буфер, рН 2,5
Впрыскиваемый объем: 10 мкл
Поток: 1 мл/мин
Определение: УФ, 210 нм
Время пробега: 30 мин. -диметилфенилуксусная кислота переходит в органическую фазу более чем на 99%; водную фазу отделяют. Органическая фаза может потом непосредственно использоваться для последующих реакций (например, этерификации).
ВЭЖХ-определение
Приготовление проб.
10 мг вещества растворяют в 10 мл смеси ацетонитрила и воды (4:6).
Колонка: Высота 0,15 м
Диаметр 4,6 мм
Стационарная фаза: стирол-бутадиен-фенил на кизельгеле,
5 мкм, Zorbax®
Подвижная фаза: 30% ацетонитрил
70% фосфатный буфер, рН 2,5
Впрыскиваемый объем: 10 мкл
Поток: 1 мл/мин
Определение: УФ, 210 нм
Время пробега: 30 мин.
Формула изобретения 1. Способ получения соединения формулы I 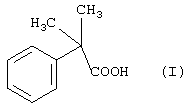 отличающийся тем, что соединение формулы II
отличающийся тем, что соединение формулы II
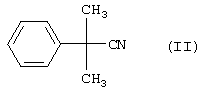 в присутствии воды, гидроокиси натрия и С4-спирта и/или С5-спирта при температуре более чем 100
в присутствии воды, гидроокиси натрия и С4-спирта и/или С5-спирта при температуре более чем 100 С превращают в соответствующую соль карбоновой кислоты и затем получают соединение формулы I путем добавления кислоты.
2. Способ по п.1, отличающийся тем, что в качестве С4– или C5-спирта используют соединение из группы н-бутанол, 2-метил-1-пропанол, н-пентанол, 2-пентанол, 3-пентанол, 2-метил-2-бутанол, 3-метил-2-бутанол, 2-метил-3-бутанол, 3-метил-1-бутанол или 2-метил-1-бутанол, предпочтительно н-бутанол.
3. Способ по п.1 или 2, отличающийся тем, что используют смесь С4– или С5-спиртов.
4. Способ по одному или более пп.1-3, отличающийся тем, что гидроокись натрия используют в форме твердого вещества или в виде водного раствора.
5. Способ по одному или более пп.1-4, отличающийся тем, что в качестве кислоты используют соляную кислоту, серную кислоту, азотную кислоту или фосфорную кислоту или смесь кислот, предпочтительно соляную кислоту.
6. Способ по одному или более пп.1-5, отличающийся тем, что на 100 молей соединения формулы II используют 120-250 молей воды и 150-300 молей гидроокиси натрия.
7. Способ по одному или более пп.1-6, отличающийся тем, что на 1 кг соединения формулы II используют 0,5-1,5 кг С4– и/или С5-спирта, предпочтительно 0,6-1,0 кг.
8. Способ по одному или более пп.1-7, отличающийся тем, что превращение соединения формулы II проводят при температуре от более чем 100 до 140 С превращают в соответствующую соль карбоновой кислоты и затем получают соединение формулы I путем добавления кислоты.
2. Способ по п.1, отличающийся тем, что в качестве С4– или C5-спирта используют соединение из группы н-бутанол, 2-метил-1-пропанол, н-пентанол, 2-пентанол, 3-пентанол, 2-метил-2-бутанол, 3-метил-2-бутанол, 2-метил-3-бутанол, 3-метил-1-бутанол или 2-метил-1-бутанол, предпочтительно н-бутанол.
3. Способ по п.1 или 2, отличающийся тем, что используют смесь С4– или С5-спиртов.
4. Способ по одному или более пп.1-3, отличающийся тем, что гидроокись натрия используют в форме твердого вещества или в виде водного раствора.
5. Способ по одному или более пп.1-4, отличающийся тем, что в качестве кислоты используют соляную кислоту, серную кислоту, азотную кислоту или фосфорную кислоту или смесь кислот, предпочтительно соляную кислоту.
6. Способ по одному или более пп.1-5, отличающийся тем, что на 100 молей соединения формулы II используют 120-250 молей воды и 150-300 молей гидроокиси натрия.
7. Способ по одному или более пп.1-6, отличающийся тем, что на 1 кг соединения формулы II используют 0,5-1,5 кг С4– и/или С5-спирта, предпочтительно 0,6-1,0 кг.
8. Способ по одному или более пп.1-7, отличающийся тем, что превращение соединения формулы II проводят при температуре от более чем 100 до 140 С, предпочтительно от 110 до 130 С, предпочтительно от 110 до 130 С. С.
PD4A – Изменение наименования обладателя патента Российской Федерации на изобретение
(73) Новое наименование патентообладателя:
Извещение опубликовано: 27.12.2005 БИ: 36/2005
|
||||||||||||||||||||||||||
