Патент на изобретение №2225715
|
||||||||||||||||||||||||||
(54) ГЕПАТОПРОТЕКТОРНОЕ СРЕДСТВО
(57) Реферат: Изобретение относится к созданию гепатопротекторного средства. Средство выполнено в форме раствора для инъекций и содержит эссенциальные фосфолипиды, бензиловый спирт, диоксихолевую кислоту, натрия хлорид, натрия гидроксид, рибофлавин,  -токоферол, этанол и воду для инъекций при определенном соотношении ингредиентов. Средство нетоксично и при введении не вызывает значимых изменений в активности ферментов, концентрации гемоглобина, количестве тромбоцитов и лейкоцитов. 3 табл., 2 ил.
Изобретение относится к медицине и касается комплексного препарата в форме раствора для инъекций, содержащего эссенциальные фосфолипиды, активным началом которых являются имеющие природное происхождение диглицеридные эфиры холинфосфорной кислоты и ненасыщенные жирные кислоты: линолевая, линоленовая и олеиновая.
Известен производимый в Германии препарат “Эссенциале” (Справочник Видаль, изд. 2. – М., 1996, с.Б-816; Машковский М.Д. Лекарственные средства, изд. 12. – М., 1993, т.II, с.52). Он выпускается в форме капсул и раствора для инъекций в ампулах по 5 мл. В инъекционной форме в одной ампуле содержится эссенциальных фосфолипидов 250 мг, пиридоксина гидрохлорида 2,5 мг, цианокобаламина 10 мкг, никотинамида 25 мг и пантотената натрия 1,5 мг.
Задачей настоящего изобретения является создание на основе эссенциальных фосфолипидов отечественного препарата гепатопротекторного действия в инъекционной лекарственной форме. Благодаря качественному и количественному подбору ингредиентов препарат нетоксичен, при введении в терапевтической дозе не вызывает статистически значимых изменений в активности ферментов аланин-, аспартотрансаминаза и щелочная фосфатаза, в концентрации гемоглобина, в количестве тромбоцитов и лейкоцитов.
Для решения поставленной задачи предложено гепатопротекторное средство в форме раствора для инъекций, содержащее эссенциальные фосфолипиды, бензиловый спирт, диоксихолевую кислоту, натрия хлорид, натрия гидроксид, рибофлавин, -токоферол, этанол и воду для инъекций при определенном соотношении ингредиентов. Средство нетоксично и при введении не вызывает значимых изменений в активности ферментов, концентрации гемоглобина, количестве тромбоцитов и лейкоцитов. 3 табл., 2 ил.
Изобретение относится к медицине и касается комплексного препарата в форме раствора для инъекций, содержащего эссенциальные фосфолипиды, активным началом которых являются имеющие природное происхождение диглицеридные эфиры холинфосфорной кислоты и ненасыщенные жирные кислоты: линолевая, линоленовая и олеиновая.
Известен производимый в Германии препарат “Эссенциале” (Справочник Видаль, изд. 2. – М., 1996, с.Б-816; Машковский М.Д. Лекарственные средства, изд. 12. – М., 1993, т.II, с.52). Он выпускается в форме капсул и раствора для инъекций в ампулах по 5 мл. В инъекционной форме в одной ампуле содержится эссенциальных фосфолипидов 250 мг, пиридоксина гидрохлорида 2,5 мг, цианокобаламина 10 мкг, никотинамида 25 мг и пантотената натрия 1,5 мг.
Задачей настоящего изобретения является создание на основе эссенциальных фосфолипидов отечественного препарата гепатопротекторного действия в инъекционной лекарственной форме. Благодаря качественному и количественному подбору ингредиентов препарат нетоксичен, при введении в терапевтической дозе не вызывает статистически значимых изменений в активности ферментов аланин-, аспартотрансаминаза и щелочная фосфатаза, в концентрации гемоглобина, в количестве тромбоцитов и лейкоцитов.
Для решения поставленной задачи предложено гепатопротекторное средство в форме раствора для инъекций, содержащее эссенциальные фосфолипиды, бензиловый спирт, диоксихолевую кислоту, натрия хлорид, натрия гидроксид, рибофлавин,  -токоферол, этанол 96 -токоферол, этанол 96 и воду для инъекций. Средство содержит указанные ингредиенты в следующем соотношении, мас.%:
3-(Фосфатидил)холин из соевых бобов,
содержащий 93% (3-фосфатидил)холина 4,5-5,5
Бензиловый спирт 0,8-1,0
Диоксихолевая кислота 2,0-2,6
Натрия хлорид 0,2-0,3
Натрия гидроксид 0,2-0,3
Рибофлавин 0,009-0,011 и воду для инъекций. Средство содержит указанные ингредиенты в следующем соотношении, мас.%:
3-(Фосфатидил)холин из соевых бобов,
содержащий 93% (3-фосфатидил)холина 4,5-5,5
Бензиловый спирт 0,8-1,0
Диоксихолевая кислота 2,0-2,6
Натрия хлорид 0,2-0,3
Натрия гидроксид 0,2-0,3
Рибофлавин 0,009-0,011
 -Токоферол 0,013-0,02
Этанол 96 -Токоферол 0,013-0,02
Этанол 96 0,25-0,4
Вода для инъекций Остальное
Пример получения инъекционного раствора эссенциальных фосфолипидов
В одной ампуле (5 мл) содержится, мг:
3-(Фосфатидил)холин из соевых бобов,
содержащий 93% (3-фосфатидил)холина 250
Бензиловый спирт 45
Диоксихолевая кислота 115
Натрия хлорид 12
Натрия гидроксид 11,5
Рибофлавин 0,5 0,25-0,4
Вода для инъекций Остальное
Пример получения инъекционного раствора эссенциальных фосфолипидов
В одной ампуле (5 мл) содержится, мг:
3-(Фосфатидил)холин из соевых бобов,
содержащий 93% (3-фосфатидил)холина 250
Бензиловый спирт 45
Диоксихолевая кислота 115
Натрия хлорид 12
Натрия гидроксид 11,5
Рибофлавин 0,5
 -Токоферол 0,75
Этанол 96 -Токоферол 0,75
Этанол 96 16,304
Вода для инъекций До 5 мл
Для приготовления 1 л препарата 700 мл воды для инъекций нагревают до температуры 45±5 16,304
Вода для инъекций До 5 мл
Для приготовления 1 л препарата 700 мл воды для инъекций нагревают до температуры 45±5 С и насыщают азотом. Загружают и растворяют 2,4 г натрия хлорида. Загружают 23 г диоксихолевой кислоты, после перемешивания получается суспензия белого цвета. К суспензии при перемешивании добавляют 1 М раствор натрия гидроксида до полного растворения диоксихолевой кислоты, значение рН при этом составляет 8,8±0,2. Расход 1 М раствора натрия гидроксида – около 60 мл.
В прозрачный бесцветный раствор при температуре 45 С и насыщают азотом. Загружают и растворяют 2,4 г натрия хлорида. Загружают 23 г диоксихолевой кислоты, после перемешивания получается суспензия белого цвета. К суспензии при перемешивании добавляют 1 М раствор натрия гидроксида до полного растворения диоксихолевой кислоты, значение рН при этом составляет 8,8±0,2. Расход 1 М раствора натрия гидроксида – около 60 мл.
В прозрачный бесцветный раствор при температуре 45 5 5 С загружают расчетное количество эссенциальных фосфолипидов и перемешивают до получения однородной суспензии желтого цвета.
После добавления 9 г бензилового спирта и перемешивания получают прозрачный раствор светло-желтого цвета.
Добавляют 0,1 г рибофлавина и перемешивают до полного растворения, получая раствор ярко-желтого цвета с зеленоватой опалесценцией, который затем охлаждают при перемешивании до температуры 20±2 С загружают расчетное количество эссенциальных фосфолипидов и перемешивают до получения однородной суспензии желтого цвета.
После добавления 9 г бензилового спирта и перемешивания получают прозрачный раствор светло-желтого цвета.
Добавляют 0,1 г рибофлавина и перемешивают до полного растворения, получая раствор ярко-желтого цвета с зеленоватой опалесценцией, который затем охлаждают при перемешивании до температуры 20±2 С.
Расчетное количество С.
Расчетное количество  -токоферола растворяют в этаноле 96 -токоферола растворяют в этаноле 96 и при перемешивании прибавляют к полученному выше раствору. Объем раствора доводят до 1 л водой для инъекций, раствор перемешивают и насыщают азотом.
После фильтрации через фильтр “Миллипор” с размером пор 22 мкм получают прозрачный раствор, который подвергают стерилизующей фильтрации и разливают в токе азота в ампулы темного стекла.
Проведено сравнительное изучение предлагаемого препарата и препарата “Эссенциале Н” – раствора для инъекций в ампулах по 5 мл производства фирмы “Рон-Пуленк Рорер” (Германия), серия 18541.
Действующее вещество препарата “Эссенциале Н” – эссенциальные фосфолипиды (субстанция EPL) – являются основными элементами в структуре клеточной оболочки и клеточных органелл печени. В организме EPL оказывают нормализующее действие на метаболизм липидов, белков и на детоксикационную функцию печени; восстанавливают и сохраняют клеточную структуру печени и фосфолипидзависимые энзиматические системы; тормозят формирование соединительной ткани в печени.
“Эссенциале Н” используется при жировой дегенерации печени различной этиологии, остром и хроническом гепатите, циррозе печени, печеночной коме, радиационном синдроме, токсикозе беременности, отравлениях, лекарственных и алкогольных отравлениях печени, нарушениях функции печени в результате осложнений при других заболеваниях, псориазе.
Определение спектра поглощения препаратов провели на спектрофотометре “Ultrospec-II” производства фирмы LKB Biochrom. Препараты разводили дистиллированной водой в соотношении 1:3,5 и полученный раствор фильтровали через фильтр “Миллипор” с размером пор 0,45 мкм.
На фиг.1 представлен обзорный спектр поглощения раствора препарата сравнения, снятый в интервале длин волн от 300 до 550 нм. Наблюдаются два выраженных пика поглощения: один при 370 нм (0,72 ед. оптической плотности), другой при 443 нм (0,73 ед. оптической плотности).
На фиг.2 приведен спектр поглощения раствора предлагаемого препарата, снятый в том же интервале длин волн. Здесь также наблюдаются два пика поглощения при тех же значениях длин волн, что и на фиг.1.
Спектры препаратов схожи по расположению пиков максимального поглощения, что указывает на идентичность активных веществ в растворах препаратов.
Провели определение острой токсичности препаратов. Для этого беспородным белым мышам вводили в хвостовую вену по 0,5 мл соответствующим образом разведенного предлагаемого препарата или препарата сравнения. Дозы, в которых вводили препараты, составляли 400, 500, 600, 700, 800 и 900 мг/кг. Наблюдение за мышами проводили в течение двух недель после однократного введения препаратов.
Как предлагаемый препарат, так и препарат сравнения при введении их в дозах 400-500 мг/кг вызывали увеличение частоты дыхания, количества уриаций и дефекаций, активизацию саливации. При дозах, превышавших 500 мг/кг, наблюдалось появление судорог – сначала тонических, при дальнейшем увеличении дозы – генерализованных клонико-тонических. Гибель животных наступала вследствие остановки дыхания.
Для предлагаемого препарата величина LD50 составила 634±65 мг/кг, для препарата сравнения 667±70 мг/кг.
Подострую токсичность препаратов изучали на беспородных белых крысах массой 180-220 г. Препараты в объеме 1 мл вводили животным в хвостовую вену. Исходя из того, что терапевтическая доза препаратов составляет 40 мг/кг, а десятикратная терапевтическая доза равна 400 мг/кг, лабораторных животных разделили на пять групп:
– группа 1 – 10-кратная доза предлагаемого препарата,
– группа 2 – терапевтическая доза предлагаемого препарата;
– группа 3 – 10-кратная доза препарата сравнения;
– группа 4 – терапевтическая доза препарата сравнения;
– группа 5 – интактные животные (физиологический раствор).
Препараты вводили крысам в течение 14 суток. Степень интоксикации оценивали по общему состоянию животных, состоянию шерстного покрова, изменению количества уриаций, дефекаций, саливации, наступлению тремора, судорог, изменению частоты и ритма дыхания.
После окончания введения препаратов произвели забой животных и их патологоанатомическое вскрытие. Отобрали образцы ткани почек, печени, селезенки, тимуса и головного мозга для гистологического анализа и образцы крови для определения биохимических и гематологических параметров.
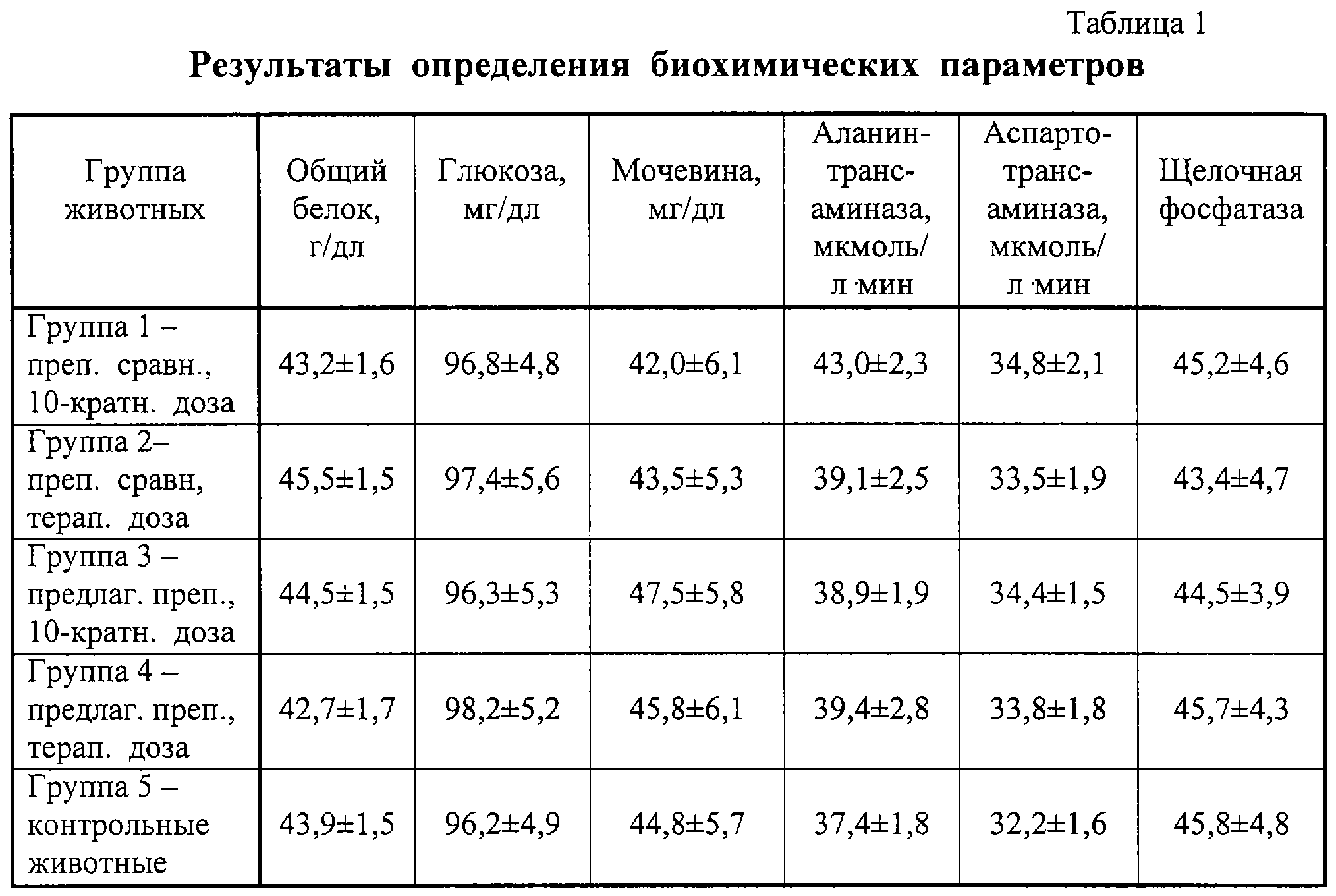
В табл.1 представлены результаты биохимического анализа крови лабораторных животных. Между результатами, полученными для предлагаемого препарата и препарата сравнения, достоверного отличия не наблюдается ни при введении терапевтической дозы, ни при введении 10-кратной дозы препаратов. Не имеется отличия и от данных, полученных в контрольной группе животных.
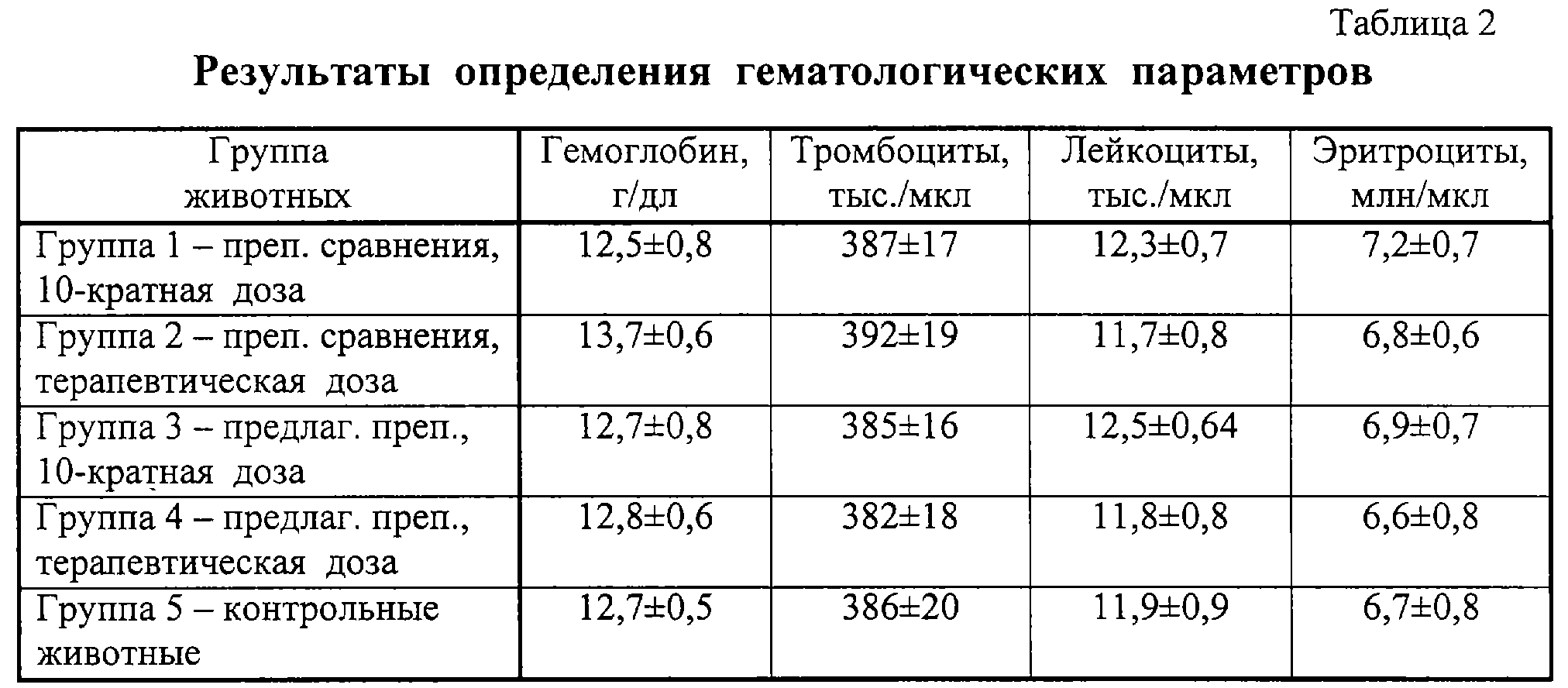
Результаты гематологического анализа приведены в табл.2. Они практически не различаются во всех группах животных, включая контрольную.
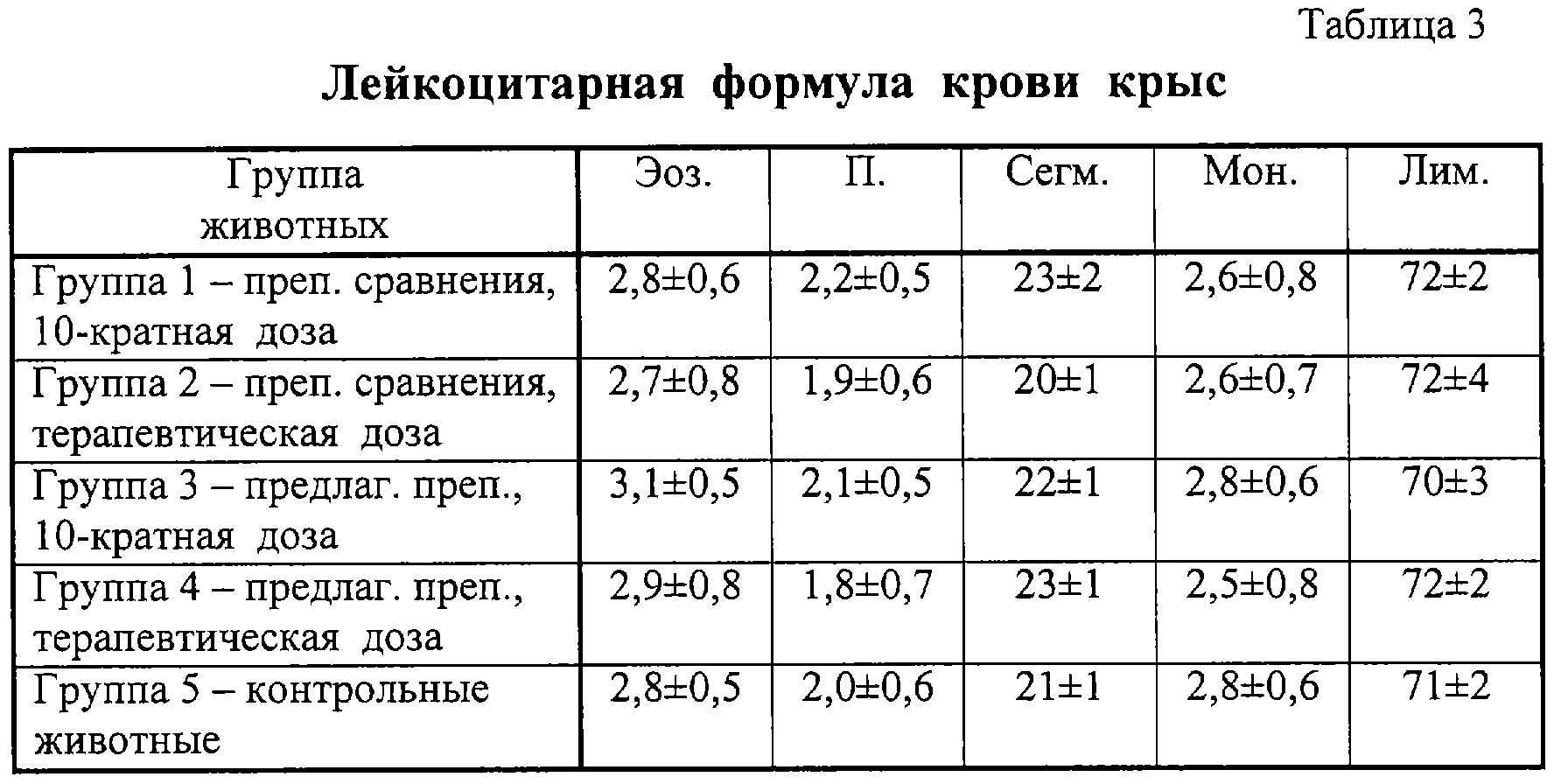
В ответ на введение препаратов в обеих исследованных дозах не изменялась и лейкоцитарная формула крови лабораторных животных (табл.3).
Гистологические исследования при определении подострой токсичности показали, что при введении терапевтических доз предлагаемого препарата и препарата сравнения не наблюдалось выраженных патологоанатомических изменений в изученных органах животных, включая слизистую желудка. Определяющие характеристики микроскопического строения печени, почек, тимуса, селезенки, ткани головного мозга соответствовали норме и были такими же, как и в контрольной группе животных.
Аналогичная картина наблюдалась при введении 10-кратной терапевтической дозы препарата сравнения.
Исследования, проведенные после введения 10-кратной терапевтической дозы предлагаемого препарата, показали, что макроскопическое строение печени, почек, тимуса, селезенки, ткани головного мозга и слизистой желудка соответствует таковым у контрольных животных.
Микроскопические исследования показали следующее:
Печень. Без видимых изменений, четко выражена типичная дольчатость строения. Отмечаются единичные мелкоклеточные инфильтраты по ходу портальных трактов в паренхиме. Отдельные центральные и поддольковые вены дилятированы и наполнены кровью. Имеются области с усиленным капиллярным рисунком, отчетливо видны эндотелиоциты.
Почки. В целом гистоархитектоника органа не отличается от таковой в контрольной группе животных. Корковое вещество представлено сосудистыми клубочками и канальцами нефрона. Капсула плотно прилегает к паренхиме органа. Крупные сосудистые магистрали сохранены, стенки сосудов без изменений. Мозговое вещество представлено лучами собирательных трубок, продольных и поперечных срезов петель нефрона. Эпителиальная выстилка канальцев без патологических изменений. Имеются области с очаговыми мелкоклеточными инфильтратами.
Тимус. Без видимых патологических изменений, выявляемых гистологическим методом. Корковое вещество покрыто тонкой капсулой и преобладает над мозговым. В мозговом веществе обнаруживаются в основном мелкие тимоциты, а периферия коры обильно инфильтрована большими и средними тимоцитами. Капилляры местами дилятированы и кровенаполнены.
Селезенка. Обычного строения, капсула хорошо развита и содержит волокнистые компоненты. Белая пульпа выявляется в виде периартериальных муфт и первичных лимфатических фолликулов. Граница между красной и белой пульпой нерезкая. Красная пульпа усилена за счет дилятации синусоидных структур и выраженного наполнения эритроцитарной массой.
Головной мозг. Кора имеет пять четких слоев с характерными по форме и размеру клетками. Ширина, густоклеточность слоев, цитоархитектоника, состояние базофильной субстанции соответствуют норме.
Ввиду того, что растворы препаратов вводили животным в хвостовую вену, местнораздражающее действие препаратов оценивали по состоянию эпителия хвоста. При помощи бинокулярной линзы проводили визуальный осмотр места введения растворов с целью выявления гематом, нарушения целостности эпителия и наличия язвенных поражений. Во всех группах лабораторных животных были отмечены единичные гематомы, причем их количество не зависело от дозы введенного препарата.
Никаких других проявлений местнораздражающего действия препаратов при макроскопическом исследовании выявлено не было.
Гистологическая картина препарированных хвостов в контрольной группе животных типична. Мускулатура прокрашена, хрящевые образования отчетливо структурированы, сосуды хорошо выражены. Вены умеренно расширены.
В группах животных, которым вводили предлагаемый препарат и препарат сравнения в обеих дозах, гистологическая картина без выраженной патологии, цитоархитектоника места введения препаратов такая же, как в контроле. и при перемешивании прибавляют к полученному выше раствору. Объем раствора доводят до 1 л водой для инъекций, раствор перемешивают и насыщают азотом.
После фильтрации через фильтр “Миллипор” с размером пор 22 мкм получают прозрачный раствор, который подвергают стерилизующей фильтрации и разливают в токе азота в ампулы темного стекла.
Проведено сравнительное изучение предлагаемого препарата и препарата “Эссенциале Н” – раствора для инъекций в ампулах по 5 мл производства фирмы “Рон-Пуленк Рорер” (Германия), серия 18541.
Действующее вещество препарата “Эссенциале Н” – эссенциальные фосфолипиды (субстанция EPL) – являются основными элементами в структуре клеточной оболочки и клеточных органелл печени. В организме EPL оказывают нормализующее действие на метаболизм липидов, белков и на детоксикационную функцию печени; восстанавливают и сохраняют клеточную структуру печени и фосфолипидзависимые энзиматические системы; тормозят формирование соединительной ткани в печени.
“Эссенциале Н” используется при жировой дегенерации печени различной этиологии, остром и хроническом гепатите, циррозе печени, печеночной коме, радиационном синдроме, токсикозе беременности, отравлениях, лекарственных и алкогольных отравлениях печени, нарушениях функции печени в результате осложнений при других заболеваниях, псориазе.
Определение спектра поглощения препаратов провели на спектрофотометре “Ultrospec-II” производства фирмы LKB Biochrom. Препараты разводили дистиллированной водой в соотношении 1:3,5 и полученный раствор фильтровали через фильтр “Миллипор” с размером пор 0,45 мкм.
На фиг.1 представлен обзорный спектр поглощения раствора препарата сравнения, снятый в интервале длин волн от 300 до 550 нм. Наблюдаются два выраженных пика поглощения: один при 370 нм (0,72 ед. оптической плотности), другой при 443 нм (0,73 ед. оптической плотности).
На фиг.2 приведен спектр поглощения раствора предлагаемого препарата, снятый в том же интервале длин волн. Здесь также наблюдаются два пика поглощения при тех же значениях длин волн, что и на фиг.1.
Спектры препаратов схожи по расположению пиков максимального поглощения, что указывает на идентичность активных веществ в растворах препаратов.
Провели определение острой токсичности препаратов. Для этого беспородным белым мышам вводили в хвостовую вену по 0,5 мл соответствующим образом разведенного предлагаемого препарата или препарата сравнения. Дозы, в которых вводили препараты, составляли 400, 500, 600, 700, 800 и 900 мг/кг. Наблюдение за мышами проводили в течение двух недель после однократного введения препаратов.
Как предлагаемый препарат, так и препарат сравнения при введении их в дозах 400-500 мг/кг вызывали увеличение частоты дыхания, количества уриаций и дефекаций, активизацию саливации. При дозах, превышавших 500 мг/кг, наблюдалось появление судорог – сначала тонических, при дальнейшем увеличении дозы – генерализованных клонико-тонических. Гибель животных наступала вследствие остановки дыхания.
Для предлагаемого препарата величина LD50 составила 634±65 мг/кг, для препарата сравнения 667±70 мг/кг.
Подострую токсичность препаратов изучали на беспородных белых крысах массой 180-220 г. Препараты в объеме 1 мл вводили животным в хвостовую вену. Исходя из того, что терапевтическая доза препаратов составляет 40 мг/кг, а десятикратная терапевтическая доза равна 400 мг/кг, лабораторных животных разделили на пять групп:
– группа 1 – 10-кратная доза предлагаемого препарата,
– группа 2 – терапевтическая доза предлагаемого препарата;
– группа 3 – 10-кратная доза препарата сравнения;
– группа 4 – терапевтическая доза препарата сравнения;
– группа 5 – интактные животные (физиологический раствор).
Препараты вводили крысам в течение 14 суток. Степень интоксикации оценивали по общему состоянию животных, состоянию шерстного покрова, изменению количества уриаций, дефекаций, саливации, наступлению тремора, судорог, изменению частоты и ритма дыхания.
После окончания введения препаратов произвели забой животных и их патологоанатомическое вскрытие. Отобрали образцы ткани почек, печени, селезенки, тимуса и головного мозга для гистологического анализа и образцы крови для определения биохимических и гематологических параметров.
В табл.1 представлены результаты биохимического анализа крови лабораторных животных. Между результатами, полученными для предлагаемого препарата и препарата сравнения, достоверного отличия не наблюдается ни при введении терапевтической дозы, ни при введении 10-кратной дозы препаратов. Не имеется отличия и от данных, полученных в контрольной группе животных.
Результаты гематологического анализа приведены в табл.2. Они практически не различаются во всех группах животных, включая контрольную.
В ответ на введение препаратов в обеих исследованных дозах не изменялась и лейкоцитарная формула крови лабораторных животных (табл.3).
Гистологические исследования при определении подострой токсичности показали, что при введении терапевтических доз предлагаемого препарата и препарата сравнения не наблюдалось выраженных патологоанатомических изменений в изученных органах животных, включая слизистую желудка. Определяющие характеристики микроскопического строения печени, почек, тимуса, селезенки, ткани головного мозга соответствовали норме и были такими же, как и в контрольной группе животных.
Аналогичная картина наблюдалась при введении 10-кратной терапевтической дозы препарата сравнения.
Исследования, проведенные после введения 10-кратной терапевтической дозы предлагаемого препарата, показали, что макроскопическое строение печени, почек, тимуса, селезенки, ткани головного мозга и слизистой желудка соответствует таковым у контрольных животных.
Микроскопические исследования показали следующее:
Печень. Без видимых изменений, четко выражена типичная дольчатость строения. Отмечаются единичные мелкоклеточные инфильтраты по ходу портальных трактов в паренхиме. Отдельные центральные и поддольковые вены дилятированы и наполнены кровью. Имеются области с усиленным капиллярным рисунком, отчетливо видны эндотелиоциты.
Почки. В целом гистоархитектоника органа не отличается от таковой в контрольной группе животных. Корковое вещество представлено сосудистыми клубочками и канальцами нефрона. Капсула плотно прилегает к паренхиме органа. Крупные сосудистые магистрали сохранены, стенки сосудов без изменений. Мозговое вещество представлено лучами собирательных трубок, продольных и поперечных срезов петель нефрона. Эпителиальная выстилка канальцев без патологических изменений. Имеются области с очаговыми мелкоклеточными инфильтратами.
Тимус. Без видимых патологических изменений, выявляемых гистологическим методом. Корковое вещество покрыто тонкой капсулой и преобладает над мозговым. В мозговом веществе обнаруживаются в основном мелкие тимоциты, а периферия коры обильно инфильтрована большими и средними тимоцитами. Капилляры местами дилятированы и кровенаполнены.
Селезенка. Обычного строения, капсула хорошо развита и содержит волокнистые компоненты. Белая пульпа выявляется в виде периартериальных муфт и первичных лимфатических фолликулов. Граница между красной и белой пульпой нерезкая. Красная пульпа усилена за счет дилятации синусоидных структур и выраженного наполнения эритроцитарной массой.
Головной мозг. Кора имеет пять четких слоев с характерными по форме и размеру клетками. Ширина, густоклеточность слоев, цитоархитектоника, состояние базофильной субстанции соответствуют норме.
Ввиду того, что растворы препаратов вводили животным в хвостовую вену, местнораздражающее действие препаратов оценивали по состоянию эпителия хвоста. При помощи бинокулярной линзы проводили визуальный осмотр места введения растворов с целью выявления гематом, нарушения целостности эпителия и наличия язвенных поражений. Во всех группах лабораторных животных были отмечены единичные гематомы, причем их количество не зависело от дозы введенного препарата.
Никаких других проявлений местнораздражающего действия препаратов при макроскопическом исследовании выявлено не было.
Гистологическая картина препарированных хвостов в контрольной группе животных типична. Мускулатура прокрашена, хрящевые образования отчетливо структурированы, сосуды хорошо выражены. Вены умеренно расширены.
В группах животных, которым вводили предлагаемый препарат и препарат сравнения в обеих дозах, гистологическая картина без выраженной патологии, цитоархитектоника места введения препаратов такая же, как в контроле.
Формула изобретения 1. Гепатопротекторное средство, характеризующееся тем, что оно представляет собой раствор для инъекций и содержит 3-(фосфатидил)холин из соевых бобов, содержащий 93% 3-(фосфатидил)холина, бензиловый спирт, диоксихолевую кислоту, натрия хлорид, натрия гидроксид, рибофлавин,  -токоферол, этанол 96 -токоферол, этанол 96 и воду для инъекций при следующем соотношении ингредиентов, мас.%:
3-(Фосфатидил)холин из соевых бобов, содержащий 93% (3-фосфатидил)холина 4,5-5,5
Бензиловый спирт 0,8-1,0
Диоксихолевая кислота 2,0-2,6
Натрия хлорид 0,2-0,3
Натрия гидроксид 0,2-0,3
Рибофлавин 0,009-0,011 и воду для инъекций при следующем соотношении ингредиентов, мас.%:
3-(Фосфатидил)холин из соевых бобов, содержащий 93% (3-фосфатидил)холина 4,5-5,5
Бензиловый спирт 0,8-1,0
Диоксихолевая кислота 2,0-2,6
Натрия хлорид 0,2-0,3
Натрия гидроксид 0,2-0,3
Рибофлавин 0,009-0,011
 -Токоферол 0,013-0,02
Этанол 96 -Токоферол 0,013-0,02
Этанол 96 0,25-0,4
Вода для инъекций Остальное 0,25-0,4
Вода для инъекций Остальное
РИСУНКИ
|
||||||||||||||||||||||||||
