Патент на изобретение №2225707
|
||||||||||||||||||||||||||
(54) ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ АНАЛЬГЕЗИРУЮЩИМ, УЛУЧШАЮЩИМ КРОВОСНАБЖЕНИЕ, СТИМУЛИРУЮЩИМ РЕГЕНЕРАЦИЮ НЕРВНОЙ ТКАНИ И ПРОТИВОАЛЛЕРГИЧЕСКИМ ДЕЙСТВИЕМ
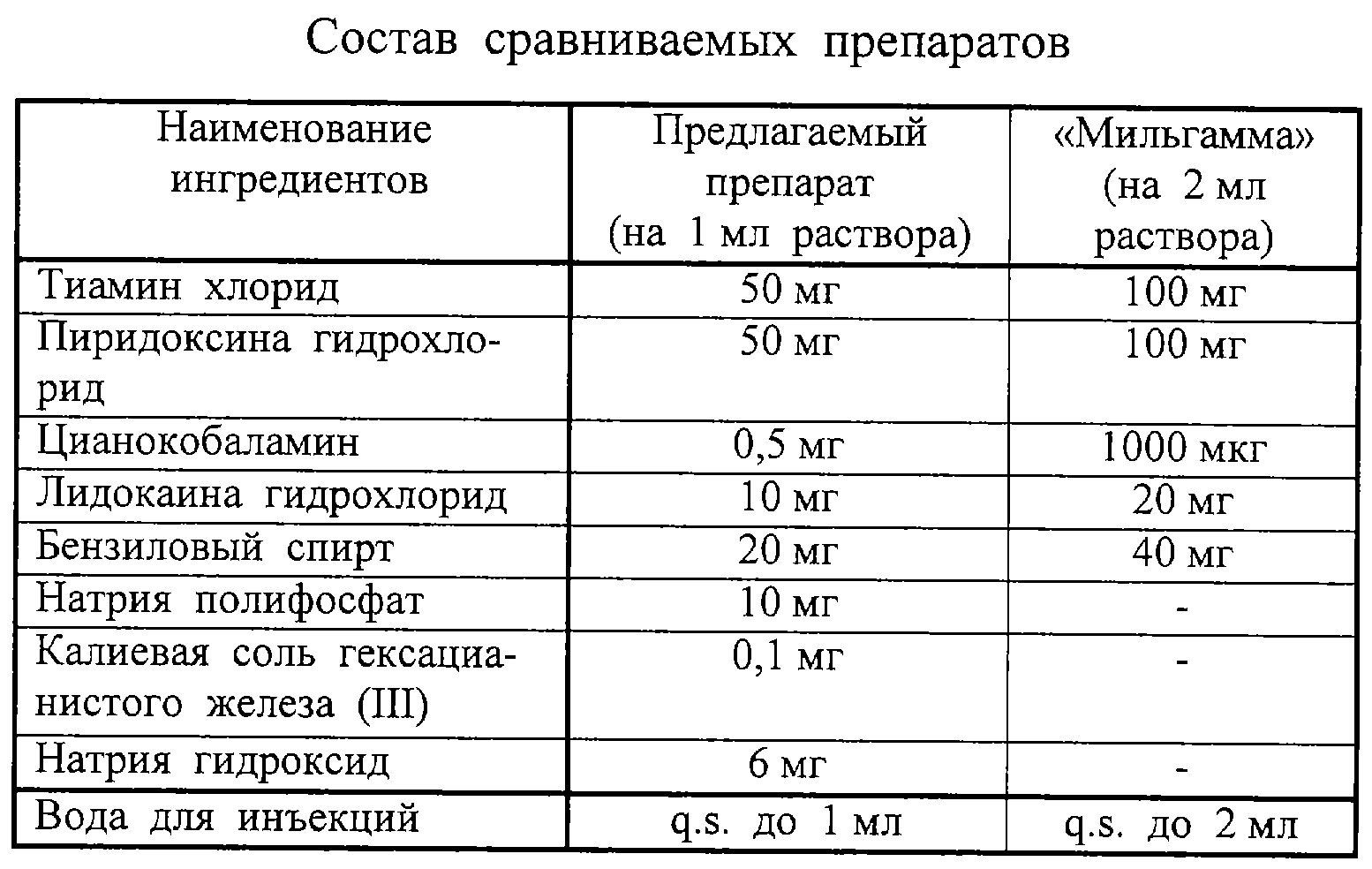
(57) Реферат: Изобретение относится к созданию препаратов группы витамина В и лидокаина комбинированного препарата, обладающего анальгезирующим, улучшающим кровоснабжение, стимулирующим регенерацию нервной ткани и противоаллергическим действием. Предложен препарат, выполненный в форме раствора для инъекций, содержащий тиамина хлорид, пиридоксина гидрохлорид, цианокобаламин, лидокаина гидрохлорид, бензиловый спирт, натрия полифосфат, калиевую соль гексацианистого железа (III), натрия гидроксид и воду для инъекций при определенном соотношении ингредиентов. Препарат малотоксичен, апирогенен, не вызывает нарушения биохимических показателей крови. 12 табл. Изобретение относится к области медицины и касается создания комбинированного препарата в форме раствора для инъекций на основе препаратов группы витамина В и лидокаина. Препарат используется в качестве средства для симптоматической терапии заболеваний нервной системы различного происхождения: невритов, невралгии, полиневропатии (в т.ч. диабетической и алкогольной), миалгии, корешковых синдромов, ретробульбарных невритов, опоясывающего герпеса, пареза лицевого нерва. Препарат применяют при системных неврологических заболеваниях, обусловленных доказанным дефицитом витаминов B1 и В6. Наиболее близким по технической сущности и достигаемому результату является препарат “Мильгамма” производства фирмы “Верваг Фарма”, Германия. Этот препарат известен в форме драже и раствора для инъекций. Раствор для инъекций в ампулах по 2 мл содержит тиамина гидрохлорида 100 мг, пиридоксина гидрохлорида 100 мг, цианокобаламина гидрохлорида 1000 мкг, лидокаина 20 мг и бензилового спирта 40 мг (Энциклопедия лекарств. – М., 2002, вып. 9, с.550). Известно использование препарата “Мильгамма” для лечения миофасциального болевого синдрома (патент РФ №2181995, 10.05.2002). Задачей настоящего изобретения является создание на основе витаминов группы В и лидокаина отечественного комбинированного препарата в форме раствора для инъекций – малотоксичного, апирогенного, не вызывающего нарушения биохимических показателей крови благодаря качественному и количественному подбору ингредиентов. Для решения поставленной задачи предложен комбинированный препарат, содержащий помимо тиамина хлорида, пиридоксина гидрохлорида, цианокобаламина, лидокаина и бензилового спирта натрия полифосфат, калиевую соль гексацианистого железа, натрия гидроксид и воду. Препарат выполнен в форме раствора для инъекций и содержит указанные ингредиенты в следующем соотношении, мас.%: Тиамина хлорид 4,5-5,5 Пиридоксина гидрохлорид 4,5-5,5 Цианокобаламин 0,045-0,055 Лидокаина гидрохлорид 0,9-1,1 Бензиловый спирт 1,8-2,2 Натрия полифосфат 0,9-1,1 Калиевая соль гексацианистого железа (III) 0,009-0,011 Натрия гидроксид 0,54-0,66 Вода для инъекций Остальное Для получения предлагаемого препарата используют воду, подготовленную следующим образом: воду для инъекций с температурой (85±5)  С охлаждают до (20±2) С охлаждают до (20±2) С при постоянном барботировании азотом. Процесс получения препарата также ведут при постоянном барботировании азотом.
В емкость помещают 500 мл насыщенной азотом воды для инъекций и при перемешивании растворяют в ней 6 г гидроксида натрия.
В раствор гидроксида натрия при перемешивании загружают и растворяют рассчитанное количество пиридоксина гидрохлорида. Получают прозрачный, со слегка желтоватым оттенком раствор с рН 5,0±0,2.
В отдельной емкости заранее готовят раствор натрия полифосфата, для чего навеску вещества растворяют при перемешивании в насыщенной азотом воде для инъекций при температуре (40-50) С при постоянном барботировании азотом. Процесс получения препарата также ведут при постоянном барботировании азотом.
В емкость помещают 500 мл насыщенной азотом воды для инъекций и при перемешивании растворяют в ней 6 г гидроксида натрия.
В раствор гидроксида натрия при перемешивании загружают и растворяют рассчитанное количество пиридоксина гидрохлорида. Получают прозрачный, со слегка желтоватым оттенком раствор с рН 5,0±0,2.
В отдельной емкости заранее готовят раствор натрия полифосфата, для чего навеску вещества растворяют при перемешивании в насыщенной азотом воде для инъекций при температуре (40-50) С и охлаждают до 20±2 С и охлаждают до 20±2 С. Полученный раствор прибавляют при перемешивании к раствору пиридоксина гидрохлорида.
Затем загружают и растворяют при перемешивании лидокаин, а за ним тиамина хлорид. Значение рН полученного раствора должно быть в пределах от 4,3 до 4,7. При необходимости его доводят до нормы при помощи раствора гидроксида натрия или 1 М раствора хлористоводородной кислоты.
Далее последовательно при постоянном перемешивании и барботировании азотом загружают калиевую соль гексацианистого железа (III), цианокобаламин, бензиловый спирт. Каждый последующий ингредиент загружают после полного растворения предыдущего ингредиента (контроль визуальный).
Получают раствор ярко-красного цвета с рН 4,3-4,7. Водой для инъекций, насыщенной азотом, доводят объем раствора до 1 л. После перемешивания раствор подвергают стерилизующей фильтрации и разливают в токе азота в ампулы темного стекла.
Экспериментальное изучение предлагаемого препарата провели в сравнении с препаратом “Мильгамма” производства фирмы “Верваг Фарма”, Германия (рег. П №012551/02-2000, сер. 010603). С. Полученный раствор прибавляют при перемешивании к раствору пиридоксина гидрохлорида.
Затем загружают и растворяют при перемешивании лидокаин, а за ним тиамина хлорид. Значение рН полученного раствора должно быть в пределах от 4,3 до 4,7. При необходимости его доводят до нормы при помощи раствора гидроксида натрия или 1 М раствора хлористоводородной кислоты.
Далее последовательно при постоянном перемешивании и барботировании азотом загружают калиевую соль гексацианистого железа (III), цианокобаламин, бензиловый спирт. Каждый последующий ингредиент загружают после полного растворения предыдущего ингредиента (контроль визуальный).
Получают раствор ярко-красного цвета с рН 4,3-4,7. Водой для инъекций, насыщенной азотом, доводят объем раствора до 1 л. После перемешивания раствор подвергают стерилизующей фильтрации и разливают в токе азота в ампулы темного стекла.
Экспериментальное изучение предлагаемого препарата провели в сравнении с препаратом “Мильгамма” производства фирмы “Верваг Фарма”, Германия (рег. П №012551/02-2000, сер. 010603).
 Определение показателей острой токсичности провели на крысах. Исследуемый препарат и препарат сравнения вводили животным внутримышечно (в бедро). Для исследования каждой дозы препаратов использовали группы из шести крыс одного пола. Группе контрольных животных вводили воду для инъекции.
Период наблюдения – 14 суток.
Установлено, что среднее значение ЛД50 предлагаемого препарата составило (6,95±0,33) мл/кг и практически не отличалось от среднего значения ЛД50 для препарата сравнения – (7,0±0,68) мл/кг.
Клиническая картина интоксикации при введении обоих препаратов характеризовалась резким снижением активности и общим угнетенным состоянием животных. Дыхание становилось частым, поверхностным, аритмичным. При больших дозах препаратов развивался ступор, отмечались судорожные подергивания. Гибель крыс наступала от остановки дыхания после введения препаратов в максимальных дозах уже через 20-30 мин, в минимальных летальных дозах – через 4-5 ч. Состояние животных, переживших интоксикацию, возвращалось к норме через 2-3 суток.
Вскрытие, проведенное через 14 суток после начала введения препаратов и забоя животных, не показало наличия каких-либо остаточных явлений, связанных с перенесенной интоксикацией.
Результаты исследований позволили отнести предлагаемый препарат к V классу практически нетоксичных лекарственных веществ (Н. Hodge и др. Clinical Toxicology of Commercial Products. Acute Poisoning, изд. IV. – Балтимор, 1975, с.427; К.К.Сидоров, 1973).
Исследование подострой токсичности провели на белых крысах обоего пола, нелинейных, массой 180-190 г. Препараты вводили животным в мышцу бедра в следующих дозах:
доза 1 – 0,3 мл/кг (превосходит максимальную терапевтическую дозу для человека в 10 раз);
доза 2 – 3 мл/кг (в 10 раз большая).
Препараты вводили в течение 30 дней 1 раз в сутки.
Животные были разбиты на 5 групп по 15 самок и 15 самцов в каждой (по две дозы каждого препарата и контрольная группа).
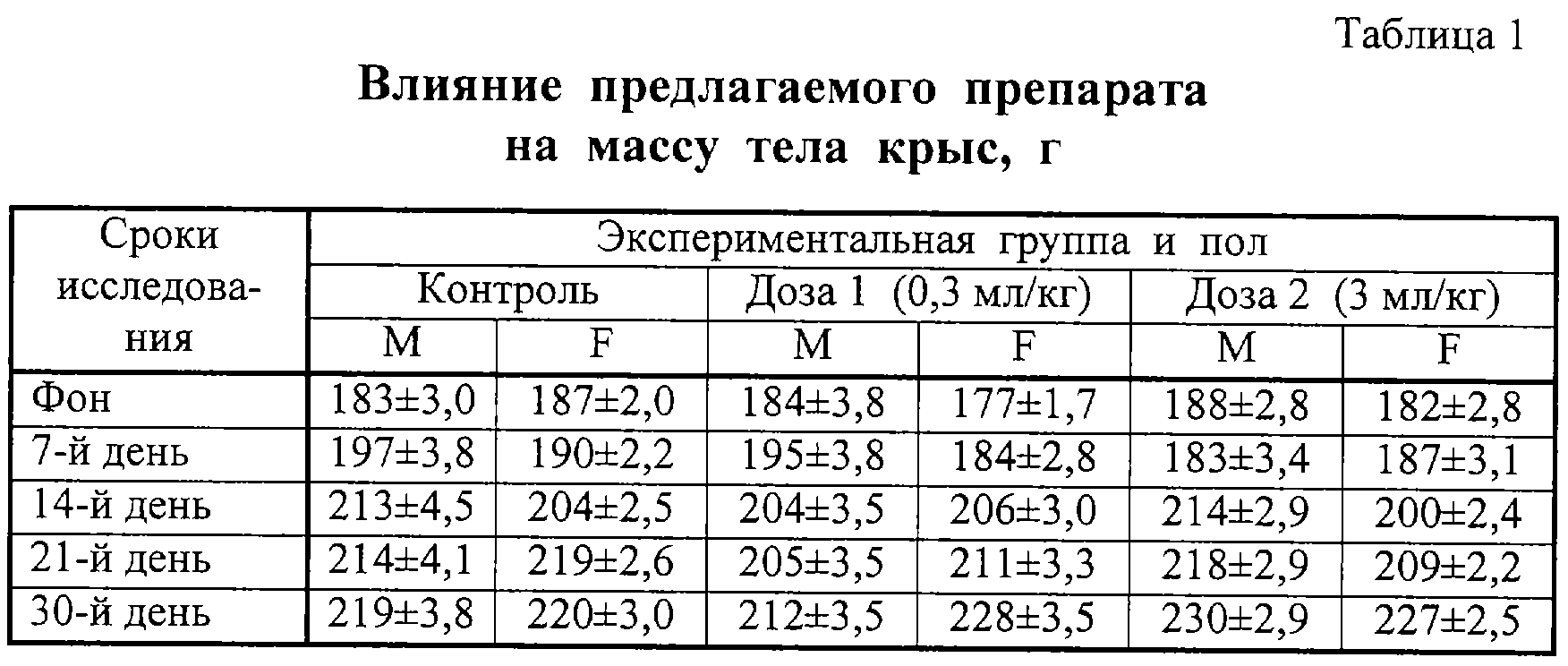
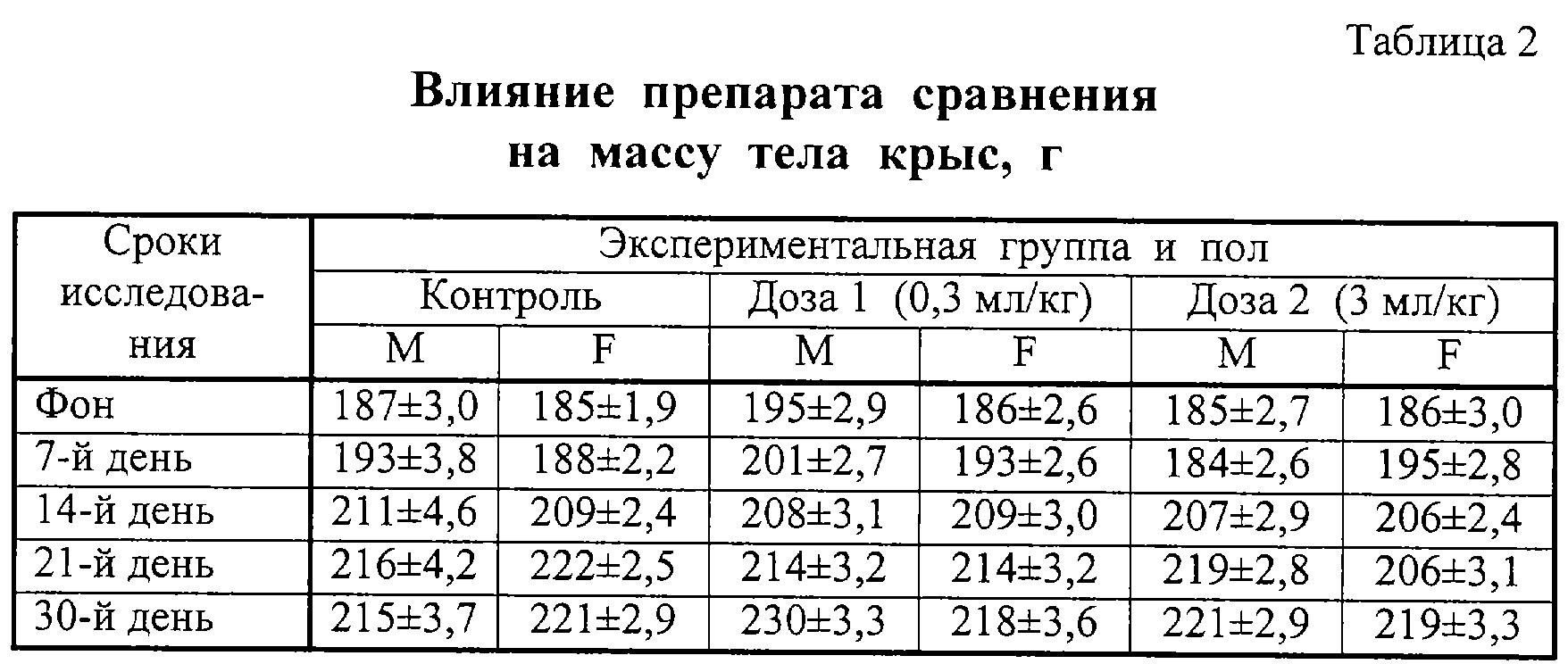
Результаты изучения влияния препаратов на массу тела крыс представлены в таблицах 1 и 2. Из таблиц видно, что масса животных во всех группах равномерно увеличивалась на протяжении всего срока исследования. Каких-либо различий, связанных с величиной дозы, не отмечено.
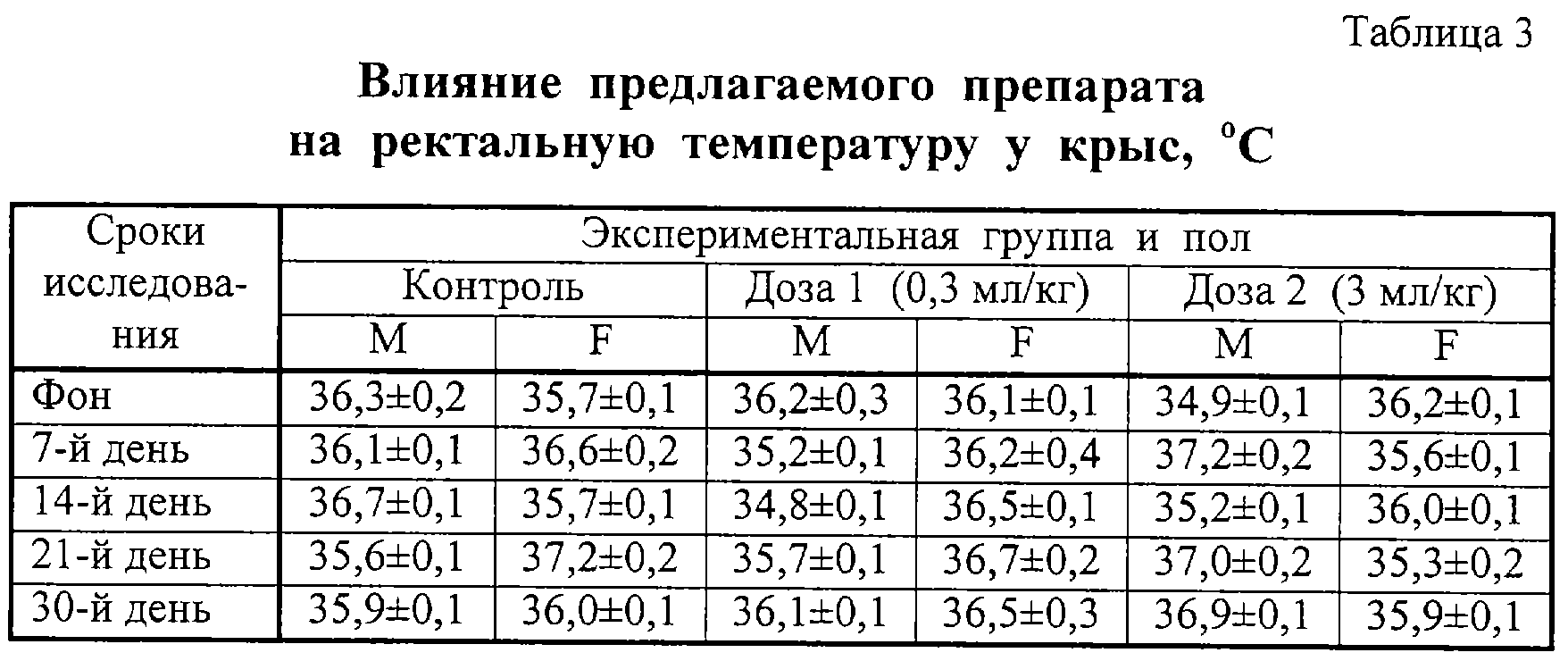
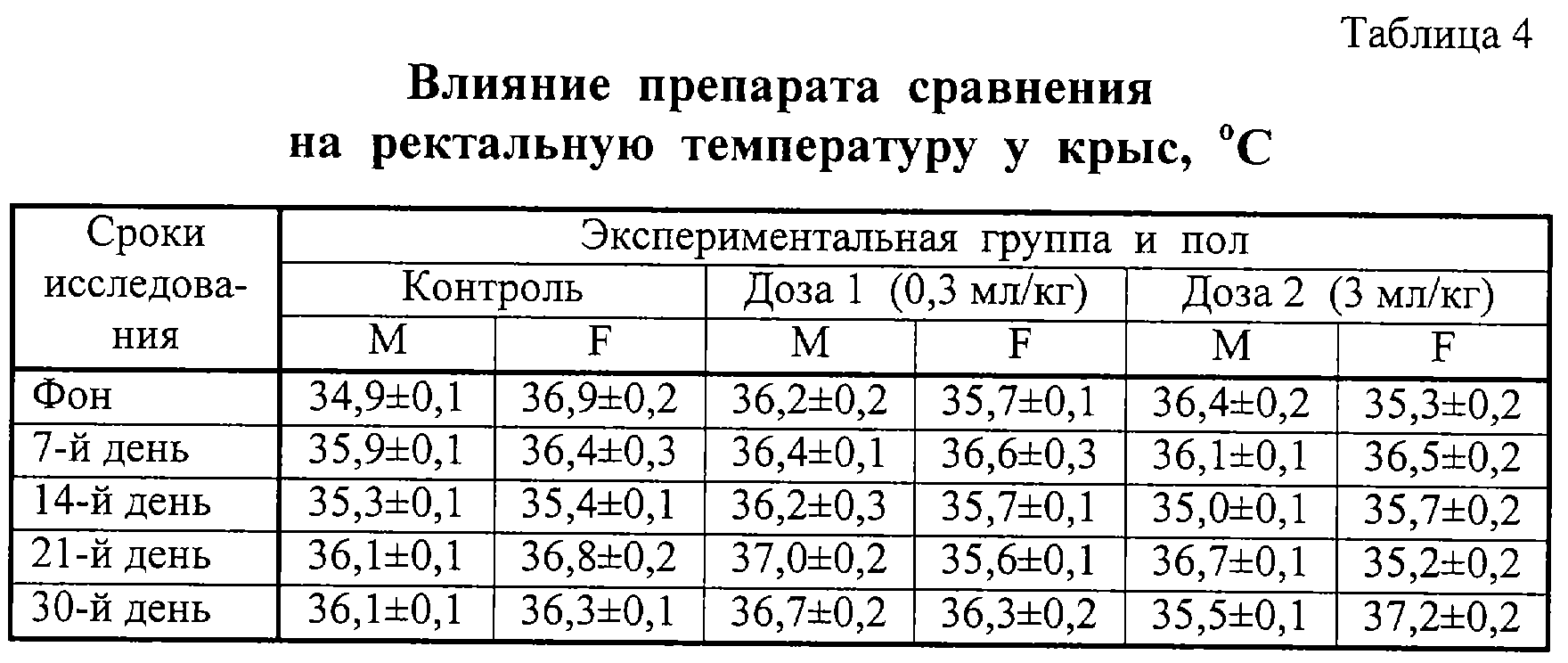
Через 1 ч после введения препаратов проводили измерение ректальной температуры. Полученные данные приведены в таблицах 3 и 4. Анализ этих данных показывает, что препараты не оказывали влияния на ректальную температуру у крыс.
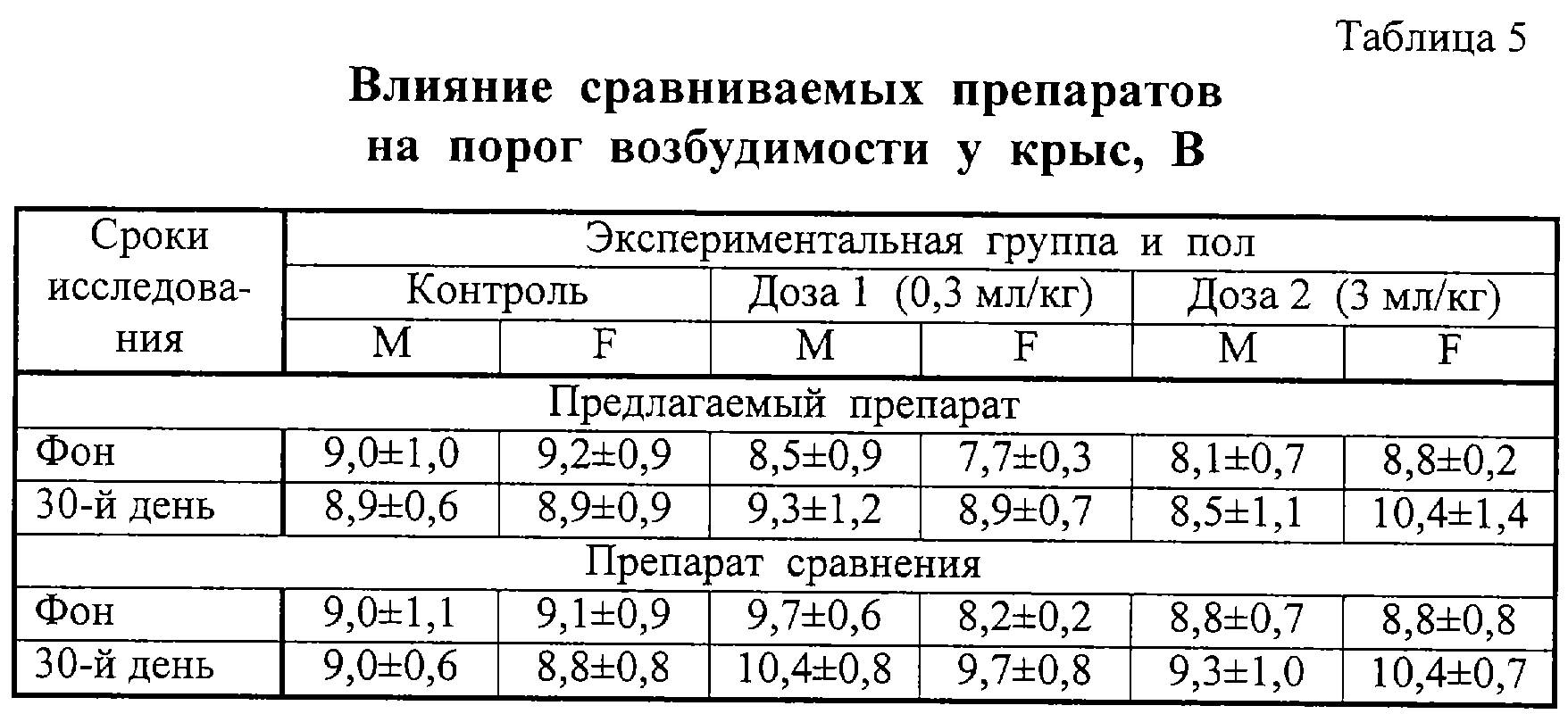
Данные по влиянию препаратов на суммационно-пороговый показатель (СПП) представлены в таблице 5. Во всех опытных группах увеличения значения СПП по сравнению с фоном и контролем не наблюдалось.
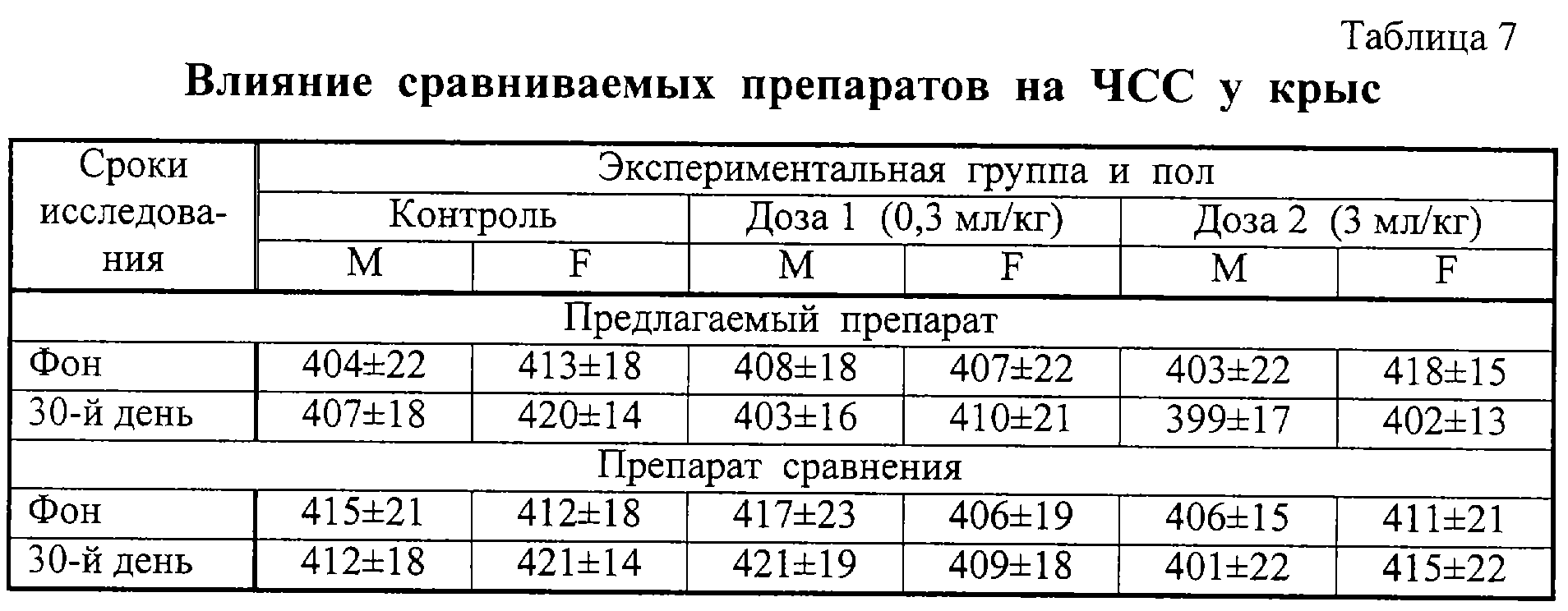
Было изучено влияние препаратов на сердечно-сосудистую деятельность лабораторных животных – систолическое артериальное давление (таблица 6), частоту сердечных сокращений (ЧСС) (таблица 7). Отрицательного воздействия препаратов в исследованных дозах на сердечно-сосудистую деятельность не выявлено.
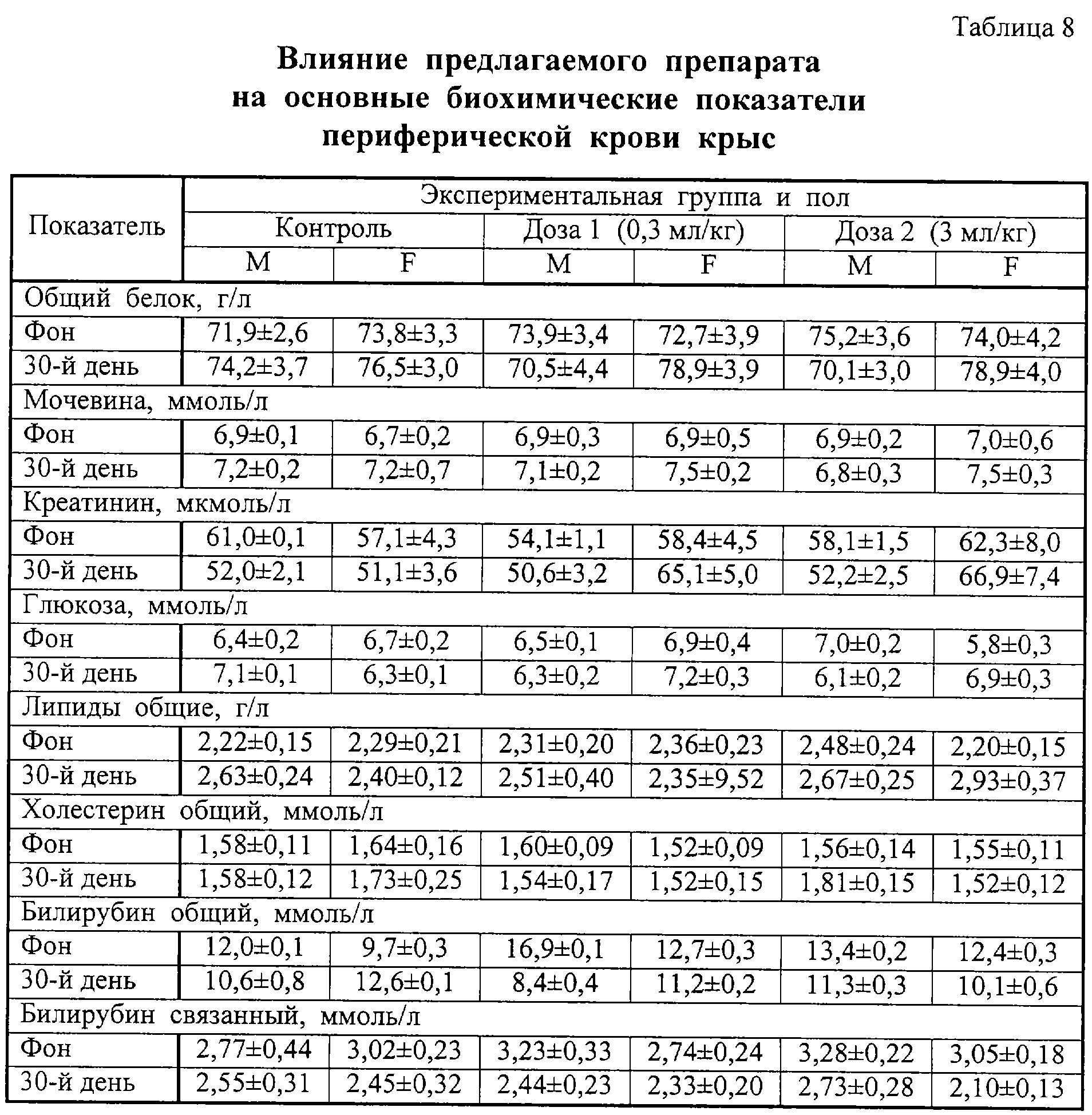
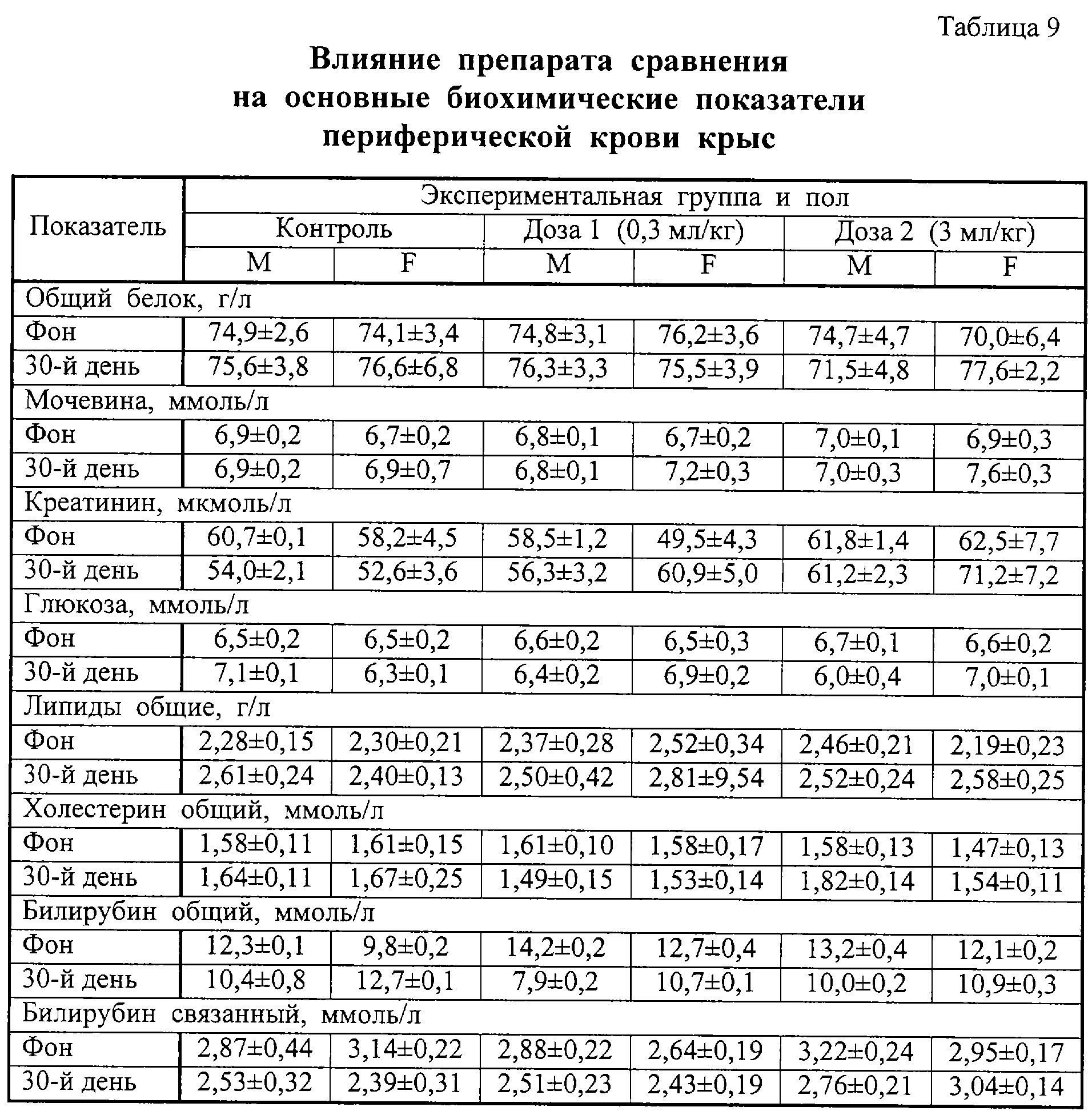
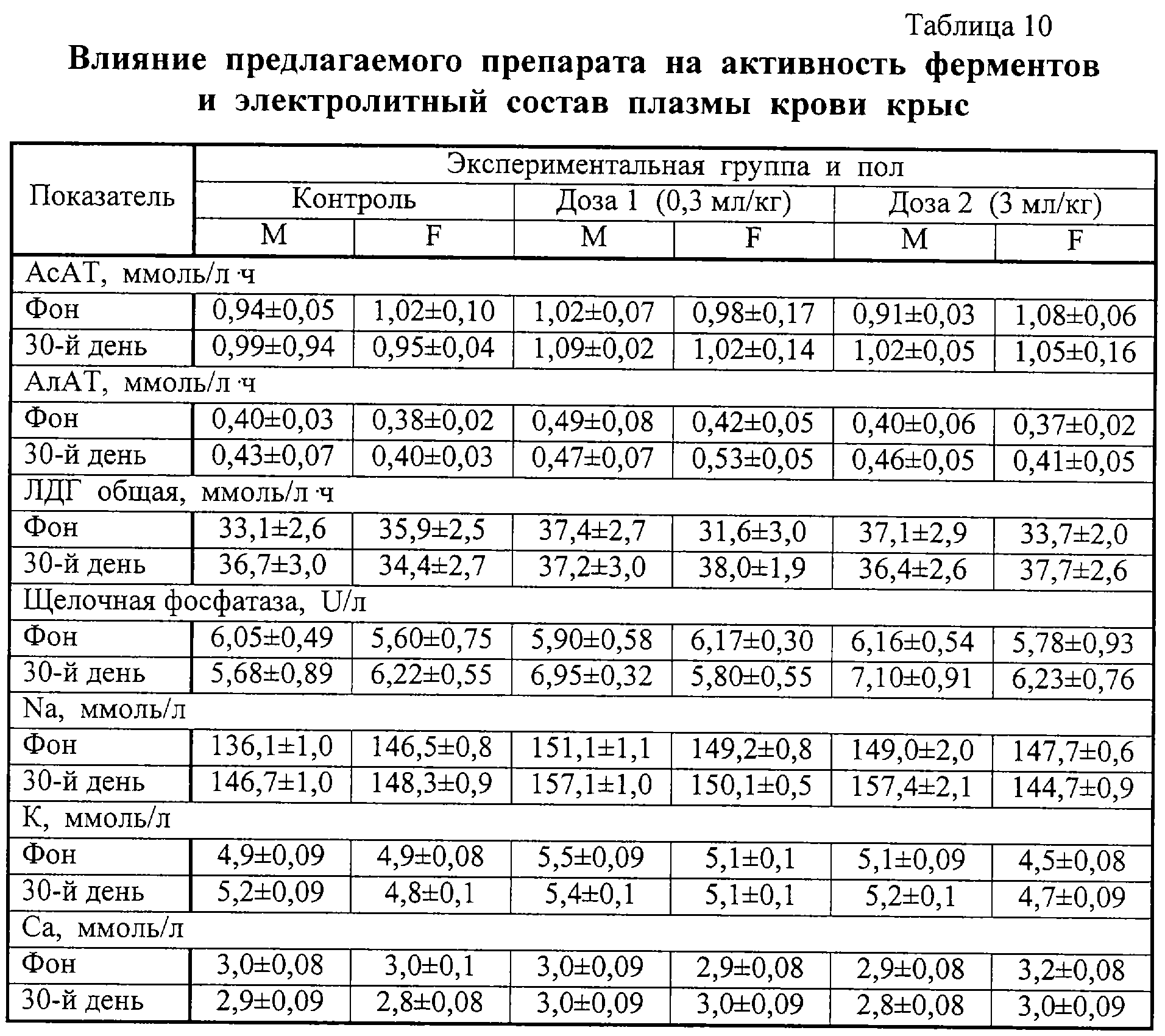
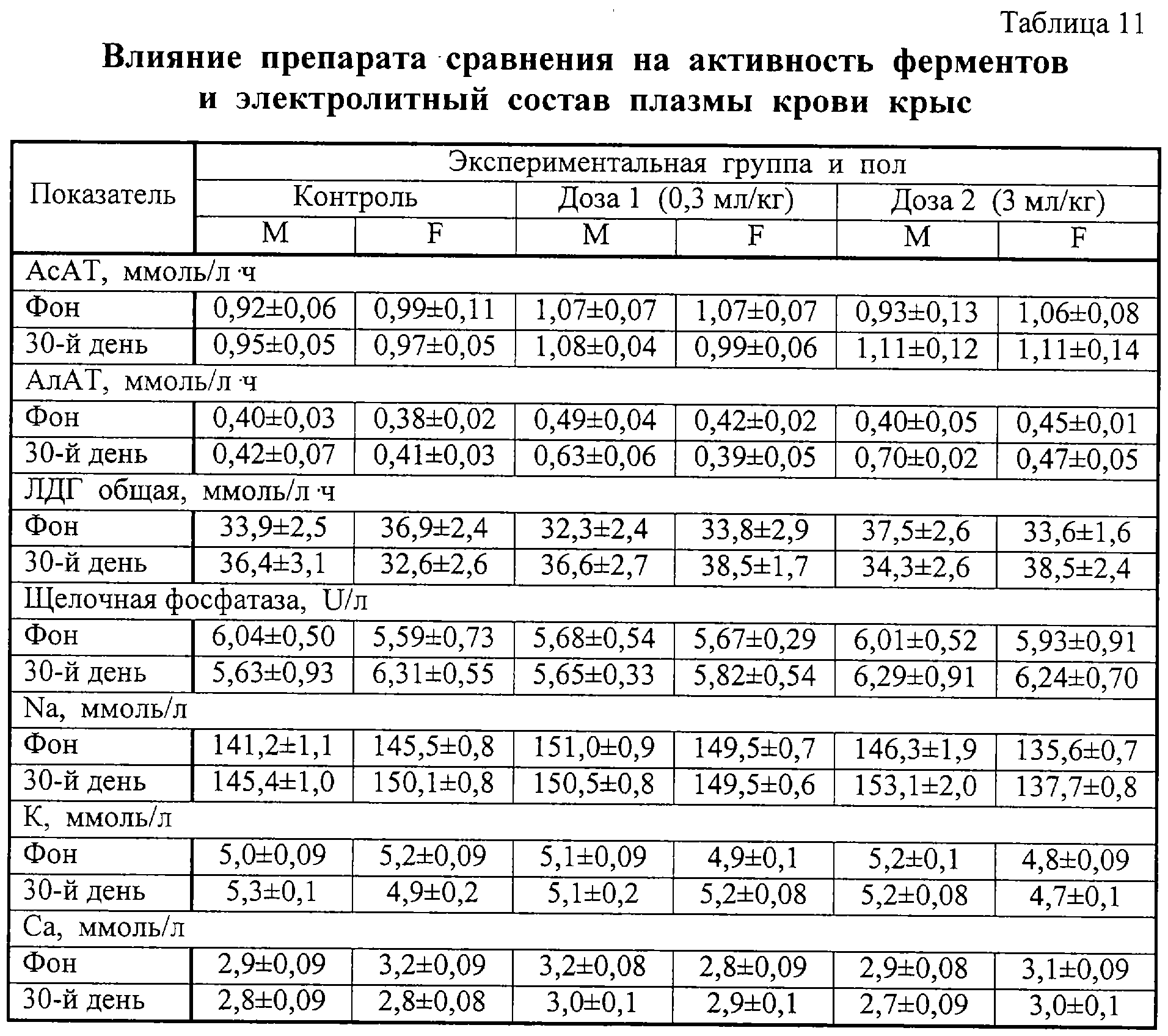
Результаты изучения влияния препаратов на основные биохимические показатели крови лабораторных животных представлены в таблицах 8 и 9, на активность ферментов и баланс ионов – в таблицах 10 и 11. Анализ приведенных в таблицах 8-11 данных показал, что введение обоих препаратов заметно не сказывалось на исследованных параметрах.
При патоморфологическом исследовании различий между всеми группами животных не выявлено.
При проведении гистологических исследований объекты фиксировали в 10-15% формалине или жидкости Карнуа и заливали парафином. Ткань головного мозга фиксировали в 96
Определение показателей острой токсичности провели на крысах. Исследуемый препарат и препарат сравнения вводили животным внутримышечно (в бедро). Для исследования каждой дозы препаратов использовали группы из шести крыс одного пола. Группе контрольных животных вводили воду для инъекции.
Период наблюдения – 14 суток.
Установлено, что среднее значение ЛД50 предлагаемого препарата составило (6,95±0,33) мл/кг и практически не отличалось от среднего значения ЛД50 для препарата сравнения – (7,0±0,68) мл/кг.
Клиническая картина интоксикации при введении обоих препаратов характеризовалась резким снижением активности и общим угнетенным состоянием животных. Дыхание становилось частым, поверхностным, аритмичным. При больших дозах препаратов развивался ступор, отмечались судорожные подергивания. Гибель крыс наступала от остановки дыхания после введения препаратов в максимальных дозах уже через 20-30 мин, в минимальных летальных дозах – через 4-5 ч. Состояние животных, переживших интоксикацию, возвращалось к норме через 2-3 суток.
Вскрытие, проведенное через 14 суток после начала введения препаратов и забоя животных, не показало наличия каких-либо остаточных явлений, связанных с перенесенной интоксикацией.
Результаты исследований позволили отнести предлагаемый препарат к V классу практически нетоксичных лекарственных веществ (Н. Hodge и др. Clinical Toxicology of Commercial Products. Acute Poisoning, изд. IV. – Балтимор, 1975, с.427; К.К.Сидоров, 1973).
Исследование подострой токсичности провели на белых крысах обоего пола, нелинейных, массой 180-190 г. Препараты вводили животным в мышцу бедра в следующих дозах:
доза 1 – 0,3 мл/кг (превосходит максимальную терапевтическую дозу для человека в 10 раз);
доза 2 – 3 мл/кг (в 10 раз большая).
Препараты вводили в течение 30 дней 1 раз в сутки.
Животные были разбиты на 5 групп по 15 самок и 15 самцов в каждой (по две дозы каждого препарата и контрольная группа).
Результаты изучения влияния препаратов на массу тела крыс представлены в таблицах 1 и 2. Из таблиц видно, что масса животных во всех группах равномерно увеличивалась на протяжении всего срока исследования. Каких-либо различий, связанных с величиной дозы, не отмечено.
Через 1 ч после введения препаратов проводили измерение ректальной температуры. Полученные данные приведены в таблицах 3 и 4. Анализ этих данных показывает, что препараты не оказывали влияния на ректальную температуру у крыс.
Данные по влиянию препаратов на суммационно-пороговый показатель (СПП) представлены в таблице 5. Во всех опытных группах увеличения значения СПП по сравнению с фоном и контролем не наблюдалось.
Было изучено влияние препаратов на сердечно-сосудистую деятельность лабораторных животных – систолическое артериальное давление (таблица 6), частоту сердечных сокращений (ЧСС) (таблица 7). Отрицательного воздействия препаратов в исследованных дозах на сердечно-сосудистую деятельность не выявлено.
Результаты изучения влияния препаратов на основные биохимические показатели крови лабораторных животных представлены в таблицах 8 и 9, на активность ферментов и баланс ионов – в таблицах 10 и 11. Анализ приведенных в таблицах 8-11 данных показал, что введение обоих препаратов заметно не сказывалось на исследованных параметрах.
При патоморфологическом исследовании различий между всеми группами животных не выявлено.
При проведении гистологических исследований объекты фиксировали в 10-15% формалине или жидкости Карнуа и заливали парафином. Ткань головного мозга фиксировали в 96 спирте и заливали целлоидином или парафином. Срезы внутренних органов окрашивали гематоксилин-эозином и по Ван-Гизону, срезы головного мозга окрашивали по Нисслю.
При просмотре гистологических препаратов органов контрольных животных и животных, получавших препараты в наибольшей дозе (3 мл/кг), различий не обнаружено.
Цитоархитектоника коры больших полушарий головного мозга не нарушена, очагов выпадения нет. Сосуды мозговых оболочек умеренно полнокровные; кортикальные сосуды равномерного диаметра. Признаки острого или хронического заболевания нейронов отсутствуют. Ядра нейронов светлые, ядерная мембрана тонкая, ядрышки четкие. В цитоплазме определяется достаточное количество хроматофильной зернистости Ниссля: пылевидной в цитоплазме нейронов 2-3-го слоев и более крупной в цитоплазме нейронов 5-го слоя коры больших полушарий. Нейроны разных ядерных образований среднего и продолговатого мозга содержат крупные глыбки тигроида. Ядра нервных и глиальных клеток не изменены, ядерная мембрана тонкая, содержание хроматина нормальное, ядрышки четкие.
Клетки эндотелия внутренней оболочки аорты с четкими ядрами. Деструкций эластических волокон средней оболочки нет. Поперечная исчерченность миофибрилл во всех отделах сердца отчетливая, ядра кардиомицитов содержат достаточное количество хроматина, ядерная оболочка тонкая. Очагов нарушений тинкториальных свойств цитоплазмы нет. Избыточного разрастания стромы (кардиофиброза) нет.
Эпителий гортани, трахеи, крупных бронхов не изменен, ядра четкие. Альвеолы всех долей легких содержат воздух. Ядра альвеолярного эпителия четкие, цитоплазма оксифильная. Эпителий внутрилегочных бронхов без изменений. Острые воспалительные изменения легочной ткани отсутствуют.
Трабекулярное строение печени на срезах, полученных из разных долей, не нарушено. Границы гепатоцитов отчетливые, цитоплазма зернистая, слабо оксифильная. Очаговых нарушений тинкториальных свойств цитоплазмы нет. Ядра содержат четкие ядрышки и достаточное количество хроматина. Ядерная мембрана тонкая. Синусоиды печени полнокровные.
Капилляры клубочков и интерстициальной ткани почек полнокровные, цитоплазма эпителия проксимальных канальцев почек оксифильная, клеточные границы различимы, ядра нефроэпителия светлые, четкие.
Сосуды коры и мозгового вещества надпочечников полнокровные. Все зоны коры надпочечников отчетливо выражены, клеточные ядра содержат достаточное количество хроматина. Цитоплазма клеток пучковой зоны вакуолизирована за счет содержания большого количества липидов. Клетки мозгового вещества крупные, овальной формы, объединенные в гроздья и тяжи.
Лимфоретикулярные элементы лимфатических узлов и селезенки с четкими ядрами, деструкции или атрофии фолликулов нет. В красной пульпе селезенки видны очаги кроветворения с единичными мегакариоцитами.
Слизистая оболочка безжелезистой части желудка выстлана многослойным плоским эпителием, клетки которого не имеют изменений. Покровный эпителий слизистой тела желудка образован слизистыми цилиндрическими клетками, дефектов эпителиальной выстилки нет. Главные и обкладочные клетки желез тела желудка не изменены. Дефектов многослойного плоского неороговевающего эпителия слизистой пищевода нет.
Дольчатое строение поджелудочной железы сохранено. Клетки островков Лангерганса содержат светлые, четкие ядра, цитоплазма слабо оксифильная. Эпителиальные клетки внешнесекреторной части железы базофильные, ядра, расположенные в средней части, четкие, с достаточным количеством хроматина. Сосуды стромы поджелудочной железы умеренно полнокровные.
Фолликулы щитовидной железы заполнены небольшим количеством оксифильного, слабовакуолизированного коллоида. Эпителий фолликул обычной высоты, ядра четкие. Сосуды стромы умеренно полнокровные. Строение подчелюстных желез без изменений. Эпителиальные клетки концевых отделов и выводных протоков с четкими ядрами, деструкции клеток нет.
Тимус сохраняет выраженное дольчатое строение. Корковое вещество долек заполнено лимфоцитами/тимоцитами. Мозговое вещество тимуса содержит меньшее количество лимфоцитов, а также светлые эпителиальные клетки, местами образующие концентрические фигуры и тельца Гассаля. Строма тимуса умеренно полнокровная.
В корковом веществе яичников самок видны фолликулы разной величины и степени созревания. Фолликулярный эпителий не изменен, ядра светлые, четкие, мозговое вещество яичников полнокровное. Клетки семенных канальцев яичек самцов находятся на разных стадиях сперматогенеза. Эпителий семенных канальцев и интерстициальные клетки не изменены. Ядра четкие.
Как показали результаты некропсии и гистологического исследования, ежедневное внутримышечное введение предлагаемого препарата и препарата сравнения в дозах 0,3 и 3 мл/кг в течение 30 дней крысам обоего пола не вызывало раздражения, воспаления или деструкции тканей в месте введения, а также не сопровождалось развитием дистрофических, деструктивных, очаговых склеротических изменений в паренхиматозных клетках и строме внутренних органов.
Для определения пирогенности предлагаемого препарата его подогревали до 37 спирте и заливали целлоидином или парафином. Срезы внутренних органов окрашивали гематоксилин-эозином и по Ван-Гизону, срезы головного мозга окрашивали по Нисслю.
При просмотре гистологических препаратов органов контрольных животных и животных, получавших препараты в наибольшей дозе (3 мл/кг), различий не обнаружено.
Цитоархитектоника коры больших полушарий головного мозга не нарушена, очагов выпадения нет. Сосуды мозговых оболочек умеренно полнокровные; кортикальные сосуды равномерного диаметра. Признаки острого или хронического заболевания нейронов отсутствуют. Ядра нейронов светлые, ядерная мембрана тонкая, ядрышки четкие. В цитоплазме определяется достаточное количество хроматофильной зернистости Ниссля: пылевидной в цитоплазме нейронов 2-3-го слоев и более крупной в цитоплазме нейронов 5-го слоя коры больших полушарий. Нейроны разных ядерных образований среднего и продолговатого мозга содержат крупные глыбки тигроида. Ядра нервных и глиальных клеток не изменены, ядерная мембрана тонкая, содержание хроматина нормальное, ядрышки четкие.
Клетки эндотелия внутренней оболочки аорты с четкими ядрами. Деструкций эластических волокон средней оболочки нет. Поперечная исчерченность миофибрилл во всех отделах сердца отчетливая, ядра кардиомицитов содержат достаточное количество хроматина, ядерная оболочка тонкая. Очагов нарушений тинкториальных свойств цитоплазмы нет. Избыточного разрастания стромы (кардиофиброза) нет.
Эпителий гортани, трахеи, крупных бронхов не изменен, ядра четкие. Альвеолы всех долей легких содержат воздух. Ядра альвеолярного эпителия четкие, цитоплазма оксифильная. Эпителий внутрилегочных бронхов без изменений. Острые воспалительные изменения легочной ткани отсутствуют.
Трабекулярное строение печени на срезах, полученных из разных долей, не нарушено. Границы гепатоцитов отчетливые, цитоплазма зернистая, слабо оксифильная. Очаговых нарушений тинкториальных свойств цитоплазмы нет. Ядра содержат четкие ядрышки и достаточное количество хроматина. Ядерная мембрана тонкая. Синусоиды печени полнокровные.
Капилляры клубочков и интерстициальной ткани почек полнокровные, цитоплазма эпителия проксимальных канальцев почек оксифильная, клеточные границы различимы, ядра нефроэпителия светлые, четкие.
Сосуды коры и мозгового вещества надпочечников полнокровные. Все зоны коры надпочечников отчетливо выражены, клеточные ядра содержат достаточное количество хроматина. Цитоплазма клеток пучковой зоны вакуолизирована за счет содержания большого количества липидов. Клетки мозгового вещества крупные, овальной формы, объединенные в гроздья и тяжи.
Лимфоретикулярные элементы лимфатических узлов и селезенки с четкими ядрами, деструкции или атрофии фолликулов нет. В красной пульпе селезенки видны очаги кроветворения с единичными мегакариоцитами.
Слизистая оболочка безжелезистой части желудка выстлана многослойным плоским эпителием, клетки которого не имеют изменений. Покровный эпителий слизистой тела желудка образован слизистыми цилиндрическими клетками, дефектов эпителиальной выстилки нет. Главные и обкладочные клетки желез тела желудка не изменены. Дефектов многослойного плоского неороговевающего эпителия слизистой пищевода нет.
Дольчатое строение поджелудочной железы сохранено. Клетки островков Лангерганса содержат светлые, четкие ядра, цитоплазма слабо оксифильная. Эпителиальные клетки внешнесекреторной части железы базофильные, ядра, расположенные в средней части, четкие, с достаточным количеством хроматина. Сосуды стромы поджелудочной железы умеренно полнокровные.
Фолликулы щитовидной железы заполнены небольшим количеством оксифильного, слабовакуолизированного коллоида. Эпителий фолликул обычной высоты, ядра четкие. Сосуды стромы умеренно полнокровные. Строение подчелюстных желез без изменений. Эпителиальные клетки концевых отделов и выводных протоков с четкими ядрами, деструкции клеток нет.
Тимус сохраняет выраженное дольчатое строение. Корковое вещество долек заполнено лимфоцитами/тимоцитами. Мозговое вещество тимуса содержит меньшее количество лимфоцитов, а также светлые эпителиальные клетки, местами образующие концентрические фигуры и тельца Гассаля. Строма тимуса умеренно полнокровная.
В корковом веществе яичников самок видны фолликулы разной величины и степени созревания. Фолликулярный эпителий не изменен, ядра светлые, четкие, мозговое вещество яичников полнокровное. Клетки семенных канальцев яичек самцов находятся на разных стадиях сперматогенеза. Эпителий семенных канальцев и интерстициальные клетки не изменены. Ядра четкие.
Как показали результаты некропсии и гистологического исследования, ежедневное внутримышечное введение предлагаемого препарата и препарата сравнения в дозах 0,3 и 3 мл/кг в течение 30 дней крысам обоего пола не вызывало раздражения, воспаления или деструкции тканей в месте введения, а также не сопровождалось развитием дистрофических, деструктивных, очаговых склеротических изменений в паренхиматозных клетках и строме внутренних органов.
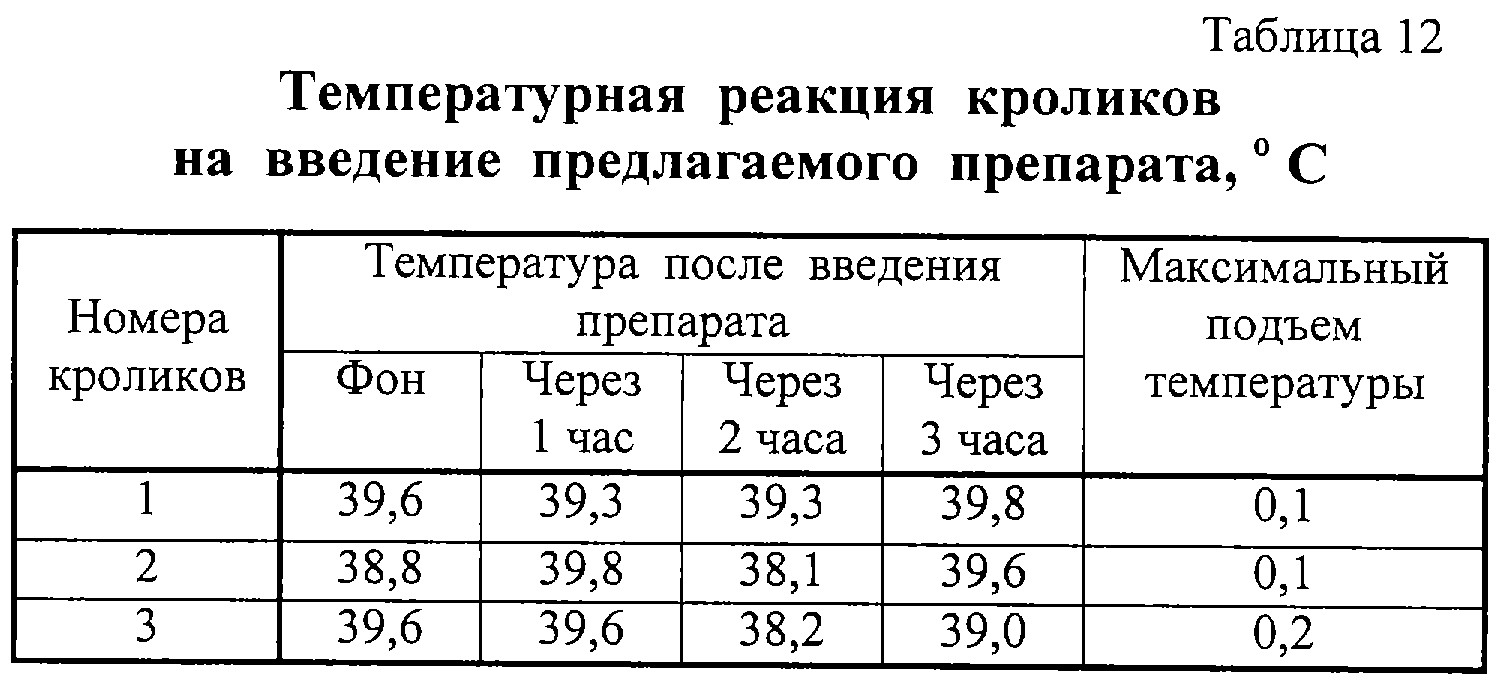
Для определения пирогенности предлагаемого препарата его подогревали до 37 С и вводили в ушную вену кроликов в объеме 1 мл/кг. Введение осуществляли медленно, в течение 30 с. Температуру измеряли до начала исследования и три раза после введения препарата с интервалом в 1 ч. Результаты представлены в таблице 12. Сумма повышений температуры у трех кроликов составила 0,4 С и вводили в ушную вену кроликов в объеме 1 мл/кг. Введение осуществляли медленно, в течение 30 с. Температуру измеряли до начала исследования и три раза после введения препарата с интервалом в 1 ч. Результаты представлены в таблице 12. Сумма повышений температуры у трех кроликов составила 0,4 С, что в соответствии с требованиями ГФ XI, вып. 2, с.184 свидетельствует об отсутствии у препарата пирогенности. С, что в соответствии с требованиями ГФ XI, вып. 2, с.184 свидетельствует об отсутствии у препарата пирогенности.

Формула изобретения Комбинированный препарат, обладающий анальгезирующим, улучшающим кровоснабжение, стимулирующим регенерацию нервной ткани и противоаллергическим действием, выполненный в форме раствора для инъекций и содержащий тиамина хлорид, пиридоксина гидрохлорид, цианокобаламин, лидокаина гидрохлорид и бензиловый спирт, отличающийся тем, что он дополнительно содержит натрия полифосфат, калиевую соль гексацианистого железа (III), натрия гидроксид и воду для инъекций при следующем содержании ингредиентов, мас.%: Тиамина хлорид 4,5-5,5 Пиридоксина гидрохлорид 4,5-5,5 Цианокобаламин 0,045-0,055 Лидокаина гидрохлорид 0,9-1,1 Бензиловый спирт 1,8-2,2 Натрия полифосфат 0,9-1,1 Калиевая соль гексацианистого железа (III) 0,009-0,011 Натрия гидроксид 0,54-0,66 Вода для инъекций Остальное |
||||||||||||||||||||||||||
