Патент на изобретение №2225692
|
||||||||||||||||||||||||||
(54) КОНСЕРВАНТ ДЛЯ ОТМЫТЫХ ЭРИТРОЦИТОВ
(57) Реферат: Изобретение относится к медицине, в частности к ресуспендирующим и консервирующим растворам для эритроцитов, полученных из донорской крови. Консервант содержит растворенные в 1 л воды 7,2-8,8 г очищенного деионизированного частично деструктурированного желатина с молекулярной массой 13000-2000 Да, 0,9-1,1 г цитрата натрия, 3,5-4,0 г хлорида натрия, 3,6-4,4 г двузамещенного фосфата натрия и 6,3-7,7 г глюкозы. Консервант позволяет сохранить морфофункциональную полноценность отмытых эритроцитов в течение 21 суток хранения. 1 табл. Изобретение относится к медицине, в частности к ресуспендирующим и консервирующим растворам для эритроцитов, полученных из донорской крови. Взвесь эритроцитов в указанном растворе находит применение в гемотрансфузионной терапии анемий и острой кровопотери. Одним из методов компонентной гемотрансфузионной терапии является применение отмытых эритроцитов. Отмывание эритроцитов производят с целью удаления из крови лейкоцитов и плазмы. Лейкоциты удаляют для профилактики неспецифических температурных реакций и иммунных посттрансфузионных реакций и осложнений негемолитического типа, предупреждения легочного дисстресс-синдрома, переноса ряда вирусных и инфекционных заболеваний. Плазму удаляют для профилактики реакций несовместимости по белкам плазмы, наблюдаемых нередко в настоящее время из-за сенсибилизации реципиента к плазменным белкам, которая может давать при этом тяжелые осложнения вплоть до развития анафилактоидного состояния, синдрома аллогенной крови, отека легкого. Существенным недостатком взвеси отмытых эритроцитов является невозможность их хранения при 4  С в течение более 24 ч. В отсутствие специального консерванта для отмытых эритроцитов быстро нарастает гемолиз эритроцитов, что обусловливает их непригодность для клинического использования.
Известен [Silbert J.A. Transfusin, 1983, v.23, №1, р.8-10] отмывающий и консервирующий водный солевой раствор, включающий аденин, гидрофосфат натрия и глюкозу с осмолярностыо 340 мOсм/л. После 4-кратного отмывания содержание лейкоцитов в отмытых эритроцитах составило около 60%, а белка 0,0024% от исходных значений. На 21 сутки хранения взвеси в указанном растворе при 4 С в течение более 24 ч. В отсутствие специального консерванта для отмытых эритроцитов быстро нарастает гемолиз эритроцитов, что обусловливает их непригодность для клинического использования.
Известен [Silbert J.A. Transfusin, 1983, v.23, №1, р.8-10] отмывающий и консервирующий водный солевой раствор, включающий аденин, гидрофосфат натрия и глюкозу с осмолярностыо 340 мOсм/л. После 4-кратного отмывания содержание лейкоцитов в отмытых эритроцитах составило около 60%, а белка 0,0024% от исходных значений. На 21 сутки хранения взвеси в указанном растворе при 4 С 24-часовая приживаемость отмытых эритроцитов составила 80%, соответственно снизилось содержание аденозинтрифосфата (АТФ). Однако наблюдался недопустимо высокий процент гемолиза – 2% (в соответствии с Европейским стандартом предельный показатель гемолиза – 0,8%).
Также известен [патент РФ №1476647, МКИ А 61 К 35/18, опубл. 30.07.94, БИ №14] консервант для нативных эритроцитов, включающий 8,0 С 24-часовая приживаемость отмытых эритроцитов составила 80%, соответственно снизилось содержание аденозинтрифосфата (АТФ). Однако наблюдался недопустимо высокий процент гемолиза – 2% (в соответствии с Европейским стандартом предельный показатель гемолиза – 0,8%).
Также известен [патент РФ №1476647, МКИ А 61 К 35/18, опубл. 30.07.94, БИ №14] консервант для нативных эритроцитов, включающий 8,0 0,8 маc.% очищенного деионизированного и частично деструктурированного желатина с молекулярной массой (ММ) 13-20 тыс. Да, 0,08-0,12 маc.% двузамещенного цитрата натрия и не более 0,35 маc.% хлорида натрия в водном растворе. Указанный консервант благодаря содержащемуся в нем желатину обеспечивает гемодинамическое, реологическое, детоксикационное действия, улучшает микроциркуляцию и корригирует кислотно-основное состояние крови реципиента.
Но отмытые эритроциты, взвешенные в консерванте по патенту №1476647, сохраняют свои морфофункциональные свойства и энергетический обмен на удовлетворительном уровне только в течение 7 суток. При дальнейшем хранении показатели резко ухудшаются.
Наиболее близким по совокупности существенных признаков к заявленному консерванту является консервант для нативных эритроцитов, включающий 8 г/л очищенного деионизированного частично расщепленного желатина с ММ 13000-20000 Да, 1 г/л двузамещенного цитрата натрия, хлорида натрия 4 г/л, двузамещенного фосфата натрия 3,5-4,5 г/л и аденина 0,30-0,45 г/л [патент РФ №2098959, МКИ A 01 N 1/02; A G1 K 35/18, опубл. 20.12.97, БИ №35].
Указанный консервант улучшает консервирование отмытых эритроцитов, особенно в отношении сохранения содержания АТФ, однако другие показатели крови (морфофункциональные свойства крови) при хранении в указанном консерванте в течение 14 суток ухудшаются: снижается содержание нормоцитов до 52-54%; содержание свободного гемоглобина повышается до 0,4 г/л и более, а содержание осмотически неустойчивых эритроцитов – до 10-13%.
Технический результат, достигаемый в заявленном изобретении, заключается в сохранении морфофункциональной полноценности отмытых эритроцитов в течение 21 суток.
Указанный технический результат достигается тем, что консервант для эритроцитов, содержащий растворенные в воде очищенный деионизированный частично деструктурированный желатин с ММ 13000-20000 Да, хлорид натрия, двузамещенный цитрат натрия и двузамещенный фосфат натрия, дополнительно включает глюкозу, причем компоненты взяты в следующем соотношении, г/л:
Желатин 7,2-8,8
Цитрат натрия 0,9-1,1
Хлорид натрия 3,5-4,0
Двузамещенный фосфат натрия 3,6-4,4
Глюкоза 6,3-7,7
Вода для инъекций До 1 л
Очищенный деионизированный частично деструктурированный желатин с ММ 13000-20000 Да получают так, как это описано в патенте РФ №2098959 и в примере 1 конкретного воплощения изобретения. Другие компоненты консерванта выпускаются промышленностью:
цитрат натрия – по ГФ Х стр. 432
хлорид натрия – по ФС 42-2572-88
двузамещенный фосфат натрия – по ГФ Х стр. 896
глюкоза – по ФС 42-2419-86
вода для инъекций – по ФС 42-2620-89
Далее изобретение поясняется примерами.
Пример 1.
В простерилизованный реактор, содержащий 22 кг дистиллированной воды при температуре 20-30 0,8 маc.% очищенного деионизированного и частично деструктурированного желатина с молекулярной массой (ММ) 13-20 тыс. Да, 0,08-0,12 маc.% двузамещенного цитрата натрия и не более 0,35 маc.% хлорида натрия в водном растворе. Указанный консервант благодаря содержащемуся в нем желатину обеспечивает гемодинамическое, реологическое, детоксикационное действия, улучшает микроциркуляцию и корригирует кислотно-основное состояние крови реципиента.
Но отмытые эритроциты, взвешенные в консерванте по патенту №1476647, сохраняют свои морфофункциональные свойства и энергетический обмен на удовлетворительном уровне только в течение 7 суток. При дальнейшем хранении показатели резко ухудшаются.
Наиболее близким по совокупности существенных признаков к заявленному консерванту является консервант для нативных эритроцитов, включающий 8 г/л очищенного деионизированного частично расщепленного желатина с ММ 13000-20000 Да, 1 г/л двузамещенного цитрата натрия, хлорида натрия 4 г/л, двузамещенного фосфата натрия 3,5-4,5 г/л и аденина 0,30-0,45 г/л [патент РФ №2098959, МКИ A 01 N 1/02; A G1 K 35/18, опубл. 20.12.97, БИ №35].
Указанный консервант улучшает консервирование отмытых эритроцитов, особенно в отношении сохранения содержания АТФ, однако другие показатели крови (морфофункциональные свойства крови) при хранении в указанном консерванте в течение 14 суток ухудшаются: снижается содержание нормоцитов до 52-54%; содержание свободного гемоглобина повышается до 0,4 г/л и более, а содержание осмотически неустойчивых эритроцитов – до 10-13%.
Технический результат, достигаемый в заявленном изобретении, заключается в сохранении морфофункциональной полноценности отмытых эритроцитов в течение 21 суток.
Указанный технический результат достигается тем, что консервант для эритроцитов, содержащий растворенные в воде очищенный деионизированный частично деструктурированный желатин с ММ 13000-20000 Да, хлорид натрия, двузамещенный цитрат натрия и двузамещенный фосфат натрия, дополнительно включает глюкозу, причем компоненты взяты в следующем соотношении, г/л:
Желатин 7,2-8,8
Цитрат натрия 0,9-1,1
Хлорид натрия 3,5-4,0
Двузамещенный фосфат натрия 3,6-4,4
Глюкоза 6,3-7,7
Вода для инъекций До 1 л
Очищенный деионизированный частично деструктурированный желатин с ММ 13000-20000 Да получают так, как это описано в патенте РФ №2098959 и в примере 1 конкретного воплощения изобретения. Другие компоненты консерванта выпускаются промышленностью:
цитрат натрия – по ГФ Х стр. 432
хлорид натрия – по ФС 42-2572-88
двузамещенный фосфат натрия – по ГФ Х стр. 896
глюкоза – по ФС 42-2419-86
вода для инъекций – по ФС 42-2620-89
Далее изобретение поясняется примерами.
Пример 1.
В простерилизованный реактор, содержащий 22 кг дистиллированной воды при температуре 20-30 С, загружают при перемешивании 4,5 кг желатина. После набухания желатина в воде в течение часа при перемешивании содержимое реактора подогревают до 50-60 С, загружают при перемешивании 4,5 кг желатина. После набухания желатина в воде в течение часа при перемешивании содержимое реактора подогревают до 50-60 С. Желатин растворяется. Содержимое реактора нагревают до 120 С. Желатин растворяется. Содержимое реактора нагревают до 120 С и проводят деструкцию желатина при 120-124 С и проводят деструкцию желатина при 120-124 С в течение 90-120 мин. После охлаждения раствор желатина обессоливают пропусканием через колонку с катионнообменной смолой КУ-2-8 при температуре 40-45 С в течение 90-120 мин. После охлаждения раствор желатина обессоливают пропусканием через колонку с катионнообменной смолой КУ-2-8 при температуре 40-45 C с постоянной удельной нагрузкой 2,5 л/л смолы/ч.
Раствор желатина разбавляют дистиллированной водой до концентрации 9,5% мас, вводят янтарный ангидрид в количестве 2 г на 1 л раствора желатина и подвергают желатин гидролизу при температуре 120-124 C с постоянной удельной нагрузкой 2,5 л/л смолы/ч.
Раствор желатина разбавляют дистиллированной водой до концентрации 9,5% мас, вводят янтарный ангидрид в количестве 2 г на 1 л раствора желатина и подвергают желатин гидролизу при температуре 120-124 С. При этом каждые 20 мин контролируется величина ММ желатина. Гидролиз прекращают при показателе ММ, равном 13000-20000 Да.
Раствор охлаждают до температуры 50-60 С. При этом каждые 20 мин контролируется величина ММ желатина. Гидролиз прекращают при показателе ММ, равном 13000-20000 Да.
Раствор охлаждают до температуры 50-60 С и вводят при постоянном перемешивании 0,83 л 5% раствора двузамещенного цитрата натрия, 0,83 л 20% раствора двузамещенного фосфата натрия и 0,58 л 50% раствора глюкозы. Для нейтрализации вводят 2,3 л 12% раствора кислого углекислого натрия, после чего добавляют 0,6 кг 20% раствора хлорида натрия.
Полученный консервант стерилизуют фильтрацией через фильтр “Орион” и разливают во флаконы вместимостью 500 мл по 400 мл в каждый.
После выдержки флаконов в течение 15 суток их подвергают визуальной оценке в соответствии с “Временной инструкцией по просмотру инъекционных растворов, препаратов крови, кровезаменителей и консервантов крови во флаконах на отсутствие в них механических загрязнений”, утвержденной МЗ СССР 29.12.71 г. После визуальной оценки препарат анализируют.
Состав консерванта:
Желатин 8,0 г/л
Цитрат натрия 1 г/л
Хлорид натрия 3,5 г/л
Двузамещенный фосфат натрия 4 г/л
Глюкоза 7 г/л
Вода для инъекций До 1 л
Пример 2.
Консервант получали как в примере 1, но брали иное соотношение компонентов.
Состав полученного консерванта:
Желатин 7,2 г/л
Цитрат натрия 0,9 г/л
Хлорид натрия 4,0 г/л
Двузамещенный фосфат натрия 3,6 г/л
Глюкоза 6,3 г/л
Вода для инъекций До 1 л
Пример 3.
Консервант получали как в примере 1, но брали иное соотношение компонентов.
Состав полученного консерванта:
Желатин 8,8 г/л
Цитрат натрия 1,1 г/л
Хлорид натрия 4,0 г/л
Двузамещенный фосфат натрия 4,4 г/л
Глюкоза 7,7 г/л
Вода для инъекций До 1 л
Для изучения свойств заявляемого препарата как ресуспендирующей и консервирующей среды для отмытых эритроцитов в нем взвешивали отмытые эритроциты крови доноров в соотношении 1:1.
Трехкратному отмыванию изотоническим 0,9 % раствором хлорида натрия подвергали эритроцитный концентрат, полученный из консервированной донорской крови, заготовленной на “Глюгицире” после ее центрифугирования и удаления плазмы и лейкотромбослоя согласно “Инструкции по фракционированию крови доноров на клеточные компоненты и плазму” (М., 1987).
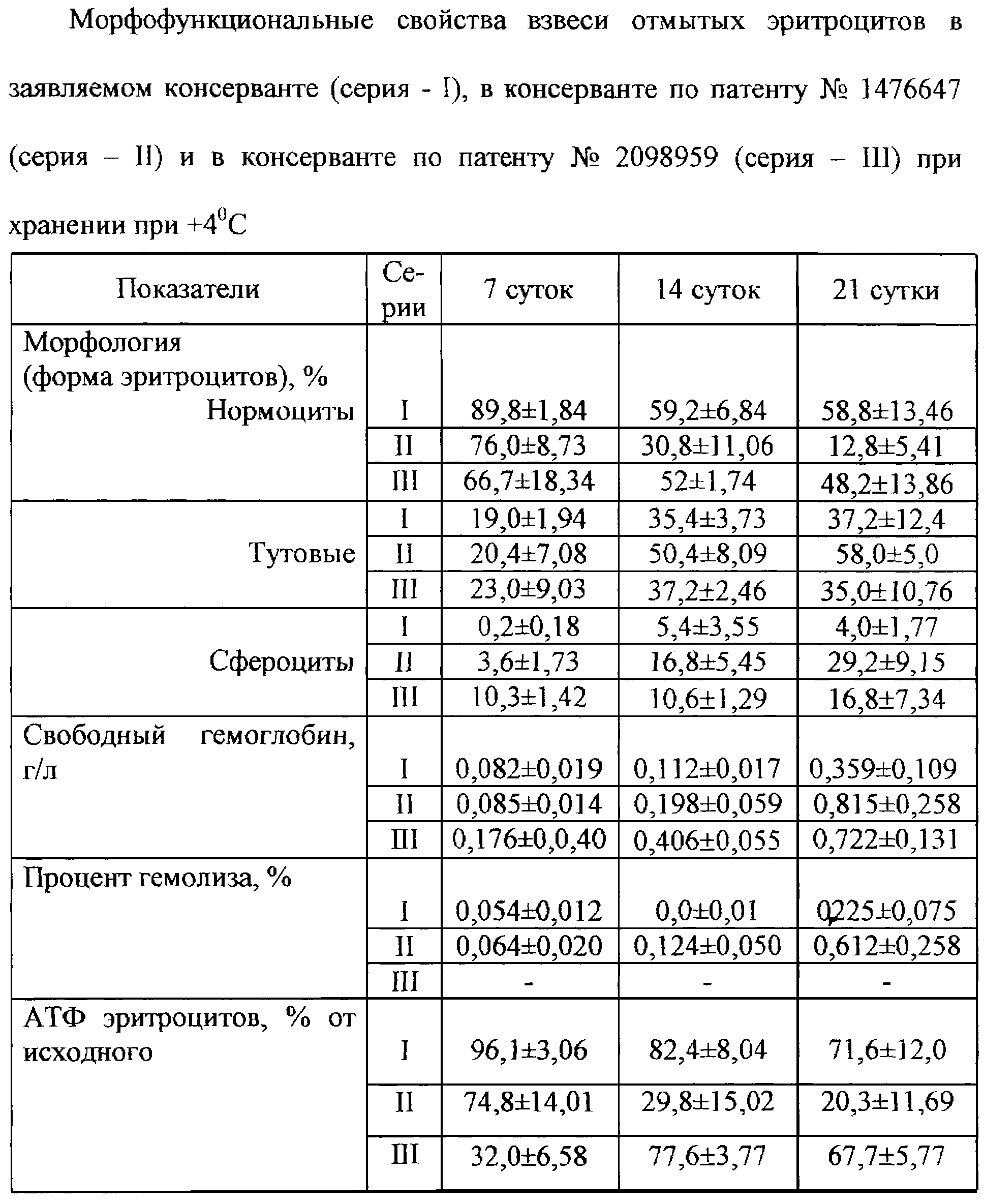
Были изучены морфофункциональные свойства отмытых эритроцитов, взвешенных в заявляемом консерванте, а также в консервантах по патентам РФ №1476647 и 2098959, на 7,14 и 21 сутки хранения. Результаты представлены в таблице.
Анализ приведенных данных показывает, что заявляемый консервант обеспечивает морфофункциональную сохранность отмытых эритроцитов при 4 С и вводят при постоянном перемешивании 0,83 л 5% раствора двузамещенного цитрата натрия, 0,83 л 20% раствора двузамещенного фосфата натрия и 0,58 л 50% раствора глюкозы. Для нейтрализации вводят 2,3 л 12% раствора кислого углекислого натрия, после чего добавляют 0,6 кг 20% раствора хлорида натрия.
Полученный консервант стерилизуют фильтрацией через фильтр “Орион” и разливают во флаконы вместимостью 500 мл по 400 мл в каждый.
После выдержки флаконов в течение 15 суток их подвергают визуальной оценке в соответствии с “Временной инструкцией по просмотру инъекционных растворов, препаратов крови, кровезаменителей и консервантов крови во флаконах на отсутствие в них механических загрязнений”, утвержденной МЗ СССР 29.12.71 г. После визуальной оценки препарат анализируют.
Состав консерванта:
Желатин 8,0 г/л
Цитрат натрия 1 г/л
Хлорид натрия 3,5 г/л
Двузамещенный фосфат натрия 4 г/л
Глюкоза 7 г/л
Вода для инъекций До 1 л
Пример 2.
Консервант получали как в примере 1, но брали иное соотношение компонентов.
Состав полученного консерванта:
Желатин 7,2 г/л
Цитрат натрия 0,9 г/л
Хлорид натрия 4,0 г/л
Двузамещенный фосфат натрия 3,6 г/л
Глюкоза 6,3 г/л
Вода для инъекций До 1 л
Пример 3.
Консервант получали как в примере 1, но брали иное соотношение компонентов.
Состав полученного консерванта:
Желатин 8,8 г/л
Цитрат натрия 1,1 г/л
Хлорид натрия 4,0 г/л
Двузамещенный фосфат натрия 4,4 г/л
Глюкоза 7,7 г/л
Вода для инъекций До 1 л
Для изучения свойств заявляемого препарата как ресуспендирующей и консервирующей среды для отмытых эритроцитов в нем взвешивали отмытые эритроциты крови доноров в соотношении 1:1.
Трехкратному отмыванию изотоническим 0,9 % раствором хлорида натрия подвергали эритроцитный концентрат, полученный из консервированной донорской крови, заготовленной на “Глюгицире” после ее центрифугирования и удаления плазмы и лейкотромбослоя согласно “Инструкции по фракционированию крови доноров на клеточные компоненты и плазму” (М., 1987).
Были изучены морфофункциональные свойства отмытых эритроцитов, взвешенных в заявляемом консерванте, а также в консервантах по патентам РФ №1476647 и 2098959, на 7,14 и 21 сутки хранения. Результаты представлены в таблице.
Анализ приведенных данных показывает, что заявляемый консервант обеспечивает морфофункциональную сохранность отмытых эритроцитов при 4 С в течение 21 суток. Низкий процент гемолиза (значительно ниже допустимого Европейским стандартом значения 0,8%) и содержание АТФ более 70% свидетельствуют о приживаемости взвеси отмытых эритроцитов в заявляемом консерванте для трансфузий в течение указанного срока хранения. С в течение 21 суток. Низкий процент гемолиза (значительно ниже допустимого Европейским стандартом значения 0,8%) и содержание АТФ более 70% свидетельствуют о приживаемости взвеси отмытых эритроцитов в заявляемом консерванте для трансфузий в течение указанного срока хранения.
Формула изобретения
MM4A Досрочное прекращение действия патента из-за неуплаты в установленный срок пошлины за
Дата прекращения действия патента: 06.03.2009
Дата публикации: 20.08.2011
|
||||||||||||||||||||||||||
