Патент на изобретение №2223950
|
||||||||||||||||||||||||||
(54) Способ получения пестицидных производных
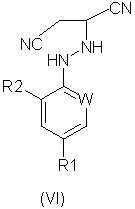
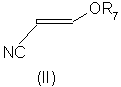
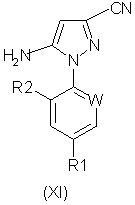
(57) Реферат: Изобретение относится к новому способу получения соединений формулы (I), где W представляет собой азот или –CR3; R1 представляет собой галоген, галогеноалкил, предпочтительно трифторметил, галогеноалкокси, предпочтительно трифторметокси, R4S(O)n-, или –SF5; R2 представляет собой водород или галоген, например хлор или бром; R3 представляет собой галоген, например хлор или бром; R4 представляет собой алкил или галогеноалкил; и n равняется 0, 1 или 2; который включает реакцию кислотно-аддитивной соли арилгидразина формулы (III), где R1, R2 и W определены выше, (А) с соединением формулы (II), где R5 и R6 независимо представляют собой алкил или вместе представляют собой алкиленовую цепь, содержащую два или три атома углерода, или (Б) с соединением формулы (IV), где R7 представляет собой алкил, предпочтительно метил или этил; или который включает окисление соединения формулы (V). Изобретение также относится к усовершенствованному способу получения соединений формулы (VI) и соединений формулы (XI), где R1, R2 и W определены, как указано выше. Способы позволяют получать соединения в чистом виде, пригодном для производства пестицидов. 5 с. и 13 з.п. ф-лы. Формула (I): 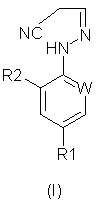 Формула (VI):
Формула (VI):
 Формула (II):
Формула (II):
 Формула (XI):
Формула (XI):
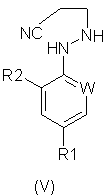
 Формула (III):
Формула (III):
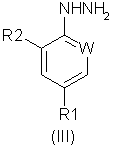 Формула (IV):
Формула (IV):
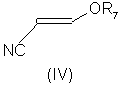 Формула (V):
Формула (V):
 Настоящее изобретение относится к новым способам получения промежуточных соединений (в частности соединений 2-(арилгидразино)-сукцинонитрила и производных 3-(арилгидразоно)пропионитрила), которые применяются при получении пестицидов.
Публикации Европейских патентов 0295117 и 0234119 описывают получение пестицидно-активных соединений фенилпиразола и промежуточные соединения 5-амино-1-арил-3-цианопиразола, которые применяются в их синтезе.
Известны различные методы получения этих соединений. Настоящее изобретение предназначено для обеспечения улучшенных или более экономичных способов получения пестицидов и промежуточных соединений, пригодных для их получения.
Германский патент № 3612940 раскрывает получение производных 5-амино-1-арилпиразола общей формулы:
Настоящее изобретение относится к новым способам получения промежуточных соединений (в частности соединений 2-(арилгидразино)-сукцинонитрила и производных 3-(арилгидразоно)пропионитрила), которые применяются при получении пестицидов.
Публикации Европейских патентов 0295117 и 0234119 описывают получение пестицидно-активных соединений фенилпиразола и промежуточные соединения 5-амино-1-арил-3-цианопиразола, которые применяются в их синтезе.
Известны различные методы получения этих соединений. Настоящее изобретение предназначено для обеспечения улучшенных или более экономичных способов получения пестицидов и промежуточных соединений, пригодных для их получения.
Германский патент № 3612940 раскрывает получение производных 5-амино-1-арилпиразола общей формулы:
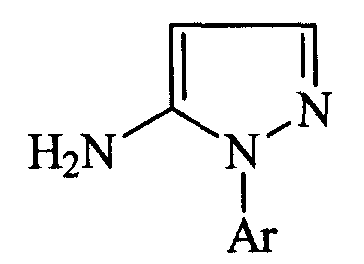 где Аr представляет собой замещенный фенил или пиридил, которые могут применяться в качестве интермедиатов при получении соединений, обладающих гербицидными или пестицидными свойствами, посредством реакции гидрохлоридов арилгидразина с натриевой солью формилацетонитрила формулы:
NaOCH=CH-CN
с образованием соединений гидразона общей формулы:
Ar-NH-N=CH-CH2-CN,
где Аr определен, как указано выше; которые далее циклизуются в присутствии основания. В названном источнике не предполагается использование вместо соли NaOCH=CH-CN реагентов с другими функциональностями.
Однако может быть желательным получить производные гидразона в чистом виде, пригодном для их дальнейшего превращения в пестициды. Известные способы могут приводить к образованию гидразонов, которые загрязнены продуктами циклизации – 5-амино-1-арилпиразолами.
Авторы настоящего изобретения неожиданно обнаружили новый способ получения гидразонов без сопутствующей циклизации. Производные гидразона могут быть далее использованы либо для создания нового способа получения 5-амино-1-арилпиразолов, либо в новом способе, который включает присоединение цианида с получением производных 2-(арилгидразино)сукцинонитрила, которые далее могут быть превращены в соединения 5-амино-1-арил-3-цианопиразола, являющиеся важными промежуточными соединениями в получении пестицидов.
В работе S.Murahashi et al. “Cyanoacetylene. I. The Synthesis and some chemical properties”. Chemical Abstract, Vol. 53, No.5, 1959, p. 5163, раскрыто получение 3-(арилгидразоно)пропионитрила взаимодействием кислотно-аддитивной соли арилгидразина с 3,3-диэтоксипропионитрилом.
Однако такая реакция раскрыта только для 2,4-динитрозамещенного в фенильном кольце арилгидразина. Указанное 2,4-динитрозамещение обеспечивает легкость протекания вышеуказанной реакции через нуклеофильную атаку гидразинового заместителя при фенильном кольце указанного 2,4-динитрозамещенного арилгидразина. Однако в названном источнике не описываются и не предполагаются возможность и условия протекания подобной реакции в случае других заместителей при фенильном кольце или их отсутствии, т.е. когда не обеспечена высокая реакционная способность гидразиновой группы в 1-положении фенильного кольца.
Патент США 4824960 описывает получение производных 5-амино-1-арилпиразола общей формулы:
где Аr представляет собой замещенный фенил или пиридил, которые могут применяться в качестве интермедиатов при получении соединений, обладающих гербицидными или пестицидными свойствами, посредством реакции гидрохлоридов арилгидразина с натриевой солью формилацетонитрила формулы:
NaOCH=CH-CN
с образованием соединений гидразона общей формулы:
Ar-NH-N=CH-CH2-CN,
где Аr определен, как указано выше; которые далее циклизуются в присутствии основания. В названном источнике не предполагается использование вместо соли NaOCH=CH-CN реагентов с другими функциональностями.
Однако может быть желательным получить производные гидразона в чистом виде, пригодном для их дальнейшего превращения в пестициды. Известные способы могут приводить к образованию гидразонов, которые загрязнены продуктами циклизации – 5-амино-1-арилпиразолами.
Авторы настоящего изобретения неожиданно обнаружили новый способ получения гидразонов без сопутствующей циклизации. Производные гидразона могут быть далее использованы либо для создания нового способа получения 5-амино-1-арилпиразолов, либо в новом способе, который включает присоединение цианида с получением производных 2-(арилгидразино)сукцинонитрила, которые далее могут быть превращены в соединения 5-амино-1-арил-3-цианопиразола, являющиеся важными промежуточными соединениями в получении пестицидов.
В работе S.Murahashi et al. “Cyanoacetylene. I. The Synthesis and some chemical properties”. Chemical Abstract, Vol. 53, No.5, 1959, p. 5163, раскрыто получение 3-(арилгидразоно)пропионитрила взаимодействием кислотно-аддитивной соли арилгидразина с 3,3-диэтоксипропионитрилом.
Однако такая реакция раскрыта только для 2,4-динитрозамещенного в фенильном кольце арилгидразина. Указанное 2,4-динитрозамещение обеспечивает легкость протекания вышеуказанной реакции через нуклеофильную атаку гидразинового заместителя при фенильном кольце указанного 2,4-динитрозамещенного арилгидразина. Однако в названном источнике не описываются и не предполагаются возможность и условия протекания подобной реакции в случае других заместителей при фенильном кольце или их отсутствии, т.е. когда не обеспечена высокая реакционная способность гидразиновой группы в 1-положении фенильного кольца.
Патент США 4824960 описывает получение производных 5-амино-1-арилпиразола общей формулы:
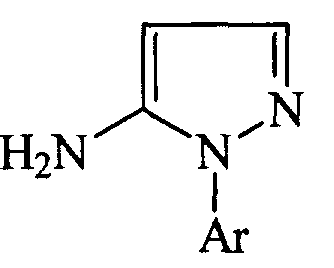 где Аr представляет собой замещенный фенил или пиридил, которые могут быть использованы в качестве интермедиатов при получении соединений, обладающих гербицидной или пестицидной активностью, посредством взаимодействия арилгидразинов общей формулы:
Ar-NH-NH2,
где Аr определен выше, с акрилонитрилом формулы:
NC-CH=CH2
в присутствии разбавителя и, возможно, катализатора на первой стадии, с образованием 3-арилгидразинопропионитрила формулы:
Ar-NH-NH-CH2-CH2-CN,
где Ar определен выше, с последующим окислением и циклизацией на второй стадии процесса. Однако такое окисление сопровождается циклизацией в 5-амино-1-арилпиразолы.
Окисление 3-арилгидразинопропионитрила с получением 3-арилгидразонопропионитрила с использованием соли металла в качестве окислителя описано также в работе P.Schmidt et al., Ueber die Herstellung von 2-Phenyl-3-amino-pyrazol als Aminokomponente eines langwirkenden Sulfonamids”, Helvetica Chimica Acta, Vol. 41, 1985, p. 306-309. Однако имеющиеся в названной работе данные спектрального анализа продуктов показывают, что и в данном случае реакция окисления сопровождается побочной реакцией циклизации, приводя к загрязнению получаемого арилгидразонопропионитрила продуктами циклизации -5-амино-1-арилпиразолами.
Таким образом, если желательно провести окисление вышеназванных 3-арилгидразинопропионитрилов (без циклизации в 5-амино-1-арилпиразолы) с целью получения 3-арилгидразонопропионитрилов, которые далее могут быть превращены в важные 5-амино-1-арил-3-цианопиразолы, являющиеся ценными интермедиатами при получении пестицидов, необходимо применять другой способ.
В настоящем изобретении, соответственно, предлагается способ (А) получения соединений формулы (I):
где Аr представляет собой замещенный фенил или пиридил, которые могут быть использованы в качестве интермедиатов при получении соединений, обладающих гербицидной или пестицидной активностью, посредством взаимодействия арилгидразинов общей формулы:
Ar-NH-NH2,
где Аr определен выше, с акрилонитрилом формулы:
NC-CH=CH2
в присутствии разбавителя и, возможно, катализатора на первой стадии, с образованием 3-арилгидразинопропионитрила формулы:
Ar-NH-NH-CH2-CH2-CN,
где Ar определен выше, с последующим окислением и циклизацией на второй стадии процесса. Однако такое окисление сопровождается циклизацией в 5-амино-1-арилпиразолы.
Окисление 3-арилгидразинопропионитрила с получением 3-арилгидразонопропионитрила с использованием соли металла в качестве окислителя описано также в работе P.Schmidt et al., Ueber die Herstellung von 2-Phenyl-3-amino-pyrazol als Aminokomponente eines langwirkenden Sulfonamids”, Helvetica Chimica Acta, Vol. 41, 1985, p. 306-309. Однако имеющиеся в названной работе данные спектрального анализа продуктов показывают, что и в данном случае реакция окисления сопровождается побочной реакцией циклизации, приводя к загрязнению получаемого арилгидразонопропионитрила продуктами циклизации -5-амино-1-арилпиразолами.
Таким образом, если желательно провести окисление вышеназванных 3-арилгидразинопропионитрилов (без циклизации в 5-амино-1-арилпиразолы) с целью получения 3-арилгидразонопропионитрилов, которые далее могут быть превращены в важные 5-амино-1-арил-3-цианопиразолы, являющиеся ценными интермедиатами при получении пестицидов, необходимо применять другой способ.
В настоящем изобретении, соответственно, предлагается способ (А) получения соединений формулы (I):
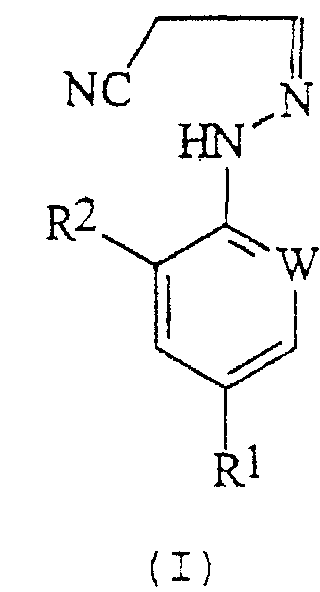 где W представляет собой азот или -CR3;
R1 представляет собой галоген, галогеноалкил (предпочтительно трифторметил), галогеноалкокси (предпочтительно трифторметокси), R4S (О)n-, или -SF5;
R2 представляет собой водород или галоген (например, хлор или бром);
R3 представляет собой галоген (например, хлор или бром);
R4 представляет собой алкил или галогеноалкил;
n представляет собой 0, 1 или 2; причем указанный способ включает реакцию соединения формулы (II):
где W представляет собой азот или -CR3;
R1 представляет собой галоген, галогеноалкил (предпочтительно трифторметил), галогеноалкокси (предпочтительно трифторметокси), R4S (О)n-, или -SF5;
R2 представляет собой водород или галоген (например, хлор или бром);
R3 представляет собой галоген (например, хлор или бром);
R4 представляет собой алкил или галогеноалкил;
n представляет собой 0, 1 или 2; причем указанный способ включает реакцию соединения формулы (II):
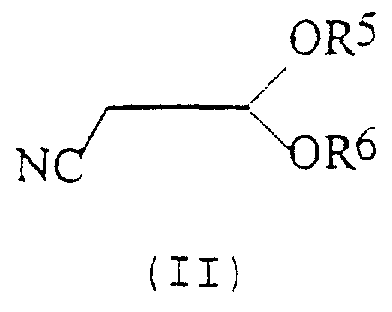 в котором R5 и R6 независимо представляют собой алкил или вместе представляют собой алкиленовую цепь, содержащую два или три углеродных атома, с кислотно-аддитивной солью арилгидразина формулы (III):
в котором R5 и R6 независимо представляют собой алкил или вместе представляют собой алкиленовую цепь, содержащую два или три углеродных атома, с кислотно-аддитивной солью арилгидразина формулы (III):
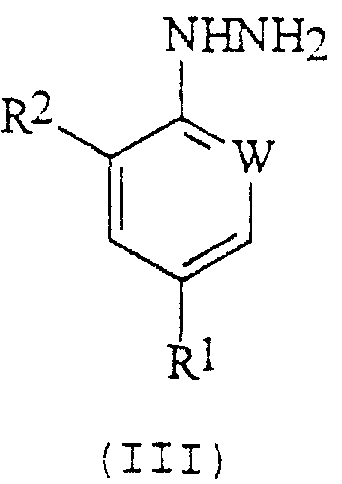 в котором R1, R2 и W определены, как указано выше. Соединения формулы (I) могут существовать в виде смеси син- и антиизомеров или как индивидуальные изомеры.
Если не дано другого определения, “алкил” в данном описании означает линейный или разветвленный алкил, содержащий от одного до шести атомов углерода (предпочтительно от одного до трех). Если не дано другого определения, “галогеноалкил” и “галогеноалкокси” означает линейный или разветвленный алкил или алкокси, соответственно, содержащий от одного до шести атомов углерода (предпочтительно от одного до трех), замещенный одним или несколькими атомами галогена, выбранными из фтора, хлора или брома.
В общем случае группы R5 и R6 в формуле (II) представляют собой одинаковые алкильные группы, предпочтительно метил или этил. Кислотно-аддитивные соли соединений формулы (III) предпочтительно являются солями, образованными сильными кислотами, такими как минеральные кислоты, например серная кислота или, предпочтительно, соляная кислота. В общем случае соли получают предварительно, но они также могут быть получены in situ. Реакция может быть проведена в полярном или неполярном растворителе в присутствии воды.
Примеры полярных растворителей включают воду; спирты, такие как метанол или этанол; нитрилы, такие как ацетонитрил; N-метилпирролидон или сульфоксиды, такие как диметилсульфоксид.
Примеры неполярных растворителей включают хлорированные углеводороды, предпочтительно четыреххлористый углерод; и углеводороды, такие как циклогексан. Температура реакции в общем случае составляет от 20 до 100
в котором R1, R2 и W определены, как указано выше. Соединения формулы (I) могут существовать в виде смеси син- и антиизомеров или как индивидуальные изомеры.
Если не дано другого определения, “алкил” в данном описании означает линейный или разветвленный алкил, содержащий от одного до шести атомов углерода (предпочтительно от одного до трех). Если не дано другого определения, “галогеноалкил” и “галогеноалкокси” означает линейный или разветвленный алкил или алкокси, соответственно, содержащий от одного до шести атомов углерода (предпочтительно от одного до трех), замещенный одним или несколькими атомами галогена, выбранными из фтора, хлора или брома.
В общем случае группы R5 и R6 в формуле (II) представляют собой одинаковые алкильные группы, предпочтительно метил или этил. Кислотно-аддитивные соли соединений формулы (III) предпочтительно являются солями, образованными сильными кислотами, такими как минеральные кислоты, например серная кислота или, предпочтительно, соляная кислота. В общем случае соли получают предварительно, но они также могут быть получены in situ. Реакция может быть проведена в полярном или неполярном растворителе в присутствии воды.
Примеры полярных растворителей включают воду; спирты, такие как метанол или этанол; нитрилы, такие как ацетонитрил; N-метилпирролидон или сульфоксиды, такие как диметилсульфоксид.
Примеры неполярных растворителей включают хлорированные углеводороды, предпочтительно четыреххлористый углерод; и углеводороды, такие как циклогексан. Температура реакции в общем случае составляет от 20 до 100 С, предпочтительно от 50 до 90 С, предпочтительно от 50 до 90 С. В общем случае используют эквимолярные количества соединений формул (II) и (III). Количество воды может изменяться от каталитического количества до большого избытка.
Предпочтительные значения символов в формулах (I), (III) и в формулах, приведенных далее по тексту, являются следующими:
R1 представляет собой галогеноалкил (предпочтительно трифторметил), галогеноалкокси (предпочтительно трифторметокси), или -SF5;
W представляет собой -CR3; и R3 представляет собой галоген. Наиболее предпочтительным соединением формулы (I) является 3-(2,6-дихлор-4-трифторметилфенилгидразоно)пропио-нитрил.
Другим предпочтительным соединением формулы (I) является 3-(2-хлор-4-трифторметилфенилгидразоно)пропио-нитрил.
Соединения формул (II) и (III) в целом известны в литературе.
Способ по изобретению имеет много преимуществ. Так, он предполагает, что производные 3-арилгидразонопропионитрила формулы (I) могут быть получены с более высокими выходами из легкодоступных исходных веществ.
Далее, может оказаться, что проведение реакции будет простым и экономичным, а выделение продуктов будет очень легким. Более того, соединения формулы (I) могут быть получены без заметной параллельной циклизации.
В соответствии со следующим признаком настоящего изобретения предлагается способ (Б) получения соединения формулы (I), где W, R1 и R2 определены выше, причем способ включает взаимодействие соединения формулы (IV): С. В общем случае используют эквимолярные количества соединений формул (II) и (III). Количество воды может изменяться от каталитического количества до большого избытка.
Предпочтительные значения символов в формулах (I), (III) и в формулах, приведенных далее по тексту, являются следующими:
R1 представляет собой галогеноалкил (предпочтительно трифторметил), галогеноалкокси (предпочтительно трифторметокси), или -SF5;
W представляет собой -CR3; и R3 представляет собой галоген. Наиболее предпочтительным соединением формулы (I) является 3-(2,6-дихлор-4-трифторметилфенилгидразоно)пропио-нитрил.
Другим предпочтительным соединением формулы (I) является 3-(2-хлор-4-трифторметилфенилгидразоно)пропио-нитрил.
Соединения формул (II) и (III) в целом известны в литературе.
Способ по изобретению имеет много преимуществ. Так, он предполагает, что производные 3-арилгидразонопропионитрила формулы (I) могут быть получены с более высокими выходами из легкодоступных исходных веществ.
Далее, может оказаться, что проведение реакции будет простым и экономичным, а выделение продуктов будет очень легким. Более того, соединения формулы (I) могут быть получены без заметной параллельной циклизации.
В соответствии со следующим признаком настоящего изобретения предлагается способ (Б) получения соединения формулы (I), где W, R1 и R2 определены выше, причем способ включает взаимодействие соединения формулы (IV):
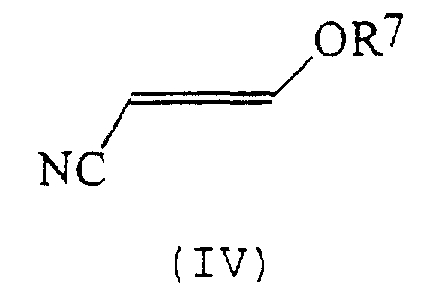 где R7 представляет собой алкил (преимущественно метил или этил), с соединением формулы (III), в которой R1, R2 и W определены выше. Применяемые условия проведения реакции в общем случае такие же, как и те, что описаны выше для получения соединения формулы (I) по реакции соединения формулы (II) с кислотно-аддитивной солью соединения формулы (III).
Соединения формулы (IV) в общем случае хорошо известны из литературы.
В соответствии со следующим признаком настоящего изобретения, предлагается способ (В) получения соединения формулы (I), где W, R1 и R2 определены выше; причем способ включает окисление соединения формулы (V):
где R7 представляет собой алкил (преимущественно метил или этил), с соединением формулы (III), в которой R1, R2 и W определены выше. Применяемые условия проведения реакции в общем случае такие же, как и те, что описаны выше для получения соединения формулы (I) по реакции соединения формулы (II) с кислотно-аддитивной солью соединения формулы (III).
Соединения формулы (IV) в общем случае хорошо известны из литературы.
В соответствии со следующим признаком настоящего изобретения, предлагается способ (В) получения соединения формулы (I), где W, R1 и R2 определены выше; причем способ включает окисление соединения формулы (V):
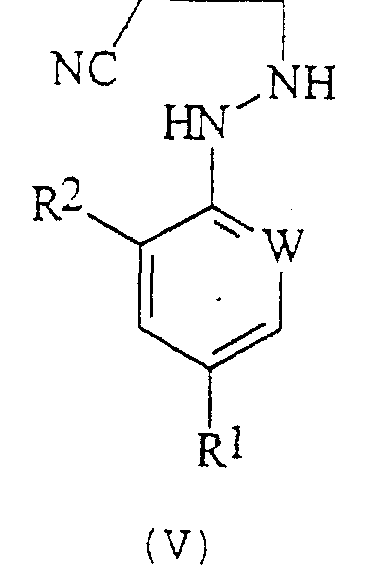 где R1, R2 и W определены выше.
Подходящие окислители для вышеназванной реакции образования соединений формулы (I) включают хиноны, такие как бензохинон, пероксиды, такие как перекись водорода, гипогалогениты, такие как гипохлорит натрия; или предпочтительно соли или оксиды металлов, например хлорид меди или оксид ртути. Окисление обычно проводят в растворителе. Подходящие растворители включают ароматические галогенированные или негалогенированные углеводороды, такие как толуол или хлорбензол, нитрилы, такие как ацетонитрил, или амиды, такие как N,N-диметилформамид. Температура реакции составляет обычно от примерно 20
где R1, R2 и W определены выше.
Подходящие окислители для вышеназванной реакции образования соединений формулы (I) включают хиноны, такие как бензохинон, пероксиды, такие как перекись водорода, гипогалогениты, такие как гипохлорит натрия; или предпочтительно соли или оксиды металлов, например хлорид меди или оксид ртути. Окисление обычно проводят в растворителе. Подходящие растворители включают ароматические галогенированные или негалогенированные углеводороды, такие как толуол или хлорбензол, нитрилы, такие как ацетонитрил, или амиды, такие как N,N-диметилформамид. Температура реакции составляет обычно от примерно 20 С до примерно 150 С до примерно 150 С и предпочтительно от примерно 50 С и предпочтительно от примерно 50 С до примерно 100 С до примерно 100 С.
Мольное отношение окислителя к соединению формулы (V) обычно составляет от 0,01:1 до 5:1, предпочтительно от 1:1 до 3:1.
В соответствии со следующим признаком настоящего изобретения, предлагается способ (Г) получения соединения формулы (VI): С.
Мольное отношение окислителя к соединению формулы (V) обычно составляет от 0,01:1 до 5:1, предпочтительно от 1:1 до 3:1.
В соответствии со следующим признаком настоящего изобретения, предлагается способ (Г) получения соединения формулы (VI):
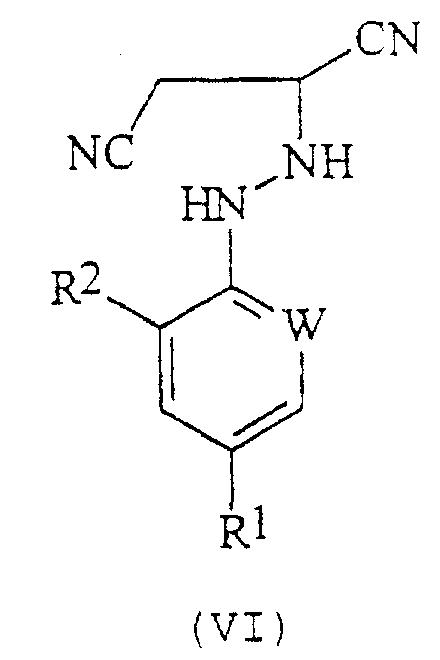 где R1, R2 и W описаны выше; причем способ включает реакцию соединения формулы (I), в котором R1, R2 и W описаны выше, с источником цианистого водорода. Соединения формулы (VI) могут существовать в R- и S-формах или в виде их смесей.
Источником цианистого водорода может быть собственно цианистый водород в газообразной форме в случае возможного проведения реакции в присутствии основания, например пиридина; но его предпочтительнее получать in situ (во избежание непосредственного использования цианистого водорода) из цианистых солей металлов (обычно цианиды щелочных металлов, например цианид натрия или цианид калия) в присутствии кислоты. Подходящие кислоты включают органические кислоты, такие как алифатические карбоновые кислоты, например уксусную кислоту, или галогенированные алифатические карбоновые кислоты, например хлоруксусная кислота или трифторуксусная кислота; сульфоновые кислоты, такие как бензолсульфоновая кислота, 4-толуолсульфоновая кислота или метансульфоновая кислота; или неорганические кислоты, такие как соляная кислота или серная кислота.
Альтернативными источниками цианистого водорода (который может быть генерирован in situ) являются триметилсилилцианид в воде или смесь триметилсилилцианида и кислот Льюиса, например тетрахлорида олова (IV), в растворителе, таком как дихлорметан или тетрагидрофуран, при температуре от 20 до 100
где R1, R2 и W описаны выше; причем способ включает реакцию соединения формулы (I), в котором R1, R2 и W описаны выше, с источником цианистого водорода. Соединения формулы (VI) могут существовать в R- и S-формах или в виде их смесей.
Источником цианистого водорода может быть собственно цианистый водород в газообразной форме в случае возможного проведения реакции в присутствии основания, например пиридина; но его предпочтительнее получать in situ (во избежание непосредственного использования цианистого водорода) из цианистых солей металлов (обычно цианиды щелочных металлов, например цианид натрия или цианид калия) в присутствии кислоты. Подходящие кислоты включают органические кислоты, такие как алифатические карбоновые кислоты, например уксусную кислоту, или галогенированные алифатические карбоновые кислоты, например хлоруксусная кислота или трифторуксусная кислота; сульфоновые кислоты, такие как бензолсульфоновая кислота, 4-толуолсульфоновая кислота или метансульфоновая кислота; или неорганические кислоты, такие как соляная кислота или серная кислота.
Альтернативными источниками цианистого водорода (который может быть генерирован in situ) являются триметилсилилцианид в воде или смесь триметилсилилцианида и кислот Льюиса, например тетрахлорида олова (IV), в растворителе, таком как дихлорметан или тетрагидрофуран, при температуре от 20 до 100 С, предпочтительно от 30 до 60 С, предпочтительно от 30 до 60 С. Реакцию предпочтительно проводят при повышенном давлении, которое ускоряет реакцию.
Получение соединений формулы (VI) из соединений формулы (I) может быть проведено в полярном или неполярном растворителе. Примеры полярных растворителей, которые могут быть использованы, включают воду; спирты, такие как метанол или этанол; N,N-диметилформамид; диметилсульфоксид; или алкановые кислоты, такие как уксусная кислота. Примеры неполярных растворителей включают углеводороды, такие как гексан, или простые эфиры, такие как тетрагидрофуран, диоксан или диалкиловые простые эфиры, такие как диэтиловый эфир; или нитрилы, такие как ацетонитрил. Когда используется соль цианида металла в присутствии кислоты, предпочтительным растворителем является вода или смесь воды со смешивающимся с водой растворителем. Может быть использовано эквимолярное количество источника цианида или его избыток, обычно применяют от 1 до 4 мольных эквивалентов. Температура реакции обычно составляет от 0 до 100 С. Реакцию предпочтительно проводят при повышенном давлении, которое ускоряет реакцию.
Получение соединений формулы (VI) из соединений формулы (I) может быть проведено в полярном или неполярном растворителе. Примеры полярных растворителей, которые могут быть использованы, включают воду; спирты, такие как метанол или этанол; N,N-диметилформамид; диметилсульфоксид; или алкановые кислоты, такие как уксусная кислота. Примеры неполярных растворителей включают углеводороды, такие как гексан, или простые эфиры, такие как тетрагидрофуран, диоксан или диалкиловые простые эфиры, такие как диэтиловый эфир; или нитрилы, такие как ацетонитрил. Когда используется соль цианида металла в присутствии кислоты, предпочтительным растворителем является вода или смесь воды со смешивающимся с водой растворителем. Может быть использовано эквимолярное количество источника цианида или его избыток, обычно применяют от 1 до 4 мольных эквивалентов. Температура реакции обычно составляет от 0 до 100 С, предпочтительно от 20 до 50 С, предпочтительно от 20 до 50 С.
Наиболее предпочтительным соединением формулы (VI) является 2-(2,6-дихлор-4-трифторметилфенилгидразино)сукцино-нитрил.
Другим предпочтительным соединением формулы (VI) является 2-(2-хлор-4-трифторметилфенилгидразино)сукцино-нитрил.
В соответствии со следующим признаком настоящего изобретения способы (А) и (Г) могут быть объединены для получения соединения формулы (VI) из соединения формулы (III).
В соответствии со следующим признаком настоящего изобретения способы (Б) и (Г) могут быть объединены для получения соединения формулы (VI) из соединения формулы (III).
В соответствии со следующим признаком настоящего изобретения способы (В) и (Г) могут быть объединены для получения соединения формулы (VI) из соединения формулы (V).
В соответствии со следующим признаком настоящего изобретения вышеназванная комбинация способов (В) и (Г) может быть дополнена стадией (Е), которая включает реакцию арилгидразина формулы (III), где R1, R2 и W определены выше; с акрилонитрилом формулы (VII):
NC-CH=CH2 (VII)
с образованием соединения формулы (V), описанным выше.
Соединения формулы (VII) являются известными.
Соединения формулы (I), полученные по способам (А), или (Б), или (В) настоящего изобретения могут быть использованы при получении производных 5-амино-1-арилпиразола формулы (VIII), обладающих пестицидной активностью, в соответствии со следующей схемой 1 реакций: С.
Наиболее предпочтительным соединением формулы (VI) является 2-(2,6-дихлор-4-трифторметилфенилгидразино)сукцино-нитрил.
Другим предпочтительным соединением формулы (VI) является 2-(2-хлор-4-трифторметилфенилгидразино)сукцино-нитрил.
В соответствии со следующим признаком настоящего изобретения способы (А) и (Г) могут быть объединены для получения соединения формулы (VI) из соединения формулы (III).
В соответствии со следующим признаком настоящего изобретения способы (Б) и (Г) могут быть объединены для получения соединения формулы (VI) из соединения формулы (III).
В соответствии со следующим признаком настоящего изобретения способы (В) и (Г) могут быть объединены для получения соединения формулы (VI) из соединения формулы (V).
В соответствии со следующим признаком настоящего изобретения вышеназванная комбинация способов (В) и (Г) может быть дополнена стадией (Е), которая включает реакцию арилгидразина формулы (III), где R1, R2 и W определены выше; с акрилонитрилом формулы (VII):
NC-CH=CH2 (VII)
с образованием соединения формулы (V), описанным выше.
Соединения формулы (VII) являются известными.
Соединения формулы (I), полученные по способам (А), или (Б), или (В) настоящего изобретения могут быть использованы при получении производных 5-амино-1-арилпиразола формулы (VIII), обладающих пестицидной активностью, в соответствии со следующей схемой 1 реакций:
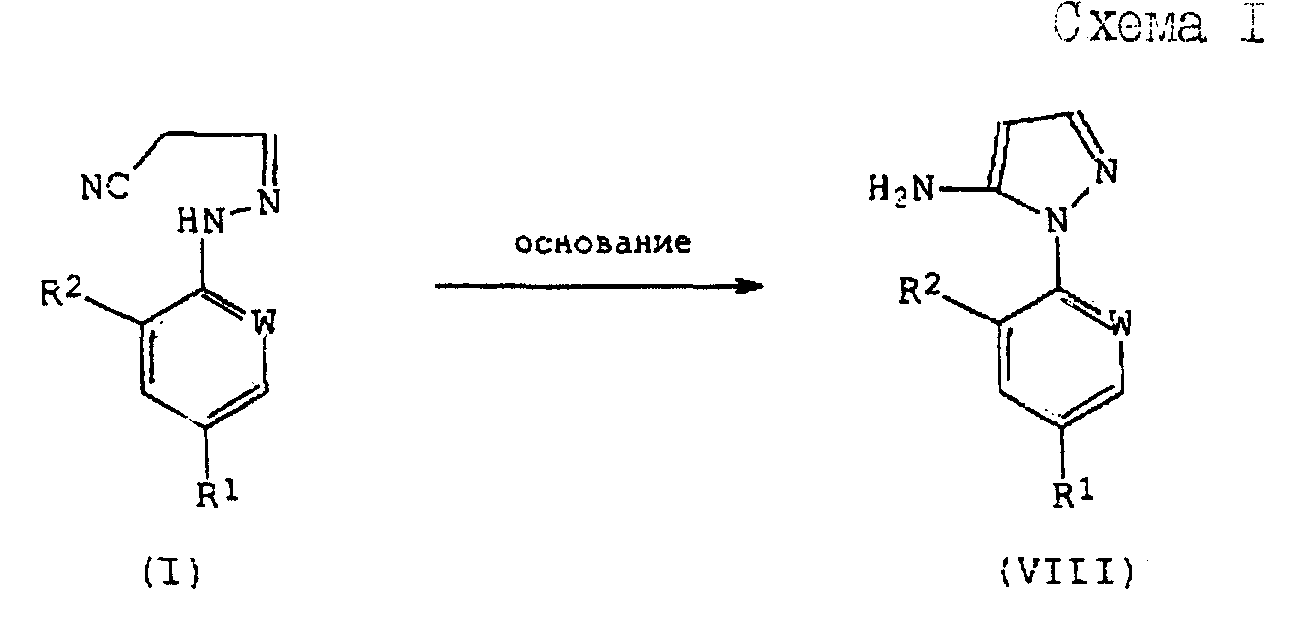 где R1, R2 и W определены выше.
Соединения формулы (VI), полученные по способу (Г) настоящего изобретения, особенно полезны для получения производных 5-амино-1-арил-3-цианопиразола формулы (IX), обладающих пестицидной активностью, и полученных из промежуточных соединений формул (X) и (XI) в соответствии со следующей схемой 2 реакций:
где R1, R2 и W определены выше.
Соединения формулы (VI), полученные по способу (Г) настоящего изобретения, особенно полезны для получения производных 5-амино-1-арил-3-цианопиразола формулы (IX), обладающих пестицидной активностью, и полученных из промежуточных соединений формул (X) и (XI) в соответствии со следующей схемой 2 реакций:
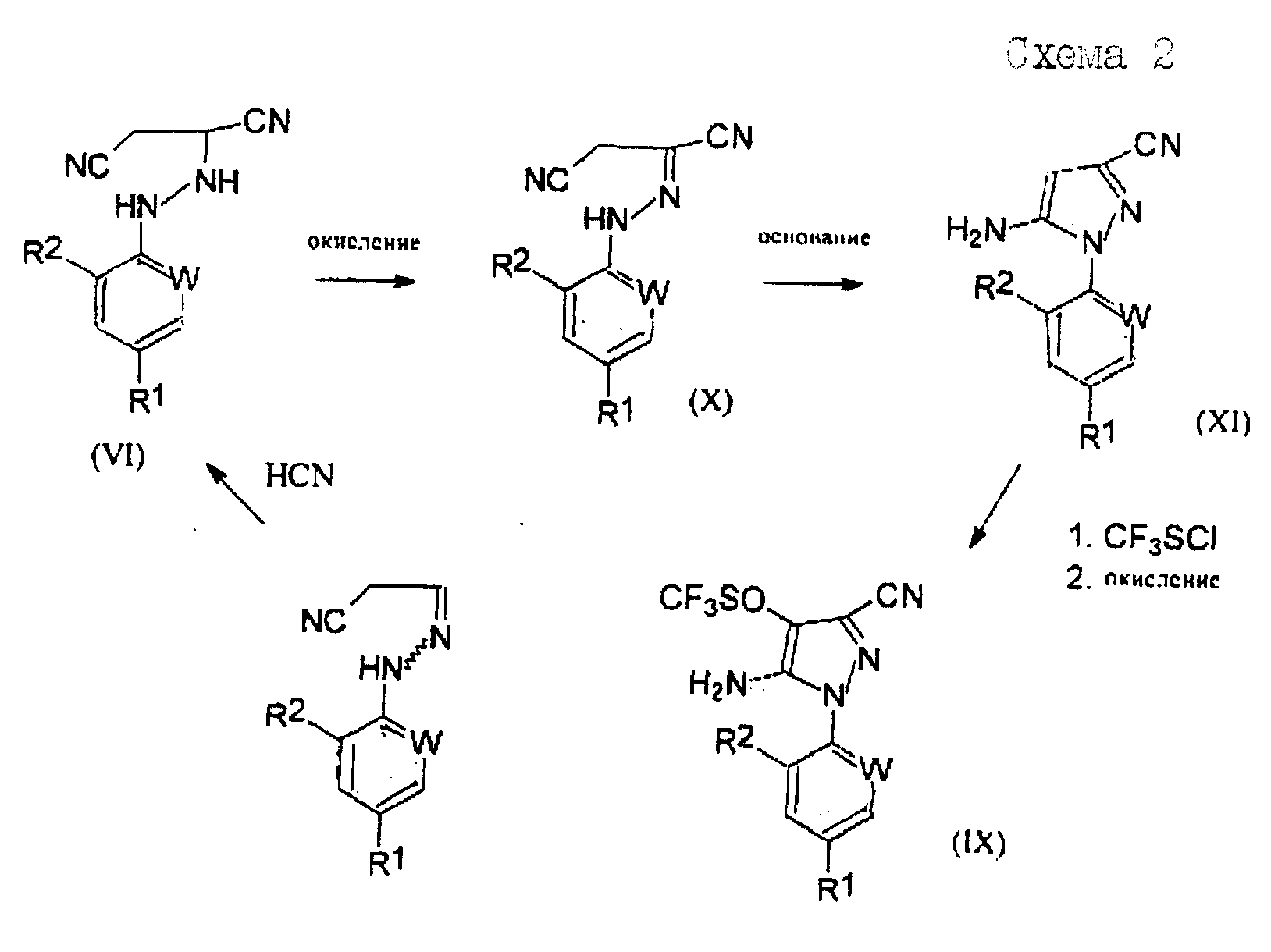 где R1, R2 и W определены выше.
Соединения формулы (X) могут быть получены окислением соединений формулы (VI). Подходящие для реакции окислители включают хиноны, такие как бензохинон, пероксиды, такие как перекись водорода, гипогалогениты, такие как гипохлорит натрия, гидроксиды щелочных металлов, такие как гидроксид натрия в присутствии воздуха, или предпочтительно соли или оксиды металлов, например хлорид меди или оксид ртути. Реакцию обычно проводят в растворителе. Подходящие растворители включают ароматические галогенированные или негалогенированные углеводороды, такие как толуол или хлорбензол, нитрилы, такие как ацетонитрил, или амиды, такие как N,N-диметилформамид. Температура реакции в общем случае находится в пределах от около 20 до около 150
где R1, R2 и W определены выше.
Соединения формулы (X) могут быть получены окислением соединений формулы (VI). Подходящие для реакции окислители включают хиноны, такие как бензохинон, пероксиды, такие как перекись водорода, гипогалогениты, такие как гипохлорит натрия, гидроксиды щелочных металлов, такие как гидроксид натрия в присутствии воздуха, или предпочтительно соли или оксиды металлов, например хлорид меди или оксид ртути. Реакцию обычно проводят в растворителе. Подходящие растворители включают ароматические галогенированные или негалогенированные углеводороды, такие как толуол или хлорбензол, нитрилы, такие как ацетонитрил, или амиды, такие как N,N-диметилформамид. Температура реакции в общем случае находится в пределах от около 20 до около 150 С, предпочтительно от около 50 до около 100 С, предпочтительно от около 50 до около 100 С. Мольное отношение окислителя к соединению формулы (VI) обычно находится в пределах от 0,01:1 до 5:1, преимущественно от 1:1 до 3:1.
Соединения формулы (XI) могут быть получены из соединений формулы (X) по известным методам.
Последующие нелимитирующие примеры иллюстрируют изобретение. Спектры ЯМР регистрировались с использованием в качестве растворителя дейтерохлороформа.
Пример 1
Получение 3- (2, 6-дихлор-4-трифторметилфенилгидразоно)-пропионитрила из 3,3-диметоксипропионитрила
Гидрохлорид 2,6-дихлор-4-трифторметилфенилгидразина получали пропусканием газообразного хлористого водорода через эфирный раствор 2,6-дихлор-4-трифторметилфенилгидразина с фильтрованием гидрохлорида, который получен с количественным выходом. Четыреххлористый углерод (5 мл) и 3,3-диметоксипропионитрил (141 микролитр) последовательно добавляли к раствору упомянутого гидрохлорида 2,6-дихлор-4-трифторметилфенилгидразина (0,349 г) в воде (5 мл), нагревали до 75 С. Мольное отношение окислителя к соединению формулы (VI) обычно находится в пределах от 0,01:1 до 5:1, преимущественно от 1:1 до 3:1.
Соединения формулы (XI) могут быть получены из соединений формулы (X) по известным методам.
Последующие нелимитирующие примеры иллюстрируют изобретение. Спектры ЯМР регистрировались с использованием в качестве растворителя дейтерохлороформа.
Пример 1
Получение 3- (2, 6-дихлор-4-трифторметилфенилгидразоно)-пропионитрила из 3,3-диметоксипропионитрила
Гидрохлорид 2,6-дихлор-4-трифторметилфенилгидразина получали пропусканием газообразного хлористого водорода через эфирный раствор 2,6-дихлор-4-трифторметилфенилгидразина с фильтрованием гидрохлорида, который получен с количественным выходом. Четыреххлористый углерод (5 мл) и 3,3-диметоксипропионитрил (141 микролитр) последовательно добавляли к раствору упомянутого гидрохлорида 2,6-дихлор-4-трифторметилфенилгидразина (0,349 г) в воде (5 мл), нагревали до 75 С в течение 10 часов. Охлажденную смесь экстрагировали (дихлорметан), промывали (вода), сушили (сульфат магния) и упаривали с получением целевого соединения (0,358 г), ЯМР: 3,37 (д.,2Н), 7,03 (т., 1Н), 7,5 (с., 2Н), 7,75 (с., 1Н). Выход составил 98%.
Пример 2
Получение 3-(2,6-дихлор-4-трифторметилфенилгидразоно)-пропионитрила из 3,3-диметоксипропионитрила
Смесь 2,6-дихлор-4-трифторметилфенилгидразина (1,8 г) и соляной кислоты (4 мл 2н. раствора, 1 эквивалент) нагревали до 80 С в течение 10 часов. Охлажденную смесь экстрагировали (дихлорметан), промывали (вода), сушили (сульфат магния) и упаривали с получением целевого соединения (0,358 г), ЯМР: 3,37 (д.,2Н), 7,03 (т., 1Н), 7,5 (с., 2Н), 7,75 (с., 1Н). Выход составил 98%.
Пример 2
Получение 3-(2,6-дихлор-4-трифторметилфенилгидразоно)-пропионитрила из 3,3-диметоксипропионитрила
Смесь 2,6-дихлор-4-трифторметилфенилгидразина (1,8 г) и соляной кислоты (4 мл 2н. раствора, 1 эквивалент) нагревали до 80 С в инертной атмосфере. 3,3-Диметоксипропионитрил (912 микролитров, 1 эквивалент) добавляли одной порцией, смесь нагревали до 80 С в инертной атмосфере. 3,3-Диметоксипропионитрил (912 микролитров, 1 эквивалент) добавляли одной порцией, смесь нагревали до 80 С в течение 2 часов, охлаждали, экстрагировали (дихлорметан), промывали (вода), сушили (сульфат магния) и упаривали. Остаток очищали хроматографически на силикагеле элюированием дихлорметаном с получением целевого соединения (1,4 г), ЯМР: 3,37 (д., 2Н), 7,03 (т., 1Н), 7,5 (с., 2Н), 7,75 (с., 1Н). Выход составил 59%.
Пример 3
Получение 3-(2,6-дихлор-4-трифторметилфенилгидразоно)-пропионитрила из 3-метоксиакрилонитрила
Целевое соединение было получено по методу, соответствующему Примеру 1, но с заменой 3,3-диметоксипропионитрила на 3-метоксиакрилонитрил, с последующей хроматографической очисткой на силикагеле при элюировании дихлорметаном, ЯМР: 3,37 (д., 2Н), 7,03 (т., 1Н), 7,5 (с., 2Н), 7,75 (с., 1Н). Выход составил 63%.
Пример 4
Получение 2-(2,6-дихлор-4-трифторметилфенилгидразино)-сукцинонитрила
2-(2,6-Дихлор-4-трифторметилфенилгидразоно)сукцино-нитрил (0,296 г, 1 ммоль), цианид натрия (0,196 г, 4 эквивалента), воду (1 мл) и уксусную кислоту (5 мл) последовательно добавляли в герметизированную пробирку. После проведения реакции в течение 40 часов при 20 С в течение 2 часов, охлаждали, экстрагировали (дихлорметан), промывали (вода), сушили (сульфат магния) и упаривали. Остаток очищали хроматографически на силикагеле элюированием дихлорметаном с получением целевого соединения (1,4 г), ЯМР: 3,37 (д., 2Н), 7,03 (т., 1Н), 7,5 (с., 2Н), 7,75 (с., 1Н). Выход составил 59%.
Пример 3
Получение 3-(2,6-дихлор-4-трифторметилфенилгидразоно)-пропионитрила из 3-метоксиакрилонитрила
Целевое соединение было получено по методу, соответствующему Примеру 1, но с заменой 3,3-диметоксипропионитрила на 3-метоксиакрилонитрил, с последующей хроматографической очисткой на силикагеле при элюировании дихлорметаном, ЯМР: 3,37 (д., 2Н), 7,03 (т., 1Н), 7,5 (с., 2Н), 7,75 (с., 1Н). Выход составил 63%.
Пример 4
Получение 2-(2,6-дихлор-4-трифторметилфенилгидразино)-сукцинонитрила
2-(2,6-Дихлор-4-трифторметилфенилгидразоно)сукцино-нитрил (0,296 г, 1 ммоль), цианид натрия (0,196 г, 4 эквивалента), воду (1 мл) и уксусную кислоту (5 мл) последовательно добавляли в герметизированную пробирку. После проведения реакции в течение 40 часов при 20 С смесь добавляли к насыщенному раствору бикарбоната натрия, экстрагировали (дихлорметан), промывали (вода), сушили (сульфат магния) и упаривали до получения смеси, содержащей 40% целевого соединения, ЯМР: 3,1 (м., 2Н), 4,5 (м., 1Н), 5,89 (м., 1Н), 6,94 (д., 1Н), 7,71 (с., 2Н), и 60% не прореагировавшего исходного гидразона.
Пример 5
Получение 3-(2,6-дихлор-4-трифторметилфенилгидразоно)-пропионитрила из 3-(2,6-дихлор-4-трифторметилфенилгидразино)-пропионитрила
Хлорид меди (II) (0,673 г, 2,5 эквивалентов) добавляли одной порцией к раствору 3-(2,6-дихлор-4-трифторметилфенилгидразино)-пропионитрила (0,591 г, 2 ммоль) в хлорбензоле, и смесь нагревали при 65 С смесь добавляли к насыщенному раствору бикарбоната натрия, экстрагировали (дихлорметан), промывали (вода), сушили (сульфат магния) и упаривали до получения смеси, содержащей 40% целевого соединения, ЯМР: 3,1 (м., 2Н), 4,5 (м., 1Н), 5,89 (м., 1Н), 6,94 (д., 1Н), 7,71 (с., 2Н), и 60% не прореагировавшего исходного гидразона.
Пример 5
Получение 3-(2,6-дихлор-4-трифторметилфенилгидразоно)-пропионитрила из 3-(2,6-дихлор-4-трифторметилфенилгидразино)-пропионитрила
Хлорид меди (II) (0,673 г, 2,5 эквивалентов) добавляли одной порцией к раствору 3-(2,6-дихлор-4-трифторметилфенилгидразино)-пропионитрила (0,591 г, 2 ммоль) в хлорбензоле, и смесь нагревали при 65 С в течение 50 минут. Когда приходили к выводу, что реакция завершилась, смесь охлаждали, промывали (вода), сушили (сульфат магния), упаривали и разделяли хроматографией на силикагеле с получением 3-(2,6-дихлор-4-трифторметилфенилгидразоно)-пропионитрила, ЯМР: 3,37 (д., 2Н), 7,03 (т., 1Н), 7,5 (с., 2Н), 7,75 (с., 1Н) (выход 35%), и 3-(2,6-дихлор-4-трифторметилфенилазо)пропионитрила, ЯМР: 3,0 (т., 2Н), 4,6 (т., 2Н), 7,6 (с., 2Н) (выход 60%).
Пример 6
Получение 2-(2,6-дихлор-4-трифторметилфенилгидразино)-сукцинонитрила
2-(2,6-Дихлор-4-трифторметилфенилгидразоно)сукцинонитрил (0,296 г, 1 ммоль), цианид натрия (0,196 г, 4 эквивалента), вода (1 мл) и уксусная кислота (5 мл) последовательно добавляли в пробирку, которую герметизировали и выдерживали при 20 С в течение 50 минут. Когда приходили к выводу, что реакция завершилась, смесь охлаждали, промывали (вода), сушили (сульфат магния), упаривали и разделяли хроматографией на силикагеле с получением 3-(2,6-дихлор-4-трифторметилфенилгидразоно)-пропионитрила, ЯМР: 3,37 (д., 2Н), 7,03 (т., 1Н), 7,5 (с., 2Н), 7,75 (с., 1Н) (выход 35%), и 3-(2,6-дихлор-4-трифторметилфенилазо)пропионитрила, ЯМР: 3,0 (т., 2Н), 4,6 (т., 2Н), 7,6 (с., 2Н) (выход 60%).
Пример 6
Получение 2-(2,6-дихлор-4-трифторметилфенилгидразино)-сукцинонитрила
2-(2,6-Дихлор-4-трифторметилфенилгидразоно)сукцинонитрил (0,296 г, 1 ммоль), цианид натрия (0,196 г, 4 эквивалента), вода (1 мл) и уксусная кислота (5 мл) последовательно добавляли в пробирку, которую герметизировали и выдерживали при 20 С в течение 40 часов. Смесь добавляли к насыщенному раствору бикарбоната натрия, экстрагировали (дихлорметан), промывали (вода), сушили (сульфат магния) и упаривали с образованием смеси, содержащей 40% целевого соединения, ЯМР: 3,1 (м., 2Н), 4,5 (м., 1Н), 5,89 (м., 1Н), 6,94 (д., 1Н), 7,71 (с., 2Н) вместе с 60% непрореагировавшего исходного гидразона.
Сравнительный Пример 7
1) Получение 2-(2,6-дихлор-4-трифторметилфенилгидразоно)-сукцинонифрила
Смесь 2-(2,6-дихлор-4-трифторметилфенилгидразино)-сукцинонитрила (0,323 г) и хлорида меди (2) (0,175 г) нагревали в хлорбензоле при 60 С в течение 40 часов. Смесь добавляли к насыщенному раствору бикарбоната натрия, экстрагировали (дихлорметан), промывали (вода), сушили (сульфат магния) и упаривали с образованием смеси, содержащей 40% целевого соединения, ЯМР: 3,1 (м., 2Н), 4,5 (м., 1Н), 5,89 (м., 1Н), 6,94 (д., 1Н), 7,71 (с., 2Н) вместе с 60% непрореагировавшего исходного гидразона.
Сравнительный Пример 7
1) Получение 2-(2,6-дихлор-4-трифторметилфенилгидразоно)-сукцинонифрила
Смесь 2-(2,6-дихлор-4-трифторметилфенилгидразино)-сукцинонитрила (0,323 г) и хлорида меди (2) (0,175 г) нагревали в хлорбензоле при 60 С в течение 6 часов. После фильтрования и упаривания целевое соединение и 5-амино-3-циано-1-(2,6-дихлор-4-трифторметилфенил)пиразол были получены в виде смеси 7:1. С помощью колоночной хроматографии на силикагеле при элюировании дихлорметаном получали чистое целевое соединение в виде смеси син- и антиизомеров, ЯМР (анти-изомер): 3,6 (с., 2Н), 7,57 (с., 2Н), 8,82 (с., 1Н, обменивается с D2O); ЯМР (син-изомер): 3,56 (с., 2Н), 7,59 (с., 2Н), 8,27 (с., 1Н, обменивается с D2О).
2) Получение 5-амино-3-циано-1-(2,6-дихлор-4-трифторметилфенил)пиразола
Аммиак (20 микролитров 8% водного раствора аммиака) добавляли к смеси вышеупомянутого 2-(2,6-дихлор-4-трифторметилфенилгидразоно)сукцинонитрила (0,077 г) в этаноле (1 мл) и воде (0,2 мл) при 0 С в течение 6 часов. После фильтрования и упаривания целевое соединение и 5-амино-3-циано-1-(2,6-дихлор-4-трифторметилфенил)пиразол были получены в виде смеси 7:1. С помощью колоночной хроматографии на силикагеле при элюировании дихлорметаном получали чистое целевое соединение в виде смеси син- и антиизомеров, ЯМР (анти-изомер): 3,6 (с., 2Н), 7,57 (с., 2Н), 8,82 (с., 1Н, обменивается с D2O); ЯМР (син-изомер): 3,56 (с., 2Н), 7,59 (с., 2Н), 8,27 (с., 1Н, обменивается с D2О).
2) Получение 5-амино-3-циано-1-(2,6-дихлор-4-трифторметилфенил)пиразола
Аммиак (20 микролитров 8% водного раствора аммиака) добавляли к смеси вышеупомянутого 2-(2,6-дихлор-4-трифторметилфенилгидразоно)сукцинонитрила (0,077 г) в этаноле (1 мл) и воде (0,2 мл) при 0 С. Через 10 минут смесь экстрагировали (дихлорметан) и упаривали с образованием 5-амино-3-циано-1-(2,6-дихлор-4-трифторметил-фенил)пиразола (0,076 г, выход 97%). Чистота 98% (данные ВЭЖХ). С. Через 10 минут смесь экстрагировали (дихлорметан) и упаривали с образованием 5-амино-3-циано-1-(2,6-дихлор-4-трифторметил-фенил)пиразола (0,076 г, выход 97%). Чистота 98% (данные ВЭЖХ).
Формула изобретения 1. Способ получения соединения формулы (I) 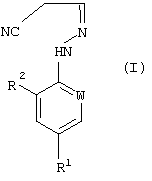 где W представляет собой азот или –CR3;
R1 представляет собой галоген, галогеноалкил, предпочтительно трифторметил, галогеноалкокси, предпочтительно трифторметокси, R4S(O)n-, или -SF5;
R2 представляет собой водород или галоген, например хлор или бром;
R3 представляет собой галоген, например хлор или бром;
R4 представляет собой алкил или галогеноалкил; и
n равняется 0, 1 или 2;
который включает реакцию кислотно-аддитивной соли арилгидразина формулы (III)
где W представляет собой азот или –CR3;
R1 представляет собой галоген, галогеноалкил, предпочтительно трифторметил, галогеноалкокси, предпочтительно трифторметокси, R4S(O)n-, или -SF5;
R2 представляет собой водород или галоген, например хлор или бром;
R3 представляет собой галоген, например хлор или бром;
R4 представляет собой алкил или галогеноалкил; и
n равняется 0, 1 или 2;
который включает реакцию кислотно-аддитивной соли арилгидразина формулы (III)
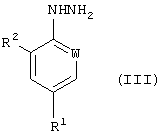 где R1, R2 и W определены, как указано выше:
(А) с соединением формулы (II):
где R1, R2 и W определены, как указано выше:
(А) с соединением формулы (II):
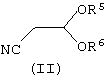 где R5 и R6 независимо представляют собой алкил или вместе представляют собой алкиленовую цепь, содержащую два или три атома углерода, или
(Б) с соединением формулы (IV):
где R5 и R6 независимо представляют собой алкил или вместе представляют собой алкиленовую цепь, содержащую два или три атома углерода, или
(Б) с соединением формулы (IV):
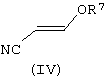 где R7 представляет собой алкил, предпочтительно метил или этил.
2. Способ по п.1(А), отличающийся тем, что R5 и R6, каждый независимо, представляют собой метил или этил.
3. Способ по п.1(А) или 1(Б), отличающийся тем, что кислотно-аддитивные соли соединений формулы (III) являются солями, образованными сильными кислотами.
4. Способ по любому из пп.1-3, отличающийся тем, что получение соединения формулы (I) осуществляется в присутствии воды.
5. Способ получения соединения формулы (I)
где R7 представляет собой алкил, предпочтительно метил или этил.
2. Способ по п.1(А), отличающийся тем, что R5 и R6, каждый независимо, представляют собой метил или этил.
3. Способ по п.1(А) или 1(Б), отличающийся тем, что кислотно-аддитивные соли соединений формулы (III) являются солями, образованными сильными кислотами.
4. Способ по любому из пп.1-3, отличающийся тем, что получение соединения формулы (I) осуществляется в присутствии воды.
5. Способ получения соединения формулы (I)
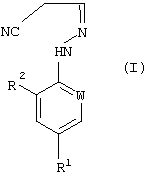 где W представляет собой азот или –CR3;
R1 представляет собой галоген, галогеноалкил, предпочтительно трифторметил, галогеноалкокси, предпочтительно трифторметокси, R4S(O)n-, или -SF5;
R2 представляет собой водород или галоген, например хлор или бром;
R3 представляет собой галоген, например хлор или бром;
R4 представляет собой алкил или галогеноалкил; и
n равняется 0, 1 или 2;
который включает окисление соединения формулы (V)
где W представляет собой азот или –CR3;
R1 представляет собой галоген, галогеноалкил, предпочтительно трифторметил, галогеноалкокси, предпочтительно трифторметокси, R4S(O)n-, или -SF5;
R2 представляет собой водород или галоген, например хлор или бром;
R3 представляет собой галоген, например хлор или бром;
R4 представляет собой алкил или галогеноалкил; и
n равняется 0, 1 или 2;
который включает окисление соединения формулы (V)
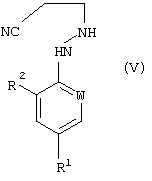 где R1, R2 и W определены, как указано выше.
6. Способ по п.5, отличающийся тем, что окислитель является солью или оксидом металла.
7. Способ по п.5 или 6, отличающийся тем, что его проводят в растворителе.
8. Способ по любому из пп.5, 6 или 7, отличающийся тем, что мольное отношение окислителя к соединению формулы (V) составляет от 0,01:1 до 5:1, предпочтительно от 1:1 до 3:1.
9. Способ получения соединения формулы (VI)
где R1, R2 и W определены, как указано выше.
6. Способ по п.5, отличающийся тем, что окислитель является солью или оксидом металла.
7. Способ по п.5 или 6, отличающийся тем, что его проводят в растворителе.
8. Способ по любому из пп.5, 6 или 7, отличающийся тем, что мольное отношение окислителя к соединению формулы (V) составляет от 0,01:1 до 5:1, предпочтительно от 1:1 до 3:1.
9. Способ получения соединения формулы (VI)
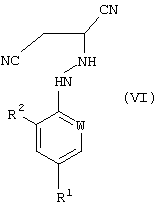 где R1, R2 и W определены, как указано в п.1, который включает реакцию соединения формулы (I), полученного способом по п. 1, где R1, R2 и W определены, как указано в п.1, с источником цианистого водорода.
10. Способ по п.9, отличающийся тем, что цианистый водород получают из цианида металла в присутствии кислоты.
11. Способ по п.9 или 10, отличающийся тем, что его
проводят при повышенном давлении.
12. Способ получения соединения формулы (VI)
где R1, R2 и W определены, как указано в п.1, который включает реакцию соединения формулы (I), полученного способом по п. 1, где R1, R2 и W определены, как указано в п.1, с источником цианистого водорода.
10. Способ по п.9, отличающийся тем, что цианистый водород получают из цианида металла в присутствии кислоты.
11. Способ по п.9 или 10, отличающийся тем, что его
проводят при повышенном давлении.
12. Способ получения соединения формулы (VI)
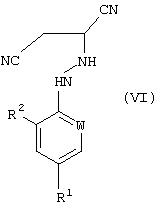 где R1, R2 и W определены, как указано в п.1, который включает реакцию соединения формулы (I), полученного способом по п.5, где R1, R2 и W определены, как указано в п.1, с источником цианистого водорода.
13. Способ по п.12, отличающийся тем, что цианистый водород получают из цианида металла в присутствии кислоты.
14. Способ по п.12 или 13, отличающийся тем, что его
проводят при повышенном давлении.
15. Способ получения соединения формулы (XI)
где R1, R2 и W определены, как указано в п.1, который включает реакцию соединения формулы (I), полученного способом по п.5, где R1, R2 и W определены, как указано в п.1, с источником цианистого водорода.
13. Способ по п.12, отличающийся тем, что цианистый водород получают из цианида металла в присутствии кислоты.
14. Способ по п.12 или 13, отличающийся тем, что его
проводят при повышенном давлении.
15. Способ получения соединения формулы (XI)
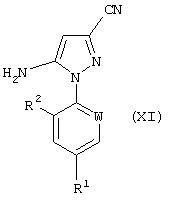 где W, R1 и R2 определены, как указано в п.1, отличающийся тем, что соединение формулы (VI), полученное способом по п.8 или 12, подвергают окислению с получением соединения формулы (X)
где W, R1 и R2 определены, как указано в п.1, отличающийся тем, что соединение формулы (VI), полученное способом по п.8 или 12, подвергают окислению с получением соединения формулы (X)
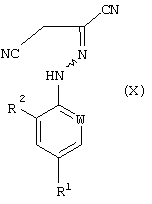 где W, R1 и R2 определены, как указано в п.1,
с последующей реакцией полученного соединения с основанием.
16. Способ по любому из пп.5-8 или 12, отличающийся тем, что используют соединение формулы (V), полученное реакцией соединения формулы (III), где R1, R2 и W определены, как указано в п.1, с акрилонитрилом формулы (VII)
NC-CH=CH2 (VII).
17. Способ по любому из предшествующих пунктов, отличающийся тем, что R1 представляет собой галогеноалкил, предпочтительно трифторметил, галогеноалкокси, предпочтительно трифторметокси, или -SF5; W представляет собой -CR3; и R3 представляет собой галоген.
18. Способ по любому из предшествующих пунктов, отличающийся тем, что R1 представляет собой трифторметил, W представляет собой -CR3; и R2 и R3 представляют собой хлор.
где W, R1 и R2 определены, как указано в п.1,
с последующей реакцией полученного соединения с основанием.
16. Способ по любому из пп.5-8 или 12, отличающийся тем, что используют соединение формулы (V), полученное реакцией соединения формулы (III), где R1, R2 и W определены, как указано в п.1, с акрилонитрилом формулы (VII)
NC-CH=CH2 (VII).
17. Способ по любому из предшествующих пунктов, отличающийся тем, что R1 представляет собой галогеноалкил, предпочтительно трифторметил, галогеноалкокси, предпочтительно трифторметокси, или -SF5; W представляет собой -CR3; и R3 представляет собой галоген.
18. Способ по любому из предшествующих пунктов, отличающийся тем, что R1 представляет собой трифторметил, W представляет собой -CR3; и R2 и R3 представляют собой хлор.
|
||||||||||||||||||||||||||
