Патент на изобретение №2222003
|
||||||||||||||||||||||||||
(54) СПОСОБ БИОТЕСТИРОВАНИЯ ПРИРОДНЫХ, СТОЧНЫХ ВОД И ВОДНЫХ РАСТВОРОВ
(57) Реферат: Изобретение относится к способам биотестирования. В способе биотестирования, включающем измерение интенсивности замедленной флуоресценции тест-организма в индукционных максимумах после включения возбуждающего света высокой, а потом низкой интенсивности, в качестве показателя фитотоксичности используют отношение измеренных величин, пронормированных к аналогичным величинам, измеренным на контрольных образцах, не содержащих токсичных веществ. Перед измерением замедленной флуоресценции контрольные и опытные пробы тест-организма в течение 2 ч облучают светом интенсивностью 60 Вт/м2. Техническим результатом данного изобретения является повышение чувствительности и расширение круга выявляемых токсических соединений при биотестировании воды. 3 табл. Изобретение относится к методам выявления токсических соединений и водных растворах. Оно может быть использовано для биотестирования токсичности природных, сточных вод и водных растворов с использованием таких тест-организмов, как микроводоросли и водные растения. Известен способ определения фитотоксичности препаратов, основанный на регистрации изменения интенсивности миллисекундного фотоиндуцируемого послесвечения (замедленной флуоресценции) хлоропластов или клеток хлореллы под действием химических соединений [1]. Недостатком данного способа является невысокая точность измерения содержания этих веществ в анализируемых пробах, поскольку интенсивность регистрируемой замедленной флуоресценции (ЗФ) зависит не только от величины токсического действия пробы, но и от мутности и цветности анализируемого раствора, а также от количества тест-организма. Наиболее близким к изобретению является способ измерения пенсии фнтотоксичности химических соединений и определения их содержания и анализируемых растворах путем регистрации амплитуды индукционного максимума ЗФ водоросли хлореллы в миллисекундном интервале затухания при возбуждении светом сначала высокой, а затем низкой интенсивностью. В качестве показателя фитотоксичности используют отношение регистрируемых величин ЗФ в указанных условиях, пронормированных к контрольной пробе водоросли, не содержащей токсиканта [2] . Недостатком данного способа является невозможность обнаружения токсических веществ, не оказывающих прямого воздействия на первичные реакции фотосинтеза. Результатом данного изобретения является повышение чувствительности и расширение круга выявляемых токсических соединений при биотестировании воды. Указанный результат достигается тем, что в способе биотестирования природных, сточных вод и водных растворов, включающем измерение интенсивности замедленной флуоресценции тест-организма в индукционных максимумах после включения возбуждающего света высокой, а потом низкой интенсивности, при этом в качестве показателя фитотоксичности используют отношение этих величин, пронормированных к аналогичным величинам, измеренным на контрольных образцах, не содержащих токсичных веществ, согласно изобретению перед измерением замедленной флуоресценции контрольные и опытные пробы тест-организма в течение 2 часов облучают светом интенсивностью 60 Вт/м. В таблице 1 представлена зависимость токсического эффект раствора сульфата меди от времени предварительной экспонирования тест-культуры водоросли хлорелла в темноте и на свету. Коэффициент токсичности определяется по формуле 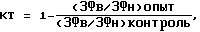 где (ЗФв/ЗФн)опыт – отношение интенсивностей ЗФ суспензии водоросли в среде с токсикантом, возбуждаемой светом высокой (80 Вт/м2) и низкой (7 Вт/м2) интенсивности; (ЗФв/ЗФн)контроль – то же отношение для проб тест-культуры, не содержащей токсикант. Представленные данные показывают, что даже после одного часа экспонирования на свету токсичность тяжелого металла (ионов меди) существенно возрастает. Эффект усиливается при увеличении времени засветки проб тест-организма. В свою очередь, удлинение периода контакта токсиканта с клетками водоросли хлорелла при их содержании в темноте не сопровождается сколь-нибудь существенным возрастанием степени его воздействия на тест-организм. Увеличение чувствительности метода достигается благодаря тому, что облучение контрольных и опытных проб тест-организма достаточно интенсивным светом запускает процесс фотоингибирования фотосинтетическою аппарата. Поскольку данное явление имеет место и в естественной среде обитания растений, то для защиты от повреждения фотоассимиляционного аппарата растительными организмами выработан особый защитный механизм. Он состоит в том, что одновременно на свету начинают работать метаболические процессы, восстанавливающие нарушенные молекулярные структуры реакционных центров фотосинтетического пигментного аппарата. В нормальных условиях оба эти процесса практически полностью компенсируют друг друга, однако в присутствии ряда ксенобиотиков, блокирующих процессы репарации, последствия фотоингибирования будут выражены значительно сильнее [3]. К числу вредных для растительного тест-организма чужеродных соединений относятся и такие широко распространенные загрязнители, как ионы тяжелых металлов. При этом, подавляя рост водорослей, они оказывают лишь незначительное прямое воздействие на первичные фотосинтетические реакции, тестируемые через регистрацию замедленной флуоресценции хлорофилла. На интенсивном свету токсическое действие этих веществ на фотосинтез проявляется существенно больше за счет подавления ими многостадийных процессов ресинтеза фотоповрежденных биомолекул. В результате, как следует из таблицы 1, чувствительность биотеста на основе регистрации ЗФ водорослей и водных растений в оценки токсичности воды значительно повышается. При увеличении времени засветки показатели токсичности тестируемой пробы возрастают, однако при этом снижается оперативность самого биотеста. Простое выдерживание проб с токсикантом в темноте не сопровождается каким-либо заметным повышением чувствительности к нему тест-организма. Пример 1. В несколько флаконов вносят по 6 мл раствора хлорида кадмия в концентрации 0,2 мг/л (в расчете на ион Cd) и по 1 мл суспензии хлорелла оптической плотности 0,6 при длине волны 660 нм и толщине слоя 1 см. Часть флаконов устанавливают в устройство для выращивания микроводорослей [4], обеспечивающего одинаковые световые условия для всех проб тест-организма, где подвергают двухчасовому облучению светом интенсивностью 60 Вт/м2. Вторая часть проб экспонируется в течение того же времени в темноте. Аналогичный эксперимент проводят с зеленой водорослью селенаструм, а также с водным растением ряска. Последняя вносится во флаконы с тестируемыми растворами по три растения в каждый. После экспозиции 4 мл содержимого каждого флакона вносят в кюветы прибора для измерения интенсивности замедленной флуоресценции на высоком и низком возбуждающем свету [2] . После вычисления отношения ЗФв к ЗФн рассчитывают коэффициент токсичности КТ. Результаты экспериментов, представленные в таблице 2, показывают, что токсичность раствора данного тяжелого металла, определяемая методом регистрации ЗФ, существенно выше для проб тест-организмов, подвергнутых предварительной световой засветке. Пример 2. В несколько флаконов вносят по 6 мл проб воды, взятых на входе (до очистки) и выходе (после очистки) правобережных очистных сооружениях г. Красноярска, а также из русла р.Енисей. К пробам добавляют по 1 мл суспензии водоросли хлорелла оптической плотности 0,6. Часть флаконов, аналогично примеру 1, подвергают двухчасовому облучению светом интенсивностью 60 Вт/м2, а вторую часть проб экспонируют в темноте. После экспозиции проводят измерение интенсивности ЗФ и расчет КТ, как описано в примере 1. Результаты экспериментов, представленные в таблице 3, показывают, что токсический эффект проб природной и сточной воды заметно выше по отношению к клеткам водоросли, на которые предварительно воздействовали интенсивным светом. Представленные данные свидетельствуют о том, что предлагаемый способ позволяет повысить чувствительность метода биотестирования воды, а также расширить круг выявляемых токсичных соединений. Источники информации 1. А.с. СССР 492805, G 01 N 33/00, 1975. Бюл. 13. 2. Патент на изобретение РФ 2069851, G 01 N 21/64, 1992. Бюл. 33 от 27.11.96 г. (прототип). 4. Патент на изобретение РФ 2165973, С 12 М 3/00, 1999. Бюл. 10 от 10.04.01 г. Формула изобретения Способ биотестирования природных, сточных вод и водных растворов, включающий измерение интенсивности замедленной флуоресценции тест-организма в индукционных максимумах после включения возбуждающего света высокой, а потом низкой интенсивности, при этом в качестве показателя фитотоксичности используют отношение измеренных величин, пронормированных к аналогичным величинам, измеренным на контрольных образцах, не содержащих токсичных веществ, отличающийся тем, что перед измерением замедленной флуоресценции контрольные и опытные пробы тест-организма в течение 2 ч облучают светом интенсивностью 60 Вт/м2. РИСУНКИ
|
||||||||||||||||||||||||||
