Патент на изобретение №2220727
|
||||||||||||||||||||||||||
(54) КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ДЕГИДРОЭПИАНДРОСТЕРОН, И СПОСОБЫ ЕЕ ИЗГОТОВЛЕНИЯ И ПРИМЕНЕНИЯ
(57) Реферат: Изобретение относится к фармацевтике и касается усовершенствованных фармацевтических препаратов, содержащих дегидроэпиандростерон (ДГЭА), обогащенный до полиморфных форм I или II, для терапевтических целей. Препарат может содержать ДГЭА в твердой форме, по крайней мере 85% которого присутствует в виде единого полиморфа, выбираемого из полиморфной формы I или II, и по крайней мере один фармацевтический наполнитель и обладает более стойким биоаккумулированием. 6 с. и 28 з.п. ф-лы, 4 ил., 10 табл. Текст описания в факсимильном виде (см. графическую часть)я Формула изобретения 1. Фармацевтический препарат, содержащий по крайней мере один фармацевтический наполнитель и дегидроэпиандростерон (ДГЭА), по крайней мере 85% которого присутствует в полиморфной форме, характеризуемой специфическими резонансными пиками твердотельного ядерного магнитного резонанса по углероду-13, наблюдаемыми для чистого образца, при 14,1 и 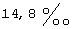 для атома углерода в позиции 18 и 118,9 и для атома углерода в позиции 18 и 118,9 и 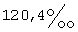 для атома углерода в позиции 6 по отношению к резонансному пику при для атома углерода в позиции 6 по отношению к резонансному пику при 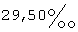 группы СН адамантана как внешнего контрольного образца.
2. Препарат по п.1, в котором по крайней мере 90% указанного дегидроэпиандростерона (ДГЭА) присутствует в указанной полиморфной форме.
3. Препарат по п.1, в котором по крайней мере 95% указанного дегидроэпиандростерона (ДГЭА) присутствует в указанной полиморфной форме.
4. Препарат по п.1, в котором по крайней мере 99% указанного дегидроэпиандростерона (ДГЭА) присутствует в указанной полиморфной форме.
5. Способ приготовления препарата ДГЭА в твердой форме, который включает смешивание по крайней мере одного фармацевтического наполнителя в твердой форме с дегидроэпиандростероном (ДГЭА), по крайней мере 85% которого присутствует в полиморфной форме по п.1.
6. Способ по п.5, в котором по крайней мере 90% указанного дегидроэпиандростерона (ДГЭА) присутствует в полиморфной форме по п.1.
7. Способ по п.5, в котором по крайней мере 95% указанного дегидроэпиандростерона (ДГЭА) присутствует в полиморфной форме по п.1.
8. Способ по п.5, в котором по крайней мере 99% указанного дегидроэпиандростерона (ДГЭА) присутствует в полиморфной форме по п.1.
9. Способ по п.5, который, кроме того, включает этап помещения препарата в твердой форме в капсульный контейнер, пригодный для доставки препарата в желудочно-кишечный тракт.
10. Способ по п.5, который, кроме того, включает этап прессования препарата в твердой форме для образования таблетки.
11. Способ назначения пациенту фармацевтического препарата, содержащего дегидроэпиандростерон (ДГЭА), включающий назначение фармацевтически приемлемого количества ДГЭА, в котором по крайней мере 85% ДГЭА присутствует в полиморфной форме по п.1.
12. Способ по п.11, в котором по крайней мере 90% ДГЭА присутствует в полиморфной форме по п.1.
13. Способ по п.11, в котором по крайней мере 95% ДГЭА присутствует в полиморфной форме по п.1.
14. Способ по п.11, в котором по крайней мере 99% ДГЭА присутствует в полиморфной форме по п.1.
15. Способ по п.11, в котором фармацевтический препарат назначают для лечения системной красной волчанки.
16. Способ по п.11, в котором фармацевтический препарат назначают для предотвращения или снижения потери плотности костей.
17. Способ по п.11, в котором фармацевтический препарат назначают для лечения хронического синдрома усталости или фибромиалгии.
18. Фармацевтический препарат, содержащий по крайней мере один фармацевтический наполнитель и дегидроэпиандростерон (ДГЭА), по крайней мере 85% которого присутствует в полиморфной форме, характеризуемой специфическими резонансными пиками твердотельного ядерного магнитного резонанса по углероду-13, наблюдаемыми для чистого образца, при группы СН адамантана как внешнего контрольного образца.
2. Препарат по п.1, в котором по крайней мере 90% указанного дегидроэпиандростерона (ДГЭА) присутствует в указанной полиморфной форме.
3. Препарат по п.1, в котором по крайней мере 95% указанного дегидроэпиандростерона (ДГЭА) присутствует в указанной полиморфной форме.
4. Препарат по п.1, в котором по крайней мере 99% указанного дегидроэпиандростерона (ДГЭА) присутствует в указанной полиморфной форме.
5. Способ приготовления препарата ДГЭА в твердой форме, который включает смешивание по крайней мере одного фармацевтического наполнителя в твердой форме с дегидроэпиандростероном (ДГЭА), по крайней мере 85% которого присутствует в полиморфной форме по п.1.
6. Способ по п.5, в котором по крайней мере 90% указанного дегидроэпиандростерона (ДГЭА) присутствует в полиморфной форме по п.1.
7. Способ по п.5, в котором по крайней мере 95% указанного дегидроэпиандростерона (ДГЭА) присутствует в полиморфной форме по п.1.
8. Способ по п.5, в котором по крайней мере 99% указанного дегидроэпиандростерона (ДГЭА) присутствует в полиморфной форме по п.1.
9. Способ по п.5, который, кроме того, включает этап помещения препарата в твердой форме в капсульный контейнер, пригодный для доставки препарата в желудочно-кишечный тракт.
10. Способ по п.5, который, кроме того, включает этап прессования препарата в твердой форме для образования таблетки.
11. Способ назначения пациенту фармацевтического препарата, содержащего дегидроэпиандростерон (ДГЭА), включающий назначение фармацевтически приемлемого количества ДГЭА, в котором по крайней мере 85% ДГЭА присутствует в полиморфной форме по п.1.
12. Способ по п.11, в котором по крайней мере 90% ДГЭА присутствует в полиморфной форме по п.1.
13. Способ по п.11, в котором по крайней мере 95% ДГЭА присутствует в полиморфной форме по п.1.
14. Способ по п.11, в котором по крайней мере 99% ДГЭА присутствует в полиморфной форме по п.1.
15. Способ по п.11, в котором фармацевтический препарат назначают для лечения системной красной волчанки.
16. Способ по п.11, в котором фармацевтический препарат назначают для предотвращения или снижения потери плотности костей.
17. Способ по п.11, в котором фармацевтический препарат назначают для лечения хронического синдрома усталости или фибромиалгии.
18. Фармацевтический препарат, содержащий по крайней мере один фармацевтический наполнитель и дегидроэпиандростерон (ДГЭА), по крайней мере 85% которого присутствует в полиморфной форме, характеризуемой специфическими резонансными пиками твердотельного ядерного магнитного резонанса по углероду-13, наблюдаемыми для чистого образца, при 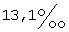 для атома углерода в позиции 18 и для атома углерода в позиции 18 и 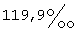 для атома углерода в позиции 6 по отношению к резонансному пику при для атома углерода в позиции 6 по отношению к резонансному пику при 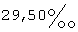 группы СН адамантана как внешнего контрольного образца.
19. Препарат по п.18, в котором по крайней мере 90% вышеуказанного дегидроэпиандростерона (ДГЭА) присутствует в указанной полиморфной форме.
20. Препарат по п.18, в котором по крайней мере 95% вышеуказанного дегидроэпиандростерона (ДГЭА) присутствует в указанной полиморфной форме.
21. Препарат по п.18, в котором по крайней мере 99% вышеуказанного дегидроэпиандростерона (ДГЭА) присутствует в указанной полиморфной форме.
22. Способ приготовления препарата ДГЭА в твердой форме, который включает смешивание по крайней мере одного фармацевтического наполнителя в твердой форме с дегидроэпиандростероном (ДГЭА), по крайней мере 85% которого присутствует в полиморфной форме по п.18.
23. Способ по п.22, в котором по крайней мере 90% вышеуказанного дегидроэпиандростерона (ДГЭА) присутствует в полиморфной форме по п.18.
24. Способ по п.22, в котором по крайней мере 95% вышеуказанного дегидроэпиандростерона (ДГЭА) присутствует в полиморфной форме по п.18.
25. Способ по п.22, в котором по крайней мере 99% вышеуказанного дегидроэпиандростерона (ДГЭА) присутствует в полиморфной форме по п.18.
26. Способ по п.22, который, кроме того, включает этап помещения препарата в твердой форме в капсульный контейнер, пригодный для доставки препарата в желудочно-кишечный тракт.
27. Способ по п.22, который, кроме того, включает этап прессования препарата в твердой форме для образования таблетки.
28. Способ назначения пациенту фармацевтического препарата, содержащего дегидроэпиандростерон (ДГЭА), включающий назначение фармацевтически приемлемого количества ДГЭА, в котором по крайней мере 85% ДГЭА присутствует в полиморфной форме по п.18.
29. Способ по п.28, в котором по крайней мере 90% ДГЭА присутствует в полиморфной форме по п.18.
30. Способ по п.28, в котором по крайней мере 95% ДГЭА присутствует в полиморфной форме по п.18.
31. Способ по п.28, в котором по крайней мере 99% ДГЭА присутствует в полиморфной форме по п.18.
32. Способ по п.28, в котором фармацевтический препарат назначают для лечения системной красной волчанки.
33. Способ по п.28, в котором фармацевтический препарат назначают для предотвращения или снижения потери плотности костей.
34. Способ по п.28, в котором фармацевтический препарат назначают для лечения хронического синдрома усталости или фибромиалгии. группы СН адамантана как внешнего контрольного образца.
19. Препарат по п.18, в котором по крайней мере 90% вышеуказанного дегидроэпиандростерона (ДГЭА) присутствует в указанной полиморфной форме.
20. Препарат по п.18, в котором по крайней мере 95% вышеуказанного дегидроэпиандростерона (ДГЭА) присутствует в указанной полиморфной форме.
21. Препарат по п.18, в котором по крайней мере 99% вышеуказанного дегидроэпиандростерона (ДГЭА) присутствует в указанной полиморфной форме.
22. Способ приготовления препарата ДГЭА в твердой форме, который включает смешивание по крайней мере одного фармацевтического наполнителя в твердой форме с дегидроэпиандростероном (ДГЭА), по крайней мере 85% которого присутствует в полиморфной форме по п.18.
23. Способ по п.22, в котором по крайней мере 90% вышеуказанного дегидроэпиандростерона (ДГЭА) присутствует в полиморфной форме по п.18.
24. Способ по п.22, в котором по крайней мере 95% вышеуказанного дегидроэпиандростерона (ДГЭА) присутствует в полиморфной форме по п.18.
25. Способ по п.22, в котором по крайней мере 99% вышеуказанного дегидроэпиандростерона (ДГЭА) присутствует в полиморфной форме по п.18.
26. Способ по п.22, который, кроме того, включает этап помещения препарата в твердой форме в капсульный контейнер, пригодный для доставки препарата в желудочно-кишечный тракт.
27. Способ по п.22, который, кроме того, включает этап прессования препарата в твердой форме для образования таблетки.
28. Способ назначения пациенту фармацевтического препарата, содержащего дегидроэпиандростерон (ДГЭА), включающий назначение фармацевтически приемлемого количества ДГЭА, в котором по крайней мере 85% ДГЭА присутствует в полиморфной форме по п.18.
29. Способ по п.28, в котором по крайней мере 90% ДГЭА присутствует в полиморфной форме по п.18.
30. Способ по п.28, в котором по крайней мере 95% ДГЭА присутствует в полиморфной форме по п.18.
31. Способ по п.28, в котором по крайней мере 99% ДГЭА присутствует в полиморфной форме по п.18.
32. Способ по п.28, в котором фармацевтический препарат назначают для лечения системной красной волчанки.
33. Способ по п.28, в котором фармацевтический препарат назначают для предотвращения или снижения потери плотности костей.
34. Способ по п.28, в котором фармацевтический препарат назначают для лечения хронического синдрома усталости или фибромиалгии.
РИСУНКИ
|
||||||||||||||||||||||||||
