Патент на изобретение №2219975
|
||||||||||||||||||||||||||
(54) СПОСОБ ПРЕДУПРЕЖДЕНИЯ РАЗВИТИЯ ПАРОКСИЗМОВ МЕРЦАНИЯ И ТРЕПЕТАНИЯ ПРЕДСЕРДИЙ
(57) Реферат: Изобретение относится к медицине, кардиологии. На фоне приема антиаритмических препаратов прогнозируют развития мерцания (МП) и трепетания предсердий (ТП). В случае прогноза МП и ТП пациенту устанавливают электрокардиографические электроды и наушники. Соединяют их с кардиоанализатором. Пациент ходит в соответствии с частотой ритма его сердечных сокращений. Этот ритм определяют по звуковым сигналам, подаваемым кардиоанализатором в момент регистрации зубца R. Ходьба, синхронизированная с частотой сердечных сокращений, производится 2 раза в день 1-2 раза в неделю в течение не менее 30 мин 28-32 дней. 3 табл. Изобретение относится к медицине, а именно к кардиологии, в частности к способам предупреждения развития пароксизмов мерцания и трепетания предсердий (МП и ТП). Аналогом предлагаемого решения является предупреждение пароксизмов МП и ТП путем использования ингибиторов ангиотензинпревращающего фермента (АПФ), причем их эффект основан на адекватной терапии основного заболевания, таких как гипертоническая болезнь, ишемическая болезнь сердца (ИБС) и т.д., обуславливающих развитие пароксизмов МП и ТП (Кушаковский М.С. Фибрилляция предсердий. – СПб.: Медицина, 1999). По наиболее близкой технической сущности прототипом является способ предупреждения впервые возникших пароксизмов МП и ТП за счет устранения предикторов, обуславливающих их развитие, таких как диастолическая дисфункция левого желудочка (ДДЛЖ), дилатация предсердий и т.д., путем использования бета-адреноблокаторов или антагонистов кальция, а также других антиаритмических средств (Кушаковский М.С. Фибрилляция предсердий. – СПб.: Медицина, 1999). Недостатком аналога и прототипа является недостаточная эффективность предупреждения пароксизмов МП и ТП из-за отсутствия конкретных сроков развития этих аритмий. Задачей изобретения является повышение эффективности предупреждения развития пароксизмов МП и ТП. Поставленная задача решается тем, что на фоне приема препаратов (ингибиторов АПФ, бета-адреноблокаторов или антагонистов кальция) прогнозируют развитие МП и ТП и при прогнозировании конкретных сроков развития пароксизмов МП и ТП пациенту на уровне подреберья устанавливают электрокардиографические электроды, а на область ушных раковин – наушники, электрокардиографические электроды и наушники соединяют с кардиоанализатором, после чего пациент ходит в соответствии с частотой ритма его сердечных сокращений, определяемого по звуковым сигналам, подаваемым кардиоанализатором в момент регистрации зубца R электрокардиограммы, 2 раза в день в течение не менее 30 мин на протяжении 28-32 дней. При наличии прогноза развития МП и ТП более 60 дней ходьбу после 28-32 дней продлевают на срок прогноза этих аритмий, причем ходьбу осуществляют 1-2 раза в неделю в течение не менее 30 мин. Способ осуществляется следующим образом. 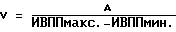 где V – скорость ПВ по миокарду в м/с, А – расстояние между двумя соседними точками сердечной мышцы предсердия, определяемое по эхокардиограмме в “В” режиме в метрах, ИВППмакс. и ИВППмин. – максимальные и минимальные значения ИВПП, определяемые по эхокардиограмме в “М” режиме в исследуемых точках в секундах. За антеградное ПВ принимают увеличение значений ИВПП от верхушки до основания, а за ретроградный характер распространения возбуждения – увеличение ИВПП от основания до верхушки. Затем проводят анализ регионарной сократимости миокарда предсердий путем аппликации друг на друга контуров левого предсердия в систолу и диастолу в тех же позициях, где регистрировались ВПП, причем полученные результаты сравнивают с сократимостью стенок предсердий в норме (у здоровых пациентов). При наличии антеградного ПВ по предсердиям больному проводят чреспищеводную электрокардиостимуляцию (ЧПЭКС) на частоте на 50% больше, чем частота базисного синусового ритма, и повторно определяют характер распространения по предсердиям и регионарной сократимости их стенок. Прогнозируют рецидивирование пароксизмов МП и ТП при выявлении более 9% ретроградного ПВ, а также двух и более участков гипоакинезии стенок предсердий до или после стимуляции. При прогнозировании развития пароксизмов МП и ТП пациент ходит в соответствии с частотой ритма его сердечных сокращений, определяемого по звуковым сигналам, подаваемым кардиоанализатором в момент регистрации зубца R ЭКГ, 2 раза в день в течение не менее 30 минут. Для этого на уровне подреберья закрепляют пояс с электрокардиографическими электродами, для того чтобы регистрировалось как минимум одно отведение ЭКГ, например Y по Небу, и соединяют их с кардиоанализатором, который передает импульсы работы сердца на наушники или головные телефоны путем трансформации прибором электрокардиографических в звуковые сигналы. Подача звуковых сигналов на наушники осуществляется в момент регистрации зубца R ЭКГ. Затем включают прибор и подбирают интенсивность звуковых сигналов, оптимальных для их восприятия пациентом. Согласование шагов с ритмом сердечных сокращений обеспечивается путем варьирования длины шага. Существенными отличительными признаками заявляемого способа являются следующие – на фоне приема препаратов (ингибиторов АПФ, бета-адреноблокаторов или антагонистов кальция) прогнозируют развитие МП и ТП и при прогнозировании конкретных сроков развития пароксизмов МП и ТП пациенту на уровне подреберья устанавливают электрокардиографические электроды, а на область ушных раковин – наушники, электрокардиографические электроды и наушники соединяют с кардиоанализатором, после чего пациент ходит в соответствии с частотой ритма его сердечных сокращений, определяемого по звуковым сигналам, подаваемым кардиоанализатором в момент регистрации зубца R электрокардиограммы, 2 раза в день в течение не менее 30 мин на протяжении 28-32 дней, причем при наличии прогноза развития МП и ТП более 60 дней ходьбу после 28-32 дней продлевают на срок прогноза этих аритмий, а ходьбу осуществляют 1-2 раза в неделю в течение не менее 30 мин в день. Ходьба пациента в ритме сердца обеспечивает адекватный венозный возврат, уменьшение преднагрузки и постнагрузки за счет включения механизма венозно-мышечной помпы, уменьшения дисбаланса между экстеро- и интерорецепцией. Пример конкретного выполнения. Пример 1. Больной В. , 55 лет, поступил в дневной стационар 05.04,1998 г. (ИБ 11465) по направлению участкового врача по поводу ИБС: стенокардии, периодических приступов сердцебиения. Из анамнеза известно, что больной страдает ИБС: стенокардией II функционального класса в течение последних 4-5 лет. Постоянно принимает нитронг, аспирин в дозе 300-400 мг в сутки, анаприлин в дозе 60-80 мг в сутки. В последние 3-4 месяца стал отмечать появление перебоев в работе сердца. При суточном мониторировании ЭКГ, выполненном амбулаторно 10.12.1997 г., выявлена одиночная и парная предсердная экстрасистолия (ПЭ) с частотой до 1-2 в час. 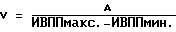 где V – скорость ПВ по миокарду в м/с, А – расстояние между двумя соседними точками сердечной мышцы предсердия, определяемое по эхокардиограмме в “В” режиме в метрах, ИВППмакс. и ИВППмин. – максимальные и минимальные значения ИВПП, определяемые по эхокардиограмме в “М” режиме в исследуемых точках в секундах. Затем провели анализ регионарной сократимости миокарда предсердий путем аппликации друг на друга контуров левого предсердия в систолу и диастолу с помощью компьютерной программы Ultra-Magic в тех же позициях, где регистрировались ВПП, причем полученные результаты сократимости стенок левого предсердия сравнивали с их нормальными значениями у здоровых лиц. За зону гипокинезии принимали участки миокарда предсердий со сниженной амплитудой сокращения (в % от нормы), акинезии – отсутствие сокращения и дискинезии – парадоксальное выпячивание миокарда предсердий в систолу. Результаты ИВПП у больного В., 55 лет, представлены в таблице 1. Как видно из таблицы, у больного В., 55 лет, отмечается увеличение значение ИВПП от верхушки до основания предсердий, т.е. антеградный характер ПВ по предсердиям (см. табл 1., исходные данные). При оценке регионарной сократимости миокарда выявлено нормокинетическое сокращение стенок предсердий. При анализе эхокардиографических показателей, определенных по общепринятой методике (Feigenbaum H. Echocardiography. – 5-th Ed., Philadelphia, Lea and Fibiger, 1994. – 695 p. ), был выявлен фиброз аорты, межжелудочковой перегородки, ДДЛЖ: максимальные скорости трансмитрального кровотока в фазу раннего (Е) и позднего (А) наполнения составили 55,2 м/с и 63,8 м/с соответственно, а их соотношение Е/А равнялось 0,87, в то время как показатели сократительной функции левого желудочка не выходили за пределы колебаний нормальных величин. Больному провели ЧПЭКС на частоте 120 имп/мин при частоте базисного ритма 80 ударов в минуту (что на 50% больше, чем частота базисного синусового ритма) и повторно определили характер ПВ по предсердиям и оценку регионарной сократимости их стенок по вышеописанной методике (см. табл. 1, после ЧПЭКС). После ЧПЭКС наблюдалось 17% участков миокарда с ретроградным ПВ по предсердиям, а также три зоны гипокинезия их стенок размером 18% от площади предсердий. Следует отметить, что помимо значений ИВПП при ЧПЭКС показатели, отражающие функцию синусового узла, такие как время восстановления функции синусового узла, корригированное время восстановления функции синусового узла, время синоатриального проведения, определенные по общепринятой методике (Кушаковский М.С. Аритмии сердца. – СПб.: Медицина, 1993), не выходили за пределы колебаний нормальных величин. Затем было индуцировано МП методом залповой сверхчастой стимуляции, причем порог индцурования аритмии (ПИА) составил 325 имп/мин. Аритмия купировалась самостоятельно через 5 минут. В последующем больному была проведена терапия нитратами, аспирином, ренитеком (эналоприлом) в дозах, указанных выше. У больного прогнозировали пароксизмы МП в течение первого месяца после обследования. Больному была рекомендована ходьба в соответствии с частотой ритма его сердечных сокращений. Для этого на уровне подреберья закрепили пояс с электрокардиографическими электродами, для того чтобы регистрировалось как минимум одно отведение – Y по Небу, и соединяют их с кардиоанализатором, который передает импульсы работы сердца на наушники или головные телефоны путем трансформации прибором электрокардиографических в звуковые сигналы. Подача звуковых сигналов на наушники осуществлялась в момент регистрации зубца R электрокардиограммы. Затем включали прибор и подбирали интенсивность звуковых сигналов, оптимальных для их восприятия пациентом. Согласование шагов с ритмом сердечных сокращений обеспечивалось путем варьирования длины шага. Больной ходил с частотой сердечного ритма не менее 30 минут 2 раза в день в течение 4 недель. При повторном обследовании, проведенном через 4 недели, включая проведение ЧПЭКС на частоте 120 имп/мин при частоте базисного ритма 80 ударов в минуту (что на 50% больше, чем частота базисного синусового ритма), было выявлено антеградное ПВ по предсердиям, зоны гипокинезии не регистрировались, как до, так и после ЧПЭКС. Соотношение Е/А до и после стимуляции составило 1,24 и 1,18 соответственно. Показатели, отражающие функцию синусового узла, такие как время восстановления функции синусового узла, корригированное время восстановления функции синусового узла, время синоатриального проведения, определенные по общепринятой методике (Кушаковский М.С. Аритмии сердца. – СПб.: Медицина, 1993), не выходили за пределы колебаний нормальных величин. Затем было индуцировано МП методом залповой сверхчастой стимуляции, причем ПИА составил 825 имп/мин. Аритмия купировалась самостоятельно через 2 секунды. В дальнейшем больной применял данный методический прием (ходьба в соответствии с частотой его сердечного ритма) как минимум 30 минут 1-2 раза в неделю. У этого пациента пароксизмы МП и ТП отсутствовали на протяжении 2 лет, причем ПИА через два года составил 920 имп/мин. Данный пример показал, что при прогнозировании пароксизмов МП и ТП в течение 1 месяца после обследования можно предупредить путем использования ходьбы в соответствии с частотой ритма его сердечных сокращений на протяжении не менее 30 минут 2 раза в день. Пример 2 Больной С. , 57 лет, поступил в стационар 19.06.1998 г. по направлению врача скорой помощи (ИБ N 21007) по поводу ИБС: прогрессирующей стенокардии. Из анамнеза известно, что больной страдает ИБС: стенокардией II функционального класса в течение последних 3 лет. Постоянно принимает сустак, антиагреганты. За два дня до госпитализации у больного усились ангинозные боли по частоте, длительности, интенсивности, а также изменился характер болевого синдрома. Госпитализация в стационар. В стационаре по данным клинико-инструментального обследования состояние больного было расценено как ИБС: прогрессирующая стенокардия, данных за наличие “свежих” очаговых изменений миокарда выявлено не было. Больному была продолжена терапия сустонитом в 19,2 мг в сутки, аспирином в дозе 300 мг в сутки. 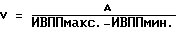 где V – скорость ПВ по миокарду в м/с, А – расстояние между двумя соседними точками сердечной мышцы предсердия, определяемое по эхокардиограмме в “В” режиме в метрах, ИВППмакс. и ИВППмин. – максимальные и минимальные значения ИВПП, определяемые по эхокардиограмме в “М” режиме в исследуемых точках в секундах. Результаты ИВПП у больного С., 57 лет, представлены в таблице 2. Как видно из таблицы, у больного С., 57 лет, отмечается увеличение значение ИВПП от верхушки до основания предсердий, т.е. антеградный характер ПВ по предсердиям (см. табл. 2, исходные данные). При оценке регионарной сократимости миокарда выявлено нормокинетическое сокращение стенок предсердий. При анализе эхокардиографических показателей, определенных по общепринятой методике (Feigenbaum H. Echocardiography. – 5-th Ed., Philadelphia, Lea and Fibiger, 1994. – 695 p.), был выявлен фиброз аорты, гипокинезия межжелудочковой перегородки, соотношение Е/А равнялось 1,12, а показатели сократительной функции левого желудочка, включая объем левого предсердия, не выходили за пределы колебаний нормальных величин. Больному провели ЧПЭКС на частоте 105 имп/мин при частоте базисного синусового ритма 70 ударов в минуту (что на 50% больше частоты базисного синусового ритма) и повторно определили характер распространения по предсердиям по вышеописанной методике (см. табл. 2, после ЧПЭКС). После ЧПЭКС на частоте на 50% и более базисного ритма отмечалось развитие 14% участков ретроградного ПВ по предсердиям, а также два участка гипокинезии предсердий площадью 15%, соответствующих локализации ретроградного распространения возбуждения. Следует отметить, что помимо значений ИВПП, при ЧПЭКС показатели, отражающие функцию синусового узла, такие как время восстановления функции синусового узла, корригированное время восстановления функции синусового узла, время синоатриального проведения, не выходили за пределы колебаний нормальных величин. Затем было индуцировано МП методом залповой сверхчастой стимуляции, причем ПИА составил 340 имп/мин. Аритмия купировалась самостоятельно через 3 минуты. В последующем больному была проведена терапия нитратами, аспирином, ренитеком (эналоприлом) в дозах, указанных выше. Противоаритмические препараты не назначались. Больному была рекомендована ходьба в соответствии с частотой ритма его сердечных сокращений. Для этого на уровне подреберья закрепили пояс с электрокардиографическими электродами, для того чтобы регистрировалось как минимум одно отведение – Y по Небу, и соединяют их с кардиоанализатором, который передает импульсы работы сердца на наушники или головные телефоны путем трансформации прибором электрокардиографических в звуковые сигналы. Подача звуковых сигналов на наушники осуществлялась в момент регистрации зубца R электрокардиограммы. Затем включали прибор и подбирали интенсивность звуковых сигналов, оптимальных для их восприятия пациентом. Согласование шагов с ритмом сердечных сокращений обеспечивалось путем варьирования длины шага. Больной ходил с частотой сердечного ритма в течение 20 минут 2 раза в день. Спонтанный пароксизм МП развился на 5 день пребывания больного в стационаре и был купирован внутривенным введением новокаинамида в дозе 1000 мг. В качестве противорецидивной терапии пароксизмов МП и ТП больному был назначен соталол в дозе 80 мг в сутки. Аритмия не рецидивировала на протяжении 2 лет, причем при повторном (через 11 месяцев после назначения соталола) проведении ПИА с помощью ЧПЭКС значения этого показателя составили 1020 имп/мин. Данный пример показал, что при прогнозировании у больного развития пароксизмов МП и ТП, ходьба с частотой сердечных сокращений в течение 20 минут 2 раза в день не предупреждает развитие пароксизмов МП и ТП. Пример 3 Больной О. , 60 лет, поступил в стационар 21.02.1997 г. по направлению врача поликлиники (ИБ N 2569) по поводу ИБС: впервые возникшей стенокардии. Из анамнеза известно, что больной ранее считал себя практически здоровым. В стационаре по данным клинико-инструментального обследования состояние больного было расценено как ИБС: стенокардия, данных за наличие “свежих” очаговых изменений миокарда выявлено не было. Больному была начата терапия эринитом в 40 мг в сутки, аспирином в дозе 300 мг в сутки, зокором 20 мг в сутки. 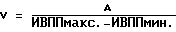 где V – скорость ПВ по миокарду в м/с, А – расстояние между двумя соседними точками сердечной мышцы предсердия, определяемое по эхокардиограмме в “В” режиме в метрах, ИВППмакс. и ИВППмин. – максимальные и минимальные значения ИВПП, определяемые по эхокардиограмме в “М” режиме в исследуемых точках в секундах. У больного О., 60 лет, отмечается увеличение значение ИВПП от верхушки до основания правого предсердия, т.е. антеградный характер ПВ по предсердию, а в области межжелудочковой перегородки и левого предсердия – 25% участков с ретроградным ПВ и три зоны гипокинезии размером 26% от площади предсердий. Больному была проведена терапия нитратами, аспирином, ренитеком (эналоприлом) в дозах, указанных выше. Противоаритмические препараты не назначались. При анализе эхокардиографических показателей, определенных по общепринятой методике (Feigenbaum H. Echocardiography. – 5-th Ed., Philadelphia, Lea and Fibiger, 1994. – 695 p.), был выявлен кальциноз аорты, гипокинезия межжелудочковой перегородки, соотношение Е/А равнялось 1,14, а показатели сократительной функции левого желудочка, включая объем левого предсердия, не выходили за пределы колебаний нормальных величин. Затем было индуцировано МП методом залповой сверхчастой стимуляции, причем ПИА составил 340 имп/мин. Аритмия купировалась самостоятельно через 3 минуты. В последующем больному была проведена терапия нитратами, аспирином, ренитеком (эналоприлом) в дозах, указанных выше. Противоаритмические препараты не назначались. Пароксизмы МП ми ТП прогнозировались в течение месяца после вышеуказанного обследования. Больному была рекомендована ходьба в соответствии с частотой ритма его сердечных сокращений. Для этого на уровне подреберья закрепили пояс с электрокардиографическими электродами, для того чтобы регистрировалось как минимум одно отведение – Y по Небу, и соединяют их с кардиоанализатором, который передает импульсы работы сердца на наушники или головные телефоны путем трансформации прибором электрокардиографических в звуковые сигналы. Подача звуковых сигналов на наушники осуществлялась в момент регистрации зубца R электрокардиограммы. Затем включали прибор и подбирали интенсивность звуковых сигналов, оптимальных для их восприятия пациентом. Согласование шагов с ритмом сердечных сокращений обеспечивалось путем варьирования длины шага. Больной ходил с частотой сердечного ритма в течение 40 минут 2 раза в день на протяжении 28 дней. Больной был выписан из стационара через две недели после стабилизации стенокардии до II функционального класса. Аритмии не рецидивировали на протяжении 1 года после первого обследования, причем при повторном обследовании (через 11 месяцев) ПИА, определенный с помощью ЧПЭКС, составил 940 имп/мин. Данный пример показал, что при прогнозировании у больного развития пароксизмов МП и ТП, ходьба с частотой сердечных сокращений в течение 40 минут 2 раза в день на протяжении 28 дней предупреждает развитие пароксизмов МП и ТП. Пример 4 Больной С. , 58 лет, поступил в стационар 01.07.1999 г. по направлению врача поликлиники (ИБ N 33369) по поводу ИБС: впервые возникшей стенокардии. Из анамнеза известно, что больной ранее считал себя практически здоровым. В стационаре по данным клинико-инструментального обследования состояние больного было расценено как ИБС: стенокардия, данных за наличие “свежих” очаговых изменений миокарда выявлено не было. Больному была начата терапия эринитом в 40 мг в сутки, аспирином в дозе 300 мг в сутки, зокором 20 мг в сутки. 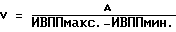 где V – скорость ПВ по миокарду в м/с, А – расстояние между двумя соседними точками сердечной мышцы предсердия, определяемое по эхокардиограмме в “В” режиме в метрах, ИВППмакс. и ИВППмин. – максимальные и минимальные значения ИВПП, определяемые по эхокардиограмме в “М” режиме в исследуемых точках в секундах. У больного С., 58 лет, отмечается увеличение значения ИВПП от верхушки до основания правого предсердия, т.е. антеградный характер ПВ по предсердию, а в области межжелудочковой перегородки и левого предсердия – 29% участков с ретроградным ПВ и три зоны гипокинезии размером 32% от площади предсердий. Больному была проведена терапия нитратами, аспирином, ренитеком (эналоприлом) в дозах, указанных выше. Противоаритмические препараты не назначались. При анализе эхокардиографических показателей, определенных по общепринятой методике (Feigenbaum H. Echocardiography. – 5-th Ed., Philadelphia, Lea and Fibiger, 1994. – 695 p.), был выявлен кальциноз аорты, гипокинезия межжелудочковой перегородки, соотношение Е/А равнялось 1,09, а показатели сократительной функции левого желудочка, включая объем левого предсердия, не выходили за пределы колебаний нормальных величин. Затем было индуцировано МП методом залповой сверхчастой стимуляции, причем ПИА составил 367 имп/мин. Аритмия купировалась самостоятельно через 5 минут. В последующем больному была проведена терапия нитратами, аспирином, ренитеком (эналоприлом) в дозах, указанных выше. Противоаритмические препараты не назначались. Пароксизмы МП ми ТП прогнозировались в течение месяца после вышеуказанного обследования. Больному была рекомендована ходьба в соответствии с частотой ритма его сердечных сокращений. Для этого на уровне подреберья закрепили пояс с электрокардиографическими электродами, для того чтобы регистрировалось как минимум одно отведение – Y по Небу, и соединяют их с кардиоанализатором, который передает импульсы работы сердца на наушники или головные телефоны путем трансформации прибором электрокардиографических в звуковые сигналы. Подача звуковых сигналов на наушники осуществлялась в момент регистрации зубца R электрокардиограммы. Затем включали прибор и подбирали интенсивность звуковых сигналов, оптимальных для их восприятия пациентом. Согласование шагов с ритмом сердечных сокращений обеспечивалось путем варьирования длины шага. Больной ходил с частотой сердечного ритма в течение 50 минут 2 раза в день на протяжении 32 дней. Больной был выписан из стационара через две недели после стабилизации стенокардии до II функционального класса. Аритмии не рецидивировали на протяжении 1 месяца после первого обследования, причем при повторном обследовании (через 1 месяц) ПИА, определенный с помощью ЧПЭКС, составил 940 имп/мин. При последующем наблюдении аритмии не рецидивировали на протяжении 1 года после первого обследования, причем при повторном обследовании (через 11 месяцев) ПИА, определенный с помощью ЧПЭКС, составил 1020 имп/мин. Данный пример показал, что при прогнозировании у больного развития пароксизмов МП и ТП ходьба с частотой сердечных сокращений в течение 50 минут 2 раза в день на протяжении 32 дней предупреждает развитие пароксизмов МП и ТП. Пример 5 Больной Ф. , 49 лет, поступил в стационар 05.06.1998 г. по направлению врача поликлиники (ИБ N 25478) по поводу ИБС: впервые возникшей стенокардии. Из анамнеза известно, что больной ранее считал себя практически здоровым. В стационаре по данным клинико-инструментального обследования состояние больного было расценено как ИБС: стенокардия, данных за наличие “свежих” очаговых изменений миокарда выявлено не было. Больному была начата терапия эринитом в 40 мг в сутки, аспирином в дозе 300 мг в сутки, зокором 20 мг в сутки. 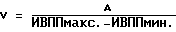 где V – скорость ПВ по миокарду в м/с, А – расстояние между двумя соседними точками сердечной мышцы предсердия, определяемое по эхокардиограмме в “В” режиме в метрах, ИВППмакс. и ИВППмин. – максимальные и минимальные значения ИВПП, определяемые по эхокардиограмме в “М” режиме в исследуемых точках, в секундах. У больного Ф., 49 лет, отмечается увеличение значение ИВПП от верхушки до основания правого предсердия, т.е. антеградный характер ПВ по предсердию, а в области межжелудочковой перегородки и левого предсердия – 23% участков с ретроградным ПВ и три зоны гипокинезии размером 21% от площади предсердий. Больному была проведена терапия нитратами, аспирином, ренитеком (эналоприлом) в дозах, указанных выше. Противоаритмические препараты не назначались. При анализе эхокардиографических показателей, определенных по общепринятой методике (Feigenbaum H. Echocardiography, – 5-th Ed., Philadelphia, Lea and Fibiger, 1994. – 695 p.), был выявлен кальциноз аорты, гипокинезия межжелудочковой перегородки, соотношение Е/А равнялось 1,11, а показатели сократительной функции левого желудочка, включая объем левого предсердия, не выходили за пределы колебаний нормальных величин. Затем было индуцировано МП методом залповой сверхчастой стимуляции, причем ПИА составил 425 имп/мин. Аритмия купировалась самостоятельно через 1 минуту. В последующем больному была проведена терапия нитратами, аспирином, ренитеком (эналоприлом) в дозах, указанных выше. Противоаритмические препараты не назначались. Пароксизмы МП и ТП прогнозировались в течение 3 месяцев после вышеуказанного обследования. Больному была рекомендована ходьба в соответствии с частотой ритма его сердечных сокращений. Для этого на уровне подреберья закрепили пояс с электрокардиографическими электродами, для того чтобы регистрировалось как минимум одно отведение – Y по Небу, и соединяют их с кардиоанализатором, который передает импульсы работы сердца на наушники или головные телефоны путем трансформации прибором электрокардиографических в звуковые сигналы. Подача звуковых сигналов на наушники осуществлялась в момент регистрации зубца R электрокардиограммы. Затем включали прибор и подбирали интенсивность звуковых сигналов, оптимальных для их восприятия пациентом. Согласование шагов с ритмом сердечных сокращений обеспечивалось путем варьирования длины шага. Больной ходил с частотой сердечного ритма в течение 40 минут 2 раза в день на протяжении 32 дней. Больной был выписан из стационара через две недели после стабилизации стенокардии до II функционального класса. После выписки из стационара после 32 дней ходьбу осуществлял 1-2 раза в неделю в течение не менее 30 мин. Аритмии не рецидивировали на протяжении 3 месяцев после первого обследования, причем при повторном обследовании (через 3 месяца) ПИА, определенный с помощью ЧПЭКС, составил 889 имп/мин. При последующем наблюдении аритмии не рецидивировали на протяжении 1 года после первого приступа, причем при повторном обследовании (через 11 месяцев) ПИА, определенный с помощью ЧПЭКС, составил 1140 имп/мин. Данный пример показал, что при прогнозировании у больного развития пароксизмов МП и ТП ходьба с частотой сердечных сокращений в течение 40 минут 2 раза в день на протяжении 32 дней, причем после 32 дней на период прогноза ходьбу осуществляли 1-2 раза в неделю в течение не менее 30 мин, предупреждает развитие пароксизмов МП и ТП. У всех больных прогнозирование пароксизмов МП и ТП проводилось по ранее предлагаемому способу (Олесин А.И., Шабров А.В., Разумова Т.В., Щеглова Е.А. , Кухарчик Г. А. Способ прогнозирования развития пароксизмов мерцания и трепетания предсердий. – Положительное решение на заявку на патент 2000121411/14(022562) от 02.06.2001 г.) после первого обследования. Эффективность предупреждения развития пароксизмов МП и ТП оценивалась согласно предлагаемому нами способу в сравнении с прототипом. Согласно предлагаемому нами способу при прогнозировании конкретных сроков развития пароксизмов МП и ТП пациенту на уровне подреберья устанавливают электрокардиографические электроды, а на область ушных раковин – наушники, электрокардиографические электроды и наушники соединяют с кардиоанализатором, после чего пациент ходит в соответствии с частотой ритма его сердечных сокращений, определяемого по звуковым сигналам, подаваемым кардиоанализатором в момент регистрации зубца R электрокардиограммы, 2 раза в день в течение не менее 30 мин на протяжении 28-32 дней, причем при наличии прогноза развития МП и ТП более 60 дней ходьбу после 28-32 дней продлевают на срок прогноза этих аритмий, а ходьбу осуществляют 1-2 раза в неделю в течение не менее 30 мин. Предупреждение пароксизмов МП и ТП (прототип) проводилось за счет устранения предикторов, обуславливающих их развитие, таких как диастолическая дисфункция левого желудочка (ДДЛЖ), дилатация предсердий и т.д., путем использования бета-адреноблокаторов или антагонистов кальция, а также других антиаритмических средств (Кушаковский М.С. Фибрилляция предсердий. – СПб.: Медицина, 1999). Статистический анализ полученных результатов проведен на ЭВМ. У всех больных прогнозировались пароксизмы МП и ТП по способу, описанному нами выше, в течение 1-6 месяцев после первого обследования (Олесин А.И., Шабров А. В., Разумова Т.В., Щеглова Е.А., Кухарчик Г.А. Способ прогнозирования развития пароксизмов мерцания и трепетания предсердий. – Положительное решение на заявку на патент 2000121411/14 (022562) от 02.06.2001 г.). У 76 (58,91%) из всех обследованных пациентов было выявлено увеличение левого предсердия более 4,0 см. У 48 (33,61%) из них была выявлена ДДЛЖ, у 22 (17,05%) – систолическая дисфункция левого желудочка. Всем больным проводилась терапия нитратами, антиагрегантами, ингибиторами АПФ (ренитек, эналоприл, энап) (базисная терапия). 21 (43,75%) из 48 больных с ДДЛЖ для предупреждения пароксизмов МП и ТП был назначен дилтиазем-ретард, а остальным – бета-адреноблокаторы (метопролол, анаприлин). Всем больным с систолической дисфункцией левого желудочка были назначены субтерапевтические дозы бета-адреноблокаторов. Все больные были разделены на две группы. В I группу было включено 59 (45,74%) больных, которым проводилось предупреждение пароксизмов МП и ТП, используя прототип, а остальные – 70 (54,26%), вошли во II группу, которым проводилось предупреждение пароксизмов МП и ТП, используя предлагаемый способ. Результаты исследования показали, что при прогнозировании развития пароксизмов МП и ТП, эти аритмии не наблюдались в течение 1 года у 18 (30,51%) и 66 (94,29%) больных I и II группы соответственно (р<0,001). Наиболее эффективно (в среднем в 3 раза) можно предупреждать развитие пароксизмов МП и ТП в течение 1 года с помощью предлагаемого способа в сравнении с прототипом (см. таблицу 3). Формула изобретения Способ предупреждения развития пароксизмов мерцания и трепетания предсердий путем медикаментозного воздействия, отличающийся тем, что на фоне медикаментозного воздействия прогнозируют развитие пароксизмов мерцания и трепетания предсердий и при наличии прогноза пароксизмов мерцания и трепетания предсердий пациенту устанавливают электроды для регистрации электрокардиограммы и наушники, которые соединяют с кардиоанализатором, после чего пациент ходит в соответствии с частотой ритма его сердечных сокращений, определяемого по звуковым сигналам, подаваемым кардиоанализатором в момент регистрации зубца R электрокардиограммы, 2 раза в день в течение 30 мин на протяжении 28-32 дней. РИСУНКИ
MM4A Досрочное прекращение действия патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 22.01.2004
Извещение опубликовано: 27.05.2006 БИ: 15/2006
|
||||||||||||||||||||||||||
