Патент на изобретение №2219917
|
||||||||||||||||||||||||||
(54) СТАБИЛЬНЫЕ РАСТВОРЫ МИТОКСАНТРОНА
(57) Реферат: Изобретение относится к фармацевтике и касается стабильного раствора митоксантрона. Изобретение заключается в том, что стабильный раствор содержит гидрохлорид митоксантрона, в целях стабилизации содержит 0,001-0,15% эдетата натрия. Изобретение обеспечивает получение раствора для инъекций, свободного от сульфитных соединений, и исключает побочные воздействия при парентеральном применении. 3 с. и 4 з.п.ф-лы, 1 табл. Изобретение относится к растворам митоксантрона, которые наряду с действующим началом митоксантроном (гидрохлорид 1,4-дигидрокси-5,8-бис-[[2-[(2-гидроксиэтил)амино] этил]амино] антрахинона) содержит стабилизатор и свободны от сульфитных соединений, а также к применению этих растворов для инъекции и в качестве концентрата инфузионного раствора. Соединение митоксантрон представляет собой производное антрахинона с химическим названием гидрохлорид 1,4-дигидрокси-5,8-бис-[[2-[(2-гидроксиэтил)амино]этил]амино]антрахинона, соответствующее формуле: 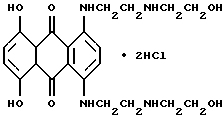 Суммарная формула: C22H28N4О6  2HCl.
Митоксантрон проявляет противоопухолевое, антивирусное, антипротозойное и иммуномоделирующее свойства. Соединение является очень полезным в качестве цитостатика, в особенности при терапии рака молочной железы, злокачественных лимфом, острых лейкемий, первичного рака клеток печени и рака яичников.
В качестве галеновой готовой формы применение нашли водные растворы этого соединения. Стабильность митоксантрона в водном растворе, однако, ограничена. Известно, что соединение подлежит окислительному разложению, если не предпринять меры, замедляющие или еще лучше предотвращающие этот распад. Этот процесс усиливают в особенности, ионы металлов, даже в незначительной концентрации.
Показано, что этому разложению можно противодействовать с помощью антиоксидантов.
Так, в патенте ЕР-В-0 236822 описан состав, который стабилизируется с помощью комбинации антиоксиданта метабисульфита натрия, определенного значения рН и комплексообразователя динатрийэдетата и глицина.
Хотя эта композиция стабильна, однако она не может удовлетворять в отношении побочного воздействия добавок. Недостатком рецептуры является применение метабисульфита натрия, в общем очень эффективного в качестве стабилизатора.
Так например, в торговле имеются растворы, содержащие митоксантрон, а также сульфитную добавку. При применении препаратов, которые содержат сульфит в обычно применяемых концентрациях, наблюдаются сверхчувствительные реакции у человека с тяжелыми побочными воздействиями. Для астматиков с чувствительностью к сульфитам наблюдались, например, осложнения, угрожающие жизни.
К этому можно добавить, что при применении металлобразующих комбинаций из, по меньшей мере, двух комплексообразователей в состав вводят дополнительные компоненты.
Недостатком является также сильно кислая область рН менее 3, как на переносимость при применении, так и на стабильность (WANG, Da-Peng; LIANG, Gow-Zaw, TU, Yu-Hsing; Stability of mitoxantrone hydrochloride in solution. Drug Development and Industrial Pharmacy, 20(11), 1895-1903 (1994).
Задачей изобретения является предотвращение побочных воздействий и получение стабильной в течение длительного времени при нормальных условиях хранения и при повышенной температуре около 30oС водной композиции, которая свободна от сульфитных соединений.
В противоположность патенту ЕР-В-0 236822 было неожиданно показано, что достаточно уже одного эдетата натрия, чтобы стабилизировать митоксантрон в водном растворе.
Задача согласно изобретению решается с помощью водного состава, который состоит из гидрохлорида митоксантрона от 1 до 5 мг/мл раствора, добавки 0,001-0,15% эдетата натрия, хлористого натрия, уксуснокислого натрия и уксусной кислоты. При этом получают значение рН в диапазоне 3,0-4,5.
Предпочтительно эдетат натрия используют в количестве 0,04%.
Фармацевтический состав согласно изобретению можно использовать в качестве раствора для инъекции и концентрата инфузионного раствора для хемотерапевтического лечения указанных раковых заболеваний. Состав исключает указанные побочные воздействия и проявляет требуемую для фармацевтических составов стабильность.
Формы осуществления выполнения изобретения: Для получения раствора в обедненную кислородом воду добавляют хлористый натрий и уксуснокислый натрий, уксусную кислоту и эдетат натрия и растворяют. В часть этого раствора вводят гидрохлорид митоксантрона и растворяют. Этот раствор активного начала добавляют к раствору вспомогательных веществ и доводят до конечного объема водой, обедненной кислородом.
Полученный таким образом раствор фильтруют, а затем сливают в емкость для инъекций и закрывают.
Для стерилизации используют обычные непроницаемые для микроорганизмов фильтры, как, например, мембранные фильтры с размером пор 0,2 мкм. Применяемые емкости предварительно стерилизуют обычным образом. Используемая вода должна быть стерильной и свободной от пирогена и соответствовать требованиям Европейской фармакопеи 1997. Емкости для инъекций целесообразно изготавливать из стекла типа стекла 1 согласно требованиям Европейской фармакопеи 1997.
Количество раствора в соответствующих емкостях составляет от 2,5 до 50 мл, предпочтительно от 5 до 15 мл на емкость. Количество митоксантрона на емкость составляет предпочтительно от 10 до 30 мг.
При заполнении инъекционного раствора при асептических условиях емкости в целях удаления кислорода подвергают дегазации, закрывают инъекционными пробками и закатывают.
Следующие примеры должны пояснять изобретение более подробно.
ПРИМЕР 1. Емкость для инъекций с 5 мл 0,2%-ного раствора митоксантрона для инъекций 2HCl.
Митоксантрон проявляет противоопухолевое, антивирусное, антипротозойное и иммуномоделирующее свойства. Соединение является очень полезным в качестве цитостатика, в особенности при терапии рака молочной железы, злокачественных лимфом, острых лейкемий, первичного рака клеток печени и рака яичников.
В качестве галеновой готовой формы применение нашли водные растворы этого соединения. Стабильность митоксантрона в водном растворе, однако, ограничена. Известно, что соединение подлежит окислительному разложению, если не предпринять меры, замедляющие или еще лучше предотвращающие этот распад. Этот процесс усиливают в особенности, ионы металлов, даже в незначительной концентрации.
Показано, что этому разложению можно противодействовать с помощью антиоксидантов.
Так, в патенте ЕР-В-0 236822 описан состав, который стабилизируется с помощью комбинации антиоксиданта метабисульфита натрия, определенного значения рН и комплексообразователя динатрийэдетата и глицина.
Хотя эта композиция стабильна, однако она не может удовлетворять в отношении побочного воздействия добавок. Недостатком рецептуры является применение метабисульфита натрия, в общем очень эффективного в качестве стабилизатора.
Так например, в торговле имеются растворы, содержащие митоксантрон, а также сульфитную добавку. При применении препаратов, которые содержат сульфит в обычно применяемых концентрациях, наблюдаются сверхчувствительные реакции у человека с тяжелыми побочными воздействиями. Для астматиков с чувствительностью к сульфитам наблюдались, например, осложнения, угрожающие жизни.
К этому можно добавить, что при применении металлобразующих комбинаций из, по меньшей мере, двух комплексообразователей в состав вводят дополнительные компоненты.
Недостатком является также сильно кислая область рН менее 3, как на переносимость при применении, так и на стабильность (WANG, Da-Peng; LIANG, Gow-Zaw, TU, Yu-Hsing; Stability of mitoxantrone hydrochloride in solution. Drug Development and Industrial Pharmacy, 20(11), 1895-1903 (1994).
Задачей изобретения является предотвращение побочных воздействий и получение стабильной в течение длительного времени при нормальных условиях хранения и при повышенной температуре около 30oС водной композиции, которая свободна от сульфитных соединений.
В противоположность патенту ЕР-В-0 236822 было неожиданно показано, что достаточно уже одного эдетата натрия, чтобы стабилизировать митоксантрон в водном растворе.
Задача согласно изобретению решается с помощью водного состава, который состоит из гидрохлорида митоксантрона от 1 до 5 мг/мл раствора, добавки 0,001-0,15% эдетата натрия, хлористого натрия, уксуснокислого натрия и уксусной кислоты. При этом получают значение рН в диапазоне 3,0-4,5.
Предпочтительно эдетат натрия используют в количестве 0,04%.
Фармацевтический состав согласно изобретению можно использовать в качестве раствора для инъекции и концентрата инфузионного раствора для хемотерапевтического лечения указанных раковых заболеваний. Состав исключает указанные побочные воздействия и проявляет требуемую для фармацевтических составов стабильность.
Формы осуществления выполнения изобретения: Для получения раствора в обедненную кислородом воду добавляют хлористый натрий и уксуснокислый натрий, уксусную кислоту и эдетат натрия и растворяют. В часть этого раствора вводят гидрохлорид митоксантрона и растворяют. Этот раствор активного начала добавляют к раствору вспомогательных веществ и доводят до конечного объема водой, обедненной кислородом.
Полученный таким образом раствор фильтруют, а затем сливают в емкость для инъекций и закрывают.
Для стерилизации используют обычные непроницаемые для микроорганизмов фильтры, как, например, мембранные фильтры с размером пор 0,2 мкм. Применяемые емкости предварительно стерилизуют обычным образом. Используемая вода должна быть стерильной и свободной от пирогена и соответствовать требованиям Европейской фармакопеи 1997. Емкости для инъекций целесообразно изготавливать из стекла типа стекла 1 согласно требованиям Европейской фармакопеи 1997.
Количество раствора в соответствующих емкостях составляет от 2,5 до 50 мл, предпочтительно от 5 до 15 мл на емкость. Количество митоксантрона на емкость составляет предпочтительно от 10 до 30 мг.
При заполнении инъекционного раствора при асептических условиях емкости в целях удаления кислорода подвергают дегазации, закрывают инъекционными пробками и закатывают.
Следующие примеры должны пояснять изобретение более подробно.
ПРИМЕР 1. Емкость для инъекций с 5 мл 0,2%-ного раствора митоксантрона для инъекцийСостав 1 мл раствора для инъекций содержит: Гидрохлорид митоксантрона – 2,328 мг Хлористый натрий – 8,000 мг Уксуснокислый натрий  3Н2О – 0,085 мг 3Н2О – 0,085 мгДинатрийэдетат – 0,040 мг 1н уксусная кислота – 7,680 мкл Вода для инъекционных целей – До 1 мл Получение раствора Для получения инъекционного раствора в воду вводят хлористый натрий, уксуснокислый натрий, уксусную кислоту и динатрийэдетат и растворяют. Предварительно подходящим образом понижают концентрацию кислорода в воде. Раствор разделяют и в одной части растворяют гидрохлорид митоксантрона. Раствор, содержащий митоксантрон, смешивают с остальным раствором и дополняют до конечного объема обедненной кислородом водой. Затем проводится стерилизация раствора путем фильтрации через мембранный фильтр. ПРИМЕР 2. Емкость для инъекций с 12,5 мл 0,2%-ного раствора митоксантрона. Состав и получение раствора митоксантрона соответствуют примеру 1. Формула изобретения 1. Стабильные растворы митоксантрона, содержащие 1-5 мг гидрохлорида митоксантрона/мл раствора, 0,001-0,15% эдетата натрия и в качестве вспомогательных веществ хлористый натрий, уксуснокислый натрий и уксусную кислоту. 2. Стабильные растворы митоксантрона по п.1, отличающиеся тем, что содержат предпочтительно 0,04% эдетата натрия и пригодны для инъекций. 3. Способ получения стабильных растворов митоксантрона по пп.1 и 2, отличающийся тем, что хлористый натрий, уксуснокислый натрий, уксусную кислоту и эдетат натрия растворяют в обедненной кислородом воде, в часть раствора вводят гидрохлорид митоксантрона, растворы объединяют и доводят до конечного объема с содержанием 1-5 мг гидрохлорида митоксантрона/мл раствора и 0,001-0,15% эдетата натрия/мл раствора. 4. Способ по п.3, отличающийся тем, что добавляют предпочтительно 0,04% эдетата натрия. 5. Стабильные растворы митоксантрона по п.1 для получения лекарственного средства, применяемого при раковых заболеваниях. 6. Лекарственное средство, применяемое при раковых заболеваниях, отличающееся тем, что оно содержит 1-5 мг гидрохлорида митоксантрона/мл раствора, эдетат натрия в количестве 0,001-0,15% в расчете на раствор гидрохлорида митоксантрона и в качестве вспомогательных веществ хлористый натрий, уксуснокислый натрий и уксусную кислоту. 7. Лекарственное средство по п.6, отличающееся тем, что оно содержит предпочтительно 0,04% эдетата натрия. РИСУНКИ
|
||||||||||||||||||||||||||
