Патент на изобретение №2211222
|
||||||||||||||||||||||||||
(54) НОВЫЕ КЕТОАЗОЛИДЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ
(57) Реферат: Изобретение относится к соединениям, представленным общей формулой (I) 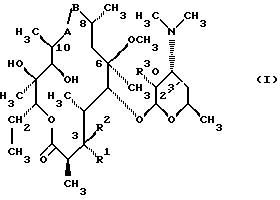 где A представляет NH-группу и В при этом С=О-группа или А – С=О-группа и В при этом NH-группа, R1 – ОН-группа, L-кладинозильная группа формулы (II) 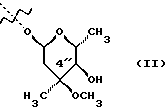 или вместе с R2 представляет собой кетон; R2 – водород или вместе с R1 представляет кетон; R3 – водород или С1-С4-алканоильная группа, и фармацевтически приемлемым солям присоединения органических и неорганических кислот. Также заявлен способ получения соединений общей формулы (I). Технический результат – новые соединения эритромицина А, относящемуся к антибиотикам класса макролидов. 2 с. и 10 з.п.ф-лы, 4 табл. Область техники Международная патентная классификация А 61 К 31/70, С 07 Н 17/08. Настоящее изобретение относится к новым соединениям эритромицина А, относящемуся к антибиотикам класса макролидов. Конкретно, оно относится к новым 15-членным кетоазалидам класса 6-О-метил-8а-аза-8а-гомо- и 6-О-метил-9а-аза-9а-гомоэритромицину А, к промежуточным продуктам и способам их получения, к их фармацевтически приемлемым солям присоединения органических и неорганических кислот. Уровень техники Эритромицин А является макролидным антибиотиком, структура которого характеризуется 14-членным лактоновым кольцом, имеющим С-9 кетон и два сахара, L-кладинозу и D-дезозамин, которые гликозидно связаны с положением С-3 и С-5 с агликоновой частью молекулы (McGuire: Antibiot. Chemother., 1952, 2: 281). В течение более чем 40 лет эритромицин считался безопасным и активным противомикробным агентом для лечения респираторных и генитальных инфекций, вызванных грамположительными бактериями, подобными Legionella, Mycoplasma, Chlamidia и Helicobacter. Наблюдаемые изменения биодоступности после перорального применения, желудочная непереносимость у многих пациентов и потеря активности в кислой среде являются основными недостатками терапевтического применения эритромицина А. Спироциклизация агликонового кольца успешно ингибируется путем химической трансформации С-9 кетона или гидроксильных групп в положениях С-6 и/или С-12. Таким образом, например, оксимированием С-9 кетона эритромицина А гидрохлоридом гидроксиламина, перегруппировкой Бэкмана полученного 9(Е)-оксима и восстановлением полученного таким образом 6,9-иминоэфира (6-деокси-9-деоксо-9а-аза-9а-гомоэритромицина А 6,9-циклического иминоэфира), получают 9-деоксо-9а-аза-9а-гомоэритромицин А, первый полусинтетический макролид, имеющий 15-членное азалактоновое кольцо (Kobrehel G. et al., патент США 43283345/1982). Восстановительным метилированием вновь введенной эндоциклической 9а-аминогруппы в соответствии со способом Эвейлера-Кларка (Eschweiler-Clark) был синтезирован 9-деоксо-9а-метил-9а-аза-9а-гомоэритромицин A (AZITHROMYCIN), прототип нового класса азалидных антибиотоков (Kobrehel G. et al., BE 892375, 7/1982). Кроме широкого спектра противомикробной активности, включающего грамотрицательные бактерии, азитромицин также характеризовался длинным биологическим временем полужизни, специфическим механизмом переноса к месту применения и коротким периодом терапевтического действия. Азитромицин способен проникать и аккумулироваться в фагоцитарных клетках человека, что приводит к улучшению активности в отношении внутриклеточных патогенных микроорганизмов рода Legionella, Chlamydia и Helicobacter. Кроме того известно, что С-6/С-12 спироциклизация эритромицина А также ингибируется O-метилированием С-6 гидроксильной группы агликонового кольца (Watanabe Y. et al., патент США 4331803 5/1982). При взаимодействии эритромицика А с бензоксикарбонилхлоридом с последующим метилированием полученного 2′-О, 3′-N-бис(бензилоксикарбонил)производного, удалении защитных групп и 3′-N-метилировании образуется 6-O-метилэритромицин A (CLARITHROMYCIN) (Morimoto S. еt al., J. Antibiotics, 1984, 37, 187). По сравнению с эритромицином А кларитромицин считается более стабильным в кислой среде и показывает повышенную активность in vitro против грамположительных видов бактерий (Kirst Н.А. et al., Antimicrobial Agents and Chemother., 1989, 1419). Новые исследования в области 14-членных макролидов привели к появлению нового типа макролидных антибиотиков, а именно кетолидов, характеризующихся 3-кетогруппой вместо нейтрального сахара L-кладинозы, причем последний хорошо известен в связи со своей нестабильностью даже в слабокислой среде (Agouridas С. et al., ЕР 596802 A1, 5/1994, Le Martret O., FR 2697524 A1/ 5/94). Кетолиды проявляют значительно улучшенную активность in vitro по сравнению с MLS (макролид, линкозамид и стрептограмин В), индуцированную устойчивыми микроорганизмами (Jamjian С. , Antimicrob. Agents Chemother., 1997, 41, 485). Европейский патент А-0507595 раскрывает 8а-аза-8а-гомоэритромициновые лактамы, отличающиеся от соединений настоящего изобретения тем, что они не имеют метоксигруппы в положении 6, что значительно меняет химические и биологические свойства молекулы. С учетом известных и установленных фактов предшествующего уровня техники, в последнем не обсуждались 15-членные кетоазалиды класса 6-O-метил-8а-аза-8а-гомо- и 6-O-метил-9а-аза-9а-гомоэритромицина А и их фармацевтически приемлемые соли присоединения органических и неорганических кислот, способы и промежуточные продукты их получения, а также способы получения фармацевтических препаратов и их использование. Предмет настоящего изобретения включает перегруппировку Бэкмана 9(Е)- и 9(Z)оксима 6-O-метилэритромицина А, гидролиз кладиноза в таким образом полученных 8а- и 9а-лактамах, защиту гидроксильных групп в 2′-положении дезозамина, окисление 3-гидроксильной группы и удаление защитных групп, причем получают новые, ранее не описанные 15-членные кетоазалиды из класса 6-O-метил-8а-аза-8а-гомо- и 6-O-метил-9а-аза-9а-гомоэритромицина А. Техническое решение Новые 15-членные кетоазалиды из класса 6-O-метил-8а-аза-8а-гомо- и 6-O-метил-9а-аза-9а-гомоэритромицина А общей формулы (I) 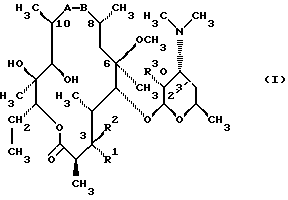 где А представляет NH-группу и В при этом представляет собой С=O-группу либо А представляет С=O-группу, и В при этом представляет собой NH-группу, R1 представляет ОН-группу, L-кладинозильную группу формулы (II) 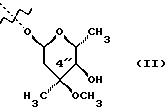 или вместе с R2 представляет собой кетон, R2 представляет водород или вместе с R1 представляет кетон, R3 представляет собой водород или C1-C4 алканоильную группу, и их фармацевтически приемлемые соли присоединения неорганических или органических кислот получают следующим образом. Стадия 1.: Первая стадия изобретения включает оксимирование С-9 кетона 6-O-метилэритромицина А (кларитромицина) формулы (III) 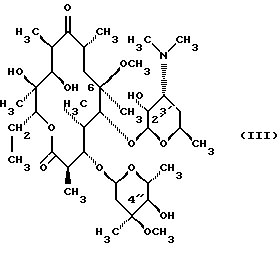 в соответствующий оксим. Превращение кетона в оксим является хорошо известной реакцией, обычно проводимой с гидроксиламингидрохлоридом в присутствии соответствующего неорганического и органического основания в подходящем протонном и апротонном растворителе. Гидроксиламина гидрохлорид используется в 1-15-эквимолярном избытке, предпочтительно в 10-эквимолярном избытке, по отношению к кларитромицину. В качестве подходящих оснований используются гидроксиды, карбонаты, гидрокарбонаты и ацетаты щелочных металлов, тогда как в качестве растворителей используются C1-С3 спирты. Предпочтительным основанием является карбонат натрия или ацетат натрия и предпочтительным растворителем является метанол. Обычно реакция проводится при температуре от 0 до 80oС, предпочтительно при 65oС, в течение от 2 часов до нескольких дней, но в основном она протекает от 8 до 20 часов. Обработка проводится обычным способом, например выпариванием растворителя в вакууме, добавлением смеси воды и органического растворителя с последующей экстракцией в щелочной среде предпочтительно при рН 8,0-10,0. В качестве растворителей для экстракции продукта используются метиленхлорид, хлороформ, этилацетат, диэтиловый эфир и толуол, причем предпочтительным является хлороформ. Продукт выделяют отделением органического слоя и выпариванием растворителя, что дает смесь 6-O-метилэритромицина А 9(Е)- и 9(Z)-оксима формулы (IV) 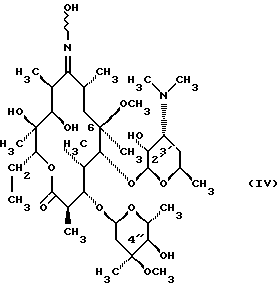 в соотношении около 1:1. Если необходимо, разделение изомеров проводится с помощью хроматографии на колонке из силикагеля, с использованием системы метиленхлорид – метанол – гидрохлорид аммония 90:9:1,5, что дает хроматографически однородный 6-O-метилэритромицин А 9(Е)-оксим с Rf 0,446 формулы (IVa) 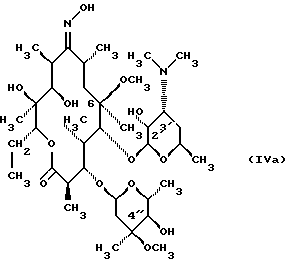 и хроматографически однородный 6-O-метилэритромицин A 9(Z)-оксим с Rf 0,355 формулы (IVb) 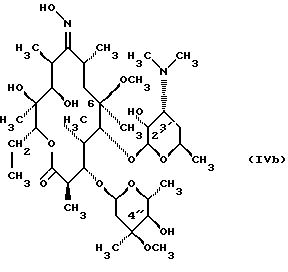 Стадия 2 Превращение 6-O-метилэритромицина А 9(Е)-оксима формулы (IVa) в 6-O-метил-9а-9-аза-9а-гомоэритромицин А общей формулы (I) 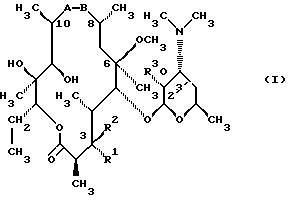 где А представляет собой группу NH, а В представляет собой С=O-группу, R1 представляет L-кладинозильную группу формулы (II) 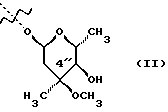 R2 и R3 одинаковые и представляют собой водород, осуществляется с помощью реакции перегруппировки Бэкмана (смотри “Comprehensive Organic Chemistry”, I.O. Sutherland (Ed)., Pergamon Press, New York, 1979, vol. 2, 398-400 and 967-968). В общем, перегруппировка Бэкмана кетоксима дает карбоксамид или, в случае циклических систем, лактам. Механизм перегруппировки включает преимущественно превращение оксимгидроксила в более легко удаляемую группу, которая на второй реакционной стадии отщепляется при одновременной миграции атома углерода в противоположение по отношению к удаляемой группе. В водной среде в качестве промежуточного продукта образуется ион нитрилия, который взаимодействует с водой, давая соответствующий амид. Реакция перегруппировки Бэкмана протекает в условиях кислой, нейтральной и щелочной среды. Обычные кислотные реактивы, катализирующие перегруппировку, включают концентрированную серную кислоту, полифосфорную кислоту, тионилхлорид, пентахлорид фоcфора, диоксид серы и муравьиную кислоту. Благодаря чувствительности макролидной молекулы в кислой среде и в особенности благодаря легкости отщепления нейтрального сахара L-кладинозы, эти реактивы не подходят для перегруппировки оксима формулы (IVа)в 6-O-9а-аза-9а-гомоэритромицин А общей формулы (I), где А, В, R1, R2 и R3 имеют вышеприведенные значения. Предпочтительно перегруппировка Бэкмана оксима (IVa) проводится путем начального O-сульфонирования оксимгидроксила алкилсульфонилгалогенидами, арилсульфонилгалогенидами или арилсульфонилангидридами. Промежуточный оксимсульфонат выделяют или, обычно, перегруппировка в желаемый продукт проводится in situ. В общем, сульфонирование и перегруппировка проводятся в присутствии органического или неорганического основания. Предпочтительные реагенты для сульфонирования, катализирующие перегруппировку оксима (IVа), включают метансульфонилхлорид, бензолсульфонилхлорид, 4-ацетиламидосульфонилхлорид, пара-толуолсульфонилхлорид, ангидриды бензолсульфоновой и пара-толуолсульфоновой кислоты. Реакция проводится в присутствии неорганических оснований, таких как гидрокарбонат натрия или карбонат калия, или в присутствии органических оснований, таких как пиридин, 4-диметиламинопиридин, триэтиламин и N,N-диизопропиламин. Подходящие растворители включают водные смеси, такие как смесь ацетон-вода и смесь диоксан-вода, и органические растворители, такие как метиленхлорид, хлороформ, этилацетат, диэтиловый эфир, тетрагидрофуран, толуол, ацетонитрил и пиридин. В общем, реакция проводится с использованием 1-3 эквимолярного избытка сульфонирующего агента и с таким же или большим эквимолярного количества основания при температуре от -20 до 50oС. Пиридин часто используется в качестве растворителя и одновременно в качестве основания. Предпочтительно перегруппировка Бэкмана оксима (IVa) проводится в смеси ацетонитрил-вода с двойным эквимолярным избытком пара-толуолсульфохлорида и гидрокарбоната натрия. При необходимости продукт очищают с помощью хроматографии на колонке из силикагеля с использованием системы растворителей метиленхлорид – метанол – гидроксид аммония 90:9:1,5, получая хроматографически однородный 6-O-метил-9а-аза-9а-гомоэритромицин А. Перегруппировка Бэкмана 6-O-метилэритромицина A 9(Z)-оксима формулы (IVb) в 6-O-8а-аза-8а-гомоэритромицин А общей формулы (I), где А представляет собой группу С= O, а В представляет группу NH, R1 представляет собой L-кладинозильную группу формулы (II) и R2 и R3 одинаковы и представляют собой водород, проводится таким же образом, как с 9(Е)-оксимом (IVа). Стадия 3. 6-O-Метил-9а-аза-9а-гомоэритромицин А или 6-O-метил-8а-аза-8а-гомоэритромицин А стадии 2 общей формулы (I), где А, В, R1, R2 и R3 имеют вышеприведенные значения, подвергают, если возможно, воздействию сильных кислот, предпочтительно 0,25-1,5 н. хлористоводородной кислоты, при комнатной температуре в течение 10-30 часов, получая 3-O-декладинозил-3-оксипроизводные 6-O-метил-9а-аза-9а-гомоэритромицина А или 6-O-8а-аза-8а-гомоэритровицина А общей формулы (I), где А представляет собой NH-группу, а В представляет собой С=O-группу, либо А представляет С=O-группу, а В представляет собой NH-группу, R1 представляет ОН-группу, и R2 и R3 одинаковы и представляют собой водород. Стадия 4. 3-O-Декладинозил-3-окси-6-O-9а-аза-9а-гомоэритромицин А или 6-O-метил-8а-аза-8а-гомоэритромицин А стадии 3 общей формулы (I), где А, В, R1, R2 и R3 имеют вышеприведенные значения, подвергают, если возможно, реакции селективного ацилирования гидроксильной группы в 2′-положении дезозамина. Ацилирование проводится с использованием карбоновых кислот, имеющих до 4 атомов углерода, предпочтительно ангидрида уксусной кислоты, в присутствии неорганических или органических оснований в инертном органическом растворителе при температуре от 0 до 30oС, получая 2′-O-ацетат 3-декладинозил-3-окси-6-O-метил-9а-аза-9а-гомоэритромицина А или 2′-ацетат 3-декладинозил-3-окси-6-O-метил-8а-аза-8а-гомоэритромицина А общей формулы (I), где А представляет собой NH-группу, а В представляет собой С=O-группу, или А представляет собой С=O-группу, а В представляет собой NH-группу, R1 представляет собой ОН-группу, R2 представляет собой водород и R3 представляет собой ацетил. В качестве подходящих оснований используются гидрокарбонат натрия, карбонат натрия, карбонат калия, триэтиламин, пиридин, трибутиламин, предпочтительно гидрокарбонат натрия. В качестве подходящего инертного растворителя используется метиленхлорид, дихлорэтан, ацетон, пиридин, этилацетат, тетрагидрофуран, предпочтительно метиленхлорид. Стадия 5. 3-Декладинозил-3-окси-6-O-метил-9а-аза-9а-гомоэритромицина А 2′-O-ацетат или 3-O-декладинозил-3-окси-6-O-метил-8а-аза-8а-гомоэритромицина А 2′-ацетат стадии 4 общей формулы (I), где А, В, R1, R2 и R3 имеют вышеприведенные значения, подвергают, если возможно, окислению гидроксильной группы по С-3 положению агликонового кольца в соответствии с модифицированным способом Моффат-Пфитнера (Moffat-Pfitzner) с N, N-диметиламинопропилэтилкарбодиимидом в присутствии диметилсульфоксида и трифторацетатом пиридиния в качестве катализатора, в инертном органическом растворителе, предпочтительно в метиленхлориде, при температуре от 10oС до комнатной температуры, получая 3-декладинозил-3-оксо-6-O-метил-9а-аза-9а-гомоэритромицина А 2′-O-ацетат или 3-декладинозил-3-оксо-6-O-метил-8а-аза-8а-гомоэритромицина А 2′-ацетат общей формулы (I), где А представляет собой NH-группу, а В представляет собой С=O-группу, либо А представляет собой С=O-группу, а В представляет собой NH-группу, R1 и R2 вместе представляют собой кетон и R3 представляет собой ацетильную группу. Стадия 6. 3-Декладинозил-3-оксо-6-O-метил-9а-аза-9а-гомоэритромицина А 2′-O-ацетат или 3-декладинозил-3-оксо-6-O-метил-8а-аза-8а-гомоэритромицина А 2′-ацетат стадии 5 общей формулы (I), где А, В, R1, R2 и R3 имеют вышеприведенные значения, затем подвергают сольволизу в низших спиртах, предпочтительно в метаноле, при температуре растворителя от комнатной температуры до температуры кипения с обратным холодильником, получая 3-декладинозил-3-оксо-6-O-метил-9а-аза-9а-гомоэритромицин А или 3-декладинозил-3-оксо-6-O-метил-8а-аза-8а-гомоэритромицина А общей формулы (I), где А представляет собой NH-группу, а В представляет собой С=O-группу, или А представляет собой С=O-группу, а В представляет собой NH-группу, R1 и R2 вместе представляют собой кетон и R3 представляет собой водород. Фармацевтически приемлемые соли присоединения, которые также являются предметом настоящего изобретения, получают взаимодействием новых соединений класса 6-O-метил-8а-аза-8а-гомоэритромицина А и 6-O-9а-аза-9а-гомоэритромицина А общей формулы (I), где А, В, R1, R2 и R3 имеют вышеприведенные значения, с по крайней мере эквимолярным количеством соответствующей неорганической или органической кислоты, такой как хлористоводородная, йодистоводородная, серная, фосфорная, уксусная, пропионовая, трифторуксусная, малеиновая, лимонная, стеариновая, янтарная, этилянтарная, метансульфоновая, бензолсульфоновая, пара-толуолсульфоновая и лаурилсульфоновая кислоты, в растворителе, инертном по отношению к реакции. Соли присоединения выделяют фильтрацией, если они нерастворимы в растворителе, инертном по отношению к реакции, осаждением с помощью нерастворителя или выпариванием растворителя, в основном способом лиофилизации. Противобактериальное действие in vitro новых соединений общей формулы (I), где А, В, R1, R2 и R3 имеют вышеприведенные значения, или их фармацевтически приемлемых солей присоединения с неорганическими или органическими кислотами определяют с набором стандартных тестовых микроорганизмов и клинических изолятов способом микроразбавления в соответствии с протоколом NCCLS (The National Commitee for Clinical Laboratory Standards, Document M7-F2, vol. 10, No 8, 1990, and Document M110F2, vol. 10, 15, 1991). Контроль лабораторного процесса производился с помощью контрольного штама Staphyloccocus aureus ATTC 29213 (The American Type Culture Collection) в соответствии с протоколом NCCLS (Document M7-F2, Table 3, M100-S4). Противобактериальная активность in vitro с набором тестовых микроорганизмов для 6-O-метил-8а-аза-8а-гомоэритромицина А из примера 3 в сравнении с азитромицином, эритромицином и кларитромицином представлены в табл. 1. Соединения по настоящему изобретению отличаются от соединений, описанных в вышеуказанных документах уровня техники тем, что они имеют метокси (ОСН3)-группу в положении 6 вместо гидрокси (ОН)-группы. Замещение группы ОН группой ОСН3 в положении 6 значительно меняет химические и биологические свойства молекулы. Сравнивая, например, биологическую активность 6-O-метил-8а-лактама по настоящему изобретению с 6-гидрокси-8а-лактамом, можно видеть, что введение ОСН3 вместо группы ОН в положении 6 увеличивает биологическую активность в отношении грамотрицательных бактерий. Так, при сравнении табл. 1 настоящей заявки с данными, представленными в табл. 1, соединение 5, Wilkening et al., Bioorg. Med. Chem. Lett. (1993), 3(6): 1287-1292, и ЕР-595 ясно, что различие между антимикробной активностью, представленной в виде минимальной ингибирующей концентрации в цитируемых публикациях, и активностью по настоящей заявке можно обобщить следующим образом (табл. 1а). Также при сравнении эритромицина с кларитромицином: Sasaki et al., J. Antibiot. (1988), 41 (7): 908-915,, и патент США 4680386, Marimoto et al. (табл. 2, соединение I). Кроме того, ОН- и ОСН3-группы по разному влияют на физико-химические свойства (например, электроотрицательность, проводимость, способность к образованию конформаций и водородной связи, стабильность в кислой среде и т.д. ) Авторы настоящего изобретения получили 3-кетопроизводное 6-метокси-8-лактама, обладающее хорошей активностью против индуцибельных резистентных штаммов. Это, в частности, подтверждается, например, следующими значениями МИК (мг/л) для S. aureus ATCC 27660 (iMLS): Азитромицин – 8 6-Метокси-8а-лактам – >128 6-O-Метил-8а-лактам – >128 3-Кетопроизводное 6-O-метил-8а-лактама – 1 Это также подтверждается in vivo активностью. Важное значение 3-кетофункции для активности в отношении индуцибельных резистентных штаммов подтверждается также и данными, представленными для других кетолидов (см. Agouridas et al., J. Med. Chem. (1998), 41: 4080-4100). Следует отметить также, что в случае 6-гидроксизаместителя получить 3-кетопроизводное (кетолиды) невозможно из-за образования неактивного 3,6-полукетального производного или циклических эфиров (вновь образованная 3-кетогруппа взаимодействует с 6-гидроксигруппой). Примером вышесказанного является азитромицин и его O-метильное производное, представленное в Kobrehel et al., WO 99/20639. Введение метоксигруппы также не было химически очевидным. Из литературы известно, что замещение в положении 6 не является прямым замещением из-за присутствия других гидроксигрупп в молекуле, которые также могут быть метилированы. Это зависит от условий реакции, а также от конформации агликонового кольца, положение которого должно быть метилировано (см. Watanabe et al. , (1993), J. Antibiot., 46(4): 647-660, и Wadel et al., (1998), Bioorg. Med. Chem. Lett., 8: 1321-1326). Дополнительная антибактериальная активность некоторых соединений очевидна из приведенной табл. 2. Цитотоксичность соединений по настоящему изобретению представлена в приведенной табл. 3, из которой очевидно, что ни одно соединение не является токсичным. Цитотоксичность определяли на четырех линиях клеток: ТНР-1, COS-7, HepG и CHO. 50000 клеток на лунку инкубировали в течение 20 часов (37oС; 5% СO2) с испытываемыми соединениями. Соединения испытывали в 10 различных концентрациях (пределы концентраций 62,5 нг/мл – 64 мкг/мл). Использовали среду DMEM, дополненную 5% фетальной бычьей сыворотки. Цитотоксический эффект определяли спектрофотометрически (490 нм) с использованием МТТ в качестве субстрата. В свете вышесказанного ясно что изобретение не является очевидным для среднего специалиста и предлагает более активные, нежели известные аналоги соединения. Пример 1 Получение 6-O-метилэритромицина А 9(Е)- и 9(Z)-оксима Способ А 6-O-Метилэритромицин А (2,0 г, 0,003 моль) в метаноле (100 мл) нагревают до температуры кипения с обратным холодильником, добавляют гидроксиламина гидрохлорид (2,0 г, 0,03 моль) и карбонат натрия (0,2 г, 0,002 моль) и нагревают при кипячении с обратным холодильником при перемешивании в течении 3 часов. Затем повторно добавляют такое же количество гидроксиламина гидрохлорида и карбоната натрия и нагревают при кипячении с обратным холодильником еще в течение 6 часов. Метанол выпаривают при пониженном давлении и затем добавляют воду (200 мл) и хлороформ (100 мл), рН доводят до 9,8, слои разделяют и водный слой экстрагируют еще два раза хлороформом. Объединенные органические экстракты сушат над карбонатом калия, фильтруют и выпаривают при пониженном давлении, получая 2,0 г смеси названных в заголовке продуктов. С помощью хроматографии на колонке из силикагеля с использованием системы метиленхлорид – метанол – конц. гидрохлорид аммония, 90:9:1,5, получают 0,63 г хроматографически однородного 6-O-метилэритромицина А 9(Е)-оксима с Rf 0,446 и 0,61 г хроматографически однородного 6-O-метилэритриомоцина А 9(Z)-оксима с Rf 0,355. 9(Е)-Oксим: Rf 0,418, этилацетат-н-гексан-диэтиламин, 100:100:20. ИК (КВr), см-1: 3449, 2974, 2939, 2832, 2788, 1735, 1638, 1459, 1379, 1348, 1169, 1112, 1054, 1012, 957, 835, 755. 1H ЯМР (300 МГц, CDCl3)  : 5,11 (Н-13), 4,95 (Н-1”), 4,45 (Н-1′), 4,03 (Н-5”), 3,77 (Н-8), 3,76 (Н-3), 3,75 (Н-11), 3,66(Н-5), 3,48(Н-5′), 3,33 (3”-ОСН3), 3,24 (Н-2′), 3,10 (6-ОСН3),3,03 (Н-4”), 2,89 (Н-2), 2,57 (Н-10), 2,45 (Н-3′), 2,37 (Н-2”а), 2,31 [3′-N(СН3)2], 1,93 (Н-4), 1,93 (Н-14а), 1,68 (Н-4’а), 1,58 (H-2”b), 1,53 (Н-7а), 1,48 (6-СН3), 1,46 (H-14b), 1,31 (5”-СН3), 1,25 (3”-СН3), 1,23 (5′-СН3), 1,20 (2-СН3), 1,13 (10-СН3), 1,13 (12-СН3), 1,08 (4-СН3), 1,00 (8-СН3), 0,86 (15-СН3).
13С ЯМР (75 МГц, СDСl3) : 5,11 (Н-13), 4,95 (Н-1”), 4,45 (Н-1′), 4,03 (Н-5”), 3,77 (Н-8), 3,76 (Н-3), 3,75 (Н-11), 3,66(Н-5), 3,48(Н-5′), 3,33 (3”-ОСН3), 3,24 (Н-2′), 3,10 (6-ОСН3),3,03 (Н-4”), 2,89 (Н-2), 2,57 (Н-10), 2,45 (Н-3′), 2,37 (Н-2”а), 2,31 [3′-N(СН3)2], 1,93 (Н-4), 1,93 (Н-14а), 1,68 (Н-4’а), 1,58 (H-2”b), 1,53 (Н-7а), 1,48 (6-СН3), 1,46 (H-14b), 1,31 (5”-СН3), 1,25 (3”-СН3), 1,23 (5′-СН3), 1,20 (2-СН3), 1,13 (10-СН3), 1,13 (12-СН3), 1,08 (4-СН3), 1,00 (8-СН3), 0,86 (15-СН3).
13С ЯМР (75 МГц, СDСl3)  : 175,5 (С-1), 169,2 (С-9), 102,5 (С-1′), 95,7 (С-1”), 80,2 (С-5), 78,4 (С-6), 78,0 (С-3), 77,8 (С-4”), 76,5 (С-13), 73,8 (С-12), 72,4 (С-3”), 71,1 (С-2′), 70,0 (С-11), 68,2 (С-5′), 65,2 (С-5”), 64,9 (С-3′), 50,8 (6-ОСН3), 49,1(3”-ОСН3), 44,7 (С-2), 40,1 [3′-N(СН3)2], 38,7 (С-4), 37,0 (С-7), 34,6 (С-2”), 32,3 (С-10), 29,4 (С-4′), 24,9 (6-8), 21,1 (5′-СН3), 21,0 (3”-СН3), 20,8 (С-14), 19,6 (6-СН3), 18,3 (5”-СН3), 18,2 (8-СН3), 15,7 (12-СН3), 15,6 (2-СН3), 14,6 (10-СН3), 10,2 (15-СН3), 8,8 (4-СН3).
9(Z)-Oксим: : 175,5 (С-1), 169,2 (С-9), 102,5 (С-1′), 95,7 (С-1”), 80,2 (С-5), 78,4 (С-6), 78,0 (С-3), 77,8 (С-4”), 76,5 (С-13), 73,8 (С-12), 72,4 (С-3”), 71,1 (С-2′), 70,0 (С-11), 68,2 (С-5′), 65,2 (С-5”), 64,9 (С-3′), 50,8 (6-ОСН3), 49,1(3”-ОСН3), 44,7 (С-2), 40,1 [3′-N(СН3)2], 38,7 (С-4), 37,0 (С-7), 34,6 (С-2”), 32,3 (С-10), 29,4 (С-4′), 24,9 (6-8), 21,1 (5′-СН3), 21,0 (3”-СН3), 20,8 (С-14), 19,6 (6-СН3), 18,3 (5”-СН3), 18,2 (8-СН3), 15,7 (12-СН3), 15,6 (2-СН3), 14,6 (10-СН3), 10,2 (15-СН3), 8,8 (4-СН3).
9(Z)-Oксим:Rf 0,300, этилацетат-н-гексан-диэтиламин, 100:100:20. ИК (КВr), cм-1: 3433, 2973, 2939, 2832, 1733, 1638, 1459, 1379, 1348, 1286, 1169, 1114, 1054, 1011, 958, 892, 755. 1H ЯМР (300 МГц, СDСl3)  : 5,07 (Н-13), 4,93 (Н-1”), 4,43 (Н-1′), 4,03 (Н-5”), 3,98 (Н-11), 3,77 (Н-3), 3,62 (Н-5), 3,48 (Н-5′), 3,33 (3”-ОСН3), 3,21 (Н-2′), 3,09 (6-ОСН3), 3,06 (Н-4”), 2,88 (Н-2), 2,74 (Н-8), 2,65 (Н-10), 2,45 (Н-3′), 2,36 (Н-2”а), 2,30 [3′-N(СН3)2], 1,96 (Н-4), 1,94 (Н-14а), 1,76 (H-14b), 1,67 (Н-4’а), 1,59 (H-2”b), 1,58 (Н-7а), 1,47 (H-7b), 1,38 (6-СН3), 1,32 (10-СН3), 1,31 (5”-СН3), 1,25 (3”-СН3), 1,24 (5′-СН3), 1,19 (2-СН3), 1,14 (12-СН3), 1,07 (4-СН3), 1,06 (8-СН3), 0,84 (15-СН3).
13С ЯМР (75 МГц, СDСl3) : 5,07 (Н-13), 4,93 (Н-1”), 4,43 (Н-1′), 4,03 (Н-5”), 3,98 (Н-11), 3,77 (Н-3), 3,62 (Н-5), 3,48 (Н-5′), 3,33 (3”-ОСН3), 3,21 (Н-2′), 3,09 (6-ОСН3), 3,06 (Н-4”), 2,88 (Н-2), 2,74 (Н-8), 2,65 (Н-10), 2,45 (Н-3′), 2,36 (Н-2”а), 2,30 [3′-N(СН3)2], 1,96 (Н-4), 1,94 (Н-14а), 1,76 (H-14b), 1,67 (Н-4’а), 1,59 (H-2”b), 1,58 (Н-7а), 1,47 (H-7b), 1,38 (6-СН3), 1,32 (10-СН3), 1,31 (5”-СН3), 1,25 (3”-СН3), 1,24 (5′-СН3), 1,19 (2-СН3), 1,14 (12-СН3), 1,07 (4-СН3), 1,06 (8-СН3), 0,84 (15-СН3).
13С ЯМР (75 МГц, СDСl3)  : 176,0 (С-1), 167,4 (С-9), 102,7 (С-1′), 96,0 (С-1”), 80,4 (С-5), 78,7 (С-6), 78,5 (С-3), 77,8 (С-4”), 76,9 (С-13), 74,7 (С-12), 72,6 (С-3”), 70,9 (С-2′), 70,3 (С-11), 68,4 (С-5′), 65,5 (С-5”), 65,3 (С-3′), 50,0 (6-ОСН3), 49,3 (3”-ОСН3), 45,0 (С-2), 41,0 [3′ -N(СН3)2], 38,9 (С-4), 37,0 (С-7), 35,6 (С-8), 34,7 (С-2”), 34,1 (С-10), 28,9 (С-4′), 21,3 (3”-СН3), 21,2 (5′-СН3), 21,1 (С-14), 19,7 (6-СН3), 19,6 (8-СН3), 18,5 (5”-СН3), 16,4 (12-СН3), 15,7 (2-СН3), 10,7 (10-СН3), 10,4 (15-СН3), 9,8 (15-СН3).
Способ В : 176,0 (С-1), 167,4 (С-9), 102,7 (С-1′), 96,0 (С-1”), 80,4 (С-5), 78,7 (С-6), 78,5 (С-3), 77,8 (С-4”), 76,9 (С-13), 74,7 (С-12), 72,6 (С-3”), 70,9 (С-2′), 70,3 (С-11), 68,4 (С-5′), 65,5 (С-5”), 65,3 (С-3′), 50,0 (6-ОСН3), 49,3 (3”-ОСН3), 45,0 (С-2), 41,0 [3′ -N(СН3)2], 38,9 (С-4), 37,0 (С-7), 35,6 (С-8), 34,7 (С-2”), 34,1 (С-10), 28,9 (С-4′), 21,3 (3”-СН3), 21,2 (5′-СН3), 21,1 (С-14), 19,7 (6-СН3), 19,6 (8-СН3), 18,5 (5”-СН3), 16,4 (12-СН3), 15,7 (2-СН3), 10,7 (10-СН3), 10,4 (15-СН3), 9,8 (15-СН3).
Способ В6-O-Метилэритромицин А (10,8 г, 0,014 моль) в метаноле (800 мл) нагревают при температуре кипячения с обратным холодильником, затем к реакционному раствору добавляют гидроксиламина гидрохлорид (27,0 г, 0,388 моль) и безводный ацетат натрия (15,0 г, 0,183 моль) четырьмя порциями за 10 часов и затем нагревают при кипячении с обратным холодильником при перемешивании в течение еще 8 часов. Метанол выпаривают при пониженном давлении, добавляют воду (1500 мл) и метиленхлорид (200 мл) и экстрагируют градиентной экстракцией при рН 5,0 и 9,8. Объединенные органические экстракты при рН 9,8 сушат над карбонатом калия, фильтруют и выпаривают при пониженном давлении, получая 9,5 г смеси названных в заголовке продуктов. С помощью хроматографии на колонке из силикагеля с использованием системы метиленхлорид – метанол – конц. гидрохлорид аммония, 90:9:1,5, получают хроматографически однородный 6-O-метиленэритромицина А 9(Е)-оксим и 6-O-метилэритромицина А 9(Z)-оксим с физико-химическими константами, идентичными тем, которые получены в способе А. Пример 2 Перегруппировка Бэкмана 6-O-метилэритромицина А 9(Е)-оксима 6-O-Метилэритромицина А 9(Е)-оксим из примера 1 (4,0 г, 0,005 моль) растворяют в ацетоне (130 мл) и раствор охлаждают до 0-5oС. Последовательно по каплям в течение 1 часа при перемешивании добавляют растворы пара-толуолсульфохлорида (2,6 г, 0,01 моль) в ацетоне (40 мл) и гидрокарбоната натрия (0,830 г, 0,01 моль) в воде (130 мл). Реакционную смесь перемешивают при комнатной температуре в течение 8 часов, ацетон выпаривают при пониженном давлении и добавляют водный раствор хлороформа (40 мл), после чего экстрагируют градиентной экстракцией при рН 5,0 и 9,0. Объединенные органические экстракты при рН 9,0 выпаривают, получая 2,8 г 6-O-метил-9а-аза-9а-гомоэритромицина А. Rf 0,218, этилацетат-н-гексан-диэтиламин, 100:100:20. ИК (КВr), см-1: 3449, 2974, 2939, 2834, 1734, 1706, 1659, 1534, 1459, 1379, 1274, 1169, 1111, 1053, 1011, 958. 1H ЯМР (300 МГц, СDСl3)  : 6,12 (9a-CONH), 4,85 (Н-1”), 4,68 (Н-13), 4,45 (Н-1′), 4,21 (Н-3), 4,16 (Н-10), 4,07 (Н-5”), 3,75(Н-5), 3,49 (Н-5′), 3,34 (3”-ОСН3), 3,32 (6-ОСН3), 3,22 (Н-11), 3,20 (Н-2′), 3,04 (Н-4”), 2,83 (Н-2), 2,43 (Н-3′), 2,38 (Н-2”а), 2,30 [3′-N(СН3)2], 2,22 (Н-8), 2,07 (Н-7а), 1,87 (Н-4), 1,87 (Н-14а), 1,67 (Н-4’а), 1,57 (H-2”b), 1,57 (H-14b), 1,36 (6-СН3), 1,33 (H-7b), 1,32 (5”-СН3), 1,25 (3”-СН3), 1,24 (H-4’b), 1,23 (5′-СН3), 1,23 (2-СН3), 1,18 (12-СН3), 1,16 (10-СН3), 1,09 (8-СН3), 1,02 (4-СН3), 0,89 (15-СН3).
13С ЯМР (75 МГц, СDСl3) : 6,12 (9a-CONH), 4,85 (Н-1”), 4,68 (Н-13), 4,45 (Н-1′), 4,21 (Н-3), 4,16 (Н-10), 4,07 (Н-5”), 3,75(Н-5), 3,49 (Н-5′), 3,34 (3”-ОСН3), 3,32 (6-ОСН3), 3,22 (Н-11), 3,20 (Н-2′), 3,04 (Н-4”), 2,83 (Н-2), 2,43 (Н-3′), 2,38 (Н-2”а), 2,30 [3′-N(СН3)2], 2,22 (Н-8), 2,07 (Н-7а), 1,87 (Н-4), 1,87 (Н-14а), 1,67 (Н-4’а), 1,57 (H-2”b), 1,57 (H-14b), 1,36 (6-СН3), 1,33 (H-7b), 1,32 (5”-СН3), 1,25 (3”-СН3), 1,24 (H-4’b), 1,23 (5′-СН3), 1,23 (2-СН3), 1,18 (12-СН3), 1,16 (10-СН3), 1,09 (8-СН3), 1,02 (4-СН3), 0,89 (15-СН3).
13С ЯМР (75 МГц, СDСl3)  : 179,5 (С-1), 177,3 (С-9), 102,5 (С-1′), 94,9 (С-1”), 79,1 (С-6), 78,5 (С-5), 77,7 (С-4”), 77,7 (С-13), 75,9 (С-3), 73,9 (С-12), 72,5 (С-3”), 72,6 (С-11), 70,7 (С-2′), 68,2 (С-5′), 65,3 (С-5”), 65,1 (С-3′), 51,0 (6-ОСН3), 49,1 (3”-ОСН3), 45,1 (С-10), 44,5 (С-2), 41,3 (С-4), 40,0 [3′-N(СН3)2], 39,6 (С-7), 35,4 (С-8), 34,4 (С-2”), 28,8 (С-4′), 21,1 (5′-СН3), 21,0 (3”-СН3), 20,3 (С-14), 20,2 (6-СН3), 19,1 (8-СН3), 18,1 (5”-СН3), 15,9 (12-СН3), 14,6 (2-СН3), 13,4 (10-СН3), 10,7 (15-СН3), 8,7 (4-СН3).
Пример 3 : 179,5 (С-1), 177,3 (С-9), 102,5 (С-1′), 94,9 (С-1”), 79,1 (С-6), 78,5 (С-5), 77,7 (С-4”), 77,7 (С-13), 75,9 (С-3), 73,9 (С-12), 72,5 (С-3”), 72,6 (С-11), 70,7 (С-2′), 68,2 (С-5′), 65,3 (С-5”), 65,1 (С-3′), 51,0 (6-ОСН3), 49,1 (3”-ОСН3), 45,1 (С-10), 44,5 (С-2), 41,3 (С-4), 40,0 [3′-N(СН3)2], 39,6 (С-7), 35,4 (С-8), 34,4 (С-2”), 28,8 (С-4′), 21,1 (5′-СН3), 21,0 (3”-СН3), 20,3 (С-14), 20,2 (6-СН3), 19,1 (8-СН3), 18,1 (5”-СН3), 15,9 (12-СН3), 14,6 (2-СН3), 13,4 (10-СН3), 10,7 (15-СН3), 8,7 (4-СН3).
Пример 3Перегруппировка Бэкмана 6-O-метилэритромицина А 9(Z)-оксима 6-O-Метилэритромицина А 9(Z)-оксим из примера 1 (1,4 г, 0,002 моль) растворяют в ацетоне (50 мл) и раствор охлаждают до 0-5oС. Туда же по каплям в течение 1 часа при перемешивании последовательно добавляют растворы пара-толуолсульфохлорида (1,84 г, 0,014 моль) в ацетоне (56 мл) и гидрокарбоната натрия (1,16 г, 0,014 моль) в воде (180 мл). Реакционную смесь перемешивают при комнатной температуре в течение 2 часов, ацетон выпаривают при пониженном давлении и добавляют к водному раствору хлороформа (70 мл), после чего экстрагируют градиентной экстракцией при рН 5,0 и 9,0. Объединенные органические экстракты при рН 9,0 выпаривают, получая 0,80 г продукта, который, если возможно, очищают с помощью хроматографии на колонке силикагеля с использованием системы метиленхлорид – метанол – конц. гидроксид аммония 90: 9: 1/5, получая 6-O-метил-8а-аза-8а-гомоэритромицин А со следующими физико-химическими константами: Rf 0,152, этилацетат-н-гексан-диэтиламин, 100:100:20. ИК (КВr), см-1: 3442, 2974, 2938, 2833, 1736, 1648, 1535, 1459, 1379, 1284, 1169, 1110, 1055, 1013, 960, 902. 1H ЯМР (300 МГц, CDCl3)  : 5,78 (8a-CONH), 5,02 (Н-1”), 4,96 (Н-13), 4,41 (Н-1′), 4,19 (Н-8), 4,02 (Н-5”), 3,96 (Н-3), 3,69 (H-5), 3,51 (Н-11), 3,47 (Н-5′), 3,32 (3”-ОСН3), 3,18 (Н-2′), 3,16 (6-ОСН3), 3,02 (Н-4”), 2,68 (Н-2), 2,44 (Н-3′), 2,35 (Н-2”а), 2,29 [3′-N(СН3)2], 2,22 (Н-10), 1,92 (Н-4), 1,91 (Н-14а), 1,68 (Н-7а), 1,64 (Н-4’а), 1,56 (H-2’b), 1,53 (H-7b), 1,47 (H-14b), 1,39 (6-СН3), 1,29 (5”-СН3), 1,24 (3”-СН3), 1,23 (5′-СН3), 1,20 (2-СН3), 1,18 (10-СН3), 1,13 (12-СН3), 1,13 (8-СН3), 1,07 (4-СН3), 0,88 (15-СН3).
13С ЯМР (75 МГц, СDСl3) : 5,78 (8a-CONH), 5,02 (Н-1”), 4,96 (Н-13), 4,41 (Н-1′), 4,19 (Н-8), 4,02 (Н-5”), 3,96 (Н-3), 3,69 (H-5), 3,51 (Н-11), 3,47 (Н-5′), 3,32 (3”-ОСН3), 3,18 (Н-2′), 3,16 (6-ОСН3), 3,02 (Н-4”), 2,68 (Н-2), 2,44 (Н-3′), 2,35 (Н-2”а), 2,29 [3′-N(СН3)2], 2,22 (Н-10), 1,92 (Н-4), 1,91 (Н-14а), 1,68 (Н-7а), 1,64 (Н-4’а), 1,56 (H-2’b), 1,53 (H-7b), 1,47 (H-14b), 1,39 (6-СН3), 1,29 (5”-СН3), 1,24 (3”-СН3), 1,23 (5′-СН3), 1,20 (2-СН3), 1,18 (10-СН3), 1,13 (12-СН3), 1,13 (8-СН3), 1,07 (4-СН3), 0,88 (15-СН3).
13С ЯМР (75 МГц, СDСl3)  : 177,0 (С-1), 174,3 (С-9), 102,9 (С-1′), 95,1 (С-1”), 80,1 (С-5), 78,6 (С-6), 77,9 (С-4”), 77,2 (С-3), 76,7 (С-13), 74,0 (С-12), 72,6 (С-3”), 70,4 (С-2′), 70,1 (С-11), 68,7 (С-5′), 65,4 (С-3′), 65,2 (С-5”), 51,5 (6-ОСН3), 49,1 (3”-ОСН3), 45,4 (С-2), 42,6 (С-7), 42,1 (С-4), 41,8 (С-10), 40,6 (С-8), 40,0 [3’N-(СН3)2], 34,5 (С-2”), 28,3 (С-4′), 23,5 (6-СН3), 21,3 (С-14), 21,2 (12-СН3), 21,1 (5′-СН3), 21,1 (3”-СН3), 17,9 (5”-СН3), 15,8 (8-СН3), 14,8 (2-СН3), 10,8 (15-СН3), 9,2 (10-СН3), 9,1 (4-СН3).
Пример 4 : 177,0 (С-1), 174,3 (С-9), 102,9 (С-1′), 95,1 (С-1”), 80,1 (С-5), 78,6 (С-6), 77,9 (С-4”), 77,2 (С-3), 76,7 (С-13), 74,0 (С-12), 72,6 (С-3”), 70,4 (С-2′), 70,1 (С-11), 68,7 (С-5′), 65,4 (С-3′), 65,2 (С-5”), 51,5 (6-ОСН3), 49,1 (3”-ОСН3), 45,4 (С-2), 42,6 (С-7), 42,1 (С-4), 41,8 (С-10), 40,6 (С-8), 40,0 [3’N-(СН3)2], 34,5 (С-2”), 28,3 (С-4′), 23,5 (6-СН3), 21,3 (С-14), 21,2 (12-СН3), 21,1 (5′-СН3), 21,1 (3”-СН3), 17,9 (5”-СН3), 15,8 (8-СН3), 14,8 (2-СН3), 10,8 (15-СН3), 9,2 (10-СН3), 9,1 (4-СН3).
Пример 43-Декладинозил-3-окси-6-O-метил-9а-аза-9а-гомоэритромицин А Вещество из примера 2 (1,5 г, 0,002 моль) растворяют в 0,25 н. хлористоводородной кислоте (40 мл) и оставляют на 24 часа при комнатной температуре. К реакционной смеси добавляют метиленхлорид (30 мл) (рН 1,8) и затем рН смеси доводят до 9,0 концентрированным аммиаком, слои разделяют и водный слой дважды экстрагируют метиленхлоридом (30 мл). Объединенные органические экстракты промывают 10% водным раствором гидрокарбоната натрия и водой и затем выпаривают, получая 1,3 г сырого продукта, который, если возможно, очищают с помощью хроматографии на колонке силикагеля, используя систему метиленхлорид – метанол – конц. гидрохлорид аммония 90:9:1,5. Из 0,9 г сырого продукта выделяют 0,65 г хроматографически однородного 3-декладинозил-3-окси-6-O-метил-9а-аза-9а-гомоэритромицина А со следующими физико-химическими константами: Rf 0,152, этилацетат-н-гексан-диэтиламин, 100:100:20. ИК (KBr), см-1: 3438, 2973, 2939, 2879, 2788, 1702, 1658, 1535, 1458, 1373, 1329, 1270, 1173, 1112, 1050, 985, 958, 937. 1H ЯМР (300 МГц, СDСl3)  : 7,16 (9a-CONH), 4,63 (Н-13), 3,81 (Н-5), 4,45 (Н-1′), 4,13 (Н-10), 3,78 (Н-3), 3,55 (Н-5′), 3,30 (Н-ОСН3), 3,25 (Н-2′), 3,16 (Н-11), 2,66 (Н-2), 2,51 (Н-3′), 2,39 (Н-8), 2,26 [3′-N(СН3)2], 2,05 (Н-4), 1,92 (Н-14а), 1,84 (Н-7а), 1,68 (Н-4’а), 1,57 (H-14b), 1,43 (Н-7b), 1,38 (6-СН3), 1,33 (2-СН3), 1,26 (5′-СН3), 1,26 (Н-4’b), 1,20 (10-СН3), 1,12 (12-СН3), 1,11 (8-СН3), 1,01 (4-СН3), 0,91 (15-СН3).
13С ЯМР (75 МГц, CDCl3) : 7,16 (9a-CONH), 4,63 (Н-13), 3,81 (Н-5), 4,45 (Н-1′), 4,13 (Н-10), 3,78 (Н-3), 3,55 (Н-5′), 3,30 (Н-ОСН3), 3,25 (Н-2′), 3,16 (Н-11), 2,66 (Н-2), 2,51 (Н-3′), 2,39 (Н-8), 2,26 [3′-N(СН3)2], 2,05 (Н-4), 1,92 (Н-14а), 1,84 (Н-7а), 1,68 (Н-4’а), 1,57 (H-14b), 1,43 (Н-7b), 1,38 (6-СН3), 1,33 (2-СН3), 1,26 (5′-СН3), 1,26 (Н-4’b), 1,20 (10-СН3), 1,12 (12-СН3), 1,11 (8-СН3), 1,01 (4-СН3), 0,91 (15-СН3).
13С ЯМР (75 МГц, CDCl3)  : 179,3 (С-1), 176,9 (С-9), 106,4 (С-1′), 88,1 (С-5), 79,1 (С-6), 78,7 (С-13), 78,0 (С-3), 73,8 (С-12), 73,9 (С-11), 70,2 (С-2′), 69,7 (С-5′), 65,4 (С-3′), 49,9 (6-ОСН3), 45,6 (С-10), 43,9 (С-2), 40,8 (С-7), 39,9 [3′-N(СН3)2] , 35,6 (С-4), 32,8 (С-7), 27,8 (С-4′), 20,9 (5′-СН3), 20,5 (С-14), 18,3 (6-СН3), 17,4 (8-СН3), 15,8 (12-СН3), 15,9 (2-СН3), 14,8 (10-СН3), 10,7 (15-СН3), 7,5 (4-СН3).
Пример 5 : 179,3 (С-1), 176,9 (С-9), 106,4 (С-1′), 88,1 (С-5), 79,1 (С-6), 78,7 (С-13), 78,0 (С-3), 73,8 (С-12), 73,9 (С-11), 70,2 (С-2′), 69,7 (С-5′), 65,4 (С-3′), 49,9 (6-ОСН3), 45,6 (С-10), 43,9 (С-2), 40,8 (С-7), 39,9 [3′-N(СН3)2] , 35,6 (С-4), 32,8 (С-7), 27,8 (С-4′), 20,9 (5′-СН3), 20,5 (С-14), 18,3 (6-СН3), 17,4 (8-СН3), 15,8 (12-СН3), 15,9 (2-СН3), 14,8 (10-СН3), 10,7 (15-СН3), 7,5 (4-СН3).
Пример 53-Декладинозил-3-окси-6-O-метил-8а-аза-8а-гомоэритромицин А Из вещества (1,5 г, 0,002 моль) из примера 3 получают в соответствии со способом, описанным в примере 4, 1,2 г сырого продукта, который, при возможности, очищают с помощью хроматографии на колонке из силикагеля, используя систему метиленхлорид – метанол – конц. гидроксид аммония 90:9:1,5, получая хроматографически однородный 3-декладинозил-3-окси-6-O-метил-8а-аза-8а-гомоэритромицин А со следующими физико-химическими константами: Rf 0,195, хлороформ – метанол – конц. гидроксид аммония, 6:1:0,1. ИК (КВr), см-1: 3438, 2974, 2939, 2788, 1733, 1648, 1535, 1458, 1378, 1263, 1165, 1113, 1075, 1050, 985, 958, 937. 1H ЯМР (300 МГц, СDСl3)  : 5,58 (9a-CONH), 5,09 (Н-13), 4,38 (Н-1′), 3,76 (Н-5), 3,92 (Н-8), 3,80 (Н-3), 2,64 (Н-2), 3,54(Н-5′), 3,47 (Н-11), 3,25 (Н-2′), 2,11 (Н-4), 3,12 (6-ОСН3), 2,48 (Н-3′), 2,38 (Н-10), 2,25 [3′-N(СН3)2] , 1,94 (Н-14а), 2,11 (Н-7а), 1,66 (Н-4’а), 1,51 (H-7b), 1,50 (H-14b), 1,31 (2-СН3), 1,39 (6-СН3), 1,12 (4-СН3), 1,26 (5′-СН3), 1,26 (H-4’b), 1,20 (10-СН3), 1,25 (8-СН3), 1,13 (12-СН3), 0,88 (15-СН3).
13С ЯМР (75 МГц, СDСl3) : 5,58 (9a-CONH), 5,09 (Н-13), 4,38 (Н-1′), 3,76 (Н-5), 3,92 (Н-8), 3,80 (Н-3), 2,64 (Н-2), 3,54(Н-5′), 3,47 (Н-11), 3,25 (Н-2′), 2,11 (Н-4), 3,12 (6-ОСН3), 2,48 (Н-3′), 2,38 (Н-10), 2,25 [3′-N(СН3)2] , 1,94 (Н-14а), 2,11 (Н-7а), 1,66 (Н-4’а), 1,51 (H-7b), 1,50 (H-14b), 1,31 (2-СН3), 1,39 (6-СН3), 1,12 (4-СН3), 1,26 (5′-СН3), 1,26 (H-4’b), 1,20 (10-СН3), 1,25 (8-СН3), 1,13 (12-СН3), 0,88 (15-СН3).
13С ЯМР (75 МГц, СDСl3)  : 176,0 (С-1), 174,4 (С-9), 106,1 (С-1′), 89,6 (С-5), 77,3 (С-6), 75,8 (С-13), 78,3 (С-3), 74,3 (С-12), 70,3 (С-11), 69,9 (С-2′), 69,4 (С-5′), 64,9 (С-3′), 49,7 (6-ОСН3), 42,1 (С-10), 43,8 (С-2), 41,7 (С-7), 39,9 [3′-N(СН3)2] , 35,2 (С-4), 42,4 (С-8), 27,4 (С-4′), 22,3 (5′-СН3), 20,9 (С-14), 20,4 (6-СН3), 20,5 (8-СН3), 15,7 (12-СН3), 15,2 (2-СН3), 9,5 (10-СН3), 10,1 (15-СН3), 7,50 (4-СН3).
Пример 6 : 176,0 (С-1), 174,4 (С-9), 106,1 (С-1′), 89,6 (С-5), 77,3 (С-6), 75,8 (С-13), 78,3 (С-3), 74,3 (С-12), 70,3 (С-11), 69,9 (С-2′), 69,4 (С-5′), 64,9 (С-3′), 49,7 (6-ОСН3), 42,1 (С-10), 43,8 (С-2), 41,7 (С-7), 39,9 [3′-N(СН3)2] , 35,2 (С-4), 42,4 (С-8), 27,4 (С-4′), 22,3 (5′-СН3), 20,9 (С-14), 20,4 (6-СН3), 20,5 (8-СН3), 15,7 (12-СН3), 15,2 (2-СН3), 9,5 (10-СН3), 10,1 (15-СН3), 7,50 (4-СН3).
Пример 63-Декладинозил-3-окси-6-O-метил-9а-аза-9а-гомоэритромицина А 2′-O-ацетат К раствору 3-декладинозил-3-окси-6-O-метил-9а-аза-9а-гомоэритромицина А (0,750 г, 0,0012 моль) из примера 4 в метиленхлориде (25 мл) добавляют гидрокарбонат натрия (0,440 г, 0,0052 моль) и ангидрид уксусной кислоты (0,128 мл, 0,0013 моль) и перемешивают в течение 3 часов при комнатной температуре. К реакционной смеси добавляют насыщенный раствор гидрокарбоната натрия (30 мл), слои разделяют, и водную часть снова экстрагируют метиленхлоридом (2 x 20 мл). Объединенные органические экстракты промывают последовательно насыщенным раствором угольной кислоты и водой и выпаривают, получая 0,750 г сырого названного в заголовке продукта со следующими физико-химическими константами: Rf 0,403, хлороформ-метанол-конц. гидроксид аммония, 6:1:0,1. ИК (КВr), см-1: 3455, 2974, 2940, 2880, 2787, 1748, 1702, 1658, 1540, 1459, 1376, 1239, 1173, 1112, 1061, 986, 958, 937, 904. Пример 7 3-Декладинозил-3-окси-6-O-метил-8а-аза-8а-гомоэритромицина А 2′-O-ацетат К раствору 3-декладинозил-3-окси-6-O-метил-9а-аза-9а-гомоэритромицина А (1,5 г, 0,0024 моль) из примера 5 в метиленхлориде (40 мл) добавляют гидрокарбонат натрия (0,88 г, 0,01 моль) и ангидрид уксусной кислоты (0,250 мл, 0,0025 моль) и затем в соответствии со способом, описанным в примере 6, получают 1,4 г названного в заголовке соединения со следующими физико-химическими константами: Rf 0,423, хлороформ-метанол-конц. гидроксид аммония, 6:1:0,1. ИК (КВr), см-1: 3394, 2972, 2939, 2784, 1736, 1649, 1542, 1459, 1376, 1262, 1165, 1085, 1059, 986, 958, 904. Пример 8 3-Декладинозил-3-оксо-6-O-метил-9а-аза-9а-гомоэритромицин А К раствору 3-декладинозил-3-окси-6-O-метил-9а-аза-9а-гомоэритромицина А 2′-O-ацетата (0,760 г, 0,0012 моль) из примера 6 в метиленхлориде (15 мл) добавляют диметилсульфоксид (1,27 мл) и N,N-диметиламинопропилэтилкарбодиимид (1,335 г, 0,007 моль). Реакционную смесь охлаждают до 15oС и затем при перемешивании, поддерживая ту же температуру, постепенно по каплям в течение 30 минут добавляют раствор пиридина трифторацетата (1,37 г, 0,007 моль) в метиленхлориде (5 мл). Температуру реакционной смеси постепенно повышают до комнатной температуры, перемешивание продолжают еще 3 часа и затем реакцию прерывают добавлением насыщенного раствора NaCl (20 мл) и метиленхлорида (20 мл). После подщелачивания реакционной смеси до рН 9,5с помощью 2 н. NaOH ее экстрагируют СН2Сl2, органические экстракты последовательно промывают насыщенным раствором NaCl, NаНСО3 и водой, затем сушат над К2СО3. После фильтрации и выпаривания метиленхлорида при пониженном давлении получают 0,800 г маслянистого остатка. Маслянистый остаток подвергают метанолизу (30 мл метанола) в течение 24 часов при комнатной температуре. Метанол выпаривают при пониженном давлении и полученный остаток (0,625 г) очищают хроматографией низкого давления на колонке силикагеля, используя систему растворителей дихлорметан – метанол – конц. гидроксид аммония, 90:9:0,5. Выпаривая объединенные экстракты с Rf 0,235 получают хроматографически однородный названный в заголовке продукт со следующими физико-химическими константами: Rf 0,235, метиленхлорид – метанол -конц. гидроксид аммония, 90:9:0,5. ИК (КВr), см-1: 3438, 2975, 2939, 2878, 2787, 1744, 1655, 1530, 1458, 1380, 1340, 1304, 1169, 1111, 1075, 1051, 986, 959, 940. 1H ЯМР (300 МГц, СDСl3)  : 6,63 (9a-CONH), 4,64 (Н-13), 4,49 (Н-5), 4,41 (Н-1′), 4,20 (Н-10), 3,90 (Н-2), 3,64 (Н-5′), 3,34 (Н-11), 3,20 (Н-2′), 3,07 (6-ОСН3), 3,02 (Н-4), 2,51 (Н-3′), 2,30 (Н-8), 2,27 [3′-N(СН3)2], 1,94 (Н-14а), 1,94 (Н-7а), 1,69 (Н-4’а), 1,63 (H-14b), 1,42 (H-7b), 1,40 (2-СН3), 1,30 (5′-СН3), 1,29 (4-СН3), 1,26 (5-СН3), 1,25 (Н-4’b), 1,22 (12-СН3), 1,19 (10-СН3), 1,10 (8-СН3), 0,91 (15-СН3).
13С ЯМР (75 МГц, CDCl3) : 6,63 (9a-CONH), 4,64 (Н-13), 4,49 (Н-5), 4,41 (Н-1′), 4,20 (Н-10), 3,90 (Н-2), 3,64 (Н-5′), 3,34 (Н-11), 3,20 (Н-2′), 3,07 (6-ОСН3), 3,02 (Н-4), 2,51 (Н-3′), 2,30 (Н-8), 2,27 [3′-N(СН3)2], 1,94 (Н-14а), 1,94 (Н-7а), 1,69 (Н-4’а), 1,63 (H-14b), 1,42 (H-7b), 1,40 (2-СН3), 1,30 (5′-СН3), 1,29 (4-СН3), 1,26 (5-СН3), 1,25 (Н-4’b), 1,22 (12-СН3), 1,19 (10-СН3), 1,10 (8-СН3), 0,91 (15-СН3).
13С ЯМР (75 МГц, CDCl3)  : 206,8 (С-3), 177,3 (С-1), 173,8 (С-9), 102,6 (С-1′), 79,3 (С-13), 78,4 (С-6), 74,4 (С-5), 73,9 (С-12), 73,1 (C-11), 70,0 (C-2′), 69,1 (С-5′), 65,5 (С-3′), 50,1 (6-ОСН3), 49,0 (С-2), 46,2 (С-4), 45,3 (С-10), 40,3(С-7), 40,0 [3′-N(СН3)2], 34,6 (С-8), 28,3 (С-4′), 21,0 (6-СН3), 20,7 (С-14), 19,6 (5′-СН3), 18,6 (8-СН3), 15,9 (12-СН3), 14,1 (2-СН3), 13,9 (10-СН3), 13,9 (4-СН3), 10,7 (15-СН3).
Пример 9 : 206,8 (С-3), 177,3 (С-1), 173,8 (С-9), 102,6 (С-1′), 79,3 (С-13), 78,4 (С-6), 74,4 (С-5), 73,9 (С-12), 73,1 (C-11), 70,0 (C-2′), 69,1 (С-5′), 65,5 (С-3′), 50,1 (6-ОСН3), 49,0 (С-2), 46,2 (С-4), 45,3 (С-10), 40,3(С-7), 40,0 [3′-N(СН3)2], 34,6 (С-8), 28,3 (С-4′), 21,0 (6-СН3), 20,7 (С-14), 19,6 (5′-СН3), 18,6 (8-СН3), 15,9 (12-СН3), 14,1 (2-СН3), 13,9 (10-СН3), 13,9 (4-СН3), 10,7 (15-СН3).
Пример 93-Декладинозил-3-оксо-6-O-метил-8а-аза-8а-гомоэритромицин А К раствору 3-декладинозил-3-окси-6-O-метил-8а-аза-8а-гомоэритромицина А 2′-O-ацетата (1,4 г, 0,0022 моль) из примера 7 в метиленхлориде (30 мл) добавляют диметилсульфоксид (2,5 мл) и N,N-диметиламинопропилэтилкарбодиимид (2,7 г, 0,014 моль). Реакционную смесь охлаждают до 15oС при перемешивании и поддерживают эту температуру, постепенно по каплям в течение 30 минут добавляют раствор пиридина трифторацетата (2,7 г, 0,014 моль) в метиленхлориде (10 мл). В соответствии со способом, описанным в примере 8, получают 1,1 г названного в заголовке продукта со следующими физико-химическими константами. ИК (КВr), см-1: 3435, 2975, 2939, 2879, 2788, 1746, 1648, 1542, 1458, 1379, 1339, 1302, 1166, 1111, 1076, 1052, 989, 960, 918. 1H ЯМР (300 МГц, СDСl3)  : 5,89 (9a-CONH), 5,08 (Н-13), 4,42 (Н-1′), 4,27 (Н-5), 4,03 (Н-8), 3,78 (Н-2), 3,60 (Н-5′), 3,58 (Н-11), 3,18 (Н-2′), 3,05 (Н-4), 2,91 (6-ОСН3), 2,49 (Н-3′), 2,39 (Н-10), 2,27 [3′-N(СН3)2], 1,96 (Н-14а), 2,68 (Н-7а), 1,68 (Н-4’а), 1,50 (H-14b), 1,41 (2-СН3), 1,32 (6-СН3), 1,30 (4-СН3), 1,25 (5′-СН3), 1,23 (H-4’b), 1,20 (10-СН3), 1,19 (8-СН3), 1,17 (12-СН3), 0,88 (15-СН3).
13С ЯМР (75 МГц, CDCl3) : 5,89 (9a-CONH), 5,08 (Н-13), 4,42 (Н-1′), 4,27 (Н-5), 4,03 (Н-8), 3,78 (Н-2), 3,60 (Н-5′), 3,58 (Н-11), 3,18 (Н-2′), 3,05 (Н-4), 2,91 (6-ОСН3), 2,49 (Н-3′), 2,39 (Н-10), 2,27 [3′-N(СН3)2], 1,96 (Н-14а), 2,68 (Н-7а), 1,68 (Н-4’а), 1,50 (H-14b), 1,41 (2-СН3), 1,32 (6-СН3), 1,30 (4-СН3), 1,25 (5′-СН3), 1,23 (H-4’b), 1,20 (10-СН3), 1,19 (8-СН3), 1,17 (12-СН3), 0,88 (15-СН3).
13С ЯМР (75 МГц, CDCl3)  : 206,2 (С-3), 170,0 (С-9), 174,6 (С-1), 103,1 (С-1′), 78,2 (С-6), 77,9 (С-5), 77,5 (С-13), 74,1 (С-12), 70,6 (С-11), 70,0 (С-2′), 69,1 (С-5′), 65,5 (С-3′), 50,5 (6-ОСН3), 50,4 (С-2), 47,6 (С-4), 42,2 (С-10), 42,1 (С-7), 41,6 (C-8), 39,9 [3′-N(СН3)2], 28,0 (С-4′), 22,8 (8-СН3), 21,2 (С-14), 20,8 (5′-СН3), 20,1 (6-СН3), 16,1 (12-СН3), 15,4 (2-СН3), 14,4 (4-СН3), 10,5 (15-СН3), 10,1 (10-СН3). : 206,2 (С-3), 170,0 (С-9), 174,6 (С-1), 103,1 (С-1′), 78,2 (С-6), 77,9 (С-5), 77,5 (С-13), 74,1 (С-12), 70,6 (С-11), 70,0 (С-2′), 69,1 (С-5′), 65,5 (С-3′), 50,5 (6-ОСН3), 50,4 (С-2), 47,6 (С-4), 42,2 (С-10), 42,1 (С-7), 41,6 (C-8), 39,9 [3′-N(СН3)2], 28,0 (С-4′), 22,8 (8-СН3), 21,2 (С-14), 20,8 (5′-СН3), 20,1 (6-СН3), 16,1 (12-СН3), 15,4 (2-СН3), 14,4 (4-СН3), 10,5 (15-СН3), 10,1 (10-СН3).
Формула изобретения 1. Соединение, представленное общей формулой (I) 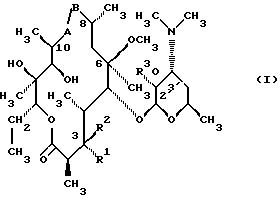 где A представляет NH группу и В при этом -С= О-группа либо А представляет С= О-группу и В при этом -NH-группа, R1 – ОН-группа, L-кладинозильная группа формулы (II) 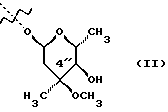 или вместе с R2 представляет собой кетон; R2 – водород или вместе с R1 – кетон; R3 – водород или С1-С4-алканоильная группа, и его фармацевтически приемлемые соли присоединения органических и неорганических кислот. 2. Соединение по п. 1, отличающееся тем, что А – NH-группа, В – С= О-группа, R1 – L-кладинозильная группа формулы (II), R2 и R3 одинаковы – водород. 3. Соединение по п. 1, отличающееся тем, что А – С= О-группа, В – NH-группа, R1 – L-кладинозильная группа формулы (II), а R2 и R3 одинаковы – водород. 4. Соединение по п. 1, отличающееся тем, что А – NH-группа, В – С= О-группа, R1 – ОН группа, а R2 и R3 одинаковы – водород. 5. Соединение по п. 1, отличающееся тем, что A – С= О-группа, В – NH-группа, R1 – ОН-группа, а R2 и R3 одинаковы – водород. 6. Соединение по п. 1, отличающееся тем, что A – NH-группа, В – С= О-группа, R1 – ОН-группа, R2 – водород, R3 – С1-С4 алканоильная группа. 7. Соединение по п. 6, отличающееся тем, что R3 – ацетильная группа. 8. Соединение по п. 1, отличающееся тем, что А – С= О-группа, В – NH-группа, R1 – ОН-группа, R2 – водород, и R3 – С1-С4 алканоильная группа. 9. Соединение по п. 8, отличающееся тем, что R3 – ацетильная группа. 10. Соединение по п. 1, отличающееся тем, что А – NH-группа, В – С= О-группа, R1 и R2 вместе – кетон, а R3 – водород. 11. Соединение по п. 1, отличающееся тем, что A – С= О-группа, В – NH-группа, R1 и R2 вместе – кетон, а R3 – водород. 12. Способ получения соединения общей формулы (I) 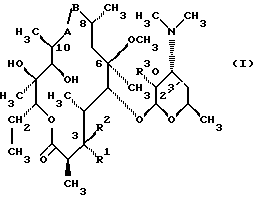 и его фармацевтически приемлемых солей присоединения с органическими и неорганическими кислотами, где А – NH-группа и В при этом – С= О-группа или A – С= О-группа и В при этом – NH-группа; R1 – ОН-группа, L-кладинозильная группа формулы (II) 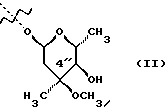 или вместе с R2 – кетон; R3 – водород или вместе с R1 – кетон; R3 – водород или С1-С4 алканоильная группа, отличающийся тем, что 6-О-метилэритромицин А формулы (III) 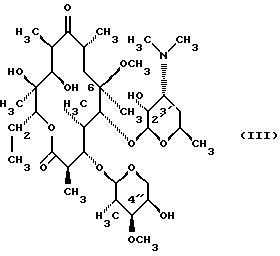 подвергают реакции с гидрохлоридом гидроксиламина в присутствии соответствующих неорганических и органических оснований, получая смесь 6-О-метилэритромицина А 9(Е)- и 9(Z)-оксима формулы (IV) 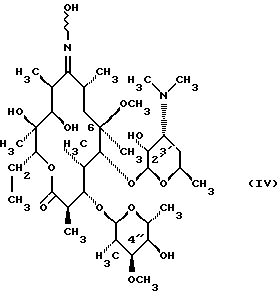 которую, если возможно, подвергают разделению на колонке из силикагеля, используя систему метиленхлорид – метанол-конц. гидрохлорид аммония 90: 9: 1,5, получая хроматографически однородный 9(Е)-оксим 6-О-метилэритромицина A с Rf 0,446 формулы (IVa) 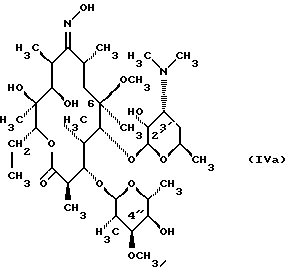 и хроматографически однородный 6-О-метилэритромицин А 9(Z)-оксим с Rf 0,355 формулы (IVb) 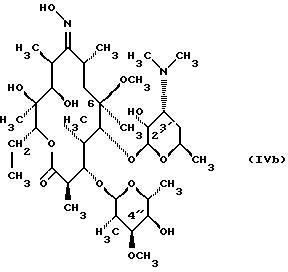 и затем подвергают перегруппировке Бэкмана с арилсульфонилгалогенидами, предпочтительно пара-толуолсульфонилхлоридом, в присутствии неорганических оснований, предпочтительно гидрокарбоната натрия, в растворителе или в смеси растворителей, инертных по отношению к реакции, предпочтительно в смеси ацетон – вода, получая в случае 9(Е)-оксима 6-О-метилэритромицина А формулы (IVa) соединение общей формулы (I), где А – NH-группа; В – С= О-группа; R1 – L-кладинозильная группа формулы (II), а R2 и R3 одинаковы – водород, либо в случае 9(Z)-оксима 6-О-метилэритромицина A формулы (IVb) соединение общей формулы (I), где A – C= O-группа, В – NH-группа, R1 – L-кладинозильная группа, а R2 и R3 одинаковы – водород, которые затем подвергают действию разбавленных неорганических кислот, предпочтительно 0,25 н хлористоводородной кислоты, при комнатной температуре, получая соединение общей формулы (I), где А – NH-группа и В при этом – C= O-группа либо А – C= O-группа и В при этом – NH-группа; R1 – ОН-группа, а R2 и R3 одинаковы – водород, которое затем подвергают реакции селективного ацилирования ангидридами карбоновых кислот, имеющими до 4 атомов углерода, предпочтительно с ангидридом уксусной кислоты в инертном органическом растворителе, предпочтительно метиленхлориде, получая соединение общей формулы (I), где А – NH-группа и В при этом – C= O-группа либо А – C= O-группа и В при этом – NH-группа; R1 – ОН-группа; R2 – водород и R3 – ацетил, которое затем подвергают окислению с диимидами, предпочтительно с N, N-диметиламинопропил-этилкарбодиимидом, в присутствии диметилсульфоксида и трифторацетатом пиридиния в качестве катализатора в инертном органическом растворителе, предпочтительно в метиленхлориде, при температуре от 10oС до комнатной температуры, получая соединение общей формулы (I), где А – NH группа, а В при этом – С= О-группа, либо А – С= О-группа, а В при этом – NH-группа; R1 и R2 вместе – кетон и R3 – ацетильная группа, которое затем подвергают реакции деацилирования по положению 2′ сольволизом в низших спиртах, предпочтительно в метаноле, при комнатной температуре, получая соединение общей формулы (I), где A – NH-группа, а В – С= О-группа, или А – С= О-группа, а В при этом – NH-группа; R1 и R2 вместе – кетон, а R3 – водород, которое затем, если возможно, подвергают взаимодействию с неорганическими и органическими кислотами, получая их фармацевтически приемлемые соли присоединения. РИСУНКИ
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 03.04.2009
Извещение опубликовано: 20.07.2010 БИ: 20/2010
|
||||||||||||||||||||||||||
