Патент на изобретение №2209416
|
||||||||||||||||||||||||||
(54) СПОСОБ ОПРЕДЕЛЕНИЯ АДГЕЗИОННОЙ УСТОЙЧИВОСТИ ИНГИБИТОРОВ КОРРОЗИИ НА ПОВЕРХНОСТИ МЕТАЛЛА
(57) Реферат: Изобретение относится к способам контроля устойчивости адгезии химических реагентов – ингибиторов коррозии на поверхности металла, и может быть использовано в различных отраслях промышленности, в том числе, нефтяной. Техническим результатом изобретения является упрощение известного способа определения адгезионной устойчивости ингибиторов коррозии на поверхности металла и повышение надежности ее установления. Сущность: образец металла помещают в проточную электрохимическую систему (ЭС). Приводят образец в контакт с жидкой коррозионно-активной средой – водным раствором электролита путем создания и поддержания постоянного во времени потока его через электрохимическую систему. Дожидаются стационарности процесса образования на поверхности металла ионно-гидратного слоя (ИГС), характеризующего адгезионную молекулярную емкость (ЭС), вносят в нее ингибиторы коррозии и их адгезионные свойства определяют по интенсивности процессов выхода электроактивных компонентов ИГС в свободную фазу, электрохимически сопряженных с процессами его разрушения при адгезии ингибиторов коррозии на поверхности металла, после чего восстанавливают поток исходного водного раствора электролита через ЭС и адгезионную устойчивость ингибиторов коррозии на поверхности металла определяют по интенсивности и степени восстановления ионно-гидратного слоя при повторном его образовании в процессе удаления ингибиторов коррозии с поверхности металла электроактивными компонентами ионно-гидратного слоя. 3 з.п. ф-лы, 8 ил. Изобретение относится к способам контроля устойчивости адгезии химических реагентов – ингибиторов коррозии металлов – на поверхности металла при их контакте с металлом из водного раствора и может быть использовано в различных отраслях промышленности, в том числе нефтяной. Известен способ определения адгезии ингибиторов коррозии на поверхности металла с использованием прямого метода пьезокварцевого микровзвешивания при их адсорбции поверхностью металла из среды органического растворителя – гептана [1] . Основным недостатком известного способа является необходимость использования высокочувствительного пьезокварцевого резонатора с пределом измерения 10-9 г  см-2 для количественной оценки приращения массы образца металла в процессе адгезии реагента. Другой существенный недостаток состоит в невозможности определения адгезии из водных растворов исследуемых ингибиторов.
Известен способ определения адгезионной ориентации молекул ингибитора коррозии при формировании ими связей с активными центрами металлической поверхности в процессе контакта ингибитора с образцом металла с использованием метода многократно нарушенного полного внутреннего отражения (МНПВО) в инфракрасной области [2]. Основным недостатком известного способа является необходимость использования дорогостоящего оборудования и комплекса приборного обеспечения инфракрасного спектрометра. Кроме этого, известный способ не дает информации об общем расходе реагента при немонослойной (многослойной) адгезии.
Известен также способ определения количественных характеристик процесса адгезии ингибиторов коррозии по изменению поверхностного потенциала металла при возрастании контактной разности потенциалов (КРП) в результате адсорбции реагентов – доноров электронов – исследуемой металлической поверхностью [3, с. 116]. Недостаток известного способа состоит в сложности его применения в случае многокомпонентных ингибиторов коррозии и многослойной адгезии, в случае которой после заполнения монослоя молекулами ингибитора контактная разность потенциалов не изменяется.
Наиболее близка по существу решаемой задачи заявляемого способа методика, основанная на сочетании измерения скорости коррозии методом поляризационного сопротивления стального датчика и изучения эффекта последействия ингибиторов коррозии [3, с. 119-124]. Последействие ингибиторов в известном способе исследовано как функциональная зависимость устойчивости адгезированного реагента по отношению к “отмывающей” жидкой фазе – воде или органическому растворителю. Главными недостатками известного способа являются, с одной стороны, необходимость предварительного формирования адгезированной пленки ингибитора на образцах металла сложной формы, с другой – разделенность эксперимента на две самостоятельные части, имеющие вышеуказанные недостатки метода КРП, поскольку эффективность оценки полного изменения количества ингибитора коррозии в процессах его адгезии на поверхности металла его и “отмывания” с нее (адгезионную устойчивость) недостаточна, что связано с экспериментальными затруднениями при практической реализации известного способа.
Решаемой задачей заявляемого способа является повышение эффективности определения адгезионной устойчивости ингибиторов коррозии на поверхности металла. Ожидаемым техническим результатом изобретения является упрощение известного способа определения адгезионной устойчивости ингибиторов коррозии на поверхности металла и повышение надежности ее установления при применении ингибиторов коррозии в качестве защитных пленкообразующих покрытий. Определение адгезионной устойчивости ингибиторов коррозии на поверхности металла проводят путем количественной оценки термодинамических и кинетических параметров создания и разрушения ионно-гидратного комплекса на поверхности металла при удалении его компонентов из жидкой фазы (раствора электролита) и последующего выхода их в раствор в процессе контакта с исследуемыми ингибиторами и дальнейшего восстановления комплекса при “отмывании” поверхности металла исходным раствором электролита, не содержащим исследуемых ингибиторов. В отличие от прототипа заявляемое техническое решение предполагает непрерывное непосредственное определение адгезионной устойчивости ингибиторов коррозии на поверхности металла в зависимости от их концентрации в кинетическом режиме по ходу испытания, без замены растворов и образца металла для каждой концентрации.
Поставленная задача решается тем, что последовательно образец металла помещают в проточную электрохимическую систему, приводят в контакт с жидкой коррозионно-активной средой – водным раствором электролита – путем создания и поддержания постоянного во времени потока его через электрохимическую систему, дожидаются стационарности процесса образования на поверхности металла ионно-гидратного слоя, характеризующего ее адгезионную молекулярную емкость, вносят в электрохимическую систему ингибиторы коррозии и их адгезионные свойства определяют по интенсивности процессов выхода электроактивных компонентов ионно-гидратного слоя в свободную фазу, электрохимически сопряженных с процессами его разрушения при адгезии ингибиторов коррозии на поверхности металла, после чего, для удаления адгезированных ингибиторов коррозии, восстанавливают поток исходного водного раствора электролита через электрохимическую систему и адгезионную устойчивость ингибиторов коррозии на поверхности металла определяют по интенсивности и степени восстановления ионно-гидратного слоя при повторном его образовании в процессе удаления ингибиторов коррозии с поверхности металла электроактивными компонентами ионно-гидратного слоя.
В качестве водного раствора электролита используют нефтепромысловую воду или ее модель.
Контроль создания и поддержания постоянного во времени потока электролита через электрохимическую систему и контроль стационарности процесса образования на поверхности металла ионно-гидратного слоя осуществляют по потенциалу течения.
Интенсивность процессов выхода электроактивных компонентов ионно-гидратного слоя в свободную фазу определяют как потенциал течения электрометрически, прямым измерением разности потенциалов между “источником” и “стоком” потока электролита в электрохимической системе, с использованием электродной пары из инертного металла.
Сопоставительный анализ существенных признаков предлагаемого технического решения и прототипа позволяет сделать вывод о соответствии заявляемого изобретения критерию “новизна”.
Определение адгезионной устойчивости ингибиторов коррозии на поверхности металла по изменению концентрации электроактивных компонентов ионно-гидратного слоя, адгезированных при его создании на поверхности металла в результате ее контакта с раствором электролита, вытесняемых ингибитором коррозии с поверхности металла в процессе его адгезии на ее поверхности и вновь адгезируемых в ходе восстановления ионно-гидратного слоя при последующем “отмывании” поверхности металла исходным раствором электролита, ранее не предлагалось.
При движении жидкости относительно твердой фазы или непосредственно примыкающего к ней неподвижного слоя жидкости происходит разделение зарядов и формируется разность потенциалов см-2 для количественной оценки приращения массы образца металла в процессе адгезии реагента. Другой существенный недостаток состоит в невозможности определения адгезии из водных растворов исследуемых ингибиторов.
Известен способ определения адгезионной ориентации молекул ингибитора коррозии при формировании ими связей с активными центрами металлической поверхности в процессе контакта ингибитора с образцом металла с использованием метода многократно нарушенного полного внутреннего отражения (МНПВО) в инфракрасной области [2]. Основным недостатком известного способа является необходимость использования дорогостоящего оборудования и комплекса приборного обеспечения инфракрасного спектрометра. Кроме этого, известный способ не дает информации об общем расходе реагента при немонослойной (многослойной) адгезии.
Известен также способ определения количественных характеристик процесса адгезии ингибиторов коррозии по изменению поверхностного потенциала металла при возрастании контактной разности потенциалов (КРП) в результате адсорбции реагентов – доноров электронов – исследуемой металлической поверхностью [3, с. 116]. Недостаток известного способа состоит в сложности его применения в случае многокомпонентных ингибиторов коррозии и многослойной адгезии, в случае которой после заполнения монослоя молекулами ингибитора контактная разность потенциалов не изменяется.
Наиболее близка по существу решаемой задачи заявляемого способа методика, основанная на сочетании измерения скорости коррозии методом поляризационного сопротивления стального датчика и изучения эффекта последействия ингибиторов коррозии [3, с. 119-124]. Последействие ингибиторов в известном способе исследовано как функциональная зависимость устойчивости адгезированного реагента по отношению к “отмывающей” жидкой фазе – воде или органическому растворителю. Главными недостатками известного способа являются, с одной стороны, необходимость предварительного формирования адгезированной пленки ингибитора на образцах металла сложной формы, с другой – разделенность эксперимента на две самостоятельные части, имеющие вышеуказанные недостатки метода КРП, поскольку эффективность оценки полного изменения количества ингибитора коррозии в процессах его адгезии на поверхности металла его и “отмывания” с нее (адгезионную устойчивость) недостаточна, что связано с экспериментальными затруднениями при практической реализации известного способа.
Решаемой задачей заявляемого способа является повышение эффективности определения адгезионной устойчивости ингибиторов коррозии на поверхности металла. Ожидаемым техническим результатом изобретения является упрощение известного способа определения адгезионной устойчивости ингибиторов коррозии на поверхности металла и повышение надежности ее установления при применении ингибиторов коррозии в качестве защитных пленкообразующих покрытий. Определение адгезионной устойчивости ингибиторов коррозии на поверхности металла проводят путем количественной оценки термодинамических и кинетических параметров создания и разрушения ионно-гидратного комплекса на поверхности металла при удалении его компонентов из жидкой фазы (раствора электролита) и последующего выхода их в раствор в процессе контакта с исследуемыми ингибиторами и дальнейшего восстановления комплекса при “отмывании” поверхности металла исходным раствором электролита, не содержащим исследуемых ингибиторов. В отличие от прототипа заявляемое техническое решение предполагает непрерывное непосредственное определение адгезионной устойчивости ингибиторов коррозии на поверхности металла в зависимости от их концентрации в кинетическом режиме по ходу испытания, без замены растворов и образца металла для каждой концентрации.
Поставленная задача решается тем, что последовательно образец металла помещают в проточную электрохимическую систему, приводят в контакт с жидкой коррозионно-активной средой – водным раствором электролита – путем создания и поддержания постоянного во времени потока его через электрохимическую систему, дожидаются стационарности процесса образования на поверхности металла ионно-гидратного слоя, характеризующего ее адгезионную молекулярную емкость, вносят в электрохимическую систему ингибиторы коррозии и их адгезионные свойства определяют по интенсивности процессов выхода электроактивных компонентов ионно-гидратного слоя в свободную фазу, электрохимически сопряженных с процессами его разрушения при адгезии ингибиторов коррозии на поверхности металла, после чего, для удаления адгезированных ингибиторов коррозии, восстанавливают поток исходного водного раствора электролита через электрохимическую систему и адгезионную устойчивость ингибиторов коррозии на поверхности металла определяют по интенсивности и степени восстановления ионно-гидратного слоя при повторном его образовании в процессе удаления ингибиторов коррозии с поверхности металла электроактивными компонентами ионно-гидратного слоя.
В качестве водного раствора электролита используют нефтепромысловую воду или ее модель.
Контроль создания и поддержания постоянного во времени потока электролита через электрохимическую систему и контроль стационарности процесса образования на поверхности металла ионно-гидратного слоя осуществляют по потенциалу течения.
Интенсивность процессов выхода электроактивных компонентов ионно-гидратного слоя в свободную фазу определяют как потенциал течения электрометрически, прямым измерением разности потенциалов между “источником” и “стоком” потока электролита в электрохимической системе, с использованием электродной пары из инертного металла.
Сопоставительный анализ существенных признаков предлагаемого технического решения и прототипа позволяет сделать вывод о соответствии заявляемого изобретения критерию “новизна”.
Определение адгезионной устойчивости ингибиторов коррозии на поверхности металла по изменению концентрации электроактивных компонентов ионно-гидратного слоя, адгезированных при его создании на поверхности металла в результате ее контакта с раствором электролита, вытесняемых ингибитором коррозии с поверхности металла в процессе его адгезии на ее поверхности и вновь адгезируемых в ходе восстановления ионно-гидратного слоя при последующем “отмывании” поверхности металла исходным раствором электролита, ранее не предлагалось.
При движении жидкости относительно твердой фазы или непосредственно примыкающего к ней неподвижного слоя жидкости происходит разделение зарядов и формируется разность потенциалов  Е. Заряды представлены или диполями растворителя, или ионно-гидратными образованиями – комплексами.
Ввиду неизвестности качественного и количественного состава электроактивных частиц (ионов) в исходном растворе, для определения их численного значения используют непосредственно представление о “формировании” ими числа Авогадро (моля): Е. Заряды представлены или диполями растворителя, или ионно-гидратными образованиями – комплексами.
Ввиду неизвестности качественного и количественного состава электроактивных частиц (ионов) в исходном растворе, для определения их численного значения используют непосредственно представление о “формировании” ими числа Авогадро (моля):ziNAe=zeF (1) где: zi – заряд иона; е – число элементарных зарядов; NА – число Авогадро (6.023  1023); 1023);ze – заряд электрона; F – постоянная Фарадея. Поскольку зарядовое число ионов zi неизвестно, выражение (1) не определено. Неопределенность устраняют почленным делением обеих частей уравнения на аналогичное вида ziNAeN= (zeF)/N после разбавления раствора в фиксированное число раз (N – кратность разбавления). Значение N=10 обеспечивает освобождение от логарифмического множителя в уравнении Нернста, т.е. соблюдаются условия автонормировки (при фиксированных отношениях еN/еX, где eN нормированное число носителей элементарных зарядов, еX искомое число носителей элементарных зарядов, изменяющееся в процессе их удаления из раствора). Таким образом, получают изменяющийся линейный коэффициент перед NA, характеризующий изменение количества частиц, составляющих число Авогадро. Линейная зависимость потенциала течения Е и электродного потенциала концентрационной цепи (потенциал Нернста) в узком диапазоне концентраций  С (разбавление на порядок), установленная экспериментально, дает возможность использовать Е для точного определения искомого коэффициента перед NA и однозначного нахождения доли электроактивных частиц (ионов), принимающих участие в формировании ионно-гидратного слоя.
Неизвестность компонентного состава сложного электролита типа нефтепромысловых вод не позволяет оперировать концентрациями, т.е. отношениями массы растворенного вещества к объему раствора. Однако при соответствующих условиях имеется возможность определить непосредственно изменение количества компонентов в исходном растворе независимо от его концентрации. Задача особенно упрощается в случае заряженных электроактивных частиц (ионов). При адсорбции поликомпонентного электролита на поверхности металла согласно принципу электронейтральности, происходит попарное связывание катионов и анионов, т.е. идет удаление собственно электролита из жидкой фазы системы. Решить задачу определения количества ионов, покинувших раствор, можно с использованием концентрационной цепи – электрохимической системы анионактивного типа с электродной парой из идентичных хлорсеребряных электродов. Поскольку хлорид-ион (Сl–) обладает наибольшей (за исключением иона гидроксила) подвижностью, ток в направлении положительного электрода практически полностью переносится им. Поэтому все катионы “нейтрализуются” хлоридом, который и компенсирует их заряд в такой анионоактивной концентрационной цепи. В результате, измерив разность электродных потенциалов двух хлорсеребряных электродов, находящихся в растворе одной природы, но разной концентрации, можно говорить о кратности различия этих концентраций. Однако это еще не решает проблемы определения количества электролита, удаленного в процессе его адсорбции при контакте с поверхностью металла. Решить ее можно, определив изменение количества электроактивных компонентов в форме коэффициента перед числом Авогадро NA, который для процессов адсорбции имеет небольшие значения, выраженные в десятичных дробях.
Используемый в предлагаемом способе подход к определению количества электроактивных частиц, удаленных из жидкой фазы системы, позволяет выразить их число непосредственно в молях, вне зависимости от их исходной концентрации в растворе, которая в общем случае не известна.
Между жидкостью и точкой твердой поверхности появляется электрокинетический, или дзета-потенциал, вида С (разбавление на порядок), установленная экспериментально, дает возможность использовать Е для точного определения искомого коэффициента перед NA и однозначного нахождения доли электроактивных частиц (ионов), принимающих участие в формировании ионно-гидратного слоя.
Неизвестность компонентного состава сложного электролита типа нефтепромысловых вод не позволяет оперировать концентрациями, т.е. отношениями массы растворенного вещества к объему раствора. Однако при соответствующих условиях имеется возможность определить непосредственно изменение количества компонентов в исходном растворе независимо от его концентрации. Задача особенно упрощается в случае заряженных электроактивных частиц (ионов). При адсорбции поликомпонентного электролита на поверхности металла согласно принципу электронейтральности, происходит попарное связывание катионов и анионов, т.е. идет удаление собственно электролита из жидкой фазы системы. Решить задачу определения количества ионов, покинувших раствор, можно с использованием концентрационной цепи – электрохимической системы анионактивного типа с электродной парой из идентичных хлорсеребряных электродов. Поскольку хлорид-ион (Сl–) обладает наибольшей (за исключением иона гидроксила) подвижностью, ток в направлении положительного электрода практически полностью переносится им. Поэтому все катионы “нейтрализуются” хлоридом, который и компенсирует их заряд в такой анионоактивной концентрационной цепи. В результате, измерив разность электродных потенциалов двух хлорсеребряных электродов, находящихся в растворе одной природы, но разной концентрации, можно говорить о кратности различия этих концентраций. Однако это еще не решает проблемы определения количества электролита, удаленного в процессе его адсорбции при контакте с поверхностью металла. Решить ее можно, определив изменение количества электроактивных компонентов в форме коэффициента перед числом Авогадро NA, который для процессов адсорбции имеет небольшие значения, выраженные в десятичных дробях.
Используемый в предлагаемом способе подход к определению количества электроактивных частиц, удаленных из жидкой фазы системы, позволяет выразить их число непосредственно в молях, вне зависимости от их исходной концентрации в растворе, которая в общем случае не известна.
Между жидкостью и точкой твердой поверхности появляется электрокинетический, или дзета-потенциал, вида = =   E/pD (2) E/pD (2)где  – вязкость; – вязкость; – удельная электропроводность текущей жидкости; – удельная электропроводность текущей жидкости;Е – потенциал потока (течения); р – давление; D – диэлектрическая проницаемость раствора электролита (  o o ). ).Решая уравнение относительно Е и раскрывая D =  o o , имеем для точки поверхности металла , имеем для точки поверхности металла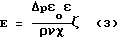 где  – плотность; – плотность; – кинематическая вязкость жидкости; – кинематическая вязкость жидкости; – диэлектрическая проницаемость вакуума; – диэлектрическая проницаемость вакуума; o – диэлектрическая проницаемость исследуемой среды.
Разбавлением исходного раствора на порядок получают нормированное (приведенное к единице) значение потенциала течения. Такое значение следует из условия автонормировки для десятичного логарифма перед отношением активностей (концентраций). После нормировки получают выражения, аналогичные для нернстовского потенциала o – диэлектрическая проницаемость исследуемой среды.
Разбавлением исходного раствора на порядок получают нормированное (приведенное к единице) значение потенциала течения. Такое значение следует из условия автонормировки для десятичного логарифма перед отношением активностей (концентраций). После нормировки получают выражения, аналогичные для нернстовского потенциалаEX~  ~CX; EN~ ~CX; EN~ N~CN (4) N~CN (4)где EX – текущее измеряемое значение электродвижущей силы (ЭДС), EN – нормированное значение ЭДС до начала опыта. EX/EN =  X/ X/ N = lg[CX/CN] (5) N = lg[CX/CN] (5)С учетом соотношения Сх/СN=10 из условия автонормировки (lg10=1) следует равенство коэффициента перед NA, аналогичного изменению мольной доли X, выражению EX/EN, из которого в свою очередь однозначно следует возможность применения ЕX, ввиду фиксированного значения ЕN, в качестве показателя изменения суммарного количества носителей заряда в жидкой фазе в процессе их адгезии на поверхности металла. В итоге получают перемененный линейный коэффициент перед NA, непосредственно характеризующий изменение количества электроактивпых частиц как долю числа Авогадро. Окончательный результат может быть представлен в виде выражения n/NA, что соответствует доле адгезированных электроактивных частиц. Циркуляция электролита при постоянном потоке создает вращательное движение раствора в ячейке, характеризуемое постоянной угловой скоростью. Связь потенциала потока с кинематическими параметрами движения жидкости задается выражением для плотности тока j = 6,2  z z F F  1/2 1/2  1/6 1/6 D2/3i D2/3i ci (6); ci (6);где Сi – концентрация i-х частиц, моль/м3. На поверхности контактной площадки формируется ионно-гидратный слой, превышающий толщину предельного диффузионного слоя  = 1,61 = 1,61  -1/2 -1/2  1/6 1/6 D1/3i (7); D1/3i (7);  – угловая скорость вращения жидкости, рад – угловая скорость вращения жидкости, рад с-1; с-1; – кинематическая вязкость жидкости, м2 – кинематическая вязкость жидкости, м2 с-1; с-1;D – коэффициент диффузии i-х частиц (ионов), м2  с-1; с-1;r – радиус контактной площадки. Это позволяет определить полную ионно-молкулярную емкость контактной площадки с “автопересчетом” на 1 моль (молярная емкость) поверхности металла. Ввиду постоянства сечения “контактной площадки” проточной электрохимической ячейки непосредственно из выражения для плотности тока j следуют соотношения для силы тока I и перенесенного заряда q за единицу времени t: I=jS (7) и q=It (8), где q  е.
После непосредственного почленного деления выражений для искомого и исходного значения qx/qN, что эквивалентно еX/еN, получают аналогичное уравнение связи предельного диффузионного тока “контактной площадки” с мольной долей заполненной поверхности, что характеризуется дробным значением числа Авогадро.
Следует отметить, что внешнее сходство уравнения (6) с выражением для предельного диффузионного тока на вращающемся дисковом электроде не отражает физический смысл процесса адгезии ионов на “контактной площадке” проточной электрохимической ячейки, что подробно разобрано в примере 1 заявляемого способа.
Таким образом, совместное решение известных уравнений связи потенциала потока и потенциала Нернста в проточной электрохимической системе с уравнением предельного диффузионного тока на поверхности металла приводит к однозначному выражению для искомого количества электроактивных частиц, образующих адгезионный слой. Почленное деление соответствующих уравнений дает в итоге возможность определить активную адгезирующую поверхность, связывающую искомую мольную долю электроактивных частиц, что характеризует молекулярную емкость поверхности.
Изложенный подход позволяет использовать стандартные выражения для энергии Гиббса (изобарно-изотермический потенциал) и энергии активации е.
После непосредственного почленного деления выражений для искомого и исходного значения qx/qN, что эквивалентно еX/еN, получают аналогичное уравнение связи предельного диффузионного тока “контактной площадки” с мольной долей заполненной поверхности, что характеризуется дробным значением числа Авогадро.
Следует отметить, что внешнее сходство уравнения (6) с выражением для предельного диффузионного тока на вращающемся дисковом электроде не отражает физический смысл процесса адгезии ионов на “контактной площадке” проточной электрохимической ячейки, что подробно разобрано в примере 1 заявляемого способа.
Таким образом, совместное решение известных уравнений связи потенциала потока и потенциала Нернста в проточной электрохимической системе с уравнением предельного диффузионного тока на поверхности металла приводит к однозначному выражению для искомого количества электроактивных частиц, образующих адгезионный слой. Почленное деление соответствующих уравнений дает в итоге возможность определить активную адгезирующую поверхность, связывающую искомую мольную долю электроактивных частиц, что характеризует молекулярную емкость поверхности.
Изложенный подход позволяет использовать стандартные выражения для энергии Гиббса (изобарно-изотермический потенциал) и энергии активации G=-RTlnX, (9) G=-RTlnX, (9)где  G – изменение изобарно-изотермического потенциала (энергии Гиббса); G – изменение изобарно-изотермического потенциала (энергии Гиббса);R – универсальная газовая постоянная; Т – заданная абсолютная температура; К – константа равновесия процесса адгезии ингибитора коррозии. Энергию активации можно также вычислить из непосредственного соотношения констант скоростей, минуя определение концентрации в какой-либо форме. С учетом стандартных условий, созданных в начале эксперимента, следует, что потенциал течения в данном случае будет непосредственно зависеть от адсорбции ионов и может быть назван потенциалом адсорбции (создания ионно-гидратного слоя). 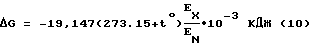 Энергию активации находят по формуле 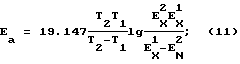 “Комбинированным” подходом возможно отыскание непосредственных переходных коэффициентов между методами концентрационной цепи и потенциалом течения. Что касается “изобретательского уровня”, то соответствие ему заявляемого технического решения определяется тем, что для определения адгезионной устойчивости ингибиторов коррозии на поверхности металла используется “потенциал течения”, определяемый в системе “раствор ингибитор коррозии – металл” с помощью электрохимической системы проточного типа, имеющей “рабочую” и “приемную” емкости, между которыми создается и поддерживается постоянный во времени поток электролита. “Неожиданность” технического решения по предлагаемому способу заключается в том, что непосредственное измерение разности потенциалов между “рабочей” и “приемной” емкостями при течении электролита через электрохимическую систему, разделяющую емкости, позволяет определить термодинамические и кинетические параметры процесса адгезии ингибиторов коррозии на поверхности металла. Авторам заявляемого изобретения известно, что имеются патент и решение о выдаче патента [4, 5], где подобный принцип измерения реализован для определения кинетики адсорбции и десорбции химреагентов-гидрофобизаторов на поверхности пористой среды при фильтрации через нее раствора электролита, однако они обращают внимание, что в заявляемом изобретении измеряемый параметр (потенциал течения Е) генерируется при перемещении потока электролита не в пространстве пористой среды, как в [4, 5], а непосредственно в слое, примыкающем к металлу, что потребовало применения в проточной электрохимической системе обязательного дополнительного элемента – электрохимической ячейки, содержащей образец металла в качестве “контактной площадки”, без которой измерение не может быть осуществлено. Способ осуществляют в следующей последовательности операций. 1. Отбор образца жидкой коррозионно-активной среды – водного раствора электролита (нефтепромысловой воды или ее модели). 2. Подготовка образца металла. 3. Приведение металла в контакт с жидкой коррозионно-активной средой – водным раствором электролита (нефтепромысловой водой или ее моделью). 4. Создание и поддержание постоянного потока раствора электролита через проточную электрохимическую ячейку. 5. Электрометрическое определение достижения стационарности процесса создания и поддержания постоянного во времени потока через электрохимическую систему и стационарности процесса образования на поверхности металла ионно-гидратного слоя. 6. Внесение в проточную электрохимическую ячейку ингибиторов коррозии и электрометрическое определение интенсивности процессов выхода электроактивных компонентов ионно-гидратного слоя в свободную фазу, как потенциала течения, прямым измерением разности потенциалов между “источником” и “стоком” потока электролита в электрохимической системе, с использованием электродной пары из инертного металла. 7. Приведение металла в контакт с исходной жидкой коррозионно-активной средой водным раствором электролита (нефтепромысловой водой или ее моделью), не содержащей ингибиторов коррозии, восстановление потока исходного водного раствора электролитая (“отмывание”). 8. Электрометрическое определение достижения стационарности процесса создания и поддержания постоянного во времени потока через электрохимическую систему и стационарности процесса вторичного образования (восстановления) на поверхности металла ионно-гидратного слоя. 9. Определение адгезионной устойчивости ингибиторов коррозии по степени адгезии их на поверхности металла как разности электроактивных компонентов ионно-гидратного слоя, адгезированных поверхностью металла до и после внесения в электрохимическую систему ингибиторов коррозии. Осуществление способа предполагает использование проточной электрохимической системы (фиг. 1), состоящей из двух идентичных термостатируемых ячеек 1 и 2 (“рабочая” и “приемная” емкости) с электродами из инертного металла 3, 4 и электрометра 5, для измерения разности потенциалов. Образец металла расположен в проточной электрохимической ячейке 6, разделяющей рабочую и приемную емкости и служит ее “дном”, образуя поверхность, относительно которой возникает потенциал течения (“контактная площадка”). Схема проточной ячейки с образцом металла приведена на фиг.2, где 7 – металл (контактная площадка радиуса r); 8 – корпус; 9 – входной штуцер (источник); 10 – выходной штуцер (сток); 11 – пружинная стяжка. Фигурными стрелками показана циркуляция электролита в электрохимической ячейке. Ниже представлено описание последовательности осуществления способа в автоматизированном режиме с использованием аппаратурного обеспечения на базе субблоков серийно выпускаемого отечественного титратора Т108. Ход эксперимента. Электрохимическую ячейку 1 (рабочая емкость) заполняют исследуемым раствором электролита в объеме до 20 см, в ячейку 2 вносят небольшое количество (до 1 см3) того же раствора, после чего обе ячейки термостатируют при заданной температуре. Образец металла подготавливают к опытам согласно [6]. Постоянный во времени поток электролита создают посредством плунжеров, являющихся одновременно рабочими инертными электродами 3, 4. Достижение стационарности потока предварительно контролируют, например, электронным расходомером. Разность потенциалов “снимают” непосредственно со штоков плунжеров на вход высокоомного вольтметра. После достижения стационарных значений разности потенциалов проводят расчет показателей адгезии при создании ионно-гидратного слоя как потенциала течения. Концентрацию адгезированных ионов определяют в форме относительной доли от исходных значений. После стабилизации потенциала течения проводят исследование влияния ингибиторов коррозии, для чего их последовательно вносят в рабочую ячейку. О завершенности эксперимента судят по степени выхода ионов с поверхности металла в раствор, т.e. по постепенному возвращению системы к исходному значению потенциала течения. Способ иллюстрируется примерами применения Пример 1. Создание на поверхности металла авизированного ионно-гидратного слоя. Контакт минерализованных нефтепромысловых вод с поверхностью металла сопровождается образованием ионно-гидратного слоя (ИГС) значительной молекулярной емкости, имеющего протяженную структуру (не только двойного электрического диффузно-адсорбционного слоя, но и адгезионно связанного гидратированного ионного комплекса, толщина которого превышает таковую для слоя Прандтля). Связанные ионы теряют электроактивность, что проявляется в изменении электрометрических показателей (потенциала течения). На фиг.3 представлены кинетические кривые изменения емкости ИГС в процессе его создания на 1 моле поверхности металла (сталь 20) при контакте с нефтепромысловой водой Правдинского месторождения в диапазоне температур 20…40oС. С ростом температуры полная молярная ионно-молекулярная емкость поверхности металла возрастает. Следует отметить, что ионно-молекулярная емкость поверхности металла, экспериментально определенная с применением вращающегося дискового электрода, оказывается заниженной более чем на порядок, что непосредственно находит отражение в известном соотношении  / / Pr = (D/ Pr = (D/ )1/3, )1/3,где  – толщина диффузионного слоя на дисковом электроде; – толщина диффузионного слоя на дисковом электроде; Pr – толщина слоя Прандтля; Pr – толщина слоя Прандтля;D – коэффициент диффузии;  – кинематическая вязкость.
Таким образом, заявляемый способ позволяет определить полную молекулярную емкость поверхности металла, включающую двойной электрический слой, диффузионный слой и пограничный слой Прандтля, в которой происходит адгезионное связывание электроактивных частиц гидратированных ионных комплексов.
Пример 2. Определение адгезионной устойчивости на поверхности металла ингибитора коррозии Коррексит SXT 002.
Ингибитор коррозии Коррексит SXT 002 является одним из базовых импортных реагентов для использования в нефтепромысловых условиях. При контакте с поверхностью металла он образует адгезированный защитный комплекс. Заявляемый способ позволяет дать количественную оценку адгезионной устойчивости этого ингибитора коррозии на поверхности металла. Устойчивость определена в ходе 8-часового эксперимента для температурного диапазона 20. . . 40oС путем “отмывания” реагента исходной минерализованной водой Правдинского месторождения (фиг.4). Коррексит SXT 002 оказывается прочно адгезированным поверхностью образца металла и незначительно удаляется при “отмывании” (остаточное содержание до 89,8%). Полученное значение и характеризует адгезионную устойчивость ингибитора на 1 моле поверхности металла, составляя, таким образом, разность между молярными емкостями ИГС до и после внесения ингибитора коррозии: 10,41 – кинематическая вязкость.
Таким образом, заявляемый способ позволяет определить полную молекулярную емкость поверхности металла, включающую двойной электрический слой, диффузионный слой и пограничный слой Прандтля, в которой происходит адгезионное связывание электроактивных частиц гидратированных ионных комплексов.
Пример 2. Определение адгезионной устойчивости на поверхности металла ингибитора коррозии Коррексит SXT 002.
Ингибитор коррозии Коррексит SXT 002 является одним из базовых импортных реагентов для использования в нефтепромысловых условиях. При контакте с поверхностью металла он образует адгезированный защитный комплекс. Заявляемый способ позволяет дать количественную оценку адгезионной устойчивости этого ингибитора коррозии на поверхности металла. Устойчивость определена в ходе 8-часового эксперимента для температурного диапазона 20. . . 40oС путем “отмывания” реагента исходной минерализованной водой Правдинского месторождения (фиг.4). Коррексит SXT 002 оказывается прочно адгезированным поверхностью образца металла и незначительно удаляется при “отмывании” (остаточное содержание до 89,8%). Полученное значение и характеризует адгезионную устойчивость ингибитора на 1 моле поверхности металла, составляя, таким образом, разность между молярными емкостями ИГС до и после внесения ингибитора коррозии: 10,41 10-2 моля и 1,06 10-2 моля и 1,06 10-2 моля, что соответствует 9,35 10-2 моля, что соответствует 9,35 10-2 моля.
Пример 3 Определение адгезионной устойчивости на поверхности металла ингибитора коррозии Союз-2000.
Несколько меньшей адгезионной устойчивостью на поверхности металла характеризуется ингибитор коррозии Союз-2000. На фиг. 5 показана кинетика процесса “отмывания” этого реагента минерализованной водой Правдинского месторождения. Остаточное содержание его на поверхности металла составляет до 89,7%, что соответствует адгезионной устойчивости ингибитора коррозии на 1 моле поверхности покрытия, равной 9,34 10-2 моля.
Пример 3 Определение адгезионной устойчивости на поверхности металла ингибитора коррозии Союз-2000.
Несколько меньшей адгезионной устойчивостью на поверхности металла характеризуется ингибитор коррозии Союз-2000. На фиг. 5 показана кинетика процесса “отмывания” этого реагента минерализованной водой Правдинского месторождения. Остаточное содержание его на поверхности металла составляет до 89,7%, что соответствует адгезионной устойчивости ингибитора коррозии на 1 моле поверхности покрытия, равной 9,34 10-2 моля.
Пример 4. Определеие адгезионной устойчивости на поверхности металла ингибитора коррозии Азол С1-130.
Далее из числа изученных реагентов по адгезионной устойчивости следует ингибитор коррозии Азол С 1-130 (фиг.6). Его остаточное содержание на поверхности металла составляет до 89,5%, при адгезионной устойчивости на 1 моле поверхности, равной 9,32 10-2 моля.
Пример 4. Определеие адгезионной устойчивости на поверхности металла ингибитора коррозии Азол С1-130.
Далее из числа изученных реагентов по адгезионной устойчивости следует ингибитор коррозии Азол С 1-130 (фиг.6). Его остаточное содержание на поверхности металла составляет до 89,5%, при адгезионной устойчивости на 1 моле поверхности, равной 9,32 10-2 моля.
Пример 5. Определение адгезионной устойчивости на поверхности металла ингибитора коррозии и бактерицида СНПХ-1004Р.
Ингибитор коррозии и бактерицида СНПХ-1004Р, изученный в данной серии экспериментов, наименее устойчив к “отмыванию” – фиг.7. Ингибитор коррозии и бактерицида СНПХ-1004Р, изученный в данной серии экспериментов, наименее устойчив к “отмыванию” и характеризуется наименьшей адгзионной устойчивостью фиг.8 (остаточное содержание до 89,3%, устойчивость 9,3 10-2 моля.
Пример 5. Определение адгезионной устойчивости на поверхности металла ингибитора коррозии и бактерицида СНПХ-1004Р.
Ингибитор коррозии и бактерицида СНПХ-1004Р, изученный в данной серии экспериментов, наименее устойчив к “отмыванию” – фиг.7. Ингибитор коррозии и бактерицида СНПХ-1004Р, изученный в данной серии экспериментов, наименее устойчив к “отмыванию” и характеризуется наименьшей адгзионной устойчивостью фиг.8 (остаточное содержание до 89,3%, устойчивость 9,3 10-2 моля.
Для непосредственного сравнения адгезионной устойчивости изученных ингибиторов коррозии на фиг.8 представлены кинетические кривые для всех реагентов при температуре 20oС. Кроме информации об адгезионной устойчивости их на поверхности металла, результаты непосредственно иллюстрируют аналитическую чувствительность заявляемого способа – “плато” кинетических кривых различаются в пределах 0,4. . .0,8 10-2 моля.
Для непосредственного сравнения адгезионной устойчивости изученных ингибиторов коррозии на фиг.8 представлены кинетические кривые для всех реагентов при температуре 20oС. Кроме информации об адгезионной устойчивости их на поверхности металла, результаты непосредственно иллюстрируют аналитическую чувствительность заявляемого способа – “плато” кинетических кривых различаются в пределах 0,4. . .0,8 10-2 М (моль), а близлежащие – 0,55… 0,59 10-2 М (моль), а близлежащие – 0,55… 0,59 10-2 М.
ИСТОЧНИКИ ИНФОРМАЦИИ 10-2 М.
ИСТОЧНИКИ ИНФОРМАЦИИ1. Гоник А.А. Коррозия нефтепромыслового оборудования и меры ее предупреждения. – М.: Недра, 1976. 2. Гутман Э.М. Механохимия металлов и защита от коррозии. – М.: Металлургия, 1981. 3. Гутман Э.М. и др. Защита газопроводов нефтяных промыслов от сероводородной коррозии. – М.: Недра, 1988. 4. Патент РФ 2179714, G 01 N 13/00, БИ 5, 2002 г. 5. Решение от 29.01.02 о выдаче Патента РФ по заявке 2000118651/03. 6. Методика контроля микробиологической зараженности нефтепромысловых вод и оценка бактерицидного действия реагентов. – РД 39-3-937-83. ВНИИСПТнефть, 1984. Формула изобретения 1. Способ определения адгезионной устойчивости ингибиторов коррозии на поверхности металла, включающий определение интенсивности процесса их адгезии поверхностью образца металла, отличающийся тем, что последовательно образец металла помещают в проточную электрохимическую систему, приводят в контакт с жидкой коррозионно-активной средой – водным раствором электролита путем создания и поддержания постоянного во времени потока его через электрохимическую систему, дожидаются стационарности процесса образования на поверхности металла ионно-гидратного слоя, характеризующего ее адгезионную молекулярную емкость, вносят в электрохимическую систему ингибиторы коррозии и их адгезионные свойства определяют по интенсивности процессов выхода электроактивных компонентов ионно-гидратного слоя в свободную фазу, электрохимически сопряженных с процессами его разрушения при адгезии ингибиторов коррозии на поверхности металла, после чего, для удаления адгезированных ингибиторов коррозии, восстанавливают поток исходного водного раствора электролита через электрохимическую систему, и адгезионную устойчивость ингибиторов коррозии на поверхности металла определяют по интенсивности и степени восстановления ионно-гидратного слоя при повторном его образовании в процессе удаления ингибиторов коррозии с поверхности металла электроактивными компонентами ионно-гидратного слоя. 2. Способ по п. 1, отличающийся тем, что в качестве водного раствора электролита используют нефтепромысловую воду или ее модель. 3. Способ по п.1 или 2, отличающийся тем, что контроль создания и поддержания постоянного во времени потока электролита через электрохимическую систему и контроль стационарности процесса образования на поверхности металла ионно-гидратного слоя осуществляют по потенциалу течения. 4. Способ по п.1, или 2, или 3, отличающийся тем, что интенсивность процессов выхода электроактивных компонентов ионно-гидратного слоя в свободную фазу определяют как потенциал течения электрометрически, прямым измерением разности потенциалов между “источником” и “стоком” потока электролита в электрохимической системе, с использованием электродной пары из инертного металла. РИСУНКИ
PC4A – Регистрация договора об уступке патента Российской Федерации на изобретение
(73) Патентообладатель(и):
(73) Патентообладатель:
Дата и номер государственной регистрации перехода исключительного права: 10.03.2004 № 18627
Извещение опубликовано: 10.08.2004 БИ: 22/2004
PC4A – Регистрация договора об уступке патента Российской Федерации на изобретение
(73) Патентообладатель(и):
(73) Патентообладатель:
Дата и номер государственной регистрации перехода исключительного права: 30.09.2005 № РД0002462
Извещение опубликовано: 20.11.2005 БИ: 32/2005
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 13.04.2006
Извещение опубликовано: 10.01.2008 БИ: 01/2008
|
||||||||||||||||||||||||||
