Патент на изобретение №2209060
|
||||||||||||||||||||||||||
(54) СПОСОБ ПОЛУЧЕНИЯ ПОКРЫТЫХ ОБОЛОЧКОЙ СФЕРИЧЕСКИХ ГРАНУЛ ПРОСТАНА
(57) Реферат: Изобретение относится к области фармации и касается способа получения покрытых оболочкой сферических гранул простана. Изобретение заключается в том, что полимер наносят толщиной в пределах от 1 до 5% (об./об.) от общей массы, при этом общая масса соответствует составу покрытых оболочкой сферических гранул, проникающую способность полимера реализуют таким образом, что она проявляется при термостатировании при температуре в интервале от 45 до 65oС, или проникающую способность полимера реализуют таким образом, что она проявляется при термостатировании, проводимом по меньшей мере в течение 24 ч, в качестве фармацевтического активного вещества применяют производное простана. В качестве предпочтительного активного вещества применяют 5-(Е)-(1S, 5S,6R)-7-гидрокси-6[(Е)-(3S,4RS)-3-гидрокси-4-метил-1-октен-6-инил] бицикло [3.3.0] октен-3-илиденпентановую кислоту с добавками циклодекстрина. Изобретение обеспечивает получение оболочек для сферических гранул, благодаря которому после длительного срока хранения не были бы нарушены требования, предъявляемые к спецификации продукта. 9 з.п.ф-лы, 4 табл. Изобретение относится к способу получения покрытых оболочкой сферических гранул, прежде всего для композиций с производными простана. Уровень техники Производные простана подробно описаны в заявке ЕР 0011591 (поданной 18.10.1979 г. ). Производные простана представляют собой соединения, дериватизированные из простациклина (PGl2). Вместо атома кислорода 9-простого эфира в простациклине они содержат в своем составе метиленовую группу. Производные простана применяются для лечения различных заболеваний, основанного в первую очередь на их воздействии на сердечно-сосудистую систему и подавлении агрегации тромбоцитов. Применение производных простана в качестве медикаментозного средства подробно описано в европейской заявке ЕР 0011591. В заявках ЕР 0055208, ЕР 0099538 и ЕР 0119949 представлены производные карбациклина, обладающие аналогичными показаниями, что и вышеуказанные производные простана. Другие производные простана описаны в заявке ЕР 0084856, где они предлагаются к использованию при ингибировании агрегации тромбоцитов, снижении системного кровяного давления или для лечения опухолей желудка. Наиболее важным производным простана является илопрост. Предназначенный для орального приема илопрост (фармацевтическое активное вещество: 5-(Е)-(1S,5S,6R)-7-гидрокси-6[(Е)-(3S,4RS)-3-гидрокси-4-метил-1-октен-6-инил] бицикло [3.3.0] октен-3-илиденпентановая кислота) представляет собой капсулу пролонгированного действия. Такие капсулы пролонгированного действия относятся к так называемым мультиплексным лекарственным формам. Они состоят из твердожелатиновых капсул, заполненных множеством маленьких ретард-зерен (в случае илопроста для орального введения: сферические гранулы в оболочке). После перорального введения твердожелатиновая капсула быстро растворяется в желудке, что сопровождается высвобождением гранул пролонгированного действия. Из желудка, независимо от степени наполнения последнего, они попадают в кишечник. Одновременно с этим происходит непрерывное выделение содержащегося в них активного вещества. Диффузионные сферические гранулы представляют собой важнейшую группу покрытых оболочкой мультиплексных лекарственных форм. В качестве покрывных материалов для пероральных лекарственных форм пролонгированного действия наиболее пригодными зарекомендовали себя полимеры. Среди используемых в этих целях типов полимеров в первую очередь следует назвать этилцеллюлозу и эфиры поли(мет)акриловой кислоты. Эти полимеры могут применяться либо в виде органического раствора, либо диспергированными в водной фазе. Поскольку они являются экологически более чистыми, более надежными и более рентабельными в их использовании, в промышленности во все возрастающей степени находят применение водные дисперсии полимеров. К наиболее известным торговым наименованиям относятся Aquacoat ECD 30  , Surelease , Surelease или Eudragit или Eudragit NE 30 D, RL 30 D и RS 30 D. В состав используемых для нанесения покрытия лаковых суспензий входят дополнительные аддитивы, наличие которых обусловлено спецификой технологии получения и последующего применения и которые наряду с другими компонентами способствуют достижению свойств пленкообразователя.
Технологически процесс нанесения оболочки на гранулы осуществляют с помощью полимерной мембраны в аппаратах с псевдоожиженным слоем. Благодаря воздушному потоку гранулы распределяются в аппарате, образуя псевдоожиженный или кипящий слой, на который в зависимости от типа аппарата противотоком либо прямотоком (распыление сверху, соответственно снизу) из распылительного устройства (через одно либо несколько сопел) напыляют полимерную дисперсию совместно с добавленными аддитивами. В результате перемещения в псевдоожиженном слое обеспечивается равномерное распределение тонкой дисперсии по всей поверхности гранул. Одновременно с этим под действием потока сушильного воздуха происходит испарение диспергатора, т.е. воды, и частицы по возрастающей принимают форму плотной шаровой упаковки, после чего наблюдается все более интенсивное взаимопроникновение частиц. Этот процесс известен под названием коалесценция. На завершающей стадии указанного процесса образуется практически гомогенная, нерастворимая в воде пленка. Эта окружающая каждую гранулу пленка служит в качестве диффузионного барьера для находящегося в сердцевине активного лекарственного вещества и обеспечивает тем самым в последующем постепенное, замедленное высвобождение последнего.
Процесс получения илопроста орального осуществляют в две основные стадии. На первой из них методом экструзии/сфероидизации формируют содержащие активное вещество сырые гранулы сферической формы. Эти сырые гранулы состоят на 90% из лактозы и 10% Avicel PH 101, используемых в качестве вспомогательных веществ, и содержат в качестве активного вещества илопрост- NE 30 D, RL 30 D и RS 30 D. В состав используемых для нанесения покрытия лаковых суспензий входят дополнительные аддитивы, наличие которых обусловлено спецификой технологии получения и последующего применения и которые наряду с другими компонентами способствуют достижению свойств пленкообразователя.
Технологически процесс нанесения оболочки на гранулы осуществляют с помощью полимерной мембраны в аппаратах с псевдоожиженным слоем. Благодаря воздушному потоку гранулы распределяются в аппарате, образуя псевдоожиженный или кипящий слой, на который в зависимости от типа аппарата противотоком либо прямотоком (распыление сверху, соответственно снизу) из распылительного устройства (через одно либо несколько сопел) напыляют полимерную дисперсию совместно с добавленными аддитивами. В результате перемещения в псевдоожиженном слое обеспечивается равномерное распределение тонкой дисперсии по всей поверхности гранул. Одновременно с этим под действием потока сушильного воздуха происходит испарение диспергатора, т.е. воды, и частицы по возрастающей принимают форму плотной шаровой упаковки, после чего наблюдается все более интенсивное взаимопроникновение частиц. Этот процесс известен под названием коалесценция. На завершающей стадии указанного процесса образуется практически гомогенная, нерастворимая в воде пленка. Эта окружающая каждую гранулу пленка служит в качестве диффузионного барьера для находящегося в сердцевине активного лекарственного вещества и обеспечивает тем самым в последующем постепенное, замедленное высвобождение последнего.
Процесс получения илопроста орального осуществляют в две основные стадии. На первой из них методом экструзии/сфероидизации формируют содержащие активное вещество сырые гранулы сферической формы. Эти сырые гранулы состоят на 90% из лактозы и 10% Avicel PH 101, используемых в качестве вспомогательных веществ, и содержат в качестве активного вещества илопрост- -циклодекстрин-клатрат. Количество илопроста составляет 0,05, соответственно 0,1 мг на 65, соответственно 130 мг сферических гранул [содержание активного вещества приблизительно 0,08% (об./об.)]. Затем на второй стадии в аппарате с псевдоожиженным слоем на сырые гранулы наносят покрывную суспензию на основе Eudragit NE 30 D и аддитивов.
По технологии, разрабатывавшейся вначале в лабораторных условиях, на сырые сферические гранулы в аппарате с псевдоожиженным слоем (АПС), тип GPCG-3 (фирмы Glatt), соответственно тип Strea (фирмы Aeromatic) (в обоих случаях работали по методу распыления сверху) наносили напылением в основном такую же в качественном отношении покрывную суспензию, которую еще применяют и в настоящее время. Целевым показателем для лакового покрытия служил определяемый в результате механизм высвобождения активного вещества (количество высвободившегося активного вещества выявляли, в частности, по истечении 1, 2 и 3 часов), который исследовали в тесте на диссоциацию согласно USP (Фармакопея США), аппарат I (корзина). Полученные сферические гранулы использовали для первых кинетических и клинических исследований. Одна из проблем, с которыми приходилось сталкиваться с самого начала, заключалась в том, что процесс высвобождения активного вещества из указанной композиции несколько замедлялся по истечении определенного срока хранения. Первые крупные партии (в промышленном масштабе) наносили в аппарате типа WSG Aeromatic MP 4 (фирмы Aeromatic). Так же, как и в имевших меньшие габариты лабораторных аппаратах, напыление проводили противотоком (распыление сверху). При этом суспензию с помощью распылительного сопла напыляли на находившиеся в псевдоожиженном слое сферические гранулы сверху в направлении, противоположном движению приточного воздуха. В итоге в аппарате вышеназванного типа Aeromatic MP 4 на каждые 75 кг сырых сферических гранул, содержавших активное вещество, наносили напылением по 16,5 кг лаковой суспензии.
При переходе от работы по описанному способу в лабораторных условиях к работе с использованием аппарата Aeromatic MP 4 было установлено, что процесс высвобождения активного вещества по истечении определенного срока хранения замедлялся, и по этой причине стало невозможным получать партии гранул, для покрытия которых пытались в последующем использовать лак в количестве, превышающем 16,5 кг, поскольку они уже не отвечали требуемой спецификации. Этот выявленный феномен, присущий указанной композиции, описан в публикации авторов T.G. Wagner и S. Keitel, The effect of dispersion concentration and curing temperature on drug release of pellets coated with Eudragit NE 30 D, Proc., материалы 1-й Всемирной конференции APGI/APV, Будапешт, 9-11 мая 1995 г.
Кроме того, впервые подвергли исследованию влияние последующей (дополнительной) обработки (термостатирования) на высвобождение активного вещества. Однако для промышленного производства подобная обработка оказалась неприемлемой и от нее пришлось в принципе отказаться, поскольку на тот момент не имелось соответствующих сушильных шкафов, точные масштабы проблемы все еще не были известны, а также существовали серьезные сомнения, обусловленные термической нестабильностью активного вещества. Это и послужило причиной того, что для нанесения стали использовать такое количество лака, которое привело к получению гранул с механизмом высвобождения активного вещества вне пределов требуемой спецификации. По истечении приблизительно 4 недель хранения при комнатной температуре процесс высвобождения активного вещества замедлялся и этот механизм соответствовал верхней трети спецификации. При последующем же хранении наблюдалось дальнейшее замедление.
В публикации авторов F.M. Goodhart и др., An evaluation of aqueous film-forming dispersions for controlled release. Pharmaceutical Technology, с. 65-71 (1984) описываются способы, в которых термостатирование проводят в научных целях, что продиктовано стремлением исследовать и понять суть упомянутых выше феноменов. Однако о результатах повышения устойчивости в названной публикации ничего не говорится.
В публикации авторов Shun Рог Li и др., Preparation and In-Vitro evaluation of a controlled release drug delivery system of Theophylline using an aqueous acrylic resin dispersion, Drug Development and Industrial Pharmacy, том 15(8), с. 1231-1242 (1989) описывается технология термостатирования, с помощью которой активное вещество теофиллин покрывают оболочкой из эфира поли(мет)акриловой кислоты. Термостатирование проводят при температуре 40oС в течение 24 часов. В результате такой операции удается повысить устойчивость указанного активного вещества.
Задача изобретения -циклодекстрин-клатрат. Количество илопроста составляет 0,05, соответственно 0,1 мг на 65, соответственно 130 мг сферических гранул [содержание активного вещества приблизительно 0,08% (об./об.)]. Затем на второй стадии в аппарате с псевдоожиженным слоем на сырые гранулы наносят покрывную суспензию на основе Eudragit NE 30 D и аддитивов.
По технологии, разрабатывавшейся вначале в лабораторных условиях, на сырые сферические гранулы в аппарате с псевдоожиженным слоем (АПС), тип GPCG-3 (фирмы Glatt), соответственно тип Strea (фирмы Aeromatic) (в обоих случаях работали по методу распыления сверху) наносили напылением в основном такую же в качественном отношении покрывную суспензию, которую еще применяют и в настоящее время. Целевым показателем для лакового покрытия служил определяемый в результате механизм высвобождения активного вещества (количество высвободившегося активного вещества выявляли, в частности, по истечении 1, 2 и 3 часов), который исследовали в тесте на диссоциацию согласно USP (Фармакопея США), аппарат I (корзина). Полученные сферические гранулы использовали для первых кинетических и клинических исследований. Одна из проблем, с которыми приходилось сталкиваться с самого начала, заключалась в том, что процесс высвобождения активного вещества из указанной композиции несколько замедлялся по истечении определенного срока хранения. Первые крупные партии (в промышленном масштабе) наносили в аппарате типа WSG Aeromatic MP 4 (фирмы Aeromatic). Так же, как и в имевших меньшие габариты лабораторных аппаратах, напыление проводили противотоком (распыление сверху). При этом суспензию с помощью распылительного сопла напыляли на находившиеся в псевдоожиженном слое сферические гранулы сверху в направлении, противоположном движению приточного воздуха. В итоге в аппарате вышеназванного типа Aeromatic MP 4 на каждые 75 кг сырых сферических гранул, содержавших активное вещество, наносили напылением по 16,5 кг лаковой суспензии.
При переходе от работы по описанному способу в лабораторных условиях к работе с использованием аппарата Aeromatic MP 4 было установлено, что процесс высвобождения активного вещества по истечении определенного срока хранения замедлялся, и по этой причине стало невозможным получать партии гранул, для покрытия которых пытались в последующем использовать лак в количестве, превышающем 16,5 кг, поскольку они уже не отвечали требуемой спецификации. Этот выявленный феномен, присущий указанной композиции, описан в публикации авторов T.G. Wagner и S. Keitel, The effect of dispersion concentration and curing temperature on drug release of pellets coated with Eudragit NE 30 D, Proc., материалы 1-й Всемирной конференции APGI/APV, Будапешт, 9-11 мая 1995 г.
Кроме того, впервые подвергли исследованию влияние последующей (дополнительной) обработки (термостатирования) на высвобождение активного вещества. Однако для промышленного производства подобная обработка оказалась неприемлемой и от нее пришлось в принципе отказаться, поскольку на тот момент не имелось соответствующих сушильных шкафов, точные масштабы проблемы все еще не были известны, а также существовали серьезные сомнения, обусловленные термической нестабильностью активного вещества. Это и послужило причиной того, что для нанесения стали использовать такое количество лака, которое привело к получению гранул с механизмом высвобождения активного вещества вне пределов требуемой спецификации. По истечении приблизительно 4 недель хранения при комнатной температуре процесс высвобождения активного вещества замедлялся и этот механизм соответствовал верхней трети спецификации. При последующем же хранении наблюдалось дальнейшее замедление.
В публикации авторов F.M. Goodhart и др., An evaluation of aqueous film-forming dispersions for controlled release. Pharmaceutical Technology, с. 65-71 (1984) описываются способы, в которых термостатирование проводят в научных целях, что продиктовано стремлением исследовать и понять суть упомянутых выше феноменов. Однако о результатах повышения устойчивости в названной публикации ничего не говорится.
В публикации авторов Shun Рог Li и др., Preparation and In-Vitro evaluation of a controlled release drug delivery system of Theophylline using an aqueous acrylic resin dispersion, Drug Development and Industrial Pharmacy, том 15(8), с. 1231-1242 (1989) описывается технология термостатирования, с помощью которой активное вещество теофиллин покрывают оболочкой из эфира поли(мет)акриловой кислоты. Термостатирование проводят при температуре 40oС в течение 24 часов. В результате такой операции удается повысить устойчивость указанного активного вещества.
Задача изобретенияИсходя из вышеизложенного в основу изобретения была положена задача разработать способ получения оболочки для сферических гранул, который обеспечивал бы такой механизм высвобождения активного вещества, благодаря которому и после длительного срока хранения не были нарушены требования, предъявляемые к спецификации продукта. Указанная задача решается с помощью способа получения покрытых оболочкой сферических гранул, который включает следующие стадии: а) в псевдоожиженном или в кипящем слое на содержащие активное вещество сырые сферические гранулы из по меньшей мере одного фармацевтического активного вещества и необязательно фармацевтически приемлемых добавок и/или носителей наносят напылением полимерную дисперсию и аддитивы, при этом в состав дисперсии в качестве полимера входит этилцеллюлоза и/или эфир поли(мет)акриловой кислоты, б) полимерную дисперсию наносят с толщиной полимера в пределах от 1 до 5% (об./об.) от общей массы, причем общая масса соответствует составу покрытых оболочкой гранул, в) покрытые полимерной оболочкой сферические гранулы подвергают термостатированию при температуре в интервале от 45 до 65oС, г) термостатирование покрытых полимерной оболочкой сферических гранул проводят по меньшей мере в течение 24 часов и д) в качестве фармацевтического активного вещества применяют производное простана. Предпочтительно работать в псевдоожиженном или кипящем слое, в котором напыление на сферические гранулы осуществляют прямотоком. Более предпочтителен такой прямоточный метод, при котором полимерную дисперсию (и добавленные аддитивы) распыляют в псевдоожиженный или кипящий слой с помощью по меньшей мере одного или двух, предпочтительно двенадцати сопел. Предпочтительно, чтобы в качестве полимера в состав полимерной дисперсии входили либо этилцеллюлоза либо один из эфиров поли(мет)акриловой кислоты. Целесообразно добиваться равномерного распределения толщины наносимого полимера по всей поверхности гранул. Так, в частности, для толщины полимерной пленки приемлемы лишь допуски, не превышающие  30%, предпочтительно 30%, предпочтительно  20% и наиболее предпочтительно 20% и наиболее предпочтительно  10%.
Предпочтительным является такой вариант способа по изобретению, согласно которому из покрытых оболочкой сферических гранул изготавливают таблетки или капсулы пролонгированного действия, представляющие собой, например, твердожелатиновые капсулы. Предпочтительно заполнять гранулами капсулы, хотя в принципе возможно заполнение и других емкостей. Такими емкостями могут быть ВМУ (внутриматочные устройства), из которых с замедлением, постепенно высвобождается находящийся там стероид. В равной степени приемлемы таблетки, представляющие собой легко растворимые спрессованные композиции. Кроме того, в качестве емкостей могут служить имплантаты.
Предпочтителен далее такой вариант осуществления способа по изобретению, согласно которому в состав сферических гранул в качестве активного вещества включают производные простана, а также фармацевтически приемлемые носители и/или добавки. В равной степени предпочтительны активные вещества в низкой дозировке, как например, стероиды (содержание активного вещества менее 1%). К наиболее предпочтительным активным веществам относится 5-(Е)-(1S,5S,6R)-7-гидрокси-6[(Е)-(3S,4RS)-3-гидрокси-4-метил-1-октен-6-инил] бицикло [3.3.0] октен-3-илиденпентановая кислота, а в качестве добавки – по меньшей мере циклодекстрин.
Преимущества изобретения 10%.
Предпочтительным является такой вариант способа по изобретению, согласно которому из покрытых оболочкой сферических гранул изготавливают таблетки или капсулы пролонгированного действия, представляющие собой, например, твердожелатиновые капсулы. Предпочтительно заполнять гранулами капсулы, хотя в принципе возможно заполнение и других емкостей. Такими емкостями могут быть ВМУ (внутриматочные устройства), из которых с замедлением, постепенно высвобождается находящийся там стероид. В равной степени приемлемы таблетки, представляющие собой легко растворимые спрессованные композиции. Кроме того, в качестве емкостей могут служить имплантаты.
Предпочтителен далее такой вариант осуществления способа по изобретению, согласно которому в состав сферических гранул в качестве активного вещества включают производные простана, а также фармацевтически приемлемые носители и/или добавки. В равной степени предпочтительны активные вещества в низкой дозировке, как например, стероиды (содержание активного вещества менее 1%). К наиболее предпочтительным активным веществам относится 5-(Е)-(1S,5S,6R)-7-гидрокси-6[(Е)-(3S,4RS)-3-гидрокси-4-метил-1-октен-6-инил] бицикло [3.3.0] октен-3-илиденпентановая кислота, а в качестве добавки – по меньшей мере циклодекстрин.
Преимущества изобретенияПри разработке оптимальных условий для проведения процесса термостатирования согласно изобретению было установлено, что с целью стабилизировать воспроизводимым образом высвобождение активного вещества из имеющейся в настоящее время композиции и поддерживать его в течение всего срока хранения на постоянном уровне термостатирование целесообразно осуществлять при температуре 50oС в течение 48 часов. Отличие предлагаемого в настоящем изобретении способа по сравнению со способом, описанным в публикации Shun Рог Li и др. в Drug Development and Industrial Pharmacy, том 15(8), с. 1231-1242 (1989), состоит в том, что производные простана в отличие от теофиллина не удается стабилизировать, если подвергать их термостатированию при 40oС в течение 24 часов. Поэтому предлагаемое в указанной публикации техническое решение касается термостатирования другой по ее специфике субстанции и неприменимо по отношению к производным простана, поскольку не обеспечивает при этом требуемого эффекта. Предпочтительные варианты осуществления изобретения Этилцеллюлоза описана в R  mpp Chemie Lixikon, 9-е изд., с. 1254 (1990), под ред. J. Falbe и М. Regitz, изд-во Georg Thieme Verlag, Штутгарт (ISBN-3-13-734709-2). Данная публикация включена в настоящее описание в качестве ссылки.
В качестве полимера предпочтителен эфир поли(мет)акриловой кислоты, описанный в Европейском справочнике лекарственных средств ( mpp Chemie Lixikon, 9-е изд., с. 1254 (1990), под ред. J. Falbe и М. Regitz, изд-во Georg Thieme Verlag, Штутгарт (ISBN-3-13-734709-2). Данная публикация включена в настоящее описание в качестве ссылки.
В качестве полимера предпочтителен эфир поли(мет)акриловой кислоты, описанный в Европейском справочнике лекарственных средств ( Arzneibuch), 3-е изд. , 1977, с. 1516-1517, пункт 733, изд-во Deutscher Apotheker Verlag, Штутгарт, Эшборн. Названная публикация также включена в качестве ссылки в настоящее описание.
Наиболее предпочтительным в качестве полимера является Eudragit NE 30 D, описанный в следующих публикациях: Arzneibuch), 3-е изд. , 1977, с. 1516-1517, пункт 733, изд-во Deutscher Apotheker Verlag, Штутгарт, Эшборн. Названная публикация также включена в качестве ссылки в настоящее описание.
Наиболее предпочтительным в качестве полимера является Eudragit NE 30 D, описанный в следующих публикациях:– К. Lehmann и D. Dreher, Coating small particles with acylic resins, Pharmaceutical Technology, том 3(3) (1979); – К. Lehmann, Formulation of controlled release tablets with acrylic resins, Ada Pharm. Fenn., том 93, с. 55 (1984); – К. Lehmann, Acrylic latices from redispersable powders for peroral and transdermal drug formulations, Drug Development and Industrial Pharmacy, том 12(3), с. 265 (1986); – К. Lehmann и D. Dreher, Mischbarkeit 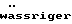 Poly(meth)acrylat -Dispersionen Poly(meth)acrylat -Dispersionen  , Pharm. Ind., том 48, с. 1182 (1986); , Pharm. Ind., том 48, с. 1182 (1986);– K. Lehmann и H.U. Petereit, Verwendung 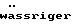 Poly(meth)acrylat -Dispersionen Poly(meth)acrylat -Dispersionen 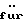 die Herstellung von Matrixtabletten, Acta Pharma. Tech., том 34(4), с.189 (1988); die Herstellung von Matrixtabletten, Acta Pharma. Tech., том 34(4), с.189 (1988);– К. Lehmann и др., Praktikum des Lackdragierens (1989). В состав сферических гранул, представленных в виде сырых гранул, входят фармацевтическое активное вещество, а также фармацевтически приемлемые носители и добавки. Такие носители и добавки описаны в Remington’s Pharmaceutical Science, 15-е изд., изд-во Mack Publishing Company, Истон, Пенсильвания (1980). Более предпочтителен в качестве носителя циклодекстрин. Циклодекстрин образуется в результате расщепления крахмала бактериями Bacillus macerans или Bacillus curculans под действием циклодекстрингликозилтрансферазы. Циклодекстрины состоят из 6, 7 или 8  -1-4-сочлененных звеньев глюкозы ( -1-4-сочлененных звеньев глюкозы ( -, -,  – и – и  -циклодекстрины). Циклогекса-(гепта-, окта-)амилозы расположены в кристаллической решетке циклодекстринов слоями таким образом, что они образуют сквозные внутримолекулярные каналы, в которых могут содержаться в различных количествах гидрофобные молекулы (литература: Adv. Carbohydr. Chem., том 12, с. 189 (1987), Angewandte Chemie, том 92, с. 343 (1980), Bender и Komiyma, Cyclodextrin Chemistry, Берлин: изд-во Springer 1978, Naturwissenschaften, том 154, с. 625 (1967)).
Понятие “фармацевтическое активное вещество” относится к производным простана общей формулы I или II -циклодекстрины). Циклогекса-(гепта-, окта-)амилозы расположены в кристаллической решетке циклодекстринов слоями таким образом, что они образуют сквозные внутримолекулярные каналы, в которых могут содержаться в различных количествах гидрофобные молекулы (литература: Adv. Carbohydr. Chem., том 12, с. 189 (1987), Angewandte Chemie, том 92, с. 343 (1980), Bender и Komiyma, Cyclodextrin Chemistry, Берлин: изд-во Springer 1978, Naturwissenschaften, том 154, с. 625 (1967)).
Понятие “фармацевтическое активное вещество” относится к производным простана общей формулы I или II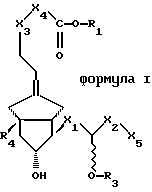 или 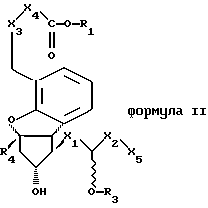 где Х1 представляет собой -СН2-СН2-, транс -СН=СН или -C  C CХ2 представляет собой прямоцепочечную либо разветвленную насыщенную алкиленовую группу с 1-6 атомами углерода, X3 представляет собой -О- или -СН2-, Х4 представляет собой -СН2– или -[CH2]3-, Х5 представляет собой -Н или -C  C-R2, C-R2,R1 представляет собой атом водорода, алкильную группу с 1-6 атомами углерода, циклоалкильную группу с 5 или 6 атомами углерода или фенильную группу, R2 представляет собой прямоцепочечную либо разветвленную, насыщенную либо ненасыщенную алкильную группу с 1-6 атомами углерода, R3 представляет собой атом водорода, ацильный остаток с 1-4 атомами углерода или бензоильный остаток и R4 представляет собой -Н или -СН3, при этом – О-R3-группа находится в положении а или b, а также к их солям с физиологически приемлемыми основаниями, при условии, что R1 обозначает атом водорода. В заявках ЕР 0011591, ЕР 0055208, ЕР 0099538, ЕР 0119949, ЕР 0084856 и ЕР 0686036 описываются производные простана, их получение и применение. Указанные публикации в части, касающейся субстанций, их получения и применения, включены в объем настоящего изобретения. Для образования солей со свободными кислотами пригодны неорганические и органические основания, известные и используемые специалистами в данной области техники при образовании физиологически приемлемых солей. В качестве примеров можно назвать гидроксиды щелочных металлов, такие как гидроксид натрия и калия, гидроксиды щелочно-земельных металлов, такие как гидроксид кальция, аммиак, амины, такие как этаноламин, диэтаноламин, триэтаноламин, N-метилглюкамин, морфолин, трис(гидроксиметил) метиламин и т.п.  -циклодекстрин-клатраты получают согласно ЕР 0259468.
Предпочтительно получение производных простана по изобретению согласно представленной выше общей формуле I, -циклодекстрин-клатраты получают согласно ЕР 0259468.
Предпочтительно получение производных простана по изобретению согласно представленной выше общей формуле I,где X1 представляет собой транс -СН=СН-, Х2 представляет собой прямоцепочечную либо разветвленную насыщенную алкиленовую группу с 2-4 атомами углерода, X3 представляет собой -СН2-, Х4 представляет собой -СН2-, Х5 представляет собой -C  C-R2, C-R2,R1 представляет собой атом водорода, алкильную группу с 1-3 атомами углерода или фенильную группу, R2 представляет собой прямоцепочечную либо разветвленную, насыщенную либо ненасыщенную алкильную группу с 1-3 атомами углерода, R3 представляет собой атом водорода или ацильный остаток с 2 атомами углерода и R4 представляет собой -Н, при этом – О-R3-группа находится в положении а или b, а также их солей с физиологически приемлемыми основаниями, при условии, что R1 обозначает атом водорода. Наиболее предпочтительно применять производное простана под названием “илопрост”, представляющее собой 5-(Е)-(1S, 5S, 6R)-7-гидрокси-6[(Е)-(3S, 4RS)-3-гидрокси-4-метил-1-октен-6-инил] бицикло [3.3.0] октен-3-илиденпентановую кислоту. Понятие “активное вещество” включает далее такие субстанции, как цикапрост, эпталопрост, ципростен и/или берапрост и их соли. Фармацевтические активные вещества могут быть представлены также в формах с низкой дозировкой, при этом имеется в виду содержание активного вещества в количестве 1% и менее (об./об.) в пересчете на общую массу активного вещества, носителя и добавки. Предпочтителен процентный показатель 0,3 и ниже, более предпочтителен – 0,1 и ниже. Предпочтительна толщина полимерной оболочки от 1,5 до 4% (об./об.) в пересчете на общую массу, более предпочтительна толщина от 1,75 до 3% и наиболее предпочтительна толщина 2,1%  10% (2,0-2,2%).
Термостатирование предпочтительно проводить в диапазоне температур с нижним пределом 45oС, более предпочтительно 47oС, еще более предпочтительно 48oС и наиболее предпочтительно 50oС; верхний же предел не должен превышать 65oС, более предпочтительно 60oС, еще более предпочтительно 47oС и наиболее предпочтительно 53oС.
Продолжительность пребывания материала в аппарате при термостатировании составляет по меньшей мере 24 часа. Сравнительно хороших результатов достигают при более продолжительном проведении этого процесса. Ухудшения показателей касательно высвобождения активного вещества можно избежать за счет сокращения продолжительности термостатирования. В принципе высокая температура может негативно влиять на устойчивость продукта, поэтому термостатирование целесообразно осуществлять в течение максимально возможного короткого периода времени и в щадящих условиях. Наиболее предпочтительна продолжительность пребывания материала в аппарате 48 ч 10% (2,0-2,2%).
Термостатирование предпочтительно проводить в диапазоне температур с нижним пределом 45oС, более предпочтительно 47oС, еще более предпочтительно 48oС и наиболее предпочтительно 50oС; верхний же предел не должен превышать 65oС, более предпочтительно 60oС, еще более предпочтительно 47oС и наиболее предпочтительно 53oС.
Продолжительность пребывания материала в аппарате при термостатировании составляет по меньшей мере 24 часа. Сравнительно хороших результатов достигают при более продолжительном проведении этого процесса. Ухудшения показателей касательно высвобождения активного вещества можно избежать за счет сокращения продолжительности термостатирования. В принципе высокая температура может негативно влиять на устойчивость продукта, поэтому термостатирование целесообразно осуществлять в течение максимально возможного короткого периода времени и в щадящих условиях. Наиболее предпочтительна продолжительность пребывания материала в аппарате 48 ч 5 ч.
Примеры 5 ч.
ПримерыПример 1 (старый способ, распыление сверху, промышленный масштаб, без термостатирования) а) Содержащие активное вещество сырые сферические гранулы формируют методом экструзии/сфероидизации. С этой целью предварительно приготовленную смесь, содержащую активное вещество и вспомогательные вещества (90% лактозы, 90% <0,1 мм, 10% Avicel PH 101 и илопрост-  -циклодекстрин-клатрата) подвергают гранулированию в смесительном аппарате с использованием воды. На второй стадии влажную порошковую смесь пропускают через решетку экструдера с получением гранулята в виде жгута, из которого затем в сфероидизационной камере формируют сферические гранулы. В завершение сырые сферические гранулы сушат в сушилке с псевдоожиженным слоем.
б) 75 кг содержащих активное вещество сырых сферических гранул [содержание активного вещества – илопроста – 0,08% (об./об.)] загружают в аппарат для нанесения покрытий типа Aeromatic MP 4, где методом распыления сверху на гранулы напыляют 16,5 кг покрывной суспензии следующего состава, кг: -циклодекстрин-клатрата) подвергают гранулированию в смесительном аппарате с использованием воды. На второй стадии влажную порошковую смесь пропускают через решетку экструдера с получением гранулята в виде жгута, из которого затем в сфероидизационной камере формируют сферические гранулы. В завершение сырые сферические гранулы сушат в сушилке с псевдоожиженным слоем.
б) 75 кг содержащих активное вещество сырых сферических гранул [содержание активного вещества – илопроста – 0,08% (об./об.)] загружают в аппарат для нанесения покрытий типа Aeromatic MP 4, где методом распыления сверху на гранулы напыляют 16,5 кг покрывной суспензии следующего состава, кг:Eudragit  NE 30 D – 7,063 NE 30 D – 7,063Стеарат магния – 0,090 Диоксид титана – 0,066 Полиэтиленгликоль 6000 – 0,040 Полисорбат 80 – 0,046 Вода – 9,0195 Общая масса покрывной суспензии – 16,500 Для процесса напыления устанавливают следующие параметры: температура приточного воздуха: 35oС; расход: 235 г/мин; распылительное сопло: сопло для распыления двухкомпонентных материалов, диаметр 1,8 мм; давление распыляющего воздуха: 4 бара. Полученные таким путем гранулы пролонгированного действия имеют следующий состав, мг: Илопрост – 0,050  -Циклодекстрин – 0,330 -Циклодекстрин – 0,330Лактоза, 90% <0,1 мм – 56,260 Avicel PH 101 – 6,250 Eudragit  NE – 1,777 NE – 1,777Стеарат магния – 0,075 Диоксид титана – 0,055 Полиэтиленгликоль 6000 – 0,034 Полисорбат 80 – 0,039 Диоксид кремния – 0,134 Общая масса гранул пролонгированного действия – 65,00 Исследования in vitro высвобождения активного вещества, проведенные с отобранной в тесте на диссоциацию пробой, аппарат 1, корзина, согласно Фармакопеи США в фосфатном буферном растворе при рН 7,4, дали результаты, приведенные в табл.1. Хранение проводили при комнатной температуре. Снижение показателей высвобождения активного вещества во время хранения свидетельствует об отсутствии стабильности полученного продукта. Пример 2 (старый способ, распыление сверху, лабораторный масштаб, без термостатирования, с термостатированием при 50oС в течение 4 часов) а) Содержащие активное вещество сырые сферические гранулы получают аналогично примеру 1а). б) 750 г содержащих активное вещество сырых сферических гранул [содержание активного вещества – илопроста – 0,08% (об./об.)] загружают в аппарат для нанесения покрытий типа Aeromatic Strea I, где на гранулы методом распыления сверху напыляют 240 г покрывной суспензии следующего состава, г: Eudragit  NE 30 D – 178,5 NE 30 D – 178,5Стеарат магния – 2,3 Диоксид титана – 1,7 Полиэтиленгликол 6000 – 1,0 Полисорбат 80 – 1,2 Вода – 232,2 Общая масса покрывной суспензии – 416,9 Для процесса напыления устанавливают следующие параметры: температура приточного воздуха: 28-32oС; расход: 4 г/мин; распылительное сопло: сопло для распыления двухкомпонентных материалов, диаметр 1,0 мм; давление распыляющего воздуха: 1,0 бар. По завершении процесса нанесения оболочки часть гранул пролонгированного действия подвергают термостатированию при 50oС в камерной сушилке с циркуляцией воздуха в течение 4 часов. Полученные таким путем гранулы пролонгированного действия имеют следующий состав, мг: Илопрост – 0,050  -Циклодекстрин – 0,330 -Циклодекстрин – 0,330Лактоза, 90%<0,1 мм – 54,632 Avicel PH 101 – 6,113 Eudragit  NE – 2,549 NE – 2,549Стеарат магния – 0,110 Диоксид титана – 0,979 Полиэтиленгликоль 6000 – 0,048 Полисорбат 80 – 0,057 Диоксид кремния – 0,132 Общая масса гранул пролонгированного действия – 65,00 Исследования in vitro высвобождения активного вещества, проведенные с отобранной в тесте на диссоциацию пробой, аппарат 1, корзина, согласно Фармакопеи США в фосфатном буферном растворе при рН 7,4, дали результаты, приведенные в табл.2. Хранение проводили при комнатной температуре. Снижение показателей высвобождения активного вещества в течение 4 недель хранения свидетельствует о том, что как не подвергнутый термостатированию продукт, так и продукт, подвергнутый термостатированию при 50oС в течение 4 часов, характеризуются отсутствием стабильности. Пример 3 (модифицированный, новый способ, распыление снизу, промышленный масштаб, термостатирование при 50oС в течение 4 часов) а) Содержащие активное вещество сырые сферические гранулы получают аналогично примеру 1а). б) 45 кг содержащих активное вещество сырых сферических гранул [содержание активного вещества – илопроста – 0,08% об./об.)] загружают в аппарат для нанесения покрытий типа  HKC 50, где методом распыления снизу на гранулы напыляют 7,7 кг покрывной суспензии следующего состава, кг: HKC 50, где методом распыления снизу на гранулы напыляют 7,7 кг покрывной суспензии следующего состава, кг:Eudragit  NE 30 D – 3,297 NE 30 D – 3,297Стеарат магния – 0,042 Диоксид титана – 0,031 Полиэтиленгликоль 6000 – 0,019 Полисорбат 80 – 0,021 Вода – 4,290 Общая масса покрывной суспензии – 7,700 Для процесса напыления устанавливают следующие параметры: температура приточного воздуха: 32oС; расход: 200 г/мин; распылительное сопло: 12 сопел для распыления трехкомпонентных материалов, диаметр 0,8 мм; давление распыляющего воздуха: 1,5 бар. По завершении процесса нанесения оболочки часть гранул пролонгированного действия подвергают термостатированию при 50oС в течение 4 часов в камерной сушилке с циркуляцией воздуха. Полученные таким путем гранулы пролонгированного действия имеют следующий состав, мг: Илопрост – 0,050  -Циклодекстрина – 0,330 -Циклодекстрина – 0,330Лактоза, 90% <0,1 мм – 56,606 Avicel PH 101 – 6,332 Eudragit  NE – 1,392 NE – 1,392Стеарат магния – 0,059 Диоксид титана – 0,044 Полиэтиленгликоль 6000 – 0,027 Полисорбат 80 – 0,030 Диоксид кремния – 0,130 Общая масса гранул пролонгированного действия – 65,00 Исследования in vitro высвобождения активного вещества, проведенные с отобранной в тесте на диссоциацию пробой, аппарат 1, корзина, согласно Фармакопеи США в фосфатном буферном растворе при рН 7,4, дали результаты, приведенные в табл.3. Хранение проводили при комнатной температуре. Как и в примере 3, у продукта, подвергнутого термостатированию при 50oС в течение 4 часов, имеет место снижение показателей высвобождения активного вещества в течение 4 недель хранения. Этот продукт также характеризуется отсутствием стабильности. Пример 4 (новый способ/завершающий процесс, распыление снизу, промышленный масштаб, без термостатирования и с термостатированием при 50oС в течение 48 часов) а) Содержащие активное вещество сырые сферические гранулы получают аналогично примеру 1а). б) 45 кг содержащих активное вещество сырых сферических гранул [содержание активного вещества – илопроста – 0,08% об./об.)] загружают в аппарат для нанесения покрытий типа  HKC 50, где методом распыления снизу на гранулы напыляют 7,6 кг покрывной суспензии следующего состава, кг: HKC 50, где методом распыления снизу на гранулы напыляют 7,6 кг покрывной суспензии следующего состава, кг:Eudragit  NE 30 D – 3,253 NE 30 D – 3,253Стеарат магния – 0,041 Диоксид титана – 0,030 Полиэтиленгликоль 6000 – 0,018 Полисорбат 80 – 0,021 Вода – 4,237 Общая масса покрывной суспензии – 7,600 Для процесса напыления устанавливают следующие параметры: температура приточного воздуха: 32oС; расход: 200 г/мин; распылительное сопло: 12 сопел для распыления трехгомпонентных материалов, диаметр 0,8 мм; давление распыляющего воздуха: 1,5 бар. По завершении процесса нанесения оболочки часть гранул пролонгированного действия подвергают термостатированию при 50oС в течение 48 часов в камерной сушилке с циркуляцией воздуха. Полученные таким путем гранулы пролонгированного действия имеют следующий состав, мг: Илопрост – 0,050  -Циклодекстрина – 0,330 -Циклодекстрина – 0,330Лактоза, 90% <0,1 мм – 56,628 Avicel PH 101 – 6,334 Eudragit  NE – 1,374 NE – 1,374Стеарат магния – 0,058 Диоксид титана – 0,042 Полиэтиленгликоль 6000 – 0,025 Полисорбат 80 – 0,030 Диоксид кремния – 0,129 Общая масса гранул пролонгированного действия – 65,00 Исследования in vitro высвобождения активного вещества, проведенные с отобранной в тесте на диссоциацию пробой, аппарат 1, корзина, согласно Фармакопеи США в фосфатном буферном растворе при рН 7,4, дали результаты, приведенные в табл.4. Хранение проводили при комнатной температуре. Продукт, подвергнутый термостатированию при 50oС в течение 48 часов, остается стабильным и после хранения в течение 9 месяцев. Формула изобретения 1. Способ получения покрытых оболочкой сферических гранул простана, заключающийся в том, что а) в псевдоожиженном или в кипящем слое на содержащие активное вещество сырые сферические гранулы из по меньшей мере одного фармацевтического активного вещества и необязательно фармацевтически приемлемых добавок и/или носителей наносят напылением полимерную дисперсию и аддитивы, при этом в состав дисперсии в качестве полимера входит этилцеллюлоза и/или эфир поли(мет)акриловой кислоты, б) полимерную дисперсию наносят с толщиной полимера в пределах от 1 до 5% (об./об.) от общей массы, причем общая масса соответствует составу покрытых оболочкой гранул, в) покрытые полимерной оболочкой сферические гранулы подвергают термостатированию при температуре в интервале от 45 до 65oС, г) термостатирование покрытых полимерной оболочкой сферических гранул проводят по меньшей мере в течение 24 ч и д) в качестве фармацевтического активного вещества применяют производное простана. 2. Способ по п.1, в котором на сферические гранулы наносят оболочку прямоточным методом. 3. Способ по п.2, в котором с помощью по меньшей мере одного или двух сопел полимерную дисперсию и необязательно добавленные аддитивы распыляют в псевдоожиженный или кипящий слой. 4. Способ по любому из пп.1-3, в котором покрытые оболочкой сферические гранулы затем инкапсулируют, заключая в капсулу пролонгированного действия либо в таблетку. 5. Способ по любому из предыдущих пунктов, в котором в качестве носителя используют циклодекстрин. 6. Способ по любому из предыдущих пунктов, в котором активное вещество представляет собой 5-(Е)-(1S,5S,6R)-7-гидрокси-6[(Е)-(3S,4RS)-3-гидрокси-4-метил-1-октен-6-инил] бицикло [3.3.0] октен-3-илиденпентановую кислоту, в виде  -циклодекстринклатратама.
7. Способ по любому из предыдущих пунктов, в котором фармацевтические активные вещества применяют в низкой дозировке.
8. Способ по любому из предыдущих пунктов, в котором полимерную оболочку наносят толщиной от 1,5 до 4% (об./об.) от общей массы.
9. Способ по любому из предыдущих пунктов, в котором термостатирование проводят при температуре в интервале от 45 до 62oС.
10. Способ по любому из предыдущих пунктов, в котором термостатирование проводят по меньшей мере в течение (48 -циклодекстринклатратама.
7. Способ по любому из предыдущих пунктов, в котором фармацевтические активные вещества применяют в низкой дозировке.
8. Способ по любому из предыдущих пунктов, в котором полимерную оболочку наносят толщиной от 1,5 до 4% (об./об.) от общей массы.
9. Способ по любому из предыдущих пунктов, в котором термостатирование проводят при температуре в интервале от 45 до 62oС.
10. Способ по любому из предыдущих пунктов, в котором термостатирование проводят по меньшей мере в течение (48 5) ч. 5) ч.
РИСУНКИ
PD4A – Изменение наименования обладателя патента СССР или патента Российской Федерации на изобретение
(73) Новое наименование патентообладателя:
Адрес для переписки:
Извещение опубликовано: 20.03.2010 БИ: 08/2010
|
||||||||||||||||||||||||||
