Патент на изобретение №2209041
|
||||||||||||||||||||||||||
(54) СПОСОБ ЛЕЧЕНИЯ ЦЕРЕБРАЛЬНОГО ВАЗОСПАЗМА
(57) Реферат: Изобретение относится к области медицины, а именно к нейрохирургии, и может быть использовано при лечении больных с развившимся вторичным церебральным вазоспазмом после субарахноидального кровоизлияния вследствие разрыва артериальной аневризмы сосудов головного мозга. Выполняют клипирование артериальной аневризмы одномоментно с наложением экстра-интракраниального микрососудистого анастомоза (ЭИКМА) между ветвью ипсилатеральной поверхностной височной артерии и корковой ветвью средней мозговой артерии. Проводят курс терапии, включающий поддерживание систолического артериального давления на 25-30% выше “рабочего” и нормоволемический вариант гемоделюции. При этом минимальный объем инфузии осуществляют в ночные часы, а соотношение энтерально введенной жидкости и внутривенной инфузии поддерживают в первые сутки 1: 6, в дальнейшем – 1:2. Способ позволяет повысить эффективность лечения. 1 з.п.ф-лы. Изобретение относится к медицине, а именно – нейрохирургии, и может быть использовано при лечении больных с развившимся вторичным церебральным вазоспазмом после субарахноидального кровоизлияния вследствие разрыва артериальной аневризмы сосудов головного мозга, сопровождающегося очаговыми ишемическими расстройствами или без клинических проявлений, подтвержденного данными транскраниальной доплеросонографии, церебральной ангиографии и компьютерной томографии. Известен способ лечения церебрального вазоспазма (В.В. Лебедев, В.В. Крылов, В.Н. Щелковский. Клиника, диагностика и лечение внутричерепных артериальных аневризм в остром периоде кровоизлияния. М.: Антидор, 1996) путем оперативного вмешательства в “холодный период” – при уменьшении выраженности клинических проявлений. К недостаткам этого метода следует отнести его неэффективность при регионарном и генерализованном вазоспазме, а также существующую вероятность развития геморрагических осложнений. Кроме того, выполнение рентгенэндоваскулярной дилатации возможно лишь специалистами, владеющими техникой эндоваскулярных нейрохирургических вмешательств, в условиях рентгеноперационной с соответствующим оборудованием. У пациентов с прогрессирующим ангиоспазмом после субарахноидального кровоизлияния вследствие разрыва артериальной аневризмы, которым была выполнена операция клипирования аневризмы (средний срок – 4,8 дня после кровоизлияния), в послеоперационном периоде дополнительно осуществлялось наложение ЭИКМА (ипси- либо билатерально). Техника операции заключается в расширении прежнего доступа (передневисочная краниэктомия), выделении сильвиевой щели до подходящей по диаметру корковой ветви средней мозговой артерии и ее временной изоляции. На участок предварительно выделенной ветви поверхностной височной артерии (диаметром 1,5-2 мм) подшивается участок короткой Vena saphena parva, т.е. создается анастамоз с аутовенозной вставкой между корковой артериальной ветвью и поверхностной височной артерией. В ближайшем послеоперационном периоде проводится мониторирование основных параметров гомеостаза. Оценка интракраниальной ситуации осуществляется на основании косвенных данных. Контрольная ангиография выполняется не ранее 3-х суток с момента операции. К недостаткам этого способа лечения следует отнести необходимость проведения повторной операции на фоне прогрессирующего ангиоспазма у больных после клипирования аневризмы. Несколько усложняется техника краниотомии – у всех пациентов с артериальными аневризмами необходимо сохранять ветви поверхностной височной артерии. Не определена тактика в отношении группы пациентов с прогрессирующим вазоспазмом и верифицированными неклипированными артериальными аневризмами. Авторами не используются возникающие после наложения ЭИКМА благоприятные гемодинамические условия для проведения 3-Н-терапии с меньшим риском осложнений и большим клиническим эффектом. Задача – создание эффективного механизма предотвращения и коррекции ишемических нарушений мозгового кровообращения, позволяющего провести оперативное лечение в условиях церебрального ангиоспазма, снизить летальность и улучшить функциональные исходы лечения больных после субарахноидального кровоизлияния вследствие разрыва артериальных аневризм сосудов головного мозга. При решении задачи достигается лечебный эффект, заключающийся в снижении смертности и инвалидизации данной категории больных. Это связано как с уменьшением опасности повторного кровоизлияния (оперативное выключение аневризмы становится возможным и при явлениях вазоспазма); так и с сокращением продолжительности ангиоспазма и улучшением клинических исходов. Ожидаемый экономический эффект связан со снижением бюджетных затрат за счет уменьшения срока госпитализации больного этой категории (по нашим прогнозам в среднем на 7 койко-дней), улучшения результатов лечения без применения ряда дорогостоящих препаратов и уменьшения расходов на реабилитацию. Социальный эффект может быть обусловлен уменьшением среди населения удельного веса инвалидов трудоспособного возраста (54,4% больных – молодые люди в возрасте от 31 до 50 лет), а также с определенными положительными демографическими последствиями (37,7% больных – лица моложе 40 лет, соотношение мужчин и женщин 2:3). Решение поставленной задачи достигается тем, что клипирование аневризмы и наложение ЭИКМА выполняют одномоментно, при этом проводят курс терапии, включающий поддержание систолического артериального давления на 25-30% выше “рабочего” и нормоволемический вариант гемоделюции. Минимальный объем инфузии осуществляют в ночные часы, а соотношение энтерально введенной жидкости и внутривенной инфузии поддерживают в первые сутки 1:6, а в дальнейшем 1:2. Предлагаемый способ осуществляется следующим образом. Пациенты с верифицированным субарахноидальным кровоизлиянием на фоне прогрессирования угрожающих явлений ангиоспазма (при наличии клинико-неврологических данных и доплерографических подтверждений – нарастание линейной скорости кровотока в спазмиро ванном сосуде на 30-40 см/с ежесуточно) подвергаются серийной церебральной ангиографии. После подтверждения диагноза, уточнения локализации артериальной аневризмы (или множественных аневризм), распространенности и выраженности ангиоспазма в возможно ранние сроки под общим обезболиванием проводится двухэтапная операция. На первом этапе после стандартной краниотомии (чаще лобно-височной, с сохранением поверхностной височной артерии) выполняется микрохирургическое клипирование выявленных артериальных аневризм и тщательная интраоперационная санация субарахноидальных пространств от гемолизированной крови). На следующем этапе выделяют ветвь поверхностной височной артерии (диаметр около 2 мм), отсепаровывают ее от апоневроза на протяжении 4-5 см и накладывают микроклипс на ее дистальном конце (при небольшом диаметре ветвей между стволом поверхностной височной артерии и наибольшей по диаметру ветвью М2 создавался анастамоз с аутовенозной вставкой из участка Vena saphena parva). Сосуд закрывают ватниками, смоченными раствором папаверина гидрохлорида. На проксимальный конец ветви височной артерии накладывают микроклипс, периферический конец сосуда промывают гепаринизированным изотоническим раствором. В бассейне наиболее спазмированного сосуда определяют сегмент корковой артерии, удобный для анастамоза (чаще использовали наиболее проксимальную ветвь средней мозговой артерии на выходе из сильвиевой щели). Арахноидальную оболочку вдоль избранного артериального сегмента рассекают на протяжении 1,5 см, под артерию подводят резиновый протектор, коагулируют и пересекают отходящие от сегмента перфорирующие веточки и на артерию накладывают 2 съемных микроклипса на расстоянии 1,5 см один от другого. Затем продольно рассекают стенку корковой ветви на протяжении 3-4 мм сосуд промывают изотоническим раствором и, используя нити и иглы 10/0, под 25-кратным увеличением между выделенной корковой ветвью и дистальным участком ветви поверхностной височной артерии накладывают микроанастамоз по типу конец-в-бок путем наложения 5-6 микрошвов с последующей герметизацией области анастамоза гемостатической сеткой Surgicell. После наложения микрошвов удаляется дистальный, затем проксимальный клипсы с корковой ветви, проверяется герметичность швов и последним снимается клипс с поверхностной височной артерии. После проверки функционирования анастамоза, при отсутствии сдавления окружающими тканями производят ушивание. Использование описанной хирургической техники создания ЭИКМА позволяет несколько изменить схему медикаментозного лечения указанной категории больных, уменьшить ее агрессивность, тем самым снизив вероятность развития осложнений. Первый компонент триады – управляемая гипертензия – реализуется непрерывной инфузией дофамина в дозе 5-8-10 мкг/кг/мин для поддержания систолического АД на 25-30% выше “рабочего” АД больного. Второй и третий компоненты – гиперволемия и умеренная гемодилюция – достигаются инфузией жидкости. Общий объем инфузии расчитывается следующим образом: Объем суточной инфузии = физиологическая потребность + дефицит жидкости + компенсация патологических потерь. Физиологическая потребность=1800 мл на кв.м площади поверхности тела. Дефицит жидкости по формуле Рачева 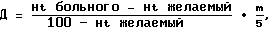 где Ht – гематокрит, Д – дефицит жидкости. Объем жидкости, необходимый для компенсации патологических потерь (лихорадка, парез желудочно-кишечного тракта, продленная искусственная вентиляция легких) расчитывается по известным методикам. Обязательным является учет времени суток – минимальный объем инфузии в ночные часы. Соблюдается традиционное соотношение коллоиды : кристаллоиды=1:3. В качестве коллоидных растворов предпочтительнее использовать растворы гидроксиметилкрахмала в дозировках, рекомендуемых производителем, а также раствора альбумина 10% в дозе 5 мл/кг. Свежезамороженная плазма применяется с целью коррекции коагуляционного потенциала крови в дозе 5-10 мл/кг под контролем коагулограммы. Сразу же при восстановлении моторики органов желудочно-кишечного тракта начинается энтеральное введение жидкости, что позволяет уменьшить нагрузку на правые отделы сердца и снизить риск возникновения гипертензии в малом круге кровообращения и отека легких. Соотношение энтерально введенной жидкости и внутривенной инфузии в 1-е сутки 1:6, в дальнейшем 1:2. Критерием адекватности водной нагрузки считается наличие у больного гематокрита=32-35%; центрального венозного давления=0-5 мм вод.ст. Необходимым условием применения 3-Н терапии является наличие круглосуточного мониторинга электрокардиограммы, инвазивно измеряемого внутричерепного давления, показателей системной гемодинамики (неинвазивный контроль АД с автоматическим расчетом среднего АД, центрального венозного давления, частоты сердечных сокращений); а также диуреза и лабораторных показателей (коагулограммы, гематокрита, электролитов и осмолярности крови и мочи). Оптимальным является и мониторирование уровня лактата – пирувата в оттекающей от мозга крови (в v. Jugularis). Оценка динамики сердечного выброса у больных с выраженной сопутствующей кардиальной патологией проводится по давлению в легочных капиллярах, у остальных больных – непрямым методом (доплерографически). КЛИНИЧЕСКИЙ ПРИМЕР Больной К-в С.П., 41 г., доставлен в неврологический стационар МКБ 1 машиной СМП 16.10.99 после впервые возникших генерализованных эпиприпадков с клонико-тоническими судорогами в правых конечностях, торпидных к медикаментозным воздействиям. При поступлении состояние тяжелое, продолжающиеся с интервалом в 1 мин судороги, сопровождающиеся тахипноэ и непроизвольным мочеиспусканием. Больной астеничен (в анамнезе – туберкулез легких). АД=160/100 торр. Неврологически – ШКГ 8 баллов, зрачки широкие, анизокория (S>D), фотореакции вялые. Силу и тонус достоверно оценить не удалось. Ригидность – 3 п. На глазном дне – начинающийся застой дисков зрительных нервов. Переведен в палату интенсивной терапии неврологического отделения. Выполнена КТ головного мозга, обнаружены признаки субарахноидального кровоизлияния в проекции правой сильвиевой щели. При ТКДГ определяется ангиоспазм в бассейнах СМА (справа – грубее, лск=165 см/с, асимметрия кровотока 16%, определяется снижение гемодинамических резервов). Несмотря на проводившуюся инфузионную, гипотензивную, противосудорожную терапию состояние больного оставалось тяжелым: сохранялись неадекватность, дезориентированность, заторможенность, гипертензия (АД=160/100), менингеальная симптоматика. Появился парез 7 п слева, левосторонний гемипарез (в руке до 3 б, в ноге – 2 б). При ТКДГ отмечено нарастание ангиоспазма (линейная скорость в СМА увеличилась справа до 202 см/с, слева – до 143 см/с, отмечено истощение коллатеральных резервов). 25.10.99 переведен в отд. микронейрохирургии, начат курс 3-Н-терапии. 26.10.99 выполнена селективная каротидная ангиография, верифицирована артериальная аневризма СМА справа, явления выраженного ангиоспазма, более выраженные в бассейне правой СМА. По жизненным показаниям 26.10.99 выполняется операция – микрохирургическое клипирование шейки аневризмы СМА справа из правостороннего птеригонального доступа, наложение ЭИКМА между поверхностной височной артерией и ветвью СМА справа. Переведен в реанимацонное отделение, где проведен послеоперационный курс 3-Н-терапии. Первый компонент триады – управляемая гипертензия – реализовывалась непрерывной инфузией дофамина в дозе 8-10 мкг/кг  мин для поддержания систолического АД на 25-30% выше “рабочего” АД (130-80 торр) больного.
Второй и третий компоненты – гиперволемия и умеренная гемодилюция – достигались инфузией жидкости. Общий объем инфузии расчитывался следующим образом: Объем суточной инфузии=физиологическая потребность + дефицит жидкости + компенсация патологических потерь.
Физиологическая потребность= 1800 мл на кв.м площади поверхности тела, что составило 3,3 л/сут.
Дефицит жидкости по формуре Рачева мин для поддержания систолического АД на 25-30% выше “рабочего” АД (130-80 торр) больного.
Второй и третий компоненты – гиперволемия и умеренная гемодилюция – достигались инфузией жидкости. Общий объем инфузии расчитывался следующим образом: Объем суточной инфузии=физиологическая потребность + дефицит жидкости + компенсация патологических потерь.
Физиологическая потребность= 1800 мл на кв.м площади поверхности тела, что составило 3,3 л/сут.
Дефицит жидкости по формуре Рачева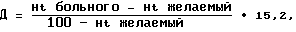 где Ht – гематокрит, Д – дефицит жидкости, 15,2=m (76 кг) :5; Ht – гематокриг желаемый, равный 35. Объем жидкости, необходимый для компенсации патологических потерь (лихорадка, продленная искусственная вентиляция легких) рассчитывался по известным методикам. Обязательным являлся учет времени суток – минимальный объем инфузии производился в ночные часы. Соблюдалось традиционное соотношение коллоиды : кристаллоиды 1:3. В качестве коллоидных растворов использовались растворы гидроксиметилкрахмала – 2500 мл/сут (в дозировке 33 мл/кг веса), а также 380 мл раствора альбумина 10% (5 мл/кг). Свежезамороженная плазма применялась с целью коррекции коагуляционного потенциала крови в дозе 5 мл/кг под контролем коагулограммы. Сразу же после восстановления моторики органов желудочно-кишечного тракта началось энтеральное введение жидкости, что позволило постепенно уменьшить нагрузку на правые отделы сердца и снизить риск возникновения гипертензии в малом круге кровообращения и отека легких. Соотношение энтерально введенной жидкости и внутривенной инфузии в 1-е сутки составило 1:6, в дальнейшем 1:2. Критерием адекватности водной нагрузки считался гематокрит 32-35%; центрального венозного давления 0-5 мм вод.ст. Осуществлялся круглосуточный мониторинг электрокардиограммы, инвазивно измеряемого внутричерепного давления, показателей системной гемодинамики (неинвазивный контроль АД с автоматическим расчетом среднего АД, центрального венозного давления, частоты сердечных сокращений); а также диуреза и лабораторных показателей (коагулограммы, гематокрита, электролитов и осмолярности мочи). Оценка динамики сердечного выброса непрямым методом (доплерографически). В утренние часы 27.10.99 – больной в сознании, адекватен. При ТКДГ отмечается резкое снижение скорости кровотока в правой СМА (до 64 см/с) и некоторое увеличение ее в левой СМА (до 187 см/с), удовлетворительное функционирование анастамоза. Вечером 27.10.99 отмечается значительный регресс очаговой и менингеальной симптоматики – нарастание силы в левых конечностях на 1-1,5 балла, уменьшение ригидности до 1,5 п. 01.11.99 переведен в профильное отделение. В дальнейшем на фоне ноотропной терапии отмечается закономерная положительная динамика – полный регресс очаговой и менингеальной симптоматики. По данным ТКДГ сохраняется асимметрия кровотока с преобладанием в контрлатеральном полушарии (ЛСК до 170 см/с слева, 60 см/с – справа), отмечается появление резервов коллатералей, хорошее функционирование анастамоза. При контрольной ангиографии (29.11.99) определяется полное выключение артериальной аневризмы СМА справа, хорошее контрастирование ЭИКМА, разрешающийся ангиоспазм. 29.11.99 больной выписан под наблюдение невропатолога поликлиники. Формула изобретения Способ лечения церебрального вазоспазма, включающий клипирование артериальной аневризмы и наложение экстра-интракраниального микрососудистого анастомоза (ЭИКМА) между ипсилатеральной поверхностной ветвью височной артерии и корковой ветвью средней мозговой артерии, отличающийся тем, что клипирование аневризмы и наложение ЭИКМА выполняют одномоментно, при этом проводят курс терапии, включающий поддерживание систолического артериального давления на 25-30% выше “рабочего” и нормоволемический вариант гемоделюции. 2. Способ по п.1, отличающийся тем, что минимальный объем инфузии осуществляют в ночные часы, а соотношение энтерально введенной жидкости и внутривенной инфузии поддерживают в первые сутки 1:6, в дальнейшем – 1:2. MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 16.06.2008
Извещение опубликовано: 27.06.2010 БИ: 18/2010
|
||||||||||||||||||||||||||
