Патент на изобретение №2208786
|
||||||||||||||||||||||||||
(54) СПОСОБ ОПРЕДЕЛЕНИЯ СПОНТАННОЙ КЛЕТОЧНОЙ ЦИТОТОКСИЧНОСТИ
(57) Реферат: Изобретение относится к медицине и может быть использовано в иммунологии, вирусологии, онкологии, трансплантологии. Способ заключается в следующем: из периферической крови пациента выделяют мононуклеары, приготавливают клетки-мишени, в качестве которых используют тучные клетки крыс, смешивают мононуклеары и клетки-мишени в соотношении 20-30:1, центрифугируют полученную смесь, инкубируют в течение 30 мин, после чего осуществляют учет результатов цитотоксической реакции путем подсчета количества дегранулировавших тучных клеток крыс в процентах от общего количества тучных клеток крыс в смеси мононуклеаров и тучных клеток крыс. При значении указанного показателя 25-35% определяют нормальную спонтанную клеточную цитотоксичность, при значении менее 25% определяют пониженную спонтанную клеточную цитотоксичность, а при значении указанного показателя свыше 35% определяют повышенную спонтанную клеточную цитотоксичность. Способ позволяет повысить точность прогноза. 1 з.п.ф-лы, 7 табл. Изобретение относится к области медицины, а именно к иммунологии, вирусологии, онкологии, трансплантологии, и может быть использовано для оценки иммунного статуса здоровых и больных людей; для оценки уровня противовирусной и противоопухолевой защиты организма; для прогнозирования кризов отторжения трансплантатов. Известны способы определения спонтанной клеточной цитотоксичности (СКЦ) с использованием в качестве клеток-мишеней для цитотоксических клеток мышей искусственно культивируемых опухолевых клеток, в частности клеток мышиных опухолей Р815, EL4, BW5147, меченных радиоактивным изотопом. Известные способы-аналоги включают следующие операции: выделение мононуклеаров из периферической крови; приготовление клеток-мишеней, включая мечение их радиоактивным изотопом; смешивание мононуклеаров и клеток-мишеней и учет результатов цитотоксической реакции по выходу используемого радионуклида. В качестве радиоактивных изотопов используют 31Сr, 3[H]-пролин, 125[I]-дезоксиуридин, 3[H]-уридин и т.п. [1, 2]. Известные способы-аналоги не обеспечивают достижения технического результата заявленного способа в связи со следующим. Опухолевые линии, применяемые для определения СКЦ у мышей, как правило, не используются для определения СКЦ у человека [2] . По мнению авторов изобретения, это может быть обусловлено отсутствием специфических рецепторов на указанных клетках-мишенях, вследствие чего воздействие цитотоксических клеток человека на морфологические и функциональные свойства этих клеток-мишеней практически не проявляется. Известны способы определения СКЦ с использованием в качестве клеток-мишеней для цитотоксических клеток человека искусственно культивируемых опухолевых клеток лимфомы мыши УАС-1 [3] и миелоидной перевиваемой клеточной линии К-562 [4]. Наиболее близким к заявленному решению по совокупности существенных признаков является способ определения СКЦ с использованием в качестве клеток-мишеней миелоидной перевиваемой клеточной линии К-562 [4]. Способ, принятый за прототип, осуществляли следующим образом. У пациента из вены брали кровь в количестве 6 мл в пенициллиновые флаконы с 0,2 мл 5% ЕДТА и разделяли в градиенте плотности фиколл/верографина (d=1,077). Полученную взвесь мононуклеарных клеток (мононуклеаров) один раз отмывали в 8 мл фосфатного буфера и два раза – в растворе Хенкса с 5% бычьей сывороткой. Конечную концентрацию клеток доводили до 5х106/мл среды RPMI-1640 с добавлением 10% бычьей сыворотки. Приготовление клеток-мишеней осуществляли следующим образом. Клеточную линию К-562 выращивали на культуральной среде RPMI-1640, которую обогащали “добавками”: 500 мл RPMI-1640 +20 mM глютамина+20 mM Hepes (Serva) +100 ед/мл пенициллина +10 ед/мл стрептомицина или гентамицина; как сывороточную добавку использовали инактивированную бычью сыворотку. В стерильный пенициллиновый флакон помещали 0,6 мл перевиваемой клеточной суспензии (содержащей 3х105 клеток), 0,6 мл инактивированной бычьей сыворотки и 1,8 мл среды RPMI-1640; флаконы инкубировали в течение 4 суток при 37oС. На 4-е сутки культивирования, когда концентрация клеток достигала 5х105 в 1 мл, клетки перевивали в свежую среду. Клетки 2-го или 3-го дня культивирования осаждали центрифугированием при 150g в течение 5 мин, ресуспендировали в свежей среде RPMI-1640 с добавлением 10% бычьей сыворотки. 1х106 клеток метили 250 мк Ku51Cr(Na2CrO4) (92,5xl05 Бк) с удельной активностью 2-5 мКи/мМ (7,4-18,5х107 Бк) в объеме 0,5 мл; помещали в термостат и инкубировали в течение 1 ч при 37oС. Клетки трижды отмывали в среде Хенкса с 5% бычьей сывороткой, центрифугируя при 150g в течение 5 мин; конечную концентрацию клеток доводили до 1х105 в 1 мл среды RPMI-1640 с 10% бычьей сывороткой. Соединяли клетки-мишени и мононуклеары. При этом клетки-мишени по 0,1 мл (1х104 клеток) раскапывали в лунки круглодонной панели фирмы “Cook” с учетом необходимого количества проб и объема опыта. Мононуклеары по 0,1 мл (0,5х106 клеток) раскапывали так, чтобы для каждой пробы исследуемой крови приходился свой ряд лунок; как опытные, так и контрольные пробы тестировали в триплете; к контрольным пробам вместо 0,1 мл суспензии мононуклеаров добавляли 0,1 мл культуральной среды, соотношение клеток-мишеней и мононуклеаров в опытных пробах соответствовало 1: 50. На этапе раскапывания мишеней по 0,1 мл суспензии клеток заливали в центрифужные пробирки и хранили до окончания опыта; они служили для определения максимального включения 51Cr (M). Панель помещали в инкубатор (37oС) с подачей 5% CO2 и относительной влажностью 100%, где инкубировали 16 ч. По окончании инкубации из лунок забирали 0,1 мл супернатанта, замеряли активность опытных проб вместе с контрольными пробами на  -счетчике.
Учет результатов реакции осуществляли следующим образом. Цитотоксическая активность мононуклеаров (СКЦ) выражалась в% с учетом общего включения 51Сr и его спонтанного выхода: -счетчике.
Учет результатов реакции осуществляли следующим образом. Цитотоксическая активность мононуклеаров (СКЦ) выражалась в% с учетом общего включения 51Сr и его спонтанного выхода: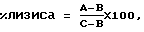 где А – удвоенное среднее значение выхода 51Сr в трех опытных лунках; В – то же, но в контрольных лунках; С – 80% от общего включения 51Сr в 1х104 клеток (М)-мишеней. Спонтанный выход 51Сr (В) при такой постановке опыта в среднем составлял 16% от значения С (1% в час). При значении указанного показателя, составляющем в среднем (53,6  3,7)% (уровень цитотоксической активности у здоровых людей), определяли нормальную цитотоксическую активность (СКЦ). При значениях указанного показателя, достоверно сниженных по сравнению с нормой, определяли пониженную цитотоксическую активность (СКЦ). При значениях указанного показателя, достоверно превышающих средние значения цитотоксической активности у здоровых людей, определяли повышенную цитотоксическую активность (СКЦ).
Способ-прототип [4] не позволяет получить технический результат, достигаемый при использовании заявленного способа, по следующим причинам. Известно, что клетки живого организма, обладающие СКЦ (называемые далее в тексте “цитотоксические мононуклеары” или “клетки-эффекторы”), принадлежат, главным образом, к нормальным киллерам и обладают способностью разрушать чужеродные клетки, клетки, пораженные вирусом, а также опухолевые клетки.
В настоящее время вследствие невозможности оценки цитотоксических реакций in vivo определение СКЦ производят путем постановки лабораторных реакций с использованием клеток-мишеней, в норме не содержащихся в организме [2].
Известно, что применяемые в способе-прототипе [4] искусственно культивируемые опухолевые клетки миелоидной линии имеют мелкие гранулы [5], выход которых из клеток в ходе цитотоксической реакции практически невозможно учитывать с помощью микроскопии. Известно также, что обусловленные воздействием цитотоксических мононуклеаров процессы, результатом которых являются значимые морфологические изменения в клетках-мишенях, протекают в течение длительного периода времени (инкубация от 16 ч до 5-ти – 6-ти суток) [2].
Кроме того, у опухолевых клеток-мишеней, по мнению авторов заявленного решения, отсутствуют особые специфические высокочувствительные рецепторы к перфоринам и цитокинам, продуцируемым клетками-эффекторами. В этой связи учет морфологических изменений в опухолевых клетках принципиально возможен только путем подсчета погибших под действием мононуклеаров клеток-мишеней. Однако описания подобного способа определения СКЦ в просмотренной научно-медицинской и патентной литературе авторы изобретения не обнаружили. Это может быть обусловлено тем, что практическая реализация подобного подхода с помощью стандартных лабораторных приемов и лабораторного оборудования будет характеризоваться относительно высокой субъективностью и относительно низкой точностью определения (вследствие возможности массовой спонтанной гибели клеток-мишеней в процессе длительной инкубации), даже при использовании соответствующих специальных красителей для выявления погибших клеток-мишеней.
В основу способа-прототипа [4] положен учет преимущественно функциональных изменений опухолевых клеток-мишеней под действием цитотоксических клеток человека. Оценку цитотоксического эффекта осуществляют путем мечения клеток-мишеней радиоактивным хромом-51. Известно [3, 2], что цитотоксический эффект проявляется только при непосредственном контакте клеток-эффекторов и клеток-мишеней в результате продуцирования клетками-эффекторами различных цитокинов и перфоринов с последующим высвобождением указанных медиаторов. В способе-прототипе этот контакт осуществляется после спонтанного оседания всех клеток смеси на дно пробирки, которое завершается через 3-5 часов. После оседания клеток смеси и возникновения контакта между клетками-мишениями и цитотоксическими клетками начинается продукция и высвобождение цитотоксических медиаторов, а также воздействие их на клетки-мишени, что занимает 12-140 часов. Таким образом, для проявления цитотоксического эффекта в отношении опухолевых клеток требуется инкубация в течение не менее 16 часов, что обусловливает длительность процедуры определения. Кроме того, необходимым условием для обеспечения контакта клеток-эффекторов и клеток-мишеней и соответственно для получения выраженного цитотоксического эффекта в отношении опухолевых клеток согласно способу-прототипу является относительно высокое соотношение между мононуклеарами и клетками-мишенями (50:1). Осуществление указанного условия на практике приводит к необходимости работы с относительно большим объемом крови, что в свою очередь исключает возможность получения крови для исследования из пальца пациента (используют только венозную кровь).
В процессе инкубации смеси мононуклеаров и опухолевых клеток-мишеней под влиянием цитотоксических мононуклеаров изменяется проницаемость клеточных мембран клеток-мишеней, в результате чего происходит высвобождение из клеток-мишеней 51Сr. Однако даже при соблюдении предусмотренных методикой способа-прототипа оптимальных условий смешивания и инкубации смеси отсутствие у опухолевых клеток-мишеней особых специфических высокочувствительных рецепторов к медиаторам клеток-эффекторов может в ряде случаев приводить к недостаточной выраженности функциональных изменений клеток-мишеней в ходе цитотоксической реакции.
В частности повышение проницаемости клеточных мембран может оказаться недостаточным для выхода 51Сr (по данным авторов изобретения в смеси остается 40-80% клеток-мишеней с неповрежденными мембранами). В этих случаях будет иметь место относительно низкий специфический (т.е. обусловленный влиянием цитотоксических мононуклеаров) выход 51Сr в опыте, что приведет к получению ложнозаниженных результатов цитотоксической реакции. Кроме того, при использовании 51Сr в качестве индикатора цитотоксического эффекта по ряду причин (качество клеток-мишеней, качество инкубационных сред и посуды, недостаточная квалификация среднего медицинского персонала и т.п.) может наблюдаться повышенный спонтанный (неспецифический) выход указанного радионуклида в контроле (16-50%). Это существенно затрудняет учет результатов цитотоксической реакции, обусловливая ложнозаниженные результаты определения, а в ряде случаев (при спонтанном выходе 51Сr в контроле более 20%) делает учет результатов реакции практически невозможным.
Относительно низкие прочностные характеристики мембран опухолевых клеток-мишеней обусловливают относительно высокую вероятность повреждения этих клеток в результате пипетирования, центрифугирования (на стадии приготовления клеток-мишеней), внесения растворов в смесь мононуклеаров и клеток-мишеней и т. д. Это находит отражение в относительно высоком спонтанном (неспецифическом) выходе 51Сr в опыте, который, по данным авторов изобретения, может в ряде случаев достигать 30-40%, что приводит к ложнозавышенным результатам определения. Все это обусловливает относительно низкую точность определения СКЦ с помощью способа-прототипа. И наконец, предусмотренное методикой способа-прототипа [4] применение 51Сr предполагает работу с материалом, меченным указанным радионуклидом, что требует специально оборудованной лаборатории и специально обученного персонала.
Задачей изобретения является создание способа определения СКЦ, обеспечивающего возможность суправитального, раннего и выраженного морфологического проявления цитотоксического эффекта при исключении возможности спонтанного лизиса клеток-мишеней, механических повреждений их мембран и спонтанного выхода радиоактивного изотопа из клеток-мишеней, за счет использования клеток, обладающих особыми, специфическими высокочувствительными рецепторами к медиаторам, продуцируемым цитотоксическими клетками человека, крупными цитоплазматическими гранулами, способными к экзоцитозу, и относительно высокой механической прочностью мембран.
Поставленная задача решается тем, что в способе определения СКЦ, включающем выделение мононуклеаров из периферической крови пациента, приготовление клеток-мишеней, смешивание мононуклеаров и клеток-мишеней, инкубирование смеси мононуклеаров и клеток-мишеней с последующим учетом результатов цитотоксической реакции, согласно изобретению в качестве клеток-мишеней используют тучные клетки крыс. Смешивают мононуклеары и тучные клетки крыс в соотношении 20-30:1. Непосредственно после смешивания мононуклеаров и тучных клеток крыс дополнительно центрифугируют полученную смесь. Инкубирование смеси мононуклеаров и тучных клеток крыс производят в течение 30 мин. Учет результатов цитотоксической реакции осуществляют путем подсчета количества дегранулировавших тучных клеток крыс в процентах от общего количества тучных клеток крыс в смеси мононуклеаров и тучных клеток крыс и при значении указанного показателя, составляющем менее 25%, определяют пониженную СКЦ, при значении указанного показателя 25-35% определяют нормальную СКЦ, а при значении указанного показателя свыше 35% определяют повышенную СКЦ. Наиболее эффективно, когда в ходе учета результатов цитотоксической реакции непосредственно перед подсчетом количества дегранулировавших тучных клеток крыс в смеси мононуклеаров и тучных клеток крыс производят перемешивание клеточного осадка и супернатанта смеси мононуклеаров и тучных клеток крыс.
Выбор оптимальных режимов и условий осуществления действий заявленного способа, обеспечивающих наибольшую эффективность изобретения при его реализации, осуществляли следующим образом.
Для установления диагностически значимых диапазонов цитотоксической активности клеток крови человека в норме и при патологии были проведены сравнительные исследования СКЦ у следующих пациентов: 3,7)% (уровень цитотоксической активности у здоровых людей), определяли нормальную цитотоксическую активность (СКЦ). При значениях указанного показателя, достоверно сниженных по сравнению с нормой, определяли пониженную цитотоксическую активность (СКЦ). При значениях указанного показателя, достоверно превышающих средние значения цитотоксической активности у здоровых людей, определяли повышенную цитотоксическую активность (СКЦ).
Способ-прототип [4] не позволяет получить технический результат, достигаемый при использовании заявленного способа, по следующим причинам. Известно, что клетки живого организма, обладающие СКЦ (называемые далее в тексте “цитотоксические мононуклеары” или “клетки-эффекторы”), принадлежат, главным образом, к нормальным киллерам и обладают способностью разрушать чужеродные клетки, клетки, пораженные вирусом, а также опухолевые клетки.
В настоящее время вследствие невозможности оценки цитотоксических реакций in vivo определение СКЦ производят путем постановки лабораторных реакций с использованием клеток-мишеней, в норме не содержащихся в организме [2].
Известно, что применяемые в способе-прототипе [4] искусственно культивируемые опухолевые клетки миелоидной линии имеют мелкие гранулы [5], выход которых из клеток в ходе цитотоксической реакции практически невозможно учитывать с помощью микроскопии. Известно также, что обусловленные воздействием цитотоксических мононуклеаров процессы, результатом которых являются значимые морфологические изменения в клетках-мишенях, протекают в течение длительного периода времени (инкубация от 16 ч до 5-ти – 6-ти суток) [2].
Кроме того, у опухолевых клеток-мишеней, по мнению авторов заявленного решения, отсутствуют особые специфические высокочувствительные рецепторы к перфоринам и цитокинам, продуцируемым клетками-эффекторами. В этой связи учет морфологических изменений в опухолевых клетках принципиально возможен только путем подсчета погибших под действием мононуклеаров клеток-мишеней. Однако описания подобного способа определения СКЦ в просмотренной научно-медицинской и патентной литературе авторы изобретения не обнаружили. Это может быть обусловлено тем, что практическая реализация подобного подхода с помощью стандартных лабораторных приемов и лабораторного оборудования будет характеризоваться относительно высокой субъективностью и относительно низкой точностью определения (вследствие возможности массовой спонтанной гибели клеток-мишеней в процессе длительной инкубации), даже при использовании соответствующих специальных красителей для выявления погибших клеток-мишеней.
В основу способа-прототипа [4] положен учет преимущественно функциональных изменений опухолевых клеток-мишеней под действием цитотоксических клеток человека. Оценку цитотоксического эффекта осуществляют путем мечения клеток-мишеней радиоактивным хромом-51. Известно [3, 2], что цитотоксический эффект проявляется только при непосредственном контакте клеток-эффекторов и клеток-мишеней в результате продуцирования клетками-эффекторами различных цитокинов и перфоринов с последующим высвобождением указанных медиаторов. В способе-прототипе этот контакт осуществляется после спонтанного оседания всех клеток смеси на дно пробирки, которое завершается через 3-5 часов. После оседания клеток смеси и возникновения контакта между клетками-мишениями и цитотоксическими клетками начинается продукция и высвобождение цитотоксических медиаторов, а также воздействие их на клетки-мишени, что занимает 12-140 часов. Таким образом, для проявления цитотоксического эффекта в отношении опухолевых клеток требуется инкубация в течение не менее 16 часов, что обусловливает длительность процедуры определения. Кроме того, необходимым условием для обеспечения контакта клеток-эффекторов и клеток-мишеней и соответственно для получения выраженного цитотоксического эффекта в отношении опухолевых клеток согласно способу-прототипу является относительно высокое соотношение между мононуклеарами и клетками-мишенями (50:1). Осуществление указанного условия на практике приводит к необходимости работы с относительно большим объемом крови, что в свою очередь исключает возможность получения крови для исследования из пальца пациента (используют только венозную кровь).
В процессе инкубации смеси мононуклеаров и опухолевых клеток-мишеней под влиянием цитотоксических мононуклеаров изменяется проницаемость клеточных мембран клеток-мишеней, в результате чего происходит высвобождение из клеток-мишеней 51Сr. Однако даже при соблюдении предусмотренных методикой способа-прототипа оптимальных условий смешивания и инкубации смеси отсутствие у опухолевых клеток-мишеней особых специфических высокочувствительных рецепторов к медиаторам клеток-эффекторов может в ряде случаев приводить к недостаточной выраженности функциональных изменений клеток-мишеней в ходе цитотоксической реакции.
В частности повышение проницаемости клеточных мембран может оказаться недостаточным для выхода 51Сr (по данным авторов изобретения в смеси остается 40-80% клеток-мишеней с неповрежденными мембранами). В этих случаях будет иметь место относительно низкий специфический (т.е. обусловленный влиянием цитотоксических мононуклеаров) выход 51Сr в опыте, что приведет к получению ложнозаниженных результатов цитотоксической реакции. Кроме того, при использовании 51Сr в качестве индикатора цитотоксического эффекта по ряду причин (качество клеток-мишеней, качество инкубационных сред и посуды, недостаточная квалификация среднего медицинского персонала и т.п.) может наблюдаться повышенный спонтанный (неспецифический) выход указанного радионуклида в контроле (16-50%). Это существенно затрудняет учет результатов цитотоксической реакции, обусловливая ложнозаниженные результаты определения, а в ряде случаев (при спонтанном выходе 51Сr в контроле более 20%) делает учет результатов реакции практически невозможным.
Относительно низкие прочностные характеристики мембран опухолевых клеток-мишеней обусловливают относительно высокую вероятность повреждения этих клеток в результате пипетирования, центрифугирования (на стадии приготовления клеток-мишеней), внесения растворов в смесь мононуклеаров и клеток-мишеней и т. д. Это находит отражение в относительно высоком спонтанном (неспецифическом) выходе 51Сr в опыте, который, по данным авторов изобретения, может в ряде случаев достигать 30-40%, что приводит к ложнозавышенным результатам определения. Все это обусловливает относительно низкую точность определения СКЦ с помощью способа-прототипа. И наконец, предусмотренное методикой способа-прототипа [4] применение 51Сr предполагает работу с материалом, меченным указанным радионуклидом, что требует специально оборудованной лаборатории и специально обученного персонала.
Задачей изобретения является создание способа определения СКЦ, обеспечивающего возможность суправитального, раннего и выраженного морфологического проявления цитотоксического эффекта при исключении возможности спонтанного лизиса клеток-мишеней, механических повреждений их мембран и спонтанного выхода радиоактивного изотопа из клеток-мишеней, за счет использования клеток, обладающих особыми, специфическими высокочувствительными рецепторами к медиаторам, продуцируемым цитотоксическими клетками человека, крупными цитоплазматическими гранулами, способными к экзоцитозу, и относительно высокой механической прочностью мембран.
Поставленная задача решается тем, что в способе определения СКЦ, включающем выделение мононуклеаров из периферической крови пациента, приготовление клеток-мишеней, смешивание мононуклеаров и клеток-мишеней, инкубирование смеси мононуклеаров и клеток-мишеней с последующим учетом результатов цитотоксической реакции, согласно изобретению в качестве клеток-мишеней используют тучные клетки крыс. Смешивают мононуклеары и тучные клетки крыс в соотношении 20-30:1. Непосредственно после смешивания мононуклеаров и тучных клеток крыс дополнительно центрифугируют полученную смесь. Инкубирование смеси мононуклеаров и тучных клеток крыс производят в течение 30 мин. Учет результатов цитотоксической реакции осуществляют путем подсчета количества дегранулировавших тучных клеток крыс в процентах от общего количества тучных клеток крыс в смеси мононуклеаров и тучных клеток крыс и при значении указанного показателя, составляющем менее 25%, определяют пониженную СКЦ, при значении указанного показателя 25-35% определяют нормальную СКЦ, а при значении указанного показателя свыше 35% определяют повышенную СКЦ. Наиболее эффективно, когда в ходе учета результатов цитотоксической реакции непосредственно перед подсчетом количества дегранулировавших тучных клеток крыс в смеси мононуклеаров и тучных клеток крыс производят перемешивание клеточного осадка и супернатанта смеси мононуклеаров и тучных клеток крыс.
Выбор оптимальных режимов и условий осуществления действий заявленного способа, обеспечивающих наибольшую эффективность изобретения при его реализации, осуществляли следующим образом.
Для установления диагностически значимых диапазонов цитотоксической активности клеток крови человека в норме и при патологии были проведены сравнительные исследования СКЦ у следующих пациентов:– у практически здоровых детей; – у детей с дефектами противовирусного иммунитета, что, как известно [3, 6, 7], является свидетельством сниженных функций нормальных киллеров – главных клеток, отвечающих за СКЦ; – у детей с выраженной реакцией “хозяин против трансплантата”, клинически проявляющейся отторжением пересаженной ткани, что, как известно [1, 6, 3] , обусловлено значительным повышением активности цитотоксических клеток. Распределение пациентов по группам выглядело следующим образом: I группа – практически здоровые дети в возрасте от 3 до 16 лет – 26 человек; II группа – дети (в возрасте от 3 до 16 лет) с частыми острыми респираторными вирусными заболеваниями /ОРВИ/ (более 8 раз в год), подтвержденными с помощью вирусологических методов обследования (иммунофлуоресцентные методы исследования мазков – отпечатков со слизистой носа и зева, исследования парных сывороток на антитела к респираторным вирусам) – 31 чел.; III группа – ожоговые больные (в возрасте от 3 до 16 лет) с кризом отторжения пересаженного кожного лоскута – 6 чел. СКЦ в каждой из указанных групп определяли с использованием заявленного способа и способа-прототипа [4]. При этом в ходе определения СКЦ и заявленным способом и способом-прототипом для обеспечения адекватности условий постановки экспериментов кровь каждого пациента исследовали в трех параллельных опытах с тремя параллельными контролями (3 опытные и 3 контрольные пробы). При определении СКЦ по методике способа-прототипа активность опытных и контрольных проб замеряли на счетчике радиоактивности “Ultra-Gamma 1280” (производства LKB, Швеция). Статистическую обработку результатов производили путем вычисления сигмального отклонения ( 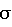 ), а также путем точного вычисления значимости различий долей по методу ), а также путем точного вычисления значимости различий долей по методу  (углового преобразования Фишера) [8].
Результаты сравнительных исследований СКЦ в группах I – III представлены в таблице 1.
Из данных таблицы 1 видно, что у практически здоровых пациентов (группа I) количество дегранулировавших тучных клеток крыс в смеси от общего количества тучных клеток крыс мононуклеаров и клеток-мишеней (% дегрануляции) составило в среднем (30 (углового преобразования Фишера) [8].
Результаты сравнительных исследований СКЦ в группах I – III представлены в таблице 1.
Из данных таблицы 1 видно, что у практически здоровых пациентов (группа I) количество дегранулировавших тучных клеток крыс в смеси от общего количества тучных клеток крыс мононуклеаров и клеток-мишеней (% дегрануляции) составило в среднем (30 2,5)% при варьировании значений указанного показателя в пределах 25-35%. Этот интервал был принят в качестве диапазона значений, характеризующих нормальную СКЦ. Во II группе пациентов (с подтвержденно сниженными функциями цитотоксических клеток) % дегрануляции составил в среднем (18 2,5)% при варьировании значений указанного показателя в пределах 25-35%. Этот интервал был принят в качестве диапазона значений, характеризующих нормальную СКЦ. Во II группе пациентов (с подтвержденно сниженными функциями цитотоксических клеток) % дегрануляции составил в среднем (18 3,0) при колебании значений указанного показателя в интервале 12-24% (р<0,001 по сравнению с показателями, полученными в I группе). В связи с этим было принято, что показателем сниженной СКЦ является % дегрануляции, составляющий менее 25%. В III группе пациентов (с подтвержденно повышенной активностью цитотоксических клеток) на основании полученного среднего значения % дегрануляции, равного (45 3,0) при колебании значений указанного показателя в интервале 12-24% (р<0,001 по сравнению с показателями, полученными в I группе). В связи с этим было принято, что показателем сниженной СКЦ является % дегрануляции, составляющий менее 25%. В III группе пациентов (с подтвержденно повышенной активностью цитотоксических клеток) на основании полученного среднего значения % дегрануляции, равного (45 4,0)%, и пределов его отклонений 37-53% (при р<0,001 по сравнению с показателями, полученными в I группе), было принято, что повышенная СКЦ может быть диагностирована при значении указанного показателя свыше 35%.
Данные таблицы 1 свидетельствуют также о том, что при определении СКЦ по методике способа-прототипа [4] авторами изобретения были получены значения СКЦ, сопоставимые с данными, приведенными авторами способа-прототипа в цитируемой работе. Так, определенный авторами изобретения по методике способа-прототипа средний уровень СКЦ у практически здоровых пациентов составил (54 4,0)%, и пределов его отклонений 37-53% (при р<0,001 по сравнению с показателями, полученными в I группе), было принято, что повышенная СКЦ может быть диагностирована при значении указанного показателя свыше 35%.
Данные таблицы 1 свидетельствуют также о том, что при определении СКЦ по методике способа-прототипа [4] авторами изобретения были получены значения СКЦ, сопоставимые с данными, приведенными авторами способа-прототипа в цитируемой работе. Так, определенный авторами изобретения по методике способа-прототипа средний уровень СКЦ у практически здоровых пациентов составил (54 4)%; по данным авторов способа-прототипа аналогичный показатель составлял (53,6 4)%; по данным авторов способа-прототипа аналогичный показатель составлял (53,6 3,7)%. Корреляция значений СКЦ, определенных по методике способа-прототипа [4] авторами изобретения и авторами способа-прототипа, наблюдалась также и для пациентов с повышенной и пониженной СКЦ, в частности для больных с кризом отторжения трансплантата (см. графу 6 таблицы 1 описания изобретения и таблицу 65 на с. 162 описания способа-прототипа [4]).
Для установления оптимального соотношения мононуклеаров и тучных клеток крыс в смеси исследовали влияние различных соотношений на точность определения СКЦ. Для исследования были предварительно отобраны 10 практически здоровых детей (в возрасте от 3 до 16 лет), у которых значения СКЦ находились в пределах 28-32%. У каждого из пациентов определяли СКЦ при соотношениях мононуклеаров и тучных клеток крыс в смеси, составляющих: 5:1, 10: 1, 15:1, 20: 1, 25: 1, 30:1, 35:1, 40:1, 45:1, 50:1. При этом кровь каждого из пациентов при каждом испытываемом соотношении мононуклеаров и заявленных клеток-мишеней исследовали в трех параллельных пробах с тремя параллельными контролями (3 опытные и 3 контрольные пробы). Каждое из соотношений проверяли при прочих фиксированных оптимальных режимах и условиях осуществления действий заявленного способа.
Статистическую обработку результатов производили аналогично обработке результатов экспериментов по установлению диагностически значимых диапазонов СКЦ в норме и при патологии.
Результаты исследований приведены в таблице 2.
Из данных таблицы 2 следует, что оптимальным является соотношение мононуклеаров и тучных клеток крыс в смеси, составляющее 20-30:1, т.к. именно это соотношение обеспечивает максимально высокий процент специфически поврежденных клеток-мишеней, чувствительных к действию цитотоксических мононуклеаров, при минимальном разбросе результатов в параллельных опытах. При более низких соотношениях между мононуклеарами и заявленными клетками-мишенями (5-15: 1) наблюдается более низкий процент дегранулировавших клеток-мишеней (5-18%), что свидетельствует о том, что не все клетки-мишени, чувствительные к действию цитотоксических клеток, подверглись цитолизу. При повышении (по сравнению с оптимальным) соотношения мононуклеаров и клеток-мишеней (30-50: 1), несмотря на то, что все клетки-мишени, чувствительные к действию цитотоксических мононуклеаров, подвергаются цитолизу (30-32%), отмечается относительно большой разброс результатов в параллельных опытах. Последнее, по-видимому, может быть обусловлено вступлением в силу механических или других факторов, препятствующих контакту цитотоксических клеток и клеток-мишеней, или действию цитотоксических медиаторов, что негативно влияет на воспроизводимость результатов реакций и тем самым снижает точность определения СКЦ.
Для установления значимости стадии центрифугирования в совокупности действий заявленного способа, а также оптимального времени инкубации исследовали влияние наличия или отсутствия стадии центрифугирования в сочетании с различными сроками инкубации на точность определения СКЦ. Для проведения экспериментов был выбран стандартный режим центрифугирования (в течение 10 мин при 600g), рекомендованный в отношении мононуклеаров периферической крови [7]. Для исследования были предварительно отобраны 10 практически здоровых детей (в возрасте от 3 до 16 лет), у которых значения СКЦ находились в пределах 28-32%. У каждого из пациентов определяли СКЦ при наличии и при отсутствии стадии центрифугирования в последовательности действий заявленного способа, при этом сроки инкубации в каждом случае варьировали от 15 до 240 мин при прочих фиксированных оптимальных режимах и условиях осуществления действий заявленного способа. Кровь каждого пациента в каждом из вариантов постановки эксперимента исследовали в трех параллельных опытах с тремя параллельными контролями (3 опытные и 3 контрольные пробы).
Статистическую обработку результатов производили аналогично обработке результатов экспериментов по установлению диагностически значимых диапазонов СКЦ в норме и при патологии.
Результаты исследований приведены в таблице 3.
Предварительно авторами изобретения была проведена проверка пригодности принятого в соответствии с рекомендациями [7] режима центрифугирования для целей заявленного способа. При этом в результате экспериментов было установлено, что, с одной стороны, при центрифугировании смеси мононуклеаров и тучных клеток крыс в указанном режиме оседают на дно пробирки 100% мононуклеаров и 100% клеток-мишеней, что подтверждалось отсутствием указанных клеток в надосадочной жидкости (супернатанте) после центрифугирования. С другой стороны, при центрифугировании в указанном режиме практически не происходит механического повреждения клеток-мишеней, в частности их мембран. Это подтверждалось тем, что, во-первых, количество заявленных клеток-мишеней до и после центрифугирования оставалось постоянным; во-вторых, в контрольных пробах (без мононуклеаров) дегрануляции тучных клеток крыс в результате центрифугирования (при оптимальном сроке инкубации) практически не отмечалось (количество дегранулировавших клеток в контроле после центрифугирования составляло 0%). В связи с этим указанный режим был принят в качестве рабочего (далее – “рабочий режим центрифугирования”).
Данные таблицы 3 показывают, что при отсутствии стадии центрифугирования в последовательности действий заявленного способа при маленьких сроках инкубации (15-60 мин) цитотоксический эффект в отношении заявленных клеток-мишеней практически не проявляется, что исключает возможность определения СКЦ. При увеличении сроков инкубации свыше 60 мин цитотоксический эффект нарастает, однако процент специфически поврежденных клеток-мишеней, чувствительных к действию цитотоксических мононуклеаров, остается относительно низким (12-21%), что препятствует достоверной оценке СКЦ. Кроме того, при сроках инкубации свыше 60 мин нарастает процесс спонтанной дегрануляции тучных клеток крыс (количество дегранулировавших клеток в контроле составляет в зависимости от времени инкубации 3-20%). Таким образом, приведенные результаты экспериментов свидетельствуют о том, что в отсутствие стадии центрифугирования учет результатов цитотоксической реакции является практически невозможным.
Из таблицы 3 видно также, что при центрифугировании в рабочем режиме смеси мононуклеаров и тучных клеток крыс в сочетании с последующей инкубацией смеси максимальное специфическое повреждение заявленных клеток-мишеней, чувствительных к действию цитотоксических клеток, достигается, начиная со времени инкубации 30 мин. Учитывая, что при этом отмечается минимальный разброс результатов в параллельных опытах, указанный срок инкубации принят в качестве оптимального. При увеличении срока инкубации смеси (45-120 мин) количество дегранулировавших клеток-мишеней остается практически постоянным, однако увеличивается разброс результатов в параллельных опытах. Последнее обусловлено начинающимися процессами спонтанной дегрануляции тучных клеток крыс (как начального проявления неспецифического лизиса указанных клеток), что подтверждается нарастанием% дегрануляции в контроле (1-3%). Это снижает воспроизводимость результатов цитотоксических реакций и соответственно точность определения СКЦ.
При дальнейшем увеличении срока инкубации смеси (свыше 120 мин) наблюдается существенное повышение количества дегранулировавших тучных клеток крыс в контроле (11-22%), что свидетельствует о нарастании процессов неспецифического лизиса клеток. Это приводит к значимому занижению результатов цитотоксических реакций, что соответственно исключает возможность определения СКЦ. Таким образом, анализ результатов экспериментов, представленных в таблице 3, позволяет заключить, что центрифугирование смеси мононуклеаров и тучных клеток крыс является существенным признаком заявленного способа, т.к. указанная стадия (ее наличие в последовательности действий способа) непосредственно влияет на достижение заявленного результата. При этом именно сочетание центрифугирования смеси с последующей ее инкубацией обеспечивает возможность выбора оптимального времени инкубации (30 мин), позволяющего получить наибольшую точность определения СКЦ.
Для сравнения авторами изобретения были проведены эксперименты по оценке возможности введения стадии центрифугирования в совокупность действий способа-прототипа [4]. При этом проверялась пригодность двух стандартных режимов центрифугирования: 3,7)%. Корреляция значений СКЦ, определенных по методике способа-прототипа [4] авторами изобретения и авторами способа-прототипа, наблюдалась также и для пациентов с повышенной и пониженной СКЦ, в частности для больных с кризом отторжения трансплантата (см. графу 6 таблицы 1 описания изобретения и таблицу 65 на с. 162 описания способа-прототипа [4]).
Для установления оптимального соотношения мононуклеаров и тучных клеток крыс в смеси исследовали влияние различных соотношений на точность определения СКЦ. Для исследования были предварительно отобраны 10 практически здоровых детей (в возрасте от 3 до 16 лет), у которых значения СКЦ находились в пределах 28-32%. У каждого из пациентов определяли СКЦ при соотношениях мононуклеаров и тучных клеток крыс в смеси, составляющих: 5:1, 10: 1, 15:1, 20: 1, 25: 1, 30:1, 35:1, 40:1, 45:1, 50:1. При этом кровь каждого из пациентов при каждом испытываемом соотношении мононуклеаров и заявленных клеток-мишеней исследовали в трех параллельных пробах с тремя параллельными контролями (3 опытные и 3 контрольные пробы). Каждое из соотношений проверяли при прочих фиксированных оптимальных режимах и условиях осуществления действий заявленного способа.
Статистическую обработку результатов производили аналогично обработке результатов экспериментов по установлению диагностически значимых диапазонов СКЦ в норме и при патологии.
Результаты исследований приведены в таблице 2.
Из данных таблицы 2 следует, что оптимальным является соотношение мононуклеаров и тучных клеток крыс в смеси, составляющее 20-30:1, т.к. именно это соотношение обеспечивает максимально высокий процент специфически поврежденных клеток-мишеней, чувствительных к действию цитотоксических мононуклеаров, при минимальном разбросе результатов в параллельных опытах. При более низких соотношениях между мононуклеарами и заявленными клетками-мишенями (5-15: 1) наблюдается более низкий процент дегранулировавших клеток-мишеней (5-18%), что свидетельствует о том, что не все клетки-мишени, чувствительные к действию цитотоксических клеток, подверглись цитолизу. При повышении (по сравнению с оптимальным) соотношения мононуклеаров и клеток-мишеней (30-50: 1), несмотря на то, что все клетки-мишени, чувствительные к действию цитотоксических мононуклеаров, подвергаются цитолизу (30-32%), отмечается относительно большой разброс результатов в параллельных опытах. Последнее, по-видимому, может быть обусловлено вступлением в силу механических или других факторов, препятствующих контакту цитотоксических клеток и клеток-мишеней, или действию цитотоксических медиаторов, что негативно влияет на воспроизводимость результатов реакций и тем самым снижает точность определения СКЦ.
Для установления значимости стадии центрифугирования в совокупности действий заявленного способа, а также оптимального времени инкубации исследовали влияние наличия или отсутствия стадии центрифугирования в сочетании с различными сроками инкубации на точность определения СКЦ. Для проведения экспериментов был выбран стандартный режим центрифугирования (в течение 10 мин при 600g), рекомендованный в отношении мононуклеаров периферической крови [7]. Для исследования были предварительно отобраны 10 практически здоровых детей (в возрасте от 3 до 16 лет), у которых значения СКЦ находились в пределах 28-32%. У каждого из пациентов определяли СКЦ при наличии и при отсутствии стадии центрифугирования в последовательности действий заявленного способа, при этом сроки инкубации в каждом случае варьировали от 15 до 240 мин при прочих фиксированных оптимальных режимах и условиях осуществления действий заявленного способа. Кровь каждого пациента в каждом из вариантов постановки эксперимента исследовали в трех параллельных опытах с тремя параллельными контролями (3 опытные и 3 контрольные пробы).
Статистическую обработку результатов производили аналогично обработке результатов экспериментов по установлению диагностически значимых диапазонов СКЦ в норме и при патологии.
Результаты исследований приведены в таблице 3.
Предварительно авторами изобретения была проведена проверка пригодности принятого в соответствии с рекомендациями [7] режима центрифугирования для целей заявленного способа. При этом в результате экспериментов было установлено, что, с одной стороны, при центрифугировании смеси мононуклеаров и тучных клеток крыс в указанном режиме оседают на дно пробирки 100% мононуклеаров и 100% клеток-мишеней, что подтверждалось отсутствием указанных клеток в надосадочной жидкости (супернатанте) после центрифугирования. С другой стороны, при центрифугировании в указанном режиме практически не происходит механического повреждения клеток-мишеней, в частности их мембран. Это подтверждалось тем, что, во-первых, количество заявленных клеток-мишеней до и после центрифугирования оставалось постоянным; во-вторых, в контрольных пробах (без мононуклеаров) дегрануляции тучных клеток крыс в результате центрифугирования (при оптимальном сроке инкубации) практически не отмечалось (количество дегранулировавших клеток в контроле после центрифугирования составляло 0%). В связи с этим указанный режим был принят в качестве рабочего (далее – “рабочий режим центрифугирования”).
Данные таблицы 3 показывают, что при отсутствии стадии центрифугирования в последовательности действий заявленного способа при маленьких сроках инкубации (15-60 мин) цитотоксический эффект в отношении заявленных клеток-мишеней практически не проявляется, что исключает возможность определения СКЦ. При увеличении сроков инкубации свыше 60 мин цитотоксический эффект нарастает, однако процент специфически поврежденных клеток-мишеней, чувствительных к действию цитотоксических мононуклеаров, остается относительно низким (12-21%), что препятствует достоверной оценке СКЦ. Кроме того, при сроках инкубации свыше 60 мин нарастает процесс спонтанной дегрануляции тучных клеток крыс (количество дегранулировавших клеток в контроле составляет в зависимости от времени инкубации 3-20%). Таким образом, приведенные результаты экспериментов свидетельствуют о том, что в отсутствие стадии центрифугирования учет результатов цитотоксической реакции является практически невозможным.
Из таблицы 3 видно также, что при центрифугировании в рабочем режиме смеси мононуклеаров и тучных клеток крыс в сочетании с последующей инкубацией смеси максимальное специфическое повреждение заявленных клеток-мишеней, чувствительных к действию цитотоксических клеток, достигается, начиная со времени инкубации 30 мин. Учитывая, что при этом отмечается минимальный разброс результатов в параллельных опытах, указанный срок инкубации принят в качестве оптимального. При увеличении срока инкубации смеси (45-120 мин) количество дегранулировавших клеток-мишеней остается практически постоянным, однако увеличивается разброс результатов в параллельных опытах. Последнее обусловлено начинающимися процессами спонтанной дегрануляции тучных клеток крыс (как начального проявления неспецифического лизиса указанных клеток), что подтверждается нарастанием% дегрануляции в контроле (1-3%). Это снижает воспроизводимость результатов цитотоксических реакций и соответственно точность определения СКЦ.
При дальнейшем увеличении срока инкубации смеси (свыше 120 мин) наблюдается существенное повышение количества дегранулировавших тучных клеток крыс в контроле (11-22%), что свидетельствует о нарастании процессов неспецифического лизиса клеток. Это приводит к значимому занижению результатов цитотоксических реакций, что соответственно исключает возможность определения СКЦ. Таким образом, анализ результатов экспериментов, представленных в таблице 3, позволяет заключить, что центрифугирование смеси мононуклеаров и тучных клеток крыс является существенным признаком заявленного способа, т.к. указанная стадия (ее наличие в последовательности действий способа) непосредственно влияет на достижение заявленного результата. При этом именно сочетание центрифугирования смеси с последующей ее инкубацией обеспечивает возможность выбора оптимального времени инкубации (30 мин), позволяющего получить наибольшую точность определения СКЦ.
Для сравнения авторами изобретения были проведены эксперименты по оценке возможности введения стадии центрифугирования в совокупность действий способа-прототипа [4]. При этом проверялась пригодность двух стандартных режимов центрифугирования:– режима, рекомендованного в отношении опухолевых клеток миелоидной линии согласно методике способа-прототипа [4] (в течение 5 мин при 150g) – режим 1; – режима, рекомендованного в отношении мононуклеаров периферической крови [7] (в течение 10 мин при 600g) – режим 2 (рабочий режим центрифугирования в заявленном способе). Было установлено, что центрифугование в режиме 1 приводило к недостаточному оседанию мононуклеаров – в надосадочной жидкости оставалось 15-30% мононуклеаров, что приводило к конечному нарушению соотношения мононуклеаров и клеток-мишеней способа-прототипа в смеси, что в свою очередь снижало точность определения СКЦ. Кроме того, спонтанный выход 51Сr в контроле возрастал до 25-30%, что свидетельствовало о механическом повреждении значительной части клеток мишеней (в частности, их мембран) в процессе центрифугирования. Указанные негативные факторы в совокупности исключали возможность определения СКЦ. Центрифугирование в режиме 2 делало практически невозможным учет результатов цитотоксической реакции из-за высокого (50-60%) спонтанного выхода 51Сr в контроле, что свидетельствовало о механическом повреждении подавляющего большинства клеток-мишеней (в частности, их мембран) в процессе центрифугирования. Таким образом, введение центрифугирования (как в режиме 1, так и в режиме 2) в последовательность действий способа-прототипа приводило к невозможности определения СКЦ по методике способа-прототипа. Достижение обеспечиваемого изобретением технического результата обусловлено следующим. Известно, что под действием аллергенов происходит дегрануляция предварительно сенсибилизированных сывороткой крови больного тучных клеток крыс. Морфологически это проявляется выходом из клеток цитоплазматических гранул, которые имеют достаточно большие размеры, позволяющие учитывать процесс дегрануляции под микроскопом. При этом сенсибилизация тучных клеток крыс сывороткой крови больного в ходе определения причинно значимого аллергена является необходимым этапом для получения реакции дегрануляции [9] . Последнее обусловлено тем, что исходно на поверхности тучных клеток крыс отсутствуют аллерген-специфические иммуноглобулины Е (IgE) человека, отвечающие за создание и функционирование рецепторного комплекса, необходимого для ответа на аллерген. Авторами заявленного решения не обнаружено источников информации, где были бы описаны изменения тучных клеток крыс в ходе цитотоксических реакций. Авторы изобретения экспериментально установили, что при реализации заявленной совокупности действий при оптимальных условиях и режимах их осуществления под воздействием цитотоксических мононуклеаров происходит дегрануляция тучных клеток крыс без предварительной сенсибилизации последних сывороткой крови больного, что является проявлением антителонезависимой клеточной цитотоксичности. По мнению авторов предложенного способа, это может быть обусловлено тем, что тучные клетки крыс исходно обладают особыми специфическими высокочувствительными рецепторами к перфоринам и цитокинам, продуцируемым цитотоксическими мононуклеарами человека. Возможно также, что цитотоксические мононуклеары могут продуцировать особые цитокины, способные направленно воздействовать на рецепторы и/или на мембраны тучных клеток крыс. Поэтому для создания и функционирования рецепторного комплекса, чувствительного к цитотоксическому действию клеток-эффекторов, не требуется предварительной сенсибилизации заявленных клеток-мишеней сывороткой крови больного. Результаты экспериментальных исследований авторов изобретения показали, что дегрануляция тучных клеток крыс при цитотоксических реакциях морфологически проявляется экзоцитозом – выходом на поверхность указанных клеток прозрачных достаточно крупных гранул, четко различимых под микроскопом. При этом установлено, что совместная инкубация клеток-эффекторов и заявленных клеток-мишеней в течение заявленного периода времени (30 мин) не приводит к гибели клеток-мишеней. Все это позволяет осуществлять учет суправитальных морфологических изменений тучных клеток крыс – их дегрануляцию под действием цитотоксических клеток человека. Возможность оценивать результаты цитотоксических реакций по морфологическим изменениям клеток-мишеней в свою очередь позволяет исключить необходимость мечения последних радиоактивным изотопом. Это, с одной стороны, дает возможность избежать необходимости принимать во внимание способность клеток-мишеней к спонтанному высвобождению радионуклида даже в отсутствие клеток-эффекторов и тем самым позволяет обеспечить оптимальный контроль реакции, за счет чего также повышается точность определения СКЦ. С другой стороны, исключается необходимость проводить анализ в специально оборудованной для работы с радиоактивными изотопами лаборатории и с участием специально обученного персонала. Наличие у заявленных клеток-мишеней особых специфических высокочувствительных рецепторов к действию клеток-эффекторов обеспечивает возможность раннего проявления выраженного цитотоксического эффекта даже при минимальных количествах перфоринов и цитокинов, продуцируемых мононуклеарами. Это позволяет получить значимый цитотоксический эффект и соответственно обеспечить относительно высокую точность определения при относительно низком соотношении клеток-эффекторов и заявленных клеток-мишеней (20-30:1). В результате появляется возможность проведения качественного анализа при использовании относительно небольшого количества крови, что дает возможность получения крови для исследования не только из вены, но и из пальца пациента. Введение в совокупность действий заявленного способа дополнительной (по сравнению с прототипом) стадии – центрифугирования смеси мононуклеаров и клеток-мишеней – позволяет обеспечить ускоренное осаждение клеток, способствуя достижению более раннего и более тесного контакта между клетками-эффекторами и клетками-мишенями и соответственно более раннему продуцированию и высвобождению цитотоксических медиаторов клеток-эффекторов и их воздействию на клетки-мишени. При этом авторами изобретения экспериментально установлено, что степень механического повреждения мембран тучных клеток крыс в результате центрифугирования в рабочем режиме недостаточна для спонтанной дегрануляции указанных клеток, что подтверждалось практически полным отсутствием (0%) дегранулировавших клеток в контроле (при оптимальном режиме инкубации). Напротив, при центрифугировании используемых в способе-прототипе опухолевых клеток миелоидной линии механические повреждения значительной части этих клеток (в частности их мембран) отмечались даже при использовании режима (5 мин при 150g), рекомендованного для данных клеток методикой способа-прототипа [4] (спонтанный выход 51Сr в контроле 25-30%). При центрифугировании в режиме (10 мин при 600g), рекомендованном для мононуклеаров периферической крови [7] (рабочий режим заявленного способа), механические повреждения клеток-мишеней становились еще более значимыми (спонтанный выход 51Сr в контроле 50-60%). Таким образом, результаты сравнительных экспериментальных исследований авторов изобретения (приведенные выше) свидетельствовали о том, что при использовании заявленных клеток-мишеней (в отличие от клеток-мишеней способа-прототипа) центрифугирование не оказывает значимого негативного влияния на точность определения СКЦ, что обусловлено относительно высокой механической прочностью мембран тучных клеток крыс. Использование в качестве клеток-мишеней тучных клеток крыс, обладающих особым специфическим рецепторным аппаратом и прочностными характеристиками мембран, позволяющими искусственно ускорить процесс осаждения клеток, в сочетании с включением центрифугирования (как дополнительной по сравнению с прототипом стадии) в совокупность действий заявленного способа обусловливают возможность получения выраженного цитотоксического эффекта при относительно коротких сроках инкубации (30 мин). Заявленные сроки инкубации в свою очередь позволяют исключить возможность неспецифического лизиса тучных клеток крыс, начальные проявления которого в виде спонтанной дегрануляции клеток отмечаются при сроках инкубации 45-60 мин и достигают значимых величин через 2-3 час инкубации. Это также вносит существенный вклад в повышение точности определения СКЦ. Перемешивание клеточного осадка и супернатанта смеси мононуклеаров и тучных клеток крыс, осуществляемое непосредственно перед подсчетом количества дегранулировавших клеток-мишеней, позволяет разрушить образовавшиеся при центрифугировании конгломераты клеток смеси, что облегчает морфологическую оценку результатов реакции – подсчет дегранулировавших тучных клеток крыс под микроскопом. Это способствует дополнительному повышению точности определения СКЦ. Таким образом, морфологические и функциональные особенности заявленных клеток-мишеней (наличие особого специфического рецепторного аппарата, специфические характеристики цитоплазматических гранул, прочностные характеристики мембран), наличие дополнительного действия (центрифугирования), а также заявленные (оптимальные) режимы и условия осуществления действий способа (смешивания мононуклеаров и клеток-мишеней, инкубации) в совокупности обеспечивают возможность учета суправитальных морфологических изменений клеток-мишеней (их дегрануляцию), специфически обусловленных действием цитотоксических клеток человека. В результате заявленная совокупность признаков в их взаимосвязи позволяет добиться суправитального раннего и выраженного морфологического проявления цитотоксического эффекта при исключении эндогенных и экзогенных значимых негативных факторов, непосредственного влияющих на учет результатов цитотоксической реакции (спонтанного лизиса клеток-мишеней, механических повреждений их мембран, спонтанного выхода радиоактивного изотопа из клеток-мишеней). Это в свою очередь позволяет повысить точность определения СКЦ, сократить сроки проведения анализа, исключить необходимость работы с радиоактивным изотопом. При этом из известного уровня техники не выявляется, по мнению заявителя, влияния предписываемых изобретением преобразований, характеризуемых отличительными от прототипа существенными признаками, на достижение технического результата. Способ осуществляют следующим образом. У пациента из пальца или из вены берут кровь в количестве 0,5 мл в пробирку, смоченную гепарином. Из взятой периферической крови выделяют мононуклеары по стандартной методике, например изложенной в работе [7]. При этом кровь разводят в два раза 0,9% раствором NaCl, наслаивают на смесь Ficoll-Pack 1,077 г/см3 и центрифугируют в течение 30 мин при 400g. Образовавшееся в интерфазе “кольцо” мононуклеаров снимают пипеткой, полученную клеточную взвесь трижды отмывают 0,9% раствором NaCl и доводят концентрацию до 2х106 клеток/мл. Тучные клетки крыс получают по методике Л.М. Ишимовой и Л.И. Зеличенко [9]. При этом белую крысу-самца с массой тела более 140 г усыпляют под эфирным наркозом и вводят в его брюшную полость подогретую до температуры 37oС среду Хемоцелл в количестве 3-5 мл. Производят массаж брюшной полости крысы в течение 2-3 мин, после чего брюшную полость послойно вскрывают и жидкость с тучными клетками крысы собирают в сосуд, подогретый до температуры 37oС. Клетки трижды отмывают средой 199 и доводят концентрацию клеток до 1х105 клеток/мл. После этого в опытную центрифужную пробирку вносят 25-38 мкл взвеси мононуклеаров и 25 мкл взвеси тучных клеток крысы (соотношение мононуклеаров и клеток-мишеней в опытных пробах соответствует 20-30:1). В контрольную центрифужную пробирку вносят 25 мкл взвеси тучных клеток крысы и 25-38 мкл среды 199. Опытную и контрольную пробирки центрифугируют в течение 10 мин при 600g, затем помещают в термостат и инкубируют в течение 30 мин при температуре 37oС. По окончании инкубации содержимое в опытной и в контрольной пробирках встряхивают для перемешивания клеточного осадка и супернатанта (надосадочной жидкости). Затем клеточные суспензии из опытной и контрольной пробирок переносят на предметные стекла (из каждой пробирки – на отдельное стекло), предварительно окрашенные спиртовым раствором нейтрального красного. Капли клеточных суспензий опытной и контрольной проб, помещенные на предметные стекла, закрывают сверху покровными стеклами, края которых смазаны вазелином (для предотвращения испарения жидкости). Подсчитывают, например под микроскопом при увеличении 15х25, количество дегранулировавших тучных клеток крысы в процентах от общего количества тучных клеток крысы в опытной пробе и в контрольной пробе (далее – соответственно “% дегрануляции в опыте” и “% дегрануляции в контроле”). СКЦ определяют как разность% дегрануляции в опыте и % дегрануляции в контроле (далее – “% дегрануляции”). При значении% дегрануляции, составляющем менее 25, определяют пониженную СКЦ, при значении указанного показателя 25-35% определяют нормальную СКЦ, а при значении указанного показателя свыше 35% определяют повышенную СКЦ. Изобретение иллюстрируется следующими примерами. Пример 1. Алеша К. , 7 лет. Обследован в рамках скрининговой программы выявления предрасположенности к частым респираторным заболеваниям в детской поликлинике при Детской городской больнице 1 Санкт-Петербурга (ДГБ 1). В анамнезе у пациента отмечены редкие ОРВИ (1-2 раза в год). При диспансерном обследовании патологии со стороны внутренних органов не выявлено. У пациента была определена СКЦ с использованием заявленного способа. В ходе определения из пальца ребенка взяли кровь в количестве 0,5 мл в пробирку, смоченную гепарином. Из взятой периферической крови выделили мононуклеары по стандартной методике [7]. При этом кровь разводили в два раза 0,9% раствором NaCl, наслаивали на смесь Ficoll-Pack 1,077 г/см3 и центрифугировали в течение 30 мин при 400g. Образовавшееся в интерфазе “кольцо” мононуклеаров снимали пипеткой, полученную клеточную взвесь трижды отмывали 0,9% раствором NaCl и доводили концентрацию до 2х106 клеток/мл. Тучные клетки крысы получали по методике Л.М.Ишимовой и Л.И. Зеличенко [9]. При этом белую крысу-самца с массой тела более 140 г усыпляли под эфирным наркозом и вводили в его брюшную полость подогретую до температуры 37oС среду Хемоцелл в количестве 3-5 мл. Производили массаж брюшной полости крысы в течение 2-3 мин, после чего брюшную полость послойно вскрывали и жидкость с тучными клетками крысы собирали в сосуд, подогретый до температуры 37oС. Клетки трижды отмывали средой 199 и доводили концентрацию клеток до 1х105 клеток/мл. Кровь пациента исследовали в трех параллельных опытах с тремя параллельными контролями (3 опытные и 3 контрольные пробирки.). В каждую опытную центрифужную пробирку вносили 25 мкл взвеси мононуклеаров и 25 мкл взвеси тучных клеток крысы (соотношение мононуклеаров и тучных клеток крысы в опытных пробах соответствовало 20: 1). В каждую контрольную центрифужную пробирку вносили 25 мкл взвеси тучных клеток крысы и 25 мкл среды 199. Опытные и контрольные пробирки центрифугировали в течение 10 мин при 600g, затем поместили в термостат и инкубировали в течение 30 мин при температуре 37oС. По окончании инкубации содержимое в опытных и в контрольных пробирках встряхивали для перемешивания клеточного осадка и супернатанта. Затем клеточные суспензии из опытных и контрольных пробирок перенесли на предметные стекла (из каждой пробирки – на отдельное стекло), предварительно окрашенные спиртовым раствором нейтрального красного. Капли клеточных суспензий опытных и контрольных проб, помещенные на предметные стекла, закрыли сверху покровными стеклами, края которых были смазаны вазелином. С помощью микроскопа “БИМАМ Р-11” (производства “ЛОМО”, Санкт-Петербург) подсчитывали (при увеличении 15х25) в каждой из опытных и контрольных проб 100 тучных клеток крысы; из их числа отмечали дегранулировавшие тучные клетки крысы; количество дегранулировавших тучных клеток крысы выражали в% от 100 подсчитанных тучных клеток крысы (соответственно % дегрануляции в опыте и% дегрануляции в контроле) (см. табл. А). Определили СКЦ как разность% дегрануляции в опыте и % дегрануляции в контроле в каждой из пар (% дегрануляцииI, % дегрануляцииII, % дегрануляцииIII): % дегрануляцииI=28% %дегрануляцииII=30% %дегрануляцииIII=29% Вычислили среднее (из 3-х проб) значение СКЦ (% дегрануляцииср.): % дегрануляцииср.=29% Полученное значение СКЦ (29%) попадало в диапазон нормальных значений СКЦ, что позволило расценить СКЦ данного пациента как нормальную. Время, затраченное на процедуру определения, составило 2 часа 5 минут (2,08 ч) (по результатам хронометрирования авторов изобретения). Параллельно проводили определение СКЦ с помощью способа-прототипа по методике [4]. При этом кровь пациента исследовали в трех параллельных опытах с тремя параллельными контролями (3 опытные и 3 контрольные пробы). Активность опытных и контрольных проб замеряли на счетчике радиоактивности “Ultra-Gamma 1280” (производства LKB, Швеция). Среднее (из 3-х проб) значение СКЦ (% лизиса), определенное по формуле, приведенной в методике [4], составило 55,2%, что соответствовало уровню нормы способа-прототипа. Длительность процедуры определения составила 89 часов 10 минут (89,2 ч) (по результатам хронометрирования авторов изобретения). Таким образом, значения СКЦ, полученные как с помощью заявленного способа, так и способа-прототипа, попадали в соответствующие интервалы значений, характеризующих нормальную СКЦ. Это подтверждалось и результатами клинического обследования ребенка, а также наблюдениями за ним в динамике в течение 2-х лет (за 2 года ребенок 1 раз переболел риновирусной инфекцией), которые свидетельствовали об отсутствии дефектов иммунитета у данного ребенка. Других заболеваний у обследуемого ребенка не выявлено. В указанном случае имело место совпадение результатов определения СКЦ с помощью заявленного способа и способа-прототипа, причем результаты определения СКЦ коррелировали с клиническими данными. Пример 2. Наталья К., 16 лет. Обратилась в детскую поликлинику при ДГБ 1 с жалобами на частые простудные заболевания (ОРВИ 1-2 раза в месяц), которые отмечались в течение последних 6 лет. Заболевания в части случаев (при госпитализации больной в стационары при тяжелых ОРВИ, бронхитах) подтверждались вирусологическими методами исследования (иммунофлуоресцентное исследование мазков-отпечатков со слизистой носа и зева, исследования парных сывороток на антитела к респираторным вирусам). При исследовании иммунного статуса больной количество Т- и В-лимфоцитов, уровень иммуноглобулинов (IgA, IgM, IgG) соответствовали нормальным возрастным показателям. У пациентки проведено определение СКЦ с использованием заявленного способа и способа-прототипа аналогично примеру 1. При определении СКЦ с использованием заявленного способа в каждую опытную центрифужную пробирку вносили 31 мкл взвеси мононуклеаров и 25 мкл взвеси тучных клеток крысы (соотношение мононуклеаров и тучных клеток крысы в опытных пробах соответствовало 25: 1). В каждую контрольную центрифужную пробирку вносили 25 мкл взвеси тучных клеток крысы и 31 мкл среды 199. Результаты определения приведены в табл. Б. % дегрануляцииI=12% % дегрануляцииII=13% % дегрануляцииIII=12% % дегрануляции ср.=12,3% Полученное среднее значение показателя СКЦ (12,3%) позволило сделать вывод о пониженной (по сравнению с нормой) СКЦ у обследуемой пациентки. На процедуру определения затрачено 2 часа 30 минут (2,5 ч). Результаты определения СКЦ с помощью способа-прототипа: среднее (из 3-х проб) значение СКЦ (% лизиса) составило 58,1%, что с свидетельствовало о нахождении СКЦ у больной в пределах нормы. Процедура определения заняла 88 часов 15 минут (88,3 ч). При наблюдении за больной в динамике в течение 14 месяцев, несмотря на проводимое лечение (ИРС-19, рибомунил), частота ОРВИ оставалась достаточно высокой (1 раз в 1-2 месяца), хотя и снизилась по сравнению с частотой ОРВИ, наблюдавшейся до лечения. Таким образом, результаты клинического обследования пациентки и наблюдения в динамике позволяли сделать вывод о том, что в данном случае имеет место сниженная противовирусная резистентность, которая обусловлена активностью клеток, обладающих СКЦ. Это подтвердило результаты определения, полученные с помощью заявленного способа, и дало возможность расценить результаты определения СКЦ по способу-прототипу как ложнозавышенные. Пример 3. Саша К. , 3 года. Поступил на ожоговое отделение ДГБ 1 с диагнозом: Термический ожог бедер, голени, S=25%, IIА-III степени. Больному была пересажена кожа человеческого эмбриона. Начиная со 2-х суток после операции пересадки кожи, ежедневно проводилось мониторирование реакции отторжения трансплантата с помощью заявленного способа и способа-прототипа аналогично примеру 1. При определении СКЦ с использованием заявленного способа в каждую опытную центрифужную пробирку вносили 38 мкл взвеси мононуклеаров и 25 мкл взвеси тучных клеток крысы (соотношение мононуклеаров и тучных клеток крысы в опытных пробах соответствовало 30: 1). В каждую контрольную центрифужную пробирку вносили 25 мкл взвеси тучных клеток крысы и 38 мкл среды 199. Результаты определения приведены в табл. В. Время, затраченное на процедуру определения с использованием заявленного способа и способа-прототипа, составило соответственно 2 часа 10 минут (2,2 ч) и 89 часов 30 минут (89,5 ч). На 10-й день после операции был клинически зарегистрирован криз отторжения трансплантата – пересаженной эмбриональной кожи. Таким образом, заявленный способ позволил прогнозировать вероятность криза, т.к. начиная с 7-х суток после операции наблюдалось повышение значений СКЦ по сравнению с нормальными показателями СКЦ. СКЦ, определенная с помощью способа-прототипа, в течение всего срока наблюдения незначительно колебалась, не выходя за пределы интервала нормальных значений СКЦ, что позволило расценить результаты цитотоксической реакции как ложнозаниженные. Прогнозировать вероятность криза отторжения трансплантата с помощью способа-прототипа не представлялось возможным. С помощью заявленного способа было обследовано in vitro 286 детей в возрасте от 3-х до 16 лет. При этом при обследовании 274 детей заявленный способ был использован в рамках скрининговой иммунологической программы выявления предрасположенности к частым респираторным заболеваниям (группа А). Кроме того, заявленный способ был применен для обследования 12 ожоговых больных (группа В) с целью мониторирования реакции отторжения трансплантата (пересаженного кожного лоскута). Исследования проводили на базе Детской городской больницы 1 Санкт-Петербурга (детская поликлиника при ДГБ 1; ожоговое отделение 36 ДГБ 1), а также на базе детской поликлиники 60 (Санкт-Петербурга) и областной детской поликлиники. Критериями эффективности определения СКЦ с использованием заявленного способа служили точность определения (количество подтвержденных результатов определения), а также длительность процедуры определения (по результатам хронометрирования авторов изобретения). Для подтверждения наличия или отсутствия отклонений от нормы значений СКЦ проводили сбор анамнеза, оценку клинической картины заболевания, клинико-инструментальное и клинико-лабораторное наблюдение за больными в динамике. Те же дети были параллельно обследованы с помощью способа-прототипа [4]. Эффективность определения СКЦ оценивали с помощью тех же критериев, что и в случае заявленного способа. Статистическую обработку результатов проводили путем точного вычисления значимости различий долей по методу  (углового преобразования Фишера) [8].
Из данных таблицы 4 следует, что заявленный способ обеспечил получение клинически подтвержденных результатов определения СКЦ в 100% случаев при отсутствии ложнозаниженных и ложнозавышенных результатов определения. При этом в группе А пониженная СКЦ была зарегистрирована у 82 детей (29,9%). У всех этих детей либо (как правило) в анамнезе отмечались частые (8-10 раз в год) острые респираторные заболевания /ОРЗ/ (ОРВИ, бронхиты, пневмонии), подтвержденные клиническими, клинико-инструментальными, клинико-лабораторными и вирусологическими методами обследования, либо при наблюдении в динамике наблюдалось резкое увеличение частоты ОРЗ (до 8-10 раз в год) по сравнению с периодом, предшествовавшим иммунологическому обследованию. Нормальная СКЦ, зарегистрированная в группе А у 191 ребенка (69,7%), также подтверждалась результатами клинического обследования и наблюдениями в динамике (частота ОРЗ 1-2 раза в год; отсутствие других заболеваний). Повышенное значение СКЦ, полученное в группе А у 1 больного, не было расценено как ложнозавышенное, т. к. у данного больного при клиническом обследовании была выявлена глистная инвазия (аскаридоз). Предполагается, что клетки, участвующие в СКЦ, могут принимать участие и в защите от гельминтов, что приводит к повышению активности цитотоксических клеток.
В группе В повышенная СКЦ была выявлена у 7 больных (58,3%) на 7-8 день после трансплантации. У всех этих больных (в 100% случаев) на 10-14 день после трансплантации был клинически зарегистрирован криз отторжения пересаженного кожного лоскута. У 3-х больных с пересаженным кожным лоскутом отмечалась нормальная СКЦ; у 2-х больных группы В – сниженная СКЦ. Ни у одного из этих больных при наблюдении в динамике не было зарегистрировано кризов отторжения трансплантата. При этом у обоих больных со сниженной СКЦ в анамнезе отмечались частые ОРВИ (8 и 9 раз в год), подтвержденные клиническими, клинико-инструментальными, клинико-лабораторными и вирусологическими методами обследования.
Из данных таблицы 4 видно также, что полученные с помощью способа-прототипа результаты определения СКЦ были подтверждены клинически только в 65,0% случаев; в 28,3% случаев полученные показатели СКЦ были расценены как ложнозаниженные, а в 6,7% случаев – как ложнозавышенные результаты определения (р<0,001 по сравнению с соответствующими значениями показателей заявленного способа). При этом в группе А сниженная СКЦ, отмеченная у 145 пациентов (52,9%), была подтверждена клинически (аналогично заявленному способу) только у 68 больных (24,8%) (частота ОРЗ 8-10 раз в год). Зарегистрированные у 77 детей (28,1%) пониженные показатели СКЦ были расценены как ложнозаниженные, т. к. они не подтверждались ни анамнестически, ни при наблюдении в динамике (частота ОРЗ 1-2 раза в год; отсутствие других заболеваний, в частности опухолей, лейкозов и т.д., которые могли бы обусловить низкие показатели СКЦ).
Нормальные значения СКЦ, выявленные у 116 детей (42,3%), были подтверждены клинически (аналогично заявленному способу) только у 110 детей (40,1%). У 5 детей (1,8%) из числа указанных 116 полученные результаты определения были расценены как ложнозавышенные, т.к. в анамнезе отмечались частые ОРЗ (8-10 раз в год), а у одного ребенка (0,4%) зарегистрированная нормальная СКЦ была расценена как ложнозаниженная в связи с наличием глистной инвазии, которая может, как было указано выше, обусловить повышенную активность цитотоксических клеток. У 13 детей (4,8%) была отмечена повышенная СКЦ, которая была расценена как ложнозавышенная, т.к. 4 ребенка (1,5%) оказались практически здоровыми, а у 9 детей (3,3%) в анамнезе отмечались частые респираторные заболевания (частота ОРЗ более 8 раз в год).
В группе В повышенная СКЦ была определена с помощью способа-прототипа только у 4-х из 7 больных, у которых был зарегистрирован клинический криз отторжения трансплантата. У 3-х больных с кризом отторжения пересаженного кожного лоскута были получены нормальные значения СКЦ, расцененные как ложнозаниженные. Из 5-ти больных с пересаженным кожным трансплантатом без отторжения последнего у одного пациента отмечались сниженные показатели СКЦ, которые коррелировали с клиническими данными (частота ОРВИ – 9 заболеваний за предшествующий ожогу год), а у 4-х пациентов полученные значения СКЦ находились в пределах нормы. При этом у 3-х больных (из числа указанных 4-х пациентов) нормальные значения СКЦ были подтверждены клинически, а у одного ребенка полученные результаты были расценены как ложнозавышенные (в анамнезе – частота ОРВИ 8 раз в год).
Данные таблицы 4 показывают также, что длительность процедуры определения СКЦ с использованием заявленного способа составила 2-2,5 ч, тогда как при использовании способа-прототипа аналогичный показатель составил 88-90 ч.
Таким образом, заявленный способ при его реализации обеспечивает повышение точности определения СКЦ по сравнению со способом-прототипом: количество результатов определения, коррелирующих с данными клинического обследования, возрастает на 35%, при отсутствии ложнозаниженных и ложнозавышенных результатов определения (в отличие от способа-прототипа, где ложнозаниженные и ложнозавышенные результаты составляют соответственно 28,3 и 6,7%). При этом длительность процедуры определения при использовании заявленного способа сокращается в 35-45 раз (по сравнению со способом-прототипом). Кроме того, исключение из хода анализа действий, связанных с мечением материала радиоактивным изотопом, позволяет исключить необходимость специально оборудованной лаборатории и специально обученного персонала, что упрощает способ.
Источники информации (углового преобразования Фишера) [8].
Из данных таблицы 4 следует, что заявленный способ обеспечил получение клинически подтвержденных результатов определения СКЦ в 100% случаев при отсутствии ложнозаниженных и ложнозавышенных результатов определения. При этом в группе А пониженная СКЦ была зарегистрирована у 82 детей (29,9%). У всех этих детей либо (как правило) в анамнезе отмечались частые (8-10 раз в год) острые респираторные заболевания /ОРЗ/ (ОРВИ, бронхиты, пневмонии), подтвержденные клиническими, клинико-инструментальными, клинико-лабораторными и вирусологическими методами обследования, либо при наблюдении в динамике наблюдалось резкое увеличение частоты ОРЗ (до 8-10 раз в год) по сравнению с периодом, предшествовавшим иммунологическому обследованию. Нормальная СКЦ, зарегистрированная в группе А у 191 ребенка (69,7%), также подтверждалась результатами клинического обследования и наблюдениями в динамике (частота ОРЗ 1-2 раза в год; отсутствие других заболеваний). Повышенное значение СКЦ, полученное в группе А у 1 больного, не было расценено как ложнозавышенное, т. к. у данного больного при клиническом обследовании была выявлена глистная инвазия (аскаридоз). Предполагается, что клетки, участвующие в СКЦ, могут принимать участие и в защите от гельминтов, что приводит к повышению активности цитотоксических клеток.
В группе В повышенная СКЦ была выявлена у 7 больных (58,3%) на 7-8 день после трансплантации. У всех этих больных (в 100% случаев) на 10-14 день после трансплантации был клинически зарегистрирован криз отторжения пересаженного кожного лоскута. У 3-х больных с пересаженным кожным лоскутом отмечалась нормальная СКЦ; у 2-х больных группы В – сниженная СКЦ. Ни у одного из этих больных при наблюдении в динамике не было зарегистрировано кризов отторжения трансплантата. При этом у обоих больных со сниженной СКЦ в анамнезе отмечались частые ОРВИ (8 и 9 раз в год), подтвержденные клиническими, клинико-инструментальными, клинико-лабораторными и вирусологическими методами обследования.
Из данных таблицы 4 видно также, что полученные с помощью способа-прототипа результаты определения СКЦ были подтверждены клинически только в 65,0% случаев; в 28,3% случаев полученные показатели СКЦ были расценены как ложнозаниженные, а в 6,7% случаев – как ложнозавышенные результаты определения (р<0,001 по сравнению с соответствующими значениями показателей заявленного способа). При этом в группе А сниженная СКЦ, отмеченная у 145 пациентов (52,9%), была подтверждена клинически (аналогично заявленному способу) только у 68 больных (24,8%) (частота ОРЗ 8-10 раз в год). Зарегистрированные у 77 детей (28,1%) пониженные показатели СКЦ были расценены как ложнозаниженные, т. к. они не подтверждались ни анамнестически, ни при наблюдении в динамике (частота ОРЗ 1-2 раза в год; отсутствие других заболеваний, в частности опухолей, лейкозов и т.д., которые могли бы обусловить низкие показатели СКЦ).
Нормальные значения СКЦ, выявленные у 116 детей (42,3%), были подтверждены клинически (аналогично заявленному способу) только у 110 детей (40,1%). У 5 детей (1,8%) из числа указанных 116 полученные результаты определения были расценены как ложнозавышенные, т.к. в анамнезе отмечались частые ОРЗ (8-10 раз в год), а у одного ребенка (0,4%) зарегистрированная нормальная СКЦ была расценена как ложнозаниженная в связи с наличием глистной инвазии, которая может, как было указано выше, обусловить повышенную активность цитотоксических клеток. У 13 детей (4,8%) была отмечена повышенная СКЦ, которая была расценена как ложнозавышенная, т.к. 4 ребенка (1,5%) оказались практически здоровыми, а у 9 детей (3,3%) в анамнезе отмечались частые респираторные заболевания (частота ОРЗ более 8 раз в год).
В группе В повышенная СКЦ была определена с помощью способа-прототипа только у 4-х из 7 больных, у которых был зарегистрирован клинический криз отторжения трансплантата. У 3-х больных с кризом отторжения пересаженного кожного лоскута были получены нормальные значения СКЦ, расцененные как ложнозаниженные. Из 5-ти больных с пересаженным кожным трансплантатом без отторжения последнего у одного пациента отмечались сниженные показатели СКЦ, которые коррелировали с клиническими данными (частота ОРВИ – 9 заболеваний за предшествующий ожогу год), а у 4-х пациентов полученные значения СКЦ находились в пределах нормы. При этом у 3-х больных (из числа указанных 4-х пациентов) нормальные значения СКЦ были подтверждены клинически, а у одного ребенка полученные результаты были расценены как ложнозавышенные (в анамнезе – частота ОРВИ 8 раз в год).
Данные таблицы 4 показывают также, что длительность процедуры определения СКЦ с использованием заявленного способа составила 2-2,5 ч, тогда как при использовании способа-прототипа аналогичный показатель составил 88-90 ч.
Таким образом, заявленный способ при его реализации обеспечивает повышение точности определения СКЦ по сравнению со способом-прототипом: количество результатов определения, коррелирующих с данными клинического обследования, возрастает на 35%, при отсутствии ложнозаниженных и ложнозавышенных результатов определения (в отличие от способа-прототипа, где ложнозаниженные и ложнозавышенные результаты составляют соответственно 28,3 и 6,7%). При этом длительность процедуры определения при использовании заявленного способа сокращается в 35-45 раз (по сравнению со способом-прототипом). Кроме того, исключение из хода анализа действий, связанных с мечением материала радиоактивным изотопом, позволяет исключить необходимость специально оборудованной лаборатории и специально обученного персонала, что упрощает способ.
Источники информации1. Лимфоциты: Методы. Пер. с англ. /Под ред. Дж. Клауса. – М.: Мир, 1990. – С. 223-226,269. 2. Иммунологические методы. / Под. ред. Г. Фримеля, Пер. с нем. А.П. Тарасова. – М.: Медицина, 1987. – С. 282-293. 3. Ярилин А.А. Основы иммунологии: Учебник. – М.: Медицина, 1999. – С. 51-54, 421-432. 4. Зарецкая Ю.М. Клиническая иммуногенетика. – М.: Медицина, 1983. – С. 159-162 (прототип). 5. Справочник по функциональной диагностике в педиатрии. / Под ред. Ю.Е. Вельтищева, Н.С. Кисляк. – М.: Медицина, 1979. – С. 455-462. 6. Фрейдлин И.С. Иммунная система и ее дефекты: Руководство для врачей. – СПб., 1998. – С. 25-27. 7. Кетлинский С. А. , Калинина Н.М. Иммунология для врача. – СПб.: ТОО издательство “Гиппократ”, 1998. – С. 9, 113-115. 8. Гублер Е.В. Вычислительные методы анализа и распознавания патологических процессов. – Л.: Медицина, 1978. – С. 84-86. 9. Зеличенко Л.И. Тучные клетки крыс в аллергических реакциях немедленного типа: Автореф. дисс. на соиск. учен. степени канд. мед. наук. – М., 1969. – 18 с. Формула изобретения 1. Способ определения спонтанной клеточной цитотоксичности, включающий выделение мононуклеаров из периферической крови пациента, приготовление клеток-мишеней, смешивание мононуклеаров и клеток-мишеней, инкубирование смеси мононуклеаров и клеток-мишеней с последующим учетом результатов цитотоксической реакции, отличающийся тем, что в качестве клеток-мишеней используют тучные клетки крыс, смешивают мононуклеары и тучные клетки крыс в соотношении 20-30: 1, непосредственно после смешивания мононуклеаров и тучных клеток крыс дополнительно центрифугируют полученную смесь, инкубирование смеси мононуклеаров и тучных клеток крыс производят в течение 30 мин, а учет результатов цитотоксической реакции осуществляют путем подсчета количества дегранулировавших тучных клеток крыс в процентах от общего количества тучных клеток крыс в смеси мононуклеаров и тучных клеток крыс и при значении указанного показателя, составляющем менее 25%, определяют пониженную спонтанную клеточную цитотоксичность, при значении указанного показателя 25-35% определяют нормальную спонтанную клеточную цитотоксичность, а при значении указанного показателя свыше 35% определяют повышенную спонтанную клеточную цитотоксичность. 2. Способ по п.1, отличающийся тем, что в ходе учета результатов цитотоксической реакции непосредственно перед подсчетом количества дегранулировавших тучных клеток крыс в смеси мононуклеаров и тучных клеток крыс производят перемешивание клеточного осадка и супернатанта смеси мононуклеаров и тучных клеток крыс. РИСУНКИ
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 29.12.2006
Извещение опубликовано: 20.01.2008 БИ: 02/2008
|
||||||||||||||||||||||||||
