Патент на изобретение №2208615
|
||||||||||||||||||||||||||
(54) НОВЫЕ ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ И СПОСОБ ПОЛУЧЕНИЯ ИЗ НИХ МАКРОЛИДНОГО АНТИБИОТИКА
(57) Реферат: Изобретение относится к производному 9-O-бензодитиолоксима эритромицина А формулы (III), где Y1 и Y2 представляют собой атомы водорода или триметилсилильные группы, или его кристаллическому сольвату, которые используют в качестве промежуточного соединения для синтеза кларитромицина. Также предложены способы получения кларитромицина формулы (I), исходя из 9-оксима эритромицина А или его гидрохлорида с использованием триметилсилильной и 1,3-бензодитиольной защитных групп. Технический результат: повышение выхода и упрощение очистки целевого продукта. 3 с. и 5 з.п.ф-лы. 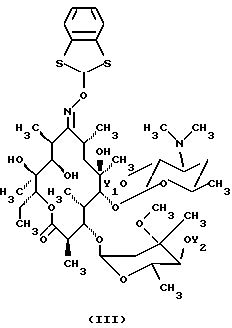 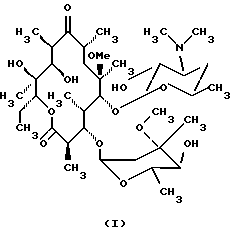 Текст описания в факсимильном виде (см. графическую часть).
Текст описания в факсимильном виде (см. графическую часть).
Формула изобретения 1. Производное 9-O-бензодитиолоксима эритромицина А, полезное для синтеза кларитромицина, представленное формулой (III) 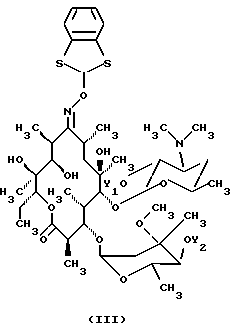 в которой Y1 и Y2 представляют атомы водорода или триметилсилильные группы или его кристаллический сольват. 2. Промежуточное соединение формулы (III) по п.1, где Y1 и Y2 представляют собой триметилсилильные группы, в виде кристаллического сольвата, который содержит соединение указанной формулы и ацетон в соотношении 2:1. 3. Способ получения кларитромицина формулы (I), включающий стадии 1) взаимодействия 9-оксима эритромицина А формулы (II) или его гидрохлорида с 1,0-1,2 эквивалентами тетрафторбората 1,3-бензодитиол-2-илия (BDTF) в апротонном неполярном органическом растворителе в присутствии 1,0-2,0 эквивалентов пиридина с синтезом производного 9-O-BDT оксима эритромицина А формулы (III)’ с оксимной группой, защищенной 1,3-бензодитиольной (BDT) группой 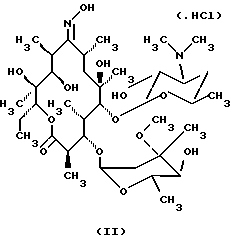 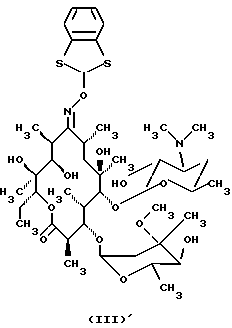 2) реакции соединения формулы (III)’, синтезированного на стадии 1), с 3,0-5,0 эквивалентами гексаметилдисилазана (HMDS), в присутствии таких солей, как хлористый аммоний, гидрохлорид пиридина или п-толуолсульфонат пиридина, с образованием производного 9-O-BDT оксима 2′-O-,4”-O-бистриметилсилилэритромицина А формулы (V) 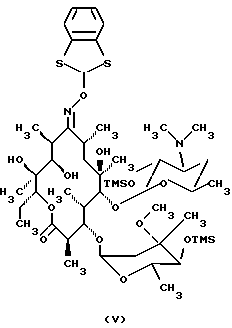 3) метилирования 6-ОН группы соединения формулы (V), синтезированного на стадии 2), метилиодидом в растворителе в присутствии сильного основания с образованием производного 9-O-BDT оксима 2′-O,-4″-O-бистриметилсилил-6-О-метилэритромицина формулы (VII) 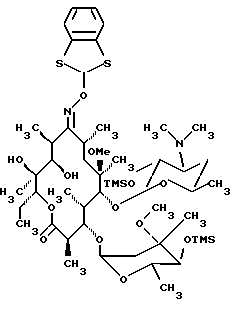 4) снятия защиты с соединения формулы (VII), синтезированного на стадии 3) с образованием соединения формулы (I). BDSA 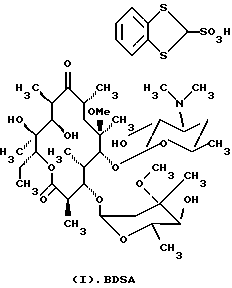 5) перемешивания соединения формулы (I).BDSA, синтезированного на стадии 4), в воде или в смеси воды и смешиваемого с водой органического растворителя, в присутствии неорганической соли или основания с последующим его фильтрованием с образованием кларитромицина, представленного формулой (I) 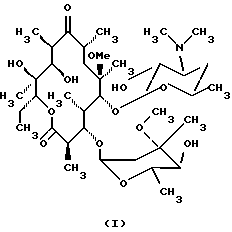 4. Способ по п. 3, в котором указанный растворитель, используемый на описанной выше на стадии 3), выбирают из апротонного полярного растворителя такого как ДМФ или ДМСО, смеси указанного апротонного полярного растворителя и ТГФ в соотношении 1:1, или смеси указанного апротонного полярного растворителя, ТГФ и такого неполярного органического растворителя, как изопропиловый эфир или третбутилметиловый эфир, в соотношении 2:2:0,3 и метилирование соединения формулы (V), описанное на стадии 3), проводят при температуре от -5 до 5oС в течение 30 мин – 2 ч 2,0-3,0 эквивалентами метилиодида в качестве метилирующего агента в указанном растворителе, взятом в 5-10-кратном количестве по отношению к количеству соединения формулы (V), и 1,0-3,0 эквивалентами такого сильного основания, как КОН, алкоксид и NaH в присутствии 0-2,5 эквивалентов Et3N. 5. Способ по п.3, в котором смешиваемый с водой органический растворитель на стадии 5) представляет этанол. 6. Способ по п.3, в котором снятие защиты на стадии 4) проводят с использованием 1,0-3,0 эквивалентов муравьиной кислоты и 4,0-8,0 эквивалентов NаНSО3, Na2S2O4, Na2S2O5 или Na2SO3 в 5-10 мас.ч. смеси этанола с водой в соотношении 1: 1, и перед кристаллизацией смесь охлаждают до комнатной температуры. 7. Способ по п.3, в котором реакцию нейтрализации стадии 5) проводят с помощью приготовления раствора соединения указанной выше формулы (I).BDSA смешением одной массовой части указанного соединения и 10-20 мас.ч. воды или 5-10 мас. ч. воды и 5-10 мас.ч. этанола, при соотношении в смеси 1:1, и добавлением к указанному раствору 3-5 мас.ч. растворителя, включающего 1-2 мас.ч. неорганической соли или основания. 8. Способ получения кларитромицина формулы (I), включающий стадии 1) добавления гексаметилдисилазана (HMDS) к 9-оксиму эритромицина А или его гидрохлориду с образованием производного 9-оксима 2′-O-4”-O-бистриметилсилилэритромицина А формулы (IV) 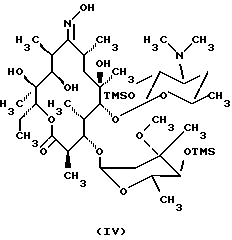 2) взаимодействия производного 9-оксима 2′-O-4”-O-бистриметилсилилэритромицина А указанной формулы (IV) в апротонном органическом растворителе, в присутствии пиридина, с BDTF с образованием производного 9-O-BDT оксима 2′-O-4”-O-бистриметилсилилэритромицина А формулы(V) 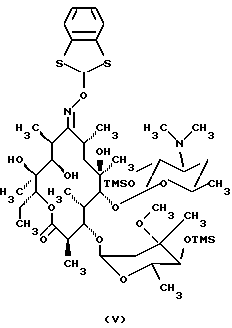 3) метилирования 6-ОН группы соединения формулы (V), синтезированного на описанной выше стадии 2), метилиодидом в апротонном полярном растворителе в присутствии сильного основания с образованием производного 9-O-BDT оксима 2′-O-, 4”-О-бистриметилсилил-6-О-метилэритромицина формулы (VII) 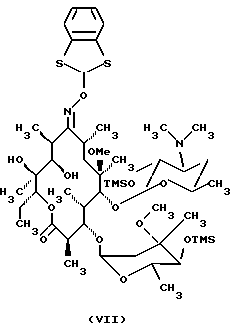 4) снятия защиты с соединения формулы (VII), синтезированного на стадии 3) с образованием соединения формулы (I).BDSA 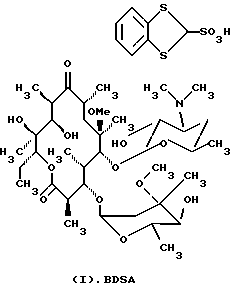 5) перемешивания соединения формулы (I).BDSA, синтезированного на стадии 4) в воде или в смеси воды и смешиваемого с водой органического растворителя, в присутствии неорганической соли или основания и с последующим его фильтрованием с образованием кларитромицина, представленного формулой (I) 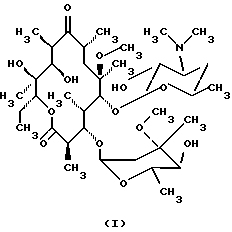 Приоритет по пунктам: 24.11.1998 – по пп.1, 3, 6; 16.11.1999 – по пп.2, 5, 7, 8. РИСУНКИ
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 25.11.2005
Извещение опубликовано: 20.12.2007 БИ: 35/2007
|
||||||||||||||||||||||||||
