Патент на изобретение №2208010
|
||||||||||||||||||||||||||
(54) ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ (ВАРИАНТЫ), ПРОИЗВОДНЫЕ 3,5-ДИФЕНИЛ-1,2,4-ТРИАЗОЛОВ, В НЕЕ ВХОДЯЩИЕ
(57) Реферат: Описываются фармацевтическая композиция для лечения заболеваний, которые вызывают появление избытка железа в организме человека или животного или которые обусловлены им, содержащая по крайней мере одно соединение формулы I, где R1 и R5 одновременно или независимо друг от друга обозначают водород, галоген, гидроксил, С1-С4алкил, галоС1-С4алкил, С1-С4алкокси, галоС1-С4алкокси, карбоксил, карбамоил, N-, С1-С4алкилкарбамоил, N,N-ди-С1-С4алкилкарбамоил или нитрил, R2 и R4 одновременно или независимо друг от друга обозначают водород, С1-С4алканоил, бензоил, толуол, нафтоил или пара-метоксибензоил либо радикал, который может быть удален в физиологической среде, R3 обозначает водород, С1-С4алкил, гидроксиС1-С4алкил, галоС1-С4алкил, карбоксиС1-С4алкил, С1-С4алкоксикарбонилС1-С4алкил, R6R7N-C(O)-С1-С4алкил, фенил, незамещенный или замещенный карбоксилом, нитрогруппой, галогеном, С1-С4алкоксигруппой, С1-С4алкоксикарбонилом или группой R8R9N-(СО)-, фенилС1-С4алкил, пара-хлорбензил, орто-фторбензил, пара-толиметил, пара-ди-С1-С4алкиламинобензил, пара-цианобензил, пара-пирролидинобензил или пиридил, незамещенный или связанный через С1-С4алкиленовую группу, R6 и R7 одновременно или независимо друг от друга обозначают водород, С1-С4алкил, гидроксиС1-С4алкил, алкоксиС1-С4алкил, гидроксиалкоксиС1-С4алкил, аминоС1-С4алкил, N-С1-С4алкиламиноС1-С4алкил, N, N-ди-С1-С4алкиламиноС1-С4алкил, N-(гидроксиС1-С4алкил)аминоС1-С4алкил, N,N-ди-(гидроксиС1-С4алкил)аминоС1-С4алкил, бензил, 4-морфолинилэтил, (4-метил-1-пиперазинил)этил или вместе с атомом азота, к которому они присоединены, образуют морфолино- или 4-метилпиперазино, R8 и R9 вместе с атомом азота, к которому они присоединены, образуют морфолино или 4-метилпиперазино, или его фармацевтически приемлемую соль и по крайней мере один фармацевтически приемлемый носитель; новые соединения, подпадающие под общую формулу I и фармацевтическая композиция, содержащая новые соединения. 4 с. и 3 з.п.ф-лы. 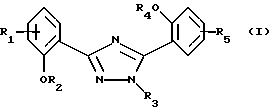 Изобретение относится к замещенным 3,5-дифенил-1,2,4-триазолам и их применению в качестве фармацевтических агентов, образующих хелатные комплексы с металлами.
Различные нарушения у теплокровных животных связаны с избытком в тканях организма металлов, в частности трехвалентных металлов, например с избытком алюминия при диализе при энцефалопатии и остеомаляции, а также при болезни Альцгеймера. При других заболеваниях, в частности, у человека в различных тканях образуется избыток железа. Такое нарушение называют перегрузкой железом (прежнее название гемосидероз). Это происходит, например, после парентерального введения железа (прежде всего при повторных трансфузиях крови) или в результате усиленного поглощения железа из желудочно-кишечного тракта. Повторные трансфузии необходимы при серьезных анемиях, прежде всего при большой талассемии, серьезной форме
Изобретение относится к замещенным 3,5-дифенил-1,2,4-триазолам и их применению в качестве фармацевтических агентов, образующих хелатные комплексы с металлами.
Различные нарушения у теплокровных животных связаны с избытком в тканях организма металлов, в частности трехвалентных металлов, например с избытком алюминия при диализе при энцефалопатии и остеомаляции, а также при болезни Альцгеймера. При других заболеваниях, в частности, у человека в различных тканях образуется избыток железа. Такое нарушение называют перегрузкой железом (прежнее название гемосидероз). Это происходит, например, после парентерального введения железа (прежде всего при повторных трансфузиях крови) или в результате усиленного поглощения железа из желудочно-кишечного тракта. Повторные трансфузии необходимы при серьезных анемиях, прежде всего при большой талассемии, серьезной форме  -талассемии, а также при других анемиях. Увеличенная абсорбция железа из желудочно-кишечного тракта либо является первичной, например, обусловлена генетическим дефектом (так называемый гемохроматоз), либо вторичной, например, после анемий, при которых необходимы трансфузии крови, например после умеренной талассемии, -талассемии, а также при других анемиях. Увеличенная абсорбция железа из желудочно-кишечного тракта либо является первичной, например, обусловлена генетическим дефектом (так называемый гемохроматоз), либо вторичной, например, после анемий, при которых необходимы трансфузии крови, например после умеренной талассемии,  -талассемии умеренной формы.
Перегрузка железом при отсутствии лечения может вызвать серьезное повреждение органа, в частности печени, сердца и органов эндокринной системы, что может привести к летальному исходу. Соединения, образующие хелатные комплексы с железом, могут мобилизировать и выводить отложенное в органах железо и тем самым снижать связанные с избытком железа заболеваемость и смертность.
Снижение концентрации железа (III) также представляет интерес для лечения нарушений, связанных с зависящими от железа (III) микроорганизмами и паразитами, которые играют ключевую роль не только в заболеваниях человека, таких, как, в частности, малярия, но также и в ветеринарных болезнях. Образование комплексов с другими металлами, в частности с трехвалентными металлами, также может использоваться для их экскреции из организма. Многочисленные другие применения также описаны в литературе, например, у G. Kontoghiorghes, Toxicology Lett., 80, 1-18 (1995).
Для этих целей уже в течение длительного периода времени известен и применяется в терапии десферриоксамин В (Н. Bickel, H. Keberle и Е. Vischer, Helv. Chem. Acta, 46, 1385-1389 [1963]). Недостатком этого препарата, однако, является то, что десферриоксамин и его соли обладают лишь незначительной, неадекватной активностью при оральном введении, а при их применении во всех вышеуказанных случаях необходима форма парентерального введения. Для них, например, рекомендовано в качестве особенно эффективного способа введения действующего вещества использовать медленную (8-12 ч) подкожную инфузию, что, однако, требует применения портативного механического приспособления, такого, как шприц для инфузии, приводимый в действие электрическим приводом. Помимо их неудобства, такие растворы обусловливают высокую стоимость лечения, что серьезно ограничивает их применение, в частности становится невозможным лечение талассимиаза в странах Средиземноморья, Среднего Востока, Индии и Юго-Восточной Азии, малярии во всем мире и серповидно-клеточной анемии в странах Африки. Широко распространенные заболевания, таким образом, представляют собой серьезную проблему для здравоохранения в этих странах, что делает крайне необходимой в данной области разработку простого и более дешевого метода лечения, предпочтительно с использованием препаратов, активных при оральном введении.
Различные 3,5-дифенил-1,2,4-триазолы известны в течение длительного периода времени, и их применение описано в качестве гербицидов, например, в ЕР 0185401, в качестве антагонистов рецептора ангиотензина II в ЕР 0480659 или очень в общей форме в качестве промежуточных продуктов и исходных соединений для чистых химических соединений, например, в JP 06345728.
В настоящее время было установлено, что определенные замещенные 3,5-дифенил-1,2,4-триазолы обладают ценными фармакологическими свойствами при их использовании для лечения нарушений, которые вызваны избытком металла в организме человека или животного или обусловливаются этим, прежде всего выраженной способностью связываться с ионами трехвалентных металлов, в частности железа (А. Е. Martell и R.J. Motekaitis, “Determination and Use of Stability Constants”, VCH Publishers, New York, 1992). Среди прочего они обладают способностью препятствовать отложению пигментов, содержащих железо, и в случае наличия в организме депо железа вызывать его экскрецию, например, на модельных животных при использовании перегруженных железом крыс после холедохостомии (R.J. Bergeron и др., J. Med. Chem., 34, 2072-2078 (1991)) или перегруженных железом обезьян (R. J. Bergeron и др., Blood, 81, 2166-2173 (1993)), в дозах приблизительно 5 мкмоль/кг.
Настоящее изобретение относится к применению соединений формулы I -талассемии умеренной формы.
Перегрузка железом при отсутствии лечения может вызвать серьезное повреждение органа, в частности печени, сердца и органов эндокринной системы, что может привести к летальному исходу. Соединения, образующие хелатные комплексы с железом, могут мобилизировать и выводить отложенное в органах железо и тем самым снижать связанные с избытком железа заболеваемость и смертность.
Снижение концентрации железа (III) также представляет интерес для лечения нарушений, связанных с зависящими от железа (III) микроорганизмами и паразитами, которые играют ключевую роль не только в заболеваниях человека, таких, как, в частности, малярия, но также и в ветеринарных болезнях. Образование комплексов с другими металлами, в частности с трехвалентными металлами, также может использоваться для их экскреции из организма. Многочисленные другие применения также описаны в литературе, например, у G. Kontoghiorghes, Toxicology Lett., 80, 1-18 (1995).
Для этих целей уже в течение длительного периода времени известен и применяется в терапии десферриоксамин В (Н. Bickel, H. Keberle и Е. Vischer, Helv. Chem. Acta, 46, 1385-1389 [1963]). Недостатком этого препарата, однако, является то, что десферриоксамин и его соли обладают лишь незначительной, неадекватной активностью при оральном введении, а при их применении во всех вышеуказанных случаях необходима форма парентерального введения. Для них, например, рекомендовано в качестве особенно эффективного способа введения действующего вещества использовать медленную (8-12 ч) подкожную инфузию, что, однако, требует применения портативного механического приспособления, такого, как шприц для инфузии, приводимый в действие электрическим приводом. Помимо их неудобства, такие растворы обусловливают высокую стоимость лечения, что серьезно ограничивает их применение, в частности становится невозможным лечение талассимиаза в странах Средиземноморья, Среднего Востока, Индии и Юго-Восточной Азии, малярии во всем мире и серповидно-клеточной анемии в странах Африки. Широко распространенные заболевания, таким образом, представляют собой серьезную проблему для здравоохранения в этих странах, что делает крайне необходимой в данной области разработку простого и более дешевого метода лечения, предпочтительно с использованием препаратов, активных при оральном введении.
Различные 3,5-дифенил-1,2,4-триазолы известны в течение длительного периода времени, и их применение описано в качестве гербицидов, например, в ЕР 0185401, в качестве антагонистов рецептора ангиотензина II в ЕР 0480659 или очень в общей форме в качестве промежуточных продуктов и исходных соединений для чистых химических соединений, например, в JP 06345728.
В настоящее время было установлено, что определенные замещенные 3,5-дифенил-1,2,4-триазолы обладают ценными фармакологическими свойствами при их использовании для лечения нарушений, которые вызваны избытком металла в организме человека или животного или обусловливаются этим, прежде всего выраженной способностью связываться с ионами трехвалентных металлов, в частности железа (А. Е. Martell и R.J. Motekaitis, “Determination and Use of Stability Constants”, VCH Publishers, New York, 1992). Среди прочего они обладают способностью препятствовать отложению пигментов, содержащих железо, и в случае наличия в организме депо железа вызывать его экскрецию, например, на модельных животных при использовании перегруженных железом крыс после холедохостомии (R.J. Bergeron и др., J. Med. Chem., 34, 2072-2078 (1991)) или перегруженных железом обезьян (R. J. Bergeron и др., Blood, 81, 2166-2173 (1993)), в дозах приблизительно 5 мкмоль/кг.
Настоящее изобретение относится к применению соединений формулы I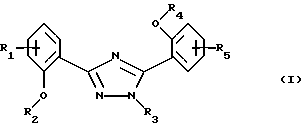 в которой R1 и R5 одновременно или независимо друг от друга обозначают водород, галоген, гидроксил, (низш. )алкил, галоид(низш. )алкил, (низш. )алкокси, галоид (низш.)алкокси, карбоксил, карбамоил, N-(низш. )алкилкарбамоил, N,N-ди(низш.)aлкилкapбaмoил или нитрил, R2 и R4 одновременно или независимо друг от друга обозначают водород, незамещенный или замещенный (низш.)алканоил или ароил либо радикал, который может быть удален в физиологической среде, R3 обозначает водород, (низш.)алкил, гидрокси(низш.)алкил, галоид(низш. )алкил, карбокси(низш. )алкил, (низш.)алкоксикарбонил-(низш.)алкил, R6R7N-С(O)-(низш.)алкил, незамещенный или замещенный арил или арил(низш.)алкил или незамещенный или замещенный гетероарил или гетероаралкил, R6 и R7 одновременно или независимо друг от друга обозначают водород, (низш. )алкил, гидрокси(низш. )алкил, алкокси(низш. )алкил, гидроксиалкокси(низш.)алкил, амино(низш.)алкил, N-(низш.)алкиламино-(низш.)алкил, N,N-ди(низш. )алкиламино-(низш.)алкил, N-(гидрокси(низш.)алкил)амино-(низш.)алкил, N, N-ди(гидрокси(низш.)алкил)амино-(низш.)алкил или вместе с атомом азота, к которому они присоединены, образуют азаалициклическое кольцо, и их солей для лечения заболеваний, которые вызывают появление избытка металла в организме человека или животного или которые обусловлены им, предпочтительно в форме фармацевтически приемлемых препаратов, в частности с использованием способа, предназначенного для терапевтического лечения организма человека, и к способу лечения такого типа. Галоген, например, обозначает хлор, бром или фтор, но также может представлять собой йод. Приставка “(низш.)” обозначает радикал, имеющий не более 7, в частности не более 4 атомов углерода. Алкил обозначает радикал с прямой или разветвленной цепью. (Низш.)алкил как таковой или в качестве составной части других групп, как, например, (низш.)алкоксигруппы, (низш.)алкиламина, (низш.)алканоила, (низш. )алкиламинокарбонила, может быть незамещен или замещен, например, галогеном, гидроксилом, (низш. )алкоксигруппой, трифторметилом, цикло(низш.)алкилом, азаалициклилом или фенилом, предпочтительно он является незамещенным или замещенным гидроксилом. (Низш. )алкил обозначает, например, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил, неопентил, н-гексил или н-гептил, предпочтительно метил, этил и н-пропил. Галоид (низш.)алкил обозначает (низш. )алкил, замещенный галогеном, предпочтительно хлором или фтором, в частности имеющий в качестве заместителей до трех атомов хлора или фтора. (Низш.)алкокси обозначает, например, н-пропокси, изопропокси, н-бутокси, изобутокси, втор-бутокси, трет-бутокси, н-амилокси, изоамилокси, предпочтительно метокси и этокси. Галоид(низш.)алкокси обозначает (низш. )алкоксигруппу, замещенную галогеном, предпочтительно хлором или фтором, в частности, имеющую в качестве заместителей до трех атомов хлора или фтора. Карбамоил обозначает радикал H2N-C(O)-, N-(низш.)алкилкарбамоил обозначает (низш.)алкил-НN-С(О)- и N,N-ди(низш.)алкилкарбамоил обозначает ди(низш. )алкил-N-С(O)-. (Низш.)алканоил обозначает НС(O)- и (низш.)алкил-С(О)- и обозначает, например, ацетил, пропаноил, бутаноил или пивалоил. (Низш.)алкоксикарбонил обозначает радикал (низш.)алкил-О-С(О)- и обозначает, например, н-пропоксикарбонил, изопропоксикарбонил, н-бутоксикарбонил, изобутоксикарбонил, втор-бутоксикарбонил, трет-бутоксикарбонил, н-амилоксикарбонил, изоамилоксикарбонил, предпочтительно метоксикарбонил и этоксикарбонил. Арил как таковой или в качестве составной части других групп обозначает, например, арил(низш.)алкил или ароил, например фенил или нафтил, который может быть замещенным или незамещенным. Арил предпочтительно обозначает фенил, который может быть незамещенным или замещеным одним или несколькими заместителями, в частности одним или двумя заместителями, например (низш. )алкилом, (низш.)алкоксигруппой, гидроксилом, нитро-, аминогруппой, галогеном, трифторметилом, карбоксилом, (низш.)алкоксикарбонилом, амино-, N-(низш. )алкиламино-, N, N-ди(низш. )алкиламиногруппой, аминокарбонилом, (низш. )алкиламинокарбонилом, ди(низш. )алкиламинокарбонилом, гетероциклоалкилом, гетероарилом или цианогруппой. Предпочтительно арил обозначает незамещенный фенил или нафтил или фенил, замещенный (низш.)алкилом, (низш. )алкоксигруппой, гидроксилом, галогеном, карбоксилом, (низш. )алкоксикарбонилом, N, N-ди(низш. )алкиламиногруппой или гетероциклоалкилкарбонилом. Ароил представляет собой радикал арил-С(О)- и обозначает, например, бензоил, толуоил, нафтоил или пара-метоксибензоил. Арил(низш. )алкил обозначает, например, бензил, пара-хлорбензил, орто-фторбензил, фенилэтил, пара-толилметил, пара-диметиламинобензил, пара-диэтиламинобензил, пара-цианбензил, пара-пирролидинобензил. Гетероциклоалкил обозначает циклоалкильный радикал, который содержит 3-8, в частности от 5 до не более 7 кольцевых атомов и в котором по крайней мере один из них представляяет собой гетероатом, предпочтительно кислород, азот и серу. Азаалициклил представляет собой насыщенный циклоалкильный радикал с 3-8, в частности с 5-7 кольцевыми атомами, по крайней мере один из которых представляет собой атом азота. Азаалициклил может также содержать дополнительные кольцевые гетероатомы, например кислород, азот или серу, и обозначает, например, пиперидинил, пиперазинил, морфолинил или пирролидинил. Азаалициклильные радикалы могут быть незамещены или замещены галогеном или (низш. )алкилом. Азаалициклильные радикалы, связанные через кольцевой атом азота и являющиеся предпочтительными, как известно, обозначают пиперидино, пиперазино, морфолино, пирролидино и т.д. Гетероарил как таковой или в качестве составной части других заместитителей, как, например, в гетероарил(низш.)алкиле, обозначает ароматический радикал, содержащий от 3 до не более 7, в частности от 5 до не более 7 кольцевых атомов, по крайней мере один из которых представляет собой гетероатом. В качестве примеров можно назвать пирролил, имидазолил, триазолил, тетразолил, оксазолил, тиазолил, фуранил, тиофенил, пиридил, пиразинил, оксазинил, тиазинил, пиранил или пиримидинил. Гетероарил может быть замещеным или незамещенным. Предпочтителен гетероарил, который является незамещенным или который замещен одним или несколькими, в частности одним или двумя заместителями, например (низш.)алкилом, галогеном, трифторметилом, карбоксилом или (низш.)алкоксикарбонилом. Гетероарил(низш.)алкил обозначает (низш.)алкильный радикал, в котором по крайней мере один из атомов водорода, предпочтительно С-концевой атом, замещен гетероарильной группой, если алкильная цепь содержит два или более атомов углерода. N-(низш. )алкиламино обозначает, например, н-пропиламино, н-бутиламино, изопропиламино, изобутиламино, гидроксиэтиламино, предпочтительно метиламино и этиламино. В N,N-ди(низш.)алкиламиногруппе алкильные заместители могут быть одинаковыми или различными. Так, N,N-ди(низш.)алкиламино обозначает, например, N, N-диметиламино, N,N-диэтиламино, N,N-метилэтиламино, N-метил-N-морфолиноэтиламино, N-метил-N-гидроксиэтиламино, N-метил-N-бензиламино. Соли соединений формулы I обозначают, в частности, фармацевтически приемлемые соли, прежде всего соли, образованные с основаниями, такие, как соли приемлемых щелочных металлов или щелочно-земельных металлов, например соли натрия, калия или магния, фармацевтически приемлемые соли переходных металлов, такие, как цинковые соли, или соли, образованные с органическими аминами, такими, как циклические амины, например моно-, ди- или три(низш. )алкиламины, такие, как гидрокси(низш.)алкиламины, например моно-, ди- или тригидрокси(низш. )алкиламины, гидрокси(низш. )алкил-(низш. )алкиламины или полигидрокси(низш. )алкиламины. Циклические амины представляют собой, например, морфолин, тиоморфолин, пиперидин или пирролидин. Приемлемые моно(низш. )алкиламины представляют собой, например, этил- и трет-бутиламин, ди(низш.)алкиламины представляют собой, например, диэтил- и диизопропиламин, а три(низш. )алкиламины представляют собой, например, триметил- и триэтиламин. Приемлемые гидрокси(низш.)алкиламины представляют собой, например, моно-, ди- и триэтаноламин, гидрокси(низш.)алкил-(низш.)алкиламины представляют собой, например, N,N-диметиламино- и N,N-диэтиламиноэтанол, пригодные полигидрокси(низш. )алкиламины представляют собой, например, глюкозамин. В других случаях также возможно образование кислотно-аддитивных солей, например, с сильными неорганическими кислотами, такими, как минеральные кислоты, например серная кислота, фосфорная кислота или галоидводородная кислота, с сильными органическими карбоновыми кислотами, такими, как (низш. )алканкарбоновые кислоты, например уксусная кислота, такими, как насыщенные или ненасыщенные дикарбоновые кислоты, например малоновая, малеиновая или фумаровая кислота, или такими, как гидроксикарбоновые кислоты, например винная или лимонная кислота, или с сульфоновыми кислотами, такими, как (низш. )алканбензолсульфоновая кислота или замещенные или незамещенные бензолсульфоновые кислоты, например метан- или пара-толуолсульфоновая кислота. Соединения формулы I, имеющие кислую группу, например карбоксил, и основную группу, например амино, также могут присутствовать в форме внутренних солей, т. е. в амфотерной форме, или часть молекул может присутствовать в виде внутренней соли, а другая часть в виде нормальной соли. В частности, изобретение относится к применению соединения формулы I для лечения заболеваний, которые вызываются избытком железа в организме человека или животного или которые обусловлены им, предпочтительно в форме фармацевтически приемлемых препаратов, в частности с использованием способа, предназначенного для терапевтического лечения организма человека, и к способу лечения этого типа. Кроме того, изобретение относится к новым препаратам, включающим по крайней мере одно соединение формулы I, в которой R1 и R5 одновременно или независимо друг от друга обозначают водород, галоген, гидроксил, (низш.)алкил, галоид (низш. )алкил, (низш.)алкокси, галоид(низш.)алкокси, карбоксил, карбамоил, N-(низш.)алкилкарбамоил, N,N-ди(низш.)алкилкарбамоил или нитрил, R2 и R4 одновременно или независимо друг от друга обозначают водород, незамещенный или замещенный (низш.)алканоил или ароил либо радикал, который может быть удален в физиологической среде, R3 обозначает водород, (низш. )алкил, гидрокси(низш. )алкил, галоид (низш.)алкил, карбокси(низш.)алкил, (низш. )алкоксикарбонил-(низш. )алкил, R6R7N-С(O)-(низш.)алкил, незамещенный или замещенный арил, арил(низш.)алкил, замещенный N-(низш.)алкиламино-, N, N-ди-(низш.)алкиламино- или пирролидиногруппой, или незамещенный или замещенный гетероарил или гетероаралкил, R6 и R7 одновременно или независимо друг от друга обозначают водород, (низш.)алкил, гидрокси(низш.)алкил, алкокси(низш. )алкил, гидроксиалкокси(низш. )алкил, амино(низш.)алкил, N-(низш. )алкиламино-(низш. )алкил, N, N-ди(низш. )aлкилaминo-(низш. )aлкил, N-(гидрокси(низш.)алкил)амино-(низш.)алкил, N,N-ди(гидрокси(низш. )алкил)амино-(низш. )алкил или вместе с атомом азота, к которому они присоединены, образуют азаалициклическое кольцо, или их соли и по крайней мере один фармацевтически приемлемый носитель, а также к способам получения указанных соединений. Эти фармацевтические препараты представляют собой препараты, предназначенные для энтерального, в частности орального, а также ректального введения, и препараты, предназначенные для парентерального введения теплокровным животным, прежде всего человеку, фармакологически активного ингредиента, входящего в состав препарата только в чистом виде или в сочетании с другими обычными фармацевтическими вспомогательными средствами. Фармацевтические препараты содержат, например, от приблизительно 0,001 до 100 мас.%, предпочтительно от приблизительно 0,1 до приблизительно 100 мас.%, действующего вещества. Фармацевтические препараты для энтерального или парентерального введения представляют собой, например, препараты в виде стандартных дозируемых форм, таких, как покрытые сахаром таблетки, таблетки, диспергируемые таблетки, “шипучие” таблетки, капсулы, суспендируемые порошки, суспензии или суппозитории или ампулы. Их получают хорошо известным методом, например с помощью таких общепринятых способов, как нанесение покрытия в резервуаре, смешение, грануляция или лиофилизация. Фармацевтические препараты для орального введения, таким образом, могут быть получены путем объединения действующего вещества с твердыми носителями, при необходимости грануляции полученной смеси и процессирования смеси или гранулята при необходимости или обязательно после добавления пригодных вспомогательных веществ с получением таблеток или сердцевин покрытых сахаром таблеток. Пригодными носителями являются, в частности, наполнители, такие, как сахара, например лактоза, сахароза, маннит или сорбит, препараты на основе целлюлозы и/или фосфатов кальция, например среднего фосфата кальция или вторичного кислого фосфата кальция, а также связующие, такие, как крахмальные пасты на основе, например, кукурузного, пшеничного, рисового или картофельного крахмала, желатин, трагакант, метилцеллюлоза и/или поливинилпирролидон, и при необходимости разрыхлители, такие, как вышеперечисленные крахмалы, а также карбоксиметиловый крахмал, поперечносшитый поливинилдпиролидон, агар или альгиновая кислота или ее соль, такая, как альгинат натрия. Вспомогательные вещества представляют собой прежде всего вещества, регулирующие текучесть, и замасливатели, например, салициловую кислоту, тальк, стеариновую кислоту или ее соли, такие, как стеарат магния или кальция, и/или полиэтиленгликоль. Ядра таблеток с сахарным покрытием покрывают пригодными, при необходимости энтеросолюбильными покрытиями, используя среди прочего концентрированные растворы сахара, которые при необходимости содержат гуммиарабик, тальк, поливинилпирролидон, полиэтиленгликоль и/или диоксид титана, покрывные растворы в пригодных органических растворителях или в смесях растворителей или для приготовления энтеросолюбильных покрытий растворы пригодных препаратов на основе целлюлозы, таких, как фталат ацетилцеллюлозы или фталат гидроксипропилметилцеллюлозы. В таблетки или в покрытия покрытых сахаром таблеток могут быть добавлены красители или пигменты, например, для идентификации или маркировки различных доз действующего вещества. Диспергируемые таблетки представляют собой таблетки, которые быстро разрушаются в относительно небольших количествах жидкости, например в воде, и которые при необходимости содержат корригенты или соединения, маскирующие вкус действующего вещества. Они преимущественно могут применяться для орального введения больших отдельных доз, в которых количество вводимого действующего вещества является столь большим, что его введение в виде таблетки, которую необходимо проглатывать целиком или без разжевывания, уже может оказаться неудобным для проглатывания, прежде всего детьми. Еще одними фармацевтическими препаратами для орального введения являются желатиновые капсулы с твердым, а также с мягким покрытием, закрытые капсулы из желатина и пластификатора, такого, как глицерин или сорбит. Желатиновые капсулы с твердым покрытием могут содержать действующее вещество в форме гранул, например, в смеси с наполнителями, такими, как лактоза, связующими, такими, как крахмалы и/или замасливатели, например тальк или стеарат магния, и при необходимости со стабилизаторами. В капсулах с мягким покрытием действующее вещество предпочтительно растворено или суспендировано в пригодных жидкостях, таких, как жирные масла, жидкий парафин или жидкие полиэтиленгликоли, также возможно добавление стабилизаторов. Кроме того, в качестве форм для орального введения пригодны суспендируемые порошки, например, которые называют “порошок во флаконе”, сокращенно PIB, или готовые для питья суспензии. Для изготовления этой формы действующее вещество смешивают, например, с фармацевтически приемлемыми поверхностно-активными веществами, например с лаурилсульфатом натрия или полисорбатом, с суспендирующими вспомогательными веществами, например с гидроксипропилцеллюлозой, гидроксипропилметилцеллюлозой или другими веществами, известными из прототипов и описанными ранее, например, в “Handbook of Pharmaceutical Ecipients”, с регуляторами значения рН, такими, как лимонная или винная кислота, или их соли, или принятый в фармакопее США буфер, и при необходимости с наполнителями, такими, как лактоза, и другими вспомогательными веществами, и разливают в пригодные емкости, преимущественно в пузырьки с однократной дозой или ампулы. Непосредственно перед употреблением добавляют определенное количество воды и путем встряхивания получают суспензию. В другом варианте вода может быть добавлена еще до розлива в пузырьки. Вводимые ректально фармацевтические препараты представляют собой, например, суппозитории, которые содержат действующее вещество в сочетании с основой суппозитория. Пригодной основой суппозитория являются, например, естественные или синтетические триглицериды, парафиновые углеводороды, полиэтиленгликоли или высшие алканолы. Также могут применяться желатиновые ректальные капсулы, которые содержат действующее вещество в сочетании с веществом основы. В качеств вещества основы можно использовать, например, жидкие триглицериды, полиэтиленгликоли или парафиновые углеводороды. Для парентерального введения прежде всего предпочтительны водные растворы действующего вещества в водорастворимой форме, например в форме водорастворимой соли. Кроме того, могут применяться суспензии действующего вещества, такие, как приемлемые масляные инъецируемые суспензии на основе пригодных липофильных растворителей или носителей, таких, как жирные масла, например кунжутное масло, или эфиры синтетических жирных кислот, например этилолеат или триглицериды, или водные инъецируемые суспензии, которые содержат вещества, повышающие вязкость, например натрийкарбоксиметилцеллюлозу, сорбит и/или декстран, и при необходимости также стабилизаторы. Доза действующего вещества может зависеть от различных факторов, таких, как активность и продолжительность действия действующего вещества, серьезность заболевания, подлежащего лечению, или его симптомов, способ введения, виды теплокровных животных, пол, возраст, вес и/или индивидуальное состояние теплокровного животного. Суточные дозы, применяемые в случае орального введения, составляют от приблизительно 10 до приблизительно 120 мг/кг, в частности от 20 до приблизительно 80 мг/кг, а для теплокровного животного с весом тела приблизительно 40 кг предпочтительно составляют от приблизительно 400 до приблизительно 4800 мг, в частности от приблизительно 800 до 3200 мг, и их целесообразно подразделять на 2-12 отдельных доз. Предпочтительно изобретение относится к новым препаратам, содержащим по крайней мере одно соединение формулы I, в которой R1 и R5 одновременно или независимо друг от друга обозначают водород, галоген, гидроксил, (низш. )алкил, галоид(низш.)алкил, (низш.)алкокси или галоид(низш.)алкокси, R2 и R4 одновременно или независимо друг от друга обозначают водород или радикал, который может быть удален в физиологической среде, R3 обозначает (низш. )алкил, гидрокси(низш.)алкил, карбокси(низш.)алкил, (низш. )алкоксикарбонил-(низш. )алкил, R6R7N-С(O)-(низш. )алкил, замещенный арил, арил(низш. )алкил, замещенный N-(низш.)алкиламино-, N,N-ди(низш.)алкиламино- или пирролидиногруппой, или незамещенный или замещенный гетероарил или гетероаралкил, R6 и R7 одновременно или независимо друг от друга обозначают водород, (низш.)алкил, гидрокси(низш.)алкил, алкокси(низш.)алкил, гидроксиалкокси(низш. )алкил, амино(низш.)алкил, N-(низш.)алкиламино-(низш.)алкил, N, N-ди(низш. )aлкилaминo-(низш. )aлкил, N-(гидрокси(низш.)алкил)амино-(низш. )алкил, N, N-ди(гидрокси(низш.)алкил)амино-(низш.)алкил или вместе с атомом азота, к которому они присоединены, образуют азаалициклическое кольцо, или его соли и по крайней мере один фармацевтически приемлемый носитель, и к способам их получения. Эти фармацевтические препараты представляют собой препараты, предназначенные для энтерального, в частности орального, а также ректального введения, и препараты, предназначенные для парентерального введения теплокровным животным, прежде всего человеку, фармакологически активного ингредиента, входящего в состав препарата либо в чистом виде, либо в сочетании с другими обычными фармацевтическими вспомогательными средствами. Фармацевтические препараты содержат, например, от приблизительно 0,001 до 100 мас.%, предпочтительно от приблизительно 0,1 до приблизительно 50 мас.%, действующего вещества. Настоящее изобретение также позволяет получить новые соединения общей формулы II 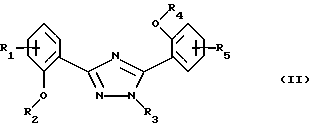 в которой R1 и R5 одновременно или независимо друг от друга обозначают водород, галоген, (низш.)алкил, галоид(низш.)алкил, (низш.)алкокси, галоид (низш. )алкокси, карбоксил, карбамоил, N-(низш.)алкилкарбамоил, N,N-ди(низш. )алкилкарбамоил или нитрил, R2 и R4 одновременно или независимо друг от друга обозначают водород, незамещенный или замещенный (низш.)алканоил или ароил либо радикал, который может быть удален в физиологической среде, R3 обозначает R6R7N-С(O)-(низш.)алкил, незамещенный или замещенный арил, арил(низш. )алкил, замещенный N-(низш.)алкиламино-, N,N-ди(низш.)алкиламино- или пирролидиногруппой, или незамещенный или замещенный гетероарил или гетероаралкил при условии, что R3 не обозначает фенил или фенил, замещенный галогеном, нитрогруппой, нитрилом, гидроксилом, (низш. )алкилом, галоид (низш. )алкилом, (низш.)алкоксигруппой или (низш.)алкоксикарбонилом, если R2 и R4 обозначают водород и R1 и R5 обозначают водород, галоген, (низш.)алкил, галоид(низш.)алкил, (низш.)алкокси или нитрил, R6 и R7 одновременно или независимо друг от друга обозначают водород, (низш. )алкил, гидрокси(низш. )алкил, алкокси(низш. )алкил, гидроксиалкокси(низш.)алкил, амино(низш.)алкил, N-(низш.)алкиламино-(низш.)алкил, N,N-ди(низш. )aлкилaминo-(низш.)aлкил, N-(гидрокси(низш.)алкил)амино-(низш.)алкил, N, N-ди(гидрокси(низш.)алкил)амино-(низш.)алкил или вместе с атомом азота, к которому они присоединены, образуют азаалициклическое кольцо, и их соли. Прежде всего изобретение относится к соединениям формулы II, в которой R1 и R5 одновременно или независимо друг от друга обозначают водород, галоген, (низш. )алкил, галоид(низш. )алкил, (низш.)алкокси или галоид(низш. )алкокси, R2 и R4 одновременно или независимо друг от друга обозначают водород или радикал, который может быть удален в физиологической среде, R3 обозначает R6R7N-С(O)-(низш.)алкил, замещенный арил, арил(низш.)алкил, замещенный N-(низш.)алкиламино-, N,N-ди(низш.)алкиламино- или пирролидиногруппой, или незамещенный или замещенный гетероаралкил, при условии, что R3 не обозначает фенил, замещенный галогеном, нитрогруппой, нитрилом, гидроксилом, (низш. )алкилом, галоид(низш. )алкилом, (низш. )алкоксигруппой или (низш. )алкоксикарбонилом, если R2 и R4 обозначают водород и R1 и R5 обозначают водород, галоген, (низш.)алкил, галоид(низш.)алкил или (низш.)алкокси, R6 и R7 одновременно или независимо друг от друга обозначают водород, (низш. )алкил, гидрокси(низш. )алкил, алкокси(низш. )алкил, гидроксиалкокси(низш. )алкил, амино(низш. )алкил, N-(низш.)алкиламино-(низш.)алкил, N,N-ди(низш. )алкиламино-(низш. )алкил, N-(гидрокси(низш. )алкил) амино-(низш.)алкил, N, N-ди(гидрокси(низш. )алкил)амино-(низш. )алкил или вместе с атомом азота, к которому они присоединены, образуют азаалициклическое кольцо, и к их солям. В частности, изобретение относится к соединениям формулы II, в которой R1 и R5 одновременно или независимо друг от друга обозначают водород, галоген или (низш. )алкил, R2 и R4 обозначают водород, R3 обозначает R6R7N-С(O)-(низш. )алкил, замещенный арил, замещенный карбоксилом или R8R9N-С(O)-, арил(низш. )алкил, замещенный N-(низш.)aлкилaминo-, N,N-ди(низш.)алкиламино- или пирролидиногруппой, или незамещенный или замещенный гетероаралкил, R6 и R7 одновременно или независимо друг от друга обозначают водород, (низш. )алкил, гидрокси(низш. )алкил, алкокси(низш. )алкил, гидроксиалкокси(низш. )алкил, амино(низш. )алкил, N-(низш.)алкиламино-(низш.)алкил, N,N-ди(низш. )aлкилaминo-(низш. )aлкил, N-(гидрокси(низш.)алкил)амино-(низш.)алкил, N,N-ди(гидрокси(низш. )алкил)амино-(низш. )алкил или вместе с атомом азота, к которому они присоединены, образуют азаалициклическое кольцо, R8 и R9 одновременно или независимо друг от друга обозначают водород или (низш.)алкил или вместе с атомом азота, к которому они присоединены, образуют азаалициклическое кольцо, и к их фармацевтически приемлемым солям. Изобретение преимущественно относится к определенным соединениям формулы II и к их солям, в частности к их фармацевтически приемлемым солям, которые описаны в примерах. Соединения могут быть получены хорошо известным способом, например а) взаимодействием соединения формулы III 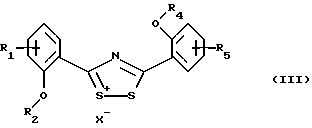 в которой R1, R2, R4 и R5 имеют указанные выше значения, а X– обозначает анион, с соединением формулы IV R3-NH-NH2 (IV) в которой R3 имеет указанные выше значения, или с его солью или б) взаимодействием соединения формулы V 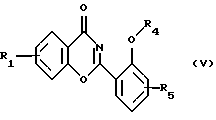 в которой R1, R4 и R5 имеют указанные выше значения, или его соли с соединением формулы IV, где R3 имеет указанные выше значения, или с его солью, или в) взаимодействием соединения формулы VI 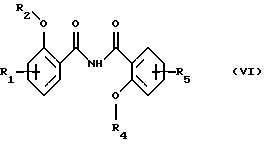 в которой R1, R2, R4 и R5 имеют указанные выше значения, с соединением формулы IV, в которой R3 имеет указанные выше значения, или с его солью, и последующее превращение этого соединения при необходимости в соединение формулы II путем удаления защитных групп и при необходимости превращение его в другое соединение формулы II, и/или при необходимости превращение полученной соли в свободное соединение или в другую соль, и/или при необходимости превращение в соль полученного свободного соединения формулы II, которое обладает способностью образовывать соли. Ниже способ описан более подробно, при этом символы R1-R5 имеют значения, приведенные для формул II, III, IV, V и VI, если не указано иное. Способ (а). Реакция согласно варианту (а) соответствует реакции перегруппировки кольца 1,2,4-дитиазолидинов в 1,2,4-триазолы с использованием гидразинов, которая является хорошо известной (Wagner G. и др., Pharmazie, 35, 48049 (1980)). X– может обозначать любой требуемый ион, предпочтительно анион галогена, в частности анион брома. Реакция может проходить с использованием растворителей или без них, предпочтительно ее проводят в полярном растворителе или в смеси растворителей, и в этом случае соединение IV может присутствовать само по себе или в другом варианте в виде сольвата, в частности в виде гидрата. Реакцию проводят при охлаждении, при температуре окружающей среды или при повышенной температуре вплоть до температуры дефлегмации реакционной смеси. Предпочтительно реакцию проводят при температуре окружающей среды или при повышенной температуре. Способ (б). Реакция согласно варианту (б) соответствует реакции бензоксазинонов с гидразинами, которая является хорошо известной (Wagner G. и др., Z. Сhеm. 21, 261 (1981), и Ryabukhin Y. и др., Khim. Geterotsiklicheskikh Soed. , 1983 (3), 406-410). Реакцию проводят в полярном растворителе или в смеси растворителей, предпочтительно в (низш.)алканоле, в частности в метаноле или этаноле, при необходимости с добавлением основания, такого, как третичный амин, в частности три(низш.)алкиламин, если соединение III и/или IV присутствует в виде соли, например в виде галогеноводорода. Реакцию проводят при охлаждении, при температуре окружающей среды или при повышенной температуре вплоть до температуры дефлегмации реакционной смеси. В особенно предпочтительном варианте осуществления реакцию проводят при температуре дефлегмации этанола. Исходные соединения формулы V могут быть получены, например, взаимодействием соответствующим образом замещенной салициловой кислоты с соответствующим образом замещенным салициламидом в присутствии тионилхлорида (Brunetti Н. и др., СН 388252, и Brunetti Н. и  С., Helv. Chim. Acta, 55, 1566 (1972)). Кроме того, исходные соединения формулы V могут быть получены нагреванием смеси соответствующим образом замещенного салицилоилхлорида и соответствующим образом замещенного салициламида.
Способ (в). Реакция согласно варианту (в) соответствует реакции диациламинов с гидразинами, которая является хорошо известной (Einhorn А. и др., Liebigs Ann. Chem., 343, 229 (1905), Brunner K., Ber. dtsch. chem. Ges. 47, 2671 (1914), и Mh. Chem., 36, 509 (1915)). Реакцию проводят в полярных, протонных растворителях с использованием в качестве катализатора слабой кислоты, предпочтительно в водном растворе уксусной кислоты при повышенной температуре.
Соединения формулы II также могут быть получены с помощью дополнительных способов, которые хорошо известны, например по методам, описанным у Temple С. в The Chemistry of Heterocyclic Compouds, том 37, John Wiley & Sons, New York, 1981.
Защитные группы, их введение и удаление описаны, например, у J.F.W. McOmie, “Ptotective Groups in Organic Chemistry”, Plenum Press, London, New York, 1973, и в “Methoden der organischen Chemie” [Методы органической химии], Houben-Weyl, 4-е изд., т. 1571, Georg-Thieme-Verlag, Stuttgart, 1974, а также у Theodora W. Greene, “Ptotective Groups in Organic Chemistry”, John Wiley & Sons, New York, 1981. Особенностью защитных групп является то, что их можно легко удалить, т. е. без проведения нежелательных побочных реакций, например сольволитически, редуктивно, фотолитически или в другом варианте в физиологических условиях.
Гидроксильные группы могут присутствовать, например, в форме легко расщепляемой группы сложного либо простого эфира, предпочтительно алканоильной или аралканоильной группы сложного эфира или циклогетероалкильной, аралкильной или алкоксиалкильной группы простого эфира, но также силилового эфира или силильной эфирной группы, в частности в виде ацетилового или бензоилового сложного эфира или в виде тетрагидропиранилового, бензилового или метоксиметилового простого эфира.
Исходные продукты для соединений формул III, IV, V и VI являются в некоторых случаях новыми и также подпадают под объем настоящего изобретения. При необходимости могут вводиться приемлемые защитные группы или может проводиться дополнительная дериватизация согласно известным методам.
Защитные группы, которые не являются составляющими требуемого конечного продукта формулы II, удаляют хорошо известным способом, например с помощью сольволиза, в частности гидролиза, алкоголиза или ацидолиза, или с помощью восстановления, необязательно постадийного или одновременного.
Соединения формулы II также могут быть превращены в другие соединения формулы II или формулы I.
Так, например, можно осуществлять гидролиз, например, соединения формулы II, в котором R3 обозначает радикал эфира арилкарбоновой кислоты, с получением соответствующей арилкарбоновой кислоты, получая соединение формулы II, в котором R3 обозначает остаток карбоновой кислоты. Реакцию проводят, например, в смеси полярных растворителей циклического простого эфира и алканола с добавлением гидроксида щелочного металла.
Когда исходные соединения формулы I или любые промежуточные продукты содержат взаимодействующие реакционноспособные группы, например карбоксильные, гидроксильные или аминогруппы, они могут быть временно защищены легко удаляемыми защитными группами.
Для окончательной обработки соединений формулы II, которые могут быть получены, или их солей и при необходимости промежуточных продуктов применяют общепринятые способы, например сольволиз избыточными количествами реагентов, перекристаллизацию, хроматографию, например распределительную, ион- или гель-хроматографию, распределение между неорганической и органической фазой растворителей, однократную или многократную экстракцию, в частности, после подкисления или увеличения основности, или увеличения содержания соли, сушку над гигроскопическими солями или при повышенной температуре путем пропускания при необходимости струи газа или обдува струей газа или расщепление, фильтрацию, промывку, растворение, упаривание (при необходимости в вакууме или в глубоком вакууме), дистилляцию, осаждение, центрифугирование, кристаллизацию, например, для соединений, полученных в форме масла или в форме маточного раствора, также возможно получение конечного продукта с помощью затравочного кристалла, лиофилизацию или сочетание двух или нескольких указанных стадий окончательной обработки, которые также могут применяться повторно, и т.д.
Исходные и промежуточные продукты могут применяться в чистой форме, например, после окончательной обработки, как указано в предыдущем параграфе, в частично очищенной форме или же непосредственно в виде неочищенных продуктов.
Соединения, включая их соли, также могут быть получены в форме гидратов или сольватов или их кристаллы могут включать, например, растворитель, применяемый для кристаллизации.
Растворители и разбавители представляют собой, например, воду, спирты, например (низш.)алканолы, такие, как метанол, этанол, пропанол, бутанол или монометиловый эфир этиленгликоля (метилцеллозольв), диолы, такие, как этиленгликоль, три- или полиолы, такие, как глицерин или диэтиленгликоль, или ариловые спирты, такие, как феноловый или бензиловый спирт, амиды кислот, например карбоксамиды, такие, как N,N-диметилформамид или N,N-диметилацетамид, амиды неорганических кислот, такие, как гексаметилфосфорамид, простые эфиры, например циклические простые эфиры, такие, как тетрагидрофуран или диоксан, или ациклические простые эфиры, такие, как диэтиловый эфир или диметиловый эфир этиленгликоля, галогенированные углеводороды, такие, как галоид(низш. )алканы, например метиленхлорид или хлороформ, кетоны, такие, как ацетон, нитрилы, такие, как ацетонитрил, сложные эфиры, такие, как этилацетат, бисалкансульфоксиды, такие, как диметилсульфоксид, азотсодержащие гетероциклы, такие, как N-метилпирролидон или пиридин, углеводороды, например (низш. )алканы, такие, как гексан или гептан, или ароматические углеводороды, такие, как бензол, толуол или ксилол(ы), или смеси этих растворителей, при этом в каждом случае для вышеуказанных реакций и стадий окончательной обработки могут быть выбраны пригодные растворители.
В способе по настоящему изобретению предпочтительно в каждом случае использовать такие исходные соединения или промежуточные продукты в свободной форме или в форме соли, которые позволяют получить соединения формулы II или их соли, указанные в начале описания в качестве особенно ценных. Новые исходные вещества и промежуточные продукты в каждом случае в свободной форме или в форме соли, предназначенные для получения соединений формулы II или их солей, и применение и способы их получения также подпадают под объем изобретения.
Изобретение также относится к таким вариантам осуществления способа, в которых соединение, получаемое на любой из соответствующих стадий процесса в качестве промежуточного продукта, применяют в качестве исходного продукта и проводят недостающие стадии процесса или в которых исходное вещество получают в реакционных условиях или применяют в форме производного, например в форме его соли.
Соли соединений формулы II могут быть получены хорошо известным способом. Так, кислотно-аддитивные соли, например, соединений формулы II, получают обработкой пригодной кислотой или пригодным ионообменным реагентом, а соли присоединения оснований получают обработкой пригодным основанием или пригодным ионообменным реагентом. Соли соединений формулы II могут быть превращены в свободные соединения формулы II общепринятым способом, кислотно-аддитивные соли могут быть превращены, например, обработкой пригодным щелочным агентом или пригодным ионообменным реагентом, а соли присоединения оснований могут быть превращены, например, обработкой пригодной кислотой или пригодным ионообменным реагентом.
Соли соединений формулы II могут быть превращены в другие соли соединений формулы II хорошо известным способом, при этом кислотно-аддитивные соли могут быть превращены, например, в другие кислотно-аддитивные соли, например, обработкой солью неорганической кислоты, такой, как гидрохлорид, пригодной солью металла, такой, как соль натрия, бария или серебра, солью другой кислоты, например ацетатом серебра, в пригодном растворителе, в котором образовавшаяся неорганическая соль, например хлорид серебра, нерастворима и поэтому осаждается из реакционной смеси.
В зависимости от процесса или реакционных условий соединения формулы II с солеобразующими свойствами могут быть получены в свободной форме или в форме солей.
В результате большого сходства между соединением формулы II в свободной форме и в форме его солей, что было указано ранее и отмечено ниже, свободное соединение формулы II или его соли следует рассматривать как аналогичные и при необходимости под этими понятиями целесообразно подразумевать также соответствующие соли или свободное соединение формулы II.
Соединения формулы II, включая соли соединений, которые могут образовывать соли, также могут быть получены в форме их гидратов и/или могут включать другие растворители, например при необходимости растворители, применяемые для кристаллизации соединений, находящихся в твердой форме.
Соединения формулы II и их соли в зависимости от выбранных исходных соединений и способов обработки могут присутствовать в форме одного из возможных изомеров, например в форме стереоизомеров или таутомеров, или их смесей. В этом контексте полученные чистые изомеры представляют собой, например, чистые энантиомеры, чистые диастереоизомеры или чистые таутомеры. Соответственно смеси изомеров, которые могут присутствовать, представляют собой, например, рацематы или диастереоизомерные смеси. Смеси изомеров соединений формулы II в свободной форме или в форме соли, полученные способом по изобретению или другими способами, могут быть разделены на компоненты общепринятым способом, например на основе физико-химических различий составляющих, известным методом фракционированной кристаллизации, дистилляции и/или хроматографии. Предпочтительно выделять наиболее активный изомер.
Ниже изобретение проиллюстрировано на примерах, которые, однако, не ограничивают его объем. (Выше и далее использованы следующие сокращения: если не указано иное, ч обозначает час(ы), tпл обозначает температуру плавления, ДМСО-d6 обозначает гексадейтеродиметилсульфоксид.) С., Helv. Chim. Acta, 55, 1566 (1972)). Кроме того, исходные соединения формулы V могут быть получены нагреванием смеси соответствующим образом замещенного салицилоилхлорида и соответствующим образом замещенного салициламида.
Способ (в). Реакция согласно варианту (в) соответствует реакции диациламинов с гидразинами, которая является хорошо известной (Einhorn А. и др., Liebigs Ann. Chem., 343, 229 (1905), Brunner K., Ber. dtsch. chem. Ges. 47, 2671 (1914), и Mh. Chem., 36, 509 (1915)). Реакцию проводят в полярных, протонных растворителях с использованием в качестве катализатора слабой кислоты, предпочтительно в водном растворе уксусной кислоты при повышенной температуре.
Соединения формулы II также могут быть получены с помощью дополнительных способов, которые хорошо известны, например по методам, описанным у Temple С. в The Chemistry of Heterocyclic Compouds, том 37, John Wiley & Sons, New York, 1981.
Защитные группы, их введение и удаление описаны, например, у J.F.W. McOmie, “Ptotective Groups in Organic Chemistry”, Plenum Press, London, New York, 1973, и в “Methoden der organischen Chemie” [Методы органической химии], Houben-Weyl, 4-е изд., т. 1571, Georg-Thieme-Verlag, Stuttgart, 1974, а также у Theodora W. Greene, “Ptotective Groups in Organic Chemistry”, John Wiley & Sons, New York, 1981. Особенностью защитных групп является то, что их можно легко удалить, т. е. без проведения нежелательных побочных реакций, например сольволитически, редуктивно, фотолитически или в другом варианте в физиологических условиях.
Гидроксильные группы могут присутствовать, например, в форме легко расщепляемой группы сложного либо простого эфира, предпочтительно алканоильной или аралканоильной группы сложного эфира или циклогетероалкильной, аралкильной или алкоксиалкильной группы простого эфира, но также силилового эфира или силильной эфирной группы, в частности в виде ацетилового или бензоилового сложного эфира или в виде тетрагидропиранилового, бензилового или метоксиметилового простого эфира.
Исходные продукты для соединений формул III, IV, V и VI являются в некоторых случаях новыми и также подпадают под объем настоящего изобретения. При необходимости могут вводиться приемлемые защитные группы или может проводиться дополнительная дериватизация согласно известным методам.
Защитные группы, которые не являются составляющими требуемого конечного продукта формулы II, удаляют хорошо известным способом, например с помощью сольволиза, в частности гидролиза, алкоголиза или ацидолиза, или с помощью восстановления, необязательно постадийного или одновременного.
Соединения формулы II также могут быть превращены в другие соединения формулы II или формулы I.
Так, например, можно осуществлять гидролиз, например, соединения формулы II, в котором R3 обозначает радикал эфира арилкарбоновой кислоты, с получением соответствующей арилкарбоновой кислоты, получая соединение формулы II, в котором R3 обозначает остаток карбоновой кислоты. Реакцию проводят, например, в смеси полярных растворителей циклического простого эфира и алканола с добавлением гидроксида щелочного металла.
Когда исходные соединения формулы I или любые промежуточные продукты содержат взаимодействующие реакционноспособные группы, например карбоксильные, гидроксильные или аминогруппы, они могут быть временно защищены легко удаляемыми защитными группами.
Для окончательной обработки соединений формулы II, которые могут быть получены, или их солей и при необходимости промежуточных продуктов применяют общепринятые способы, например сольволиз избыточными количествами реагентов, перекристаллизацию, хроматографию, например распределительную, ион- или гель-хроматографию, распределение между неорганической и органической фазой растворителей, однократную или многократную экстракцию, в частности, после подкисления или увеличения основности, или увеличения содержания соли, сушку над гигроскопическими солями или при повышенной температуре путем пропускания при необходимости струи газа или обдува струей газа или расщепление, фильтрацию, промывку, растворение, упаривание (при необходимости в вакууме или в глубоком вакууме), дистилляцию, осаждение, центрифугирование, кристаллизацию, например, для соединений, полученных в форме масла или в форме маточного раствора, также возможно получение конечного продукта с помощью затравочного кристалла, лиофилизацию или сочетание двух или нескольких указанных стадий окончательной обработки, которые также могут применяться повторно, и т.д.
Исходные и промежуточные продукты могут применяться в чистой форме, например, после окончательной обработки, как указано в предыдущем параграфе, в частично очищенной форме или же непосредственно в виде неочищенных продуктов.
Соединения, включая их соли, также могут быть получены в форме гидратов или сольватов или их кристаллы могут включать, например, растворитель, применяемый для кристаллизации.
Растворители и разбавители представляют собой, например, воду, спирты, например (низш.)алканолы, такие, как метанол, этанол, пропанол, бутанол или монометиловый эфир этиленгликоля (метилцеллозольв), диолы, такие, как этиленгликоль, три- или полиолы, такие, как глицерин или диэтиленгликоль, или ариловые спирты, такие, как феноловый или бензиловый спирт, амиды кислот, например карбоксамиды, такие, как N,N-диметилформамид или N,N-диметилацетамид, амиды неорганических кислот, такие, как гексаметилфосфорамид, простые эфиры, например циклические простые эфиры, такие, как тетрагидрофуран или диоксан, или ациклические простые эфиры, такие, как диэтиловый эфир или диметиловый эфир этиленгликоля, галогенированные углеводороды, такие, как галоид(низш. )алканы, например метиленхлорид или хлороформ, кетоны, такие, как ацетон, нитрилы, такие, как ацетонитрил, сложные эфиры, такие, как этилацетат, бисалкансульфоксиды, такие, как диметилсульфоксид, азотсодержащие гетероциклы, такие, как N-метилпирролидон или пиридин, углеводороды, например (низш. )алканы, такие, как гексан или гептан, или ароматические углеводороды, такие, как бензол, толуол или ксилол(ы), или смеси этих растворителей, при этом в каждом случае для вышеуказанных реакций и стадий окончательной обработки могут быть выбраны пригодные растворители.
В способе по настоящему изобретению предпочтительно в каждом случае использовать такие исходные соединения или промежуточные продукты в свободной форме или в форме соли, которые позволяют получить соединения формулы II или их соли, указанные в начале описания в качестве особенно ценных. Новые исходные вещества и промежуточные продукты в каждом случае в свободной форме или в форме соли, предназначенные для получения соединений формулы II или их солей, и применение и способы их получения также подпадают под объем изобретения.
Изобретение также относится к таким вариантам осуществления способа, в которых соединение, получаемое на любой из соответствующих стадий процесса в качестве промежуточного продукта, применяют в качестве исходного продукта и проводят недостающие стадии процесса или в которых исходное вещество получают в реакционных условиях или применяют в форме производного, например в форме его соли.
Соли соединений формулы II могут быть получены хорошо известным способом. Так, кислотно-аддитивные соли, например, соединений формулы II, получают обработкой пригодной кислотой или пригодным ионообменным реагентом, а соли присоединения оснований получают обработкой пригодным основанием или пригодным ионообменным реагентом. Соли соединений формулы II могут быть превращены в свободные соединения формулы II общепринятым способом, кислотно-аддитивные соли могут быть превращены, например, обработкой пригодным щелочным агентом или пригодным ионообменным реагентом, а соли присоединения оснований могут быть превращены, например, обработкой пригодной кислотой или пригодным ионообменным реагентом.
Соли соединений формулы II могут быть превращены в другие соли соединений формулы II хорошо известным способом, при этом кислотно-аддитивные соли могут быть превращены, например, в другие кислотно-аддитивные соли, например, обработкой солью неорганической кислоты, такой, как гидрохлорид, пригодной солью металла, такой, как соль натрия, бария или серебра, солью другой кислоты, например ацетатом серебра, в пригодном растворителе, в котором образовавшаяся неорганическая соль, например хлорид серебра, нерастворима и поэтому осаждается из реакционной смеси.
В зависимости от процесса или реакционных условий соединения формулы II с солеобразующими свойствами могут быть получены в свободной форме или в форме солей.
В результате большого сходства между соединением формулы II в свободной форме и в форме его солей, что было указано ранее и отмечено ниже, свободное соединение формулы II или его соли следует рассматривать как аналогичные и при необходимости под этими понятиями целесообразно подразумевать также соответствующие соли или свободное соединение формулы II.
Соединения формулы II, включая соли соединений, которые могут образовывать соли, также могут быть получены в форме их гидратов и/или могут включать другие растворители, например при необходимости растворители, применяемые для кристаллизации соединений, находящихся в твердой форме.
Соединения формулы II и их соли в зависимости от выбранных исходных соединений и способов обработки могут присутствовать в форме одного из возможных изомеров, например в форме стереоизомеров или таутомеров, или их смесей. В этом контексте полученные чистые изомеры представляют собой, например, чистые энантиомеры, чистые диастереоизомеры или чистые таутомеры. Соответственно смеси изомеров, которые могут присутствовать, представляют собой, например, рацематы или диастереоизомерные смеси. Смеси изомеров соединений формулы II в свободной форме или в форме соли, полученные способом по изобретению или другими способами, могут быть разделены на компоненты общепринятым способом, например на основе физико-химических различий составляющих, известным методом фракционированной кристаллизации, дистилляции и/или хроматографии. Предпочтительно выделять наиболее активный изомер.
Ниже изобретение проиллюстрировано на примерах, которые, однако, не ограничивают его объем. (Выше и далее использованы следующие сокращения: если не указано иное, ч обозначает час(ы), tпл обозначает температуру плавления, ДМСО-d6 обозначает гексадейтеродиметилсульфоксид.)Пример 1: 3,5-бис(2-гидроксифенил)-1-(2-гидроксиэтил)-1Н-[1,2,4]триазол. 12,0 г 2-(2-гидроксифенил)бенз[е] [1,3]оксазин-4-она суспендируют в 100 мл метанола и обрабатывают 7,6 г 2-гидроксиэтилгидразина. Смесь кипятят с обратным холодильником в течение 1 ч, охлаждают и добавляют 100 мл воды. Кристаллы, осаждающиеся в процессе этой стадии, отфильтровывают и промывают метанолом/водой. После сушки остается указанное в заголовке соединение в виде бесцветных кристаллов, tпл 145-147oС. Исходное соединение может быть получено, например, следующим образом. а) 2-(2-Гидроксифенил)бенз[е][1,3]оксазин-4-он 106,0 г салицилоилхлорида и 93,0 г салициламида смешивают и выдерживают при 170oС в течение 30 мин до полного прекращения выделения хлористого водорода. Смесь охлаждают и остаток кристаллизуют из этанола. После сушки получают 2-(2-гидроксифенил)бенз[е] [1,3]оксазин-4-он в виде желтоватых кристаллов, tпл 206-208oС. Пример 2: этил[3,5-бис(2-гидроксифенил)[1,2,4]триазол-1-ил]ацетат. 51,5 г 2-(2-гидроксифенил)бенз[е] [1,3]оксазин-4-она, 30,5 мл триэтиламина и 33,4 г гидрохлорида этилгидразинацетата кипятят с обратным холодильником в течение 0,5 ч в 450 мл этанола. При охлаждении осаждается продукт в кристаллической форме. Его отфильтровывают и промывают этанолом. После сушки остается этил[3,5-бис(2-гидроксифенил)[1,2,4]триазол-1-ил]ацетат в виде бесцветных кристаллов, tпл 172-174oС. Пример 3: 3,5-бис(2-гидроксифенил)-1-(2,2,2-трифторэтил)-1Н-[1,2,4]триазол. 1,38 г 2-(2-гидроксифенил)бенз[е] [1,3]оксазин-4-она кипятят с обратным холодильником в течение 0,5 ч с 1,6 мл 2,2,2-трифторэтилгидразина в 20 мл этанола. Смесь охлаждают, сливают на воду и экстрагируют этилацетатом. Объединенные органические фазы сушат над сульфатом натрия и концентрируют на роторном испарителе. Остаток кристаллизуют из смеси метанол/вода. После сушки остается 3,5-бис(2-гидроксифенил)-1-(2,2,2-трифторэтил)-1Н-[1,2,4]триазол в виде бесцветных кристаллов, tпл 154-156oC. Пример 4: 3,5-бис(2-гидроксифенил)-1-(4-нитрофенил)-1Н-[1,2,4]триазол. 1,0 г 2-(2-гидроксифенил)бенз[е] [1,3]оксазин-4-она, 0,5 мл триэтиламина и 0,7 г гидрохлорида нитрофенилгидразина кипятят с обратным холодильником в течение 1 ч в 10 мл этанола. При охлаждении осаждается продукт в кристаллической форме. Его отфильтровывают и промывают этанолом. После сушки остается 3,5-бис(2-гидроксифенил)-1-(4-нитрофенил)-1Н-[1,2,4] триазол в виде бесцветных кристаллов, tпл 180-183oС. Пример 5: 4-[3,5-бис(2-гидроксифенил)[1,2,4]триазол-1-ил]безойная кислота. 5,0 г 2-(2-гидроксифенил)бенз[е] [1,3]оксазин-4-она и 3,5 г 4-гидразинобензойной кислоты кипятят с обратным холодильником в течение 2 ч в 75 мл этанола. Кристаллы, осаждающиеся при охлаждении, промывают этанолом. После сушки остается 4-[3,5-бис(2-гидроксифенил)[1,2,4] триазол-1-ил] безойная кислота в виде бесцветных кристаллов, tпл 264-265oС. Пример 6: {4-[3,5-бис(2-гидроксифенил)[1,2,4]триазол-1-ил]фенил}морфолин-4-илметанон. 3,0 г 4-[3,5-бис(2-гидроксифенил)[1,2,4]-триазол-1-ил]безойной кислоты (пример 5) и 1,25 мл 1-хлор-N,N,2-триметил-1-пропен-1-амина [CAS-регистрационный 26189-59-3] перемешивают в течение 2 ч в 50 мл тетрагидрофурана. Добавляют 2,2 мл триэтиламина и 0,8 мл морфолина и смесь перемешивают при комнатной температуре в течение 18 ч. Ее сливают на воду и экстрагируют этилацетатом. Объединенные органические фазы сушат над сульфатом натрия и концентрируют на роторном испарителе. Остаток кристаллизуют из изопропанола. После сушки остается {4-[3,5-бис(2-гидроксифенил)[1,2,4]триазол-1-ил]фенил} морфолин-4-илметанон в виде бесцветных кристаллов, tпл 157-160oС. Пример 7: [4-[3,5-бис(2-гидроксифенил)[1,2,4]триазол-1-ил]фенил}(4-метилпиперазин-1-ил)метанон. 3 г 4- [3,5-бис(2-гидроксифенил)[1,2,4]-триазол-1-ил]безойной кислоты (пример 5) и 1,25 мл 1-хлор-N,N,2-триметил-1-пропен-1-амина перемешивают в течение 2 ч в 50 мл тетрагидрофурана. Добавляют 2,2 мл триэтиламина и 1 мл N-метилпиперазина и смесь перемешивают при комнатной температуре в течение 48 ч. Эту смесь сливают на воду и экстрагируют этилацетатом. Объединенные органические фазы сушат над сульфатом натрия и концентрируют на роторном испарителе. Остаток кристаллизуют из изопропанола. После сушки остается { 4-[3,5-бис(2-гидроксифенил)[1,2,4] триазол-1-ил] фенил}(4-метилпиперазин-1-ил)метанон в виде бесцветных кристаллов, tпл 226-229oС. Пример 8: 3,5-бис(2-гидроксифенил)-1-(4-метоксифенил)-1Н-[1,2,4]триазол. 5 г 2-(2-гидроксифенил)бенз[е] [1,3] оксазин-4-она, 3,7 г гидрохлорида 4-метоксифенилгидразина и 3 мл триэтиламина кипятят с обратным холодильником в течение 2 ч в 75 мл этанола. Смесь охлаждают, сливают на воду и экстрагируют этилацетатом. Объединенные органические фазы сушат над сульфатом натрия и концентрируют на роторном испарителе. Остаток кристаллизуют из изопропанола. После сушки остается 3,5-бис(2-гидроксифенил)-1-(4-метоксифенил)-1Н-[1,2,4]триазол в виде бесцветных кристаллов, tпл 179-181oС. Пример 9: 3,5-бис(2-гидроксифенил)-1-(2,4-дифторфенил)-1Н-[1,2,4]триазол. 5,0 г 2-(2-гидроксифенил)бенз[е] [1,3]оксазин-4-она, 3,9 г гидрохлорида 2,4-дифторфенилгидразина и 3 мл триэтиламина кипятят с обратным холодильником в течение 2 ч в 25 мл этанола. Смесь охлаждают, сливают на воду и экстрагируют этилацетатом. Объединенные органические фазы сушат над сульфатом натрия и концентрируют на роторном испарителе. Остаток кристаллизуют из этанола. После сушки остается 3,5-бис(2-гидроксифенил)-1-(2,4-дифторфенил)-1Н-[1,2,4]триазол в виде бесцветных кристаллов, tпл 144-146oС. Пример 10: 3,5-бис(2-гидроксифенил)-1-бензил-1Н-[1,2,4]триазол. 5,0 г 2-(2-гидроксифенил)бенз[е] [1,3]оксазин-4-она кипятят с обратным холодильником в течение 4 ч с 3,4 г гидрохлорида бензилгидразина и 5,9 мл триэтиламина в 50 мл этанола. Смесь охлаждают, сливают на воду и экстрагируют этилацетатом. Объединенные органические фазы сушат над сульфатом натрия и концентрируют на роторном испарителе. Остаток кристаллизуют из изопропанола. После сушки остается 3,5-бис(2-гидроксифенил)-1-бензил-1Н-[1,2,4]триазол в виде бесцветных кристаллов, tпл 166-168oС. Пример 11: 4-[3,5-бис(2-гидроксифенил[1,2,4]триазол-1-илметил]бензонитрил. 5,0 г 2-(2-гидроксифенил)бенз[е] [1,3]оксазин-4-она, 3,9 г гидрохлорида 4-цианбензилгидразина и 6 мл триэтиламина кипятят с обратным холодильником в течение 3 ч с 50 мл этанола. Смесь охлаждают, сливают на воду и экстрагируют этилацетатом. Объединенные органические фазы сушат над сульфатом натрия и концентрируют на роторном испарителе. Остаток кристаллизуют из смеси этанол/вода. После сушки остается 4-[3,5-бис(2-гидроксифенил[1,2,4]триазол-1-илметил]бензонитрил в виде бесцветных кристаллов, tпл 147-149oС. Пример 12: 3,5-бис(2-гидроксифенил)-1-(4-диэтиламинобензил)-1Н-[1,2,4] триазол. 5,0 г 2-(2-гидроксифенил)бенз[е] [1,3]оксазин-4-она кипятят с обратным холодильником в течение 18 ч с 5,4 г гидрохлорида 4-диэтиламинобензилгидразина и 6,7 мл триэтиламина в 50 мл этанола. Смесь сливают на воду и экстрагируют этилацетатом. Объединенные органические фазы сушат над сульфатом натрия и концентрируют на роторном испарителе. Остаток кристаллизуют из изопропанола. После сушки остается 3,5-бис(2-гидроксифенил)-1-(4-диэтиламинобензил)-1Н-[1,2,4]триазол в виде бесцветных кристаллов, tпл 125-127oС. Пример 13: 3,5-бис(2-гидроксифенил)-1-(4-пирролидин-1-илбензил)-1Н-[1,2,4]триазол. 5,0 г 2-(2-гидроксифенил)бенз[е] [1,3]оксазин-4-она кипятят с обратным холодильником в течение 18 ч с 5,2 г гидрохлорида (4-пирролидин-1-илбензил)гидразина и 6,7 мл триэтиламина в 50 мл этанола. Смесь сливают на воду и экстрагируют этилацетатом. Объединенные органические фазы сушат над сульфатом натрия и концентрируют на роторном испарителе. Остаток кристаллизуют из смеси этилацетат/гексан. После сушки остается 3,5-бис(2-гидроксифенил)-1-(4-пирролидин-1-илбензил)-1Н-[1,2,4] триазол в виде бесцветных кристаллов, tпл 153-155oС. Исходный продукт может быть получен, например, следующим образом. а) Гидрохлорид (4-пирролидин-1-илбензил)гидразина 7,0 г 4-пирролидинбензальдегида и 5,3 г трет-бутилкарбазата кипятят с обратным холодильником в течение 5 ч в 50 мл этанола. Смесь охлаждают, разбавляют этанолом до 250 мл, добавляют 1,0 г палладия на угле (10%) и смесь гидрируют до абсорбции 1 моля водорода на 1 моль исходного продукта. Катализатор отфильтровывают и фильтрат концентрируют досуха на роторном испарителе. Остаток растворяют в 90 мл смеси 4 М хлористый водород/диоксан и дают выстояться при комнатной температуре в течение 20 ч. После сушки вымораживанием получают гидрохлорид (4-пирролидин-1-илбензил)гидразина в виде твердого вещества желтоватого цвета. МС: 192 (М++Н). Пример 14: 3,5-бис(2-гидроксифенил)-1-(пиридин-4-илметил)-1Н-[1,2,4] триазол. 5,0 г 2-(2-гидроксифенил)бенз[е] [1,3]оксазин-4-она кипятят с обратным холодильником в течение 4 ч с 5,9 г гидрохлорида 4-гидразинметилпиридина [peг. номер CAS 89598-56-1] и 10 мл триэтиламина в 50 мл этанола. Смесь охлаждают, сливают на воду и экстрагируют этилацетатом. Объединенные органические фазы сушат над сульфатом натрия и концентрируют на роторном испарителе. Остаток кристаллизуют из изопропанола. После сушки остается 3,5-бис(2-гидроксифенил)-1-(пиридин-4-илметил)-1Н-[1,2,4] триазол в виде бесцветных кристаллов, tпл 197-199oС. Пример 15: 3,5-бис(2-гидроксифенил)-1-(пиридин-3-илметил)-1Н-[1,2,4] триазол. 5,0 г 2-(2-гидроксифенил)бенз[е] [1,3]оксазин-4-она кипятят с обратным холодильником в течение 5 ч с 6,2 г гидрохлорида 3-гидразинметилпиридина (57616-01-0) и 13 мл триэтиламина в 50 мл этанола. Смесь охлаждают, сливают на воду и экстрагируют этилацетатом. Объединенные органические фазы сушат над сульфатом натрия и концентрируют на роторном испарителе. Остаток кристаллизуют из изопропанола. После сушки остается 3,5-бис(2-гидроксифенил)-1-(пиридин-3-илметил)-1Н-[1,2,4] триазол в виде бесцветных кристаллов, tпл 174-176oC. Пример 16: 3,5-бис(5-хлор-2-гидроксифенил)-1-(2-гидроксиэтил)-1Н-[1,2,4] триазол. 15,0 г 6-хлор-2-(5-хлор-2-гидроксифенил)бенз[е] [1,3]оксазин-4-она кипятят с обратным холодильником в течение 2 ч с 4 мл гидроксиэтилгидразина в 50 мл этанола. Кристаллы, осаждающиеся при охлаждении, кристаллизуют из смеси этанол/вода. После сушки остается 3,5-бис(5-хлор-2-гидроксифенил)-1-(2-гидроксиэтил)-1Н-[1,2,4]триазол в виде бесцветных кристаллов, tпл 166-170oС. Исходный продукт может быть получен, например, следующим образом. а) 6-Хлор-2-(5-хлор-2-гидроксифенил)бенз[е][1,3]оксазин-4-он 40,0 г 5-хлорсалициламида и 54,0 г 5-хлорсалициловой кислоты после добавления 2,5 мл пиридина кипятят с обратным холодильником в 400 мл ксилола. В течение 2 ч добавляют 38 мл тионилхлорида, смесь перемешивают еще в течение 1 ч и затем растворитель отгоняют при пониженном давлении. Остаток суспендируют в 200 мл этанола, отфильтровывают и промывают этанолом. После сушки получают 6-хлор-2-(5-хлор-2-гидроксифенил)бенз[е] [1,3] оксазин-4-он в виде кристаллов желтоватого цвета, tпл 246-248oС. Пример 17: 4-[3,5-бис(5-хлор-2-гидроксифенил)[1,2,4]триазол-1-ил]бензойная кислота. 3,0 г 6-хлор-2-(5-хлор-2-гидроксифенил)бенз[е][1,3]оксазин-4-она и 1,7 г 4-гидразинбензойной кислоты кипятят с обратным холодильником в течение 2 ч в 40 мл этанола. Кристаллы, осаждающиеся при охлаждении, перекристаллизовывают из изопропанола. После сушки остается 4-[3,5-бис(5-хлор-2-гидроксифенил)[1,2,4] триазол-1-ил]бензойная кислота в виде бесцветных кристаллов, tпл 275-278oС. Пример 18: 3,5-бис(5-хлор-2-гидроксифенил)-1-(пиридин-2-илметил)-1Н-[1,2,4]триазол. 3,0 г 6-хлор-2-(5-хлор-2-гидроксифенил)бенз[е][1,3]оксазин-4-она кипятят с обратным холодильником в течение 5 ч с 1,7 г гидрохлорида 2-гидразинметилпиридина и 3 мл триэтиламина в 50 мл этанола. Кристаллы, осаждающиеся при охлаждении, кристаллизуют из этанола. После сушки остается 3,5-бис(5-хлор-2-гидроксифенил)-1-(пиридин-2-илметил)-1Н-[1,2,4] триазол в виде бесцветных кристаллов, tпл 227-229oС. Пример 19: 3,5-бис(5-хлор-2-гидроксифенил)-1-(4-диметиламинобензил)-1Н-[1,2,4]триазол. 3,0 г 6-хлор-2-(5-хлор-2-гидроксифенил)бенз[е][1,3]оксазин-4-она кипятят с обратным холодильником в течение 4 ч с 2,2 г гидрохлорида 4-диметиламиногидразина и 3 мл триэтиламина в 50 мл этанола. Кристаллы, осаждающиеся при охлаждении, промывают этанолом. После сушки остается 3,5-бис(5-хлор-2-гидроксифенил)-1-(4-диметиламинобензил)-1Н-[1,2,4] триазол в виде бесцветных кристаллов, tпл 205-207oС. Пример 20: 4-[3,5-бис(5-фтор-2-гидроксифенил)[1,2,4]триазол-1-ил]бензойная кислота. 2,5 г 6-фтор-2-(5-фтор-2-гидроксифенил)бенз[е][1,3]оксазин-4-она и 1,6 г 4-гидразинбензойной кислоты кипятят с обратным холодильником в течение 3 ч в 25 мл этанола. Смесь охлаждают, сливают на воду и экстрагируют этилацетатом. Объединенные органические фазы сушат над сульфатом натрия и концентрируют на роторном испарителе. Остаток кристаллизуют из смеси этилацетат/гексан. После сушки остается 4-[3,5-бис(5-фтор-2-гидроксифенил)[1,2,4] триазол-1-ил]бензойная кислота в виде бесцветных кристаллов, tпл 252-255oС. Исходный продукт может быть получен, например, следующим образом. а) 6-Фтор-2-(5-фтор-2-гидроксифенил)бенз[е][1,3]оксазин-4-он 4,3 г 5-фторсалициламида и 4,7 г 5-фторсалициловой кислоты после добавления 0,3 мл пиридина кипятят с обратным холодильником в 50 мл ксилола. В течение 2 ч добавляют 4,4 мл тионилхлорида, смесь перемешивают еще в течение 1 ч и затем растворитель отгоняют при пониженном давлении. Остаток суспендируют в 30 мл этанола, отфильтровывают и промывают этанолом. После сушки получают 6-фтор-2-(5-фтор-2-гидроксифенил)бенз[е] [1,3] оксазин-4-он в виде кристаллов желтоватого цвета, tпл 250-252oС. Пример 21: 4-[3,5-бис(2-гидрокси-5-метилфенил)[1,2,4]триазол-1-ил]бензойная кислота. 1,15 г 2-(6-гидрокси-мета-толил)-6-метил-4Н-[1,3] бензоксазин-4-она [CAS-регистрационный номер 24789-62-7] и 0,6 г 4-гидразинбензойной кислоты кипятят с обратным холодильником в течение 2 ч в 15 мл этанола. Кристаллы, осаждающиеся при охлаждении, кристаллизуют из изопропанола. После сушки остается 4-[3,5-бис(2-гидрокси-5-метилфенил)[1,2,4]триазол-1- ил]бензойная кислота в виде бесцветных кристаллов, tпл 268-269oС. Пример 22: [3,5-бис(2-гидроксифенил)[1,2,4] триазол-1-ил]уксусная кислота. 0,6 г этил[3,5-бис(2-гидроксифенил)[1,2,4]триазол-1-ил]ацетата (пример 2) растворяют в 20 мл метанола с 0,4 г гидроксида натрия и смесь перемешивают при комнатной температуре в течение 2 ч. Ее подкисляют с помощью 0,1 н. соляной кислоты и осадившиеся кристаллы отфильтровывают. После промывки водой и сушки остается [3,5-бис(2-гидроксифенил) [1,2,4]триазол-1-ил]уксусная кислота в виде бесцветных кристаллов, tпл 231-233oС. Пример 23: 2-[3,5-бис(2-гидроксифенил)[1,2,4]триазол-1-ил]-N-метилацетамид. 2,0 г этил[3,5-бис(2-гидроксифенил)[1,2,4] триазол-1-ил]ацетата (пример 2) растворяют в 15 мл этанола и обрабатывают 0,8 мл 8 М метиламина в этаноле. Смесь перемешивают при 60oС в течение 3 ч и затем охлаждают. Кристаллы, осаждающиеся при охлаждении, отфильтровывают и промывают этанолом. После сушки остается 2-[3,5-бис(2-гидроксифенил)[1,2,4]триазол-1-ил]-N-метилацетамид в виде бесцветных кристаллов, tпл 247-249oС. Пример 24: 2-[3,5-бис(2-гидроксифенил)[1,2,4] триазол-1-ил]-N-(2-гидроксиэтил)ацетамид. 2,0 г этил[3,5-бис(2-гидроксифенил)[1,2,4]триазол-1-ил]ацетата (пример 2) растворяют в 10 мл этаноламина и перемешивают при комнатной температуре в течение 2 ч. Смесь концентрируют досуха в вакууме и остаток кристаллизуют из изопропанола. После сушки остается 2-[3,5-бис(2-гидроксифенил)[1,2,4]триазол-1-ил] -N-(2-гидроксиэтил)ацетамид в виде бесцветных кристаллов, tпл 208-211oС. Пример 25: 2-[3,5-бис(2-гидроксифенил)[1,2,4]триазол-1-ил]-N-(2-метоксиэтил) ацетамид. 4,0 г этил[3,5-бис(2-гидроксифенил)[1,2,4]триазол-1-ил]ацетата (пример 2) растворяют в 30 мл 2-метоксиэтиламина и перемешивают при комнатной температуре в течение 2 ч. Смесь концентрируют досуха в вакууме и остаток кристаллизуют из изопропанола. После сушки остается 2-[3,5-бис(2-гидроксифенил)[1,2,4] триазол-1-ил] -N-(2-метоксиэтил)ацетамид в виде бесцветных кристаллов, tпл 184-186oС. Пример 26: 2-[3,5-бис(2-гидроксифенил)[1,2,4]триазол-1-ил]-N-(2,3-дигидроксипропил)ацетамид. 2,0 г этил[3,5-бис(2-гидроксифенил)[1,2,4]триазол-1-ил]ацетата (пример 2) и 2,4 г (  )-3-амино-1,2-пропандиола выдерживают в 10 мл этанола при 60oС в течение 2 ч. Кристаллы, осаждающиеся при охлаждении, отфильтровывают и промывают этанолом. После сушки остается 2-[3,5-бис(2-гидроксифенил)[1,2,4] триазол-1-ил]-N-(2,3-дигидроксипропил)ацетамид в виде бесцветных кристаллов, tпл 180-181oС.
Пример 27: 2-[3,5-бис(2-гидроксифенил)[1,2,4]триазол-1-ил]-N-(2-морфолин-4-илэтил)ацетамид.
5,0 г этил[3,5-бис(2-гидроксифенил)[1,2,4]триазол-1-ил]ацетата (пример 2) и 2,9 мл 4-(2-аминоэтил)морфолина кипятят с обратным холодильником в течение 18 ч в 50 мл тетрагидрофурана. Смесь охлаждают, сливают на воду и экстрагируют этилацетатом. Объединенные органические фазы сушат над сульфатом натрия и концентрируют на роторном испарителе. Остаток кристаллизуют из изопропанола. После сушки остается 2-[3,5-бис(2-гидроксифенил)[1,2,4]триазол-1-ил] -N-(2-морфолин-4-илэтил)ацетамид в виде бесцветных кристаллов, tпл 180-182oС.
Пример 28: 2-[3,5-бис(2-гидроксифенил)[1,2,4] триазол-1-ил]-N-(2-гидроксиэтил) -N-метилацетамид.
2,0 г этил[3,5-бис(2-гидроксифенил)[1,2,4]триазол-1-ил]ацетата (пример 2) и 8 мл N-метилэтаноламина выдерживают при 60oС в течение 1 ч. Смесь охлаждают, сливают на воду и экстрагируют этилацетатом. Объединенные органические фазы сушат над сульфатом натрия и концентрируют на роторном испарителе. Остаток кристаллизуют из изопропанола. После сушки остается 2-[3,5-бис(2-гидроксифенил)[1,2,4] триазол-1-ил]-N-(2-гидроксиэтил)-N-метилацетамид в виде бесцветных кристаллов, tпл 101-104oС.
Пример 29: 2-[3,5-бис(2-гидроксифенил)[1,2,4] триазол-1-ил]-N-[2-(2-гидроксиэтокси)этил]ацетамид.
2,0 г этил[3,5-бис(2-гидроксифенил)[1,2,4]триазол-1-ил]ацетата (пример 2) и 10 мл 2-(2-аминоэтокси)этанола перемешивают при комнатной температуре в течение 2 ч. Смесь сливают на воду и экстрагируют этилацетатом. Объединенные органические фазы сушат над сульфатом натрия и концентрируют на роторном испарителе. Остаток кристаллизуют из изопропанола. После сушки остается 2-[3,5-бис(2-гидроксифенил)[1,2,4] триазол-1-ил] -N-[2-(2-гидроксиэтокси)этил] ацетамид в виде бесцветных кристаллов, tпл 173-174oС.
Пример 30: N-{2-[бис(2-гидроксиэтил)амино]этил}-2-[3,5-бис(2-гидроксифенил)[1,2,4]триазол-1-ил]ацетамид.
2,0 г этил[3,5-бис(2-гидроксифенил)[1,2,4]триазол-1-ил]ацетата (пример 2) и 1,0 г N,N-бис(2-гидроксиэтил)этилендиамина кипятят с обратным холодильником в течение 24 ч в 8 мл этанола. Смесь охлаждают, сливают на воду и экстрагируют этилацетатом. Объединенные органические фазы сушат над сульфатом натрия и концентрируют на роторном испарителе. Остаток хроматографируют на силикагеле. После концентрирования и сушки остается N-{2-[бис(2-гидроксиэтил)амино] этил} -2-[3,5-бис(2-гидроксифенил)[1,2,4] триазол-1-ил]ацетамид в виде бесцветной пены. Значение Rf 0,35 (силикагель 60, метиленхлорид/метанол в соотношении 9/1).
1Н-ЯМР (ДМСО-d6): 2,5 (m, 6H), 3,1 (m, 2Н), 3,4 (m, 4Н), 4,2 (bs, 2Н), 4,9 (s, 2H), 7,0 (m, 4H), 7,4 (m, 3Н), 7,95 (d, 1H), 8,1 (t, 1H), 11,0 ч. /млн. (s, 1H).
Пример 31: 2-[3,5-бис(2-гидроксифенил)[1,2,4]триазол-1-ил]-N-(2-гидрокси-1-гидроксиметилэтил)ацетамид.
2,0 г этил[3,5-бис(2-гидроксифенил)[1,2,4]триазол-1-ил]ацетата (пример 2) и 2,0 г 2-амино-1,3-пропандиола кипятят с обратным холодильником в течение 3 ч в 8 мл этанола. Кристаллы, осаждающиеся при охлаждении, перекристаллизовывают из изопропанола. После сушки остается 2-[3,5-бис(2-гидроксифенил)[1,2,4]триазол-1-ил]-N-(2-гидрокси-1-гидроксиметилэтил)ацетамид в виде бесцветных кристаллов, tпл 212-214oС.
Пример 32: 2-[3,5-бис(2-гидроксифенил)[1,2,4]триазол-1-ил]-N-[2-(4-метилпиперазин-1-ил)этил]ацетамид.
3,0 г этил[3,5-бис(2-гидроксифенил)[1,2,4]триазол-1-ил]ацетата (пример 2) и 2,5 г 2-(4-метилпиперазин-1-ил)этиламина кипятят с обратным холодильником в течение 20 ч в 40 мл этанола. Смесь охлаждают, сливают на воду и экстрагируют этилацетатом. Объединенные органические фазы сушат над сульфатом натрия и концентрируют на роторном испарителе. Остаток хроматографируют на силикагеле. После концентрирования и сушки получают 2-[3,5-бис(2-гидроксифенил)[1,2,4] триазол-1-ил]-N-[2-(4-метилпиперазин-1-ил)этил]ацетамид в виде бесцветной пены. Значение Rf 0,17 (силикагель 60, метиленхлорид/метанол в соотношении 9/1).
1Н-ЯМР (ДМСО-d6): 2,1 (s, 3Н), 2,3 (m, 10Н), 3,15 (m, 2H), 4,9 (s, 2H), 7,0 (m, 4H), 7,4 (m, 3Н), 8,0 (m, 2H), 11,0 ч./млн. (s, 1H).
Пример 33: 2-[3,5-бис(2-гидроксифенил)[1,2,4]триазол-1-ил]-N,N-диметилацетамид.
2,0 г этил[3,5-бис(2-гидроксифенил)[1,2,4]триазол-1-ил]ацетата (пример 2) растворяют в 15 мл этанольного раствора диметиламина (33%) и раствор перемешивают при 60oС в течение 20 ч. Кристаллы, осаждающиеся при охлаждении, перекристаллизовывают из изопропанола. После сушки остается 2-[3,5-бис(2-гидроксифенил)[1,2,4]триазол-1-ил]-N,N-диметилацетамид в виде бесцветных кристаллов, tпл 196-197oС.
Пример 34: 2-[3,5-бис(2-гидроксифенил)[1,2,4]триазол-1-ил]морфолин-4-илэтанон.
2,0 г этил[3,5-бис(2-гидроксифенил)[1,2,4]триазол-1-ил]ацетата (пример 2) и 8 мл морфолина кипятят с обратным холодильником в течение 1 ч. Смесь охлаждают, сливают на воду и экстрагируют этилацетатом. Объединенные органические фазы сушат над сульфатом натрия и концентрируют на роторном испарителе. Остаток кристаллизуют из смеси этилацетат/гексан. После сушки остается 2-[3,5-бис(2-гидроксифенил)[1,2,4] триазол-1-ил] морфолин-4-илэтанон в виде бесцветных кристаллов, tпл 149-151oС.
Пример 35: 2-[3,5-бис(2-гидроксифенил)[1,2,4]триазол-1-ил]-1-(4-метилпиперазин-1-ил)этанон.
2,0 г этил[3,5-бис(2-гидроксифенил)[1,2,4]триазол-1-ил]ацетата (пример 2) и 8 мл 1-метилпиперазина перемешивают при 80oС в течение 3 ч. Смесь охлаждают, сливают на воду и экстрагируют этилацетатом. Объединенные органические фазы сушат над сульфатом натрия и концентрируют на роторном испарителе. Остаток кристаллизуют из этанола. После сушки остается 2-[3,5-бис(2-гидроксифенил)[1,2,4] триазол-1-ил] -1-(4-метилпиперазин-1-ил)этанон в виде бесцветных кристаллов, tпл 199-201oС.
Пример 36: N-бензил-2-[3,5-бис(2-гидроксифенил)[1,2,4]триазол-1-ил]-N-метилацетамид.
2,0 г этил[3,5-бис(2-гидроксифенил)[1,2,4]триазол-1-ил]ацетата (пример 2) и 9 мл N-метилбензиламина перемешивают при 80oС в течение 16 ч. Смесь охлаждают, сливают на воду и экстрагируют этилацетатом. Объединенные органические фазы сушат над сульфатом натрия и концентрируют на роторном испарителе. Остаток кристаллизуют из смеси этанол/вода. После сушки остается N-бензил-2-[3,5-бис(2-гидроксифенил)[1,2,4] триазол-1-ил] -N-метилацетамид в виде бесцветных кристаллов, tпл 179-180oС.
Пример 37: 2-[3,5-бис(2-гидроксифенил)[1,2,4]триазол-1-ил]-N,N-бис(2-гидроксиэтил)ацетамид.
2,0 г этил [3,5-бис(2-гидроксифенил)[1,2,4]триазол-1-ил]ацетата (пример 2) и 6,5 г диэтаноламина кипятят с обратным холодильником в течение 2 ч в 5 мл этанола. Смесь охлаждают, сливают на воду и экстрагируют этилацетатом. Объединенные органические фазы сушат над сульфатом натрия и концентрируют на роторном испарителе. Остаток хроматографируют на силикагеле. После концентрирования и сушки получают 2-[3,5-бис(2-гидроксифенил)[1,2,4]триазол-1-ил]-N, N-бис(2-гидроксиэтил)ацетамид в виде бесцветной пены. Значение Rf 0,28 (силикагель 60, метиленхлорид/метанол в соотношении 9/1).
1H-ЯМР (ДМСО-d6): 3,2-3,6 (m, 8H), 4,4-5,1 (b, 2H), 5,35 (s, 2H), 7,0 (m, 4Н), 7,4 (m, 3Н), 7,95 (d, 1H), 10,4 (bs, 1H), 11,05 ч./млн. (s, 1H).
Пример 38: 2-[3,5-бис(2-гидроксифенил)[1,2,4]триазол-1-ил]-N-(2-диметиламиноэтил)-N-метилацетамид.
2,0 г этил[3,5-бис(2-гидроксифенил)[1,2,4]триазол-1-ил]ацетата (пример 2) и 9 мл N,N,N’-триметилэтилендиамина перемешивают при 80oС в течение 5 ч. Смесь охлаждают, сливают на воду и экстрагируют этилацетатом. Объединенные органические фазы сушат над сульфатом натрия и концентрируют на роторном испарителе. Остаток кристаллизуют из изопропанола. После сушки остается 2-[3,5-бис(2-гидроксифенил)[1,2,4] триазол-1-ил] -N-(2-диметиламиноэтил)-N-метилацетамид в виде бесцветных кристаллов, tпл 172-174oС.
Пример 39: 2-[3,5-бис(5-хлор-2-гидроксифенил)[1,2,4]триазол-1-ил]-N-(2-морфолин-4-илэтил)ацетамид.
4,0 г этил[3,5-бис(5-хлор-2-гидроксифенил)[1,2,4] триазол-1-ил]ацетата (пример 40) и 2,6 г 4-(2-аминоэтил)морфолина кипятят с обратным холодильником в течение 18 ч в 50 мл этанола. Смесь охлаждают, сливают на воду и экстрагируют этилацетатом. Объединенные органические фазы сушат над сульфатом натрия и концентрируют на роторном испарителе. Остаток кристаллизуют из изопропанола. После сушки остается 2-[3,5-бис(5-хлор-2-гидроксифенил)[1,2,4] триазол-1-ил] -N-(2-морфолин-4-илэтил)ацетамид в виде бесцветных кристаллов, tпл 224-226oС.
Пример 40: Этил[3,5-бис(5-хлор-2-гидроксифенил)[1,2,4]триазол-1-ил]ацетат.
6,0 г хлор-2-(5-хлор-2-гидроксифенил)бенз[е][1,3]оксазин-4-она (пример 16), 3,0 мл триэтиламина и 3,3 г гидрохлорида этилгидразинацетата кипятят с обратным холодильником в течение 2 ч в 60 мл этанола. При охлаждении продукт осаждается в кристаллической форме. Его отфильтровывают и промывают этанолом. После сушки остается этил[3,5-бис(5-хлор-2-гидроксифенил)[1,2,4]триазол-1-ил]ацетат в виде бесцветных кристаллов, tпл 195-200oС.
Пример 41: 2-[3,5-бис(2-гидроксифенил)[1,2,4]триазол-1-ил]бензойная кислота.
4,8 г 2-(2-гидроксифенил)бенз[е] [1,3] оксазин-4-она и 3,5 г 2-гидразинбензойной кислоты кипятят с обратным холодильником в течение 4 ч в 10 мл этанола. Смесь охлаждают, сливают на воду и экстрагируют этилацетатом. Объединенные органические фазы сушат над сульфатом натрия и концентрируют на роторном испарителе. Остаток кристаллизуют из смеси этилацетат/гексан. После сушки получают 2-[3,5-бис(2-гидроксифенил)[1,2,4]триазол-1-ил]бензойную кислоту в виде бесцветных кристаллов, tпл 132-138oС.
Пример 42: Этил-4-[3,5-бис(2-гидроксифенил)[1,2,4]триазол-1-ил]бензоат.
10 г 4-[3,5-бис(2-гидроксифенил)[1,2,4] триазол-1-ил]бензойной кислоты (пример 5) и 0,5 мл серной кислоты кипятят с обратным холодильником в течение 20 ч в 200 мл этанола. Кристаллы, осаждающиеся при охлаждении, кристаллизуют из смеси изопропанол/вода. После сушки получают этил-4-[3,5-бис(2-гидроксифенил)[1,2,4] триазол-1-ил] бензойную кислоту в виде бесцветных кристаллов, tпл 148-149oС.
Примеры А-Г иллюстрируют фармацевтические композиции.
Ниже под понятием “действующее вещество” следует понимать соединение формулы I в свободной форме или в форме фармацевтически примлемой соли, в частности соединение типа, описанного в качестве продукта в вышеприведенных примерах.
Пример А. Таблетки, каждая из которых содержит 200 мг действующего вещества, могут быть получены следующим образом.
Состав (10000 таблеток), г: )-3-амино-1,2-пропандиола выдерживают в 10 мл этанола при 60oС в течение 2 ч. Кристаллы, осаждающиеся при охлаждении, отфильтровывают и промывают этанолом. После сушки остается 2-[3,5-бис(2-гидроксифенил)[1,2,4] триазол-1-ил]-N-(2,3-дигидроксипропил)ацетамид в виде бесцветных кристаллов, tпл 180-181oС.
Пример 27: 2-[3,5-бис(2-гидроксифенил)[1,2,4]триазол-1-ил]-N-(2-морфолин-4-илэтил)ацетамид.
5,0 г этил[3,5-бис(2-гидроксифенил)[1,2,4]триазол-1-ил]ацетата (пример 2) и 2,9 мл 4-(2-аминоэтил)морфолина кипятят с обратным холодильником в течение 18 ч в 50 мл тетрагидрофурана. Смесь охлаждают, сливают на воду и экстрагируют этилацетатом. Объединенные органические фазы сушат над сульфатом натрия и концентрируют на роторном испарителе. Остаток кристаллизуют из изопропанола. После сушки остается 2-[3,5-бис(2-гидроксифенил)[1,2,4]триазол-1-ил] -N-(2-морфолин-4-илэтил)ацетамид в виде бесцветных кристаллов, tпл 180-182oС.
Пример 28: 2-[3,5-бис(2-гидроксифенил)[1,2,4] триазол-1-ил]-N-(2-гидроксиэтил) -N-метилацетамид.
2,0 г этил[3,5-бис(2-гидроксифенил)[1,2,4]триазол-1-ил]ацетата (пример 2) и 8 мл N-метилэтаноламина выдерживают при 60oС в течение 1 ч. Смесь охлаждают, сливают на воду и экстрагируют этилацетатом. Объединенные органические фазы сушат над сульфатом натрия и концентрируют на роторном испарителе. Остаток кристаллизуют из изопропанола. После сушки остается 2-[3,5-бис(2-гидроксифенил)[1,2,4] триазол-1-ил]-N-(2-гидроксиэтил)-N-метилацетамид в виде бесцветных кристаллов, tпл 101-104oС.
Пример 29: 2-[3,5-бис(2-гидроксифенил)[1,2,4] триазол-1-ил]-N-[2-(2-гидроксиэтокси)этил]ацетамид.
2,0 г этил[3,5-бис(2-гидроксифенил)[1,2,4]триазол-1-ил]ацетата (пример 2) и 10 мл 2-(2-аминоэтокси)этанола перемешивают при комнатной температуре в течение 2 ч. Смесь сливают на воду и экстрагируют этилацетатом. Объединенные органические фазы сушат над сульфатом натрия и концентрируют на роторном испарителе. Остаток кристаллизуют из изопропанола. После сушки остается 2-[3,5-бис(2-гидроксифенил)[1,2,4] триазол-1-ил] -N-[2-(2-гидроксиэтокси)этил] ацетамид в виде бесцветных кристаллов, tпл 173-174oС.
Пример 30: N-{2-[бис(2-гидроксиэтил)амино]этил}-2-[3,5-бис(2-гидроксифенил)[1,2,4]триазол-1-ил]ацетамид.
2,0 г этил[3,5-бис(2-гидроксифенил)[1,2,4]триазол-1-ил]ацетата (пример 2) и 1,0 г N,N-бис(2-гидроксиэтил)этилендиамина кипятят с обратным холодильником в течение 24 ч в 8 мл этанола. Смесь охлаждают, сливают на воду и экстрагируют этилацетатом. Объединенные органические фазы сушат над сульфатом натрия и концентрируют на роторном испарителе. Остаток хроматографируют на силикагеле. После концентрирования и сушки остается N-{2-[бис(2-гидроксиэтил)амино] этил} -2-[3,5-бис(2-гидроксифенил)[1,2,4] триазол-1-ил]ацетамид в виде бесцветной пены. Значение Rf 0,35 (силикагель 60, метиленхлорид/метанол в соотношении 9/1).
1Н-ЯМР (ДМСО-d6): 2,5 (m, 6H), 3,1 (m, 2Н), 3,4 (m, 4Н), 4,2 (bs, 2Н), 4,9 (s, 2H), 7,0 (m, 4H), 7,4 (m, 3Н), 7,95 (d, 1H), 8,1 (t, 1H), 11,0 ч. /млн. (s, 1H).
Пример 31: 2-[3,5-бис(2-гидроксифенил)[1,2,4]триазол-1-ил]-N-(2-гидрокси-1-гидроксиметилэтил)ацетамид.
2,0 г этил[3,5-бис(2-гидроксифенил)[1,2,4]триазол-1-ил]ацетата (пример 2) и 2,0 г 2-амино-1,3-пропандиола кипятят с обратным холодильником в течение 3 ч в 8 мл этанола. Кристаллы, осаждающиеся при охлаждении, перекристаллизовывают из изопропанола. После сушки остается 2-[3,5-бис(2-гидроксифенил)[1,2,4]триазол-1-ил]-N-(2-гидрокси-1-гидроксиметилэтил)ацетамид в виде бесцветных кристаллов, tпл 212-214oС.
Пример 32: 2-[3,5-бис(2-гидроксифенил)[1,2,4]триазол-1-ил]-N-[2-(4-метилпиперазин-1-ил)этил]ацетамид.
3,0 г этил[3,5-бис(2-гидроксифенил)[1,2,4]триазол-1-ил]ацетата (пример 2) и 2,5 г 2-(4-метилпиперазин-1-ил)этиламина кипятят с обратным холодильником в течение 20 ч в 40 мл этанола. Смесь охлаждают, сливают на воду и экстрагируют этилацетатом. Объединенные органические фазы сушат над сульфатом натрия и концентрируют на роторном испарителе. Остаток хроматографируют на силикагеле. После концентрирования и сушки получают 2-[3,5-бис(2-гидроксифенил)[1,2,4] триазол-1-ил]-N-[2-(4-метилпиперазин-1-ил)этил]ацетамид в виде бесцветной пены. Значение Rf 0,17 (силикагель 60, метиленхлорид/метанол в соотношении 9/1).
1Н-ЯМР (ДМСО-d6): 2,1 (s, 3Н), 2,3 (m, 10Н), 3,15 (m, 2H), 4,9 (s, 2H), 7,0 (m, 4H), 7,4 (m, 3Н), 8,0 (m, 2H), 11,0 ч./млн. (s, 1H).
Пример 33: 2-[3,5-бис(2-гидроксифенил)[1,2,4]триазол-1-ил]-N,N-диметилацетамид.
2,0 г этил[3,5-бис(2-гидроксифенил)[1,2,4]триазол-1-ил]ацетата (пример 2) растворяют в 15 мл этанольного раствора диметиламина (33%) и раствор перемешивают при 60oС в течение 20 ч. Кристаллы, осаждающиеся при охлаждении, перекристаллизовывают из изопропанола. После сушки остается 2-[3,5-бис(2-гидроксифенил)[1,2,4]триазол-1-ил]-N,N-диметилацетамид в виде бесцветных кристаллов, tпл 196-197oС.
Пример 34: 2-[3,5-бис(2-гидроксифенил)[1,2,4]триазол-1-ил]морфолин-4-илэтанон.
2,0 г этил[3,5-бис(2-гидроксифенил)[1,2,4]триазол-1-ил]ацетата (пример 2) и 8 мл морфолина кипятят с обратным холодильником в течение 1 ч. Смесь охлаждают, сливают на воду и экстрагируют этилацетатом. Объединенные органические фазы сушат над сульфатом натрия и концентрируют на роторном испарителе. Остаток кристаллизуют из смеси этилацетат/гексан. После сушки остается 2-[3,5-бис(2-гидроксифенил)[1,2,4] триазол-1-ил] морфолин-4-илэтанон в виде бесцветных кристаллов, tпл 149-151oС.
Пример 35: 2-[3,5-бис(2-гидроксифенил)[1,2,4]триазол-1-ил]-1-(4-метилпиперазин-1-ил)этанон.
2,0 г этил[3,5-бис(2-гидроксифенил)[1,2,4]триазол-1-ил]ацетата (пример 2) и 8 мл 1-метилпиперазина перемешивают при 80oС в течение 3 ч. Смесь охлаждают, сливают на воду и экстрагируют этилацетатом. Объединенные органические фазы сушат над сульфатом натрия и концентрируют на роторном испарителе. Остаток кристаллизуют из этанола. После сушки остается 2-[3,5-бис(2-гидроксифенил)[1,2,4] триазол-1-ил] -1-(4-метилпиперазин-1-ил)этанон в виде бесцветных кристаллов, tпл 199-201oС.
Пример 36: N-бензил-2-[3,5-бис(2-гидроксифенил)[1,2,4]триазол-1-ил]-N-метилацетамид.
2,0 г этил[3,5-бис(2-гидроксифенил)[1,2,4]триазол-1-ил]ацетата (пример 2) и 9 мл N-метилбензиламина перемешивают при 80oС в течение 16 ч. Смесь охлаждают, сливают на воду и экстрагируют этилацетатом. Объединенные органические фазы сушат над сульфатом натрия и концентрируют на роторном испарителе. Остаток кристаллизуют из смеси этанол/вода. После сушки остается N-бензил-2-[3,5-бис(2-гидроксифенил)[1,2,4] триазол-1-ил] -N-метилацетамид в виде бесцветных кристаллов, tпл 179-180oС.
Пример 37: 2-[3,5-бис(2-гидроксифенил)[1,2,4]триазол-1-ил]-N,N-бис(2-гидроксиэтил)ацетамид.
2,0 г этил [3,5-бис(2-гидроксифенил)[1,2,4]триазол-1-ил]ацетата (пример 2) и 6,5 г диэтаноламина кипятят с обратным холодильником в течение 2 ч в 5 мл этанола. Смесь охлаждают, сливают на воду и экстрагируют этилацетатом. Объединенные органические фазы сушат над сульфатом натрия и концентрируют на роторном испарителе. Остаток хроматографируют на силикагеле. После концентрирования и сушки получают 2-[3,5-бис(2-гидроксифенил)[1,2,4]триазол-1-ил]-N, N-бис(2-гидроксиэтил)ацетамид в виде бесцветной пены. Значение Rf 0,28 (силикагель 60, метиленхлорид/метанол в соотношении 9/1).
1H-ЯМР (ДМСО-d6): 3,2-3,6 (m, 8H), 4,4-5,1 (b, 2H), 5,35 (s, 2H), 7,0 (m, 4Н), 7,4 (m, 3Н), 7,95 (d, 1H), 10,4 (bs, 1H), 11,05 ч./млн. (s, 1H).
Пример 38: 2-[3,5-бис(2-гидроксифенил)[1,2,4]триазол-1-ил]-N-(2-диметиламиноэтил)-N-метилацетамид.
2,0 г этил[3,5-бис(2-гидроксифенил)[1,2,4]триазол-1-ил]ацетата (пример 2) и 9 мл N,N,N’-триметилэтилендиамина перемешивают при 80oС в течение 5 ч. Смесь охлаждают, сливают на воду и экстрагируют этилацетатом. Объединенные органические фазы сушат над сульфатом натрия и концентрируют на роторном испарителе. Остаток кристаллизуют из изопропанола. После сушки остается 2-[3,5-бис(2-гидроксифенил)[1,2,4] триазол-1-ил] -N-(2-диметиламиноэтил)-N-метилацетамид в виде бесцветных кристаллов, tпл 172-174oС.
Пример 39: 2-[3,5-бис(5-хлор-2-гидроксифенил)[1,2,4]триазол-1-ил]-N-(2-морфолин-4-илэтил)ацетамид.
4,0 г этил[3,5-бис(5-хлор-2-гидроксифенил)[1,2,4] триазол-1-ил]ацетата (пример 40) и 2,6 г 4-(2-аминоэтил)морфолина кипятят с обратным холодильником в течение 18 ч в 50 мл этанола. Смесь охлаждают, сливают на воду и экстрагируют этилацетатом. Объединенные органические фазы сушат над сульфатом натрия и концентрируют на роторном испарителе. Остаток кристаллизуют из изопропанола. После сушки остается 2-[3,5-бис(5-хлор-2-гидроксифенил)[1,2,4] триазол-1-ил] -N-(2-морфолин-4-илэтил)ацетамид в виде бесцветных кристаллов, tпл 224-226oС.
Пример 40: Этил[3,5-бис(5-хлор-2-гидроксифенил)[1,2,4]триазол-1-ил]ацетат.
6,0 г хлор-2-(5-хлор-2-гидроксифенил)бенз[е][1,3]оксазин-4-она (пример 16), 3,0 мл триэтиламина и 3,3 г гидрохлорида этилгидразинацетата кипятят с обратным холодильником в течение 2 ч в 60 мл этанола. При охлаждении продукт осаждается в кристаллической форме. Его отфильтровывают и промывают этанолом. После сушки остается этил[3,5-бис(5-хлор-2-гидроксифенил)[1,2,4]триазол-1-ил]ацетат в виде бесцветных кристаллов, tпл 195-200oС.
Пример 41: 2-[3,5-бис(2-гидроксифенил)[1,2,4]триазол-1-ил]бензойная кислота.
4,8 г 2-(2-гидроксифенил)бенз[е] [1,3] оксазин-4-она и 3,5 г 2-гидразинбензойной кислоты кипятят с обратным холодильником в течение 4 ч в 10 мл этанола. Смесь охлаждают, сливают на воду и экстрагируют этилацетатом. Объединенные органические фазы сушат над сульфатом натрия и концентрируют на роторном испарителе. Остаток кристаллизуют из смеси этилацетат/гексан. После сушки получают 2-[3,5-бис(2-гидроксифенил)[1,2,4]триазол-1-ил]бензойную кислоту в виде бесцветных кристаллов, tпл 132-138oС.
Пример 42: Этил-4-[3,5-бис(2-гидроксифенил)[1,2,4]триазол-1-ил]бензоат.
10 г 4-[3,5-бис(2-гидроксифенил)[1,2,4] триазол-1-ил]бензойной кислоты (пример 5) и 0,5 мл серной кислоты кипятят с обратным холодильником в течение 20 ч в 200 мл этанола. Кристаллы, осаждающиеся при охлаждении, кристаллизуют из смеси изопропанол/вода. После сушки получают этил-4-[3,5-бис(2-гидроксифенил)[1,2,4] триазол-1-ил] бензойную кислоту в виде бесцветных кристаллов, tпл 148-149oС.
Примеры А-Г иллюстрируют фармацевтические композиции.
Ниже под понятием “действующее вещество” следует понимать соединение формулы I в свободной форме или в форме фармацевтически примлемой соли, в частности соединение типа, описанного в качестве продукта в вышеприведенных примерах.
Пример А. Таблетки, каждая из которых содержит 200 мг действующего вещества, могут быть получены следующим образом.
Состав (10000 таблеток), г:Действующее вещество – 2000,0 Лактоза – 500,0 Картофельный крахмал – 352,0 Желатин – 8,0 Тальк – 60,0 Стеарат магния – 10,0 Кремниевая кислота (высокодисперсная) – 20,0 Этанол – q.s. Действующее вещество смешивают с лактозой и 292 г картофельного крахмала, смесь увлажняют этанольным раствором желатина и гранулируют через сито. После сушки смешивают остаток картофельного крахмала, стеарат магния, тальк и кремниевую кислоту и смесь таблетируют, получая таблетки массой 295,0 г каждая, которые содержат по 200 мг действующего вещества и при необходимости могут быть снабжены насечками для разламывания с целью более точной регулировки дозы. Пример Б. Таблетки с покрытием, каждая из которых содержит 400 мг действующего вещества, могут быть получены следующим образом. Состав (1000 таблеток), г: Действующее вещество – 400,0 Лактоза – 100,0 Кукурузный крахмал – 70,0 Тальк – 8,5 Стеарат кальция – 1,5 Гидроксипропилметилцеллюлоза – 2,36 Шеллак – 0,64 Вода – q.s. Дихлорметан – q.s. Действующее вещество смешивают с лактозой и 40 г кукурузного крахмала, увлажняют и гранулируют с пастой, полученной из 15 г кукурузного крахмала и воды (при нагревании). Гранулы сушат и добавляют остаток кукурузного крахмала, тальк и стеарат кальция и смешивают с гранулами. Смесь таблетируют, получая таблетки, которые покрывают гидроксипропилметилцеллюлозой и шеллаком в дихлорметане. Конечная масса таблеток с покрытием составляет 583 г. Пример В. Желатиновые капсулы с твердым покрытием, содержащие по 500 мг действующего вещества, могут быть получены, например, следующим образом. Состав (1000 капсул), г: Действующее вещество – 500,0 Лактоза – 250,0 Микрокристаллическая целлюлоза – 30,0 Лаурилсульфат натрия – 2,0 Стеарат магния – 8,0 Лаурилсульфат натрия просеивают на лиофилизированное действующее вещество через сито с размером ячейки 0,2 мм. Оба компонента смешивают до однородного состояния. Затем сначала просеивают лактозу через сито с шириной размером 0,6 мм, а затем микрокристаллическую целлюлозу просеивают через сито с размером ячейки 0,9 мм. После этого ингредиенты вновь смешивают до однородного состояния в течение 10 мин. В завершение стеарат магния просеивают через сито с размером ячейки 0,8 мм. После 3-минутного дополнительного смешения 790 мг полученного состава заполняют желатиновые капсулы соответствующего размера с твердым покрытием. Пример Г. Суспендируемый порошок для орального введения, содержащий по 300 мг действующего вещества, может быть получен, например, следующим образом. Состав (на 1 введение): Действующее вещество, г – 300,0 Гидроксипропилцеллюлоза (Klucel HF), мг – 50 Винная кислота, мг – 100 Лаурилсульфат натрия, мг – 100 Лаурилсульфат натрия просеивают на лиофилизированное действующее вещество через сито с размером ячейки 0,2 мм. Оба компонента смешивают до однородного состояния. Затем микрокристаллическую целлюлозу просеивают через сито с размером ячейки 0,9 мм. После этого ингредиенты вновь смешивают до однородного состояния в течение 10 мин. В завершение винную кислоту просеивают через сито с размером ячейки 0,8 мм. После 3-минутного дополнительного смешения смесью заполняют емкость вместимостью по крайней мере 10 мл. Для употребления смесь разбавляют водой до 10 мл и интенсивно встряхивают. Формула изобретения 1. Фармацевтическая композиция для лечения заболеваний, которые вызывают появление избытка железа в организме человека или животного или которые обусловлены им, содержащая по крайней мере одно соединение формулы I 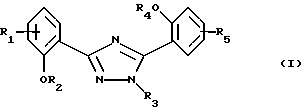 в которой R1 и R5 одновременно или независимо друг от друга обозначают водород, галоген, гидроксил, С1-С4алкил, галоС1-С4алкил, С1-С4алкокси, галоС1-С4алкокси, карбоксил, карбамоил, N-С1-С4алкилкарбамоил, N, N-ди-С1-С4алкилкарбамоил или нитрил; R2 и R4 одновременно или независимо друг от друга обозначают водород, С1-С4алканоил, бензоил, толуоил, нафтоил или пара-метоксибензоил, либо радикал, который может быть удален в физиологической среде; R3 обозначает водород, С1-С4алкил, гидроксиС1-С4алкил, галоС1-С4алкил, карбоксиС1-С4алкил, С1-С4алкоксикарбонилС1-С4алкил, R6R7N-С(O)-С1-С4алкил, фенил, незамещенный или замещенный карбоксилом, нитрогруппой, галогеном, С1-С4алкоксигруппой, С1-С4алкоксикарбонилом или группой R8R9N-С(O)-, фенилС1-С4алкил, пара-хлорбензил, орто-фторбензил, пара-толилметил, пара-диС1-С4алкиламинобензил, пара-цианобензил, пара-пирролидинобензил или пиридил, незамещенный или связанный через С1-С4алкиленовую группу; R6 и R7 одновременно или независимо друг от друга обозначают водород, С1-С4алкил, гидроксиС1-С4алкил, алкоксиС1-С4алкил, гидроксиалкоксиС1-С4алкил, аминоС1-С4алкил, N-С1-С4алкиламиноС1-С4алкил, N,N-диС1-С4алкиламиноС1-С4алкил, N-(гидроксиС1-С4алкил)аминоС1-С4алкил, N,N-ди(гидроксиС1-С4алкил)аминоС1-С4алкил, бензил, 4-морфолинилэтил, (4-метил-1-пиперазинил)этил или вместе с атомом азота, к которому они присоединены, образуют морфолино- или 4-метилпиперазино; R8 и R9 вместе с атомом азота, к которому они присоединены, образуют морфолино- или 4-метилпиперазино, или его фармацевтически приемлемую соль и по крайней мере один фармацевтически приемлемый носитель. 2. Производные 3,5-дифенил-1,2,4-триазолов формулы II 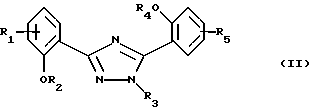 в которой R1 и R5 одновременно или независимо друг от друга обозначают водород, галоген или С1-С4алкил; R2 и R4 одновременно или независимо друг от друга обозначают водород или радикал, который может быть удален в физиологической среде; R3 обозначает R6R7N-С(O)-С1-С4алкил, фенил, замещенный карбоксилом или группой R8R9N-С(O)-, пара-диС1-С4алкиламинобензил, пара-пирролидинбензил или пиридил, незамещенный или связанный через С1-С4алкиленовую группу; R6 и R7 одновременно или независимо друг от друга обозначают водород, С1-С4алкил, гидроксиС1-С4алкил, алкоксиС1-С4алкил, гидроксиалкоксиС1-С4алкил, N,N-диС1-С4алкиламиноС1-С4алкил, N, N-ди(гидроксиС1-С4алкил)аминоС1-С4алкил, бензил, 4-морфолинилэтил, (4-метил-1-пиперазинил)этил или вместе с атомом азота, к которому они присоединены, образуют морфолино- или 4-метилпиперазино; R8 и R9 вместе с атомом азота, к которому они присоединены, образуют морфолино- или 4-метилпиперазино, и его соли. 3. Соединение формулы II по п.2, в которой R1 и R5 одновременно или независимо друг от друга обозначают водород, галоген или С1-С4алкил; R2 и R4 обозначают водород; R3 обозначает R6R7N-С(O)-С1-С4алкил, фенил, замещенный карбоксилом или R8R9N-С(O)-, пара-диметиламинобензил, пара-диэтиламинобензил, пара-пирролидинбензил или пиридил, незамещенный или связанный через С1-С4алкиленовую группу; R6 и R7 одновременно или независимо друг от друга обозначают водород, С1-С4алкил, гидроксиС1-С4алкил, алкоксиС1-С4алкил, гидроксиалкоксиС1-С4алкил, N,N-диС1-С4алкиламиноС1-С4алкил, N,N-ди(гидроксиС1-С4алкил)аминоС1-С4алкил, бензил, 4-морфолинилэтил, (4-метил-1-пиперазинил)этил или вместе с атомом азота, к которому они присоединены, образуют морфолино- или 4-метилпиперазино; R8 и R9 вместе с атомом азота, к которому они присоединены, образуют морфолино- или 4-метилпиперазино, и его фармацевтически приемлемые соли. 4. Соединение, выбранное из группы, включающей { 4-[3,5-бис(2-гидроксифенил)[1,2,4]триазол-1-ил]фенил}(4-метилпиперазин-1-ил)метанон, { 4-[3,5-бис(2-гидроксифенил)[1,2,4] триазол-1-ил]фенил}морфолин-4-илметанон, 2-[3,5-бис(2-гидроксифенил)[1,2,4] триазол-1-ил]-1-(4-метилпиперазин-1-ил)этанон, 2-[3,5-бис(2-гидроксифенил)[1,2,4]триазол-1-ил]-1-морфолин-4-илэтанон, 2-[3,5-бис(2-гидроксифенил)[1,2,4] триазол-1-ил] -N, N-биc(2-гидpoкcиэтил)ацетамид, 2-[3,5-бис(2-гидроксифенил)[1,2,4]триазол-1-ил]-N,N-димeтилaцeтaмид, 2-[3,5-бис(2-гидроксифенил)[1,2,4] триазол-1-ил] -N-(2,3-дигидроксипропил)ацетамид, 2-[3,5-бис(2-гидроксифенил)[1,2,4] триазол-1-ил] -N-(2-диметиламиноэтил)-N-метилацетамид, 2-[3,5-бис(2-гидроксифенил)[1,2,4] триазол-1-ил] -N-(2-гидрокси-1-гидроксиметилэтил)ацетамид, 2-[3,5-бис(2-гидроксифенил)[1,2,4] триазол-1-ил] -N-(2-гидроксиэтил)ацетамид, 2-[3,5-бис(2-гидроксифенил)[1,2,4] триазол-1-ил] -N-(2-гидроксиэтил)-N-метилацетамид, 2-[3,5-бис(2-гидроксифенил)[1,2,4]триазол-1-ил]-N-(2-метоксиэтил)ацетамид, 2-[3,5-бис(2-гидроксифенил)[1,2,4] триазол-1-ил] -N-(2-морфолин-4-илэтил)ацетамид, 2-[3,5-бис(2-гидроксифенил)[1,2,4] триазол-1-ил] -N-[2-(2-гидроксиэтокси)этил]ацетамид, 2-[3,5-бис(2-гидроксифенил)[1,2,4] триазол-1-ил] -N-[2-(4-метилпиперазин-1-ил)этил]ацетамид, 2-[3,5-бис(2-гидроксифенил)[1,2,4]триазол-1-ил]-N-метилацетамид, 2-[3,5-бис(5-хлор-2-гидроксифенил)[1,2,4] триазол-1-ил] -N-(2-мopфoлин-4-илэтил)ацетамид, 3,5-бис(2-гидроксифенил)-1-(4-диэтиламинобензил)-1Н-[1,2,4]триазол, 3,5-бис(2-гидроксифенил)-1-(4-пирролидин-1-илбензил)-1Н-[1,2,4]триазол, 3,5-бис(2-гидроксифенил)-1-(пиридин-3-илметил)-1Н-[1,2,4]триазол, 3,5-бис(2-гидроксифенил)-1-(пиридин-4-илметил)-1Н-[1,2,4]триазол, 3,5-бис(5-хлор-2-гидроксифенил)-1-(4-диметиламинобензил)-1Н-[1,2,4] триазол, 3,5-бис(5-хлор-2-гидроксифенил)-1-(пиридин-2-илметил)-1Н-[1,2,4]триазол, 4-[3,5-бис(2-гидрокси-5-метилфенил)[1,2,4] триазол-1-ил] бензойную кислоту, 2-[3,5-бис(2-гидроксифенил)[1,2,4]триазол-1-ил]бензойную кислоту, 4-[3,5-бис(5-хлор-2-гидроксифенил)[1,2,4]триазол-1-ил]бензойную кислоту, 4-[3,5-бис(5-фтор-2-гидроксифенил)[1,2,4]триазол-1-ил]бензойную кислоту, N-[2-[бис(2-гидроксиэтил)амино] этил}-2-[3,5-бис(2-гидроксифенил)[1,2,4] триазол-1-ил]ацетамид, N-бензил-2-[3,5-бис(2-гидроксифенил)[1,2,4] триазол-1-ил] -N-метилацетамид, 4-[3,5-бис(2-гидроксифенил)[1,2,4]триазол-1-ил]бензойную кислоту и их фармацевтически приемлемые соли. 5. Соединение формулы II по п.2, представляющее собой 4-[3,5-бис(2-гидроксифенил)[1,2,4] триазол-1-ил] бензойную кислоту или ее фармацевтически приемлемую соль. 6. Фармацевтическая композиция для лечения заболеваний, которые вызывают появление избытка железа в организме человека или животного или которые обусловлены им, содержащая по крайней мере одно соединение по любому из пп. 2-5 или его фармацевтически приемлемую соль и по крайней мере один фармацевтически приемлемый носитель. 7. Соединение по любому из пп.2-5, предназначенное для лечения заболеваний, которые вызывают появление избытка железа в организме человека или животного или которые обусловлены им. RH4A – Выдача дубликата патента Российской Федерации на изобретение
Дата выдачи дубликата: 10.05.2007
Наименование лица, которому выдан дубликат:
Извещение опубликовано: 27.06.2007 БИ: 18/2007
ND4A Продление срока действия патента Российской Федерации на изобретение
Дата, до которой продлен срок действия: 25.06.2022
(пп. 1 – 7)
Извещение опубликовано: 10.02.2008 БИ: 04/2008
|
||||||||||||||||||||||||||
