Патент на изобретение №2206556
|
||||||||||||||||||||||||||
(54) ВЫСОКОМЕЧЕННЫЙ ТРИТИЕМ ТАФЦИН И СПОСОБ ОПРЕДЕЛЕНИЯ ТАФЦИНА В БИОЛОГИЧЕСКИХ ОБРАЗЦАХ
(57) Реферат: Изобретение относится к новому соединению – меченному тритием тафцину и способу определения тафцина в биологических образцах, включающий введение предварительно в образец высокомеченного тритием тафцина, экстракцию, превращение в приготовленном экстракте тафцина и его меченого аналога в их бензоиновые или ортофталевые производные, которые затем анализируют методом ВЭЖХ с флуоресцентным детектором. Предлагаемый тафцин является высокомеченым соединением, а способ позволяет определять микроколичества тафцина. 2 с.п.ф-лы, 2 табл. Изобретение относится к области органической химии и может найти применение в аналитической химии, биоорганической химии, биохимии и прикладной медицине. При изучении физиологически активных соединений необходимы их меченые аналоги. Известен тафцин – тетрапептид Thr-Lys-Pro-Аrg формулы: 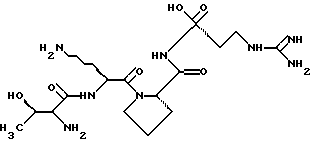 Однако меченный тритием аналог тафцина не описан.
Известен способ определения тафцина в биологических образцах, включающий их экстракцию, и анализ полученных экстрактов (Naim J.O., Desiderio D.M., Trimble J., Hinshaw J.R. Analytical Biochemistry. 1987,164, 221-226). Экстракты, полученные данным известным способом, хроматографируют с последующим масс-спектрометрическим анализом требуемой фракции – прототип. Однако данный известный способ требует наличия сложного оборудования, является трудоемким и дорогим. Кроме того, низкая чувствительность способа требует больших объемов исследуемых биологических образцов (10-20 мл).
Техническим результатом, достигаемым настоящим изобретением, является расширение ассортимента меченых аналогов физиологически активных соединений, разработка условий определения микроколичеств тафцина в малых объемах биологических образцов.
Указанный технический результат достигается получением высокомеченного тритием тафцина.
Достигается данный технический результат также тем, что в способе определения тафцина в биологических образцах, включающем их экстракцию и анализ полученных экстрактов, отличительной особенностью является то, что предварительно в образец вносят высокомеченный тритием тафцин, в приготовленном экстракте тафцин и его меченый аналог превращают в их бензоиновые или ортофталевые производные, которые затем анализируют методом ВЭЖХ с флуоресцентным детектированием.
Собственные исследования показали возможность определения методом ВЭЖХ значительно меньших количеств тафцина, если определять не природный тафцин, а его ортофталевое или бензоиновое производные. Природный тафцин можно детектировать только по оптическому поглощению, а его ортофталевое и бензоиновое производное – флуоресцентным детектированием, что повышает пороговую чувствительность определения в 10-1000 раз.
Найденный предел обнаружения тафцина в виде его ортофталевого производного для образцов плазмы крови и ликвора составляет 50-60 нг/мл. Предел обнаружения тафцина в виде производного с бензоином для образцов плазмы крови и ликвора – 3-4 нг на пробу.
Способ реализовали следующим образом.
Фракцию тафцина (содержащую биогенный тафцин и добавленный меченный тритием тафцин) собирали и определяли ее молярную радиоактивность MR (отношение радиоактивности фракции к количеству содержащегося в ней тафцина). Затем рассчитывали исходную концентрацию тафцина в биологической пробе методом изотопного разбавления.
Расчет концентраций тафцина методом изотопного разбавления.
Расчет концентраций тафцина по методу изотопного разбавления проводится по следующему уравнению:
Однако меченный тритием аналог тафцина не описан.
Известен способ определения тафцина в биологических образцах, включающий их экстракцию, и анализ полученных экстрактов (Naim J.O., Desiderio D.M., Trimble J., Hinshaw J.R. Analytical Biochemistry. 1987,164, 221-226). Экстракты, полученные данным известным способом, хроматографируют с последующим масс-спектрометрическим анализом требуемой фракции – прототип. Однако данный известный способ требует наличия сложного оборудования, является трудоемким и дорогим. Кроме того, низкая чувствительность способа требует больших объемов исследуемых биологических образцов (10-20 мл).
Техническим результатом, достигаемым настоящим изобретением, является расширение ассортимента меченых аналогов физиологически активных соединений, разработка условий определения микроколичеств тафцина в малых объемах биологических образцов.
Указанный технический результат достигается получением высокомеченного тритием тафцина.
Достигается данный технический результат также тем, что в способе определения тафцина в биологических образцах, включающем их экстракцию и анализ полученных экстрактов, отличительной особенностью является то, что предварительно в образец вносят высокомеченный тритием тафцин, в приготовленном экстракте тафцин и его меченый аналог превращают в их бензоиновые или ортофталевые производные, которые затем анализируют методом ВЭЖХ с флуоресцентным детектированием.
Собственные исследования показали возможность определения методом ВЭЖХ значительно меньших количеств тафцина, если определять не природный тафцин, а его ортофталевое или бензоиновое производные. Природный тафцин можно детектировать только по оптическому поглощению, а его ортофталевое и бензоиновое производное – флуоресцентным детектированием, что повышает пороговую чувствительность определения в 10-1000 раз.
Найденный предел обнаружения тафцина в виде его ортофталевого производного для образцов плазмы крови и ликвора составляет 50-60 нг/мл. Предел обнаружения тафцина в виде производного с бензоином для образцов плазмы крови и ликвора – 3-4 нг на пробу.
Способ реализовали следующим образом.
Фракцию тафцина (содержащую биогенный тафцин и добавленный меченный тритием тафцин) собирали и определяли ее молярную радиоактивность MR (отношение радиоактивности фракции к количеству содержащегося в ней тафцина). Затем рассчитывали исходную концентрацию тафцина в биологической пробе методом изотопного разбавления.
Расчет концентраций тафцина методом изотопного разбавления.
Расчет концентраций тафцина по методу изотопного разбавления проводится по следующему уравнению:C=M/V, где С – концентрация тафцина [нг/мл], V=1 мл – объем взятой пробы, М=А/MR0  MW MW (MR0/MR-1), (MR0/MR-1),или в данном случае C=5,762  (84/MR-1), (84/MR-1),где А=1 мкКи – активность тафцина, добавленного в пробу, MW=484 – молекулярный вес тафцина; MR – конечная молярная радиоактивность меченого аналога тафцина после добавления в пробу [Ки/ммоль]. MR0= 84 Ки/ммоль – исходная молярная радиоактивность меченого аналога тафцина до добавления в пробу. Сущность метода изотопного разбавления заключается в уменьшении молярной радиоактивности тафцина за счет его разбавления немеченым эндогенным тафцином из биологической пробы. И чем больше нативного тафцина будет в пробе, тем больше будет отношение MR0/MR. Метод изотопного разбавления позволяет учесть потери тафцина при подготовке пробы и при проведении реакции получения производных тафцина, которые определяют методом ВЭЖХ с флуоресцентным детектированием. Ниже приведены примеры, иллюстрирующие изобретение. Пример 1. Синтез меченного тритием тафцина В 15 мл колбу помещают и интенсивно перемешивают 50 мг 5% Pd/СаСО3 и раствор 10 мг тафцина и 10 мг RhCl3 в 2,0 мл воды. Приготовленную смесь замораживают жидким азотом и лиофилизируют. Сухой остаток переносят в реакционную ампулу, вакуумируют до давления 0,1 Па, напускают газообразный тритий до давления 400 гПа и ведут реакцию при 170oС 30 мин. Затем избыточный тритий удаляют вакуумированием. Содержимое ампулы растворяют в воде (3  5 мл), фильтруют, катализатор промывают водой (3 5 мл), фильтруют, катализатор промывают водой (3 1 мл), фильтраты объединяют. Лабильный тритий удаляют трехкратным упариванием реакционной смеси с водой (3 1 мл), фильтраты объединяют. Лабильный тритий удаляют трехкратным упариванием реакционной смеси с водой (3 3 мл). Остаток очищают методом высокоэффективной жидкостной хроматографии (ВЭЖХ), см. табл. 1. Выход меченого тафцина составляет 5-10%, молярная радиоактивность – 80-90 Ки/ммоль.
Пример 2. Приготовление ортофталевых производных тафцина 3 мл). Остаток очищают методом высокоэффективной жидкостной хроматографии (ВЭЖХ), см. табл. 1. Выход меченого тафцина составляет 5-10%, молярная радиоактивность – 80-90 Ки/ммоль.
Пример 2. Приготовление ортофталевых производных тафцинаПриготовление реактива. 24 мг ортофталевого альдегида растворяют в 1 мл метанола, добавляют 20 мкл меркаптоэтанола и 9 мл 0,4 М боратного буфера (рН 10,4). Раствор сохраняется в холодильнике под аргоном в течение недели. Приготовление производного. К анализируемой биологической пробе добавляют 25 мкл рабочего раствора приготовленного реактива, смесь встряхивают 20-30 с, добавляют 25 мкл метанола, еще встряхивают 20-30 с, 25 мкл реакционной смеси заводят в хроматограф. Пример 3. Приготовление бензоиновых производных тафцина. К высушенной биологической пробе добавляли реагенты в следующем порядке: 50 мкл (4 мМ бензоин в метилцеллозольве, 2 мг/мл), 50 мкл (0,2 М сульфит натрия, 25 мг/мл), 50 мкл (0,1 М меркаптоэтанол, 10 мкл/мл), 50 мкл (0,5 М NaOH). После тщательного перемешивания раствор выдерживали 30 мин при 45oС. Реакция прекращается добавлением 50 мкл (0,25 М трис-НСl+0,5 М HCl). 50 мкл раствора заводят на колонку для анализа. Анализ биологических проб проводят методом ВЭЖХ (см. таблицу 1). Для расчета концентрации тафцина используется метод изотопного разбавления. Детектирование элюента по флуоресценции проводили с помощью флуориметра FP820 фирмы Jasco, позволяющего независимо настраивать длины волн возбуждения и флуоресценции. Пример 4. Твердофазная экстракция тафцина из ликвора. В полипропиленовый наконечник объемом 1 мл помещают около 50 мкл сорбента LiChrosorb C18, 30-40 мкм. Полученный патрон последовательно промывают 300 мкл метанола, 3 раза по 300 мкл 0,25% раствора трифторуксусной кислоты (ТФК). В микропробирке смешивается 50 мкл ликвора, 50 мкл 0,25% р-ра ТФК, 1 мкКи [3Н]тафцина. Полученная смесь наносится на подготовленный микропатрон с сорбентом и продавливается аргоном. Патрон промывается 2 раза по 50 мкл 0,25% ТФК, затем содержащая тафцин фракция смывается 2 раза по 50 мкл 0,25% ТФК в метаноле и упаривается в вакуум-эксикаторе до объема около 30 мкл. Выход тафцина (по метке) 30-50%. Пример 5. Твердофазная экстракция тафцина из ликвора В этом варианте используется ион-парный реагент (пентансульфонат натрия) для увеличения константы сорбции тафцина на фазе C18. Показано, что присутствие пентансульфоната натрия не мешает реакции образования производных тафцина. В полипропиленовый наконечник объемом 1 мл помещают примерно 50 мкл сорбента LiChrosorb C18, 30-40 мкм. Полученный патрон последовательно промывают 300 мкл метанола, 3 раза по 300 мкл раствором 10 мМ раствора пентансульфоната натрия в 50 мМ растворе КН2РО4 (рН 5) (раствор А). В микропробирке смешивается 50 мкл ликвора, 100 мкл раствора (А) ТФК, 1 мкКи [3Н]тафцина. Полученная смесь наносится на подготовленный микропатрон с сорбентом и продавливается аргоном. Патрон промывается 2 раза по 100 мкл раствором (А), 2 раза по 100 мкл смесью 10% метанола в растворе (А), затем содержащая тафцин фракция смывается двумя порциями по 50 мкл смесью 30% метанола в (А) и лиофильно высушивается. Выход тафцина (по метке) 85-90%. Пример 6. Твердофазная экстракция тафцина из плазмы крови 200 мкл LiChrosorb C18, 30-40 мкм помещают в 1 мл патрончик. Патрончик последовательно промывают 500 мкл метанола и 2  500 мкл (А). К 500 мкл плазмы крови добавляют 1 мкКи [3Н]тафцина, 500 мкл раствора (А) и наносят на патрончик. Промывают патрончик 2 500 мкл (А). К 500 мкл плазмы крови добавляют 1 мкКи [3Н]тафцина, 500 мкл раствора (А) и наносят на патрончик. Промывают патрончик 2 500 мкл (А), затем 500 мкл смеси (метанол -(А), 10: 90), затем 250 мкл смеси метанол-вода-ТФУ (10:90:0,1). Тафцин смывают 500 мкл смеси метанол-вода-ТФУ (30:70:0,1). Раствор высушивают на лиофильной сушке для последующего получения производных. Эта методика позволяет выделять из биологической жидкости 85-90% содержащегося тафцина.
Пример 7. Анализ тафцина в биологических образцах.
Разработанная методика (примеры 2-6) использовалась для определения тафцина в биологических образцах ликвора и плазмы крови методом ВЭЖХ с использованием ортофтафталевых и бензоиновых производных (табл.2).
При этом было показано, что с использованием метода, предусматривающего анализ ортофталевых производных, возможно определение концентрации тафцина в спиномозговой жидкости и плазме крови только свыше 50 нг/мл (предел обнаружения метода), а с использованием метода анализа бензоиновых производных – от 3-4 нг/мл 500 мкл (А), затем 500 мкл смеси (метанол -(А), 10: 90), затем 250 мкл смеси метанол-вода-ТФУ (10:90:0,1). Тафцин смывают 500 мкл смеси метанол-вода-ТФУ (30:70:0,1). Раствор высушивают на лиофильной сушке для последующего получения производных. Эта методика позволяет выделять из биологической жидкости 85-90% содержащегося тафцина.
Пример 7. Анализ тафцина в биологических образцах.
Разработанная методика (примеры 2-6) использовалась для определения тафцина в биологических образцах ликвора и плазмы крови методом ВЭЖХ с использованием ортофтафталевых и бензоиновых производных (табл.2).
При этом было показано, что с использованием метода, предусматривающего анализ ортофталевых производных, возможно определение концентрации тафцина в спиномозговой жидкости и плазме крови только свыше 50 нг/мл (предел обнаружения метода), а с использованием метода анализа бензоиновых производных – от 3-4 нг/млТаким образом, получен высокомеченный тритием тафцин. Разработан новый способ анализа, позволяющий определять тафцин в биологических образцах в нанограммовых количествах. Формула изобретения
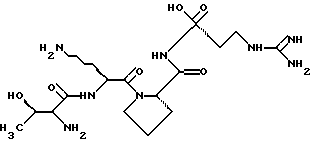 2. Способ определения тафцина в биологических образцах, включающий их экстракцию и анализ полученных экстрактов, отличающийся тем, что предварительно в образец вносят высокомеченный тритием тафцин, в приготовленном экстракте тафцин и его меченый аналог превращают в их бензоиновые или ортофталевые производные, которые затем анализируют методом ВЭЖХ с флуоресцентным детектированием. РИСУНКИ
|
||||||||||||||||||||||||||
