Патент на изобретение №2205185
|
||||||||||||||||||||||||||
(54)
(57) Реферат: Изобретение относится к  , ,  -дизамещенным производным 9-дезоксо-9а-N-этенил-9а-аза-9а-гомоэритромицина А общей формулы (I), где R1 и R2 взаимно одинаковы или различны и представляют нитрил, карбоксигруппу формулы COOR3, где R3 представляет С1-С4-алкильную группу, или кетогруппу формулы COR4, где R4 представляет C1-C4-алкильную группу, и их фармацевтически приемлемым аддитивным солям с неорганическими или органическими кислотами. Также предложен способ получения этих производных путем проведения реакции 9-дезоксо-9а-аза-9а-гомоэритромицина А формулы (II) с этоксиметиленпроизводными общей формулы (III) в толуоле, ксилоле или некоторых других апротонных растворителях при температуре 20-115oС и затем, если требуется, с неорганическими или органическими кислотами. Соединения по изобретению обладают антибактериальными свойствами. 2 с. и 12 з.п.ф-лы. -дизамещенным производным 9-дезоксо-9а-N-этенил-9а-аза-9а-гомоэритромицина А общей формулы (I), где R1 и R2 взаимно одинаковы или различны и представляют нитрил, карбоксигруппу формулы COOR3, где R3 представляет С1-С4-алкильную группу, или кетогруппу формулы COR4, где R4 представляет C1-C4-алкильную группу, и их фармацевтически приемлемым аддитивным солям с неорганическими или органическими кислотами. Также предложен способ получения этих производных путем проведения реакции 9-дезоксо-9а-аза-9а-гомоэритромицина А формулы (II) с этоксиметиленпроизводными общей формулы (III) в толуоле, ксилоле или некоторых других апротонных растворителях при температуре 20-115oС и затем, если требуется, с неорганическими или органическими кислотами. Соединения по изобретению обладают антибактериальными свойствами. 2 с. и 12 з.п.ф-лы.
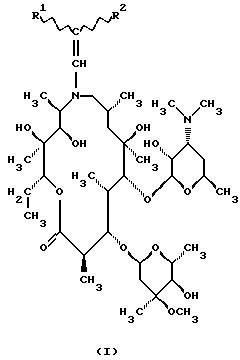  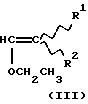
Изобретение относится к  , ,  -дизамещенным производным 9-дезоксо-9а-N-этенил-9а-аза-9а-гомоэритромицина А, новым полусинтетическим антибиотикам класса макролидов с антибактериальным действием, общей формулы (I): -дизамещенным производным 9-дезоксо-9а-N-этенил-9а-аза-9а-гомоэритромицина А, новым полусинтетическим антибиотикам класса макролидов с антибактериальным действием, общей формулы (I):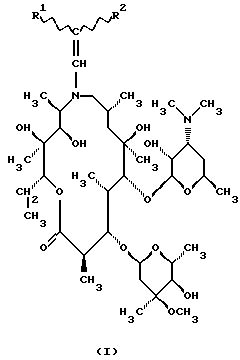 где R1 и R2 взаимно одинаковы или различны и представляют нитрил, карбоксигруппу формулы COOR3, где R3 представляет С1-С4-алкильную группу, или кетогруппу формулы COR4, где R4 представляет С1-С4-алкильную группу, их фармацевтически приемлемым аддитивным солям с неорганическими или органическими кислотами, способу их получения, способу получения фармацевтических композиций, а также использованию полученных фармацевтических композиций в лечении бактериальных инфекций. 9-Дезоксо-9а-аза-9а-гомоэритромицин А представляет собой макролидный антибиотик, структура которого характеризуется 15-членным кольцом макролактона, образованным вследствие расширения 14-членного кольца путем включения атома азота. В то же время он является также первым синтезированным соединением из новой группы полусинтетических макролидов, полученных путем введения атома азота в 14-членное макролактоновое кольцо азалида. Антимикробная активность упомянутого соединения против грамположительных микроорганизмов, несомненно, равноценна таковой у эритромицина А и оксима эритромицина, тогда как она выше, чем антимикробная активность эритромицина А против грамотрицательных организмов и клинических изолятов культур. Стабильность в кислотной среде, а также острая токсичность его более благоприятны, чем таковые у оксима эритромицина, но несколько хуже, чем у эритромицина А. Посредством восстановления простого 6,9-иминоэфира, образованного прямой перегруппировкой Бекмана 9(Е)-оксима, тозилхлоридом в смеси ацетона и воды в качестве промежуточного продукта получают 9-дезоксо-9а-аза-9а-гомоэритромицин A (S. Djokic, G. Kobrehel, G. Lazarevski, N. Lopotar, Z. Tamburasev, B. Kamenar, A. Nagl and I. Vickovic, J. Chem. Soc. Perkin Trans I, 1881, 1986). Чтобы получить соединения, имеющие улучшенные биологические свойства, было синтезировано большое число новых соединений на основе 9-дезоксо-9а-аза-9а-гомоэритромицина А в качестве исходного соединения. Ацилпроизводные были получены селективным ацилированием 9-дезоксо-9а-аза-9а-гомоэритромицина А ангидридами карбоновых кислот (S. Djokic, G. Kobrehel, G. Lazarevski, J. Antibiotics, 40, 1006, 1987). Селективность ацилирования достигалась путем изменения как температуры, так и времени реакции. Так, реакцией исходного соединения при комнатной температуре были получены моно-, ди- и триацетилпроизводные. Диацетилпроизводное было выделено реакцией исходного соединения с ангидридом уксусной кислоты в пиридине, тогда как моноацетилпроизводное было получено метанолизом исходного соединения, после чего удаляли 2′-О-ацетильную группу. Увеличивая время реакции, получают триацетилпроизводное. Тетраацетилпроизводное было образовано ацетилированием 9-дезоксо-9а-аза-9а-гомоэритромицина А при повышенной температуре (70oС). Кроме этих соединений были получены также 9a-N-формил-, 9а-N-пропионил-, 2′-О, 9а-N-дипропионил- и 2′-О,9а-N-диформил производные 9-дезоксо-9а-аза-9а-гомоэритромицина А. О-Метилциклические карбаматы были получены метилированием тризащищенного (3′, 9а)-ди-N-2′-О-трис(бензилхлорформиата) с последующим удалением защитных групп путем элиминирования защитных групп в 2′- и 3′-положениях (G. Kobrehel, G. Lazarevski, Z. Kelneric and S. Djokiс, J. Antibiot., 46, 1239, 1993), и конечный продукт был получен введением метильной группы в 3′-положение путем восстановительного метилирования соответствующих 3′-дез-N-метилпроизводных. 11,12-Циклический карбонат был получен путем переэтерификации 9-дезоксо-9а-аза-9а-гомоэритромицина А этиленкарбонатом в этиленацетате (S. Djokic, G. Kobrehel, G. Lazarevski, J. Antibiotics, 40, 1006, 1987). При испытании на ряде клинических культур полученный циклический карбонат обнаруживал лучшую активность in vitro против грамотрицательных бактерий, чем эритромицин А. Посредством восстановительного метилирования азота в 9а-положении 9-дезоксо-9а-аза-9а-гомоэритромицина А по способу Eschwriler-Clark получали 9-дезоксо-9а-метил-9а-аза-9а-гомоэритромицин А – азитромицин – (S. Djokic and G. Kobrehel, BE 892 357, 1982), который сам характеризуется стабильностью в кислотной среде, значительно усиленным проникновением в ткани и пролонгированным биологическим периодом полураспада и обладает также значительным антибактериальным действием против грамположительных и грамотрицательных бактерий и внутриклеточных патогенных микроорганизмов (G.M.Bright, A.A.Nagel, J. Bordner, К.А.Desai, J.N.Dibrino, J.Nowakowska, L.Vincent, R.M.Watrous, F.C. Sciavolino, A. R.English, J.A.Retsema, M.R.Anderson, L.A.Brenana, R.J.Borovov, C. R. Cimochowski, J.A.Faiella, A.E.Girard, D.Girard, C.Herbert, M.Manousos and R.Mason, J. Antibiot., 41, 1029, 1988). В соответствии с известным и установленным уровнем техники  , ,  -дизамещенные производные 9-дезоксо-9а-N-этенил-9а-аза-9а-гомоэритромицина А и их фармацевтически приемлемые аддитивные соли с неорганическими или органическими кислотами, способ их получения и способы получения фармацевтических препаратов и их использование до настоящего времени не были описаны.
Авторами установлено, что -дизамещенные производные 9-дезоксо-9а-N-этенил-9а-аза-9а-гомоэритромицина А и их фармацевтически приемлемые аддитивные соли с неорганическими или органическими кислотами, способ их получения и способы получения фармацевтических препаратов и их использование до настоящего времени не были описаны.
Авторами установлено, что  , ,  -дизамещенные производные 9-дезоксо-9а-N-этенил-9а-аза-9а-гомоэритромицина А и их фармацевтически приемлемые аддитивные соли с неорганическими или органическими кислотами, которые представляют цель и объект настоящего изобретения, можно получить реакцией 9-дезоксо-9а-аза-9а-гомоэритромицина А с замещенными этоксиметиленпроизводными и, если это удобно, реакцией полученных -дизамещенные производные 9-дезоксо-9а-N-этенил-9а-аза-9а-гомоэритромицина А и их фармацевтически приемлемые аддитивные соли с неорганическими или органическими кислотами, которые представляют цель и объект настоящего изобретения, можно получить реакцией 9-дезоксо-9а-аза-9а-гомоэритромицина А с замещенными этоксиметиленпроизводными и, если это удобно, реакцией полученных  , ,  -дизамещенных производных 9-дезоксо-9а-N-этенил-9а-аза-9в-гомоэритромицина А с неорганическими или органическими кислотами соответственно.
Техническое решение задачи -дизамещенных производных 9-дезоксо-9а-N-этенил-9а-аза-9в-гомоэритромицина А с неорганическими или органическими кислотами соответственно.
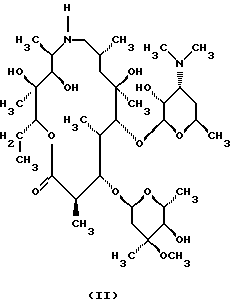
Техническое решение задачиБыло обнаружено, что  , ,  -дизамещенные производные 9-дезоксо-9а-N-этенил-9а-аза-9а-гомоэритромицина А общей формулы (I) -дизамещенные производные 9-дезоксо-9а-N-этенил-9а-аза-9а-гомоэритромицина А общей формулы (I)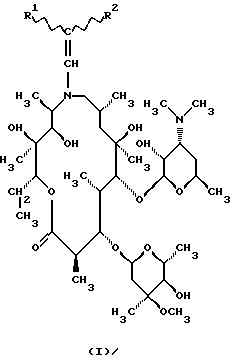 где R1 и R2 взаимно одинаковы или различны и представляют нитрил, карбоксигруппу формулы COOR3, где R3 представляет С1-С4-алкильную группу, или кетогруппу формулы COR4, где R4 представляет С1-С4-алкильную группу, и их фармацевтически приемлемые аддитивные соли с неорганическими или органическими кислотами, можно получить реакцией 9-дезоксо-9а-N-9а-аза-9а-гомоэритромицина А формулы (II) 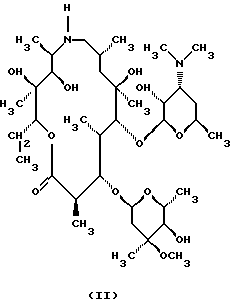 с этоксиметиленпроизводными общей формулы (III) 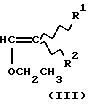 где R1 и R2 взаимно одинаковы или различны и представляют нитрил, карбоксигруппу формулы COOR3 где R3 представляет С1-С4-алкильную группу, или кетогруппу формулы COR4, где R4 представляет С1-С4-алкильную группу. Реакцию проводят в толуоле, ксилоле или некоторых других апротонных растворителях при температуре 20-115oС. Фармацевтически приемлемые аддитивные соли, представляющие собой еще один аспект настоящего изобретения, получают реакцией  , ,  -дизамещенных производных 9-дезоксо-9а-N-этенил-9а-аза-9а-гомоэритромицина А с эквимолярным количеством подходящей неорганической или органической кислоты, такой как хлористоводородная, иодистоводородная, серная, фосфорная, уксусная, трифторуксусная, пропионовая, бензойная, бензолсульфоновая, метансульфоновая, лаурилсульфоновая, стеариновая, пальмитиновая, янтарная, этилянтарная, лактобионовая, щавелевая, салициловая кислоты и тому подобное в растворителе, инертном в реакции. -дизамещенных производных 9-дезоксо-9а-N-этенил-9а-аза-9а-гомоэритромицина А с эквимолярным количеством подходящей неорганической или органической кислоты, такой как хлористоводородная, иодистоводородная, серная, фосфорная, уксусная, трифторуксусная, пропионовая, бензойная, бензолсульфоновая, метансульфоновая, лаурилсульфоновая, стеариновая, пальмитиновая, янтарная, этилянтарная, лактобионовая, щавелевая, салициловая кислоты и тому подобное в растворителе, инертном в реакции.
 , ,  -Дизамещенные производные 9-дезоксо-9а-N-этенил-9а-аза-9а-гомоэритромицина А формулы (I) и их фармацевтически приемлемые аддитивные соли с неорганическими или органическими кислотами обладают антибактериальной активностью in vitro, схожей с антибактериальной активностью эритромицина. Поэтому их можно использовать для той же цели и таким же способом, как эритромицин А. Их активность определяют способом разведения на микропланшетах по протоколу National Committee for Clinical Laboratory Standards (NCCLS, M7-A2). Полученные результаты, выраженные как минимальные ингибирующие концентрации (MIС в мкг/мл), указывают на их потенциальное использование в качестве средств для стерилизации, например комнат и медицинских инструментов, и в качестве промышленных антимикробных средств, например для защиты покрытий древесины и стен.
Способ получения -Дизамещенные производные 9-дезоксо-9а-N-этенил-9а-аза-9а-гомоэритромицина А формулы (I) и их фармацевтически приемлемые аддитивные соли с неорганическими или органическими кислотами обладают антибактериальной активностью in vitro, схожей с антибактериальной активностью эритромицина. Поэтому их можно использовать для той же цели и таким же способом, как эритромицин А. Их активность определяют способом разведения на микропланшетах по протоколу National Committee for Clinical Laboratory Standards (NCCLS, M7-A2). Полученные результаты, выраженные как минимальные ингибирующие концентрации (MIС в мкг/мл), указывают на их потенциальное использование в качестве средств для стерилизации, например комнат и медицинских инструментов, и в качестве промышленных антимикробных средств, например для защиты покрытий древесины и стен.
Способ получения  , ,  -дизамещенных производных 9-дезоксо-9а-N-этенил-9а-аза-9а-гомоэритромицина А иллюстрируется следующими примерами, которые никоим образом не ограничивают объем изобретения.
Пример 1 -дизамещенных производных 9-дезоксо-9а-N-этенил-9а-аза-9а-гомоэритромицина А иллюстрируется следующими примерами, которые никоим образом не ограничивают объем изобретения.
Пример 19-Дезоксо-9а-N-(  , ,  -дикарбэтоксиэтенил)-9а-аза-9а-гомоэритромицин А -дикарбэтоксиэтенил)-9а-аза-9а-гомоэритромицин АСмесь 9-дезоксо-9а-аза-9а-гомоэритромицина А (7,27 г, 0,01 моль) и диэтилэтоксиметиленмалоната (10,36, 0,04 моль) нагревали в течение 12 часов при температуре 100-105oС. Затем ее охлаждали и пропускали через колонку с силикагелем при элюировании сначала хлороформом и затем смесью растворителей СНС13: МеОН= 9:1. Был получен чистый 9-дезоксо-9а-N-(  , ,  -дикарбэтоксиэтенил)-9а-аза-9а-гомоэритромицин А. Спектроскопический анализ (спектры ЯМР, ИК и МС) показал ожидаемую и предполагаемую структуру соединения.
Пример 2 -дикарбэтоксиэтенил)-9а-аза-9а-гомоэритромицин А. Спектроскопический анализ (спектры ЯМР, ИК и МС) показал ожидаемую и предполагаемую структуру соединения.
Пример 29-Дезоксо-9а-N-(  -циано- -циано- -карбэтоксиэтенил)-9а-аза-9а-гомоэритромицин А -карбэтоксиэтенил)-9а-аза-9а-гомоэритромицин АРаствор 9-дезоксо-9а-аза-9а-гомоэритромицина А (7,27 г, 0,01 моль) и этилэтоксиметиленцианоацетата (2,0 г, 0,018 моль) в толуоле (50,0 мл) перемешивали в течение 18 часов при температуре 110-115oС. После охлаждения реакционной смеси до комнатной температуры отделялся смолистый осадок. Раствор толуола декантировали и смолистый осадок сначала растворяли в ацетоне (15,0 мл), после чего раствор выпаривали досуха. Получали сырой продукт (3,27 г), из которого путем хроматографии на колонке с силикагелем в системе растворителей СНС13: МеОН= 9: 1 получали 9-дезоксо-9a-N-(  -циано- -циано- -карбэтоксиэтенил)-9а-аза-9а-гомоэритромицин А. Анализ спектроскопическим способом (спектры ЯМР, ИК и МС) показал ожидаемую и предполагаемую структуру соединения.
Пример 3 -карбэтоксиэтенил)-9а-аза-9а-гомоэритромицин А. Анализ спектроскопическим способом (спектры ЯМР, ИК и МС) показал ожидаемую и предполагаемую структуру соединения.
Пример 39-Дезоксо-9а-N-(  , ,  -дицианоэтенил)-9а-аза-9а-гомоэритромицин А -дицианоэтенил)-9а-аза-9а-гомоэритромицин АРаствор 9-дезоксо-9а-аза-9а-гомоэритромицина А (7,27 г, 0,01 моль) и (этоксиметилен)малонового динитрила (1,6 г, 0,01 моль) в толуоле (30,0 мл) перемешивали в течение около 8 часов при температуре около 70oС. После охлаждения реакционной смеси до комнатной температуры отделялся смолистый осадок. Раствор толуола декантировали и смолистый осадок сначала растворяли в ацетоне (15,0 мл), после чего раствор выпаривали досуха. Получали сырой продукт (3,31 г), из которого путем хроматографии на колонке с силикагелем в системе растворителей СНС13:МеОН=9:1 получали 9-дезоксо-9a-N-(  , ,  -дицианоэтенил)-9а-аза-9а-гомоэритромицин А. Спектроскопический анализ (спектры ЯМР, ИК и МС) показал ожидаемую и предполагаемую структуру соединения.
Пример 4 -дицианоэтенил)-9а-аза-9а-гомоэритромицин А. Спектроскопический анализ (спектры ЯМР, ИК и МС) показал ожидаемую и предполагаемую структуру соединения.
Пример 49-Дезоксо-9а-N-(  -ацетил- -ацетил- -карбэтоксиэтенил)-9а-аза-9а-гомоэритромицин А -карбэтоксиэтенил)-9а-аза-9а-гомоэритромицин АРаствор 9-дезоксо-9а-аза-9а-гомоэритромицина А (7,27 г, 0,01 моль) и этил-  -(этоксиметилен)ацетоацетата (2,0 мл, 0,011 моль) в толуоле (30,0 мл) перемешивали около 6 часов при температуре 110-115oС. После охлаждения реакционной смеси до комнатной температуры отделялся смолистый осадок. Раствор толуола выпаривали при пониженном давлении (2,13 -(этоксиметилен)ацетоацетата (2,0 мл, 0,011 моль) в толуоле (30,0 мл) перемешивали около 6 часов при температуре 110-115oС. После охлаждения реакционной смеси до комнатной температуры отделялся смолистый осадок. Раствор толуола выпаривали при пониженном давлении (2,13 103 Па). Получали сырой продукт (4,84 г), из которого путем хроматографии на колонке с силикагелем в системе растворителей СНС13:МеОН=9:1 получали 9-дезоксо-9а-N-( 103 Па). Получали сырой продукт (4,84 г), из которого путем хроматографии на колонке с силикагелем в системе растворителей СНС13:МеОН=9:1 получали 9-дезоксо-9а-N-( -ацетил- -ацетил- -карбэтоксиэтенил)-9а-аза-9а-гомоэритромицин А. Спектроскопический анализ (спектры ЯМР, ИК и МС) показал ожидаемую и предполагаемую структуру соединения.
Антибактериальная активность in vitro 9-деоксо-9а-N-( -карбэтоксиэтенил)-9а-аза-9а-гомоэритромицин А. Спектроскопический анализ (спектры ЯМР, ИК и МС) показал ожидаемую и предполагаемую структуру соединения.
Антибактериальная активность in vitro 9-деоксо-9а-N-( , ,  -дикарбэтоксиэтенил)-9а-аза-9а-гомоэритромицина А -дикарбэтоксиэтенил)-9а-аза-9а-гомоэритромицина АМикроорганизм – MIC (мкг/мл) Micrococcus flavus ATCC 10240 – 4,0 Streptococcus faecalis ATCC 8043 – 0,5 Streptococcus “A” J 21 – 1,0 Streptococcus “B” J 21 – 1,0 Streptococcus pygenes F 20 – 1,0 Bacillus subtilis ATCC 6633 – 2,0 Bacillus subtilis NCTC 8236 – 1,0 Bacillus pulmis NCTC 8241 – 1,0 Bacillus, cereus ATCC 11778 – 2,0 Pseudomonas aeruginosa NCTC 10490 – 128,0 Escherichia coli ATCC 10536 – 4,0 Escherichia coli (Lac.+) F 6131 – 16,0 Escherichia coli (Lac.-) F 6130 – 16,0 Salmonella Panama F 6117 – 128,0й Формула изобретения
 , ,  -Дизамещенные производные 9-дезоксо-9а-N-этенил-9а-аза-9а-гомоэритромицина А общей формулы (I) -Дизамещенные производные 9-дезоксо-9а-N-этенил-9а-аза-9а-гомоэритромицина А общей формулы (I)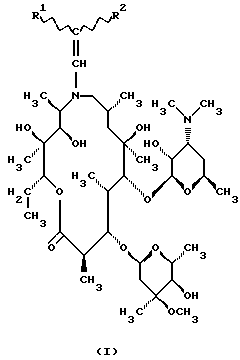 где R1 и R2 взаимно одинаковы или различны и представляют нитрил, карбоксигруппу формулы COOR3, где R3 представляет С1-С4-алкильную группу, или кетогруппу формулы COR4, где R4 представляет С1-С4-алкильную группу, и их фармацевтически приемлемые аддитивные соли с неорганическими или органическими кислотами. 2. Соединение по п. 1, отличающееся тем, что R1 и R2 взаимно одинаковые и представляют карбоксигруппу формулы COOR3. 3. Соединение по п. 2, отличающееся тем, что R3 представляет С1-С4-алкильную группу. 4. Соединение по п. 3, отличающееся тем, что С1-С4-алкильная группа представляет этильную группу. 5. Соединение по п. 1, отличающееся тем, что один из R1 и R2 представляет нитрил и другой из R1 и R2 представляет карбоксигруппу формулы COOR3. 6. Соединение по п. 5, отличающееся тем, что R3 представляет С1-С4-алкильную группу. 7. Соединение по п. 6, отличающееся тем, что С1-С4-алкильная группа представляет этильную группу. 8. Соединение по п. 1, отличающееся тем, что R1 и R2 взаимно одинаковы и представляют нитрил. 9. Соединение по п. 1, отличающееся тем, что один из R1 и R2 представляет карбоксигруппу формулы COOR3 и другой из R1 и R2 представляет кетогруппу формулы COR4. 10. Соединение по п. 9, отличающееся тем, что R3 представляет С1-С4-алкильную группу. 11. Соединение по п. 10, отличающееся тем, что С1-С4-алкильная группа представляет этильную группу. 12. Соединение по п. 9, отличающееся тем, что R4 представляет С1-С4-алкильную группу. 13. Соединение по п. 12, отличающееся тем, что С1-С4-алкильная группа представляет метильную группу. 14. Способ получения  , ,  -дизамещенных производных 9-дезоксо-9а-N-этенил-9а-аза-9а-гомоэритромицина А общей формулы (I) -дизамещенных производных 9-дезоксо-9а-N-этенил-9а-аза-9а-гомоэритромицина А общей формулы (I)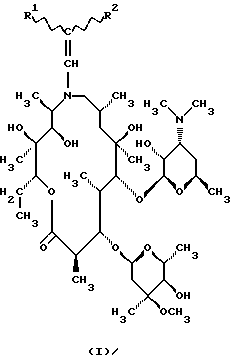 где R1 и R2 взаимно одинаковы или различны и представляют нитрил или карбоксигруппу формулы COOR3, где R3 представляет С1-С4-алкильную группу, или кетогруппу формулы COR4, где R4 представляет С1-С4-алкильную группу, и их фармацевтически приемлемых аддитивных солей с неорганическими или органическими кислотами, отличающийся тем, что 9-дезоксо-9а-аза-9а-гомоэритромицин А формулы (II) 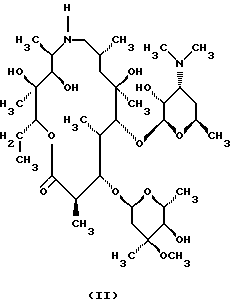 подвергают реакции с этоксиметиленпроизводными общей формулы (III) 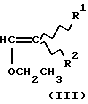 где R1 и R2 взаимно одинаковы или различны и представляют нитрил или карбоксигруппу формулы COOR3, где R3 представляет С1-С4-алкильную группу, или кетогруппу формулы COR4, где R4 представляет С1-С4-алкильную группу, причем реакцию проводят в толуоле, ксилоле или некоторых других апротонных растворителях при температуре 20-115oС и затем, если требуется, реакции с неорганическими или органическими кислотами. MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 30.12.2008
Извещение опубликовано: 20.07.2010 БИ: 20/2010
|
||||||||||||||||||||||||||
