Патент на изобретение №2205174
|
||||||||||||||||||||||||||
(54) СПОСОБ ПОЛУЧЕНИЯ НАСЫЩЕННЫХ МОНОАЛЬДЕГИДОВ
(57) Реферат: Изобретение относится к способу получения насыщенных моноальдегидов – промежуточных продуктов органического синтеза. Способ заключается в окислении олефинов закисью азота при температуре 250 – 600oС. Как правило, окисление осуществляют в присутствии гетерогенного катализатора – благородного металла в комбинации с оксидным или углеродным носителем, оксидов переходных металлов, оксидов непереходных металлов, оксидов переходных металлов в комбинации с оксидами непереходных металлов, кристаллического силиката общей формулы yМе2OnxEl2OnSiO2, где х=0-6,5  10-2, у=0-6,5 10-2, у=0-6,5 10-2, Me – щелочной либо щелочноземельный металл и/или водород, El – по крайней мере, один из элементов 2, 3, 4 и 5 групп Периодической системы, n – соответствует валентности элемента Е1 либо валентности металла Me. Обычно кристаллический силикат используют со связующим – оксидом алюминия, оксидом кремния или их смесью. Как правило, процесс осуществляют либо в избытке закиси азота, либо в избытке окисляемого вещества, а реакционную смесь разбавляют газом-разбавителем – азотом, аргоном, гелием, двуокисью углерода или их любой смесью. Способ позволяет получать насыщенные моноальдегиды в одну стадию и с высокой селективностью. 12 з.п. ф-лы, 2 табл. 10-2, Me – щелочной либо щелочноземельный металл и/или водород, El – по крайней мере, один из элементов 2, 3, 4 и 5 групп Периодической системы, n – соответствует валентности элемента Е1 либо валентности металла Me. Обычно кристаллический силикат используют со связующим – оксидом алюминия, оксидом кремния или их смесью. Как правило, процесс осуществляют либо в избытке закиси азота, либо в избытке окисляемого вещества, а реакционную смесь разбавляют газом-разбавителем – азотом, аргоном, гелием, двуокисью углерода или их любой смесью. Способ позволяет получать насыщенные моноальдегиды в одну стадию и с высокой селективностью. 12 з.п. ф-лы, 2 табл.
Изобретение относится к способу получения насыщенных моноальдегидов путем одностадийного окисления закисью азота соответствующих олефинов 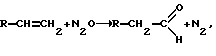 где R=Н; CnH2n+1. Альдегиды широко используются как промежуточные продукты органического синтеза. Например, ацетальдегид применяют в производстве уксусной и пероксиуксусной кислот, бутанола и др. (Kirk-Othmer encyclopedia, 3rd ed., v.1, N. Y., 1997, р. 97-112; Химическая энциклопедия, Из-во БРЭ, Москва, 1998, т. 1, 224). Из пропионового альдегида получают пропионовую кислоту и ее эфиры, а также пропионовый спирт и др. (Kirk-Othmer encyclopedia, 2 ed., v.16, N.Y. , 1968, р. 548-553; Химическая энциклопедия, Из-во БРЭ, Москва, 1995, т.4, 108). Для получения альдегидов используют самые разные способы. Технологии получения ацетальдегида основаны на окислении бутана, дегидрировании и окислении этанола, гидратации ацетилена и окислении этилена. При окислении бутана ацетальдегид образуется как побочный продукт. Промышленные процессы, в которых исходным веществом является этанол, требуют для своего осуществления высоких температур. Получение альдегида путем гидратации ацетилена (реакция Кучерова) осуществляется в растворе соли Kg и серной кислоты (Kirk-Othmer encyclopedia. 3rd ed., v.1, N.Y., 1997, р. 97-112; Химическая энциклопедия, Из-во БРЭ, Москва, 1998, т.1, 224). Использование этой технологии выдвигает повышенные требования к материалу реактора. Известен также способ (Kirk-Othmer encyclopedia, 3rd ed., v.1, N.Y., 1997. р. 97-112; Химическая энциклопедия, Из-во БРЭ, Москва. 1998, т.1, 224; Рубайло В.Л., Маслов С.А. Жидкофазное окисление непредельных соединений. Химия, М., 1989) получения ацетальдегида путем жидкофазного окисления этилена молекулярным кислородом с использованием в качестве катализатора водного pacтвopa PdCl2 и СuСl2. Недостатком этого способа является образование в побочных продуктах хлорсодержащих соединений. Пропионовый альдегид (пропаналь) получают оксосинтезом из этилена, СО и Н2 в присутствии Со(СО)4. Использование высокого давления (250 атм) требует повышенных капитальных затрат и создает проблему взрывоопасности. В отличие от этих методов существует принципиальная возможность прямого окисления молекулярным кислородом олефинов в соответствующие альдегиды. Однако в этом случае альдегиды образуются как побочные продукты в незначительном количестве. Основными продуктами окисления этилена в зависимости от условий реакции и катализатора являются или оксид этилена (U.S. Pat. 5,734,068 March 25, 1997, Klopries Burkhard etc., или уксусная кислота (U.S. Pat. 6,274,765 November 10, 1999, Borchert Holger etc.). При окислении пропилена без катализатора образуется оксид пропилена (U.S. Pat. 6,303,800 July 14, 2000, Dingerdissen Uwe etc.). А при каталитическом окислении пропилена в зависимости от условий реакции и катализатора образуются преимущественно либо оксид пропилена (U.S. Pat. 5,763,630 June 9, 1998, Kahn Andrew P. etc. ; U.S. Pat. 5,703,254 October 2, 1996, Gaffney Anne M. etc.), либо акролеин и акриловая кислота (U.S. Pat. 6,143,928 August 10, 1998, Karim Khalid etc.). Изобретение решает задачу разработки эффективного способа получения альдегидов. Задача решается путем окисления соответствующих олефинов закисью азота при повышенных температурах. По предлагаемому способу окисление олефинов закисью азота осуществляют при температуре 250-600oС без катализатора. Исходная газовая либо парогазовая смесь подается в реактор, нагретый до заданной температуры, где и происходит превращение олефина. Целевой продукт выделяют из реакционной смеси известными способами. Для снижения температуры процесса и увеличения его производительности процесс ведут и в присутствии гетерогенного катализатора. В качестве катализатора используют благородный металл в комбинации с оксидным или углеродным носителем, оксиды переходных металлов, оксиды непереходных металлов, а также оксиды переходных металлов в комбинации с оксидами непереходных металлов, кристаллический силикат, общей формулы yMe2ОnxEl2ОnSiО2, где х=0-6,5  10-2, у= 0-6,5 10-2, у= 0-6,5 10-2, Me – щелочной либо щелочноземельный металл и/или водород. El – по крайней мере, один из элементов 2, 3, 4 и 5 групп периодической системы, n – соответствует валентности элемента Е1, либо валентности металла Me, а также кристаллический силикат со связующим, в качестве которого применяют Аl2О3, SiO2 или их смесь.
Окисление закисью азота проводят в газовой фазе как в избытке окислителя, так и в избытке окисляемого вещества. Во избежание образования взрывоопасных смесей процесс желательно вести либо выше верхнего, либо ниже нижнего концентрационных пределов взрываемости. Для уменьшения адиабатического разогрева реакционную смесь разбавляют газом-разбавителем, в качестве которого используют Не, Ar, 2, СО2 и т.п.
Сущность изобретения иллюстрируется следующими примерами.
Пример 1 10-2, Me – щелочной либо щелочноземельный металл и/или водород. El – по крайней мере, один из элементов 2, 3, 4 и 5 групп периодической системы, n – соответствует валентности элемента Е1, либо валентности металла Me, а также кристаллический силикат со связующим, в качестве которого применяют Аl2О3, SiO2 или их смесь.
Окисление закисью азота проводят в газовой фазе как в избытке окислителя, так и в избытке окисляемого вещества. Во избежание образования взрывоопасных смесей процесс желательно вести либо выше верхнего, либо ниже нижнего концентрационных пределов взрываемости. Для уменьшения адиабатического разогрева реакционную смесь разбавляют газом-разбавителем, в качестве которого используют Не, Ar, 2, СО2 и т.п.
Сущность изобретения иллюстрируется следующими примерами.
Пример 1Окисление пропилена С3Н6 + N2O–>С3Н6О + Na2 ведут в проточном стеклянном реакторе с внутренним диаметром 7 мм. Через реактор, нагретый до 400oС, со скоростью 1 см3/сек подают реакционную смесь следующего состава (моль. %): 3Н6 – 26; N2O – 4.6; остальное – гелий. Состав реакционной смеси до и после реактора определяют с помощью хроматографического анализа. Исходя из данных анализа, рассчитывают производительность и селективность образования целевого продукта. Основным продуктом окисления является пропаналь, селективность образования которого составляет 96%. Остальное – продукты глубокого окисления и ацетон. Результаты представлены в таблице 1. Примеры 2-4 Реакцию ведут аналогично примеру 1, за исключением того, что температуру варьируют от 450 до 600oС. Результаты представлены в таблице 1. С увеличением температуры растет скорость образования пропаналя. При увеличении температуры до 500oС селективность сохраняется на уровне 96-98%. Дальнейший рост температуры от 500 до 600oС приводит к заметному снижению селективности. Пример 5 Окисление пропилена ведут аналогично примеру 1, за исключением того, что процесс осуществляется в присутствии катализатора 1 мас.% Аu/ТiO2. Использование Аu/ТiO2 катализатора позволяет заметно увеличить скорость процесса, однако при этом селективность заметно падает. Результаты представлены в таблице 1. Пример 6 Окисление пропилена ведут аналогично примеру 1, за исключением того, что процесс осуществляют в присутствии катализатора 0.5 мас.% Pt/С. Использование катализатора увеличивает скорость образования пропаналя в 3 раза по сравнению с окислением без катализатора. Результаты показаны в таблице 1. Примеры 7-9 Окисление пропилена ведут аналогично примеру 4, за исключением того, что температуру варьируют от 425 до 475oС. Результаты представлены в таблице 1. Пример 10 Окисление пропилена ведут аналогично примеру 2, за исключением того, что процесс осуществляют в присутствии активной окиси алюминия  -Al2O3. Результаты представлены в таблице 1. Введение -Al2O3. Результаты представлены в таблице 1. Введение  -Al2O3 сопровождается некоторым увеличением производительности по пропаналю и снижением селективности. Основными побочными продуктами являются СО и СО2.
Пример 11 -Al2O3 сопровождается некоторым увеличением производительности по пропаналю и снижением селективности. Основными побочными продуктами являются СО и СО2.
Пример 11Окисление пропилена ведут аналогично примеру 2, за исключением того, что процесс осуществляют в присутствии ТiO2. Результаты представлены в таблице 1. Окисление в присутствии ТiO2 сопровождается увеличением производительности по целевому продукту и снижением селективности процесса. Основными побочными продуктами являются СО и СО2. Пример 12 Окисление пропилена ведут аналогично примеру 1, за исключением того, что процесс осуществляют в присутствии V2O5. Результаты представлены в таблице 1. Окисление в присутствии V2O5 сопровождается увеличением скорости образования пропаналя в 5 раз по сравнению с окислением без катализатора. Основными побочными продуктами являются СО и СО2. Пример 13 Окисление пропилена ведут аналогично примеру 1, за исключением того, что процесс осуществляют в присутствии Fе2О3 при температуре 250oС. Результаты представлены в таблице 1. Использование в качестве катализатора Fе2О3 приводит к снижению температуры процесса. При этом скорость образования пропаналя при 250oС выше скорости образования пропаналя по сравнению с окислением без катализатора при 400oС (пример 2). Пример 14 Окисление пропилена ведут аналогично примеру 1, за исключением того, что в качестве катализатора используют систему 1 мас.% Fe2O3/SiO2. Результаты представлены в таблице 1. Катализатор Fe2O3/SiO2 при селективности 89% обеспечивает на порядок более высокую производительность по целевому продукту, чем при окислении без катализатора. Основными побочными продуктами являются ацетон, СО и СO2. Примеры 15-18 Окисление пропилена ведут аналогично примеру 14, за исключением того, что температуру варьируют от 300 до 375oС. Результаты представлены в таблице 1. Видно, что использование катализатора Fе2О3/SiO2 при 300oС обеспечивает такую же производительность, что и при 400oС без катализатора (пример 1). Пример 19 Окисление пропилена ведут аналогично примеру 1, за исключением того, что процесс осуществляют в присутствии катализатора 1 мас.% Fe2O3/MgO. Результаты представлены в таблице 1. Использование катализатора 1 мас.% Fe2O3/MgO позволяет увеличить производительность по целевому продукту более чем на порядок по сравнению с окислением без катализатора (пример 1). Пример 20 Окисление пропилена ведут аналогично примеру 2, за исключением того, что процесс осуществляют в присутствии катализатора – кристаллического SiO2 со структурой MFI (силикалит-1) Результаты представлены в таблице 1. При близкой селективности (96%) производительность по целевому продукту существенно выше по сравнению с осуществлением реакции без катализатора (пример 2). Пример 21 Окисление пропилена ведут аналогично примеру 2, за исключением того, что процесс осуществляют в присутствии катализатора – кристаллического титаносиликата состава 3.2  10-2 10-2 ТiО2 ТiО2 SiO2 со структурой MFI (TS-1). Результаты представлены в таблице 1. При близкой селективности (~98%) производительность на 30% выше по сравнению с осуществлением реакции без катализатора (пример 2).
Примеры 22-23 SiO2 со структурой MFI (TS-1). Результаты представлены в таблице 1. При близкой селективности (~98%) производительность на 30% выше по сравнению с осуществлением реакции без катализатора (пример 2).
Примеры 22-23Окисление пропилена ведут аналогично примерам 6-7, за исключением того, что процесс осуществляют в присутствии цеолита со структурой MEL состава 2.3  10-3 10-3 Na2O Na2O 8.2 8.2 10-4 10-4 Fе2O3 Fе2O3 9.5 9.5 10-3 10-3 АlО3 АlО3 SiO2.
Результаты представлены в таблице 1. Видно, что изменение химического состава кристаллического силиката позволяет увеличить в несколько раз производительность по целевому продукту.
Пример 24 SiO2.
Результаты представлены в таблице 1. Видно, что изменение химического состава кристаллического силиката позволяет увеличить в несколько раз производительность по целевому продукту.
Пример 24В этом примере в качестве субстрата для окисления закисью азота используют этилен С2Н4+N2O–>С2Н4O+N3. Процесс осуществляют в проточном стеклянном реакторе. В качестве катализатора используют цеолит со структурой MFI состава 3.3  10-4 10-4 Fе2O3 Fе2O3 9.4 9.4 10-3 10-3 Аl2О3 Аl2О3 SiO2. Загрузка катализатора составляет 1 см3. Через реактор, нагретый до 375oС, со скоростью 1 см3/сек подают реакционную смесь состава 7 моль.% С2Н6 и 10 моль.% N2O, остальное – Не. Результаты представлены в таблице 2.
Окисление этилена закисью азота сопровождается образованием ацетальдегида с селективностью выше 50%.
Таким образом, как видно из примеров и таблиц 1 и 2, использование закиси азота в качестве окислителя позволяет в одну стадию с высокой селективностью получать из олефинов соответствующие альдегиды. SiO2. Загрузка катализатора составляет 1 см3. Через реактор, нагретый до 375oС, со скоростью 1 см3/сек подают реакционную смесь состава 7 моль.% С2Н6 и 10 моль.% N2O, остальное – Не. Результаты представлены в таблице 2.
Окисление этилена закисью азота сопровождается образованием ацетальдегида с селективностью выше 50%.
Таким образом, как видно из примеров и таблиц 1 и 2, использование закиси азота в качестве окислителя позволяет в одну стадию с высокой селективностью получать из олефинов соответствующие альдегиды.
Формула изобретения
yMe2OnxEl2OnSiO2, где х= 0-6,5  10-2; 10-2;у= 0-6,5  10-2; 10-2;Me – щелочной либо щелочноземельный металл и/или водород; El – по крайней мере один из элементов 2, 3, 4 и 5 групп Периодической системы; n соответствует валентности элемента Еl либо валентности металла Me. 8. Способ по п. 7, в котором кристаллический силикат используют со связующим. 9. Способ по п. 8, в котором в качестве связующего используют оксид алюминия, оксид кремния или их смесь. 10. Способ по любому из пп. 1-9, в котором процесс осуществляют в избытке закиси азота. 11. Способ по любому из пп. 1-9, в котором процесс осуществляют в избытке окисляемого вещества. 12. Способ по любому из пп. 1-11, в котором реакционная смесь разбавляется газом разбавителем. 13. Способ по п. 12, в котором в качестве газа разбавителя используют азот, аргон, гелий, двуокись углерода или их любую смесь. РИСУНКИ
|
||||||||||||||||||||||||||
