Патент на изобретение №2205028
|
||||||||||||||||||||||||||
(54) ПЕРОРАЛЬНАЯ ФАРМАЦЕВТИЧЕСКАЯ ЛЕКАРСТВЕННАЯ ФОРМА С ДИСКРЕТНЫМ ВЫСВОБОЖДЕНИЕМ
(57) Реферат: Предложено: новые пероральная фармацевтическая лекарственная форма с дискретным высвобождением, драже или таблетка, включающие указанную форму, способы ее получения и способы лечения избыточной секреции кислоты в желудке. Новое средство отличает дискретное высвобождение активного ингредиента, сначала – немедленное и через 0,5-12 ч – отсроченное, что дает возможность создавать в желудке его непрерывное высвобождение. Изобретение расширяет арсенал средств указанного назначения. 7 с. и 26 з.п. ф-лы, 5 ил. Изобретение относится к новым пероральным фармацевтическим лекарственным формам, которые содержат ингибитор протонной помпы, то есть ингибитор H+, K+-АТФазы. Эти новые лекарственные формы представляют собой препараты с энтеросолюбильным покрытием, которые обеспечивают дискретную модель двух или более чем двух дискретных импульсов высвобождения ингибитора H+,K+-АТФазы в тонком и/или толстом кишечнике. Эти импульсы разделены во времени интервалом от 0,5 и до 12 часов, предпочтительно они разделены интервалом от 0,5 и до 6 часов и более предпочтительно интервалом от 0,5 и до 4 часов. Более того, настоящее изобретение относится к производству таких фармацевтических препаратов с импульсным замедленным высвобождением и их применению в медицине. Неустойчивые в кислоте ингибиторы H+,K+-АТФазы, также называемые ингибиторами желудочной протонной помпы, представляют собой, например, соединения, известные под родовыми названиями омепразол, лансопразол, пантопразол, рабепразол и леминопразол. Некоторые из этих соединений описаны в ЕР-А1-0005129, ЕР-А1-124495, WO 94/27988, ЕР-А1-174726, ЕР-А1-166287 и GB 2163747. Эти фармацевтические вещества полезны для ингибирования секреции желудочной кислоты у млекопитающих, включая человека, путем регулирования секреции желудочной кислоты на конечной стадии секреторного пути кислоты и таким образом снижают базальную и вызванную раздражителем секрецию желудочной кислоты независимо от раздражителя. В более общем смысле они могут быть использованы для предупреждения и лечения заболеваний, связанных с желудочной кислотой, у млекопитающих и человека, включая, например, рефлюкс-эзофагит, гастрит, дуоденит, язву желудка, язву двенадцатиперстной кишки и синдром Золлингера-Эллисона. Более того, они могут быть использованы для лечения других желудочно-кишечных расстройств, где желателен эффект ингибирования желудочной кислоты, например у пациентов при терапии нестероидными противовоспалительными средствами (НСПВС), у пациентов с неязвенной диспепсией и у пациентов с симптоматическим заболеванием гастроэзофагеальный рефлюкс (ГЭР). Они могут также быть использованы у пациентов в ситуациях интенсивной терапии, у пациентов с острым верхним желудочно-кишечным кровотечением, пре- и постоперационно для предотвращения аспирации желудочной кислоты и для предупреждения и лечения стрессового изъязвления. Более того, они могут быть полезны при лечении псориаза, кроме того, при лечении инфекций Helicobacter, а также заболеваний, связанных с ними. Терапевтический контроль секреции желудочной кислоты является непременным при всех этих заболеваниях, но степень и продолжительность ингибирования кислоты, требуемые для оптимального клинического эффекта, не до конца понятны. В WO 97/48380 (опубликовано 24 декабря 1997, то есть после даты приоритета по настоящей заявке) заявитель предположил, что режим введения, который дает уровни в плазме крови, продолжающиеся от 2 до 12 часов (с помощью любого из нескольких способов), приведет к тому, что будет ингибироваться большая часть протонных помп. Таким образом, пролонгированный уровень в плазме крови должен приводить к более эффективному ингибированию секреции кислоты, приводя к улучшению эффективности при ГЭР, более быстрому заживлению язвы желудка и улучшенной ликвидации Н. Pylori. Настоящее изобретение предлагает фармацевтические лекарственные формы, которые достигают таких пролонгированных уровней в плазме путем высвобождения лекарственного средства в два или более чем два отдельных импульса. Фармацевтическая лекарственная форма омепразола или любого другого ингибитора протонной помпы лучше всего защищена от контакта с кислым желудочным соком слоем энтеросолюбильного покрытия. В US 4786505 и US 4853230 описаны такие препараты с энтеросолюбильным покрытием. Эти препараты имеют ядро, содержащее щелочную соль лекарственного средства или ядро, содержащее лекарственное средство вместе с щелочным реагирующим соединением, причем это ядро покрыто водорастворимым или быстро разрушающимся в воде разделяющим слоем, а затем слоем энтеросолюбильного покрытия. В WO 96/01623 и WO 96/01624 описаны таблетированные лекарственные формы омепразола и других ингибиторов протонной помпы, где драже с нанесенным слоем энтеросолюбильного покрытия прессуют в таблетированную лекарственную форму составных единиц. Существенным в этих таблетированных препаратах является то, что слой энтеросолюбильного покрытия может выдерживать силы прессования. Ни один из этих ранее описанных заявителем препаратов не дал растворения двух или более чем двух импульсов, разделенных во времени, то есть в значении импульсного высвобождения ингибитора протонной помпы, которое приводило к пролонгированному профилю в плазме крови. Существуют различные методики и фармацевтические препараты, описанные в уровне техники, которые направлены на замедленное высвобождение вводимого лекарственного средства. Такими фармацевтическими препаратами являются, например, препараты, обеспечивающие различное время запаздывания, конструкции, основанные на осмотических различиях, медленноразрушающиеся/растворяющиеся слои, контролируемые во времени взрывающиеся системы или любые их комбинации. Некоторые из этих принципов описаны далее. Gazzaniga et al. (Proceed. 12th Pharm. Int. Techn. Conf., 1993, 1, 400-8) описал таблетки, на которые путем распыления или прессования были нанесены слои НРМС (гидроксипропилметилцеллюлозы) для получения препаратов кетопрофена или верапамила с замедленным высвобождением. Слой НРМС может также содержать нерастворимый наполнитель. Gazzaniga et al. также описали таблетки с покрытием, нанесенным путем прессования, содержащие антипирин со слоями НРМС, для получения замедленного высвобождения, имеющие внешнее энтеросолюбильное покрытие, содержащее нанесенный на него Eudragit L30D (Proc. Inter. Symp. Control. Rel. Bioact. Mater. 1996, 23, 571-2). В ЕР-А1-0629398 описана лекарственная форма, содержащая лекарственное средство и органическую кислоту в ядре, окруженном пленкой, которая регулирует начало высвобождения, и дополнительно покрытом слоем энтеросолюбильного покрытия. Данная лекарственная форма не подходит для веществ, которые подвержены кислотному разрушению, поскольку ядро содержит органическую кислоту. Осмотические системы описаны Fox (“Colon-Targeted Osmotic System for Oral delivery of Peptides and Proteins”, In; Oral Delivery of Proteins, Peptides and other Biopharmaceutical Agents; Proceedings Technology Management Group, Wakefield, MA, USA, Sept. 1991). Система высвобождения в ободочной кишке, OROS-CT, используется для получения замедленного пролонгированного высвобождения по окончании времени запаздывания. Данная лекарственная форма имела энтеросолюбильное покрытие, которое растворялось в тонком кишечнике, причем высвобождение лекарственного средства начиналось по окончании желаемого времени запаздывания, и высвобождение поддерживалось в течение нескольких часов. ЕР 0384642 и ЕР 0384646 (а также Pharm. J., July 27th, 1991 pp. 137-9) ввели лекарственную форму PULSINCAPTM как для системы, покрытой энтеросолюбильным покрытием, так и для системы, не покрытой энтеросолюбильным покрытием. Данная система содержит капсулу, состоящую из водонерастворимого корпуса и водорастворимого колпачка. Лекарственный препарат содержался в корпусе капсулы и был запечатан в этом пространстве с помощью гидрогелевой пробки. Conte et al. (Drug Development and Industrial Pharmacy, 1989, vol 15, pp. 2583-96) описали трехслойную таблетку, дающую систему двойного импульса, подходящую для ибупрофена. Первый слой содержал быстро высвобождающийся препарат и был отделен от слоя, содержащего вторую дозу, разбухающим полимерным барьерным слоем. Эта вторая доза была покрыта непроницаемой пленкой этилцеллюлозы. Данная конструкция высвобождает лекарственное средство в кислой среде. В US 5567441 была описана лекарственная форма для дилтиазема, содержащая смесь одной фракции драже, покрытых энтеросолюбильным покрытием, с медленным высвобождением и другой фракции драже, покрытых мембраной с замедленным импульсным высвобождением, причем последняя фракция драже не была покрыта энтеросолюбильным покрытием. Такая лекарственная форма будет неподходящей для чувствительных к кислоте лекарственных средств, таких как омепразол или ему подобные. Существуют две недавно опубликованные заявки на патент, в которых предлагаются препараты с контролируемым высвобождением, содержащие ингибитор протонной помпы, то есть в WO 97/02020 предлагается лекарственная форма для пантопразола в комбинации с антибактериальным веществом. По меньшей мере часть дозы пантопразола должна быть в медленно высвобождающейся форме с непрерывным высвобождением пантопразола во времени. Данный препарат имеет один промежуточный слой, который будет оставаться интактным как слой и который высвобождает дозу пантопразола непрерывно, так чтобы уровень пантопразола в плазме сохранялся как можно дольше. В WO 97/02021 обсуждается очень похожая лекарственная форма обратимого ингибитора протонной помпы в комбинации с антибактериальным веществом. Фиг. 1-5 показывают графики, иллюстрирующие профили растворения для некоторых фармацевтических препаратов по данному изобретению, приготовленных в примерах. Эти графики показывают высвободившееся количество вещества по отношению ко времени. Количество высвободившегося вещества определяют путем регистрации оптической плотности при 292 нм в буферном растворе. На фиг.1 показан профиль растворения для драже однократной дозы с нанесенным слоем, полученных в Примере 1. На фиг.2 показан профиль растворения для драже однократной дозы с нанесенным слоем, полученных в Примере 2. На фиг.3 показан профиль растворения для драже однократной дозы с нанесенным слоем, полученных в Примере 3. На фиг.4 показан профиль растворения для таблеток однократной дозы с нанесенным слоем, полученных в Примере 5. На фиг. 5 показан профиль растворения для таблеток множественной дозы с нанесенным слоем, полученных в Примере 6. Терапевтический эффект омепразола и подобных веществ может быть улучшен путем обеспечения пролонгированного профиля в плазме путем введения один раз в сутки лекарственной формы. По настоящему изобретению такого пролонгированного профиля в плазме добиваются с помощью фармацевтической лекарственной формы, способной к высвобождению лекарственного средства дискретными импульсами, разделенными во времени, то есть лекарственной формы с дискретной моделью высвобождения. В настоящем изобретении предлагаются такие лекарственные формы, содержащие чувствительный к кислоте ингибитор H+,K+-АТФазы, как например омепразол или любой другой ингибитор протонной помпы. Специфической проблемой является то, что фармацевтические лекарственные формы, подходящие для ингибитора H+,K+-АТФазы, должны удовлетворять определенному требованию в отношении устойчивости к желудочной кислоте товаров, покрытых энтеросолюбильной оболочкой, указанных в Фармакопее США (Edition 23). В соответствии с одним аспектом по настоящему изобретению пролонгированный профиль ингибитора протонной помпы в плазме обеспечивают с помощью введения один раз в сутки лекарственной формы, которая в тонком и/или толстом кишечнике (но не в желудке) высвобожает ингибитор протонной помпы двумя или более чем двумя дискретными импульсами, разделенными во времени интервалом от 0,5 до 12 часов, предпочтительно разделенными во времени интервалом от 0,5 и до 8 часов и более предпочтительно интервалом от 0,5 и до 4 часов. В соответствии с другим аспектом изобретения предлагается дискретная модель высвобождения ингибитора протонной помпы посредством введения раз в сутки лекарственной формы, причем часть лекарственной формы дает импульсное замедленное высвобождение, а другие части лекарственной формы высвобождают ингибитор протонной помпы немедленно. Данная лекарственная форма обеспечивает по меньшей мере два последовательных импульса высвобождения вещества, причем эти импульсы должны быть разделены во времени интервалом от 0,5 и до 12 часов, предпочтительно от 0,5 и до 8 часов и более предпочтительно от 0,5 и до 4 часов. Настоящие препараты с импульсным высвобождением показывают улучшенное соблюдение пациентами режима введения, включающего в себя последовательное введение двух или более чем двух стандартных доз в пределах определенных временных интервалов. Активное вещество Соединения, представляющие интерес для новых фармацевтических препаратов по настоящему изобретению, представляют собой соединения общей формулы I, их щелочные соли, один из их единственных энантиомеров или щелочную соль одного из энантиомеров 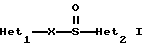 где Het1 представляет собой 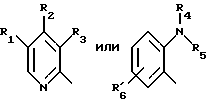 Het2 представляет собой 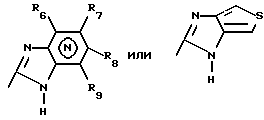 X= 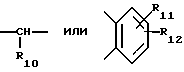 где N в бензимидазольной группировке означает, что один из кольцевых атомов углерода, замещенных R6-R9, возможно может быть заменен на атом азота без каких-либо заместителей; R1, R2 и R3 являются одинаковыми или разными и выбраны из водорода, алкила, алкокси, возможно замещенного фтором, алкилтио, алкоксиалкокси, диалкиламино, пиперидино, морфолино, галогена, фенила и фенилалкокси; R4 и R5 являются одинаковыми или разными и выбраны из водорода, алкила и арилалкила; R6‘ представляет собой водород, галоген, трифторметил, алкил или алкокси; R6-R9 являются одинаковыми или разными и выбраны из водорода, алкила, алкокси, галогена, галогеноалкокси, алкилкарбонила, алкоксикарбонила, оксазолинила и трифторалкила, или соседние группы R6-R9 образуют кольцевые структуры, которые могут быть, кроме того, замещены; R10 представляет собой водород или образует алкиленовую цепь вместе с R3, и R11 и R12 являются одинаковыми или разными и выбраны из водорода, галогена или алкила. Примерами особенно интересных соединений формулы I являются 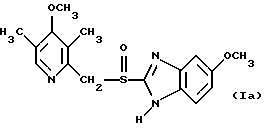 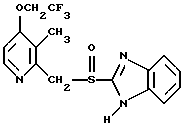 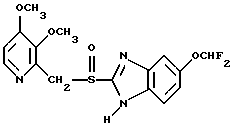 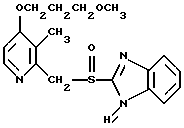 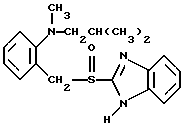 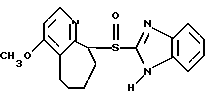 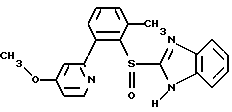 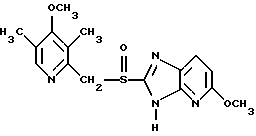 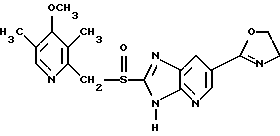 Соединение, подходящее для использования в препаратах с импульсным высвобождением по настоящему изобретению, может быть использовано в нейтральной форме или в форме щелочной соли, как например соли Мg2+, Са2+, Na+ или К+, предпочтительно солей Mg2+. Данные соединения могут также быть использованы в форме одного из их единственных энантиомеров или щелочной соли единственного энантиомера. Особенно предпочтительными соединениями для перорального фармацевтического препарата по настоящему изобретению являются омепразол, магниевая соль омепразола или магниевая соль (-)-энантиомера омепразола. Омепразол и родственные вещества, а также их препараты, описаны в ЕР 5129, ЕР 124495, WO 95/01977, WO 94/27988, которые включены сюда целиком путем ссылок. Вышеупомянутые соединения чувствительны к разрушению/превращению в кислой и нейтральной средах. Обычно разрушение катализируется кислыми реагирующими соединениями, а стабилизируются активные соединения щелочными реагирующими соединениями. Существуют различные препараты с нанесенным слоем энтеросолюбильного покрытия, содержащие омепразол, а также другие ингибиторы протонной помпы, описанные в уровне техники, см., например, US-А 4853230, WO 95/01783 и WO 96/01623. В частности, в последнем описаны альтернативные способы производства для приготовления драже с нанесенным энтеросолюбильным покрытием, содержащих омепразол и подобные соединения. Лекарственные формы по изобретению обеспечивают по меньшей мере часть дозы с импульсным замедленным высвобождением лекарственного средства и другую часть препарата с быстрым или немедленным высвобождением. Немедленное или импульсное замедленное высвобождение лекарственного средства может быть достигнуто в соответствии с различными принципами, как например: – с помощью драже или таблеток однократной дозы с нанесенным слоем, – с помощью драже или таблеток множественной дозы с нанесенным слоем, – с помощью двух или более чем двух различных фракций драже или таблеток однократной или множественной дозы с нанесенным слоем, возможно в комбинации с драже или таблетками, обладающими немедленным высвобождением. Драже множественной дозы с нанесенным слоем или две или более чем две различные совокупности драже однократной или множественной дозы с нанесенным слоем, полученные в соответствии с любым из нижеописанных принципов, загружают в капсулу или вместе с эксципиентами таблетки прессуют в таблетку составных единиц. Альтернативно может быть получена таблетка множественной дозы с нанесенным слоем. Драже или таблетки однократной дозы с нанесенным слоем В соответствии с одним аспектом данного изобретения получают драже или таблетки, дающие один отдельный импульс замедленного высвобождения лекарственного средства. Драже или таблетки однократной дозы с нанесенным слоем могут быть созданы так, чтобы содержать следующие части: – материал ядра, возможно нанесенный слоем на зернышко/сферу, причем этот материал ядра содержит лекарственное средство вместе с разбухающим в воде веществом, и, возможно, фармацевтически приемлемые эксципиенты, при этом этот материал ядра является свободным от кислотных соединений, и на нем следующую последовательность слоев: – окружающий слой, контролирующий время запаздывания, и, наконец, – слой энтеросолюбильного покрытия, расположенный так, чтобы покрывать слой, контролирующий время запаздывания. В соответствии с альтернативным аспектом изобретения также возможно создать драже или таблетки с нанесенным слоем, так чтобы они содержали следующие части: – материал ядра, возможно нанесенный слоем на зернышко/сферу, причем этот материал ядра содержит лекарственное средство, возможно вместе с фармацевтически приемлемыми эксципиентами, при этом этот материал ядра является свободным от кислотных соединений, и на нем следующую последовательность слоев: – окружающий слой, содержащий разбухающее в воде вещество, и на нем – окружающий слой, контролирующий время запаздывания, и, наконец, – слой энтеросолюбильного покрытия, расположенный так, чтобы покрывать слой, контролирующий время запаздывания. Драже или таблетки множественной дозы с нанесенным слоем В соответствии с другим аспектом данного изобретения получают драже или таблетки множественной дозы с нанесенным слоем, дающие два или более чем два импульса замедленного высвобождения лекарственного средства. Эти драже или таблетки могут быть созданы так, чтобы содержать следующие части: – материал ядра (I), возможно нанесенный слоем на зернышко/сферу, причем этот материал ядра содержит лекарственное средство вместе с разбухающим в воде веществом и, возможно, фармацевтически приемлемые эксципиенты, при этом этот материал ядра является свободным от кислотных соединений, и на нем следующую последовательность слоев: – окружающий слой (II), контролирующий время запаздывания, – слой (III), содержащий лекарственное средство, возможно вместе с разбухающим в воде веществом, и/или фармацевтически приемлемые эксципиенты; причем этот слой является свободным от кислотных соединений, и – возможно, разделяющий слой (IV), который является водорастворимым или быстро распадающимся в воде, причем слои II, и III, и возможный слой IV могут находиться в повторяющихся последовательностях (в этом порядке) и каждый набор слоев (II+III) дает дополнительный отдельный импульс лекарственного средства. Эта лекарственная форма в заключение покрыта внешним слоем энтеросолюбильного покрытия (V). Таким образом, драже или таблетка с трехимпульсным замедленным высвобождением могут быть созданы имеющими следующую последовательность слоев I+II+III+II+III+ возможный слой IV и заданный внешний слой энтеросолюбильного покрытия (V). В соответствии с альтернативным аспектом изобретения драже или таблетки множественной дозы с нанесенным слоем могут также быть созданы со следующими частями: – материал ядра (I), возможно нанесенный слоем на зернышко/сферу, причем этот материал ядра содержит лекарственное средство возможно вместе с фармацевтически приемлемыми эксципиентами, при этом этот материал ядра является свободным от кислых соединений, и на нем следующую последовательность слоев: – окружающий слой (II), содержащий разбухающее в воде вещество, за которым следует – окружающий слой (III), контролирующий время запаздывания, и – слой (IV), содержащий лекарственное средство, возможно вместе с фармацевтически приемлемыми эксципиентами; причем этот слой является свободным от кислотных соединений, и – возможно, разделяющий слой (V), который является водорастворимым или быстро распадающимся в воде, причем слои II, III, IV и, возможно, слой V могут находиться в повторяющихся последовательностях (в этом порядке) и каждый набор слоев (II+III+IV) дает дополнительный отдельный импульс лекарственного средства. Эта лекарственная форма покрыта внешним слоем энтеросолюбильного покрытия (VI). Таким образом, трехимпульсные драже или таблетка могут быть созданы имеющими следующую последовательность слоев I+II+III+IV+II+III+IV+ возможный – слой V и заданный внешний слой энтеросолюбильного покрытия (VI). Материал ядра, содержащий активное лекарственное средство, может быть приготовлен путем нанесения покрывающего слоя лекарственного средства на зернышко, такое как, например, сахарные сферы, или путем экструзии/сферонизации смеси, содержащей лекарственное средство и фармацевтически приемлемые эксципиенты. Также возможно приготовить материал ядра путем использования таблеточной технологии, то есть прессования гранул лекарственного средства и, возможно, фармацевтически приемлемых эксципиентов в ядро таблетки. Драже этих двух типов, то есть драже однократной или множественной дозы, которые имеют лекарственное средство, отложенное на зернышке/сфере путем нанесения слоя, также могут иметь возможный слой, содержащий разбухающее в воде вещество под слоем, содержащим лекарственное средство, в материале ядра. Полученный материал ядра используют для дальнейшей обработки. Различные методики приготовления материала ядра для драже или таблеток описаны ниже. Материал ядра Материал ядра для отдельных драже или таблеток может быть составлен в соответствии с различными принципами. Зернышко/сфера с нанесенным слоем активного вещества, причем это активное вещество возможно смешано с разбухающим в воде веществом и/или фармацевтически приемлемым эксципиентом, может быть использовано в качестве материала ядра для дальнейшей обработки. Этот материал ядра является свободным от кислотного соединения, за исключением того, что активное вещество как таковое может быть с незначительной кислотностью. Микроокружение вокруг чувствительного к кислоте ингибитора H+, K+-АТФазы должно предпочтительно быть не меньше рН=7 и более предпочтительно не меньше рН=8, когда вода впитывается в смесь материала ядра или когда воду добавляют в небольшом количестве к смеси. Зернышки/сферы могут быть водонерастворимыми и содержать различные оксиды, целлюлозы, органические полимеры и другие материалы, одни или в смесях, либо быть водорастворимыми и содержать различные неорганические соли, сахара и другие материалы, одни или в смесях. Далее, зернышки/сферы могут содержать активное вещество в форме кристаллов, агломератов, крупки и так далее. Размер затравок может варьировать между приблизительно 0,1 и 2 мм. Зернышки с нанесенным слоем активного вещества получают либо путем нанесения слоя порошка или раствора/суспензии с использованием, например, гранулирующего оборудования или оборудования для нанесения покрытия методом распыления/наслоения. Перед тем как на зернышки наносят слой, активное вещество может быть смешано с дополнительными компонентами для получения предпочтительных для обращения и обработки свойств и подходящей концентрации активного вещества в конечной смеси. Такие компоненты могут представлять собой связующие вещества, поверхностно-активные вещества, наполнители, разрыхляющие вещества, щелочные добавки или другие фармацевтически приемлемые ингредиенты, одни или в смесях. Связующими веществами являются, например, целлюлозы, как например гидроксипропилметилцеллюлоза, метилцеллюлоза, гидроксипропилцеллюлоза и натрий-карбоксиметилцеллюлоза, поливинилпирролидон, желатин, сахара, крахмалы и другие фармацевтически приемлемые вещества с когезионными свойствами. Подходящие поверхностно-активные вещества обнаружены в группах фармацевтически приемлемых неионогенных поверхностно-активных веществ, таких как полисорбат 80, или ионогенных поверхностно-активных веществ, таких как, например, лаурилсульфат натрия. Возможно в материал ядра помещен осмотический агент. Такой осмотический агент является водорастворимым и будет обеспечивать осмотическое давление в таблетке. Примерами осмотических агентов являются сульфат магния, хлорид натрия, хлорид лития, хлорид калия, сульфат калия, карбонат натрия, сульфат лития, бикарбонат кальция, сульфат натрия, лактат кальция, мочевина, сукцинат магния, сахароза или их смеси. Альтернативно активное вещество, возможно смешанное с любым из компонентов, определенных выше, может быть приготовлено в виде материала ядра. Указанный материал ядра может быть приготовлен путем экструзии/сферонизации, комкования или прессования с использованием различного оборудования. Для способов экструзии/сферонизации включение микрокристаллической целлюлозы и гидроксипропилцеллюлозы с низкой степенью замещения в материал ядра является предпочтительным. Размер приготовленных материалов ядра составляет приблизительно 0,1-4 мм, предпочтительно 0,1-2 мм для препарата в форме драже и 2-10 мм, предпочтительно 3-7 мм для препарата в форме таблетки. Подходящие щелочные добавки могут быть выбраны, но не ограничены ими, среди таких веществ, как натриевые, калиевые, кальциевые, магниевые и алюминиевые соли фосфорной кислоты, карбоновой кислоты, лимонной кислоты или других подходящих слабых неорганических или органических кислот; гидроксида алюминия/бикарбоната натрия соосажденных; веществ, обычно используемых в антацидных препаратах, таких как гидроксиды алюминия, кальция и магния; оксида магния или сложных веществ, таких как Аl2O3  6МgО 6МgО СO2 СO2 12Н2O, (Мg6Аl2(ОН)16СО3 12Н2O, (Мg6Аl2(ОН)16СО3 4H2О), MgO 4H2О), MgO Al2O3 Al2O3 2SiO2 2SiO2 nH2O или подобных соединений; органических рН-буферных веществ, таких как тригидроксиметиламинометан, основных аминокислот, таких как аргинин, и их солей или других подобных фармацевтически приемлемых рН-буферных веществ.
Альтернативно вышеупомянутый материал ядра для препарата в форме драже может быть получен путем использования методик сушки распылением или замораживания.
Разбухающий слой nH2O или подобных соединений; органических рН-буферных веществ, таких как тригидроксиметиламинометан, основных аминокислот, таких как аргинин, и их солей или других подобных фармацевтически приемлемых рН-буферных веществ.
Альтернативно вышеупомянутый материал ядра для препарата в форме драже может быть получен путем использования методик сушки распылением или замораживания.
Разбухающий слойНанесенный разбухающий слой содержит одно или более чем одно разбухающее в воде вещество, подходящее связующее вещество и возможно фармацевтически приемлемый(ые) эксципиент(ы). Подходящие разбухающие вещества, связующие вещества, а также фармацевтически приемлемые эксципиенты описаны ниже. Разбухающий слой увеличивается в объеме при подвергании действию водного раствора, такого как кишечная жидкость. Альтернативно один из дополнительных слоев, содержащих лекарственное средство, нанесенных на материал ядра, может представлять собой объединенный лекарственный разбухающий слой. Разбухающие в воде вещества Разбухающие в воде вещества, подходящие для лекарственных форм по настоящему изобретению, представляют собой соединения, которые способны увеличиваться в объеме, когда они подвергаются действию водного раствора, такого как кишечная жидкость. Одно или более чем одно разбухающее в воде вещество может присутствовать в материале ядра вместе с активным веществом и возможно фармацевтически приемлемым эксципиентом(ами). Альтернативно одно или более чем одно разбухающее в воде вещество включено в разбухающий слой, нанесенный на материал ядра. В качестве дополнительной альтернативы разбухающее вещество(а) может также присутствовать в возможном разбухающем слое, расположенном под слоем, содержащим лекарственное средство, если в качестве материала ядра используют зернышко или сферу с нанесенным слоем. Количество и состояние разбухающего(их) в воде вещества(в) в разбухающем слое или в материале ядра выбирают таким образом, что материал ядра или разбухающий слой при контакте с водным раствором, таким как кишечная жидкость, будет увеличиваться в объеме до такой степени, что окружающая мембрана, регулирующая время запаздывания, разрывается. Разбухающее в воде вещество может также быть включено в слой, содержащий лекарственное средство, многослойных драже или таблеток, чтобы увеличить степень растворения лекарственной фракции. Подходящими веществами, которые могут быть использованы в качестве разбухающих в воде веществ, являются, например, гидроксипропилцеллюлоза с низкой степенью замещения, например L-HPC, поперечно-связанный поливинилпирролидон (PVP-XL), например KollidonTMCL и PolyplasdoneTMXL, поперечно-связанная натрий-карбоксиметилцеллюлоза, например Ac-di-solTM, PrimelloseTM, натрийкрахмалгликолят, например PrimojelTM, натрий-карбоксиметилцеллюлоза, например Nymcel ZSB 10TM, натрий-карбоксиметилкрахмал, например ExplotabTM, ионобменные смолы, например DowexTM или AmberliteTM, микрокристаллическая целлюлоза, например AvicelTM, крахмалы или предварительно желатинизированный крахмал, например Starch 1500TM, Sepistab ST200TM, и формалин-казеин, например Plas-VitaTM. Может быть использовано одно из этих веществ или любые их комбинации или смеси, принимая во внимание, что использование любого кислотного соединения не является подходящим. Слой, контролирующий время запаздывания Слой, контролирующий время запаздывания, представляет собой полупроницаемую мембрану, содержащую водостойкий полимер, который является полупроницаемым для водного раствора, такого как кишечная жидкость. Подходящими полимерами являются ацетат целлюлозы, этилцеллюлоза, поливинилацетат, ацетобутират целлюлозы, ацетопропионат целлюлозы, сополимеры акриловой кислоты, такие как EudragitTMRS или RL. Полимер возможно может содержать порообразующие агенты, такие как водорастворимое вещество, например сахароза, соль; или водорастворимый полимер, например полиэтиленгликоль. Также могут быть включены фармацевтически приемлемые эксципиенты, такие как наполнители и агенты, влияющие на прочность мембраны, такие как тальк, аэросил или алюмосиликат натрия. Существует по меньшей мере один слой, контролирующий время запаздывания, присутствующий в лекарственных формах по настоящему изобретению. Слой, контролирующий время запаздывания, расположенный ближе всего к внутреннему материалу ядра, создан в виде полупроницаемой мембраны, которая будет разрушена через желаемое время после проглатывания. Желаемое время запаздывания может быть откорректировано с помощью состава и толщины данного слоя. Количество веществ, образующих такую разрушающуюся полупроницаемую мембрану, то есть слой, контролирующий время запаздывания, обычно находится в диапазоне от 0,5 до 25% в расчете на массу материала ядра, включая разбухающие вещества или разбухающий слой. Предпочтительно количество такого слоя, контролирующего время запаздывания, то есть разрушающейся полупроницаемой мембраны, находится между 2 и 20% по массе. Предпочтительная разрушающаяся полупроницаемая мембрана, то есть слой, контролирующий время запаздывания, состоит из смеси этилцеллюлозы и талька. Данная смесь наиболее предпочтительно содержит 10-80% мас./мас. талька. Возможно любой дополнительный слой, контролирующий время запаздывания, может быть создан в виде разрушающейся полупроницаемой мембраны. Слой(и) энтеросолюбильного покрытия и разделяющий слой(и) Перед нанесением слоя энтеросолюбильного покрытия на драже или таблетки с нанесенным слоем они возможно могут быть покрыты одним или более чем одним разделяющим слоем, содержащим фармацевтические эксципиенты, возможно включающие в себя щелочные соединения, такие как, например, рН-буферные соединения. Этот разделяющий слой отделяет композицию драже или таблеток с нанесенным слоем от внешнего слоя энтеросолюбильного покрытия. Разделяющий слой, так же как другой тип слоев, как например разбухающий слой и слой, контролирующий время запаздывания, может быть нанесен путем процедур нанесения покрытия или нанесения слоя в подходящем оборудовании, как например в дражировочном котле, грануляторе для нанесения покрытия, центробежном грануляторе, или в аппарате с псевдоожиженным слоем (включая тип Wurster), с использованием воды и/или органических растворителей для процесса нанесения покрытия. В качестве альтернативы слой(и) могут быть нанесены путем использования методик нанесения порошкового покрытия или нанесения покрытия путем прессования. Подходящими материалами для возможного разделяющего слоя являются такие фармацевтически приемлемые соединения, как например сахар, полиэтиленгликоль, поливинилпирролидон, поливиниловый спирт, поливинилацетат, гидроксипропилцеллюлоза, метилцеллюлоза, этилцеллюлоза, гидроксипропилметилцеллюлоза, натрий-карбоксиметилцеллюлоза и другие, используемые независимо или в смесях. Добавки, такие как пластификаторы, красители, пигменты, наполнители, агенты против прилипания и антистатики, такие как, например, стеарат магния, диоксид титана, тальк, рН-буферные вещества и другие добавки могут также быть включены в разделяющий слой. Когда возможный разделяющий слой нанесен на драже или таблетки с нанесенным слоем, он может иметь переменную толщину. Максимальная толщина возможного разделяющего слоя в норме ограничена только условиями способа. Разделяющий слой может служить в качестве диффузионного барьера и может действовать в качестве рН-буферной зоны. Возможный разделяющий слой может улучшать химическую стабильность активного вещества и/или физические свойства лекарственной формы. Наконец, драже или таблетки с нанесенным слоем покрывают одним или более чем одним слоем энтеросолюбильного покрытия путем использования подходящей методики нанесения покрытия. Материал слоя энтеросолюбильного покрытия может быть диспергирован или растворен либо в воде, либо в подходящих органических растворителях. В качестве полимеров слоя энтеросолюбильного покрытия один или более чем один из следующих, отдельно или в комбинации, может быть использован; например, растворы или дисперсии сополимеров метакриловой кислоты, ацетофталата целлюлозы, фталата гидроксипропилметилцеллюлозы, ацетосукцината гидроксипропилметилцеллюлозы, поливинилацетофталата, ацетотриметилата целлюлозы, карбоксиметилэтилцеллюлозы, шеллака или другого подходящего полимера(ов) слоя энтеросолюбильного покрытия. Добавки, такие как диспергаторы, красители, пигменты, дополнительные полимеры, например поли(этилакрилат, метилметакрилат), агенты против прилипания и предупреждающие вспенивание могут также быть включены в слой энтеросолюбильного покрытия. Другие соединения могут быть добавлены для увеличения толщины пленки и для уменьшения диффузии кислых желудочных соков в материал, чувствительный к кислоте. Слой(и) энтеросолюбильного покрытия имеют толщину приблизительно по меньшей мере 10 мкм, предпочтительно более чем 20 мкм. Максимальная толщина нанесенного слоя(ев) энтеросолюбильного покрытия, как правило, ограничена только условиями способа. Любой из нанесенных полимерсодержащих слоев и особенно слои энтеросолюбильного покрытия могут также содержать фармацевтически приемлемые пластификаторы для получения желаемых механических свойств. Такими пластификаторами являются, но не ограничены ими, например, триацетин, сложные эфиры лимонной кислоты, сложные эфиры фталевой кислоты, дибутилсебацат, цетиловый спирт, полиэтиленгликоли, сложные моноэфиры глицерина, полисорбаты или другие пластификаторы. Количество пластификатора предпочтительно оптимизировано для каждого состава в отношении к выбранному полимеру(ам), выбранному пластификатору(ам) и нанесенному количеству указанного полимера(ов). Конечная лекарственная форма Полученные драже с нанесенным слоем, возможно смешанные с эксципиентами таблетки, загружают в капсулу или прессуют в таблетированную лекарственную форму составных единиц. Альтернативно лекарственная форма представляет собой многослойную таблетку. Полученные таблетки возможно покрывают пленкообразующим агентом(ами) для получения гладкой поверхности таблетки и дополнительного увеличения прочности таблетки во время упаковки и транспортировки. Такой слой покрытия таблетки может дополнительно содержать добавки наподобие агентов против прилипания, красителей и пигментов или другие добавки для получения таблетки с хорошим внешним видом. Лекарственные формы по изобретению являются подходящими для перорального введения. Доза будет зависеть от природы и тяжести заболевания, которое лечат. Доза может также варьировать в соответствии с возрастом, массой тела и реакцией конкретного пациента. Дети и пациенты с заболеваниями печени, а также пациенты, находящиеся на длительном лечении, будут в большинстве случаев получать пользу от доз, которые несколько ниже средних. При лечении других состояний должны быть использованы дозы, более высокие, чем средние. Предпочтительно лекарственную форму ингибитора протонной помпы, например 1-500 мг, вводят раз в сутки. Подходящие дозы содержат, например, примерно 5-100 мг вещества и более предпочтительно 10-80 мг. Лекарственную форму можно вводить вместе с другими подходящими лекарствами, такими как антибактериальное соединение(я), НСПВС, агенты, стимулирующие моторику, и/или антациды. Примеры Следующие примеры описывают изобретение более детально без ограничения его. Пример 1 Драже однократной дозы с импульсным замедленным высвобождением с нанесенным слоем, содержащие магниевую соль S-омепразола (содержание активного вещества в драже приблизительно 44 мг/г). Приготовление материала ядра (сферы с нанесенным слоем лекарственного средства) Содержащая лекарственное средство суспензия была приготовлена в соответствии с нижеприведенным составом: Мg-соль S-омепразола – 100 г HPMC, 6 cps – 15 г Полисорбат 80 – 2 г Очищенная вода – 323 г НРМС растворили в воде при перемешивании с последующим добавлением Полисорбата 80 и лекарственного средства. Данную суспензию нанесли методом распыления на 290 г сахарных сфер (нонпарель) в псевдоожиженном слое. Масса полученного продукта составляла 395 г. Нанесение разбухающего слоя Суспензию (свободную от воды), содержащую разбухающие в воде вещества, приготовили в соответствии со следующим составом: Гидроксипропилцеллюлоза с низкой степенью замещения (L-HPC) – 162 г Гидроксипропилцеллюлоза LF (HPC-LF) – 74 г Тальк – 354 г ЕtOН (99,5%) – 3100 г HPC-LF растворили в этаноле во время перемешивания, затем добавили тальк и разбухающий агент L-HPC. Данную суспензию нанесли методом распыления на 175 г материала ядра из вышеописанного в Wurster с псевдоожиженным слоем. Масса полученного продукта составляла 711 г. Нанесение слоя, контролирующего время запаздывания (полупроницаемой мембраны) Покрывающую суспензию готовят в соответствии со следующей рецептурой: Этилцеллюлоза, 10 cps – 10 г Тальк – 23 г ЕtOН (99,5%) – 1000 г Этилцеллюлозу растворили в этаноле во время перемешивания, затем добавили тальк. Нанесение данной суспензии методом распыления на 150 г драже с нанесенным разбухающим слоем из вышеописанного (0,61-0,71 мм получены путем просеивания) осуществили в Wurster с псевдоожиженным слоем. Масса полученных драже составляла 176 г. Драже (соответствующие приблизительно 10 мг активного вещества) анализировали с использованием аппарата для растворения 2 (лопастной) Фармакопеи США и работу выполняли при 100 оборотах в минуту, 37oС и с фосфатным буфером рН 6,8. За растворением активного вещества следили путем регистрации оптической плотности при 292 нм в буферном растворе, используя 0,5 см проточную компактную ячейку. Профиль растворения, измеренный при 292 нм, показан на фиг.1. Пример 2 Драже однократной дозы с импульсным замедленным высвобождением с нанесенным слоем, содержащие магниевую соль S-омепразола (содержание активного вещества в драже приблизительно 43 мг/г). Приготовление материала ядра (сферы с нанесенным слоем лекарственного средства) Содержащая лекарственное средство суспензия была приготовлена в соответствии с нижеприведенным составом: Мg-соль S-омепразола – 100 г HPMC, 6 cps – 15 г Полисорбат 80 – 2 г Очищенная вода – 323 г НРМС растворили в воде во время перемешивания с последующим добавлением Полисорбата 80 и вещества. Данную суспензию нанесли методом распыления на 290 г сахарных сфер (нонпарель) в псевдоожиженном слое. После нанесения покрытия масса полученного продукта составляла 395 г. Нанесение разбухающего слоя Суспензию, свободную от воды, содержащую разбухающие в воде вещества, приготовили в соответствии со следующим составом: Гидроксипропилцеллюлоза с низкой степенью замещения (L-HPC) – 162 г Гидроксипропилцеллюлоза LF (HPC-LF) – 74 г Тальк – 354 г ЕtOН (99,5%) – 3100 г HPC-LF растворили в этаноле во время перемешивания, затем добавили тальк и разбухающий агент L-HPC. Данную суспензию нанесли методом распыления на 175 г драже из вышеописанного в Wurster с псевдоожиженным слоем. Масса полученного продукта составляла 711 г. Нанесение слоя, контролирующего время запаздывания (полупроницаемой мембраны) 100 г драже с нанесенным разбухающим слоем, полученных выше, покрывали нижеописанной суспензией, чтобы получить слой, контролирующий время запаздывания: Этилцеллюлоза, 10 cps – 8 г Тальк – 9 г Мg-стеарат – 2 г ЕtOН (99,5%) – 620 г Данную суспензию приготовили путем растворения этилцеллюлозы в этаноле во время перемешивания, затем добавили остальные соединения. Нанесение данной суспензии методом распыления на драже осуществили в Wurster с псевдоожиженным слоем. Масса полученных драже составляла 116 г. Драже анализировали как описано в Примере 1. Профиль растворения показан на фиг.2. Пример 3 Драже однократной дозы с нанесенным слоем, то есть драже однократной дозы с импульсным замедленным высвобождением с энтеросолюбильным покрытием, содержащие магниевую соль S-омепразола (содержание активного вещества в драже приблизительно 37 мг/г). Нанесение слоя энтеросолюбильного покрытия Драже из Примера 1 покрывали энтеросолюбильным покрытием в псевдоожиженном слое с помощью покрывающей дисперсии в соответствии с нижеуказанным: Eudragit L30 D-55 (30% мас./мас. дисперсия) – 73,3 г Триэтилцитрат (ТЕС) – 6,6 г Моностеарат глицерина (GMS) – 0,3 г Полисорбат 80 – 0,03 г Очищенная вода – 40,4 г Гомогенную покрывающую дисперсию приготовили путем диспергирования полисорбата 80 и моностеарата глицерина в воде. Триэтилцитрат растворили в дисперсии Eudragit и после этого эти две дисперсии смешали для получения покрывающей дисперсии. Покрывающую дисперсию нанесли на 120 г драже из Примера 1, используя Wurster с псевдоожиженным слоем. Масса драже с нанесенным слоем составляла 140 г. Драже (соответствующие приблизительно 10 мг активного вещества) анализировали с использованием аппарата для растворения 2 (лопастной) Фармакопеи США и работу выполняли при 100 оборотах в минуту и 37oС. Сначала драже погружали в 0,1 М HCl на 2 часа (рН 1,2), после чего добавляли компоненты фосфатного буфера для получения рН 6,8. Профиль растворения регистрировали как описано в Примере 1, и он показан на фиг.3. Драже проверяли в отношении устойчивости к кислоте. После выдерживания в 0,1 М HCl в течение двух часов 96% активного вещества осталось интактным. Пример 4 Драже однократной дозы с нанесенным слоем, то есть драже однократной дозы с импульсным замедленным высвобождением с энтеросолюбильным покрытием, содержащие магниевую соль омепразола (содержание активного вещества в драже приблизительно 35 мг/г). Приготовление материала ядра (сферы с нанесенным слоем лекарственного средства) Содержащая лекарственное средство суспензия была приготовлена в соответствии с нижеприведенным составом: Мg-соль омепразола – 100 г HPMC, 6 cps – 15 г Полисорбат 80 – 2 г Очищенная вода – 323 г НРМС растворили в воде во время перемешивания с последующим добавлением Полисорбата 80 и лекарственного средства. Данную суспензию нанесли методом распыления на 290 г сахарных сфер (нонпарель) в псевдоожиженном слое. После нанесения покрытия масса полученного продукта составляла 395 г. Нанесение разбухающего слоя Суспензию (свободную от воды), содержащую разбухающие в воде вещества, приготовили в соответствии со следующим составом: Гидроксипропилцеллюлоза с низкой степенью замещения (L-НРС) – 162 г Гидроксипропилцеллюлоза LF (HPC-LF) – 74 г Тальк – 354 г ЕtOН (99,5%) – 3100 г HPC-LF растворили в этаноле во время перемешивания, затем добавили тальк и разбухающий агент L-HPC. Данную суспензию нанесли методом распыления на 175 г материала ядра из вышеописанного в Wurster с псевдоожиженным слоем. Масса полученного продукта составляла 711 г. Нанесение слоя, контролирующего время запаздывания (полупроницаемой мембраны) 120 г драже с нанесенным разбухающим слоем (фракция 0,61 мм – 0,71 мм, полученная путем просеивания), полученные выше, покрывали нижеописанной суспензией: Этилцеллюлоза, 10 cps – 8 г Тальк – 18 г ЕtOН (99,5%) – 810 г Суспензию приготовили путем растворения этилцеллюлозы в этаноле во время перемешивания, затем добавили тальк. Данную суспензию нанесли методом распыления на драже в Wurster с псевдоожиженным слоем. Масса полученного продукта составляла 137 г. Нанесение слоя энтеросолюбильного покрытия 120 грамм драже с предыдущей вышеописанной стадии покрывали раствором энтеросолюбильного покрытия в соответствии с указанным ниже: НРМСР (HP-55) – 33 г Цетанол – 2,4 г Ацетон – 353 г ЕtOН (99,5%) – 151 г Покрывающий раствор приготовили путем растворения НРМСР и цетанола в смеси растворителей во время перемешивания. Покрывающий раствор наносили в Wurster с псевдоожиженным слоем. Масса драже с нанесенным слоем составляла 149 г. Драже с нанесенным слоем проверяли в отношении устойчивости к кислоте в 0,1 М HCl. Устойчивость к кислоте составляла 97%. Пример 5 Таблетки однократной дозы с нанесенным слоем, то есть таблетки однократной дозы с импульсным замедленным высвобождением с энтеросолюбильным покрытием, содержащие магниевую соль S-омепразола (содержание активного вещества в таблетке приблизительно 16 мг/г). Гранулы Гранулы для гомогенных ядер таблеток приготовили в соответствии со следующим составом: Мg-соль S-омепразола – 229 г Микрокристаллическая целлюлоза, Avicel pH 101 – 151 г Микрокристаллическая целлюлоза, Avicel рН 102 sp. крупнозернистого сорта – 400 г L-HPC – 256 г PVP-XL – 302 г Лаурилсульфат натрия (SLS) – 30 г Очищенная вода – 1060 г Раствор для гранулирования получали путем растворения SLS в 460 г очищенной воды. Вышеуказанные порошки смешивали с получением смеси, после чего добавляли раствор равномерной струей. После этого приблизительно 600 г воды добавили к этой массе в течение непрерывного перемешивания с получением удовлетворительной консистенции. Данную массу высушивали в сушильном шкафу при 50oС в течение ночи. Получение ядер таблеток После протирания через 1,0 мм сито полученные гранулы смешивали со смазывающим веществом для таблеток, хлоридом натрия и дополнительным количеством разбухающего вещества в соответствии со следующим составом: Гранулы для ядра таблетки – 400 г Хлорид натрия (проходящий 0,3 мм) – 80 г Стеарилфумарат натрия (Pruv  ) – 8 г ) – 8 гПоперечно-связанный поливинилпирролидон (PVP-XL) – 20 г Смешивание осуществляли до гомогенности в смесителе Кенвуда. Данную смесь прессовали в таблетки с диаметром 6 мм, имеющие среднюю массу 126 мг, на таблеточной машине с одним пуансоном (Diaf). Нанесение слоя, контролирующего время запаздывания (полупроницаемой мембраны) Таблетки из предыдущей стадии покрывали покрывающей суспензией следующего состава в аппарате для нанесения покрытия Wurster с псевдоожиженным слоем: ЕtOН 99,5% (мас./об.) – 291 мас.ч. Этилцеллюлоза N-10 – 11 мас.ч. Тальк, микронизированный – 7 мас.ч. Сумма: – 309 мас.ч. 200 грамм таблеток подвергали обработке и нанесение покрытия продолжали до тех пор, пока средняя масса таблетки не составила 134 мг. Нанесение слоя энтеросолюбильного покрытия Таблетки, полученные на предыдущей стадии, покрывали слоем энтеросолюбильного покрытия в том же самом оборудовании, что использовали на предыдущей стадии нанесения покрытия. Покрывающий раствор имел следующий состав: Фталат гидроксипропилметилцеллюлозы (HP-55  ) – 16 мас.ч.
Цетанол – 1 мас.ч.
Ацетон – 151 мас.ч.
Этанол (95% мас./об.) – 65 мас.ч.
Сумма: – 233 мас.ч.
Подвергали обработке 100 г таблеток и нанесение покрытия продолжали до тех пор, пока средняя масса таблетки не составила 148 мг.
Отдельные таблетки анализировали, используя аппарат для растворения 2 (лопастной) Фармакопеи США, снабженный стационарными корзинками, и работу выполняли при 100 оборотах в минуту и 37oС. Сначала таблетки предварительно выдерживали в 0,1 М HCl в течение 2 часов (рН 1,2), после чего среду растворения заменяли фосфатным буфером рН 6,8.
Полученный профиль растворения регистрировали как описано в Примере 1, и его можно видеть на фиг.4.
Пример 6 ) – 16 мас.ч.
Цетанол – 1 мас.ч.
Ацетон – 151 мас.ч.
Этанол (95% мас./об.) – 65 мас.ч.
Сумма: – 233 мас.ч.
Подвергали обработке 100 г таблеток и нанесение покрытия продолжали до тех пор, пока средняя масса таблетки не составила 148 мг.
Отдельные таблетки анализировали, используя аппарат для растворения 2 (лопастной) Фармакопеи США, снабженный стационарными корзинками, и работу выполняли при 100 оборотах в минуту и 37oС. Сначала таблетки предварительно выдерживали в 0,1 М HCl в течение 2 часов (рН 1,2), после чего среду растворения заменяли фосфатным буфером рН 6,8.
Полученный профиль растворения регистрировали как описано в Примере 1, и его можно видеть на фиг.4.
Пример 6Таблетки множественной дозы с нанесенным слоем, то есть таблетки множественной дозы с двойным импульсным высвобождением с энтеросолюбильным покрытием (содержание активного вещества в таблетке приблизительно 2 х 15 мг). Гранулы Гранулы для ядер таблеток приготовили в соответствии со следующим составом: Мg-соль S-омепразола – 229 г Микрокристаллическая целлюлоза, Avicel pH 101 – 151 г Микрокристаллическая целлюлоза, Avicel pH 102 sp. крупнозернистого сорта – 400 г L-HPC – 256 г PVP-XL – 302 г Лаурилсульфат натрия (SLS) – 30 г Очищенная вода – 1060 г Раствор для гранулирования получали путем растворения SLS в 460 г очищенной воды. Вышеуказанные порошки смешивали с получением смеси, после чего добавляли раствор равномерной струей. После этого приблизительно 600 г воды добавили к этой массе в течение непрерывного перемешивания с получением удовлетворительной консистенции. Данную массу высушивали в сушильном шкафу при 50oС в течение ночи. Приготовление ядер таблеток После перемалывания через 1,0 мм сито полученные гранулы смешивали со смазывающим веществом для таблеток, хлоридом натрия и дополнительным количеством разбухающего вещества в соответствии со следующим составом: Гранулы для гомогенного ядра таблетки – 400 Хлорид натрия (проходящий 0,3 мм) – 80 Стеарилфумарат натрия (Pruv  ) – 8 ) – 8Поперечно-связанный поливинилпирролидон (PVP-XL) – 20 Смешивание осуществляли до гомогенности в смесителе Кенвуда. Данную смесь прессовали в таблетки с диаметром 6 мм, имеющие среднюю массу 126 мг, на таблетировочной машине с одним пуансоном (Diaf). Нанесение слоя, контролирующего время запаздывания (полупроницаемой мембраны) Таблетки с предыдущей стадии покрывали покрывающей суспензией следующего состава в аппарате для нанесения покрытия Wurster с псевдоожиженным слоем: ЕtOН 99,5% (мас./об.) – 291 мас.ч. Этилцеллюлоза N-10 – 11 мас.ч. Тальк, микронизированный – 7 мас.ч. Сумма: – 309 мас.ч. 200 грамм таблеток подвергали обработке и нанесение покрытия продолжали до тех пор, пока средняя масса таблетки не составила 134 мг. Нанесение слоя, содержащего лекарственное средство Таблетки, полученные на предыдущей стадии, покрывали в том же самом оборудовании, которое описано выше, покрывающей суспензией следующего состава: Мg-соль S-омепразола – 20 мас.ч. Гидроксипропилметилцеллюлоза 6 cps – 13 мас.ч. Этанол 99% – 128 мас.ч. Вода очищенная – 128 мас.ч. Сумма: – 289 мас.ч. Подвергали обработке 99 г таблеток и нанесение покрытия продолжали до тех пор, пока средняя масса таблетки не составила 162 мг. Нанесение слоя энтеросолюбильного покрытия Таблетки, полученные на предыдущей стадии, покрывали слоем энтеросолюбильного покрытия в том же самом оборудовании, которое использовали на предыдущей стадии нанесения покрытия. Покрывающий раствор имел следующий состав: Фталат гидроксипропилметилцеллюлозы (HP-55) – 16 мас.ч. Цетанол – 1 мас.ч. Ацетон – 153 мас.ч. Этанол (95% мас./об.) – 65 мас.ч. Сумма: – 235 мас.ч. Подвергали обработке 119 г таблеток и нанесение покрытия продолжали до тех пор, пока средняя масса таблетки не составила 173 мг. Индивидуальные таблетки анализировали, используя аппарат для растворения 2 (лопастной) Фармакопеи США, снабженный стационарными ядрозинами, и работу выполняли при 100 оборотах в минуту и 37oС. Сначала таблетки предварительно выдерживали в 0,1 М HCl в течение 2 часов, после чего среду растворения заменяли фосфатным буфером рН 6,8. Полученный профиль растворения регистрировали как описано в Примере 1, и его можно видеть на фиг.5. Проверяли устойчивость таблеток к кислоте и результат составил 98%. Пример 7 Препарат множественной дозы в форме капсулы, содержащий (2 х 20) мг омепразола в форме драже с энтеросолюбильным покрытием, смешанных с таблеткой с энтеросолюбильным покрытием с замедленным высвобождением. Нанесение слоя суспензии Магниевая соль омепразола – 5 кг Ядра сахарных сфер (0,25-0,355 мм диам.) – 10 кг Гидроксипропилметилцеллюлоза – 0,8 кг Очищенная вода – 20 кг Разделяющий слой Ядра, содержащие лекарственное средство (согласно описанному выше) – 14,6 кг Гидроксипропилцеллюлоза – 1,5 кг Тальк – 2,5 кг Стеарат магния – 0,2 кг Очищенная вода – 29 кг Энтеросолюбильное покрытие Драже (см. выше) – 9 кг Сополимер метакриловой кислоты (30% суспензия) – 15 кг Триэтилцитрат – 1,4 кг Моно- и диглицериды (NF) – 0,2 кг Полисорбат 80 – 0,02 кг Вода очищенная – 9 кг Сверх-покрытие Драже с энтеросолюбильным покрытием – 9 кг Гидроксипропилметилцеллюлоза – 0,2 кг Мg-Стеарат – 0,005 кг Очищенная вода – 3,6 кг Нанесение слоя суспензии осуществляли в аппарате с псевдоожиженным слоем. Магниевую соль омепразола наносили методом распыления на инертные ядра сахарных сфер из водной суспензии, содержащей растворенное связующее вещество. Полученный материал ядра покрывали нижним покрытием с использованием раствора гидроксипропилцеллюлозы, содержащего тальк и стеарат магния, в аппарате с псевдоожиженным слоем. Энтеросолюбильное покрытие, состоящее из сополимера метакриловой кислоты, моно- и диглицеридов, триэтилцитрата и полисорбата, наносили методом распыления на драже с нижним покрытием в аппарате с псевдоожиженным слоем. В аппарате того же типа драже с энтеросолюбильным покрытием покрывали суспензией гидроксипропилметилцеллюлоза/Mg-стеарат. Драже с внешним покрытием разделяли по крупности путем просеивания, чтобы они проходили 0,71 мм. Данный продукт проанализировали и обнаружили, что он содержит 209 мг/г Мg-омепразола. Таблетки однократной дозы с нанесенным слоем, то есть таблетки с замедленным высвобождением с энтеросолюбильным покрытием, содержащие магниевую соль омепразола (содержание активного вещества в таблетке приблизительно 16 мг). Гранулы Гранулы для ядер таблеток готовили в соответствии со следующим составом (массовые части): Мg соль омепразола – 229 г Микрокристаллическая целлюлоза, Avicel pH 101 – 145 г Микрокристаллическая целлюлоза, Avicel pH 102 sp. крупнозернистого сорта – 400 г L-HPC – 251 г PVP-XL – 302 г Гидроксиметилцеллюлоза 6 cps – 11 г Лаурилсульфат натрия (SLS) – 30 г Очищенная вода – 960 г Раствор для гранулирования готовили путем растворения SLS в 460 г очищенной воды. Вышеуказанные порошки смешивали с получением смеси, после чего добавляли раствор равномерной струей. После этого приблизительно 500 г воды добавили к этой массе при непрерывном перемешивании с получением удовлетворительной консистенции. Данную массу высушивали в сушильном шкафу при 50oС в течение ночи. Получение таблеточных ядер После протирания через 1,0 мм сито полученные гранулы смешивали со смазывающим веществом для таблеток, хлоридом натрия и дополнительным количеством разбухающего вещества в соответствии со следующим составом: Гранулы для ядра таблетки – 400 г Хлорид натрия (проходящий 0,3 мм) – 80 г Стеарил фумарат натрия (Pruv  ) – 8 г ) – 8 гПоперечно-связанный поливинилпирролидон (PVP-XL) – 20 г Смешивание осуществляли до гомогенности в смесителе Кенвуда. Данную смесь прессовали в таблетки диаметром 6 мм, имеющие среднюю массу 126 мг, на таблеточной машине с одним пуансоном (Diaf). Нанесение слоя, контролирующего время запаздывания (полупроницаемой мембраны) Таблетки с предыдущей стадии покрывали покрывающей суспензией следующего состава в аппарате для нанесения покрытия Wurster с псевдоожиженным слоем: EtOH 99,5% (мас./об.) – 291 мас.ч. Этилцеллюлоза N-10 – 11 мас.ч. Тальк, микронизированный – 7 мас.ч. Сумма: – 309 мас.ч. Подвергали обработке 200 грамм таблеток и нанесение покрытия продолжали до тех пор, пока средняя масса таблетки не составила 134 мг. Нанесение слоя энтеросолюбильного покрытия Таблетки, полученные на предыдущей стадии, покрывали слоем энтеросолюбильного покрытия в том же самом оборудовании, которое использовали на предыдущей стадии нанесения покрытия. Покрывающий раствор имел следующий состав: Фталат гидроксипропилметилцеллюлозы (HP-55  ) – 16 мас.ч.
Цетанол – 1 мас.ч.
Ацетон – 151 мас.ч.
Этанол (95% мас./об.) – 65 мас.ч.
Сумма: – 233 мас.ч.
100 г таблеток подвергали обработке и нанесение покрытия продолжали до тех пор, пока средняя масса таблетки не составила 148 мг.
Заполнение капсулы ) – 16 мас.ч.
Цетанол – 1 мас.ч.
Ацетон – 151 мас.ч.
Этанол (95% мас./об.) – 65 мас.ч.
Сумма: – 233 мас.ч.
100 г таблеток подвергали обработке и нанесение покрытия продолжали до тех пор, пока средняя масса таблетки не составила 148 мг.
Заполнение капсулы0,10 г драже, полученных выше, и одну из таблеток с нанесенным слоем, полученных выше, загружали в твердую желатиновую капсулу размера 1. Наилучший способ практического применения изобретения соответствует описанию, приведенному в Примере 6. Формула изобретения
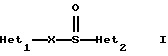 где Het1 представляет собой 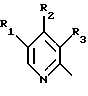 или 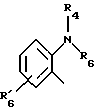 Het2 представляет собой 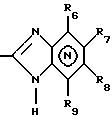 или 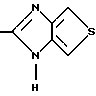 X= 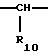 или 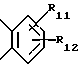 где N в бензимидазольной группировке означает, что один из кольцевых атомов углерода, замещенных R6-R9, возможно может быть заменен на атом азота без каких-либо заместителей; R1, R2 и R3 являются одинаковыми или разными и выбраны из группы, состоящей из водорода, алкила, алкокси, замещенного фтором алкокси, алкилтио, алкоксиалкокси, диалкиламино, пиперидино, морфолино, галогена, фенила и фенилалкокси; R4 и R5 являются одинаковыми или разными и выбраны из группы, состоящей из водорода, алкила и арилалкила; R’6 выбран из группы, состоящей из водорода, галогена, трифторметила, алкила и алкокси; R6-R9 являются одинаковыми или разными и выбраны из группы, состоящей из водорода, алкила, алкокси, галогена, галогеноалкокси, алкилкарбонила, алкоксикарбонила, оксазолинила и трифторалкила, или соседние группы R6-R9 образуют кольцевые структуры; R10 представляет собой водород или образует алкиленовую цепь вместе с R3; R11 и R12 являются одинаковыми или разными и выбраны из группы, состоящей из водорода, галогена и алкила. 2. Лекарственная форма по п. 1, где ингибитор H+, K+-АТФазы представляет собой омепразол, щелочную соль омепразола, (-)-энантиомер омепразола или щелочную соль (-)-энантиомера омепразола. 3. Лекарственная форма по п. 2, где щелочная соль представляет собой магниевую соль. 4. Лекарственная форма по п. 1, где ингибитор H+, K+-АТФазы представляет собой лансопразол, щелочную соль лансопразола, единственный энантиомер лансопразола или щелочную соль этого единственного энантиомера. 5. Лекарственная форма по п. 1, где части, высвобождающие ингибитор, составляют единицу, содержащую а) материал ядра, содержащий порцию ингибитора H+, K+-АТФазы, разбухающее в воде вещество и, возможно, фармацевтически приемлемые эксципиенты, и б) следующую последовательность слоев, покрывающих материал ядра: б1) полупроницаемая для водного раствора мембрана, б2) по меньшей мере один дополнительный слой, содержащий другую порцию ингибитора H+, K+-АТФазы, и б3) слой энтеросолюбильного покрытия. 6. Лекарственная форма по п. 1, где части, высвобождающие ингибитор, составляют единицу, содержащую а) материал ядра, содержащий одну порцию ингибитора H+, K+-АТФазы и, возможно, фармацевтически приемлемые эксципиенты, и б) следующую последовательность слоев, покрывающих материал ядра: б1) разбухающий слой, содержащий разбухающее в воде вещество, б2) полупроницаемая для водного раствора мембрана, б3) по меньшей мере один дополнительный слой, содержащий другую порцию ингибитора H+, K+-АТФазы, и б4) слой энтеросолюбильного покрытия. 7. Лекарственная форма по п. 1, где указанные части, высвобождающие ингибитор, находятся в форме единиц, выбранных из группы, состоящей из драже, таблеток и их комбинации. 8. Лекарственная форма по п. 26 или 27, где один или более чем один дополнительный слой, содержащий дополнительную порцию ингибитора H+, K+-АТФазы, нанесен под слой энтеросолюбильного покрытия части (а), высвобождающей ингибитор. 9. Лекарственная форма по п. 1, где последовательные промежутки времени разделены интервалом от 0,5 и до 4 ч. 10. Лекарственная форма по любому из пп. 5-7, 26 или 27, где ингибитор H+, K+-АТФазы находится в смеси со щелочной добавкой. 11. Лекарственная форма по любому из пп. 5, 6, 26 или 27, где разбухающее в воде вещество выбрано из группы, состоящей из гидроксипропилцеллюлозы с низкой степенью замещения, полеречно-связанного поливинилпирролидона, поперечно-связанной натрий-карбоксиметилцеллюлозы и натрийкрахмалгликолята. 12. Лекарственная форма по п. 11, где полупроницаемая для водного раствора мембрана представляет собой разрушающуюся полупроницаемую мембрану. 13. Лекарственная форма по п. 11, где масса полупроницаемой для водного раствора мембраны составляет от 0,5 до 25%, в расчете на суммарную массу материала ядра и разбухающего в воде вещества или разбухающего слоя. 14. Лекарственная форма по п. 26 или 27, где части, высвобождающие ингибитор, загружены в капсулу. 15. Лекарственная форма по п. 26 или 27, где части, высвобождающие ингибитор, смешаны вместе с фармацевтически приемлемыми эксципиентами и спрессованы в таблетированную лекарственную форму составных единиц. 16. Лекарственная форма по п. 5 или 6, где разделяющий слой находится под слоем энтеросолюбильного покрытия. 17. Лекарственная форма по п. 5 или 6, где дополнительно материал ядра содержит зернышко с нанесенным слоем ингибитора H+, K+-АТФазы. 18. Драже или таблетка с нанесенным слоем, представляющая собой лекарственную форму по п. 5 или 6. 19. Способ получения фармацевтической лекарственной формы с энтеросолюбильным покрытием, содержащей ингибитор H+, K+-АТФазы и имеющей часть, высвобождающую ингибитор немедленно, и по меньшей мере одну часть, высвобождающую ингибитор с задержкой, причем эта лекарственная форма дает дискретное высвобождение ингибитора H+, K+-АТФазы в течение по меньшей мере двух отдельных промежутков времени, при котором осуществляют следующие стадии: а) смешивают порцию ингибитора H+, K+-АТФазы, разбухающее в воде вещество и, возможно, фармацевтически приемлемые эксципиенты с получением материала ядра и б) на этот материал ядра наносят последовательно следующие слои: б1) полупроницаемую для водного раствора мембрану, б2) слой, содержащий другую порцию ингибитора H+, K+-АТФазы, и б3) слой энтеросолюбильного покрытия, с получением указанной лекарственной формы. 20. Способ получения фармацевтической лекарственной формы с энтеросолюбильным покрытием, содержащей ингибитор H+, K+-АТФазы и имеющей часть, высвобождающую ингибитор немедленно, и по меньшей мере одну часть, высвобождающую ингибитор с задержкой, причем эта лекарственная форма дает дискретное высвобождение ингибитора H+, K+-АТФазы в течение по меньшей мере двух отдельных промежутков времени, при котором осуществляют следующие стадии: а) порции ингибитора H+, K+-АТФазы, возможно смешанного с фармацевтически приемлемыми эксципиентами, придают форму с получением материала ядра и б) на этот материал ядра наносят последовательно следующие слои: б1) разбухающий слой, содержащий разбухающее в воде вещество, б2) полупроницаемую для водного раствора мембрану, б3) слой, содержащий другую порцию ингибитора H+, K+-АТФазы, и б4) слой энтеросолюбильного покрытия, с получением указанной лекарственной формы. 21. Способ получения лекарственной формы по п. 19 или 20, при котором дополнительный слой, содержащий другую порцию ингибитора H+, K+-АТФазы, наносят до того как наносят слой энтеросолюбильного покрытия. 22. Фармацевтическая лекарственная форма с энтеросолюбильным покрытием по любому из пп. 1-17 для применения в медицине. 23. Лекарственная форма по любому из пп. 1-17 для производства лекарства для ингибирования секреции желудочной кислоты. 24. Лекарственная форма по любому из пп. 1-17 для производства лекарства для лечения желудочно-кишечных расстройств, связанных с избыточной секрецией кислоты. 25. Лекарственная форма по п. 1, где ингибитор H+, K+-АТФазы представляет собой щелочную соль, единственный энантиомер или щелочную соль единственного энантиомера соединения формулы I. 26. Лекарственная форма по п. 7, где части, высвобождающие ингибитор, в сущности представляют собой следующее: а) часть, высвобождающую ингибитор, содержащую соответственно объединенный первый материал ядра, который содержит порцию ингибитора H+, K+-АТФазы, разбухающее в воде вещество и, возможно, фармацевтически приемлемые эксцепиенты, причем этот первый материал ядра покрыт в указанной последовательности полупроницаемой для водного раствора мембраной и соответственно присоединенным первым слоем энтеросолюбильного покрытия, и б) часть, высвобождающую ингибитор, содержащую соответственно объединенный второй материал ядра, который содержит другую порцию ингибитора H+, K+-АТФазы и, возможно, фармацевтически приемлемые эксцепиенты, причем этот второй материал ядра покрыт соответственно присоединенным вторым слоем энтеросолюбильного покрытия. 27. Лекарственная форма по п. 7, где части, высвобождающие ингибитор, в сущности представляют собой следующее: а) часть, высвобождающую ингибитор, содержащую соответственно объединенный первый материал ядра, который содержит порцию ингибитора H+, K+-АТФазы и, возможно, фармацевтически приемлемые эксцепиенты, причем этот первый материал ядра покрыт в указанной последовательности разбухающим слоем, содержащим разбухающее в воде вещество, полупроницаемой для водного раствора мембраной и соответственно присоединенным первым слоем энтеросолюбильного покрытия, и б) часть, высвобождающую ингибитор, содержащую соответственно объединенный второй материал ядра, который содержит другую порцию ингибитора H+, K+-АТФазы и, возможно, фармацевтически приемлемые эксцепиенты, причем этот второй материал ядра покрыт соответственно присоединенным вторым слоем энтеросолюбильного покрытия. 28. Лекарственная форма по п. 26 или 27, где разделяющий слой находится по меньшей мере под одним из слоев энтеросолюбильного покрытия. 29. Лекарственная форма по п. 26 или 27, где дополнительно по меньшей мере один материал ядра содержит зернышко с нанесенным слоем ингибитора H+, K+-АТФазы. 30. Драже или таблетка с нанесенным слоем по п. 18, где по меньшей мере один дополнительный слой, содержащий другую порцию ингибитора H+, K+-АТФазы, нанесен под слой энтеросолюбильного покрытия. 31. Лекарственная форма по п. 1, где указанные по меньшей мере два последовательных промежутка времени разделены интервалом от 0,5 и до 8 часов. 32. Способ ингибирования секреции желудочной кислоты, при котором пациенту, нуждающемуся в этом, вводят пероральную фармацевтическую лекарственную форму по любому из пп. 1-18 и 22-31. 33. Способ лечения желудочно-кишечных расстройств, связанных с избыточной секрецией кислоты, при котором пациенту, нуждающемуся в этом, вводят пероральную фармацевтическую лекарственную форму по любому из пп. 1-18 и 22-31. РИСУНКИ
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 18.12.2008
Извещение опубликовано: 20.07.2010 БИ: 20/2010
|
||||||||||||||||||||||||||
