Патент на изобретение №2205012
|
||||||||||||||||||||||||||
(54) ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ ДЛЯ СУШКИ ВЫМОРАЖИВАНИЕМ
(57) Реферат: Изобретение относится к медицине и касается фармацевтической композиции, содержащей нуклеотидный аналог, маннит и модифицирующую добавку, которая является хлористым натрием или полиолом, пригодной для сушки вымораживанием. Композиция обладает повышенной стабильностью. 3 с. и 10 з.п. ф-лы, 4 табл. Данное изобретение относится к фармацевтической композиции, пригодной для сушки вымораживанием, и к способу получения композиции. Сушка вымораживанием является хорошо известным способом, применяемым для получения устойчивых при хранении композиций фармацевтических соединений, которые в противном случае претерпевают разложение, если их хранят в присутствии воды, например, из-за диспропорционирования и/или гидролиза. Типичный цикл сушки вымораживанием состоит из четырех стадий. Вымораживание композиции соединения, подлежащего сушке вымораживанием, является первичным циклом сушки, который включает применение вакуума и достаточного тепла для сублимации льда, присутствующего в композиции; второй цикл сушки представляет удаление любой остаточной воды и затем извлечение высушенной вымораживанием композиции. Этот способ является дорогостоящим, так как требует длительного времени и низкой температуры и вакуума. Низкая температура необходима, поскольку вакуум применяют при температуре, ниже эвтектической температуры для смесей кристаллических веществ или ниже температуры стеклования или температуры оседания (сжимания) аморфных смесей. Это обеспечивает испарение присутствующей воды без прохождения через жидкое состояние и условия, при которых аморфные смеси не оседают. Осевшие аморфные смеси неэффективны, так как трудно восстанавливаются и могут быть нестабильными. Для сохранения низкой стоимости предпочтительно, чтобы температура оседания или эвтектическая температура были не слишком низкими для того, чтобы снизить стоимость охлаждения. Более высокая температура оседания или эвтектическая температура также благоприятны, поскольку ускоряется испарение, что снижает продолжительность использования вакуума. Подбираются композиции, пригодные для сушки вымораживанием, которые образуют стабильный продукт и для которых температура оседания или эвтектическая температура не очень низкая. В соответствии с первым аспектом изобретения предлагается фармацевтическая композиция, содержащая нуклеотидный аналог, маннит и модифицирующую добавку, представляющую собой хлористый натрий или полиол. Далее изобретение предлагает фармацевтическую композицию в форме высушенной вымораживанием, в форме, высушенной распылением, или в форме, высушенной в вакууме, и в восставленной (повторно составленной) форме. Согласно изобретению также предлагается способ получения композиции по данному изобретению, который включает смешивание ингредиентов композиции, и либо их замораживание и высушивание замороженной смеси, либо их распыление (например, в нагретом воздухе). Неожиданно было обнаружено, что использование сочетания маннита и модифицирующей добавки в композициях по изобретению улучшает длительную стабильность композиций после сушки вымораживанием. Другим преимуществом использования такого сочетания является предотвращение разрушения или растрескивания ампул во время сушки вымораживанием. Нуклеотид представляет собой соединение, содержащее, пуриновое или пиримидиновое основание, присоединенное к пентосахару, где одна или более гидроксигрупп пентосахара фосфорилированы моно- или полифосфатом. Нуклеотидный аналог для применения в изобретении представляет собой в общем соединение, в котором одну или более из трех групп, которые содержат нуклеотид, модифицируют, например, присоединением одного или более заместителей и/или замещением одного или более скелетных атомов. Нуклеотид, используемый в изобретении, предпочтительно представляет собой нуклеотид из международной заявки WO 94/18216, то есть соединение формулы (1): 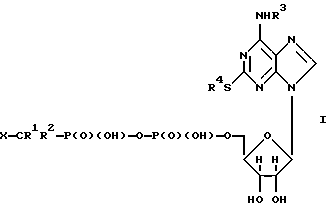 где R1 и R2 независимо представляют водород или галоген, R3 и R4 независимо представляют фенил, или C1-6-алкил, необязательно замещенный одним или более заместителями, выбранными из OR5, C1-балкилтио, NR6R7, фенила, COOR8 и галогена, R5, R6, R7 и R8 независимо представляют водород или C1-6-алкил, и Х представляет кислотную группу, или его фармацевтически приемлемую соль. Соединения формулы (I) могут существовать в таутомерной, энантиомерной и диастереомерной формах, все из которых включены в объем определения. Фармацевтически приемлемые соли соединений формулы (I) включают соли щелочных металлов, например соли натрия и калия; соли щелочноземельных металлов, например соли кальция и магния; соли элементов группы III, например соли алюминия; и соли аммония. Соли с подходящими органическими основаниями, например соли с гидроксиламином; низшими алкиламинами, например метиламином или этиламином; замещенными низшими алкиламинами, например гидроксизамещенными алкиламинами; или с моноциклическими азотными гетероциклическими соединениями, например пиперидином или морфолином; и соли с аминокислотами, например с аргинином, лизином и так далее, или их N-алкильное производное; или с аминосахаром, например N-метил-D-глюкамином или глюкозамином. Предпочтительны нетоксичные физиологически приемлемые соли, хотя другие соли также полезны, например, при выделении или очистке продукта. Алкильные группы в определениях соединений формулы (I) включают нормальные, разветвленные, или циклические, насыщенные или ненасыщенные алкильные группы. Арильные группы в определениях соединений формулы (I) включают как карбоциклические, так и гетероциклические группы. Группы могут содержать кольца или различное число С-атомов и могут быть конденсированными кольцевыми структурами. Конкретные карбоциклические арильные группы, которые могут быть упомянуты, представляют собой фенил и нафтил. Гетероарильные группы включают гетероциклы с азотом, кислородом или серой и могут содержать один или более гетероатомов. Примеры гетероциклов, содержащих только один гетероатом, включают пиррол, фуран, тиофен и пиридин. Группы, содержащие более одного гетероатома, включают пиразол, оксазол, тиазол, триазол, оксадиазол, тиадиазол и так далее. Галогены, которые в R1 и R2 могут представлять, включают F, Cl, Вr и I. Предпочтительно R1 и R2 являются одинаковыми и более предпочтительно представляют Cl. Предпочтительно R3 и R4 представляют C1-6-алкил, необязательно замещенный одним или более заместителями, выбранными из OR5, C1-6-алкилтио, MR6R7, фенила, COOR8 и галогена. Галогены, которыми могут быть замещены R3 и R4, включают Cl, Вr и I и особенно F. Особо предпочтительными являются соединения, в которых R3 представляет C1-6-алкил, необязательно замещенный C1-6-алкилтио. Конкретные алкильные группы, которые могут представлять R3, включают пропил и бутил, и особенно этил. Конкретные замещенные алкильные группы, которые могут представлять R3, включают 2-(метилтио)этил. Предпочтительно R4 представляет C1-6-алкил, необязательно замещенный одним или более, например тремя, атомами галогена. Конкретные группы, которые могут представлять R4, включают пропил и 3,3,3-трифторпропил. Кислотные группы, которые могут представлять X, включают кислоты Бренстеда-Лоури (Bronsted-Lowry), то есть группы, которые действуют как доноры протонов. Кислотная группа может быть моно- или поликислотной. Специфические кислотные группы, которые могут быть упомянуты, включают -Р(О)(ОН)2, -SО3Н и -СО2Н. Предпочтительно Х представляет -Р(O) (ОН)2. Наиболее предпочтительно, нуклеотидный аналог представляет собой N-[2-(метилтио)этил] -2-[(3,3,3-трифторпропил)тио] -5′-адениловую кислоту, моноангидрид с дихлорметиленбисфосфоновой кислотой или ее фармацевтически приемлемую соль, то есть соединение формулы (1а): 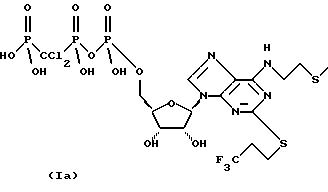 Наиболее предпочтительно соединения формулы (1а) находятся в форме четырехнатриевой соли. Соединения формулы (I) могут быть получены с использованием способов, описанных в международной заявке WO 94/18216. Соединения формулы (I) полезны, так как они проявляют фармакологическую активность у млекопитающих. В другом аспекте изобретение предлагает композицию, как определено в описании, для применения при лечении, в частности, для предотвращения агрегации тромбоцитов. Следовательно, композиции по изобретению действуют как антитромбозные вещества. Дополнительный аспект изобретения обеспечивает способ лечения нарушения агрегации тромбоцитов, включающий лечение субъекта, страдающего от упомянутого нарушения, терапевтически эффективным количеством фармацевтической композиции, как определено в описании. В еще одном аспекте изобретение обеспечивает применение фармацевтической композиции, как определено, в производстве лекарственного средства для лечения нарушения агрегации тромбоцитов. Модифицирующая добавка или агент предпочтительно представляет собой подходящий полиол. Это связано с тем, что при использовании в качестве модифицирующего агента NaCl профиль примесей оказывается неблагоприятным. Подходящий для использования в изобретении полиол представляет собой в основном многоатомный спирт с нормальной цепью или циклическую молекулу, содержащую одну или более кето- или альдегидных групп, которая, предпочтительно, является углеводом. Полиол, используемый в композиции согласно изобретению, предпочтительно представляет собой сорбит, лактозу, сахарозу, инозит, или трегалозу. Наиболее предпочтительно, модифицирующий агент является сорбитом, так как к удивлению было обнаружено, что продолжительная стабильность высушенных вымораживанием композиций, содержащих сорбит, улучшается по сравнению с такими композициями, содержащими другие модифицирущие агенты. Композиция согласно изобретению предпочтительно содержит маннит в качестве кристаллизующего агента. Подходящие композиции по изобретению содержат примерно 1% или более по весу маннита, например, 20-40%. Однако при использовании маннита возникает проблема, заключающаяся в том, что при сушке вымораживанием ампулы, содержащие смесь без модифицирующей добавки, имеют тенденцию к растрескиванию вследствие фазового перехода из аморфного состояния в кристаллическое. Количество модифицирующей добавки, предпочтительно достаточной для предотвращения от появления этого фазового перехода, составляет, например, примерно 3-25%. Подходящее количество можно легко определить посредством общепринятых аналитических способов, таких как дифференциальная сканирующая калориметрия. Однако количество модифицирующей добавки не должно быть таким большим, чтобы вызвать оседания (сжимание) композиции. Содержание воды в композиции предпочтительно составляет менее чем 5% по весу, более предпочтительно менее чем 2% по весу и наиболее предпочтительно менее чем 1% по весу. Фармацевтическая композиция согласно данному изобретению необязательно дополнительно содержит фармацевтически приемлемый эксципиент, например хелатообразователь или связывающий агент, антиоксидант, регулирующий тонус агент, модифицирующий рН агент и/или буферный агент, например, один или более из описанных в “Review of Excipients and pH’s for Parenteral Products used in the United States” Yu-Chang John Wang and R.R. Kowal, J. Parenteral Drug Association 34, 452-462 (1980). Способ получения фармацевтической композиции согласно данному изобретению осуществляют подходяще, используя любой из способов: лиофилизацию, вакуумную сушку или распылительную сушку, обычно используемых в фармацевтической области. В дополнительном аспекте изобретение предлагает способ получения фармацевтической композиции, как определено в описании, который включает смешивание нуклеотидного аналога, маннита и хлористого натрия или полиольной модифицирующей добавки и проведение процедуры лиофилизации смеси, вакуумной сушки смеси или распылительной сушки смеси. Предпочтительным способом по изобретению является ампульный способ сушки вымораживанием. Такой способ включает заполнение стерильных ампул стерильным отфильтрованным раствором композиции согласно изобретению. Стерильную пробку для сушки вымораживанием частично вставляют в ампулу, которую замораживают, например, при температуре от -30 до 40oС, и затем сушат в вакууме в замороженном состоянии. После высушивания пробку вставляют полностью перед удалением ампулы из установки для лиофилизации. При использовании, но перед введением, фармацевтические композиции согласно данному изобретению обычно восстанавливают в фармацевтически приемлемом разбавителе. Примеры фармацевтически приемлемых разбавителей включают воду, физиологический раствор и декстрозу. Предпочтительно в качестве разбавителя используют воду. В другом аспекте изобретение обеспечивает способ получения фармацевтической композиции, как определено, который включает смешивание нуклеотидного аналога, маннита и хлористого натрия или полиольной модифицирующей добавки с фармацевтически приемлемым разбавителем. Подходяще, раствор фармацевтической композиции по изобретению, полученный после восстановления и содержащий маннит, представляет собой изотонический раствор. В предпочтительном воплощении рН композиции по данному изобретению составляет от примерно 6 до примерно 10, более предпочтительно от примерно 7 до примерно 9. Фармацевтическую композицию согласно данному изобретению после восстановления предпочтительно вводят посредством инъекции внутривенно, подкожно или внутримышечно, предпочтительно внутривенно. Композиции согласно изобретению могут быть упакованы в подходяще приспособленные устройства для фармацевтического применения, например шприцы, пузырьки или ампулы, так чтобы добавление воды давало возможность получения in situ водного раствора активного ингредиента в форме, подходящей для немедленного введения пациенту. Такие устройства составляют дополнительный аспект изобретения. Далее изобретение более подробно описывается в следующих примерах. Пример 1 Высушенные вымораживанием композиции, перечисленные в таблице 1, получают следующим образом. Для каждой пробы 5 мл аликвоты показанного раствора заливают в ампулы и затем помещают в сублимационную сушилку Secfroid. Lyolab G. Их замораживают до -35oС, подвергают 2-часовому первичному высушиванию при -30oС, с последующим 33-часовым первичным высушиванием, во время которого температуру снижают до -35oС, и затем осуществляют вторичное высушивание в течение 12 часов при 35oС. Вакуум поддерживают при 100 мТор в течение первичного и вторичного высушивания. Пример 2 Высушенные вымораживанием композиции, перечисленные в таблице 3, получают следующим образом. Для каждой пробы 3 мл аликвоты показанного раствора заливают в ампулы и затем помещают в сублимационную сушилку Virtis Genesis 25EL. Их замораживают до -35oС, подвергают 2-чacoвoмy первичному высушиванию при -30oС, с последующим 25-28-часовым первичным высушиванием при 5oС, и затем проводят вторичное высушивание в течение 11 часов при 35oС. Вакуум поддерживают при 100 мТор во время первичного и вторичного высушивания. Затем каждую пробу хранят при 40oС и 75% относительной влажности, и имеющее место разложение представлено в таблице 4. Формула изобретения
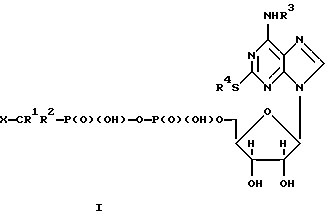 где R1 и R2 независимо представляют водород или галоген; R3 и R4 независимо представляют фенил или С1-6-алкил, необязательно замещенный одним или более заместителями, выбранными из OR5, С1-6 алкилтио, NR6R7, фенила, СООR8 и галогена, R5, R6, R7 и R8 независимо представляют водород или С1-6-алкил; Х представляет кислотную группу, или его фармацевтически приемлемую соль, маннит и модифицирующую добавку, представляющую собой хлористый натрий или полиол. 2. Фармацевтическая композиция по п. 1, где R1 и R2 являются галогеном, R3 является С1-6-алкилом, необязательно замещенным С1-6-алкилтио, R4 является С1-6алкилом, необязательно замещенным галогеном, и Х является -Р(О)(ОН)2, -SO3H или -СО2Н. 3. Фармацевтическая композиция по п. 1 или 2, где нуклеотид является N-[2-(метилтио)этил] -2-[(3,3,3-трифторпропил)тио] -5′-адениловой кислотой, моноангидридом с дихлорметиленбисфосфорной кислотой. 4. Фармацевтическая композиция по любому из пп. 1-3, где модифицирующая добавка представляет собой полиол. 5. Фармацевтическая композиция по любому из пп. 1-4, где модифицирующая добавка является сорбитом. 6. Фармацевтическая композиция по любому из пп. 1-5, которая содержит 1% по весу или более маннита. 7. Фармацевтическая композиция по любому из пп. 1-6, которая находится в форме, высушенной вымораживанием, форме, высушенной распылением, или в форме, высушенной в вакууме. 8. Фармацевтическая композиция по п. 7, которая находится в восстановленной форме. 9. Фармацевтическая композиция по любому из пп. 1-8, рН которой составляет примерно 6-10. 10. Фармацевтическая композиция по любому из пп. 1-9, в которой содержание воды составляет менее 5% по весу. 11. Фармацевтическая композиция по любому из пп. 1-10 для применения при лечении. 12. Способ получения фармацевтической композиции по п. 7, включающий смешивание ингредиентов композиции и либо их замораживание и высушивание замороженной смеси, либо их распыление. 13. Способ получения фармацевтической композиции по любому из пп. 1-10, включающий смешивание нуклеотидного аналога, маннита и хлористого натрия или полиольной модифицирующей добавки и проведение лиофилизации смеси, вакуумной сушки смеси или распылительной сушки смеси. РИСУНКИ
RH4A – Выдача дубликата патента Российской Федерации на изобретение
Дата выдачи дубликата: 20.06.2007
Наименование лица, которому выдан дубликат:
Извещение опубликовано: 20.08.2007 БИ: 23/2007
PC4A – Регистрация договора об уступке патента Российской Федерации на изобретение
Прежний патентообладатель:
(73) Патентообладатель:
Дата и номер государственной регистрации перехода исключительного права: 23.07.2007 № РД0024470
Извещение опубликовано: 10.09.2007 БИ: 25/2007
|
||||||||||||||||||||||||||
