Патент на изобретение №2205002
|
||||||||||||||||||||||||||
(54) ГИПОКСЕН – ИНГИБИТОР C1Q СУБКОМПОНЕНТА И C1 КОМПОНЕНТА СИСТЕМЫ КОМПЛЕМЕНТА ЧЕЛОВЕКА
(57) Реферат: Предложено средство для подавления C1q субкомпонента C1 компонента системы комплемента человека, представляющее собой гипоксен (олифен) и имеющее структурную формулу 1. Изобретение может быть использовано в клинике для терапии заболеваний, сопровождающихся патологической активацией классического пути системы комплемента человека, и расширяет арсенал средств указанного назначения. 6 табл. 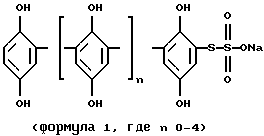
Изобретение относится к медицине, а именно к медицинской иммунологии, и может быть использовано в клинике для терапии заболеваний, сопровождающихся патологической активацией классического пути системы комплемента человека. Система комплемента (СК) состоит из более чем 30 сывороточных и мембранных белков. СК играет важную роль в поддержании нормального клеточного статуса организма. Являясь частью иммунной системы, комплемент участвует в поддержании иммунного статуса организма, в обеспечении иммунного ответа на внешнюю агрессию, в реакциях воспаления, клиренсе иммунных комплексов и т.д. Эти функции СК выполняются различными способами. 1. СК метит патогены и ускоряет поглощение чужеродных клеток фагоцитами или же вызывает лизис определенных патогенов как результат формирования мембраноатакующего комплекса. 2. СК продуцирует локальный воспалительный ответ против патогенов генерированием анафилатоксических пептидов. 3. Предотвращает иммунную преципитацию, способствуя солюбилизации и клиренсу иммунных комплексов из циркуляции. 4. Регулирует уровень иммунного ответа. 5. Способствует элиминированию аутореактивных В-клеток из организма. СК активируется тремя различными путями: классический путь активируется комплексами антиген-антитело, альтернативный и лектиновый пути активируются микробными поверхностями. Активация СК приводит к генерированию анафилатоксинов (С3а, С4а, С5а) и к формированию мембраноатакующего комплекса (A. Sahu and J.D.Lambris, Immunopharmacology, 2000. V.49. Р. 133-148). В данном случае рассматривается активация СК только по классическому пути. Активация СК по классическому пути осуществляется при специфическом связывании С1, первого компонента комплемента, на иммунных комплексах. В состав комплекса С1 входит субкомпонент C1q, узнающий специфический участок на молекуле иммуноглобулина и имеющий уникальную ультраструктуру, а также по две молекулы зимогенов протеиназ трипсинового типа Clr2 и Cls2, превращающихся в ферментативно активные формы после активации на иммунных комплексах. В результате активации Сl значительно возрастает лабильность комплекса (константа ассоциации активированного Сl на порядок меньше константы ассоциации зимогенной формы). С1-ингибитор (Cl-inh) быстро и необратимо связывается с активированными формами Сlr и Сls. При диссоциации С1 под действием Cl-inh, Clq остается связанным с комплексом антиген-антитело и проявляет различные рецептор-опосредованные биологические функции, такие как усиление фагоцитоза, продукция супероксидов нейтрофилами, синтез иммуноглобулинов, хемотаксис, клеточная адгезия и регуляция функции тромбоцитов. Все клетки крови связывают Clq, рецепторы этой молекулы выявлены также на эндотелиальных и эпителиальных клетках, фибробластах и клетках гладкой мускулатуры (Cooper N.R. Adv. Immunol., 1985. V. 37. Р. 151-216). Активация СК может также вызывать нежелательные феномены, такие как воспаление, повреждение нормальной ткани, аутоиммунные заболевания. Аутоиммунные состояния связаны с иммунными комплексами, образованными против собственной ткани, которые связаны с биологически активными фрагментами комплемента, генерированными в результате активации СК по классическому пути. Нерегулируемая активация комплемента составляет сущность большого числа патологий, которые затрагивают иммунную, почечную, сердечно-сосудистую, нервную и другие системы организма. К патологическим состояниям, обусловленным острой нерегулируемой активацией СК, относятся инфаркт миокарда, гиперострое отторжение трансплантанта, сепсис, астма, множественная органная дисфункция, травма, геморрагический шок и т.д. При хронической активации наблюдаются следующие заболевания: пароксизмальная ночная гемоглобинурия, гломерулонефрит, системная красная волчанка, ревматоидный артрит, болезнь Альцгеймера, отторжение трансплантанта, множественный склероз (Volonakis J. E. , Frank M. M. The Human Complement System in Health and Disease. Marcel Dekker, New York, 1998. P. 455-490). С этой точки зрения понятен интерес к веществам, влияющим на систему комплемента, особенно на классический путь активации. Актуальной проблемой является поиск и получение в индивидуальном состоянии ингибиторов системы комплемента, которые могут быть полезными при лечении патологических состояний, описанных выше. Ингибиторы могут стать либо основой лекарственных препаратов для фармакологического воздействия на организм, либо моделью для химического синтеза новых ингибиторов. Наиболее близким техническим решением является применение фактора J в качестве ингибитора компонента С1 (Патент США 5268363, кл. С07К 3/28; А61К 37/02, 27.04.1992). Фактор J является белком с молекулярной массой 18400-22000 Да. Его действие на Clq подобно действию Clq-ингибитора. Однако фактор J действует только на С1 компонент и обладает недостаточно активным действием. Задачей настоящего изобретения является расширение ассортимента ингибиторов комплемента человека, а также поиск наиболее эффективных ингибиторов, обладающих более широким спектром действия в отношении компонентов комплемента человека. Поставленная задача достигается за счет использования в качестве ингибитора Clq и С1 компонентов комплемента человека препарата гипоксен. Гипоксен – торговое название натриевой соли [(2,5-дигидроксифенилен)]-4-тиосульфокислоты. Синтетический препарат гипоксен разрешен к применению в медицине (Патент РФ 2105000 С1, 30.10.96. Регистрационный номер 99/398/2. ВФС 42-3507-99, ВФС 42-3508-99, ВФС 42-3541-99). 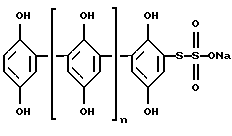 где n=0-4. Известно, что препарат улучшает утилизацию организмом циркулирующего в крови кислорода, повышает устойчивость организма к кислородной недостаточности, блокирует свободнорадикальные реакции, препятствует образованию токсических продуктов перекисного окисления липидов (В.С. Смирнов, М.К. Кузмич. “Гипоксен”, С.-Пб.-М.: ФАРМиндекс, 2001, с. 18-91). Техническим результатом заявленного изобретения является обнаружение высокоспецифичного ингибитора, который блокирует только классический путь активации системы комплемента, подавляет как функционирование компонента С1, так и связавшись с Clq ингибирует сборку Сl комплекса [Clq(Clr2Cls2)] с Кi=7 нг/мл (8,9  10-9 М).
Кроме того, использование данного вещества в качестве ингибитора комплемента имеет ряд достоинств, свойственных ему: обладает уникальной активностью как антиоксидант, активное вещество стабильно при хранении в защищенном от света месте при комнатной температуре в течение 3 лет, препарат безвреден (LD50=1700 мг/кг веса при внутривенном введении белым мышам), не канцерогенен и не обладает эмбриотоксичностью, для введения эффективной дозы препарата в организм можно использовать любой подходящий способ применения, например пероральный, парентеральный, ректальный или наружный, препарат прошел многолетние испытания в клиниках при постгипоксических состояниях и зарекомендовал себя как высокоэффективное лечебно-профилактическое средство.
Все вышеизложенные достоинства значительно упрощают его применение в качестве ингибитора комплемента.
Нами впервые проведены исследования влияния гипоксена на систему комплемента человека, что до наших исследований не было известно.
Исследования проводили следующим образом.
Пример 1. Влияние гипоксена на классический путь активации системы комплемента.
Для исследования функциональной активности гипоксена в ингибировании активации комплемента in vitro были использованы гемолитические тесты.
Для классического пути бараньи эритроциты (109 кл/мл) в вероналовом солевом буфере, содержащем 0,5 мМ MgCl2 и 0,15 мМ CaCl2 (VBS2+), были сенсибилизированы кроличьими анти-Форсмановскими антителами в течение 30 мин при 37oС. Клетки (ЕА) были затем отмыты буфером VBS2+ центрифугированием и ресуспендированы до 1,5 10-9 М).
Кроме того, использование данного вещества в качестве ингибитора комплемента имеет ряд достоинств, свойственных ему: обладает уникальной активностью как антиоксидант, активное вещество стабильно при хранении в защищенном от света месте при комнатной температуре в течение 3 лет, препарат безвреден (LD50=1700 мг/кг веса при внутривенном введении белым мышам), не канцерогенен и не обладает эмбриотоксичностью, для введения эффективной дозы препарата в организм можно использовать любой подходящий способ применения, например пероральный, парентеральный, ректальный или наружный, препарат прошел многолетние испытания в клиниках при постгипоксических состояниях и зарекомендовал себя как высокоэффективное лечебно-профилактическое средство.
Все вышеизложенные достоинства значительно упрощают его применение в качестве ингибитора комплемента.
Нами впервые проведены исследования влияния гипоксена на систему комплемента человека, что до наших исследований не было известно.
Исследования проводили следующим образом.
Пример 1. Влияние гипоксена на классический путь активации системы комплемента.
Для исследования функциональной активности гипоксена в ингибировании активации комплемента in vitro были использованы гемолитические тесты.
Для классического пути бараньи эритроциты (109 кл/мл) в вероналовом солевом буфере, содержащем 0,5 мМ MgCl2 и 0,15 мМ CaCl2 (VBS2+), были сенсибилизированы кроличьими анти-Форсмановскими антителами в течение 30 мин при 37oС. Клетки (ЕА) были затем отмыты буфером VBS2+ центрифугированием и ресуспендированы до 1,5 10 кл/мл.
Влияние на активность СК определяли по снижению гемолиза по классическому пути разбавленной сыворотки крови человека после ее преинкубации с 0,1-0,8 мкг гипоксена в течение 0 и 15 мин при 37oC в объеме 0,3 мл и внесения 200 мкл суспензии ЕА (1,5 10 кл/мл.
Влияние на активность СК определяли по снижению гемолиза по классическому пути разбавленной сыворотки крови человека после ее преинкубации с 0,1-0,8 мкг гипоксена в течение 0 и 15 мин при 37oC в объеме 0,3 мл и внесения 200 мкл суспензии ЕА (1,5 108 кл/мл) с последующей 30 мин инкубацией. После инкубации в каждую пробу добавляли по 2,5 мл холодного раствора 0,15 М NaCl, центрифугировали и определяли степень гемолиза по величине А412 супернатанта. Контрольная проба не содержала гипоксена. Пониженный гемолиз в опытных пробах по сравнению с контрольной свидетельствовал о наличии воздействия на СК.
Проведенные исследования показали, что гипоксен дозозависимо ингибирует классический путь активации системы комплемента, причем преинкубация сыворотки с препаратом гипоксена в течение 15 мин при 37oС усиливает эффект (см. табл. 1).
Таким образом, препарат гипоксена обладает ингибирующим действием на систему комплемента. Усиление эффекта при преинкубации сыворотки с препаратом может свидетельствовать либо об активации комплемента, либо об инактивации одного из компонентов классического пути.
Пример 2. Влияние гипоксена на формирование комплекса ЕАС1.
Эксперименты были проведены следующим образом. 0,1-0,4 мкг препарата инкубировали 15 мин при 37oС с подобранной концентрацией R4 (сыворотка, истощенная по С4 компоненту, источник С1 комплекса) и суспензией ЕА (200 мкл) в общем объеме 500 мкл, доведенном VBS2+. Реакцию останавливали добавлением 500 мкл холодного раствора 0,15 М NaCl, центрифугировали 5 мин при 1500 g, декантировали и к осадку ЕАС1 добавляли 0,5 мл разведенного реагента R1 (сыворотка крови человека, истощенная по С1 компоненту). Тщательно перемешивали встряхиванием и инкубировали 30 мин при 37oС. После инкубации определяли степень гемолиза при А412, как описано выше.
Измеренную величину (степень лизиса у) использовали для расчета значения Z, которое определяется по формуле 108 кл/мл) с последующей 30 мин инкубацией. После инкубации в каждую пробу добавляли по 2,5 мл холодного раствора 0,15 М NaCl, центрифугировали и определяли степень гемолиза по величине А412 супернатанта. Контрольная проба не содержала гипоксена. Пониженный гемолиз в опытных пробах по сравнению с контрольной свидетельствовал о наличии воздействия на СК.
Проведенные исследования показали, что гипоксен дозозависимо ингибирует классический путь активации системы комплемента, причем преинкубация сыворотки с препаратом гипоксена в течение 15 мин при 37oС усиливает эффект (см. табл. 1).
Таким образом, препарат гипоксена обладает ингибирующим действием на систему комплемента. Усиление эффекта при преинкубации сыворотки с препаратом может свидетельствовать либо об активации комплемента, либо об инактивации одного из компонентов классического пути.
Пример 2. Влияние гипоксена на формирование комплекса ЕАС1.
Эксперименты были проведены следующим образом. 0,1-0,4 мкг препарата инкубировали 15 мин при 37oС с подобранной концентрацией R4 (сыворотка, истощенная по С4 компоненту, источник С1 комплекса) и суспензией ЕА (200 мкл) в общем объеме 500 мкл, доведенном VBS2+. Реакцию останавливали добавлением 500 мкл холодного раствора 0,15 М NaCl, центрифугировали 5 мин при 1500 g, декантировали и к осадку ЕАС1 добавляли 0,5 мл разведенного реагента R1 (сыворотка крови человека, истощенная по С1 компоненту). Тщательно перемешивали встряхиванием и инкубировали 30 мин при 37oС. После инкубации определяли степень гемолиза при А412, как описано выше.
Измеренную величину (степень лизиса у) использовали для расчета значения Z, которое определяется по формулеZ= ln[(H-R)/H-X)], где Н, R и Х – величины оптической плотности при A412 гемолитической системы при полном лизисе, в контроле (без титруемого компонента) и в опытной пробе соответственно. Результаты исследования убедительно свидетельствуют о том, что гипоксен оказывает дозозависимое ингибирующее действие на формирование комплекса ЕАС1 (см. табл. 2). Константу ингибирования Ki рассчитывали по линейному уравнению 1/Zi=[I] /(Zo  Кi)+1/Zo, строя график зависимости 1/Zi от [I]. При этом точка пересечения графика с осью абсцисс соответствует значению Ki=1,1 Кi)+1/Zo, строя график зависимости 1/Zi от [I]. При этом точка пересечения графика с осью абсцисс соответствует значению Ki=1,1 0,1 мкг/мл (1,5 0,1 мкг/мл (1,5 10-5М).
Пример 3. Связывание гипоксена с комплексом ЕАС1.
Исследования действия гипоксена после образования комплекса ЕАС1 проводили следующим образом. Комплекс ЕАС1, приготовленный инкубацией ЕА с реагентом R4 (сыворотка, истощенная по С4 компоненту, источник Сl комплекса), отмывали центрифугированием, ресуспендировали в буфере VBS2+ и концентрацию комплекса ЕАС1 доводили до 1,5 10-5М).
Пример 3. Связывание гипоксена с комплексом ЕАС1.
Исследования действия гипоксена после образования комплекса ЕАС1 проводили следующим образом. Комплекс ЕАС1, приготовленный инкубацией ЕА с реагентом R4 (сыворотка, истощенная по С4 компоненту, источник Сl комплекса), отмывали центрифугированием, ресуспендировали в буфере VBS2+ и концентрацию комплекса ЕАС1 доводили до 1,5 108 кл/мл. 200 мкл ЕАС1 инкубировали с разными концентрациями гипоксена (0,1-0,4 мкг) в течение 15 мин при 37oС в общем объеме 0,5 мл, доведенном буфером VBS2+. После инкубации комплекс отмывали центрифугированием, декантировали и осадок ресуспендировали в гемолитической системе, содержащей реагент R1. Гипоксен в зависимости от концентрации подавлял функционирование Сl в комплексе ЕАС1 (см. табл. 3).
Была определена Кi=6,75 108 кл/мл. 200 мкл ЕАС1 инкубировали с разными концентрациями гипоксена (0,1-0,4 мкг) в течение 15 мин при 37oС в общем объеме 0,5 мл, доведенном буфером VBS2+. После инкубации комплекс отмывали центрифугированием, декантировали и осадок ресуспендировали в гемолитической системе, содержащей реагент R1. Гипоксен в зависимости от концентрации подавлял функционирование Сl в комплексе ЕАС1 (см. табл. 3).
Была определена Кi=6,75 10-7 М (как описано выше).
Таким образом, антикомплементарное действие гипоксена обусловлено взаимодействием с С1 комплексом, причем после образования комплекса ЕАС1 эффект ингибирования выше, чем на стадии формирования комплекса.
Пример 4. Определение обратимости связывания гипоксена с ЕАС1.
Комплекс ЕАС1 с ограниченным числом эффективных молекул С1 готовили, как описано в примере 3. 200 мкл суспензии комплекса ЕАС1 инкубировали с 0,1-0,4 мкг гипоксена в объеме 500 мкл в течение 15 мин при 37oС. После инкубации с эффектором добавляли 500 мкл буфера VBS2+, комплекс отделяли центрифугированием и определяли остаточную активность С1 комплекса на ЕА в гемолитической системе с реагентом R1 после 30 мин инкубации. Степень лизиса клеток определяли, как описано выше. Контроль не содержал препарата гипоксен. Результаты эксперимента показали дозозависимое ингибирование активности С1, предполагая необратимое связывание гипоксена с комплексом С1, связанным с ЕА (см. табл. 4).
Константу ингибирования Ki рассчитывали по линейному уравнению 1/Zi=[I] /(Zo 10-7 М (как описано выше).
Таким образом, антикомплементарное действие гипоксена обусловлено взаимодействием с С1 комплексом, причем после образования комплекса ЕАС1 эффект ингибирования выше, чем на стадии формирования комплекса.
Пример 4. Определение обратимости связывания гипоксена с ЕАС1.
Комплекс ЕАС1 с ограниченным числом эффективных молекул С1 готовили, как описано в примере 3. 200 мкл суспензии комплекса ЕАС1 инкубировали с 0,1-0,4 мкг гипоксена в объеме 500 мкл в течение 15 мин при 37oС. После инкубации с эффектором добавляли 500 мкл буфера VBS2+, комплекс отделяли центрифугированием и определяли остаточную активность С1 комплекса на ЕА в гемолитической системе с реагентом R1 после 30 мин инкубации. Степень лизиса клеток определяли, как описано выше. Контроль не содержал препарата гипоксен. Результаты эксперимента показали дозозависимое ингибирование активности С1, предполагая необратимое связывание гипоксена с комплексом С1, связанным с ЕА (см. табл. 4).
Константу ингибирования Ki рассчитывали по линейному уравнению 1/Zi=[I] /(Zo Кi)+1/Zo, строя график зависимости 1/Zi от [I]. При этом точка пересечения графика с осью абсцисс соответствует значению Кi=7 нг/мл (8,9 Кi)+1/Zo, строя график зависимости 1/Zi от [I]. При этом точка пересечения графика с осью абсцисс соответствует значению Кi=7 нг/мл (8,9 10-9 М).
Таким образом, проведенные исследования обратимости связывания гипоксена с комплексом ЕАС1 свидетельствуют о высокой аффинности и практически необратимом характере взаимодействия.
Ингибирование активности ЕАС1 может быть обусловлено либо прямой инактивацией, либо диссоциацией С1 в результате взаимодействия гипоксена с субкомпонентами комплекса.
Пример 5. Влияние гипоксена на активность субкомпонента Clq.
Эксперименты проводили следующим образом. 0,1-0,4 мкг гипоксена предварительно инкубировали 15 мин при 37oС с подобранной концентрацией очищенного функционально активного субкомпонента Clq первого компонента комплемента человека С1 и после инкубации собирали гемолитическую систему, добавляя 200 мкл суспензии ЕА (1,5 10-9 М).
Таким образом, проведенные исследования обратимости связывания гипоксена с комплексом ЕАС1 свидетельствуют о высокой аффинности и практически необратимом характере взаимодействия.
Ингибирование активности ЕАС1 может быть обусловлено либо прямой инактивацией, либо диссоциацией С1 в результате взаимодействия гипоксена с субкомпонентами комплекса.
Пример 5. Влияние гипоксена на активность субкомпонента Clq.
Эксперименты проводили следующим образом. 0,1-0,4 мкг гипоксена предварительно инкубировали 15 мин при 37oС с подобранной концентрацией очищенного функционально активного субкомпонента Clq первого компонента комплемента человека С1 и после инкубации собирали гемолитическую систему, добавляя 200 мкл суспензии ЕА (1,5 108 кл/мл) и 20 мкл реагента Rlq (сыворотка, дефицитная по субкомпоненту Clq). Общий объем гемолитической системы доводили до 0,5 мл буфером VBS2+. После инкубации 30 мин при 37oС реакцию останавливали добавлением 2,5 мл холодного раствора 0,15 М NaCl, центрифугировали 5 мин при 1500 g и степень гемолиза определяли, как описано выше.
В результате проведенных исследований получены данные, которые свидетельствуют о связывании субкомпонента Clq с гипоксеном с Кi=1,66 108 кл/мл) и 20 мкл реагента Rlq (сыворотка, дефицитная по субкомпоненту Clq). Общий объем гемолитической системы доводили до 0,5 мл буфером VBS2+. После инкубации 30 мин при 37oС реакцию останавливали добавлением 2,5 мл холодного раствора 0,15 М NaCl, центрифугировали 5 мин при 1500 g и степень гемолиза определяли, как описано выше.
В результате проведенных исследований получены данные, которые свидетельствуют о связывании субкомпонента Clq с гипоксеном с Кi=1,66 108 М (см. табл. 5).
Таким образом, исследования влияния гипоксена на субкомпонент Clq свидетельствуют о прямой инактивации узнающей субъединицы С1 комплекса.
Пример 6. Определение связывания гипоксена с комплексом EAClq. Для определения взаимодействия гипоксена с Clq, связанным с ЕА, комплекс EAClq был предварительно инкубирован с различными количествами гипоксена в диапазоне доз между 0,05 и 0,4 мкг/мл в течение 20 мин при 37oС. После инкубации комплекс отмывали центрифугированием, ресуспендировали в гемолитической системе с реагентом Rlq. Эти эксперименты показали дозозависимое ингибирование активности Clq, предполагая связывание гипоксена с Clq, связанным с ЕА (см. табл.6).
Препарат гипоксен взаимодействует с иммобилизованным субкомпонентом Clq на ЕА и тем самым ингибирует формирование комплекса С1 с Кi=7,65 108 М (см. табл. 5).
Таким образом, исследования влияния гипоксена на субкомпонент Clq свидетельствуют о прямой инактивации узнающей субъединицы С1 комплекса.
Пример 6. Определение связывания гипоксена с комплексом EAClq. Для определения взаимодействия гипоксена с Clq, связанным с ЕА, комплекс EAClq был предварительно инкубирован с различными количествами гипоксена в диапазоне доз между 0,05 и 0,4 мкг/мл в течение 20 мин при 37oС. После инкубации комплекс отмывали центрифугированием, ресуспендировали в гемолитической системе с реагентом Rlq. Эти эксперименты показали дозозависимое ингибирование активности Clq, предполагая связывание гипоксена с Clq, связанным с ЕА (см. табл.6).
Препарат гипоксен взаимодействует с иммобилизованным субкомпонентом Clq на ЕА и тем самым ингибирует формирование комплекса С1 с Кi=7,65 10-8 М.
Таким образом, из приведенных выше примеров следует, что ингибирующее действие гипоксена на С1 компонент системы комплемента обусловлено связыванием с субкомпонентом Clq в растворе, которое приводит к диссоциации С1 комплекса, а связывание гипоксена с иммобилизованным Clq предотвращает формирование комплекса С1. 10-8 М.
Таким образом, из приведенных выше примеров следует, что ингибирующее действие гипоксена на С1 компонент системы комплемента обусловлено связыванием с субкомпонентом Clq в растворе, которое приводит к диссоциации С1 комплекса, а связывание гипоксена с иммобилизованным Clq предотвращает формирование комплекса С1.
Формула изобретения
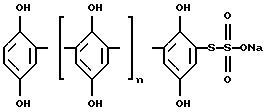 где n = 0 – 4, в качестве специфического ингибитора Clq субкомпонента и Сl компонента классического пути системы комплемента человека. РИСУНКИ
|
||||||||||||||||||||||||||
