Патент на изобретение №2204141
|
||||||||||||||||||||||||||
(54) СПОСОБ ОПРЕДЕЛЕНИЯ АКТИВНОСТИ ФАКТОРА XIII
(57) Реферат: Изобретение относится к области медицины, в частности к лабораторной диагностике. Способ обеспечивает сокращение времени определения активности фактора XIII. Проводят определение лизиса фибринового сгустка, при этом в качестве источника образования фибринового сгустка используют фибрин-мономер в концентрации 1,0-9,0 г/л. 4 табл. Изобретение относится к области медицины, в частности к лабораторной диагностике, и может быть использовано для исследования крови при нарушениях в системе гемостаза. Как известно, завершающий этап процесса свертывания крови характеризуется самосборкой фибрин-мономеров с последующей сшивкой образовавшихся олигомеров фибрина фактором XIII (фибринстабилизирующим фактором). В результате образуется сгусток фибрина, обладающий гораздо большей прочностью и стойкостью к действию фибринолитических агентов и растворителей (мочевина, монохлоруксусная кислота и др. ), по сравнению со сгустком, полученным из плазмы, дефицитной по фактору XIII. В клинической практике имеет значение снижение активности фактора XIII, которое наблюдается при наследственном глубоком дефиците этого фактора (снижение до 1-5% от нормы) и в случаях приобретенного его дефицита (снижение до 30-40% от нормы) при ДВС-синдромах, множественных переломах, геморрагических васкулитах, острых лейкозах, неспецифическом язвенном колите и др. состояниях. Между тем, определение активности фактора XIII затруднено в связи с отсутствием доступного для клинических лабораторий и одновременно чувствительного метода оценки этого параметра коагулограммы. Известный способ высоко специфичен, однако его недостатками являются трудоемкость, высокая стоимость и необходимость использования специального оборудования для фотометрического анализа. Известен способ определения активности фактора XIII по времени лизиса образовавшегося в исследуемой плазме фибринового сгустка в растворе кислой щавелевокислой мочевины при предварительном блокировании избытка фактора XIII раствором монойодуксусной кислоты (Балуда В.П., Баркаган З.С., Гольдберг Е. Д. и др. Лабораторные методы исследования системы гемостаза. – Томск, 1980. – С. 196-198). Недостатком известного способа является зависимость получаемых результатов от концентрации фибриногена в исследуемой плазме. Способ-прототип осуществляют следующим образом. Исследуют богатую тромбоцитами плазму крови. 1 этап. Получение фибринового сгустка, стабилизированного фактором XIII. К 0,2 мл исследуемой плазмы последовательно добавляют 0,1 мл 0,3% раствора монойодуксусной кислоты и 0,4 мл 0,277% раствора хлорида кальция. Смесь выдерживают при температуре +37oС в течение 20 мин. 2 этап. Определение времени лизиса фибринового сгустка. По истечении времени инкубации в пробирку вносят 2,0 мл 0,12% раствора кислой щавелевокислой мочевины. Немедленно включают секундомер и при покачивании пробирки, не вынимая ее из водяной бани (+37oС), регистрируют время лизиса фибринового сгустка. 3 этап. Определение концентрации фибриногена в исследуемой плазме (по Р. А.Рутберг [Балуда В.П., Баркаган З.С., Гольдберг Е.Д. и др. Лабораторные методы исследования системы гемостаза. – Томск, 1980. – С. 192]). К 1,0 мл плазмы добавляют 0,2 мл раствора тромбина, пробирку ставят на 10 мин на водяной бане (+37oС). В процессе свертывания образующийся фибрин наматывают на стеклянную палочку, которую извлекают из плазмы лишь по истечении 10 мин. Полученный сгусток переносят на беззольный фильтр и высушивают сжатием и перемещением сгустка по фильтру. Такое высушивание продолжают до тех пор, пока на фильтре в проходящем свете не будет уже заметно следов влаги. Высушенный фибрин немедленно взвешивают на торсионных весах. При умножении веса сухого фибрина на коэффициент, равный 25, получают значение уровня фибриногена в мг%. Оценка результатов. Определение активности фактора XIII с учетом концентрации фибриногена в исследуемой плазме производится по формуле 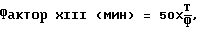 где Т – время лизиса сгустка (мин), Ф – концентрация фибриногена в исследуемой плазме (мг%). В норме активность фактора XIII составляет 2,0  0,5 мин.
К недостаткам способа-прототипа следует отнести: 0,5 мин.
К недостаткам способа-прототипа следует отнести:1. Необходимость дополнительного определения концентрации фибриногена в исследуемой плазме больного, что усложняет определение активности фактора XIII. 2. Выражение активности фактора XIII в единицах времени (минутах, затраченных на лизис фибринового сгустка) не соответствует принятым вариантам количественного выражения ферментативной активности. Вследствие этого измерение фактора XIII по способу-прототипу не может рассматриваться как количественное. Авторы предлагают способ определения активности фактора XIII путем использования нового субстрата (фибрин-мономера) для получения фибринового сгустка, что позволяет исключить необходимость дополнительного определения концентрации фибриногена в исследуемом образце плазмы. В заявляемом способе активность фактора XIII выражается в процентах от нормы, что соответствует принятым стандартам. Положительным результатом заявляемого способа является сокращение времени исследования (устранение дополнительного этапа определения концентрации фибриногена в образце плазмы). Положительный результат достигается тем, что в качестве источника образования фибринового сгустка используют препарат фибрин-мономера в концентрации 1,0 – 9,0 г/л. Способ осуществляют следующим образом. Реактивы и оборудование: 1. Цитрат натрия, трехзамещенный, 3,8% раствор, получают растворением 3,8 г цитрата натрия в 100 мл дистиллированной воды. 2. Фибрин-мономер из плазмы крови человека (лиофильно высушенный), производства фирмы “Технология-Стандарт”, Россия. 3. Буфер трис-НСl концентрированный (20:1), 1,0 М, рН 7,3-7,4, фирма “Технология-Стандарт”, Россия. 4. Каолин (легкая фракция), взвесь с концентрацией 50 мг/мл дистиллированной воды, фирма “Технология-Стандарт”, Россия. 5. Хлорид кальция, концентрированный раствор (20: 1; 5,54%), фирма “Технология-Стандарт”, Россия. 6. Монохлоруксусная кислота, кристаллическая, фирма “Sigma”, США. 7. Дистиллированная вода. 8. Центрифуга типа ОПН-8. 9. Термостат для исследования гемокоагуляции (ТПС), Украина. 10. Секундомер. 11. Пробирки стеклянные объемом 20 мл. 12. Цилиндр стеклянный мерный, на 100 мл. 13. Планшет полистироловый 72-х луночный с размерами 23  12 см (“Мед-полимер”, С.-Петербург, Россия).
14. Осветитель для микроскопа типа ОИ-32.
Приготовление реактивов: 12 см (“Мед-полимер”, С.-Петербург, Россия).
14. Осветитель для микроскопа типа ОИ-32.
Приготовление реактивов:1. Разведение фибрин-мономера: Во флакон с лиофильно высушенным фибрин-мономером добавляют 2,0 мл дистиллированной воды и при легком покачивании при комнатной температуре растворяют реагент в течение 15 минут. 2. Приготовление 0,554% раствора хлорида кальция: Концентрированный хлорид кальция в объеме 10,0 мл вносят в мерный цилиндр и общий объем доводят дистиллированной водой до 100 мл. 3. Приготовление 5% раствора монохлоруксусной кислоты: Монохлоруксусную кислоту в количестве 5 г помещают в мерный цилиндр и растворяют в 50 мл дистиллированной воды. Общий объем доводят дистиллированной водой до 100 мл. 4. Приготовление рабочего буферного раствора: Концентрированный буфер трис-HCl в объеме 1,0 мл и взвесь каолина в объеме 2,0 мл вносят в мерный цилиндр и общий объем доводят дистиллированной водой до 100 мл. В результате получают буферный раствор со следующим составом – трис-НСl 0,01 М, рН 7,3-7,4, содержащий каолин в концентрации 1,0 мг/мл. Подготовка исследуемой плазмы больного и пула контрольной нормальной плазмы крови (взятой у здоровых людей). Кровь получают из локтевой вены самотеком через иглу в пластиковую пробирку, содержащую 3,8% раствор цитрата натрия (соотношение крови и цитрата 9: 1). Кровь центрифугируют 5 мин при скорости вращения 1000 об/мин (150g). Полученную богатую тромбоцитами плазму повторно центрифугируют в течение 15 мин при 4000 об/мин (1200 g). Полученную бедную тромбоцитами плазму используют для проведения исследования. Для приготовления пула контрольной нормальной плазмы в равной пропорции смешивают образцы бедной тромбоцитами плазмы от 8-10 практически здоровых людей в возрасте 18-45 лет. Активность фактора XIII в таком пуле плазмы принимают за 100% от нормы. Приготовление разведений плазмы для анализа. Для приготовления разведений плазмы используют полистироловый планшет, в котором имеется 6 рядов лунок (по 12 лунок в каждом ряду); один ряд приходится на исследование одного образца плазмы. В 1, 2, 3, 4, 6, 8, 10 и 12 лунки помещают по 1,0 мл дистиллированной воды. После этого в первую лунку добавляют 1,0 мл плазмы, получая разведение 1:2. Из нее 1,0 мл смеси переносят во вторую лунку, получая разведение 1:4 и аналогичным образом поступают с 3, 4, 6, 8, 10 и 12 лунками, получая следующие основные разведения: 1:8 (3-я лунка), 1:16 (4-я лунка), 1:32 (6-я лунка), 1:64 (8-я лунка), 1:128 (10-я лунка) и 1:256 (12-я лунка). Лунки 5, 7, 9 и 11 остаются пустыми для приготовления промежуточных разведений. Для их получения вносят по 0,2 мл основных разведений из предыдущей и последующей лунок в находящуюся между ними пустую лунку. В таблице 1 представлены все необходимые разведения одного образца плазмы. Ход определения: В пробирку последовательно вносят 0,1 мл раствора хлористого кальция, 0,1 мл буфера, 0,2 мл одного из разведений плазмы и 0,1 мл раствора фибрин-мономера. Включают секундомер и инкубируют на водяной бане при +37oС в течение 10 минут. По истечении времени пробирку достают из бани, добавляют 0,5 мл 5% раствора монохлоруксусной кислоты и оставляют ее при комнатной температуре на 2-3 минуты. Затем в проходящем свете, наклоняя пробирку, определяют, произошло ли растворение сгустка. Лизис сгустка отмечают знаком “-“, отсутствие лизиса – знаком “+”. Параллельно исследование проводят со всеми приготовленными разведениями исследуемого образца плазмы с целью нахождения границы между наличием и отсутствием сгустка в этих разведениях. Искомым является наибольшее разведение плазмы, в котором еще имеется сгусток (таблица 1). Оценка полученных результатов. Расчет активности фактора XIII производят по формуле: 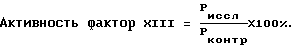 где Рконтр – наибольшее разведение нормальной контрольной плазмы, в котором еще имеется сгусток, Риссл – наибольшее разведение исследуемого образца плазмы, в котором еще имеется сгусток. В таблице 2 представлены значения активности фактора XIII (в процентах от нормы), соответствующие конкретным разведениям плазмы, расцененным как наибольшие разведения, в которых еще имеется сгусток. По результатам обследования 43 практически здоровых людей нормальные показатели активности фактора XIII (Х  2 2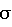 ) составили 66 – 133% (Х=100,0%; ) составили 66 – 133% (Х=100,0%; 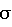 =16,5; m=2,5), что соответствует разведениям плазмы 1:64 -1:128.
Апробация предлагаемого способа.
Известно, что при остром ДВС-синдроме происходит снижение уровня всех факторов свертывания крови, в том числе фактора XIII. В связи с этим для апробации заявляемого способа было проведено обследование 20 больных с острым и подострым ДВС-синдромом, в том числе септическим (14), посттравматическим (5) и акушерским (1). Данные обследования представлены в таблице 3. Из нее видно, что в плазме больных с острым ДВС-синдромом происходит закономерное снижение активности фактора XIII.
Обоснование выбранного диапазона концентрации фибрин-мономера для определения активности фактора XIII в предложенном способе.
Для выбора требуемой концентрации фибрин-мономера при определении активности фактора XIII использовали образцы раствора фибрин-мономера с концентрацией от 0,5 до 12,0 г/л (таблица 4). Экспериментальным путем было установлено, что оптимальные концентрации фибрин-мономера лежат в диапазоне от 1,0 до 9,0 г/л. Использование концентрации фибрин-мономера ниже 1,0 г/л приводило к образованию небольшого по плотности сгустка, слабо различимого при визуальной оценке. С другой стороны, использование концентрации фибрин-мономера от 10,0 г/л и выше приводило к смещению границы “+”/”-” в сторону меньших разведений плазмы и снижению чувствительности метода.
Специфичность способа и его воспроизводимость.
Заявляемый способ позволяет сократить время исследования (устраняется дополнительный этап определения концентрации фибриногена в образце плазмы) за счет использования фибрин-мономера в концентрации 1,0-9,0 г/л в качестве источника образования фибринового сгустка в плазме крови.
В результате повышается эффективность способа, что приводит к более точной диагностике нарушений свертывания крови, обусловленные изменением активности фактора XIII. Концентрация фибриногена в исследуемой плазме не оказывает влияния на результаты заявляемого способа. Способ может быть использован в клинико-диагностических лабораториях в научных и лечебно-профилактических учреждениях и найдет широкое применение, поскольку не требует дорогостоящего оборудования и реактивов.
Для оценки воспроизводимости заявляемого способа используют коэффициент вариации CV (%). Коэффициент вариации способа при исследовании в разные дни не превышает 10%. =16,5; m=2,5), что соответствует разведениям плазмы 1:64 -1:128.
Апробация предлагаемого способа.
Известно, что при остром ДВС-синдроме происходит снижение уровня всех факторов свертывания крови, в том числе фактора XIII. В связи с этим для апробации заявляемого способа было проведено обследование 20 больных с острым и подострым ДВС-синдромом, в том числе септическим (14), посттравматическим (5) и акушерским (1). Данные обследования представлены в таблице 3. Из нее видно, что в плазме больных с острым ДВС-синдромом происходит закономерное снижение активности фактора XIII.
Обоснование выбранного диапазона концентрации фибрин-мономера для определения активности фактора XIII в предложенном способе.
Для выбора требуемой концентрации фибрин-мономера при определении активности фактора XIII использовали образцы раствора фибрин-мономера с концентрацией от 0,5 до 12,0 г/л (таблица 4). Экспериментальным путем было установлено, что оптимальные концентрации фибрин-мономера лежат в диапазоне от 1,0 до 9,0 г/л. Использование концентрации фибрин-мономера ниже 1,0 г/л приводило к образованию небольшого по плотности сгустка, слабо различимого при визуальной оценке. С другой стороны, использование концентрации фибрин-мономера от 10,0 г/л и выше приводило к смещению границы “+”/”-” в сторону меньших разведений плазмы и снижению чувствительности метода.
Специфичность способа и его воспроизводимость.
Заявляемый способ позволяет сократить время исследования (устраняется дополнительный этап определения концентрации фибриногена в образце плазмы) за счет использования фибрин-мономера в концентрации 1,0-9,0 г/л в качестве источника образования фибринового сгустка в плазме крови.
В результате повышается эффективность способа, что приводит к более точной диагностике нарушений свертывания крови, обусловленные изменением активности фактора XIII. Концентрация фибриногена в исследуемой плазме не оказывает влияния на результаты заявляемого способа. Способ может быть использован в клинико-диагностических лабораториях в научных и лечебно-профилактических учреждениях и найдет широкое применение, поскольку не требует дорогостоящего оборудования и реактивов.
Для оценки воспроизводимости заявляемого способа используют коэффициент вариации CV (%). Коэффициент вариации способа при исследовании в разные дни не превышает 10%.
Формула изобретения
РИСУНКИ
|
||||||||||||||||||||||||||
