Патент на изобретение №2202835
|
||||||||||||||||||||||||||
(54) СПОСОБ ПОЛУЧЕНИЯ МОДЕЛЕЙ БИОЛОГИЧЕСКИХ МЕМБРАН
(57) Реферат: Изобретение относится к фармации и касается способа получения средств для излучения биологической доступности и высвобождения лекарственных веществ из лекарственных форм. Способ осуществляют путем приготовления 6% раствора лецитина в кипящем 95 мас.% спирте этиловом, погружения мелкопористых бумажных фильтров “синяя лента” диаметром 5-20 см в раствор лецитина и выдерживания в нем, удаления избытка спирта от фильтров доаэрацией. Технический результат – создание мембран, близких к натуральным биологическим мембранам, с длительным сроком хранения и использования, с большой рабочей поверхностью; упрощенность и доступность изготовления, исключение использования животных. 6 табл. Изобретение относится к фармации и касается способа получения средств для изучения биологической доступности и высвобождения лекарственных веществ из лекарственных форм. Наиболее распространенным методом изучения биодоступности и высвобождения лекарственных веществ является метод диализа. Эффективное использование этого метода определяется главным образом выбором подходящей мембраны. Объектами исследования были выбраны полисахариды. Сахара собирают (как диффузаты) обычно в виде одной или нескольких порций раствора снаружи мембранного мешка (или мембранной пленки). Перемешивание растворов с обеих сторон мембраны повышает эффективность способа диализа. Выбор подходящей мембраны для полимерных углеводов имеет решающее значение. Обычно в качестве диализной мембраны используют пленки из полимерных материалов различной природы (целлофан, поливинилхлорид, полиамид, ацетат целлюлозы) (патент РФ 2116075. Способ получения медицинского очищенного пектина; Методы химии углеводов (Под ред. Н.К.Кочеткова. – М.: Мир, 1967. – С. 299-300). Недостатком этих мембран является то, что они синтетические, в основном это – полимеры углеводов и их производных, в то время как биологические мембраны состоят из липидов и белков. Липиды в биологической мембране образуют типичный бимолекулярный слой, состоящий из ненасыщенных фосфолипидов и холестерина. В мембранах больше фосфолипидов, несущих двойной отрицательный или общий нейтральный заряд. Холестерин регулирует образование кристаллических структур, он мешает излишнему “затвердеванию” жидкой пленки, как бы разъединяя неполярные цепи фосфолипидов. Белки располагаются по поверхности полярных головок фосфолипидов с обеих сторон бимолекулярного слоя (Строев Е.А. Биологическая химия. – М.: ВШ, 1986. – С. 109-112). Поэтому диализ лекарственных веществ через полимерные материалы не дает объективного определения биодоступности и высвобождения лекарственных веществ, т.к. при прохождении лекарственных веществ через полимерные материалы не учитываются такие процессы, как растворение, взаимодействие, метаболизм лекарственных веществ в белково-липидном слое мембраны. Описано применение в качестве диализных мембран пленок из натуральных материалов (переживающая кожа животных, стенка желудка и кишки, яичная оболочка, париетальный (наружный) лист брюшины животных). Метод применения подобных диализных мембран носит название метода изолированных органов (или метод situ). Указанные мембраны наиболее близки к предлагаемым и выбраны за прототип. В качестве среды, в которую диализируют лекарственные вещества, используются вода, изотонический раствор хлорида натрия, раствор Рингера. Процесс диализа обычно ведется в термостате при температуре 37oС. Аппаратурное оформление может быть различным. (Биофармацевтические основы технологии лекарств и их использование в деятельности аптечных учреждений ГАПУ МЗ РСФСР. – Пятигорск, 1983. – С. 10-11). Несмотря на естественную природу используемых биологических мембран, они имеют недостатки в использовании: а) для выделения подобных мембран требуется производить забой животных, б) выделенные мембраны имеют очень маленькую рабочую поверхность, в) мембраны из-за содержащихся в них липидов и белков очень быстро подвергаются процессам окисления, гниения; продукты разложения мембран могут сильно повлиять на результаты исследований (они увеличивают величину оптической плотности, растворы мутнеют, выделяются коллоидные осадки и др.). Метаболиты мембран могут образовывать продукты взаимодействия с исследуемыми лекарственными веществами. Поэтому натуральные мембраны должны быть всегда свежевыделенными; г) трудоемкость в отделении мембраны от мышечного, кожного слоя. Цель изобретения – создание мембран, близких к натуральным биологическим мембранам, с длительным сроком хранения и использования, с большой рабочей поверхностью; упрощенность и доступность изготовления; исключение использования животных. Поставленная цель достигается тем, что способ получения моделей биологических мембран осуществляют путем приготовления 6% раствора лецитина в кипящем 95 мас.% спирте этиловом, погружения мелкопористых бумажных фильтров “синяя лента” диаметром 5-20 см (рабочая площадь 15-300 см2) в раствор лецитина и выдерживания в нем в течение 48 ч; удаления избытка спирта от фильтров деаэрацией. В предлагаемом способе для пропитывания бумажных фильтров используется лецитин, т. к. именно лецитин составляет основу биологической мембраны. В химическом отношении лецитин представляет собою сложный эфир глицерина, в молекуле которого два гидроксила этерифицированы жирными кислотами, а третий гидроксил – фосфорной кислотой, в свою очередь связанной с азотистым основанием – холином (фосфатидилхолины): 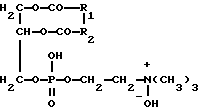 Фосфатидилхолин (3-sп-фосфатидилхолин; 1,2-диацил-sп-глицеро-3-фосфохолин; лецитин), где R1, R2 – остатки насыщенных или ненасыщенных жирных кислот (Справочник биохимика: Пер. с англ./Доссон Р., Эллиот Д., Эллиот У., Джонс К. – М.: Мир, 1991. – С. 153). Пропитывание бумажных фильтров раствором лецитина позволяет создать мембрану, подобную биологической. Поскольку нанесение лецитина на поверхность фильтра не позволяет получить равномерного слоя, то нами были приготовлены растворы лецитина в кипящем 95% спирте этиловом, т.к. лецитин растворяется в указанном растворителе. При погружении бумажных фильтров в спиртовой раствор лецитина фильтры равномерно пропитываются раствором, приобретая светло-желтую окраску. После пропитывания спирт очень легко удаляется из фильтров путем деаэрации в вытяжном шкафу. Из бумажных фильтров нами выбраны наиболее плотные фильтры “синяя лента” с порами, диаметр которых соответствует диаметрам пор естественных и целлофановых мембран (0,35-0,4 нм) (Коростелев П.П. Лабораторная техника химического анализа. – М.: Химия, 1981. – С. 86-87; Бабко А.К., Шкаравский Ю. Ф. , Кулик В.И. Изучение молибденовых гетерополикомплексов методом диализа. (Украинский хим. журнал. – 1968. – 1. – С. 80-83). При этом могут быть использованы фильтры различного диаметра от 5 до 20 см с рабочей площадью от 15 до 300 см2, что позволяет использовать для диализа различные объемы растворов. Таким образом, предлагаемый способ получения моделей биологических мембран позволяет получить мембраны, близкие к натуральным, т.е. пропитанные основным компонентом биологических мембран – лецитином. Полученные мембраны не подвергаются окислению, разрушению, гниению и другим процессам; они, как и обычные бумажные фильтры, могут храниться и применяться длительное время. Кроме того, они могут быть изготовлены непосредственно перед проведением исследований. Для диализа различных объемов растворов можно подобрать фильтры с различной рабочей поверхностью. При этом способ отличается доступностью и простотой: лецитин, предлагаемый для получения мембран, широко используется при производстве шоколада, маргарина; кроме того, не требуется сложной аппаратуры. При использовании подобных мембран исключается забой животных, трудоемкое отделение мембранного слоя, экстренное использование животных мембран во избежание их порчи. Полученные мембраны имеют светло-желтую окраску и воскообразную поверхность. Аппаратурное оформление диализа может быть различным. Чаще всего прибор представляет собою стеклянную трубку длиной 15 см, один конец которой закрывают лецитиновой мембраной, края которой закрепляют на диализной трубке с помощью резинок. Рабочая площадь трубки обычно составляет 9-102 см. Для сбора диализатов можно применять фармацевтические перколяторы или химические стаканы различной емкости. Перколятор или стакан снабжают приспособлением (картон с отверстием, диаметр которого соответствует диаметру диализной трубки) для поддержания заданного уровня жидкости, позволяющим сливать диализат при прибавлении свежего растворителя. В перколятор или стакан вносят 0,154 моль/л раствора хлорида натрия (или 0,9% раствор), который создает осмотическое давление, соответствующее давлению биологических жидкостей в сосудах. Прибор для диализа термостатируют при температуре 37  0,5oС; после достижения этой температуры в диализную трубку вносят исследуемый раствор и опускают трубку в стакан на такую глубину, чтобы уровни растворов в трубке и стакане были примерно одинаковыми. После начала диализа содержимое трубки и стакана перемешивают механически. Отбор проб диализата в каждом случае производят с помощью пипетки через определенные интервалы времени с момента начала диализа с немедленным возвращением взятого объема растворителя. Взятые пробы анализируются различными методами. Содержание полисахаридов анализируют методом спектрофотометрии в УФ-области. Степень диализа (d) рассчитывают по формуле 0,5oС; после достижения этой температуры в диализную трубку вносят исследуемый раствор и опускают трубку в стакан на такую глубину, чтобы уровни растворов в трубке и стакане были примерно одинаковыми. После начала диализа содержимое трубки и стакана перемешивают механически. Отбор проб диализата в каждом случае производят с помощью пипетки через определенные интервалы времени с момента начала диализа с немедленным возвращением взятого объема растворителя. Взятые пробы анализируются различными методами. Содержание полисахаридов анализируют методом спектрофотометрии в УФ-области. Степень диализа (d) рассчитывают по формуле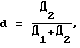 где Д1 и Д2 – оптическая плотность диализуемого раствора и диализата соответственно на определенный момент диализа. В результате исследований подобраны следующие оптимальные условия получения лецитиновых мембран (табл. 1-6). Как видно из табл. 1, при диализе растворов полисахаридов через париетальный лист брюшины крысы и лецитиновую мембрану степень диализа приблизительно одинакова, что свидетельствует об идентичности указанных мембран. При диализе через целлофановую мембрану степень диализа завышена, по-видимому, из-за инертного характера мембраны. Как видно из табл. 2, из изученных растворителей лучше всего для растворения лецитина подходит спирт этиловый. Как следует из табл. 3, максимальная растворимость лецитина достигается при использовании этанола в концентрации 95%. Из табл. 4 следует, что оптимальная температура растворителя – 95% этанола – для максимального растворения лецитина соответствует 78oС (температура кипения растворителя); это соответствует концентрации лецитина в 95% этаноле 6%. Таким образом, коэффициент растворимости лецитина при температуре кипения этанола 78oС составляет 6 г/100 г 95% спирта. Как было указано выше, мембранам, выделенным из брюшины крысы, по диаметру пор соответствуют плотные бумажные фильтры “синяя лента”. Как видно из табл. 5, для пропитки десяти бумажных фильтров диаметром 5-20 см (с рабочей площадью 15-300 см2) используется от 80 до 130 мл 6% спиртового раствора лецитина. Этот объем раствора является избыточным и необходим для полного погружения фильтров в раствор. Как видно из табл. 6, при погружении бумажных фильтров в раствор лецитина в течение 48 ч фильтры полностью пропитываются, что подтверждается их равномерным окрашиванием в светло-желтый цвет, присущий лецитину. Заявляемый способ получения моделей биологических мембран поясняется следующими примерами конкретного выполнения. ПРИМЕР 1. В круглодонную колбу со шлифом вместимостью 250 мл, соединенную с обратным холодильником, вносят 100 г 95 мас.% спирта этилового; содержимое колбы нагревают на кипящей водяной бане до кипения спирта (температура кипения 78oС), затем в колбу вносят 6 г лецитина и продолжают нагревание до растворения лецитина. Колбу с содержимым охлаждают и раствор лецитина желтого цвета переливают в чашку Петри; в раствор погружают 10 бумажных фильтров “синяя лента” диаметром 10 см (рабочая площадь 50 см2), выдерживают в течение 48 ч. Затем фильтры вынимают и остатки растворителя удаляют в вытяжном шкафу. Целевой продукт – мембраны – представляют собою фильтры с воскообразной поверхностью светло-желтого цвета; окраска равномерная по всей поверхности. Степень диализа через полученную мембрану 1% раствора альгината натрия составляет 0,580; 1% раствора свекловичного пектина 0,848. ПРИМЕР 2. В колбу со шлифом вместимостью 250 мл, соединенную с обратным холодильником, вносят 80 г 90 мас. % спирта этилового; содержимое колбы нагревают на кипящей водяной бане до температуры 60oС (контролируется по термометру), затем в колбу вносят 4 г лецитина и нагревают до растворения лецитина (5% раствор). Колбу с содержимым охлаждают и раствор лецитина переносят в чашку Петри; в раствор погружают 10 бумажных фильтров “синяя лента” диаметром 5 см (рабочая площадь 15 см2), выдерживают в течение 72 ч. Затем фильтры вынимают и удаляют остатки спирта деаэрацией в вытяжном шкафу. Степень диализа через полученные мембраны: 1% раствора альгината натрия составляет 0,595; 1% раствора свекловичного пектина 0,867. ПРИМЕР 3. В колбу со шлифом вместимостью 250 мл, соединенную с обратным холодильником, вносят 130 г 80 мас.% спирта этилового; содержимое колбы нагревают на кипящей водяной бане до температуры 40oС (контроль температуры по термометру), затем в колбу вносят 5,2 г лецитина и нагревают до растворения лецитина (4% раствор). Колбу с содержимым охлаждают и переносят раствор в кристаллизатор; в раствор погружают 10 бумажных фильтров “синяя лента” диаметром 20 см (рабочая площадь 300 см2), выдерживают в течение 36 ч, после чего фильтры вынимают из раствора и остаток спирта удаляют деаэрацией в вытяжном шкафу. Степень диализа через мембрану: 1% раствора альгината натрия 0,621; 1% раствора свекловичного пектина 0,888. Из оставшихся спиртовых растворов регенерируют спирт отгонкой. Таким образом, предлагаемый способ обеспечивает следующий положительный эффект: 1) обеспечивается создание мембран, близких по природе к естественным мембранам, выделенным из организма животных, т.к. предлагаемые мембраны пропитываются раствором лецитина – основным компонентом биологических мембран. Это подтверждается близкими значениями степени диализа на примере полисахаридов. 2) полученные мембраны могут храниться и использоваться в течение длительного срока, не подвергаясь различным процессам деструкции, что характерно для изолированных натуральных мембран. В результате порчи изолированных естественных мембран при окислении, гниении образуются прежде всего ароматические аминокислоты (триптофан, тирозин, фенилаланин), которые могут реагировать с исследуемыми лекарственными веществами, что приводит к неадекватным результатам, в то время как лецитин не подвергается деструкции в условиях эксперимента. 3) предлагаемые мембраны можно изготавливать по мере их необходимости, непосредственно перед проведением исследований. 4) лецитиновые мембраны отличаются комфортностью применения. 5) предлагаемые мембраны могут иметь различную рабочую поверхность в пределах 15-300 см2 (подбор диаметра фильтра можно производить по мере необходимости в зависимости от объема диализуемого раствора), в то время как рабочая поверхность естественных мембран, даже самых крупных, очень незначительна (1,8 см2). Как известно, по закону Фика 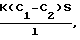 (где К – коэффициент пропорциональности, характеризующей сродство веществ к воде и липоидам, или гидрофильно-липофильный баланс (отношение величины сольватации липоидов к величине сольватации воды) – величина постоянная для каждого конкретного вещества; C1 и С2 – концентрации веществ по обе стороны мембраны соответственно, S – площадь рабочей поверхности мембраны, l – толщина мембраны), с увеличением площади рабочей поверхности степень диализа возрастает, поэтому использование мембран с большей поверхностью позволит ускорить диализ исследуемых растворов. 6) изготовление лецитиновых мембран отличается упрощенностью и доступностью используемых материалов и реактивов: применяемый для пропитки фильтров лецитин имеет широкое применение как компонент различных кондитерских изделий, а бумажные фильтры “синяя лента” имеются в наличии в любой химической лаборатории. При этом нет необходимости проводить забой животных. Кроме того, отделение даже самой крупной мембраны из брюшины крысы от мышечного и косного слоя очень трудоемко и длительно. 7) применение лецитиновых мембран для диализа исследуемых растворов с использованием в качестве растворителя 0,154 моль/л хлорида натрия (изотонический раствор) при температуре 37oС позволяет максимально моделировать процессы высвобождения и изучения биологической доступности лекарственных веществ в организме человека. Формула изобретения
РИСУНКИ
MM4A Досрочное прекращение действия патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 31.07.2003
Извещение опубликовано: 27.09.2004 БИ: 27/2004
|
||||||||||||||||||||||||||
