Патент на изобретение №2202113
|
||||||||||||||||||||||||||
(54) СПОСОБ ОПРЕДЕЛЕНИЯ ТАФЦИНА В БИОЛОГИЧЕСКИХ ОБРАЗЦАХ
(57) Реферат: Изобретение относится к медицине и биологии, а именно к способам исследования биологических материалов. Способ заключается в следующем: в анализируемый биологический образец вводят [D-Arg] изомер тафцина, пробу экстрагируют, в полученном экстракте тафцин и его [D-Arg] изомер превращают в их бензоиновые производные, которые определяют методом ВЭЖХ с флуоресцентным детектированием. Способ позволяет определять микроколичества тафцина в биологических образцах. 2 табл., 2 ил. Изобретение относится к органической, аналитической и биологической химии и может найти применение в биологии и в медицине. Известен тафцин – тетрапептид Thr-Lys-Pro-Аrg формулы 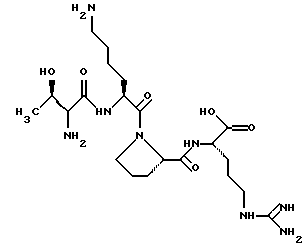 Известен способ определения тафцина в биологических образцах, включающий их экстракцию и анализ полученных экстрактов (Naim J.O. et al. Analytical Biochemistry, 1987, v.164, p.221-226 [3]) – прототип.
Экстракты, получаемые данным известным способом, хроматографируют с последующим масс-спектрометрическим анализом требуемой фракции.
Однако данный известный способ требует наличия сложного оборудования, является трудоемким и дорогим. Кроме того, низкая чувствительность способа требует больших объемов исследуемых биологических образцов (10-20 мл).
Техническим результатом, достигаемым настоящим изобретением, является рекомендация условий по определению субнанограммовых количеств тафцина в малых объемах биологических образцов.
Указанный технический результат достигается тем, что в способе определения тафцина в биологических образцах, включающем экстракцию образцов и анализ полученных экстрактов, отличительной особенностью является то, что предварительно в пробу вводят [D-Arg] изомер тафцина, в полученном экстракте тафцин и его [D-Arg] изомер превращают в бензоиновые бензоиновые производные, которые определяют методом ВЭЖХ с флуоресцентным детектированием.
Собственные исследования показали, что при введении в анализируемый биологический образец [D-Аrg] изомера тафцина с последующим получением их бензоиновых производных пороговую чувствительность определения тафцина можно значительно повысить, т.к. химические свойства тафцина и его [D-Arg] изомера идентичны, что делает идентичными и их потери при подготовке пробы. И выходы в реакциях получения производных тождественны, а хроматографические свойства различаются (они имеют разные времена удерживания при анализе методом ВЭЖХ). Т. е. [D-Arg] изомер является идеальным внутренним стандартом, позволяющим определять абсолютные концентрации природного тафцина.
Таким образом, исследования показали возможность определения методом ВЭЖХ малых количеств тафцина в виде его бензоинового производного. При этом метод анализа оказывается в 5-10 раз более чувствительным, чем описанный в прототипе [3].
Найденный предел обнаружения тафцина в виде бензоинового производного для образцов плазмы крови и ликвора – 0,3-0,5 нг на пробу.
Способ реализуется следующим образом.
Анализ биологических проб проводят методом ВЭЖХ (табл.1). Для расчета концентрации тафцина используется метод внутреннего стандарта (программно-аппаратный комплекс сбора и обработки хроматографических данных “МультиХром 1,5”, OOO “Амперсенд”). Концентрация добавленного стандарта – 20-50 нг/мл. Детектирование элюента по флуоресценции проводят с помощью флуориметра FP820 фирмы Jasco (фиг.1,2).
Метод внутреннего стандарта позволяет учесть потери тафцина при подготовке пробы и проведении реакции получения бензоиновых производных тафцина и [D-Arg] тафцина.
Ниже приведены примеры, иллюстрирующие изобретение.
Пример 1. Приготовление бензоиновых производных тафцина и его [D-Аrg] изомера
Известен способ определения тафцина в биологических образцах, включающий их экстракцию и анализ полученных экстрактов (Naim J.O. et al. Analytical Biochemistry, 1987, v.164, p.221-226 [3]) – прототип.
Экстракты, получаемые данным известным способом, хроматографируют с последующим масс-спектрометрическим анализом требуемой фракции.
Однако данный известный способ требует наличия сложного оборудования, является трудоемким и дорогим. Кроме того, низкая чувствительность способа требует больших объемов исследуемых биологических образцов (10-20 мл).
Техническим результатом, достигаемым настоящим изобретением, является рекомендация условий по определению субнанограммовых количеств тафцина в малых объемах биологических образцов.
Указанный технический результат достигается тем, что в способе определения тафцина в биологических образцах, включающем экстракцию образцов и анализ полученных экстрактов, отличительной особенностью является то, что предварительно в пробу вводят [D-Arg] изомер тафцина, в полученном экстракте тафцин и его [D-Arg] изомер превращают в бензоиновые бензоиновые производные, которые определяют методом ВЭЖХ с флуоресцентным детектированием.
Собственные исследования показали, что при введении в анализируемый биологический образец [D-Аrg] изомера тафцина с последующим получением их бензоиновых производных пороговую чувствительность определения тафцина можно значительно повысить, т.к. химические свойства тафцина и его [D-Arg] изомера идентичны, что делает идентичными и их потери при подготовке пробы. И выходы в реакциях получения производных тождественны, а хроматографические свойства различаются (они имеют разные времена удерживания при анализе методом ВЭЖХ). Т. е. [D-Arg] изомер является идеальным внутренним стандартом, позволяющим определять абсолютные концентрации природного тафцина.
Таким образом, исследования показали возможность определения методом ВЭЖХ малых количеств тафцина в виде его бензоинового производного. При этом метод анализа оказывается в 5-10 раз более чувствительным, чем описанный в прототипе [3].
Найденный предел обнаружения тафцина в виде бензоинового производного для образцов плазмы крови и ликвора – 0,3-0,5 нг на пробу.
Способ реализуется следующим образом.
Анализ биологических проб проводят методом ВЭЖХ (табл.1). Для расчета концентрации тафцина используется метод внутреннего стандарта (программно-аппаратный комплекс сбора и обработки хроматографических данных “МультиХром 1,5”, OOO “Амперсенд”). Концентрация добавленного стандарта – 20-50 нг/мл. Детектирование элюента по флуоресценции проводят с помощью флуориметра FP820 фирмы Jasco (фиг.1,2).
Метод внутреннего стандарта позволяет учесть потери тафцина при подготовке пробы и проведении реакции получения бензоиновых производных тафцина и [D-Arg] тафцина.
Ниже приведены примеры, иллюстрирующие изобретение.
Пример 1. Приготовление бензоиновых производных тафцина и его [D-Аrg] изомераК высушенной биологической пробе добавили реагенты в следующем порядке: 50 мкл (4 мМ бензоин в метилцеллозольве, 2 мг/мл), 50 мкл (0,2 М сульфит натрия, 25 мг/мл), 50 мкл (0,1 М меркаптоэтанол, 10 мкл/мл), 50 мкл (0,5 М NaOH). После тщательного перемешивания раствор выдерживали 30 мин при 45oС. Реакция прекращается добавлением 50 мкл (0,25 М трис-НСl + 0,5 М HCl). 50 мкл раствора заводят на колонку для анализа. Пример 2. Твердофазная экстракция тафцина и его [D-Аrg] изомера из ликвора В полипропиленовый наконечник объемом 1 мл помещают примерно 50 мкл сорбента LiChrosorb C18, 30-40 мкм. Полученный патрон последовательно промывают 300 мкл метанола, 3 раза по 300 мкл 0,25% раствора трифторуксусной кислоты (ТФК). В микропробирке смешивают 50 мкл ликвора, 50 мкл 0,25% р-ра ТФК, 20-50 нг [D-Аrg] изомера тафцина. Полученную смесь наносят на подготовленный микропатрон с сорбентом и продавливают аргоном. Патрон промывают 2 раза по 50 мкл 0,25% ТФК, затем содержащую тафцин фракцию смывают 2 раза по 50 мкл 0,25% ТФК в метаноле и упаривают в вакуум-эксикаторе до объема около 30 мкл. Выход тафцина – 30-50%. Пример 3. Твердофазная экстракция тафцина и его [D-Аrg] изомера из ликвора В этом варианте используется ион-парный реагент (пентансульфонат натрия) для увеличения константы сорбции тафцина на фазе C18. Показано, что присутствие пентансульфоната натрия не мешает реакции образования бензоиновых производных. В полипропиленовый наконечник объемом 1 мл помещают примерно 50 мкл сорбента LiChrosorb C18, 30-40 мкм. Полученный патрон последовательно промывают 300 мкл метанола, 3 раза по 300 мкл раствором 10 мМ раствора пентансульфоната натрия в 50 мМ растворе КН2РO4 (рН 5) (раствор А). В микропробирке смешивается 50 мкл ликвора, 100 мкл раствора (А) ТФК, 20-50 нг [D-Аrg] изомера тафцина. Полученную смесь наносят на подготовленный микропатрон с сорбентом и продавливают аргоном. Патрон промывают 2 раза по 100 мкл раствором (А), 2 раза по 100 мкл смесью 10% метанола в (А), затем содержащую тафцин фракцию смывают двумя порциями по 50 мкл смесью 30% метанола в (А) и лиофильно высушивают. Выход тафцина -85-90%. Пример 4. Твердофазная экстракция тафцина и его [D-Аrg] изомера из плазмы крови 200 мкл LiChrosorb C18, 30-40 мкм помещают в патрончик объемом в 1 мл. Патрончик последовательно промывают 500 мкл метанола и 2х500 мкл (А). К 500 мкл плазмы добавляют 20-50 нг [D-Аrg] изомера тафцина, 500 мкл (А) и наносят на патрончик. Промывают патрончик 2х500 мкл (А), затем 500 мкл смеси (метанол -(А), 10:90), затем 250 мкл смеси метанол – вода – ТФУ (10:90:0,1). Тафцин смывают 500 мкл смеси метанол – вода – ТФУ (30:70:0,1). Раствор высушивают на лиофильной сушке для последующего получения бензоиновых производных. Эта методика позволяет выделять из биологической жидкости 85-90% содержащегося в ней тафцина. Пример 5. Анализ тафцина в биологических образцах Разработанная методика (примеры 1-4) использовалась для определения тафцина в биологических образцах ликвора и плазмы крови методом ВЭЖХ с использованием бензоиновых производных (табл.2). При этом показано, что с использованием метода анализа в виде бензоиновых производных возможно определение концентрации тафцина в спинномозговой жидкости и плазме крови от 0,3-0,5 нг/мл (предел обнаружения метода). Таким образом, способ согласно изобретению позволяет определять микроколичества тафцина в биологических образцах. Формула изобретения
РИСУНКИ
|
||||||||||||||||||||||||||
