Патент на изобретение №2201937
|
||||||||||||||||||||||||||
(54) ПРОИЗВОДНЫЕ D-ПРОЛИНА
(57) Реферат: Изобретение относится к производным D-пролина общей формулы 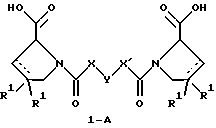 или 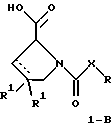 где R – SH, бензил или фенил, необязательно замещенный гидроксигруппой или низшей алкоксигруппой, или группа формулы  R1 – водород или галоген; Х обозначает -(СН2)n-; -СН(R2)(CH2)n-; -СН2O(СН2)n-; CH2NH-; бензил, -C(R2)=СН-; СН2СН (ОН)- или тиазол-2,5-диил; Y обозначает -S-S-; (CH2)n; -О-; -NH-; -N (R2)-; -СН=СН-; -NHC(O)NH-; -N(R2)C(O)N(R2)-; -N[СН2С6Н3(ОСН3)2]-; -N(СН2С6Н5)-; -N(СН2С6Н5)С(O)N(СН2С6Н5)-; -N-(алкоксиалкил)-; -N-(циклоалкилметил)-; 2,6-пиридил; 2,5-фуранил; 2,5-тиенил; 1,2-циклогексил; 1,3-циклогексил; 1,4-циклогексил; 1,2-нафтил; 1,4-нафтил; 1,5-нафтил; 1,6-нафтил или дифенилен; 1,2-фенилен; 1,3-фенилен или 1,4-фенилен, где фениленовые группы необязательно замещены 1-4 заместителями, выбранными из группы, включающей галоген, низший алкил, низшую алкоксигруппу, гидроксигруппу, карбоксигруппу, -СОО-низший алкил, нитрил, 5-тетразол, (2-карбоксипирролидин-1-ил)-2-оксоэтоксигруппу, N-гидроксикарбамимидоил, 5-оксо[1,2,4]оксадиазолил, 2-оксо[1,2,3,5] оксатиадиазолил, 5-тиоксо[1,2,4]оксадиазолил и 5-трет-бутилсульфанил[1,2,4] оксадиазолил; X’ обозначает -(CH2)n-; (CH2)n CH(R2)-; -(СН2)nОСН2-; -NHCH2-; бензил, -CH= C(R2)-; -CH(OH)CH2– или тиазол-2,5-диил; R2 обозначает низший алкил, низшую алкоксигруппу или бензил и n = 0-3, их фармацевтически приемлемым солям, моно- и диэфирам, за исключением (R)-1-[(R)- и (R)-1-[(S)-3-меркапто-2-метилпропионил] пирролидин-2-карбоновых кислот; лекарственному средству, обладающему амилоидозной активностью, и способу получения этих производных. 3 с. и 12 з.п.ф-лы, 2 табл. Настоящее изобретение относится к D-пролинам формулы 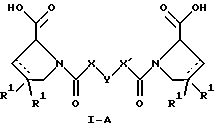 или 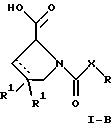 где R обозначает SH, бензил или фенил, необязательно замещенный гидроксигруппой или низшей алкоксигруппой, или группу формулы 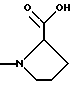 R1 обозначает водород или галоген; X обозначает -(CH2)n-; -CH(R2)(CH2)n-; -СН2O(CH2)n-; -CH2NH-; бензил, -C(R2)=CH-, -СН2СH(ОН)- или тиазол-2,5-диил; Y обозначает -S-S-; -(CH2)n-; -О-; -NH-; -N(R2)-; -CH=CH-; -NHC(O)NH-; -N(R2)C(O)N(R2)-; -N[СH2С6H3(ОСH3)2]-; -N-(CH2C6H5)-; -N(СН2С6Н5)С(O)N(СН2С6Н5)-; -N-(алкоксиалкил)-; -N-(циклоалкилметил)-; 2,6-пиридил; 2,5-фуранил; 2,5-тиенил; 1,2-циклогексил; 1,3-циклогексил; 1,4-циклогексил; 1,2-нафтил; 1,4-нафтил; 1,5-нафтил; 1,6-нафтил; дифенилен; 1,2-фенилен; 1,3-фенилен или 1,4-фенилен, где фениленовые группы необязательно замещены 1-4 заместителями, выбранными из группы, включающей галоген, низший алкил, низшую алкоксигруппу, гидроксигруппу, карбоксигруппу, -СОО-низший алкил, нитрил, 5-тетразол, (2-карбоксипирролидин-1-ил)-2-оксоэтоксигруппу, N-гидроксикарбамимидоил, 5-оксо[1,2,4]оксадиазолил, 2-оксо[1,2,3,5] оксатиадиазолил, 5-тиоксо[1,2,4]оксадиазолил и 5-трет-бутилсульфанил[1,2,4] оксадиазолил; X’ обозначает -(CH2)n-; -(СН2)nСH(R2)-; -(СН2)ОСН2-; -NHCH2-; бензил, -CH=C(R2)-; -CH(OH)CH2– или тиазол-2,5-диил; R2 обозначает низший алкил, низшую алкоксигруппу или бензил и n = 0-3, к их фармацевтически приемлемым солям, моно- и диэфирам. Соединения формул I-A и I-B являются новыми, за исключением (R)-1-[(R)- и (R)-1-[(S)-3-меркапто-2-метилпропионил]пирролидин-2-карбоновых кислот. Эти соединения описаны в WO 97/10225 как обладающие антибактериальным действием против B. fragilis. Более того, в J. Comput. -Aided Mol. Des. (1987), 1(2) 133-42, описано их использование в теоретическом исследовании ингибиторов ангиотензин-конвертирующего фермента. Соединения формул I-A и I-B могут содержать по 4 или 2 асимметрических углеродных атома. Таким образом, настоящее изобретение включает все стереоизомерные формы соединений формул I-A и I-B, включая каждый из индивидуальных энантиомеров и их смеси. Неожиданно было установлено, что D-пролины формул I-A и I-B могут быть использованы для лечения или профилактики всех форм центрального и системного амилоидоза, являющегося следствием нарушений белкового обмена, при котором растворимые в нормальном состоянии аутологические белки откладываются в тканях в форме аномально нерастворимых фибрилл, вызывающих структурные и функциональные нарушения. Самыми распространенными заболеваниями, которые обусловлены амилоидозом, являются болезнь Альцгеймера (БА), начало возрастного сахарного диабета или амилоидоз – как существенная причина неишемической сердечной недостаточности, – как осложнение при длительном гемодиализе при почечной недостаточности, – как осложнение при моноклональной гаммапатии, – как результат хронических воспалительных заболеваний, – как результат хронических инфекционных болезней, – как результат раковых заболеваний некоторых типов. Более того, амилоидоз охватывает множество различных болезней, таких, как формы наследственного амилоидоза, чаще всего семейной амилоидной полинейропатии (СПП), чесотка и болезнь Крейцфельда- Якоба. Общим патологическим признаком этих заболеваний является внеклеточное отложение так называемых амилоидных белков в b-структурированных волокнах и одинаковые особенности окраски. Амилоидный компонент Р сыворотки (АР С) является обычным белком плазмы и предшественником амилоидного компонента, универсального составляющего аномальных отложений в тканях при амилоидозе. Он стоек к действию протеаз и, следовательно, играет ключевую роль в персистенции амилоида in vivo. Для лечения были найдены фармацевтически активные соединения, которые, по-видимому, предотвращают взаимодействие АРС с амилоидными фибриллами. Было показано, что это взаимодействие представляет собой скорее взаимодействие с белковым волокном, а не взаимодействие с более общими волокнистыми компонентами, такими, как гликозаминогликаны. АРС представляет собой пентамер 5 идентичных, нековалентно связанных подзвеньев. Два пентамера могут быть нековалентно связаны в декамер посредством двух пентамерных дископодобных колец, которые взаимодействуют непосредственно между собой. АРС является кальцийзависимым лигандным связывающим белком. Он продуцируется и разлагается только в гепатоцитах и исключительно стоек вне печени. Участие АРС в патогенезе или амилоидозе in vivo является подтверждением того, что ингибирование связи с амилоидными фибриллами представляет значительный интерес с точки зрения терапии ряда серьезных заболеваний человека. Объектом настоящего изобретения являются вышеупомянутые соединения формул I-A и I-B, их соли и эфиры как таковые и в качестве терапевтически действующих веществ, их получение и их применение для терапевтических целей и соответственно для приготовления соответствующих лекарственных средств, а также лекарственные средства, содержащие соединения формул I-A и I-B, их соли и эфиры, и приготовление таких лекарственных средств для упомянутых целей. Термин “низший алкил” обозначает прямоцепочечные или разветвленные насыщенные углеводородные остатки, предпочтительно с 1-4 углеродными атомами, такие, как метил, этил, пропил, изопропил, н-бутил, 2-бутил, изобутил и трет-бутил. Термин “галоген” обозначает хлор, иод, фтор и бром. Соединения формул I-A и I-B могут образовывать соли с металлами, например соли щелочных металлов, такие, как натриевые и калиевые соли, или соли щелочно-земельных металлов, такие, как соли кальция и магния, с органическими основаниями, например соли с аминами, такими, как N-этилпиперидин, прокаин и дибензиламин, или же соли с основными аминокислотами, такие, как соли с аргинином и лизином. Эти соли можно получать и выделять с использованием методов, которые в данной области техники хорошо известны. Эти соединения могут быть также использованы в эфирной форме, причем такие эфиры могут быть алифатическими или ароматическими, например, такими, как алкильные и фенольные эфиры. Самыми предпочтительными эфирами являются алкильные эфиры, полученные из С1-4алканолов, прежде всего метиловый и этиловый эфиры. Соединения формул I-A и I-B могут быть также использованы в форме их пролекарств с одной или двумя карбонильными функциями. В качестве примеров можно назвать эфиры, внутренние эфиры, фосфатные эфиры, двойные эфиры, эфиры амидогликолевой кислоты, глицеридные сопряженные производные, дигидропиридиновые производные и 8-(гидроксиметил)-1-нафтилметилдисульфидные эфиры. Пролекарства способны повысить ценность предлагаемых соединений за счет абсорбции, фармакокинетики при распределении и переносе к головному мозгу (WO 95/14705; Н. Bundgaard и др., Drugs of Future, 16, 443, 1991; A.N. Saab и др. , Pharmaceutical Science, 79, 802, 1990; D.M. Lambert и др., Current Medical Chemistry 1, 376, 1995). Предпочтительными являются соединения формулы I-A. В рамках настоящего изобретения особенно предпочтительными соединениями формулы I-A являются те, у которых Х обозначает -CH(R2)(CH2)n-, где R2 обозначает метил или метоксигруппу, а n=0 или 1. Их примерами являются следующие соединения: (R)-1-{ (S)-3-[(S)-3-[(R)-2-карбоксипирролидин-1-ил] -2-метил-3-оксопропилдисульфанил] -2-метилпропионил} пирролидин-2-карбоновая кислота, (R)-1-{ 8-[(R)-2-карбоксипирролидин-1-ил] -2,7-диметил-8-оксооктаноил} пирролидин-2-карбоновая кислота, (R)-1-{ 8-[(R)-2-карбоксипирролидин-1-ил] -2,7-диметокси-8-оксооктаноил} пирролидин-2-карбоновая кислота и (R)-1-{ 6-[(R)-2-карбоксипирролидин-1-ил] -2,5-диметил-6-оксогексаноил} пирролидин-2-карбоновая кислота (смесь 3 диастереоизомеров). Особенно предпочтительны также соединения, у которых Х обозначает -(CH2)n-, a n=0 или 1. К таким соединениям относятся: (R)-1-{ 7-[(R)-2-карбоксипирролидин-1-ил] -7-оксогептаноил}пирролидин-2-карбоновая кислота, (R)-1-{ 6-[(R)-2-карбоксипирролидин-1-ил] -6-оксогексаноил}пирролидин-2-карбоновая кислота, (R)-1-{ 5-[(R)-2-карбоксипирролидин-1-ил] -5-оксопентаноил]пирроли-дин-2-карбоновая кислота, (R)-1-{ { 4-[2-[(R)-2-карбоксипирролидин-1-ил] – 2-оксоэтил} фенил} ацетил} пирролидин-2-карбоновая кислота, (R)-1-{ 3-[2-[(R)-2-карбоксипирролидин-1-ил] -2-оксоэтокси] уреидо} пирролидин-2-карбоновая кислота, (R)-1-{ { бензил-[2-[(R)-2-карбоксипирролидин-1-ил] -2-оксоэтил] амино} ацетил} пирролидин-2-карбоновая кислота, (R)-1-{ цис-4-[(R)-2-карбоксипирролидин-1-карбонил] циклогексанкарбонил} пирролидин-2-карбоновая кислота и (R)-1-{[3-[2-[(R)-2-карбоксипирролидин-1-ил] -2-оксоэтил] фенил} ацетил} пирролидин-2-карбоновая кислота. Кроме того, предпочтительны соединения формулы I-A, у которых Х обозначает -СН2О-. Их примерами являются следующие соединения: (R)-1-{ { 2-[2-[(R)-2-карбоксипирролидин-1-ил] – 2-оксоэтокси] фенокси} ацетил} пирролидин-2-карбоновая кислота, (R)-1-{ { 4-[2-[(R)-2-карбоксипирролидин-1-ил] – 2-оксоэтокси] фенокси} ацетил} пирролидин-2-карбоновая кислота, (R)-1-{ { 4-[2-[(R)-2-карбоксипирролидин-1-ил] – 2-оксоэтокси]-2-метоксифенокси} ацетил} пирролидин-2-карбоновая кислота, (R)-1-{ { 3-[2-[(R)-2-карбоксипирролидин-1-ил] – 2-оксоэтокси] фенокси} ацетил} пирролидин-2-карбоновая кислота, (R)-1-{ { 3-[2-[(R)-2-карбоксипирролидин-1-ил] -2-оксоэтокси] -2-метилфенокси} ацетил} пирролидин-2-карбоновая кислота и (R)-1-{ { 5-[2-[(R)-2-карбоксипирролидин-1-ил] -2-оксоэтокси] нафталин-1-илокси} ацетил} пирролидин-2-карбоновая кислота. Дополнительными предпочтительными соединениями являются те, у которых Х обозначает -CH2NH. Примером таких соединений является (R)-1-{{4-[2-[(R)-2-карбоксипирролидин-1-ил] -2-оксоэтиламино] фениламино} ацетил} пирролидин-2-карбоновая кислота. Предпочтительны далее соединения, у которых Х обозначает -СН2СH(ОН)-. Таким соединением является, например, (2Е,4Е)-(R)-1-{6-[(R)-2-карбоксипирролидин-1-ил] – 2,5 -диметил – 6 – оксогекса -2,4 -диеноил} пирролидин – 2 -карбоновая кислота. Вышеупомянутые соединения формул I-A и I-B могут быть получены в соответствии с изобретением а) превращением соединения формулы 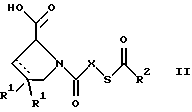 в соединение формулы 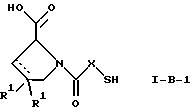 а затем в соединение формулы 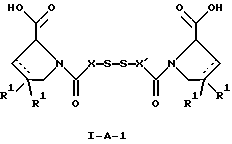 где R1, Х и X’ имеют указанные выше значения, a R2 обозначает низший алкил или б) обработкой соединения формулы 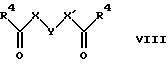 соединением формулы 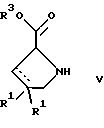 с получением соединения формулы 1-А посредством удаления защитной группы, где X, Y и X’ имеют указанные выше значения, a R4 обозначает гидроксигруппу или галоген, или в) взаимодействием соединения формулы 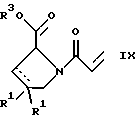 с амином формулы NH2R5 и удалением защитной группы из соединения формулы 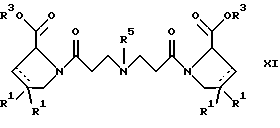 где R1 и R3 имеют указанные выше значения, а R5 обозначает водород, низший алкил, низшую алкоксигруппу, бензил, низший алкоксиалкил, циклоалкилметил или -СН2С6Н3(ОСН3)2, или г) взаимодействием соединения формулы 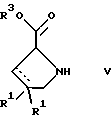 с соединением формулы 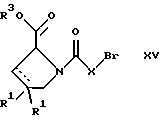 и удалением защитной группы из соединения формулы 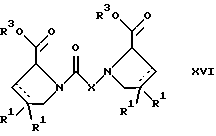 где R1, R3 и Х имеют указанные выше значения, или д) взаимодействием соединения формулы 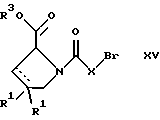 с соединением формулы 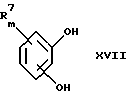 и удалением защитной группы из соединения формулы 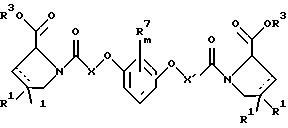 где R1, R3 и Х имеют указанные выше значения, а R7 обозначает галоген, низший алкил, низшую алкоксигруппу, гидроксигруппу, карбоксигруппу, -СОО-низший алкил, нитрил, 5-тетразол, (2-карбоксипирролидин-1-ил)-2-оксоэтокси, N-гидроксикарбамимидоил, 5-оксо[1,2,4] оксадиазолил, 2-оксо-[1,2,3,5]оксатиадиазолил, 5-тиоксо [1,2,4]оксадиазолил или 5-трет-бутилсульфанил[1,2,4] оксадиазолил, a m=0-4, или е) удалением защитной группы из соединений формул 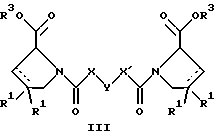 и 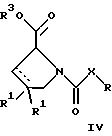 где R, R1, X, Y и X’ имеют указанные выше значения, a R3 обозначает защитную группу, с получением соединений формулы IA или IB и при необходимости превращением соединений общей формулы IA или IB в фармацевтически приемлемые соли или в моно- или диэфиры. В соответствии с вариантом а) способа соединение формулы I-A-1 получают превращением соединения формулы II, например 1-[(S)-3-ацетилсульфанил-2-метилпропионил] -(R)-пирролидин-2-карбоновой кислоты, в соединение формулы I-B-1, а затем в соединение формулы I-A-1. Эту реакцию целесообразно проводить в инертной атмосфере при комнатной температуре в присутствии аммиака в растворителе, таком, как метанол. После перемешивания в течение приблизительно 2 ч соединение выделяют и в дальнейшем продукт реакции можно обрабатывать до требуемой степени чистоты в соответствии с общеизвестными методами. Соединения формулы I-A-1 получают перемешиванием упомянутого выше соединения при комнатной температуре в растворе CuSO4 в воде. Конкретные условия проведения реакции более подробно описаны в примерах. В соответствии с реакционной стадией б) D-пролин с защитной группой обрабатывают соответствующей дикарбоновой кислотой или соответствующим ацетилгалогенидом при 0oС. Предпочтительны следующие дикарбоновые кислоты: 2,4-диметилглутаровая кислота, 2,3-диметилянтарная кислота, циклогексан-1,4-дикарбоновая кислота, циклогексан-1,3-дикарбоновая кислота, циклогексан-1,2-дикарбоновая кислота, 1,4-фенилендиуксусная кислота, 1,3-фенилендиуксусная кислота, бензол-1,4-дикарбоновая кислота, бензол-1,3-дикарбоновая кислота, пиридин-2,6-дикарбоновая кислота, тиофен-2,5-дикарбоновая кислота, фуран-2,5-дикарбоновая кислота, адипиновая кислота, 1,4-фенилендиуксусная кислота, 1,2-фенилендиуксусная кислота, (4- карбоксиметилнафталин-1 -ил) уксусная кислота, (6-карбоксиметилпиридин- 2-ил) уксусная кислота, (5-карбоксиметилтиофен-2-ил)уксусная кислота, 2,5-диметоксигександикислота, 2,5-дибензилгекс-3-ендикислота и 2,5-диизопропилгек-3-ендикислота. Подробная методика описана в примерах раздела “Общая методика А”. На реакционной стадии в) предусмотрена обработка амина, например пропиламина, циклопропилметиламина, метоксиэтиламина, бензиламина или вератриламина, соединением формулы IX. Эту реакцию проводят при температуре в пределах 20-80oС в растворителе, таком, как ацетонитрил. В соответствии с вариантом г) получают соединение формулы I-B. К соединению формулы XV в дихлорметане при 0oС добавляют соответствующее бромацетиловое производное, такое, как бромацетилбромид, и соединение формулы V. Удаление защитной группы можно осуществлять по методам, которые известны в данной области техники. Соединения, у которых Y обозначает необязательно замещенную 1,2-, 1,3- или 1,4-фениленовую группу, могут быть получены в соответствии с вариантом д). К соединению формулы XV добавляют соответствующее дигидроксипроизводное формулы XVII. Реакцию ведут в диметилформамиде при комнатной температуре. Предпочтительны следующие дигидроксипроизводные: гидрохинон, тетрафторгидрохинон, хлоргидрохинон, метоксигидрохинон, резорцин, 2,6-дигидрокситолуол, 5-метоксирезорцин, 3,5-дигидроксибензоат, 3,5-дигидросибензонитрил, флороглюцин, пирогаллол-1-метиловый эфир, 3-метилкатехин, тетрахлоркатехин, 2,6-дигидроксинафталин, 1,5-дигидроксинафталин, 2,3-дигидроксинафталин, 2,2′-дигидроксидифенил, 1,4-нафтохинон и 2,7-дигидроксинафталин. В соответствии с вариантом е) способа у соединения формулы III или IV удаляют защитную группу, получая соединение общей формулы I-A или I-B. Приемлемые защитные группы и методы их удаления известны в данной области техники, хотя, что очевидно, можно использовать только те защитные группы, которые могут быть удалены с помощью методов, при осуществлении которых другие структурные элементы остаются незатронутыми. Предпочтительными O-защитными группами являются трет-бутильная группа и бензильная группа. Процесс проводят обычным путем. Так, например, соединение формулы III растворяют в приемлемом растворителе или смеси растворителей, таких, как этанол и этилацетат, и при комнатной температуре и под атмосферным давлением гидрогенизуют в присутствии Pd на угле. Фармацевтически приемлемые соли и эфиры могут быть получены в соответствии с методами, которые известны в данной области техники. На схемах 1-9 отражены процессы получения соединений формул I-A и I-В исходя из известных соединений или из соединений, которые могут быть получены по известным методам. Исходные соединения формул V, VI, VIII, IX, X, XII, XIV, XVII, XX и XXIV представляют собой имеющиеся в продаже продукты или могут быть получены по известным методам. 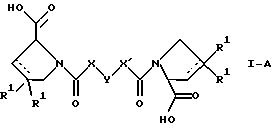 и 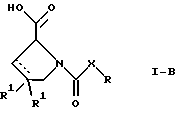 Получение соединений формул I-A и I-B, приведенных в табл. 1, более подробно описано в примерах 1-104. Как сказано выше, соединения общих формул I-A и I-B, предлагаемые в соответствии с изобретением, обладают ценными фармакологическими свойствами. Их можно применять против всех форм центрального и системного амилоидоза, который является следствием нарушений белкового обмена, при котором растворимые в нормальном состоянии аутологические белки откладываются в тканях в форме аномально нерастворимых фибрилл, вызывающих структурные и функциональные нарушения. Соединения общих формул I-A и I-B испытывали по следующей методике. Методика испытаний Связывание АРС (амилоидного компонента Р сыворотки) с амилоидными фибриллами А  (1-42) (1-42)96-луночные планшеты Nunc Fluoro Polysorp покрывали 0,5 мкг/лунку А  (1-42), которые выдерживали в течение 7 дней при 37oС. Планшеты сушили в течение 3 дней при 37oС, промывали 2 порциями по 150 мкл ТС (10 мМ трис, 138 мМ NaCl, 6 мМ CaCl2, 0,05% NаN3 с рН 8,0) с 1% коровьего сывороточного альбумина. Затем в каждую лунку добавляли по 50 мкл ТС, содержавшего 8% коровьего сывороточного альбумина, 25 мкл соединения в ТС и 25 мкл 40 нМ сывороточного амилоидного белка [125I] в ТЕ (10 мМ этиленгликольтетрауксусной кислоты (ЭГТК) вместо Са). Инкубацию проводили в течение ночи при комнатной температуре и лунки дважды промывали 180 мкл ТС, содержавшего 1% коровьего сывороточного альбумина. Для определения радиоактивности в каждую лунку добавляли по 100 мкл продукта Microscint 40 и в приборе TopCount (фирмы Packard) измеряли радиоактивность. ИК50 (в мкМ) предпочтительных соединений формул I-A и I-B находилась в интервале приблизительно 0,2-2,0.
Способность соединений согласно изобретению связывать АРС (амилоидный компонент Р сыворотки) с амилоидными фибриллами (1-42), которые выдерживали в течение 7 дней при 37oС. Планшеты сушили в течение 3 дней при 37oС, промывали 2 порциями по 150 мкл ТС (10 мМ трис, 138 мМ NaCl, 6 мМ CaCl2, 0,05% NаN3 с рН 8,0) с 1% коровьего сывороточного альбумина. Затем в каждую лунку добавляли по 50 мкл ТС, содержавшего 8% коровьего сывороточного альбумина, 25 мкл соединения в ТС и 25 мкл 40 нМ сывороточного амилоидного белка [125I] в ТЕ (10 мМ этиленгликольтетрауксусной кислоты (ЭГТК) вместо Са). Инкубацию проводили в течение ночи при комнатной температуре и лунки дважды промывали 180 мкл ТС, содержавшего 1% коровьего сывороточного альбумина. Для определения радиоактивности в каждую лунку добавляли по 100 мкл продукта Microscint 40 и в приборе TopCount (фирмы Packard) измеряли радиоактивность. ИК50 (в мкМ) предпочтительных соединений формул I-A и I-B находилась в интервале приблизительно 0,2-2,0.
Способность соединений согласно изобретению связывать АРС (амилоидный компонент Р сыворотки) с амилоидными фибриллами  (1-42). Ниже представлены доказательства связи между этой способностью и пригодностью терапевтических агентов для лечения амилоидозов. Амилоидоз является следствием нарушений белкового метаболизма, при котором растворимые в нормальном состоянии аутологические белки откладываются в тканях в форме аномально нерастворимых фибрилл, что приводит к структурным и функциональным нарушениям. Сердцевинная структура фибрилл всегда одинаковая и представляет собой упорядоченные полипептидные цепи (перекрестная укладка (1-42). Ниже представлены доказательства связи между этой способностью и пригодностью терапевтических агентов для лечения амилоидозов. Амилоидоз является следствием нарушений белкового метаболизма, при котором растворимые в нормальном состоянии аутологические белки откладываются в тканях в форме аномально нерастворимых фибрилл, что приводит к структурным и функциональным нарушениям. Сердцевинная структура фибрилл всегда одинаковая и представляет собой упорядоченные полипептидные цепи (перекрестная укладка  –волокон). Другим общим признаком для всех типов амилоидозов является взаимодействие обычных белков плазмы, в частности амилоидного компонента Р сыворотки (АРС), с фибриллами. Участие АРС в патогенезах амилоидозов подтверждает, что ингибирование взаимодействия АРС с амилоидными фибриллами является привлекающей внимание терапевтической мишенью для лечения болезней человека, таких, как болезнь Альцгеймера, т.к. амилоидоз, локализованный в головном мозгe, связан с болезнью Альцгеймера. Целью данного изобретения является обнаружение терапевтических агентов для амилоидозов, которые ингибируют взаимодействие амилоидного компонента Р сыворотки с амилоидными фибриллами. Соответствующие методы тестирования описаны в описании. В табл. 2, представленной в конце описания, даны некоторые специфические данные по связыванию АРС.
Соединения формул I-A и I-B, их фармацевтически приемлемые кислотно-аддитивные соли, их моно- и диэфиры и их циклические имиды могут быть использованы в качестве лекарственных средств, например в виде фармацевтических препаратов. Эти фармацевтические препараты можно вводить перорально, например в форме таблеток, таблеток с покрытием, драже, твердых и мягких желатиновых капсул, растворов, эмульсий и суспензий. Однако также эффективно их можно вводить ректально, например, в форме суппозиториев, парентерально, например, в форме растворов для инъекций, или интраназально.
При приготовлении фармацевтических препаратов соединения формул I-A и I-B, а также их фармацевтически приемлемые кислотно-аддитивные соли и эфиры можно объединять с фармацевтически инертными неорганическими или органическими носителями. В качестве таких носителей для таблеток, таблеток с покрытием, драже и твердых желатиновых капсул могут быть использованы, например, лактоза, кукурузный крахмал и его производные, тальк, стеариновая кислота и ее соли и т.п. Пригодными носителями для мягких желатиновых капсул служат, например, растительные масла, воски, твердые жиры, полутвердые и жидкие полиолы и т.п. Однако в случае мягких желатиновых капсул в зависимости от природы действующего вещества носители обычно не требуются. Пригодными носителями для приготовления растворов и сиропов являются, например, вода, полиолы, глицерин, растительные масла и т.п. Подходящие носители для суппозиториев представляют собой, например, природные и отвержденные масла, воски, твердые жиры, полужидкие и жидкие полиолы и т.п.
Более того, фармацевтические препараты могут включать некоторые консерванты, солюбилизаторы, стабилизаторы, смачивающие вещества, эмульгаторы, подслащивающие вещества, красители, корригенты, соли для варьирования осмотического давления, буферные добавки, материалы для покрытий и антиоксиданты. Они могут также содержать другие терапевтически действующие вещества.
Лекарственные препараты, содержащие соединение формулы I-A или I-B или его фармацевтически приемлемую кислотно-аддитивную соль, моно- или диэфир и терапевтически инертный носитель, также составляют объект настоящего изобретения, как и способ их приготовления, который включает придание одному или нескольким соединениям формул I-A и I-B и/или их фармацевтически приемлемым кислотно-аддитивным солям и моно- и диэфирам галеновой формы для введения совместно с одним или несколькими терапевтически инертными носителями.
В соответствии с изобретением соединения общих формул I-А и I-В, а также их фармацевтически приемлемые кислотно-аддитивные соли и моно- и диэфиры могут быть использованы для лечения или профилактики центрального и системного амилоидоза. Самыми распространенными заболеваниями, которые связаны с амилоидозом, являются болезнь Альцгеймера (БА), начало возрастного сахарного диабета или амилоидоз –волокон). Другим общим признаком для всех типов амилоидозов является взаимодействие обычных белков плазмы, в частности амилоидного компонента Р сыворотки (АРС), с фибриллами. Участие АРС в патогенезах амилоидозов подтверждает, что ингибирование взаимодействия АРС с амилоидными фибриллами является привлекающей внимание терапевтической мишенью для лечения болезней человека, таких, как болезнь Альцгеймера, т.к. амилоидоз, локализованный в головном мозгe, связан с болезнью Альцгеймера. Целью данного изобретения является обнаружение терапевтических агентов для амилоидозов, которые ингибируют взаимодействие амилоидного компонента Р сыворотки с амилоидными фибриллами. Соответствующие методы тестирования описаны в описании. В табл. 2, представленной в конце описания, даны некоторые специфические данные по связыванию АРС.
Соединения формул I-A и I-B, их фармацевтически приемлемые кислотно-аддитивные соли, их моно- и диэфиры и их циклические имиды могут быть использованы в качестве лекарственных средств, например в виде фармацевтических препаратов. Эти фармацевтические препараты можно вводить перорально, например в форме таблеток, таблеток с покрытием, драже, твердых и мягких желатиновых капсул, растворов, эмульсий и суспензий. Однако также эффективно их можно вводить ректально, например, в форме суппозиториев, парентерально, например, в форме растворов для инъекций, или интраназально.
При приготовлении фармацевтических препаратов соединения формул I-A и I-B, а также их фармацевтически приемлемые кислотно-аддитивные соли и эфиры можно объединять с фармацевтически инертными неорганическими или органическими носителями. В качестве таких носителей для таблеток, таблеток с покрытием, драже и твердых желатиновых капсул могут быть использованы, например, лактоза, кукурузный крахмал и его производные, тальк, стеариновая кислота и ее соли и т.п. Пригодными носителями для мягких желатиновых капсул служат, например, растительные масла, воски, твердые жиры, полутвердые и жидкие полиолы и т.п. Однако в случае мягких желатиновых капсул в зависимости от природы действующего вещества носители обычно не требуются. Пригодными носителями для приготовления растворов и сиропов являются, например, вода, полиолы, глицерин, растительные масла и т.п. Подходящие носители для суппозиториев представляют собой, например, природные и отвержденные масла, воски, твердые жиры, полужидкие и жидкие полиолы и т.п.
Более того, фармацевтические препараты могут включать некоторые консерванты, солюбилизаторы, стабилизаторы, смачивающие вещества, эмульгаторы, подслащивающие вещества, красители, корригенты, соли для варьирования осмотического давления, буферные добавки, материалы для покрытий и антиоксиданты. Они могут также содержать другие терапевтически действующие вещества.
Лекарственные препараты, содержащие соединение формулы I-A или I-B или его фармацевтически приемлемую кислотно-аддитивную соль, моно- или диэфир и терапевтически инертный носитель, также составляют объект настоящего изобретения, как и способ их приготовления, который включает придание одному или нескольким соединениям формул I-A и I-B и/или их фармацевтически приемлемым кислотно-аддитивным солям и моно- и диэфирам галеновой формы для введения совместно с одним или несколькими терапевтически инертными носителями.
В соответствии с изобретением соединения общих формул I-А и I-В, а также их фармацевтически приемлемые кислотно-аддитивные соли и моно- и диэфиры могут быть использованы для лечения или профилактики центрального и системного амилоидоза. Самыми распространенными заболеваниями, которые связаны с амилоидозом, являются болезнь Альцгеймера (БА), начало возрастного сахарного диабета или амилоидоз– как существенная причина неишемической сердечной недостаточности, – как осложнение длительного гемодиализа при почечной недостаточности, – как осложнение при моноклональной гаммапатии, – как результат хронических воспалительных заболеваний, – как результат хронических инфекционных болезней, – как результат раковых заболеваний некоторых типов. Более того, амилоидоз охватывает множество различных болезней, таких, как формы наследственного амилоидоза, чаще всего семейной амилоидной полинейропатии (СПП), чесотка и болезнь Крейцфельда-Якоба. Кроме того, предлагаемые соединения могут быть использованы при приготовлении соответствующих лекарственных препаратов. Доза может варьироваться в широком диапазоне, и ее, что очевидно, следует выбирать в соответствии с индивидуальными потребностями в каждом конкретном случае. В случае перорального введения доза соединения формулы I-A или I-B или соответствующее количество его фармацевтически приемлемой кислотно-аддитивной соли или моно- или диэфира находится в интервале от примерно 0,1 мг для разового приема до примерно 5000 мг в день, хотя, если это показано, такой верхний предел можно превысить. Сущность настоящего изобретения более подробно проиллюстрирована в следующих примерах, однако их не следует рассматривать как ограничивающие объем изобретения. Температура во всех случаях указана в градусах Цельсия. Пример 1 (R)-1- { (S)-3- [(S)-3- [(R)-2-карбоксипирролидин-1-ил] -2-метил-3-оксопродилдисульфанил] -2-метилпропионил} пирролидин-2-карбоновая кислота а) трет-Бутиловый эфир 1-[(S)-3-(ацетилсульфанил)-20-метилпропионил]-(R)-пирролидин-2-карбоновой кислоты и трет-бутиловый эфир 1-[(R) -3- (ацетилсульфанил) -20-метилпропионил] – (R) -пирролидин-2-карбоновой кислоты 18,6 мл триэтиламина при 0-5oС вводили в перемешиваемый раствор из 23,2 г (135 ммолей) трет-бутилового эфира D-пролина в 230 мл сухого дихлорметана. При этой температуре в течение 1 ч добавляли раствор из 24,5 г (135 ммолей) эфира 8-(3-хлор-2-метил-3-оксопропил)этантиокислоты в 116 мл дихлорметана и перемешивание продолжали при комнатной температуре в течение 2 ч. Осадок удаляли фильтрованием. Раствор промывали водой и сушили сульфатом натрия. В результате выпаривания растворителя при пониженным давлением получали 41,4 г бесцветного продукта в виде масла, которое хроматографировали на 4 кг силикагеля, используя диэтиловый эфир/циклогексан в соотношении 2/1, с получением 19,6 г (46%) трет-бутилового эфира 1- [(R)-3- (ацетилсульфанил)-20-метилпропионил] -(R)-пирролидин-2-карбоновой кислоты, 18,2 г (43%) трет-бутилового эфира 1-[(S)-3-(ацетилсульфанил) -20-метилпропионил] – (R) -пирролидин-2-карбоновой кислоты и 1,6 г смеси эпимеров. МС m/е (%)= 315 (М+, 3), 259 (10), 242 (10), 214 (100), 172 (10), 145 (32), 70 (22); [  ]D=-0,7o (1% ЕtOН).
МС m/е (%)=315 (M+,4), 259 (7), 242 (9), 214 (100), 172 (9), 145 (33), 70 (33); ]D=-0,7o (1% ЕtOН).
МС m/е (%)=315 (M+,4), 259 (7), 242 (9), 214 (100), 172 (9), 145 (33), 70 (33);[  ]D=+156,7o (1% ЕtOН).
б) 1- [(S) -3- (Ацетилсульфанил) -2-метилпропионил] – (R) -пирролидин-2-карбоновая кислота ]D=+156,7o (1% ЕtOН).
б) 1- [(S) -3- (Ацетилсульфанил) -2-метилпропионил] – (R) -пирролидин-2-карбоновая кислота15,45 г (48,9 ммоля) трет-бутилового эфира 1- [(S)-3- (ацетилсульфанил) -20-метилпропионил] -(R)-пирролидин-2-карбоновой кислоты в токе аргона в течение трех часов перемешивали с 99 мл трифторуксусной кислоты и 55 мл анизола. Смесь упаривали в вакууме. Остаток растворяли в примерно 100 мл охлажденного льдом этилацетата и промывали приблизительно 200 мл охлажденного льдом водного раствора бикарбоната натрия. При охлаждении льдом концентрированную соляную кислоту добавляли до рН 1-2. Водную фазу четыре раза экстрагировали охлажденным льдом этилацетатом, сушили сульфатом натрия и упаривали. Получали 11,6 г (выход 91%) l-[(S)-3-(aцeтилсульфанил) -2-метилпропионил] – (R) -пирролидин-2-карбоновой кислоты, которую использовали без дальнейшей очистки. [  ]D=-11,8o (0,6% EtOH).
в) 1- [(S)-3-меркапто-2-метилпропионил] -(R)-пирролидин-2-карбоновая кислота ]D=-11,8o (0,6% EtOH).
в) 1- [(S)-3-меркапто-2-метилпропионил] -(R)-пирролидин-2-карбоновая кислота11,59 г (44,69 ммоля) 1-[(S)-3-(ацетилсульфанил) -2-метилпропионил] -(R)-пирролидин-2-карбоновой кислоты при комнатной температуре в токе аргона растворяли в 70 мл метанола, очищенного от кислорода аргоном. После добавления 70 мл 10н. раствора аммиака в метаноле перемешивание продолжали в течение двух часов при комнатной температуре. Затем в вакууме отгоняли растворитель. Остаток растворяли в 5%-ном водном растворе KHSO4 и шесть раз экстрагировали дихлорметаном. Органические слои дважды промывали 5%-ным раствором KHSO4, три раза 1н. соляной кислотой и сушили над сульфатом натрия. В результате выпаривания растворителя и кристаллизации из этилацетата/гексана получали 6,25 г (64%) 1-[(S)-3-меркапто-2-метилпропионил]-(R)-пирролидин-2-карбоновой кислоты с температурой плавления 99-101oС. [  ]D=+40,7o (1% EtOH).
г) (R)-1- {(S)-3- [(S)-3- [(R)-2-карбоксипирролидин-1-ил] -2-метил-3-оксопропилдисульфанил] -2-метилпропионил} пирролидин-2-карбоновая кислота ]D=+40,7o (1% EtOH).
г) (R)-1- {(S)-3- [(S)-3- [(R)-2-карбоксипирролидин-1-ил] -2-метил-3-оксопропилдисульфанил] -2-метилпропионил} пирролидин-2-карбоновая кислотаПри комнатной температуре раствор 749 мг (3,0 ммоля) CuSO4  5H2O в 90 мл воды вводили в раствор 651,85 мг (3,0 ммоля) 1-[(S)-3-меркапто-2-метилпропионил] -(R)-пирролидин-2-карбоновой кислоты в 90 мл дихлорметана. Смесь в течение 10 мин интенсивно перемешивали и фильтровали. Водную фазу 5 раз промывали дихлорметаном, органические фазы промывали рассолом и сушили сульфатом магния и в вакууме удаляли растворитель. Кристаллизацией из дихлорметана/гексана получали 275,3 мг (43%) (R)-1- {(S)-3-[(S)3-[(R)-2 – карбоксипирролидин -1 – ил] – 2 – метил – 3 – оксопропилдисульфанил] – 2 – метилпропионил} пирролидин-2-карбоновой кислоты с температурой плавления 142-144oС.
[ 5H2O в 90 мл воды вводили в раствор 651,85 мг (3,0 ммоля) 1-[(S)-3-меркапто-2-метилпропионил] -(R)-пирролидин-2-карбоновой кислоты в 90 мл дихлорметана. Смесь в течение 10 мин интенсивно перемешивали и фильтровали. Водную фазу 5 раз промывали дихлорметаном, органические фазы промывали рассолом и сушили сульфатом магния и в вакууме удаляли растворитель. Кристаллизацией из дихлорметана/гексана получали 275,3 мг (43%) (R)-1- {(S)-3-[(S)3-[(R)-2 – карбоксипирролидин -1 – ил] – 2 – метил – 3 – оксопропилдисульфанил] – 2 – метилпропионил} пирролидин-2-карбоновой кислоты с температурой плавления 142-144oС.
[ ]D=+42,8o(1% СНСl3).
Пример 2 ]D=+42,8o(1% СНСl3).
Пример 2(R)-1-{ (R)-3-[(R)-3-[(R)-2-карбоксипирролидин-1-ил] -2-метил-3-оксопропилдисульфанил] -2-метилпропионил} пирролидин-2-карбоновая кислота а) 1- [(R)-3-(Ацетилсульфанил)-2-метилпропионил] -(R)пирролидин-2-карбоновая кислота 18,9 г (60,0 ммолей) трет-бутилового эфира 1-(3-ацетилсульфанил-2-метилпропионил)пирролидин-2-карбоновой кислоты со 120 мл трифторуксусной кислоты и 75 мл анизола перемешивали в токе аргона в течение трех часов. Смесь упаривали в вакууме. Остаток растворяли в охлажденном льдом этилацетате и промывали охлажденным льдом водным раствором бикарбоната натрия. Охлажденную льдом концентрированную соляную кислоту добавляли до рН 2-3. Водную фазу три раза экстрагировали охлажденным льдом этилацетатом, сушили сульфатом натрия и упаривали. Таким путем получали 15,3 г (98%) 1-[(R)-3-(ацетилсульфанил)-2-метилпропионил] -(R)-пирролидин-2-карбоновой кислоты, которую использовали без дальнейшей очистки. [  ]D=+127,8o (1% EtOH).
б) 1- [(R)-3-меркапто-2-метилпропионил] -(R) -пирролидин-2-карбоновая кислота ]D=+127,8o (1% EtOH).
б) 1- [(R)-3-меркапто-2-метилпропионил] -(R) -пирролидин-2-карбоновая кислота2,98 г (11,5 ммоля) 1-[(R)-3-(ацетилсульфанил)-2-метилпропионил]- (R)-пирролидин-2-карбоновой кислоты при комнатной температуре в токе аргона растворяли в 15 мл метанола, очищенного от кислорода аргоном. После добавления 15 мл 10н. раствора аммиака в метаноле перемешивание продолжали в течение двух часов при комнатной температуре. Затем при комнатной температуре в вакууме отгоняли растворитель. Остаток растворяли в 5%-ном водном растворе KHSO4 и шесть раз экстрагировали дихлорметаном и три раза этилацетатом. Органические слои дважды промывали 5%-ным раствором KHSO4, три раза 1н. соляной кислотой и сушили над сульфатом натрия. После выпаривания растворителя и кристаллизации из этилацетата/гексана получали 1,59 г (64%) 1-[(R)-3-меркапто-2-метилпропионил] – (R)-пирролидин-2-карбоновой кислоты с температурой плавления 98-100oС. [  ]D=+128,8o (1% EtOH).
в) (R)-1-{ (R)-3-[(R)-3-[(R)-2-карбоксипирролидин-1-ил] -2-метил-3-оксопропилдисульфанил] -2-метилпропионил} пирролидин-2-карбоновая кислота ]D=+128,8o (1% EtOH).
в) (R)-1-{ (R)-3-[(R)-3-[(R)-2-карбоксипирролидин-1-ил] -2-метил-3-оксопропилдисульфанил] -2-метилпропионил} пирролидин-2-карбоновая кислотаАналогично изложенному в примере 1г). МС m/е (%): (M+, 2) 217(100), 184(76), 172(67), 142(13), 70(79), 41(21). Пример 3 (R)-1- {3- [3- [(R)-2-карбоксипирролидин-1-ил] -3-оксопропилдисульфанил] пропионил} пирролидин-2-карбоновая кислота 0,9 г (4 ммоля) 1-(3-меркаптопропионил)- (R)-пирролидин-2-карбоновой кислоты (исходного материала) растворяли в дихлорметане и экстрагировали 50 мл насыщенного водного раствора CuSO4. Водную фазу дважды экстрагировали дихлорметаном, объединенные органические фазы фильтровали, сушили сульфатом магния и упаривали. Хроматографией с дихлорметаном/ацето-ном/муравьиной кислотой в соотношении 80/10/1 в виде бесцветного масла получали 70 мг (R)-1-{ 3-[3- [(R)-2-карбоксипирролидин-1-ил] -3-оксопропилдисульфанил] пропионил} пирролидин-2-карбоновой кислоты. ISN-MC: 403 (М-Н)–. Пример 4 (R)-1- { 9- [(R)-2-карбоксипирролидин-1-ил] -9-оксононаноил} пирролидин-2-карбоновая кислота а) Бензиловый эфир (R)-1-{9-[(R)-2-бензилоксикарбонилпирролидин-1-ил] -9-оксононаноил} пирролидин-2-карбоновой кислоты 0,97 г (4 ммоля) гидрохлорида D-пролинбензилового эфира в 25 мл дихлорметана в токе аргона при комнатной температуре перемешивали с 450 мг (2 ммоля) азелаоилхлорида и 1,12 мл (8 ммолей) триэтиламина в течение 20 ч. Экстракцией 2н. соляной кислотой и рассолом, сушкой сульфатом натрия и упариванием в виде масла получали 1,2 г продукта, который хроматографировали с ацетоацетатом на силикагеле с получением в виде бесцветного масла 0,9 г (80%) бензилового эфира (R)-1-{9-[(R)-2-бензилоксикарбонилпирролидин-1-ил] -9-оксононаноил}пирролидин-2-карбоновой кислоты. 1H-ЯМР (СDСl3, част. /млн): 1,1-2,4 (m, 22H), 3,4-3,7 (m, 4H), 4,4-4,6 (m, 2H), 5,1-5,3 (2хАВ, 4H), 7,34 (m, 10Н). б) (R)-1- {9- [(R)-2-карбоксипирролидин-1-ил] -9-оксононаноил}пирролидин-2-карбоновая кислота 100 мг (0,18 ммоля) бензилового эфира (R)-1-{9-[(R)-2-бензилоксикарбонилпирролидин-1-ил] -9-оксононаноил} пирролидин-2-карбоновой кислоты в 20 мл этанола гидрогенизовали в течение двух часов при комнатной температуре в присутствии 20 мг 5%-ного Pd на угле. Фильтрованием и упариванием в виде бесцветного масла получали 60 мг (R)-1- {9- [(R)-2-карбоксипирролидин-1-ил] -9-оксононаноил} пирролидин-2-карбоновой кислоты. ISP-MC:383 (MH)+. Пример 5 (R)-1- {8- [(R)-2-карбоксипирролидин-1-ил] -2,7-диметил-8-оксооктаноил] пирролидин-2-карбоновая кислота 1,2 г (5,0 ммолей) 2,7-диметил-8-октандиоилхлорида растворяли в 100 мл перемешиваемого диметилформамида, добавляли 1,15 г (10 ммолей) D-пролина и 1,4 мл (10 ммолей) триэтиламина и смесь выдерживали в течение пяти минут при 50oС. Перемешивание продолжали при комнатной температуре в течение ночи. Отгоняли растворитель и остаток растворяли в 30 мл 2н. соляной кислоты. В результате экстракции этилацетатом, сушки сульфатом натрия, упаривания и хроматографии на силикагеле с хлороформом/ацетоном/муравьиной кислотой в соотношении 80/15/5 в виде бесцветного масла получали 0,11 г (R)-1-{8-[(R)-2 – карбоксипирролидин – 1-ил] -2,7 -диметил – 8 – оксооктаноил] пирролидин- 2 -карбоновой кислоты. ISP-MC: 397 (МН)+. Пример 6 (R)-1- {8- [(R)-2-карбоксипирролидин-1-ил]-2,7-диметокси-8-оксооктаноил] пирролидин – 2 – карбоновая кислота а) Бензиловый эфир (R)-1-{8-[(R)-2-бензилоксикарбонилпирролидин-1-ил]-2,7-диметокси-8-оксооктаноил]пирролидин-2-карбоновой кислоты К 0,25 г (1,1 ммоля) 2,7-диметоксиоктандикислоты в смеси 25 мл тетрагидрофурана с 20 мл дихлорметана добавляли раствор 0,35 г (2,1 ммоля) карбонилдиимидазола в 15 мл тетрагидрофурана. После перемешивания при комнатной температуре в течение двух часов добавляли 0,52 г (2,16 ммоля) гидрохлорида D-пролинбензилового эфира в 10 мл дихлорметана и 0,54 г триэтиламина и перемешивание продолжали в течение 18 ч. После фильтрования растворитель отгоняли, остаток растворяли в этилацетате и экстрагировали 2н. соляной кислотой и водой. В результате сушки сульфатом натрия, выпаривания растворителя и хроматографии на силикагеле с этилацетатом в виде бесцветного масла получали 0,21 г бензилового эфира (R)-1- {8- [(R)-2-бензилоксикарбонилпирролидин -1 – ил] -2,7 -диметокси- 8 – оксооктаноил] пирролидин- 2 – карбоновой кислоты. S-ISP: 609 (М+Н)+. б) (R)-1- { 8- [(R)-2-карбоксипирролидин-1-ил]-2,7-диметокси-8-оксооктаноил] пирролидин-2-карбоновая кислота 182 мг (0,3 ммоля) бензилового эфира (R)-1-{8-[(R)-2-бензилоксикарбонилпирролидин-1-ил] -2,7-диметокси-8-оксооктаноил] пирролидин-2-карбоновой кислоты в 10 мл метанола гидрогенизовали в присутствии 30 мг 5%-ного Pd на угле. Фильтрованием и выпариванием растворителя в виде бесцветного масла получали 109 мг (84%) (R)-1- {8-[(R)-2-карбоксипирролидин-1-ил] -2,7-диметокси-8-оксооктаноил] пирролидин-2-карбоновой кислоты. МС: 427 (М-Н)–. Пример 7 (R)-1-{ 7- [(R)-2-карбоксипирролидин-1-ил]-7-оксогептаноил]пирролидин-2-карбоновая кислота Смесь 0,99 г (5 ммолей) пимелоилхлорида с 1,15 г (10 ммолей) D-пролина и 1,4 мл (10 ммолей) триэтиламина в 100 мл диметилформамида подогревали до тех пор, пока не образовывался прозрачный раствор, и затем перемешивали при комнатной температуре в течение ночи. В вакууме отгоняли растворитель. Остаток растворяли в 2н. соляной кислоте и экстрагировали дихлорметаном. В результате выпаривания растворителя и хроматографии на силикагеле с хлороформом/ацетоном/муравьиной кислотой в соотношении 80/15/5 в виде масла получали 0,27 г (R)-1-{ 7-[(R)-2-карбоксипирролидин-1-ил]-7-оксогептаноил] пирролидин-2-карбоновой кислоты. МС:353 (М-Н)–. Пример 8 (R)-1- { 6- [(R)-2-карбоксипирролидин-1-ил] -6-оксогексаноил]пирролидин-2-карбоновая кислота а) Бензиловый эфир (R)-1-{6-[(R)-2-бензилоксикарбонилпирролидин-1-ил]-6-оксогексаноил] пирролидин-2-карбоновой кислоты 0,97 г (10 ммолей) гидрохлорида D-пролинбензилового эфира в 70 мл дихлорметана при комнатной температуре в токе аргона перемешивали с 0,92 г (5 ммолей) адипоилхлорида и 2,8 мл (20 ммолей) триэтиламина с вечера пятницы до утра понедельника. В результате экстракции 2н. соляной кислотой и водой, сушки сульфатом натрия, упаривания и хроматографии на силикагеле с ацетоацетатом в виде бесцветного масла получали 0,42 г (16%) бензилового эфира (R)-1- {6- [(R)-2-бензилоксикарбонилпирролидин-1-ил] -6-оксогексаноил] пирролидин-2-карбоновой кислоты. ISP-MC:521 (M+H)+. б) (R)-1- {6- [(R)-2-карбоксипирролидин-1-ил]- 6-оксогексаноил] пирролидин-2-карбоновая кислота 410 мг (0,79 ммоля) бензилового эфира (R)-1-{6-[(R)-2-бензилоксикарбонилпирролидин-1-ил] -6-оксогексаноил] пирролидин-2-карбоновой кислоты в 100 мл метанола гидрогенизовали в присутствии 50 мг 5%-ного Pd на угле. Фильтрованием и выпариванием растворителя в виде бесцветного масла получали 160 мг (59%) (R)-1-{ 6-[(R)-2-карбоксипирролидин-1-ил]-6-оксогексаноил] пирролидин-2-карбоновой кислоты. МС: 339 (М-Н)–. Пример 9 (R)-1- {5- [(R)-2-карбоксипирролидин-1-ил] -5-оксопентаноил] пирролидин-2-карбоновая кислота а) Бензиловый эфир (R)-1-{5-[(R)-2-бензилоксикарбонилпирролидин-1-ил] -5-оксопентаноил]пирролидин-2-карбоновой кислоты 0,97 г (10 ммолей) гидрохлорида D-пролинбензилового эфира в 70 мл дихлорметана в течение ночи при комнатной температуре в токе аргона перемешивали с 0,85 г (5 ммолей) глутарилдихлорида и 2,8 мл (20 ммолей) триэтиламина. В результате экстракции 2н. соляной кислотой и рассолом, сушки сульфатом натрия, упаривания и хроматографии на силикагеле с ацетоацетатом в виде бесцветного масла получали 0,44 г (17%) бензилового эфира (R)-1- {5-[(R) -2-бензилоксикарбонилпирролидин-1-ил] -5-оксопентаноил] пирролидин-2-карбоновой кислоты. ISP-MC: 507 (М+Н)+. б) (R)-1- {5- [(R)-2-карбоксипирролидин-1-ил] -5-оксопентаноил] пирролидин-2-карбоновая кислота 440 мг (0,87 ммоля) бензилового эфира (R)-1-{5-[(R)-2-бензилоксикарбонилпирролидин-1-ил] -5-оксопентаноил] пирролидин-2-карбоновой кислоты в 100 мл этанола гидрогенизовали в присутствии 40 мг 5%-ного Pd на угле. Фильтрованием и выпариванием растворителя в виде бесцветного масла получали 130 мг (46%) (R)-1-{ 5-[(R)-2-карбоксипирролидин-1-ил]-5-оксопентаноил] пирролидин-2-карбоновой кислоты. ISP-MC: 327 (М+Н)+. Пример 10 (R)-1- { 4- [(R)-2-карбоксипирролидин-1-ил] – 4-оксобутирил] пирролидин-2-карбоновая кислота а) Бензиловый эфир (R)-1-{4-[(R)-2-бензилоксикарбонилпирролидин-1-ил] -4-оксобутирил]пирролидин-2-карбоновой кислоты В перемешиваемый раствор 300 мг (1,2 ммоля) гидрохлорида D-пролинбензилового эфира и 0,35 мл (2,5 ммоля) триэтиламина в 9 мл дихлорметана при 0oС по каплям добавляли 68 мл (0,6 ммоля) сукцинилхлорида и перемешивание продолжали при комнатной температуре в течение 24 ч. Затем реакционную смесь последовательно промывали насыщенным раствором хлорида аммония, насыщенным раствором бикарбоната натрия и в завершение водой и водную фазу подвергали обратной экстракции дихлорметаном. Объединенные органические экстракты сушили над сульфатом натрия и концентрировали в вакууме с получением в виде бледно-желтого масла 286 мг (94%) указанного в заголовке соединения. МС m/е (%): 510 (M+NH+ 4, 20), 493 (M+Н+, 100), 288 (80). б) (R) -1- {4- [(R) -2-карбоксипирролидин-1-ил] -4-оксобутирил] пирролидин-2-карбоновая кислота Раствор 256 мг (0,5 ммоля) бензилового эфира (R)-1-{4-[(R)-2-бензилоксикарбонилпирролидин-1-ил] -4-оксобутирил] пирролидин-2-карбоновой кислоты в 5 мл этанола в течение 16 ч при комнатной температуре перемешивали с 13 мг 10%-ного палладия на угле под давлением водорода 1 ат. После фильтрования для удаления катализатора и концентрирования в вакууме в виде бесцветного вязкого масла получали 170 мг (100%) (R)-1-{4-[(R)-2-кapбоксипирролидин-1-ил] -4-оксобутирил] пирролидин-2-карбоновой кислоты. МС m/е (%): 313 (М+Н+, 100). Пример 11 (R)-1- {{2- [2- [2-[(R)-2-карбоксипирролидин-1-ил]-2-оксоэтокси]этокси] этокси} ацетил}пирролидин-2-карбоновая кислота Смесь 1,04 г (4 ммоля) 2,2′-[оксобис(2,1-этандиилокси)]бисацетилхлорида, 0,92 г (8 ммолей) D-пролина и 1,2 мл триэтиламина в 200 мл диметилформамида перемешивали в течение трех дней при комнатной температуре. В вакууме отгоняли растворитель. Остаток хроматографировали на силикагеле с метанолом с получением в виде бежевого гигроскопического твердого вещества 0,42 г (R)-1- { {2- [2- [2- [(R)-2-карбоксипирролидин-1-ил] -2-оксоэтокси] этокси] этокси} ацетил} пирролидин-2-карбоновой кислоты. ISP-MC: 417 (М+Н)+. Пример 12 (R)-1- {3- {4- [3- [(R)-2-карбоксипирролидин-1-ил] -3-оксопропил] фенил} пропионил} пирролидин-2-карбоновая кислота Смесь 1,30 г (5 ммолей) 1,4-бензолдипропаноилдихлорида, 1,15 г (10 ммолей) D-пролина и 1,5 мл триэтиламина в 100 мл диметилформамида перемешивали в течение 24 ч при комнатной температуре. Суспензию фильтровали и в вакууме отгоняли растворитель. Остаток растворяли в ацетоацетате, промывали 2н. соляной кислотой, сушили над сульфатом натрия и хроматографировали на силикагеле с дихлорметаном/ацетоном/муравьиной кислотой в соотношении 80/5/15 с получением в виде бесцветной пены 0,48 г (R)-1- {3- {4- [3- [(R)-2-карбоксипирролидин-1-ил] -3-оксопропил] фенил} пропионил} пирролидин-2-карбоновой кислоты. ISP-MC: 417 (М+Н)+. Пример 13 (R)-1- {{4- [2- [(R)-2-карбоксипирролидин-1-ил] -2-оксоэтил] фенил} ацетил} пирролидин-2-карбоновая кислота Смесь 1,15 г (5 ммолей) 1,4-бензолдиацетилдихлорида с 1,15 г (10 ммолей) D-пролина и 1,5 мл триэтиламина в 100 мл диметилформамида перемешивали в течение 20 ч при комнатной температуре. В вакууме отгоняли растворитель. Остаток растворяли в 30 мл 2н. соляной кислоты, обрабатывали ультразвуком, фильтровали и сушили с получением 1,19 г коричневого твердого вещества. Его перемешивали и кипятили с обратным холодильником в течение 30 мин в 300 мл метанола. Фильтрованием, упариванием и перекристаллизацией из метанола/ацетоацетата в виде желтых кристаллов получали 0,18 г (R)-1-{{4-[2- [ (R) -2-карбоксипирролидин-1-ил] -2-оксоэтил] фенил} ацетил} пирролидин-2-карбоновой кислоты с температурой плавления 210-214oС. ISP-MC: 389 (М+Н)+. Пример 14 (R)-1- {{2- [2- [(R)-2-карбоксипирролидин-1-ил] -2-оксоэтокси] фенокси} ацетил} пирролидин-2-карбоновая кислота а) Бензиловый эфир (R)-1-{{2-[2-[(R)-2-бензилоксикарбонилпирролидин-1-ил]-2-оксоэтокси] фенокси} ацетил} пирролидин-2-карбоновой кислоты К 0,566 г (2,5 ммоля) 1,2-фенилендиоксиуксусной кислоты в 60 мл тетрагидрофурана добавляли раствор 0,81 г (5 ммолей) карбонилдиимидазола в 25 мл тетрагидрофурана. После перемешивания при комнатной температуре в течение двух часов добавляли 1,21 г (5 ммолей) гидрохлорида D-пролинбензилового эфира в 30 мл дихлорметана и 1,4 мл триэтиламина и перемешивание продолжали с вечера пятницы до утра понедельника. Смесь экстрагировали 2н. соляной кислотой и рассолом. В результате сушки сульфатом натрия, выпаривания растворителя и хроматографии на силикагеле с этилацетатом в виде бесцветного масла получали 0,25 г бензилового эфира (R)-1- {{2- [2- [(R)-2-бензилоксикарбонилпирролидин-1-ил] -2-оксоэтокси] фенокси} ацетил} пирролидин-2-карбоновой кислоты. МС m/е (%): 600 (1, M+), 509 (1), 368 (25), 246 (17), 217 (19), 204 (14), 91 (100). б) (R)-1- { { 2- [2- [(R)-2-карбоксипирролидин-1-ил] – 2- оксоэтокси] фенокси} ацетил} пирролидин-2-карбоновая кислота 230 мг (0,38 ммоля) бензилового эфира (R)-1-{{2-[2-[(R)-2-бензилоксикарбонилпирролидин-1-ил] -2-оксоэтокси] фенокси} ацетил} пирролидин-2-карбоновой кислоты в 100 мл этанола гидрогенизовали в присутствии 30 мг 5%-ного Pd на угле. В результате фильтрования и выпаривания растворителя в виде бесцветной стеклообразной массы получали 0,2 г (R)-1- {{2- [2-[(R)-2-карбок-сипирролидин-1-ил] -2-оксоэтокси] фенокси} ацетил} пирролидин-2-карбоновой кислоты (которая все еще содержала небольшие количества этанола). ISP-MC: 421 (М+Н)+. Пример 15 (R)-1- { 3- {6- [3- [(R)-2-карбоксипирролидин-1-ил] -3-оксопропил]пиридин-2-ил} пропионил} пирролидин-2-карбоновая кислота а) 3- [6-(2-карбоксиэтил)пиридин-2-ил]пропионовая кислота Смесь 25,6 г (0,2 моля) нафталина и 1,39 г (0,2 моля) лития в 150 мл тетрагидрофурана в течение трех часов перемешивали при комнатной температуре. После охлаждения до -15oС добавляли раствор 5,72 мл (0,1 моля) уксусной кислоты в 10 мл тетрагидрофурана и перемешивание продолжали при комнатной температуре в течение трех часов. Затем добавляли 13,3 г (0,5 моля) 2, б-бис(бромметил)пиридина в 65 мл тетрагидрофурана и перемешивание продолжали в течение ночи при комнатной температуре. Добавляли 200 мл диэтилового эфира и смесь экстрагировали водой. Водные слои фильтровали через слой из 200 мл ионообменной смолы BioRad AG1-X8. Ионообменник промывали водой до нейтральной реакции, а затем проводили элюирование уксусной кислотой/водой. Содержавшие продукт фракции упаривали, растворяли в воде и лиофилизировали с получением в виде светло-желтого порошка 3,9 г (35%) 3- [6-(2-карбоксиэтил)пиридин-2-ил]пропионовой кислоты. МС m/е (%): 223 (М+, 15), 178 (100), 160 (81), 132 (68), 104 (16), 77 (13). б) Бензиловый эфир (R)-1- {3- {6- [3- [(R)-2-бензилоксикарбонилпирролидин-1-ил] -3-оксопропил] пиридин-2-ил}пропионил} пирролидин-2-карбоновой кислоты К 0,45 г (2,0 ммоля) 3-[6-(2-карбоксиэтил)пиридин-2-ил] пропионовой кислоты в смеси 25 мл тетрагидрофурана с 25 мл дихлорметана добавляли раствор 0,65 г (4,0 ммоля) карбонилдиимидазола в 20 мл тетрагидрофурана. После перемешивания при комнатной температуре в течение двух часов добавляли 0,97 г (4,0 ммоля) гидрохлорида D-пролинбензилового эфира в 50 мл дихлорметана и 1,12 г триэтиламина и перемешивание продолжали в течение 18 ч. Далее в смесь добавляли этилацетат с последующей экстракцией водой. В результате сушки сульфатом натрия, выпаривания растворителя и хроматографии на силикагеле с этилацетатом/гексаном в соотношении 2/8, затем этилацетатом, после чего этилацетатом/метанолом в соотношении 95/5 с последующей второй хроматографией содержавших продукт фракций на силикагеле с ацетоном/гексаном в соотношении 6/4 в виде бесцветного масла получали 0,18 г (15%) бензилового эфира (R)-1-{ 3-{6-[3-[(R)-2-бензилоксикарбонилпирролидин-1-ил] -3-оксопропил] пиридин-2-ил} пропионил} пирролидин-2-карбоновой кислоты. ISP-MС:598 (M+H)+. в) (R)-1- {3- {6- [3- [(R)-2-карбоксипирролидин-1-ил] -3-оксопропил]пиридин-2-ил} пропионил} пирролидин-2-карбоновая кислота 0,17 г (0,29 ммоля) бензилового эфира (R)-1-{3-{6-[3-[(R)-2-бензилоксикарбонилпирролидин-1-ил] -3-оксопропил] пиридин-2-ил} пропионил} пирролидин-2-карбоновой кислоты в 100 мл этанола гидрогенизовали в присутствии 35 мг 5%-ного Pd на угле. В результате фильтрования и выпаривания растворителя в виде бесцветного масла получали 0,11 г (92%) (R)-1- {3- {6- [3- [(R)-2-карбоксипирролидин-1-ил] -3-оксопропил] пиридин-2-ил} пропионил} пирролидин-2-карбоновой кислоты. ISP-MC: 418 (М+Н)+. Пример 16 (R)-1- {3-{[3-[(R)-2-карбоксипирролидин-1-ил] -3-оксопропил]пропиламино} пропионил} пирролидин-2-карбоновая кислота а) Бензиловый эфир (R)-1-акрилоилпирролидин-2-карбоновой кислоты В перемешиваемый раствор 390 мг (1,6 ммоля) гидрохлорида D-пролинбензилового эфира и 0,47 мл (3,4 ммоля) триэтиламина в 20 мл дихлорметана при 0oС по каплям добавляли 0,2 мл (2,4 ммоля) акрилоилхлорида и перемешивание продолжали при комнатной температуре в течение 24 ч. Затем реакционную смесь последовательно промывали водой, 1 М соляной кислотой и еще раз водой и водную фазу подвергали обратной экстракции дихлорметаном. Объединенные органические экстракты сушили над сульфатом натрия и концентрировали в вакууме с получением в виде бесцветного масла 420 мг (100%) бензилового эфира (R)-1-акрилоилпирролидин-2-карбоновой кислоты. МС m/е (%): 259 (М+, 25), 124 (100), 91 (25), 70 (21). б) Бензиловый эфир (R)-1- {3- {6 [3- [(R)-2-бензилоксикарбонилпирролидин-1-ил] -3-оксопропил] пропиламино} пропионил} пирролидин-2-карбоновой кислоты Раствор 400 мг (1,5 ммоля) бензилового эфира (R)-1-акрилоилпирролидин-2-карбоновой кислоты и 63 мл (0,75 ммоля) пропиламина в 5 мл ацетонитрила в течение 16 ч перемешивали при комнатной температуре, затем в течение 6 ч при 45oС и в завершение в течение 16 ч при 80oС. В результате концентрирования в вакууме и экспресс-хроматографии (20% Н2О в ацетоне) в виде бледно-желтого масла получали 84 мг (19%) указанного в заголовке соединения, бензилового эфира (R)-1-{3-{[3-[(R)-2-бензилоксикарбонилпирролидин-1-ил] -3-оксопропил] пропиламино} пропионил} пирролидин-2-карбоновой кислоты. МС m/е (%): 578 (М+Н+, 100). в) (R)-1- {3- {[3- [(R)-2-карбоксипирролидин-1-ил] -3-оксопропил] пропиламино} пропионил} пирролидин-2-карбоновая кислота 84 мг (0,15 ммоля) раствора бензилового эфира (R)-1-{3-{[3-[(R)-2-бензилоксикарбонилпирролидин-1-ил] -3-оксопропил] пропиламино} пропионил} пирролидин-2-карбоновой кислоты в 3 мл этанола в течение 16 ч при комнатной температуре перемешивали с 10 мг 10%-ного палладия на угле под давлением водорода 1 ат. После фильтрования для удаления катализатора и концентрирования в вакууме в виде белого твердого вещества получали 58 мг (100%) (R)-1-{ 3-{ [3-[(R)-2-карбоксипирролидин-1-ил]-3-оксопропил] пропиламино} пропионил} пирролидин-2-карбоновой кислоты. МС m/е (%): 398 (М+Н+ 100). Пример 17 (R)-1- { 3- [2- [(R)-2-Карбоксипирролидин-1-ил] -2-оксоэтокси]уреидо} пирролидин-2-карбоновая кислота а) Бензиловый эфир (R)-1-трет-бутоксикарбониламиноацетилпирролидин-2-карбоновой кислоты 1,21 г (5 ммолей) гидрохлорида D-пролинбензилового эфира растворяли в 100 мл дихлорметана и перемешивали с 0,7 мл триэтиламина. Смесь экстрагировали водой, сушили сульфатом натрия и упаривали. Остаток растворяли в смеси 100 мл тетрагидрофурана и 50 мл хлороформа. Добавляли с перемешиванием 1,03 г (5 ммолей) N,N’-дициклогексилкарбодиимида и 0,88 г (5 ммолей) БОК-глицина и перемешивание продолжали в течение 18 ч при комнатной температуре. Добавляли пять капель уксусной кислоты и после 10-минутной выдержки при комнатной температуре смесь фильтровали и отгоняли из нее растворители. Остаток растворяли в ацетоацетате, промывали водной лимонной кислотой, водным бикарбонатом натрия и водой, сушили сульфатом натрия и отгоняли растворитель. В результате хроматографии на силикагеле с дихлорметаном/метанолом в соотношении 99/1 в виде бесцветного масла получали 1,43 г (79%) бензилового эфира (R)-1-трет-бутоксикарбониламиноацетилпирролидин-2-карбоновой кислоты. МС m/е (%): 398 (М+Н+, 1), 303 (29), 289 (10), 114 (44), 91 (76), 70 (100), 57 (64). б) Бензиловый эфир (R)-1- {3- [2- [(R)-2-бензилоксикарбонилпирролидин-1-ил] -2-оксоэтокси]уреидо}пирролидин-2-карбоновой кислоты 8,6 мл трифторуксусной кислоты при 0oС добавляли в перемешиваемый раствор 1,57 г (4,34 ммоля) бензилового эфира (R)-1-трет-бутоксикарбониламиноацетилпирролидин-2-карбоновой кислоты в 8,6 мл дихлорметана и перемешивание продолжали в течение получаса при комнатной температуре. Раствор промывали водным бикарбонатом натрия, сушили сульфатом натрия и упаривали. Остаток растворяли в 200 мл дихлорметана и перемешивали с 0,21 г (0,7 ммоля) трифосгена и 1,8 мл (13 ммолей) триэтиламина в течение четырех часов при комнатной температуре. Смесь экстрагировали 1н. соляной кислотой, сушили сульфатом натрия и упаривали. Полученный в количестве 1,15 г остаток хроматографировали на силикагеле с дихлорметаном/метанолом в соотношении 96/4 и содержавшие продукт фракции вновь хроматографировали на силикагеле с дихлорметаном/ацетоном/муравьиной кислотой в соотношении 80/15/5 с получением в виде масла 0,23 г (33%) бензилового эфира (R)-1-{3-[2-[(R)-2-бензилоксикарбонилпирролидин-1-ил] -2-оксоэтокси] уреидо} пирролидин-2-карбоновой кислоты. МС:551 (М+Н)+. в) (R)-1- {3- [2- [(R)-2-карбоксипирролидин-1-ил] -2-оксоэтокси] -уреидо} пирролидин-2-карбоновая кислота 0,14 г (0,36 ммоля) бензилового эфира (R)-1-{3-[2-[(R)-2-бензилоксикарбонилпирролидин-1-ил] -2-оксоэтокси] уреидо} пирролидин-2-карбоновой кислоты в 60 мл этанола гидрогенизовали в присутствии 40 мг 5%-ного Pd на угле. В результате фильтрования, выпаривания растворителя и кристаллизации из метанола/этилацетата получали 0,07 г (52%) белых кристаллов с температурой плавления 157-160oС. Пример 18 Са-соль (R)-1- { 10- [(R)-2-карбоксипирролидин-1-ил] -10-оксодеканоил} пирролидин-2-карбоновой кислоты (1:1) Смесь 1,20 г (5 ммолей) себацилхлорида с 1,15 г (10 ммолей) D-пролина и 1,4 мл (10 ммолей) триэтиламина в 100 мл диметилформамида перемешивали с вечера пятницы до утра понедельника при комнатной температуре. В вакууме отгоняли растворитель. Остаток растворяли в 40 мл водной лимонной кислоты и экстрагировали этилацетатом. В результате выпаривания растворителя и хроматографии на силикагеле с хлороформом/ацетоном/муравьиной кислотой в соотношении 80/5/15 в виде масла получали 1,21 г (R)-1-{10-[(R)-2-карбокси-пирролидин-1-ил] -10-оксодеканоил} пирролидин-2-карбоновой кислоты. ISP-MC: 397 (М+Н)+. 0,89 г (2,24 ммоля) этого масла растворяли в 50 мл этанола и в течение 48 ч перемешивали с 0,175 г (2,24 ммоля) гидроксида кальция. Суспензию фильтровали. Твердый остаток растворяли в 15 мл воды, нагревали до 80oС, в горячем состоянии фильтровали и упаривали. Остаток суспендировали в диэтиловом эфире, фильтровали и промывали диэтиловым эфиром с получением в виде белого твердого вещества 0,5 г Са-соли (R)-1- {10- [(R)-2-карбоксипирролидин-1-ил] -10-оксодеканоил} пирролидин-2-карбоновой кислоты (1:1). С (рассчитано): 55,28; Н (рассчитано): 6,96; N (рассчитано): 6,45; С (обнаружено): 55,29; Н (обнаружено): 7,11; N (обнаружено): 6,08. Пример 19 Са-соль (R)-1- { 8- [(R)-2-карбоксипирролидин-1-ил] -8-оксооктаноил} пирролидин-2-карбоновой кислоты (1:1) Смесь 1,10 г (5 ммолей) субероилхлорида с 1,15 г (10 ммолей) D-пролина и 1,5 мл (10 ммолей) триэтиламина в 100 мл диметилформамида перемешивали в течение 20 ч при комнатной температуре. В вакууме отгоняли растворитель. Остаток растворяли в 40 мл водной лимонной кислоты и экстрагировали этилацетатом. В результате выпаривания растворителя и хроматографии на силикагеле с хлороформом/ацетоном/муравьиной кислотой в соотношении 80/5/15 в виде масла получали 0,8 г (R)-1-{8-[(R)-2-карбоксипирролидин-1-ил] -8-оксооктаноил}пирролидин-2-карбоновой кислоты. ISP-MC: 367 (М-Н)–. 0,79 г (2,15 ммоля) этого масла растворяли в 40 мл этанола и в течение 20 ч перемешивали с 0,167 г (2,15 ммоля) гидроксида кальция. Суспензию фильтровали и твердый остаток почти полностью растворяли в 25 мл воды. Раствор фильтровали и упаривали с получением в виде белого твердого вещества 0,5 г Са-соли (R)-1-{ 8-[(R)-2-карбоксипирролидин-1-ил] -8-оксооктаноил} пирролидин-2-карбоновой кислоты (1:1). Пример 20 (R)-1- { 4′- [(R)-2-карбоксипирролидин-1-илкарбонил] – [2.2]-битиазолил-4-ил} пирролидин-2-карбоновая кислота а) Бензиловый эфир (R)-1-{4′-[(R)-2-карбоксипирролидин-1-илкарбонил] – [2,2] -битиазолил-4-ил}пирролидин-2-карбоновой кислоты 2 мл тионилхлорида добавляли в раствор 0,26 г (1 ммоль) [2,2′] -битиазолил-4,4′-дикарбоновой кислоты в 20 мл тетраметилмочевины и смесь перемешивали в течение трех дней при комнатной температуре. Избыток тионилхлорида и растворителя отгоняли под пониженным давлением в вакууме. Остаток три раза растворяли в диметилформамиде и упаривали, а затем растворяли в 50 мл пиридина. Добавляли 0,28 г (1,1 ммоля) гидрохлорида D-пролинбензилового эфира и перемешивание продолжали при комнатной температуре в течение 24 ч. Растворитель отгоняли, остаток растворяли в ацетоацетате и экстрагировали 2 н. НСl и рассолом. В результате сушки карбонатом натрия, выпаривания растворителя и хроматографии на силикагеле с ацетоацетатом/гексаном в соотношении 1:1 получали 0,094 г бензилового эфира (R) -1- {4′ [(R) -2-карбоксипирролидин-1-илкарбонил] – [2,2] -битиазолил-4-ил} пирролидин-2-карбоновой кислоты. МС m/е (%): 630 (M+, 24), 539 (17), 495 (44), 449 (51), 380 (25), 329 (33), 313 (30), 223 (38), 194 (83), 180 (66), 145 (24), 137 (21), 91 (100). б) (R)-1- {4′- [(R)-2-карбоксипирролидин-1-илкарбонил] – [2.2] -битиазолил-4-ил} пирролидин-2-карбоновая кислота 0,51 г (0,08 ммоля) бензилового эфира (R)-1-{4′-[(R)-2-бензилоксикарбонилпирролидин-1-ил] – [2,2] -битиазолил-4-ил} пирролидин-2-карбоновой кислоты в 50 мл метанола при комнатной температуре перемешивали в течение 64 ч с 5 мл 2н. раствора гидроксида натрия. После добавления 2н. соляной кислоты до рН 1 смесь экстрагировали дихлорметаном. Экстракты сушили сульфатом натрия и упаривали. В результате хроматографии на силикагеле с дихлорметаном/ацетоном/муравьиной кислотой в соотношении 80/15/5 в виде бесцветного твердого вещества получали 0,04 г (R)-1- {4′- [(R)-2-карбоксипирролидин-1-илкарбонил] – [2,2] -битиазолил-4-ил} пирролидин-2-карбоновой кислоты. ISP-MC: 451 (М+Н)+. Пример 21 (R)-1-{ [(R)-2-Карбоксипирролидин-1-ил] ацетил} пирролидин-2-карбоновая кислота а) трет-Бутиловый эфир (R)-пирролидин-2-карбоновой кислоты Указанное в заголовке соединение получали в соответствии с описанным в литературе методом (М. Thorsen, Т.Р. Andersen, U. Pedersen, В. Yde и S.-O. Lawesson, Tetrahedron 1985, 41, 5633-5636. Используя в качестве исходного вещества 25,0 г (217 ммолей) D-пролина, в виде бесцветного масла получали 27,52 г (74%) трет-бутилового эфира (R)-пирролидин-2-карбоновой кислоты. б) трет-Бутиловый эфир (R)-(1)-бромацетилпирролидин-2-карбоновой кислоты В раствор 64,9 г (322 ммоля) бромацетилбромида в 250 мл дихлорметана при 0oС по каплям в течение 40 мин добавляли раствор 27,5 г (161 ммоль) трет-бутилового эфира (R)-пирролидин-2-карбоновой кислоты и 30 мл (177 ммолей) N-этилдиизопропиламина в 150 мл дихлорметана. Реакционной смеси давали нагреться в течение ночи до комнатной температуры и выливали в 600 мл воды. Органическую фазу отделяли, а водную фазу экстрагировали 600 мл дихлорметана. Объединенные органические фазы промывали насыщенным раствором бикарбоната натрия и рассолом, сушили (сульфатом магния) и упаривали с получением в виде коричневого масла 44,1 г (94%) указанного в заголовке соединения, которое при стоянии в условиях комнатной температуры кристаллизовалось. Температура плавления 51,5-53,2oС. в) трет-Бутиловый эфир (R)-1-{[ (R) -2-трет-бутоксикарбонилпирролидин-1-ил] ацетил} -пирролидин-2-карбоновой кислоты В раствор 34,3 г (200 ммолей) трет-бутилового эфира (R)-(1)-бромацетилпирролидин-2-карбоновой кислоты в 350 мл дихлорметана при 0oС по каплям вводили 27,9 мл (200 ммолей) триэтиламина. После перемешивания в течение 45 мин при этой температуре по каплям добавляли 17,8 г (200 ммолей) бромацетилбромида. Перемешивание продолжали при 0oС в течение 3 ч и добавляли 250 мл 1н. раствора соляной кислоты. Органическую фазу отделяли и промывали насыщенным раствором бикарбоната натрия и рассолом, сушили (сульфатом магния) и упаривали с получением в виде масла 45 г коричневого продукта. В результате растирания в этилацетате и охлаждения до -78oС получали 7,1 (9%) бледно-желтого твердого вещества. Температура плавления 75,0-76,0oС. MC m/e (%): 405 (M+Na+, 11), 383 (М+Н+, 100). г) (R)-1- { [(R) -2-карбоксипирролидин-1-ил] ацетил} пирролидин-2-карбоновая кислота Раствор 382 мг (1,0 ммоль) трет-бутилового эфира (R) -1-{[ (R) -2-трет-бутоксикарбонилпирролидин-1-ил] ацетил} пирролидин-2-карбоновой кислоты в 4 мл трифторуксусной кислоты при комнатной температуре перемешивали в течение 3 ч. В вакууме удаляли растворитель и остаток суспендировали в 10 мл диэтилового эфира. Образовавшуюся суспензию перемешивали в течение ночи. В результате фильтрования и сушки в виде бледно-желтого аморфного и гигроскопического вещества получали 300 мг (количественный выход) продукта RO-64-2799/000, который все еще содержал следовые количества трифторуксусной кислоты. МС m/е (%): 269 (М-Н–, 4,5), 113 (CF3CO2 –, 100). Пример 22 (R)-1- { { 4- [2- [(R) -2-карбоксипирролидин-1-ил] – 2-оксоэтокси] фенокси} ацетил} пирролидин-2-карбоновая кислота а) трет-Бутиловый эфир (R) -1- {{4- [2- [(R) -2-трет-бутоксикарбонилпирролидин-1-ил] -2-оксоэтокси] фенокси} ацетил} пирролидин-2-карбоновой кислоты В раствор 236 мг (2,1 ммоля) трет-бутилата калия в 2 мл диметилформамида при комнатной температуре с перемешиванием по каплям вводили раствор 110 мг (1,0 ммоль) гидрохинона в 2 мл диметилформамида. Перемешивание продолжали в течение 2-3 мин и в течение 1-2 мин добавляли раствор 584 мг (2,0 ммоля) трет-бутилового эфира (R)-(1)-бромацетилпирролидин-2-карбоновой кислоты в 4 мл диметилформамида. Реакционную смесь перемешивали в течение дополнительных 3 ч при комнатной температуре. В вакууме удаляли растворитель и остаток очищали экспресс-хроматографией с получением в виде бесцветного масла 380 мг (71%) указанного в заголовке соединения. МС m/е (%): 550 (M+NH4 +, 100), 477 (23), 421 (65). б) (R)-1- { { 4-[2- [(R) -2-карбоксипирролидин-1-ил]-2-оксоэтокси] фенокси} ацетил} пирролидин-2-карбоновая кислота Раствор 350 мг (0,66 ммоля) трет-бутилового эфира (R)-1-{{4-[2-[(R)-2-трет-бутоксикарбонилпирролидин-1-ил] -2-оксоэтокси] фенокси} ацетил] пирролидин-2-карбоновой кислоты в 4 мл трифторуксусной кислоты перемешивали в течение 3 ч при комнатной температуре. В вакууме удаляли растворитель и остаток суспендировали в 10 мл диэтилового эфира. Образовавшуюся суспензию перемешивали в течение ночи. В результате фильтрования и сушки в виде белого порошка получали 265 мг (96%) соединения, указанного в заголовке. МС m/е (%): 443 (M+Na+, 48), 438 (M+NH4 +, 39), 421 (М+Н+, 100). Пример 23 (R)-1- { { 4- [2- [(R) -2-карбоксипирролидин-1-ил] -2-оксоэтокси] -2,3,5,6-тетрафторфенокси} ацетил} пирролидин-2-карбоновая кислота а) трет-Бутиловый эфир (R)-1- {{4- [2- [(R) -2-трет-бутоксикарбонилпирролидин-1-ил] -2-оксоэтокси] -2,3,5,6-тетрафторфенокси} ацетил} пирролидин-2-карбоновой кислоты В раствор 185 мг (1,65 ммоля) трет-бутилата калия в 1 мл диметилформамида при комнатной температуре с перемешиванием по каплям вводили раствор 137 мг (0,75 ммоля) тетрафторгидрохинона в 1 мл диметилформамида. Перемешивание продолжали в течение 2-3 мин и в течение 1-2 мин добавляли раствор 438 мг (1,50 ммоля) трет-бутилового эфира (R)-(1)-бромацетилпирролидин-2-карбоновой кислоты в 2 мл диметилформамида. Реакционную смесь перемешивали в течение дополнительных 4 ч при комнатной температуре. В вакууме удаляли растворитель и остаток очищали экспресс-хроматографией с получением в виде белой пены 87 мг (19%) указанного в заголовке соединения. МС m/е (%): 622 (M+NH4 +, 100), 549 (32), 493 (57). б) (R)-1- { {4- [2- [(R) -2-карбоксипирролидин-1-ил] -2-оксоэтокси] -2,3,5,6-тетрафторфенокси} ацетил} пирролидин-2-карбоновая кислота Раствор 80 мг (0,13 ммоля) трет-бутилового эфира (R)-1-{{4-[2-[(R)-2-трет-бутоксикарбонилпирролидин-1 – ил] – 2 – оксоэтокси] -2,3,5,6 -тетрафторфенокси} ацетил} пирролидин-2-карбоновой кислоты в 1,5 мл трифторуксусной кислоты в течение 4 ч перемешивали при комнатной температуре. В вакууме удаляли растворитель и остаток суспендировали в 10 мл диэтилового эфира. Образовавшуюся суспензию перемешивали в течение ночи. В результате фильтрования и сушки в виде белого порошка получали 64 мг (96%) указанного в заголовке соединения. МС m/е (%): 491 (М-Н–, 100). Пример 24 (R)-1- {{4- [2- [(R)-2-карбоксипирролидин-1-ил] -2-оксоэтокси] -2-хлорфенокси} ацетил} пирролидин-2-карбоновая кислота а) трет-Бутиловый эфир (R) -1- {{4- [2- [(R) -2-трет-бутоксикарбонилпирролидин-1-ил] -2-оксоэтокси] -2-хлорфенокси} ацетил} пирролидин-2-карбоновой кислоты В раствор 185 мг (1,65 ммоля) трет-бутилата калия в 1 мл диметилформамида при комнатной температуре с перемешиванием по каплям вводили раствор 108 мг (0,75 ммоля) хлоргидрохинона в 1 мл диметилформамида. Перемешивание продолжали в течение 2-3 мин и в течение 1-2 мин добавляли раствор 438 мг (1,50 ммоля) трет-бутилового эфира (R)-(1)-бромацетилпирролидин-2-карбоновой кислоты в 2 мл диметилформамида. Реакционную смесь перемешивали в течение дополнительных 4 ч при комнатной температуре. В вакууме удаляли растворитель и остаток очищали экспресс-хроматографией с получением в виде белой пены 149 мг (35%) указанного в заголовке соединения. МС m/е (%): 584 (M+NH4 +, 100), 511 (48), 455 (96). б) (R)-1- {{4- [2- [(R) -2-карбоксипирролидин-1-ил] -2-оксоэтокси] -2-хлорфенокси} ацетил} пирролидин-2-карбоновая кислота Раствор 140 мг (0,25 ммоля) трет-бутилового эфира (R)-1-{{4-[2-[(R)-2-трет-бутоксикарбонилпирролидин-1-ил] -2-оксоэтокси] -2-хлорфенокси} ацетил} пирролидин-2-карбоновой кислоты в 1,5 мл трифторуксусной кислоты в течение 4 ч перемешивали при комнатной температуре. В вакууме удаляли растворитель и остаток суспендировали в 10 мл диэтилового эфира. Образовавшуюся суспензию перемешивали в течение ночи. В результате фильтрования и сушки в виде белого порошка получали 126 мг (количественный выход) указанного в заголовке соединения. МС m/е (%): 453 (М-Н–, 100). Пример 25 (R)-1- { {4- [2- [(R) -2-карбоксипирролидин-1-ил] -2-оксоэтокси] -2-метоксифенокси} ацетил} пирролидин-2-карбоновая кислота а) трет-Бутиловый эфир (R)-1- {{4- [2- [(R) -2-трет-бутоксикарбонилпирролидин-1-ил] -2-оксоэтокси] -2-метоксифенокси} ацетил} пирролидин-2-карбоновой кислоты В раствор 236 мг (2,1 ммоля) трет-бутилата калия в 2 мл диметилформамида при комнатной температуре с перемешиванием по каплям вводили раствор 140 мг (1,0 ммоля) метоксигидрохинона в 2 мл диметилформамида. Перемешивание продолжали в течение 2-3 мин и в течение 1-2 мин добавляли раствор 584 мг (2,0 ммоля) трет-бутилового эфира (R) -(1)-бромацетилпирролидин-2-карбоновой кислоты в 4 мл диметилформамида. Реакционную смесь перемешивали в течение дополнительных 3 ч при комнатной температуре. В вакууме удаляли растворитель и остаток очищали экспресс-хроматографией с получением в виде бесцветного масла 280 мг (50%) указанного в заголовке соединения. МС m/е (%): 580 (M+NH4 +, 100), 563 (М+Н+, 75), 507 (62), 451 (67). б) (R)-1- {{4- [2- [(R) -2-карбоксипирролидин-1-ил] -2-оксоэтокси] -2-метоксифенокси} ацетил} пирролидин-2-карбоновая кислота Раствор 250 мг (0,44 ммоля) трет-бутилового эфира (R)-1- {{4-[2-[(R)-2-трет- бутоксикарбонилпирролидин -1 -ил] – 2 – оксоэтокси] – 2 – метоксифенокси} ацетил} пирролидин-2-карбоновой кислоты в 4 мл трифторуксусной кислоты в течение 3 ч перемешивали при комнатной температуре. В вакууме удаляли растворитель и остаток суспендировали в 10 мл диэтилового эфира. Образовавшуюся суспензию перемешивали в течение ночи. В результате фильтрования и сушки в виде белого порошка получали 188 мг (94%) указанного в заголовке соединения. МС m/е (%): 473 (M+Na+, 45), 468 (M+NH4 +, 24), 451 (М+Н+, 100). Пример 26 Смесь (R) -1-[(4-гидрокси-3- и -2-метоксифенокси)ацетил]пирролидин-2-карбоновых кислот а) Смесь трет-бутиловых эфиров (R) -1-[(4-гидрокси-3- и -2-метоксифенокси)ацетил] пирролидин-2-карбоновых кислот Указанные в заголовке соединения получали в виде побочных продуктов в процессе получения трет-бутилового эфира (R)-1- {{4- [2- [(R) -2-трет-бутоксикарбонилпирролидин-1-ил] -2-оксоэтокси] -2-метоксифенокси} ацетил} пирролидин-2-карбоновой кислоты. В результате выделения и очистки экспресс-хроматографией в виде бесцветного масла получали 80 мг (23%) продукта RO-64-2915/000. 1H-ЯМР (CDCl3, част./млн): 1,41 (s, 2,4H), 1,45 (s, 6,6H), 1,81-2,32 (m, 4H), 3,55-3,82 (m, 2H), 3,75 (s, 3Н), 4,39-4,78 (m, 3Н), 6,16-6,26 (m, 1H), 6,40-6,43 (m, 1H), 6,67-6,74 (m, 1H). б) Смесь (R) -1-[(4-гидрокси-3- и -2-метоксифенокси)ацетил]пирролидин-2-карбоновых кислот В раствор 80 мг (0,23 ммоля) смеси трет-бутиловых эфиров (R)-1-[(4-гидрокси-3- и -2-метоксифенокси) ацетил] пирролидин-2-карбоновых кислот в 1 мл дихлорметана вводили 5 мл 4н. раствора соляной кислоты в диоксане. По прошествии 24 ч в вакууме удаляли растворитель и остаток суспендировали в 10 мл диэтилового эфира. Образовавшуюся суспензию перемешивали в течение ночи. В результате фильтрования и сушки в виде белого порошка получали 65 мг (97%) указанной в заголовке смеси соединений. МС m/е (%): 296 (М+Н+, 100). Пример 27 (R)-1- { {3- [2- [(R)-2-карбоксипирролидин-1-ил] -2-оксоэтокси]фенокси} ацетил}пирролидин-2-карбоновая кислота а) трет-Бутиловый эфир (R)-1- {{3- [2- [(R) -трет-бутоксикарбонилпирролидин-1-ил] -2-оксоэтокси] фенокси} ацетил} пирролидин-2-карбоновой кислоты В перемешиваемый раствор 561 мг (5,0 ммолей) трет-бутилата калия в 4 мл диметилформамида при комнатной температуре по каплям вводили раствор 275 мг (2,5 ммоля) резорцина в 4 мл диметилформамида. Перемешивание продолжали в течение 2-3 мин и в течение 1-2 мин добавляли раствор 1,46 мг (5,0 ммолей) трет-бутилового эфира (R) -(1)-бромацетилпирролидин-2-карбоновой кислоты в 5 мл диметилформамида. Реакционную смесь перемешивали в течение дополнительных 3 ч при комнатной температуре. В вакууме удаляли растворитель и остаток очищали экспресс-хроматографией с получением в виде бесцветного масла 830 мг (62%) указанного в заголовке соединения. MC m/e (%): 550 (M+NH+, 100), 533 (М+Н+, 95), 477 (48), 421 (95). б) (R)-1- {{3- [2- [(R) -2-карбоксипирролидин-1-ил] – 2-оксоэтокси] фенокси} ацетил} пирролидин-2-карбоновая кислота Раствор 750 мг (1,41 ммоля) трет-бутилового эфира (R)-1-{{3-[2-[(R)-2-трет-бутоксикарбонилпирролидин-1-ил] -2-оксоэтокси] фенокси} ацетил} пирролидин-2-карбоновой кислоты в 6 мл трифторуксусной кислоты в течение 3 ч перемешивали при комнатной температуре. В вакууме удаляли растворитель и остаток суспендировали в 15 мл диэтилового эфира. Образовавшуюся суспензию перемешивали в течение ночи. В результате фильтрования и сушки в виде белого порошка получали 581 мг (98%) указанного в заголовке соединения. MC m/e (%): 443 (M+Na+, 32), 438 (M+NH4 +, 20), 421 (М+Н+, 100). Пример 28 (R)-1- [(3-гидроксифенокси) ацетил] пирролидин-2-карбоновая кислота а) трет-Бутиловый эфир (R) -1-[(3-гидроксифенокси)ацетил]пирролидин-2-карбоновой кислоты Указанное в заголовке соединение получали в качестве побочного продукта процесса получения трет-бутилового эфира (R)-1- {{3- [2- [(R) -2-трет-бутоксикарбонилпирролидин-1-ил] -2-оксоэтокси] фенокси} ацетил} пирролидин-2-карбоновой кислоты. В результате выделения и очистки экспресс-хроматографией в виде бесцветного масла получали 120 мг (37%) продукта RO-64-2802/000. MC m/e (%): 344 (M+Na+, 9), 322 (M+H+, 73), 266 (100). б) (R)-1- [(3-гидроксифенокси) ацетил] пирролидин-2-карбоновая кислота В раствор 120 мг (0,37 ммоля) трет-бутилового эфира (R)-1-[(3-гидроксифенокси)ацетил]пирролидин-2-карбоновой кислоты в 1 мл дихлорметана вводили 5 мл 4н. раствора соляной кислоты в диоксане. По прошествии 3 дней в вакууме удаляли растворитель и остаток суспендировали в 10 мл диэтилового эфира. Образовавшуюся суспензию перемешивали в течение ночи. В результате фильтрования и сушки в виде белого порошка получали 95 мг (97%) указанного в заголовке соединения. МС m/е (%): 264 (М-Н–, 100). Пример 29 (R)-1- { { 3- [2- [(R)-2-карбоксипирролидин-1-ил] -2-оксоэтокси] -2-метилфенокси} ацетил} пирролидин-2-карбоновая кислота а) трет-Бутиловый эфир (R)-1- {{3- [2-[(R)-2-трет-бутоксикарбонилпирролидин-1-ил] -2-оксоэтокси] -2-метилфенокси} ацетил} пирролидин-2-карбоновой кислоты В перемешиваемый раствор 236 мг (2,1 ммоля) трет-бутилата калия в 2 мл диметилформамида при комнатной температуре по каплям вводили раствор 124 мг (1,0 ммоль) 2,6-дигидрокситолуола в 2 мл диметилформамида. Перемешивание продолжали в течение 2-3 мин и в течение 1-2 мин добавляли раствор 584 мг (2,0 ммоля) трет-бутилового эфира (R) -(1)-бромацетилпирролидин-2-карбоновой кислоты в 4 мл диметилформамида. Реакционную смесь перемешивали в течение дополнительных 3 ч при комнатной температуре. В вакууме удаляли растворитель и остаток очищали экспресс-хроматографией с получением в виде бесцветного масла 335 мг (61%) указанного в заголовке соединения. МС m/е (%): 564 (M+NH4 +, 100), 491 (27), 435 (71). б) (R)-1- {{3- [2- [(R) -2-карбоксипирролидин-1-ил] -2-оксоэтокси] -2-метилфенокси} ацетил} пирролидин-2-карбоновая кислота Раствор 300 мг (0,55 ммоля) трет-бутилового эфира (R)-1-{{3-[2-[(R)-2-трет-бутоксикарбонилпирролидин-1-ил] -2-оксоэтокси] -2-метилфенокси} ацетил} пирролидин-2-карбоновой кислоты в 4 мл трифторуксусной кислоты в течение 3 ч перемешивали при комнатной температуре. В вакууме удаляли растворитель и остаток суспендировали в 10 мл диэтилового эфира. Образовавшуюся суспензию перемешивали в течение ночи. В результате фильтрования и сушки в виде белого порошка получали 226 мг (95%) указанного в заголовке соединения. МС m/е (%): 457 (M+Na+, 54), 452 (M+NH4 +, 55), 435 (М+Н+, 100). Пример 30 (R)-1- { {3- [2- [(R) -2-карбоксипирролидин-1-ил] -2-оксоэтокси] -5-метоксифенокси} ацетил} пирролидин-2-карбоновая кислота а) трет-Бутиловый эфир (R) -1- {{3- [2- [(R) -2-трет-бутоксикарбонилпирролидин-1-ил] -2-оксоэтокси] -5-метоксифенокси} ацетил} пирролидин-2-карбоновой кислоты В перемешиваемый раствор 236 мг (2,1 ммоля) трет-бутилата калия в 2 мл диметилформамида при комнатной температуре по каплям вводили раствор 140 мг (1,0 ммоль) 5-метоксирезорцина в 2 мл диметилформамида. Перемешивание продолжали в течение 2-3 мин и в течение 1-2 мин добавляли раствор 584 мг (2,0 ммоля) трет-бутилового эфира (R) -(1)-бромацетилпирролидин-2-карбоновой кислоты в 4 мл диметилформамида. Реакционную смесь перемешивали в течение дополнительных 3 ч при комнатной температуре. В вакууме удаляли растворитель и остаток очищали экспресс-хроматографией с получением в виде бесцветного масла 407 мг (72%) указанного в заголовке соединения. МС m/е (%): 580 (M+NH4 +, 98), 563 (М+Н+, 100), 507 (54), 451 (95). б) (R)-1- {{3- [2- [(R) -2-карбоксипирролидин-1-ил] -2-оксоэтокси] -5-метоксифенокси} ацетил} пирролидин-2-карбоновая кислота Раствор 370 мг (0,66 ммоля) трет-бутилового эфира (R)-1- {{3- [2- [(R)-2 -трет- бутоксикарбонилпирролидин -1 – ил] – 2 – оксоэтокси] -5 – метоксифенокси} ацетил} пирролидин-2-карбоновой кислоты в 4 мл трифторуксусной кислоты в течение 3 ч перемешивали при комнатной температуре. В вакууме удаляли растворитель и остаток суспендировали в 10 мл диэтилового эфира. Образовавшуюся суспензию перемешивали в течение ночи. В результате фильтрования и сушки в виде белого порошка получали 287 мг (97%) указанного в заголовке соединения. MC m/e (%): 473 (M+Na+, 45), 468 (M+NH4 +, 30), 451 (М+Н+, 100). Пример 31 (R)-1-{ { 3- [2- [(R)-2-карбоксипирролидин-1-ил] -2-оксоэтокси] -5-метоксикарбонилфенокси} ацетил} пирролидин-2-карбоновая кислота а) трет-Бутиловый эфир (R)-1- {{3- [2- [(R)-2-трет-бутоксикарбонилпирролидин-1-ил] -2-оксоэтокси] -5-метоксикарбонилфенокси} ацетил} пирролидин-2-карбоновой кислоты В перемешиваемый раствор 595 мг (5,3 ммоля) трет-бутилата калия в 4 мл диметилформамида при комнатной температуре по каплям вводили раствор 420 мг (2,5 ммоля) 3,5-дигидроксибензоата в 4 мл диметилформамида. Перемешивание продолжали в течение 2-3 мин и в течение 1-2 мин добавляли раствор 1,46 мг (5,0 ммолей) трет-бутилового эфира (R)-(1)-бромацетилпирролидин-2-карбоновой кислоты в 5 мл диметилформамида. Реакционную смесь перемешивали в течение дополнительных 2 ч при комнатной температуре. В вакууме удаляли растворитель и остаток очищали экспресс-хроматографией с получением в виде бесцветного масла 1,01 мг (68%) указанного в заголовке соединения. MC m/e (%): 608 (M+NH4 +, 92), 591 (М+Н+, 48), 535 (41), 479 (100). б) (R)-1- {{3- [2- [(R)-2-карбоксипирролидин-1-ил] -2-оксоэтокси] -5-метоксикарбонилфенокси} ацетил} пирролидин-2-карбоновая кислота Раствор 710 мг (1,2 ммоля) трет-бутилового эфира (R)-1- {{3- [2- [(R)-2-трет- бутоксикарбонилпирролидин -1 – ил] – 2 – оксоэтокси] – 5 – метоксикарбонилфенокси} ацетил} пирролидин-2-карбоновой кислоты в 10 мл трифторуксусной кислоты в течение 3 ч перемешивали при комнатной температуре. В вакууме удаляли растворитель и остаток суспендировали в 20 мл диэтилового эфира. Образовавшуюся суспензию перемешивали в течение ночи. В результате фильтрования и сушки в виде белого порошка получали 540 мг (94%) указанного в заголовке соединения. MC m/e (%): 477 (М-Н–, 100). Пример 32 (R)-1- { { 3-карбокси-5- [2- [(R)-2-карбоксипирролидин-1-ил] -2-оксоэтокси] фенокси} ацетил} пирролидин-2-карбоновая кислота В 10 мл 0,5н. раствора гидроксида лития в метаноле/воде в соотношении 3: 1 вводили 100 мг (0,2 ммоля) (R)-1-{{3-[2-[(R)-2-карбоксипирролидин-1-ил]-2-оксоэтокси] -5-метоксикарбонилфенокси} ацетил} пирролидин-2-карбоновой кислоты. Раствору давали постоять при комнатной температуре в течение 24 ч. Добавлением по каплям раствора соляной кислоты значение рН смеси доводили до 6 и лиофилизировали с получением 800 мг белого порошка. Продукт выделяли хроматографией с использованием ионообменной смолы (продукта Dowex). В результате лиофилизации в виде белого порошка получали 20 мг (22%) указанного в заголовке соединения. МС m/е (%): 487 (M+Na+, 61), 482 (M+NH4 +, 54), 465 (М+Н+, 100). Пример 33 а) трет-Бутиловый эфир (R)-1- {{3- [2- [(R)-2-трет-бутоксикарбонилпирролидин-1-ил] -2-оксоэтокси] -5-цианофенокси} ацетил} пирролидин-2-карбоновой кислоты В раствор 1,35 мг (10 ммолей) 3,5-дигидроксибензонитрила и 5,84 г (20 ммолей) трет-бутилового эфира (R)-(1)-бромацетилпирролидин-2-карбоновой кислоты в 25 мл диметилформамида при комнатной температуре вводили 7 г безводного карбоната калия. После перемешивания в течение дополнительных 20 ч калиевые соли отфильтровывали и в вакууме удаляли растворитель. Остаток очищали экспресс-хроматографией с получением в виде бесцветной пены 4,77 мг (86%) указанного в заголовке соединения. МС m/е (%): 575 (M+NH4 +, 100), 558 (М+Н+, 42), 502 (35), 446 (85). б) (R)-1- {{3- [2- [(R)-2-карбоксипирролидин-1-ил] -2-оксоэтокси] -5-цианофенокси} ацетил} пирролидин-2-карбоновая кислота Раствор 280 мг (0,5 ммоля) трет-бутилового эфира (R)-1-{{3-[2-[(R)-2-трет-бутоксикарбонилпирролидин-1-ил] -2-оксоэтокси] -5-цианофенокси} ацетил} пирролидин-2-карбоновой кислоты в 5 мл трифторуксусной кислоты в течение 18 ч перемешивали при комнатной температуре. В вакууме удаляли растворитель и остаток суспендировали в 10 мл диэтилового эфира. Образовавшуюся суспензию перемешивали в течение ночи. В результате фильтрования и сушки в виде белого порошка получали 280 мг (72%) указанного в заголовке соединения. МС m/е (%): 444 (М-Н–, 100). Пример 34 (R)-1- { {3- [2- [(R)-2-карбоксипирролидин-1-ил] -2-оксоэтокси] -5-1Н-тетразол-5-илфенокси} ацетил} пирролидин-2-карбоновая кислота В раствор 110 мг (0,2 ммоля) трет-бутилового эфира (R)-1-{{3-[2-[(R)-2-трет-бутоксикарбонилпирролидин-1-ил] -2-оксоэтокси] -5-цианофенокси} -ацетил} пирролидин-2-карбоновой кислоты в 10 мл 1,2-диметоксиэтана вводили 200 мг (0,6 ммоля) азида трибутилолова. Смесь кипятили с обратным холодильником в течение 3 дней. После охлаждения до комнатной температуры через раствор барботировали 1,4 г газообразной соляной кислоты с получением 4н. раствора соляной кислоты в 1,2-диметоксиэтане и перемешивание продолжали в течение 12 ч. В вакууме удаляли растворитель, а маслянистый остаток растирали в диэтиловом эфире с получением в виде бледно-желтого аморфного твердого вещества 61 мг (92%) соединения, указанного в заголовке. МС m/е (%): 511 (М+Na4 +, 41), 506 (M+NH4 +, 32), 489 (М+Н+, 100). Пример 35 (R)-1- { {3- [2- [(R)-2-карбоксипирролидин-1-ил] -2-оксоэтокси] -5-гидроксифенокси} ацетил} пирролидин-2-карбоновая кислота а) трет-Бутиловый эфир (R)-1-{{3- [2- [(R)-2-трет-бутоксикарбонилпирролидин-1-ил] -2-оксоэтокси] -5-гидроксифенокси} ацетил} пирролидин-2-карбоновой кислоты В раствор 95 мг (0,75 ммоля) флороглюцинола и 438 мг (1,5 ммоля) трет-бутилового эфира (R)-(1)-бромацетилпирролидин-2-карбоновой кислоты в 2 мл диметилформамида при комнатной температуре вводили 520 мг безводного карбоната калия. После перемешивания в течение ночи калиевые соли отфильтровывали и в вакууме удаляли растворитель. Остаток очищали экспресс-хроматографией с получением в виде бесцветной пены 50 мг (12%) указанного в заголовке соединения. МС m/е (%): 566 (M+NH4 +, 96), 549 (М+Н+, 88), 493 (47), 437 (100). б) (R)-1 {{3- [2- [(R)-2-карбоксипирролидин-1-ил] -2-оксоэтокси] -5-гидроксифенокси} ацетил} пирролидин-2-карбоновая кислота Раствор 46 мг (0,084 ммоля) трет-бутилового эфира (R)-1-{{3-[2-[(R)-2-трет-бутоксикарбонилпирролидин-1-ил] -2-оксоэтокси] -5-гидроксифенокси} ацетил} пирролидин-2-карбоновой кислоты в 1 мл трифторуксусной кислоты в течение 4 ч перемешивали при комнатной температуре. В вакууме удаляли растворитель и остаток суспендировали в 5 мл диэтилового эфира. Образовавшуюся суспензию перемешивали в течение ночи. В результате фильтрования и сушки в виде светло-коричневого порошка получали 35 мг (96%) указанного в заголовке соединения. МС m/е (%): 435 (М-Н–, 100). Пример 36 (R)-1- { { 3,5-бис- [2- [(R)-2-карбоксипирролидин-1-ил] -2-оксоэтокси] фенокси} ацетил} пирролидин-2-карбоновая кислота а) трет-Бутиловый эфир (R)-1- {{3,5-бис-[2- [(R)-2-трет-бутоксикарбонилпирролидин-1 -ил] -2-оксоэтокси] фенокси} ацетил} пирролидин-2-карбоновой кислоты В раствор 95 мг (0,75 ммоля) флороглюцинола и 220 мг (0,75 ммоля) трет-бутилового эфира (R)-(1)-бромацетилпирролидин-2-карбоновой кислоты в 2 мл диметилформамида при комнатной температуре вводили 520 мг безводного карбоната калия. После перемешивания при комнатной температуре в течение 2 и 6 ч каждый раз добавляли по 220 мг (0,75 ммоля) трет-бутилового эфира (R)-(1)-бромацетилпирролидин-2-карбоновой кислоты и перемешивание продолжали в течение 18 ч. Калиевые соли отфильтровывали и в вакууме удаляли растворитель. Остаток очищали экспресс-хроматографией с получением в виде бесцветной пены 465 мг (82%) указанного в заголовке соединения. МС m/е (%): 777 (M+NH4 +, 100), 760 (М+Н+, 4), 704 (11), 648 (22), 592 (22). б) (R)-1- {{3,5-бис- [2- [(R)-2-карбоксипирролидин-1-ил] -2-оксоэтокси] фенокси} ацетил} пирролидин-2-карбоновая кислота Раствор 350 мг (0,47 ммоля) трет-бутилового эфира (R)-1-{{3,5-бис-[2-[(R) -2-трет-бутоксикарбонилпирролидин-1-ил] -2-оксоэтокси] фенокси} ацетил} пирролидин-2-карбоновой кислоты в 1,5 мл трифторуксусной кислоты в течение 4 ч перемешивали при комнатной температуре. В вакууме удаляли растворитель и остаток суспендировали в 10 мл диэтилового эфира. Образовавшуюся суспензию перемешивали в течение ночи. В результате фильтрования и сушки в виде светло-коричневого порошка получали 254 мг (92%) указанного в заголовке соединения. МС m/е (%): 614 (М+Na+, 73), 609 (M+NH4 +, 100), 592 (М+Н+, 56). Пример 37 Смесь (Е)- и (Z)-(R)-1-{{3-[2-[(R)-2-карбоксипирролидин-1-ил]-2-оксоэтокси] -5- (N-гидроксикарбамимидоил)фенокси} ацетил} пирролидин-2-карбоновых кислот а) Смесь трет-бутиловых эфиров (Е)- и (Z)-(R)-1-{{3-[2-[(R)-2-тpeт-бутоксикарбонилпирролидин-1-ил] -2-оксоэтокси] -5- (N-гидроксикарбамимидоил)фенокси} ацетил} пирролидин-2-карбоновых кислот В раствор 1,25 г (17,9 ммоля) гидроксиламингидрохлорида в 6 мл диметилсульфоксида вводили 1,82 г (18 ммолей) триэтиламина. Нерастворимый материал отфильтровывали и промывали 5 мл тетрагидрофурана. Фильтрат концентрировали в вакууме, под остаточным давлением 100 мбар, удаляя тетрагидрофуран, и добавляли 2,0 г (3,59 ммоля) трет-бутилового эфира (R)-1-{{3- [2- [(R)-2-трет-бутоксикарбонилпирролидин-1-ил] -2-оксоэтокси] -5-цианофенокси} ацетил} пирролидин-2-карбоновой кислоты. После перемешивания в течение 20 ч при 75oС реакционную смесь разбавляли водой и экстрагировали этилацетатом. Органический раствор экстрагировали 1н. раствором соляной кислоты. Добавлением в водный раствор 1н. раствора гидроксида натрия значение рН доводили до 10 и экстрагировали этилацетатом. Органический раствор промывали водой, сушили (сульфатом натрия) и упаривали с получением в виде бесцветной пены 1,74 г смеси соединений, указанных в заголовке. МС m/е (%): 613 (M+Na+, 7), 591 (M+NH4 +, 100), 535 (21), 479 (15). б) Смесь (Е)- и (Z)- (R)-1-{{3-[2-[(R)-2-карбоксипирролидин-1-ил]-2-оксоэтокси] -5- (N-гидроксикарбамимидоил)фенокси} ацетил} пирролидин-2-карбоновых кислот Раствор 120 мг (0,2 ммоля) смеси трет-бутиловых эфиров (Е)- и (Z)-(R)-1- { {3- [2- [(R)-2-трет-бутоксикарбонилпирролидин-1-ил] -2-оксоэтокси] -5-(N-гидроксикарбамимидоил)фенокси} ацетил} пирролидин-2-карбоновых кислот в 1,5 мл трифторуксусной кислоты в течение 4 ч перемешивали при комнатной температуре. В вакууме удаляли растворитель и остаток суспендировали в 10 мл диэтилового эфира. Образовавшуюся суспензию перемешивали в течение ночи. В результате фильтрования и сушки в виде светло-коричневого порошка получали 96 мг (количественный выход) указанной в заголовке смеси соединений. MC m/e (%):501 (M+Na+, 31), 479 (M+H+, 100). Пример 38 (R)-1- {{3- [2- [(R)-2-карбоксипирролидин-1-ил] -2-оксоэтокси] -5-(5-оксо-4,5-дигидро [1,2,4] оксадиазол-3-ил)фенокси} ацетил} пирролидин-2-карбоновая кислота а) трет-Бутиловый эфир (R)-1- {{3- [2- [(R)-2-трет-бутоксикарбонилпирролидин-1-ил] -2-оксоэтокси] -5-(5-оксо-4,5-дигидро[1,2,4] оксадиазол-3-ил)фенокси} ацетил} пирролидин-2-карбоновой кислоты В охлажденный льдом раствор 300 мг (0,51 ммоля) трет-бутиловых эфиров (Е)- и (Z)-(R)-1- {{3- [2- [(R)-2-трет-бутоксикарбонилпирролидин-1-ил] -2-оксоэтокси] -5- (N-гидроксикарбамимидоил)фенокси} ацетил} пирролидин-2-карбоновых кислот и 43 мг (0,55 ммоля) пиридина в 2 мл диметилформамида добавляли по каплям 200 мг (0,51 ммоля) 2-этилгексилхлорформиата. Смесь перемешивали при 0oС в течение 30 мин, разбавляли водой и экстрагировали этилацетатом. Органическую фазу сушили (сульфатом натрия), упаривали и маслянистый остаток растворяли в 20 мл толуола. После перемешивания в течение 16 ч при комнатной температуры толуольный раствор промывали рассолом, сушили (сульфатом натрия) и фильтровали на силикагеле с получением в виде вязкого масла 280 мг (89%) соединения, указанного в заголовке. MC m/e (%): 639 (M+Na+, 51), 634 (М+NH4 +, 100), 617 (М+Н+, 14), 561 (40), 505 (79). б) (R)-1- {{3- [2- [(R)-2-карбоксипирролидин-1-ил] -2-оксоэтокси] -5-(5-оксо-4,5-дигидро[1,2,4]оксадиазол-3-ил)фенокси} ацетил} пирролидин-2-карбоновая кислота Раствор 220 мг (0,36 ммоля) трет-бутилового эфира (R)-1-{{3-[2-[(R)-2-трет-бутоксикарбонилпирролидин-1-ил] -2-оксоэтокси] -5- (5-оксо-4,5-дигидро[1,2,4] оксадиазол-3-ил)фенокси} ацетил} пирролидин-2-карбоновой кислоты в 1,5 мл трифторуксусной кислоты в течение 4 ч перемешивали при комнатной температуре. В вакууме удаляли растворитель и остаток суспендировали в 10 мл диэтилового эфира. Образовавшуюся суспензию перемешивали в течение ночи. В результате фильтрования и сушки в виде светло-коричневого порошка получали 135 мг (74%) указанного в заголовке соединения. MC m/e (%): 527 (M+Na+, 73), 522 (M+NH4 +, 75), 505 (М+Н+ 100). Пример 39 (R)-1- { {3- [2- [(R)-2-карбоксипирролидин-1-ил] -2-оксоэтокси] -5-(2-оксо-2,3-дигидро[1,2,3,5] оксатиадиазол-4-ил)фенокси} ацетил} пирролидин-2-карбоновая кислота (S-оксидной конфиг., R/S=1:1) а) трет-Бутиловый эфир (R)-1- {{3- [2- [(R)-2-трет-бутоксикарбонилпирролидин-1-ил] -2-оксоэтокси] -5-(2-оксо-2,3-дигидро[1,2,3,5]оксатиадиазол-4-ил)фенокси} ацетил} пирролидин-2-карбоновой кислоты (S-оксидной конфиг., R/S=1:1) В охлажденный льдом раствор 300 мг (0,51 ммоля) трет-бутиловых эфиров (Е)- и (Z)-(R)-1- {{3- [2- [(R)-2-трет-бутоксикарбонилпирролидин-1-ил] -2-оксоэтокси] -5- (N-гидроксикарбамимидоил)фенокси} ацетил} пирролидин-2-карбоновых кислот и 80 мг (1 ммоль) пиридина в 2 мл дихлорметана добавляли по каплям 60 мг (0,51 ммоля) тионилхлорида (растворенного в 0,3 мл дихлорметана). Смесь перемешивали при 0oС в течение 45 мин, разбавляли дихлорметаном, промывали водой, сушили (сульфатом натрия) и упаривали. В результате экспресс-хроматографии в виде полутвердой жидкости получали 190 мг (59%) соединения, указанного в заголовке. MC m/e (%): 659 (M+Na+, 14), 654 (M+NH4 +, 100), 637 (М+Н+, 11), 581 (14), 525 (74). б) (R)-1- {{3- [2- [(R)-2-карбоксипирролидин-1-ил] -2-оксоэтокси] -5-(2-оксо-2,3-дигидро[1,2,3,5] оксатиадиазол-4-ил)фенокси} ацетил} пирролидин-2-карбоновая кислота (S-оксидной конфиг., R/S=1:1) Раствор 165 мг (0,26 ммоля) трет-бутилового эфира (R)-1-{{3-[2-[(R)-2-трет-бутоксикарбонилпирролидин-1-ил] -2-оксоэтокси] -5-(2-оксо-2,3-дигидро[1,2,3,5] оксатиадиазол-4-ил)фенокси} ацетил} пирролидин-2-карбоновой кислоты (S-оксидной конфиг. , R/S=1:1) в 1,5 мл трифторуксусной кислоты в течение 4 ч перемешивали при комнатной температуре. В вакууме удаляли растворитель и остаток суспендировали в 10 мл диэтилового эфира. Образовавшуюся суспензию перемешивали в течение ночи. В результате фильтрования и сушки в виде светло-коричневого порошка получали 115 мг (85%) указанного в заголовке соединения. MC m/e (%): 547 (M+Na+, 65), 542 (M+NH4 +, 86), 525 (М+Н+, 100). Пример 40 (R)-1- { {3- [2- [(R)-2-карбоксипирролидин-1-ил] -2-оксоэтокси] -5-(5-трет-бутилсульфанил[1,2,4] оксадиазол-3-ил)фенокси} ацетил} пирролидин-2-карбоновая кислота а) трет-Бутиловый эфир (R)-1- {{3- [2- [(R)-2-трет-бутоксикарбонилпирролидин-1-ил] -2-оксоэтокси] -5-(5-тиоксо-4,5-дигидро[1,2,4] оксадиазол-3-ил)фенокси} ацетил} пирролидин-2-карбоновой кислоты Смесь 515 мг (0,87 ммоля) трет-бутиловых эфиров (Е)- и (Z)-(R)-1-{{3-[2- [(R)-2-трет-бутоксикарбонилпирролидин-1-ил] -2-оксоэтокси] -5-(N-гидроксикарбамимидоил)фенокси} ацетил} пирролидин-2-карбоновых кислот с 177 мг (0,94 ммоля) 1,1′-тиокарбонилдиимидазола и 530 мг (3,5 ммоля) 1,8-диазабицикло[5.4.0] -ундец-7-ена в 10 мл ацетонитрила перемешивали при комнатной температуре в течение 4 ч. Смесь концентрировали в вакууме, разбавляли водой, с помощью 1н. раствора соляной кислоты значение рН доводили до 4-5 и экстрагировали этилацетатом. Экстракт концентрировали вновь, остаток разбавляли 100 мл 1н. раствора гидроксида натрия и промывали диэтиловым эфиром. Добавлением 1н. раствора соляной кислоты значение рН доводили до 4 и экстрагировали этилацетатом. Органическую фазу промывали водой, сушили (сульфатом натрия) и упаривали с получением в виде бледно-коричневой пены 490 мг (89%) указанного в заголовке соединения. МС m/е (%): 655 (M+Na+, 35), 650 (M+NH4 +, 100), 633 (М+Н+, 14), 577 (31), 521 (52). б) (R)-1- {{3- [2- [(R)-2-карбоксипирролидин-1-ил] -2-оксоэтокси] -5-(5-трет-бутилсульфанил[1,2,4] оксадиазол-3-ил)фенокси} ацетил} пирролидин-2-карбоновая кислота Раствор 315 мг (0,5 ммоля) трет-бутилового эфира (R)-1-{{3-[2-[(R)-2-трет-бутоксикарбонилпирролидин-1-ил] -2-оксоэтокси] -5- (5-тиоксо-4,5-дигидро[1,2,4]оксадиазол-3-ил)фенокси} ацетил} пирролидин-2-карбоновой кислоты в 1,5 мл трифторуксусной кислоты в течение 4 ч перемешивали при комнатной температуре. В вакууме удаляли растворитель и остаток суспендировали в 10 мл диэтилового эфира. Образовавшуюся суспензию перемешивали в течение ночи. В результате фильтрования и сушки в виде белого порошка получали 160 мг (57%) указанного в заголовке соединения. MC m/e (%): 599 (M+Na+, 54), 594 (M+NH4 +, 71), 577 (М+Н+, 100), 521 (37). Пример 41 (R)-1- {{2- [2- [(R)-2-карбоксипирролидин-1-ил] -2-оксоэтокси] -3-метоксифенокси} ацетил} пирролидин-2-карбоновая кислота а) трет-Бутиловый эфир (R)-1- {{2- [2- [(R)-2-трет-бутоксикарбонилпирролидин-1-ил] -2-оксоэтокси] -3-метоксифенокси} ацетил} пирролидин-2-карбоновой кислоты В перемешиваемый раствор 236 мг (2,1 ммоля) трет-бутилата калия в 2 мл диметилформамида при комнатной температуре по каплям вводили раствор 140 мг (1,0 ммоль) пирогаллол-1-метилового эфира в 2 мл диметилформамида. Перемешивание продолжали в течение 2-3 мин и в течение 1-2 мин добавляли раствор 584 мг (2,0 ммоля) трет-бутилового эфира (R)-(1)-бромацетилпирролидин-2-карбоновой кислоты в 4 мл диметилформамида. Реакционную смесь перемешивали в течение дополнительных 3 ч при комнатной температуре. В вакууме удаляли растворитель и остаток очищали экспресс-хроматографией с получением в виде бесцветного масла 375 мг (67%) указанного в заголовке соединения. МС m/е (%): 580 (М+NH4 +, 14), 563 (М+Н+, 100), 507 (14), 451 (12). б) (R)-1- {{2- [2- [(R)-2-карбоксипирролидин-1-ил] -2-оксоэтокси] -3-метоксифенокси} ацетил} пирролидин-2-карбоновая кислота Раствор 345 мг (0,61 ммоля) трет-бутилового эфира (R)-1-{{2-[2-[(R)-2-трет-бутоксикарбонилпирролидин-1 -ил] – 2-оксоэтокси] -3 -метоксифенокси} ацетил} пирролидин-2-карбоновой кислоты в 4 мл трифторуксусной кислоты в течение 4 ч перемешивали при комнатной температуре. В вакууме удаляли растворитель и остаток суспендировали в 10 мл диэтилового эфира. Образовавшуюся суспензию перемешивали в течение ночи. В результате фильтрования и сушки в виде белого порошка получали 265 мг (96%) указанного в заголовке соединения. МС m/е (%): 473 (M+Na+, 54), 451 (М+Н+, 100). Пример 42 (R)-1- { { 2- [2- [(R)-2-карбоксипирролидин-1-ил] -2-оксоэтокси] -3-метилфенокси} ацетил} пирролидин-2-карбоновая кислота а) трет-Бутиловый эфир (R)-1- {{2- [2-[(R)-2-трет-бутоксикарбонилпирролидин-1-ил] -2-оксоэтокси] -3-метилфенокси} ацетил} пирролидин-2-карбоновой кислоты В перемешиваемый раствор 236 мг (2,1 ммоля) трет-бутилата калия в 2 мл диметилформамида при комнатной температуре по каплям вводили раствор 124 мг (1,0 ммоль) 3-метилкатехина в 2 мл диметилформамида. Перемешивание продолжали в течение 2-3 мин и в течение 1-2 мин добавляли раствор 584 мг (2,0 ммоля) трет-бутилового эфира (R)-(1)-бромацетилпирролидин-2-карбоновой кислоты в 4 мл диметилформамида. Реакционную смесь перемешивали в течение дополнительных 3 ч при комнатной температуре. В вакууме удаляли растворитель и остаток очищали экспресс-хроматографией с получением в виде бесцветного масла 356 мг (65%) указанного в заголовке соединения. МС m/е (%): 547 (М+Н+, 100), 491 (14), 435 (17). б) (R)-1- {{2- [2- [(R)-2-карбоксипирролидин-1-ил] -2-оксоэтокси] -3-метилфенокси} ацетил} пирролидин-2-карбоновая кислота Раствор 325 мг (0,60 ммоля) трет-бутилового эфира (R)-1-{{2-[2-[(R)-2-трет-бутоксикарбонилпирролидин-1-ил] -2-оксоэтокси] -3-метилфенокси} ацетил} пирролидин-2-карбоновой кислоты в 4 мл трифторуксусной кислоты в течение 3 ч перемешивали при комнатной температуре. В вакууме удаляли растворитель и остаток суспендировали в 10 мл диэтилового эфира. Образовавшуюся суспензию перемешивали в течение ночи. В результате фильтрования и сушки в виде белого порошка получали 235 мг (91%) указанного в заголовке соединения. МС m/е (%): 457 (M+Na+, 59), 435 (М+Н+, 100). Пример 43 (R)-1- { { 2- [2- [(R)-2-карбоксипирролидин-1-ил] -2-оксоэтокси] -3,4,5,6-тетрахлорфенокси} ацетил} пирролидин-2-карбоновая кислота а) трет-Бутиловый эфир (R)-1- {{2- [2- [(R)-2-трет-бутоксикарбонилпирролидин-1-ил] -2-оксоэтокси] -3,4,5,6-тетрахлорфенокси} ацетил} пирролидин-2-карбоновой кислоты В перемешиваемый раствор 185 мг (1,65 ммоля) трет-бутилата калия в 1 мл диметилформамида при комнатной температуре по каплям вводили раствор 186 мг (0,75 ммоля) тетрахлоркатехина в 1 мл диметилформамида. Перемешивание продолжали в течение 2-3 мин и в течение 1-2 мин добавляли раствор 438 мг (1,50 ммоля) трет-бутилового эфира (R)-(1)-бромацетилпирролидин-2-карбоновой кислоты в 2 мл диметилформамида. Реакционную смесь перемешивали в течение дополнительных 4 ч при комнатной температуре. В вакууме удаляли растворитель и остаток очищали экспресс-хроматографией с получением в виде белой пены 229 мг (45%) указанного в заголовке соединения. МС m/е (%): 671 (М+Н+, 100), 615 (19), 559 (14). б) (R)-1- { { 2- [2- [(R)-2-карбоксипирролидин-1-ил] -2-оксоэтокси] -3,3,5,6-тетрахлорфенокси} ацетил} пирролидин-2-карбоновая кислота Раствор 220 мг (0,34 ммоля) трет-бутилового эфира (R)-1- {{2- [2- [(R)-2-трет-бутоксикарбонилпирролидин-1-ил] -2-оксоэтокси] -3,4,5,6-тетрахлорфенокси} ацетил} пирролидин-2-карбоновой кислоты в 1,5 мл трифторуксусной кислоты в течение 4 ч перемешивали при комнатной температуре. В вакууме удаляли растворитель и остаток суспендировали в 10 мл диэтилового эфира. Образовавшуюся суспензию перемешивали в течение ночи. В результате фильтрования и сушки в виде белого порошка получали 172 мг (94%) указанного в заголовке соединения. МС m/е (%): 559 (М-Н–, 100). Пример 44 (R)-1- { { 6- [2- [(R)-2-карбоксипирролидин-1-ил] -2-оксоэтокси] нафталин-2-илокси} ацетил} пирролидин-2-карбоновая кислота а) трет-Бутиловый эфир (R)-1- {{6- [2- [(R)-2-трет-бутоксикарбонилпирролидин-1-ил] -2-оксоэтокси] нафталин-2-илокси} ацетил} пирролидин-2-карбоновой кислоты В перемешиваемый раствор 236 мг (2,1 ммоля) трет-бутилата калия в 2 мл диметилформамида при комнатной температуре по каплям вводили раствор 160 мг (1,0 ммоль) 2,6-дигидроксинафталина в 2 мл диметилформамида. Перемешивание продолжали в течение 2-3 мин и в течение 1-2 мин добавляли раствор 584 мг (2,0 ммоля) трет-бутилового эфира (R)-(1)-бромацетилпирролидин-2-карбоновой кислоты в 4 мл диметилформамида. Реакционную смесь перемешивали в течение дополнительных 3 ч при комнатной температуре. В вакууме удаляли растворитель и остаток очищали экспресс-хроматографией с получением в виде белого твердого вещества 120 мг (21%) указанного в заголовке соединения. МС m/е (%): 605 (M+Na+, 14), 600 (M+NH4 +, 92), 583 (М+Н+, 5), 527 (32), 471 (100). б) (R)-1- {{6- [2- [(R)-2-карбоксипирролидин-1-ил] -2-оксоэтокси] нафталин-2-илокси} ацетил} пирролидин-2-карбоновая кислота Раствор 75 мг (0,13 ммоля) трет-бутилового эфира (R)-1-{{6-[2-[(R)-2-трет-бутоксикарбонилпирролидин-1-ил] -2-оксоэтокси] нафталин-2-илокси} ацетил} пирролидин-2-карбоновой кислоты в 1,5 мл трифторуксусной кислоты в течение 18 ч перемешивали при комнатной температуре. В вакууме удаляли растворитель и остаток суспендировали в 10 мл диэтилового эфира. Образовавшуюся суспензию перемешивали в течение ночи. В результате фильтрования и сушки в виде белого порошка получали 60 мг (98%) указанного в заголовке соединения. МС m/е (%): 493 (M+Na+, 58), 488 (M+NH4 +, 33), 471 (М+Н+, 100). Пример 45 (R)-1- {{5- [2- [(R)-2-карбоксипирролидин-1-ил] -2-оксоэтокси] нафталин- 1 -илокси} ацетил} пирролидин-2-карбоновая кислота а) трет-Бутиловый эфир (R)-1- {{5- [2- [(R)-2-трет-бутоксикарбонилпирролидин-1-ил] -2-оксоэтокси] нафталин-1-илокси} ацетил} пирролидин-2-карбоновой кислоты В перемешиваемый раствор 236 мг (2,1 ммоля) трет-бутилата калия в 2 мл диметилформамида при комнатной температуре по каплям вводили раствор 160 мг (1,0 ммоль) 1,5-дигидроксинафталина в 2 мл диметилформамида. Перемешивание продолжали в течение 2-3 мин и в течение 1-2 мин добавляли раствор 584 мг (2,0 ммоля) трет-бутилового эфира (R)-(1)-бромацетилпирролидин-2-карбоновой кислоты в 4 мл диметилформамида. Реакционную смесь перемешивали в течение дополнительных 3 ч при комнатной температуре. В вакууме удаляли растворитель и остаток очищали экспресс-хроматографией с получением в виде бледно-желтой пены 470 мг (81%) указанного в заголовке соединения. МС m/е (%): 605 (M+Na+, 10), 600 (M+NH4 +, 100), 527 (20), 471 (63). б) (R)-1- {{5- [2- [(R)-2-карбоксипирролидин-1-ил] -2-оксоэтокси] нафталин-1-илокси} ацетил} пирролидин-2-карбоновая кислота Раствор 290 мг (0,5 ммоля) трет-бутилового эфира (R)-1-{{5-[2-[(R)-2-трет-бутоксикарбонилпирролидин-1-ил] -2-оксоэтокси] нафталин-1-илокси}ацетил} пирролидин-2-карбоновой кислоты в 5 мл трифторуксусной кислоты в течение 18 ч перемешивали при комнатной температуре. В вакууме удаляли растворитель и остаток суспендировали в 10 мл диэтилового эфира. Образовавшуюся суспензию перемешивали в течение ночи. В результате фильтрования и сушки в виде белого порошка получали 230 мг (98%) указанного в заголовке соединения. МС m/е (%): 493 (M+Na+, 45), 488 (M+NH4 +, 37), 471 (М+Н+ 100). Пример 46 (R)-1- { { 3- [2- [(R)-2-карбоксипирролидин-1-ил] – 2- оксоэтокси] нафталин -2- илокси} ацетил} пирролидин-2-карбоновая кислота а) трет-Бутиловый эфир (R)-1- {{3- [2- [(R)-2-трет-бутоксикарбонилпирролидин-1-ил] -2-оксоэтокси] нафталин-2-илокси} ацетил} пирролидин-2-карбоновой кислоты В перемешиваемый раствор 236 мг (2,1 ммоля) трет-бутилата калия в 2 мл диметилформамида при комнатной температуре по каплям вводили раствор 160 мг (1,0 ммоль) 2,3-дигидроксинафталина в 2 мл диметилформамида. Перемешивание продолжали в течение 2-3 мин и в течение 1-2 мин добавляли раствор 584 мг (2,0 ммоля) трет-бутилового эфира (R)-(1)-бромацетилпирролидин-2-карбоновой кислоты в 4 мл диметилформамида. Реакционную смесь перемешивали в течение дополнительных 3 ч при комнатной температуре. В вакууме удаляли растворитель и остаток очищали экспресс-хроматографией с получением в виде бесцветного масла 310 мг (53%) указанного в заголовке соединения. МС m/е (%): 605 (M+Na+, 27), 600 (M+NH4 +, 16), 583 (М+Н+, 100), 527 (16), 471 (24). б) (R)-1- {{3- [2- [(R)-2-карбоксипирролидин-1-ил] -2-оксоэтокси] нафталин – 2 – илокси} ацетил} пирролидин – 2 – карбоновая кислота Раствор 230 мг (0,4 ммоля) трет-бутилового эфира (R)-1-{{3-[2-[(R)-2-трет-бутоксикарбонилпирролидин-1-ил] -2-оксоэтокси] нафталин-2-илокси} ацетил} пирролидин-2-карбоновой кислоты в 5 мл трифторуксусной кислоты в течение 18 ч перемешивали при комнатной температуре. В вакууме удаляли растворитель и остаток суспендировали в 10 мл диэтилового эфира. Образовавшуюся суспензию перемешивали в течение ночи. В результате фильтрования и сушки в виде белого порошка получали 180 мг (96%) указанного в заголовке соединения. МС m/е (%): 469 (М-Н–, 100). Пример 47 (R)-1- { { 2′- [2- [(R)-2-карбоксипирролидин-1-ил] -2-оксоэтокси]дифенил-2-илокси} ацетил} пирролидин-2-карбоновая кислота а) трет-Бутиловый эфир (R)-1- {{2′- [2- [(R)-2-трет-бутоксикарбон-илпирролидин-1-ил] -2-оксоэтокси] дифенил-2-илокси} ацетил} пирролидин-2-карбоновой кислоты В перемешиваемый раствор 160 мг (1,44 ммоля) трет-бутилата калия в 1,6 мл диметилформамида при комнатной температуре по каплям вводили раствор 127 мг (0,69 ммоля) 2,2′-дигидроксидифенила в 1 мл диметилформамида. Перемешивание продолжали в течение 2-3 мин и в течение 1-2 мин добавляли раствор 400 мг (1,37 ммоля) трет-бутилового эфира (R)-(1)-бромацетилпирролидин-2-карбоновой кислоты в 4 мл диметилформамида. Реакционную смесь перемешивали в течение ночи при комнатной температуре. В вакууме удаляли растворитель и остаток очищали экспресс-хроматографией с получением в виде светло-коричневого масла 84 мг (20%) указанного в заголовке соединения. МС m/е (%): 631 (M+Na+ 22), 626 (M+NH4 +, 100), 609 (М+Н+, 16). б) (R)-1- {{2′- [2- [(R)-2-карбоксипирролидин-1-ил]-2-оксоэтокси] дифенил-2-илокси} ацетил} пирролидин-2-карбоновая кислота Раствор 87 мг (0,14 ммоля) трет-бутилового эфира (R)-1- {{2′-[2-[(R)-2-трет – бутоксикарбонилпирролидин -1 – ил] – 2 – оксоэтокси] дифенил – 2 – илокси} ацетил} пирролидин-2-карбоновой кислоты в 1 мл трифторуксусной кислоты в течение 4 ч перемешивали при комнатной температуре. В вакууме удаляли растворитель и остаток суспендировали в 10 мл диэтилового эфира. Образовавшуюся суспензию перемешивали в течение ночи. В результате фильтрования и сушки в виде светло-коричневого порошка получали 31 мг (44%) указанного в заголовке соединения. МС m/е (%): 519 (M+Na+, 62), 497 (М+Н+, 100). Пример 48 (R)-1- {{4- [2- [(R)-2-карбоксипирролидин-1-ил] – 2- оксоэтокси] нафталин- 1-илокси} ацетил} пирролидин-2-карбоновая кислота а) трет-Бутиловый эфир (R)-1- {{4- [2- [(R)-2-трет-бутоксикарбонилпирролидин-1-ил] -2-оксоэтокси] нафталин- 1-илокси} ацетил} пирролидин-2-карбоновой кислоты В перемешиваемый раствор 160 мг (1,44 ммоля) трет-бутилата калия в 1,6 мл диметилформамида при комнатной температуре по каплям вводили раствор 116 мг (0,69 ммоля) 1,4-нафтохинона в 1 мл диметилформамида. Перемешивание продолжали в течение 2-3 мин и в течение 1-2 мин добавляли раствор 400 мг (1,37 ммоля) трет-бутилового эфира (R)-(1)-бромацетилпирролидин-2-карбоновой кислоты в 4 мл диметилформамида. Реакционную смесь перемешивали в течение ночи при комнатной температуре. В вакууме удаляли растворитель и остаток очищали экспресс-хроматографией с получением в виде светло-коричневой пены 269 мг (67%) указанного в заголовке соединения. МС m/е (%): 600 (M+NH4 +, 100). б) (R)-1-{ { 4- [2- [(R)-2-карбоксипирролидин-1-ил] -2-оксоэтокси] нафталин-1-илокси} ацетил} пирролидин-2-карбоновая кислота Раствор 172 мг (0,30 ммоля) трет-бутилового эфира (R)-1-{{4-[2-[(R)-2-трет-бутоксикарбонилпирролидин-1-ил] -2-оксоэтокси] нафталин-1-илокси} ацетил} пирролидин-2-карбоновой кислоты в 1,5 мл трифторуксусной кислоты в течение 4 ч перемешивали при комнатной температуре. В вакууме удаляли растворитель и остаток суспендировали в 10 мл диэтилового эфира. Образовавшуюся суспензию перемешивали в течение ночи. В результате фильтрования и сушки в виде светло-коричневого порошка получали 140 мг (количественный выход) указанного в заголовке соединения. МС m/е (%): 469 (М-Н–, 100). Пример 49 (R)-1- {{7- [2- [(R)-2-карбоксипирролидин-1-ил] – 2- оксоэтокси] нафталин- 2-илокси} ацетил} пирролидин-2-карбоновая кислота а) трет-Бутиловый эфир (R)-1- {{7- [2- [(R)-2-трет-бутоксикарбонилпирролидин-1-ил] -2-оксоэтокси] нафталин-2-илокси} ацетил} пирролидин-2-карбоновой кислоты В раствор 110 мг (0,69 ммоля) 2,7-дигидроксинафталина и 400 мг (1,37 ммоля) трет-бутилового эфира (R)-(1)-бромацетилпирролидин-2-карбоновой кислоты в 1,5 мл диметилформамида при комнатной температуре вводили 480 мг безводного карбоната калия. После перемешивания в течение дополнительных 20 ч калиевые соли отфильтровывали и в вакууме удаляли растворитель. Остаток очищали экспресс-хроматографией с получением в виде белой пены 296 мг (74%) указанного в заголовке соединения. МС m/е (%): 600 (M+NH4 +, 100), 527 (25), 471 (99). б) (R)-1- {{7- [2- [(R)-2-карбоксипирролидин-1-ил] -2-оксоэтокси] нафталин-2-илокси} ацетил} пирролидин-2-карбоновая кислота Раствор 272 мг (0,47 ммоля) трет-бутилового эфира (R)-1-{{7-[2-[(R)-2 – трет – бутоксикарбонилпирролидин -1 – ил] – 2 – оксоэтокси] нафталин – 2-илокси} ацетил} пирролидин-2-карбоновой кислоты в 1,5 мл трифторуксусной кислоты в течение 4 ч перемешивали при комнатной температуре. В вакууме удаляли растворитель и остаток суспендировали в 10 мл диэтилового эфира. Образовавшуюся суспензию перемешивали в течение ночи. В результате фильтрования и сушки в виде белого порошка получали 209 мг (95%) указанного в заголовке соединения. МС m/е (%): 493 (M+Na+, 48), 488 (M+NH4 +, 23), 471 (М+Н+, 100). Пример 50 Трифторацетат (R) -1- {{3- [2- [(R) -2-карбоксипирролидин-1-ил] -2-оксоэтиламино] фениламино} ацетил} пирролидин-2-карбоновой кислоты (2:1) а) трет-Бутиловый эфир (R)-1- {{3- [2- [(R)-2-трет-бутоксикарбонилпирролидин-1-ил] -2-оксоэтиламино] фениламино} ацетил} пирролидин-2-карбоновой кислоты В раствор 75 мг (0,69 ммоля) 1,3-фенилендиамина и 400 мг (1,37 ммоля) трет-бутилового эфира (R)-(1)-бромацетилпирролидин-2-карбоновой кислоты в 3 мл дихлорметана при комнатной температуре вводили 0,21 мл (1,5 ммоля) триэтиламина. Реакционную смесь перемешивали при комнатной температуре в течение ночи. Органическую фазу промывали 1н. раствором карбоната натрия и рассолом, сушили (сульфатом натрия) и упаривали. Остаток очищали экспресс-хроматографией с получением в виде светло-коричневой пены 285 мг (78%) указанного в заголовке соединения. МС m/е (%): 553 (M+Na+, 15), 531 (M+H+, 100), 475 (20), 419 (10). б) Трифторацетат (R)-1- {{3- [2- [(R)-2-карбоксипирролидин-1-ил] -2-оксоэтиламино] фениламино} ацетил} пирролидин-2-карбоновой кислоты (2:1) Раствор 170 мг (0,32 ммоля) трет-бутилового эфира (R)-1- {{3- [2- [(R)-2-трет-бутоксикарбонилпирролидин-1-ил] -2-оксоэтиламино] фениламино} ацетил} пирролидин-2-карбоновой кислоты в 4 мл трифторуксусной кислоты в течение 4 ч перемешивали при комнатной температуре. В вакууме удаляли растворитель и остаток суспендировали в 10 мл диэтилового эфира. Образовавшуюся суспензию перемешивали в течение ночи. В результате фильтрования и сушки в виде коричневой пены получали 130 мг (63%) указанного в заголовке соединения. МС: 417 (М-Н–, 100). Пример 51 Трифторацетат (R)-1- {{4- [2- [(R)-2-карбоксипирролидин-1-ил] -2-оксоэтиламино] фениламино} ацетил} пирролидин-2-карбоновой кислоты (2:1) а) трет-Бутиловый эфир (R)-1- {{4- [2- [(R)-2-трет-бутоксикарбонилпирролидин-1-ил] -2-оксоэтиламино] фениламино} ацетил} пирролидин-2-карбоновой кислоты В раствор 75 мг (0,69 ммоля) 1,4-фенилендиамина и 400 мг (1,37 ммоля) трет-бутилового эфира (R)-(1)-бромацетилпирролидин-2-карбоновой кислоты в 4 мл тетрагидрофурана при комнатной температуре вводили 190 мг безводного карбоната калия. Реакционную смесь перемешивали при 40oС в течение ночи. Калиевые соли отфильтровывали и в вакууме удаляли растворитель. Остаток очищали экспресс-хроматографией с получением в виде коричневой пены 180 мг (50%) указанного в заголовке соединения. МС m/е (%): 553 (M+Na+, 26), 531 (M+H+, 100). б) Трифторацетат (R)-1- {{4- [2- [(R)-2-карбоксипирролидин-1-ил] -2-оксоэтиламино] фениламино} ацетил} пирролидин-2-карбоновой кислоты (2:1) Раствор 168 мг (0,32 ммоля) трет-бутилового эфира (R)-1-{{4-[2-[(R)-2-трет-бутоксикарбонилпирролидин-1-ил] -2-оксоэтиламино] фениламино} ацетил} пирролидин-2-карбоновой кислоты в 2 мл трифторуксусной кислоты в течение 4 ч перемешивали при комнатной температуре. Удаляли растворитель, остаток суспендировали в толуоле и растворитель удаляли вновь с одновременным удалением избытка трифторуксусной кислоты. Остаток вновь суспендировали в 10 мл диэтилового эфира. Образовавшуюся суспензию перемешивали в течение ночи. В результате фильтрования и сушки в виде коричневой пены получали 160 мг (78%) указанного в заголовке соединения. МС: 417 (М-Н–, 100). Пример 52 Трифторацетат (R)-1- {{[2- [(R)-2-карбонилпирролидин-1-ил] -2-оксоэтил] бутиламино} ацетил} пирролидин-2-карбоновой кислоты (1:1) а) трет-Бутиловый эфир (R)-1- {{[2- [(R)-2-трет-бутоксикарбонилпирролидин-1-ил] -2-оксоэтил] бутиламино} ацетил} пирролидин-2-карбоновой кислоты В раствор 136 мг (1,86 ммоля) бутиламина и 995 мг (3,40 ммоля) трет-бутилового эфира (R)-(1)-бромацетилпирролидин-2-карбоновой кислоты в 4 мл дихлорметана при комнатной температуре вводили 0,52 мл (3,74 ммоля) триэтиламина. Суспензию перемешивали при комнатной температуре в течение ночи. Органическую фазу промывали 1н. раствором карбоната натрия и рассолом, сушили (сульфатом натрия) и упаривали. Остаток очищали экспресс-хроматографией с получением в виде светло-коричневого масла 830 мг (98%) указанного в заголовке соединения. МС m/е (%): 524 (2M+Ni+, 37), 496 (М+Н+, 100), 468 (2), 440 (7). б) Трифторацетат (R)-1- {{[2- [(R)-2-карбонилпирролидин-1-ил] -2-оксоэтил] бутиламино} ацетил} пирролидин-2-карбоновой кислоты (1:1) Раствор 50 мг (0,1 ммоля) трет-бутилового эфира (R)-1-{{[2-[(R)-2-трет-бутоксикарбонилпирролидин-1-ил] -2-оксоэтил] бутиламино} ацетил} пирролидин-2-карбоновой кислоты в 0,2 мл трифторуксусной кислоты в течение 4 ч перемешивали при комнатной температуре. В вакууме удаляли растворитель и остаток суспендировали в 10 мл диэтилового эфира. Образовавшуюся суспензию перемешивали в течение ночи. В результате фильтрования и сушки в виде светло-коричневого порошка получали 46 мг (92%) указанного в заголовке соединения. МС: 382 (М-Н–, 100). Пример 53 Трифторацетат (R)-1- {{[2- [(R)-2-карбонилпирролидин-1-ил] -2-оксоэтил] -(2-метоксиэтил)амино} ацетил}пирролидин-2-карбоновой кислоты (1:1) а) трет-Бутиловый эфир (R)-1- {{[2- [(R)-2-трет-бутоксикарбонилпирролидин-1-ил] -2-оксоэтил] – (2-метоксиэтил)амино} ацетил} пирролидин-2-карбоновой кислоты В раствор 137 мг (1,83 ммоля) 2-метоксиэтиламина и 970 мг (3,33 ммоля) трет-бутилового эфира (R)-(1)-бромацетилпирролидин-2-карбоновой кислоты в 4 мл дихлорметана при комнатной температуре вводили 0,51 мл (3,66 ммоля) триэтиламина. Суспензию перемешивали при комнатной температуре в течение ночи. Органическую фазу промывали 1н. раствором карбоната натрия и рассолом, сушили (сульфатом натрия) и упаривали. Остаток очищали экспресс-хроматографией с получением в виде светло-коричневого масла 397 мг (48%) указанного в заголовке соединения. МС m/е (%): 520 (M+Na+, 50), 498 (M+H+, 100). б) Трифторацетат (R) -1- {{ [2- [(R) -2-карбонилпирролидин-1-ил] -2-оксоэтил] – (2-метоксиэтил)амино} ацетил} пирролидин-2-карбоновой кислоты (1:1) Раствор 367 мг (0,74 ммоля) трет-бутилового эфира (R)-1-{{[2-[(R)-2-трет-бутоксикарбонилпирролидин-1-ил] -2-оксоэтил] – (2-метоксиэтил)амино} ацетил} пирролидин-2-карбоновой кислоты в 2 мл трифторуксусной кислоты в течение 3 ч перемешивали при комнатной температуре. В вакууме удаляли растворитель и остаток суспендировали в 10 мл диэтилового эфира. Образовавшуюся суспензию перемешивали в течение ночи. В результате фильтрования и сушки в виде светло-коричневой пены получали 350 мг (95%) указанного в заголовке соединения. МС: 384 (М-Н–, 100). Пример 54 Трифторацетат (R) -1- {{бензил [2- [(R) -2-карбоксипирролидин-1-ил] -2-оксоэтил] амино} ацетил} пирролидин-2-карбоновой кислоты (1:1) а) трет-Бутиловый эфир (R)-1-{{бензил[2-[ (R)-2-трет-бутоксикарбонилпирролидин-1-ил] -2-оксоэтил] амино} ацетил} пирролидин-2-карбоновой кислоты В раствор 104 мг (0,97 ммоля) бензиламина и 514 мг (1,76 ммоля) трет-бутилового эфира (R)-(1)-бромацетилпирролидин-2-карбоновой кислоты в 5 мл дихлорметана при комнатной температуре вводили 0,27 мл (1,94 ммоля) триэтиламина. Суспензию перемешивали при комнатной температуре в течение ночи. Органическую фазу промывали 1н. раствором карбоната натрия и рассолом, сушили (сульфатом натрия) и упаривали. Остаток очищали экспресс-хроматографией с получением в виде светло-коричневого масла 270 мг (58%) указанного в заголовке соединения. MC m/e (%): 552 (M+Na+, 12), 530 (М+Н+, 100). б) Трифторацетат (R)-1- {{бензил[2- [(R)-2-карбоксипирролидин-1-ил] -2-оксоэтил] амино} ацетил} пирролидин-2-карбоновой кислоты (1:1) Раствор 200 мг (0,38 ммоля) трет-бутилового эфира (R)-1-{{бензил[2-[ (R)-2-трет-бутоксикарбонилпирролидин-1-ил]-2-оксоэтил] амино} ацетил} пирролидин-2-карбоновой кислоты в 2 мл трифторуксусной кислоты в течение 3 ч перемешивали при комнатной температуре. В вакууме удаляли растворитель и остаток суспендировали в 10 мл диэтилового эфира. Образовавшуюся суспензию перемешивали в течение ночи. В результате фильтрования и сушки в виде белых кристаллов получали 189 мг (94%) указанного в заголовке соединения. MC m/e (%): 440 (M+Na+, 16), 418 (М+Н+, 100). Пример 55 (R)-1- { { 3- [2- [(R)-2-карбоксипирролидин-1-ил] -2-оксоэтил] -1,3-дибутилуреидо} ацетил} пирролидин-2-карбоновая кислота а) трет – Бутиловый эфир (R) -1 – бутиламиноацетилпирролидин – 2 -карбоновой кислоты В раствор 1,58 мл (16 ммолей) бутиламина в 1 мл дихлорметана при комнатной температуре по каплям вводили раствор 470 мг (1,6 ммоля) трет-бутилового эфира (R)-(1)-бромацетилпирролидин-2-карбоновой кислоты в 2 мл дихлорметана. Суспензию перемешивали в течение ночи. Органическую фазу промывали 1н. раствором карбоната натрия и рассолом, сушили (сульфатом натрия) и упаривали. Остаток очищали экспресс-хроматографией с получением в виде светло-коричневого масла 370 мг (81%) указанного в заголовке соединения. МС m/е (%): 285 (М+Н+, 100). б) трет-Бутиловый эфир (R)-1- [ {3- {2- [(R)-2-трет-бутоксикарбонилпирролидин-1-ил] -2-оксоэтил] -1,3-дибутилуреидо} ацетил} пирролидин-2-карбоновой кислоты В раствор 165 мг (0,58 ммоля) трет-бутилового эфира (R)-1-бутиламиноацетилпирролидин-2-карбоновой кислоты в 5 мл толуола вводили 305 мг безводного карбоната натрия. Суспензию упаривали досуха и остаток вновь суспендировали в 2 мл тетрагидрофурана. Затем с перемешиванием добавляли 1,4 мл (2,88 ммоля) 20%-ного раствора фосгена в толуоле и перемешивание продолжали в течение 6 ч при 50oС. Натриевые соли отфильтровывали и промывали тетрагидрофураном. Фильтрат упаривали, дбавляли 165 мг (0,58 ммоля) продукта RO-64-2576/000, растворенного в 2 мл тетрагидрофурана, и вновь добавляли 305 мг безводного карбоната натрия. После перемешивания в течение ночи при 50oС органическую фазу промывали 1н. раствором соляной кислоты, сушили (сульфатом магния) и упаривали с получением в виде светло-коричневого порошка 330 мг (91%) указанного в заголовке соединения. МС m/е (%): 617 (M+Na+, 19), 595 (М+Н+, 100). в) (R)-1- {{3- [2- [(R)-2-карбоксипирролидин-1-ил] -2-оксоэтил] -1,3-дибутилуреидо} ацетил} пирролидин-2-карбоновая кислота Раствор 278 мг (0,47 ммоля) трет-бутилового эфира (R)-1-{{3-[2-[(R)-2-трет-бутоксикарбонилпирролидин-1-ил] -2-оксоэтил] -1,3-дибутилуреидо} ацетил} пирролидин-2-карбоновой кислоты в 2 мл трифторуксусной кислоты в течение 4 ч перемешивали при комнатной температуре. В вакууме удаляли растворитель и остаток сушили с получением в виде коричневой пены 167 мг (74%) указанного в заголовке соединения. МС m/е (%): 505 (M+Na+, 11), 487 (33), 483 (М+Н+, 33), 465 (100). Пример 56 (R)-1- { {1,3-дибензил-3- [2- [(R)-2-карбоксипирролидин-1-ил] -2-оксоэтил] уреидо} ацетил} пирролидин-2-карбоновая кислота а) трет-Бутиловый эфир (R)-1-бензиламиноацетилпирролидин-2-карбоновой кислоты В раствор 1,25 мл (11,4 ммоля) бензиламина в 1 мл дихлорметана при 0oС по каплям вводили раствор 335 мг (1,14 ммоля) трет-бутилового эфира (R)-(1)-бромацетилпирролидин-2-карбоновой кислоты в 2 мл дихлорметана. При этой температуре суспензию перемешивали в течение 4 ч. Органическую фазу промывали 1н. раствором карбоната натрия и рассолом, сушили (сульфатом натрия) и упаривали. Остаток очищали экспресс-хроматографией с получением в виде аморфного твердого вещества 312 мг (86%) указанного в заголовке соединения. МС m/е (%): 319 (М+Н+, 100). б) трет-Бутиловый эфир (R)-1- {{1,3-дибензил-3- [2-[ (R)-2-трет-бутоксикарбонилпирролидин-1-ил] -2-оксоэтил] уреидо} ацетил} пирролидин-2-карбоновой кислоты В раствор 233 мг (0,73 ммоля) трет-бутилового эфира (R)-1-бензиламиноацетилпирролидин-2-карбоновой кислоты в 2 мл толуола при комнатной температуре вводили 0,20 мл (1,34 ммоля) триэтиламина. В течение 3 ч в виде 6 порций с перемешиванием вводили 0,30 мл (0,70 ммоля) 20%-ного раствора фосгена в толуоле и перемешивание продолжали в течение 3 ч при комнатной температуре. Органическую фазу промывали 1н. раствором соляной кислоты, 1н. раствором карбоната натрия и рассолом, сушили (сульфатом магния) и упаривали. Остаток очищали экспресс-хроматографией с получением в виде светло-желтого масла 245 мг (50%) указанного в заголовке соединения. МС m/е (%): 685 (M+Na+, 28), 680 (M+NH4 +, 100), 663 (М+Н+, 30). в) (R)-1- {{1,3-дибензил-3- [2- [(R)-2-карбоксипирролидин-1-ил] -2-оксоэтил] уреидо} ацетил} пирролидин-2-карбоновая кислота Раствор 220 мг (0,33 ммоля) трет-бутилового эфира (R)-1-{{1,3-дибензил-3- [2- [(R)-2-трет-бутоксикарбонилпирролидин-1-ил] -2-оксо-этил]уреидо} ацетил] пирролидин-2-карбоновой кислоты в 5 мл 4н. раствора соляной кислоты в диоксане в течение 5 ч перемешивали при комнатной температуре. Продукт экстрагировали 1н. раствором гидроксида натрия, основный экстракт подкисляли 1н. раствором соляной кислоты до рН 4 и продукт экстрагировали этилацетатом. Органическую фазу сушили (сульфатом магния) и упаривали с получением в виде коричневого масла 74 мг (41%) указанного в заголовке соединения. МС m/е (%): 549 (М-Н–, 100). Пример 57 (R) -1-бензиламиноацетилпирролидин-2-карбоновая кислота Указанное в заголовке соединение образовалось в результате расщепления мочевины в качестве побочного продукта процесса получения (R)-1- {{1,3-дибензил-3- [2- [(R)-2-карбоксипирролидин-1-ил] -2-оксоэтил]уреидо} ацетил} пирролидин-2-карбоновой кислоты. Продукт выделяли из подкисленного водного раствора следующим образом. Водную фазу концентрировали и остаток суспендировали в 2-пропаноле. Неорганические соли отфильтровывали на броунмиллерите. В результате упаривания и сушки в виде бесцветной пены получали 78 мг (45%) (R)-1-бензиламиноацетилпирролидин-2-карбоновой кислоты. МС m/е (%): 261 (М-Н–, 100). В приведенных ниже примерах работали по следующим общим методикам. Общая методика А: реакция сочетания этилендихлорэтана (ЭДХ) В перемешиваемый раствор гидрохлорида D-пролинбензилового эфира (2 экв. ), дикарбоновой кислоты (1 экв.), N-метилморфолина (6 экв.) и гидроксибензотриазола (2 экв. ) в дихлорметане при 0oС вводили N-(3-диметиламинопропил)-N’-этилкарбодиимидгидрохлорид (2 экв.) и перемешивание продолжали при 0oС в течение 2 ч, а затем при комнатной температуре в течение 16 ч. Далее реакционную смесь последовательно промывали 1М соляной кислотой, насыщенным раствором бикарбоната натрия и в завершение насыщенным рассолом и водные фазы подвергали обратной экстракции дихлорметаном. Объединенные органические экстракты сушили над сульфатом натрия и концентрировали в вакууме. После этого очисткой экспресс-хроматографией на кизельгеле получали указанное в заголовке соединение. Общая методика Б: гидрогенолиз бензилового эфира Раствор бензилового эфира в изопропаноле в течение 16 ч при комнатной температуре перемешивали с 5 мас.% 10%-ного палладия на угле под давлением водорода 1 атм. После фильтрования для удаления катализатора реакционную смесь концентрировали в вакууме и трижды подвергали азеотропной перегонке с хлороформом в роторном испарителе, удаляя последние следы изопропанола. Полученный продукт (часто в виде вязкого масла, полутвердого вещества или пены) растирали в диэтиловом эфире и затем сушили в вакууме (под остаточным давлением 10 мбар) при 50oС в течение 16 ч. Пример 58 (R)-1- {5- [(R)-2-карбоксипирролидин-1-ил] -2,4-диметил-5-оксопентаноил} пирролидин-2-карбоновая кислота (смесь 3 диастереоизомеров) а) Бензиловый эфир (R)-1-{5-[ (R)-2-бензилоксиметилпирролидин-1-ил]-2,4-диметил-5-оксопентаноил} пирролидин-2-карбоновой кислоты (смесь 3 диастереоизомеров) В соответствии с общей методикой А с использованием 6,05 г (25 ммолей) гидрохлорида D-пролинбензилового эфира и 2,0 г (12,5 ммоля) 2,4-диметилглутаровой кислоты после экспресс-хроматографии (EtOAc) в виде светло-желтого масла получали 4,3 г (64%) указанного в заголовке соединения. МС m/е (%): 535 (М+Н+, 100). б) (R)-1- { 5- [(R)-2-карбоксипирролидин-1-ил] -2,4-диметил-5-оксопентаноил}пирролидин-2-карбоновая кислота (смесь 3 диастереоизомеров) В соответствии с общей методикой Б с использованием 4,30 г (8,05 ммоля) бензилового эфира (R)-1- {5- [(R)-2-бензилоксиметилпирролидин-1-ил] -2,4-диметил-5-оксопентаноил} пирролидин-2-карбоновой кислоты (смесь 3 диастереоизомеров) в виде белой пены получали 2,58 г (91%) указанного в заголовке соединения. МС m/е (%): 355 (M+H+, 100). Пример 59 (R)-1- { 4- [(R)-2-карбоксипирролидин-1-ил] -2,3-диметил-4-оксобутирил} пирролидин-2-карбоновая кислота (смесь 3 диастереоизомеров) а) Бензиловый эфир (R)-1-{4-[ (R)-бензилоксикарбонилпирролидин-1-ил]-2,3-диметил-4-оксобутирил} пирролидин-2-карбоновой кислоты (смесь 3 диастереоизомеров) В соответствии с общей методикой А с использованием 2,0 г (8,2 ммоля) гидрохлорида D-пролинбензилового эфира и 600 мг (4,1 ммоля) 2,3-диметилянтарной кислоты после экспресс-хроматографии (EtOAc) в виде бесцветного масла получали 1,45 г (69%) указанного в заголовке соединения. МС m/е (%): 521 (М+Н+, 100). б) (R)-1- {4- [(R)-2-карбоксипирролидин-1-ил] -2,3-диметил-4-оксобутирил}пирролидин-2-карбоновая кислота (смесь 3 диастереоизомеров) В соответствии с общей методикой Б с использованием 1,45 г (2,78 ммоля) бензилового эфира (R)-1- {4- [(R)-2-бензилоксикарбонилпирролидин-1-ил] -2,3-диметил-4-оксобутирил} пирролидин-2-карбоновой кислоты (смесь 3 диастереоизомеров) в виде белой пены получали 780 мг (80%) указанного в заголовке соединения. МС m/е (%): 341 (М+Н+, 100). Пример 60 (R)-1- { транс-4- [(R)-2-карбоксипирролидин-1-карбонил] циклогексанкарбонил} пирролидин-2-карбоновая кислота а) Бензиловый эфир (R)-1- {транс-4- [(R)-2-бензилоксикарбонилпирролидин-1-карбонил] циклогексанкарбонил} пирролидин-2-карбоновой кислоты В соответствии с общей методикой А с использованием 2,0 г (8,2 ммоля) гидрохлорида D-пролинбензилового эфира и 700 мг (4,1 ммоля) трансциклогексан-1,4-дикарбоновой кислоты после экспресс-хроматографии (EtOAc) в виде бесцветного масла получали 1,67 г (76%) указанного в заголовке соединения. МС m/е (%): 547 (М+Н+, 100). б) (R)-1- {транс-4- [(R)-2-карбоксипирролидин-1-карбонил} циклогексанкарбонил} пирролидин-2-карбоновая кислота В соответствии с общей методикой Б с использованием 1,61 г (2,95 ммоля) бензилового эфира (R)-1- {транс-4- [(R)-2-бензилоксикарбонилпирролидин-1-карбонил] циклогексанкарбонил} пирролидин-2-карбоновой кислоты в виде белой пены получали 1,07 г (99%) указанного в заголовке соединения. МС m/е (%): 367 (М+Н+, 100). Пример 61 (R)-1- { цис-4- [(R)-2-карбоксипирролидин-1-карбонил] циклогексанкарбонил} пирролидин-2-карбоновая кислота а) Бензиловый эфир (R)-1- {цис-4- [(R)-2-бензилоксикарбонилпирролидин-1-карбонил] циклогексанкарбонил} пирролидин-2-карбоновой кислоты В соответствии с общей методикой А с использованием 2,0 г (8,2 ммоля) гидрохлорида D-пролинбензилового эфира и 700 мг (4,1 ммоля) цис-циклогексан-1,4-дикарбоновой кислоты после экспресс-хроматографии (EtOAc) в виде бесцветного масла получали 2,0 г (91%) указанного в заголовке соединения. МС m/е (%): 547 (М+Н+, 100). б) (R) -1- {цис-4- [(R) -2-карбоксипирролидин-1-карбонил] циклогексанкарбонил} пирролидин-2-карбоновая кислота В соответствии с общей методикой Б с использованием 2,0 г (3,66 ммоля) бензилового эфира (R)-1- [цис-4- [(R)-2-бензилоксикарбонилпирролидин-1- карбонил] циклогексанкарбонил}пирролидин-2-карбоновой кислоты в виде белой пены получали 930 мг (69%) указанного в заголовке соединения. МС m/е (%): 365 ([М-Н]–, 100). Пример 62 (R)-1- { 3- [(R)-2-карбоксипирролидин-1-карбонил] циклогексанкарбонил} пирролидин-2-карбоновая кислота (смесь 3 диастереоизомеров) а) Бензиловый эфир (R)-1- {3- [(R)-2-бензилоксикарбонилпирролидин-1-карбонил] циклогексанкарбонил} пирролидин-2-карбоновой кислоты (смесь 3 диастереоизомеров) В соответствии с общей методикой А с использованием 5,6 г (23,2 ммоля) гидрохлорида D-пролинбензилового эфира и 2,0 г (11,6 ммоля) циклогексан-1,3-дикарбоновой кислоты после экспресс-хроматографии (EtOAc) в виде бесцветного масла получали 4,4 г (70%) указанного в заголовке соединения. МС m/е (%): 547 (М+Н+, 100). б) (R)-1- {3- [(R)-2-карбоксипирролидин-1-карбонил] циклогексанкарбонил} пирролидин-2-карбоновая кислота (смесь 3 диастереоизомеров) В соответствии с общей методикой Б с использованием 4,4 г (8,05 ммоля) бензилового эфира (R)-1-{3-[ (R)-2-бензилоксикарбонилпирролидин-1-карбонил] циклогексанкарбонил} пирролидин-2-карбоновой кислоты (смесь 3 диастереоизомеров) в виде белой пены получали 2,9 г (98%) указанного в заголовке соединения. МС m/е (%): 367 (М+Н+, 100). Пример 63 Смесь (R)-1-[(1R. 2R)- и -[(1S,2S)-2-[ (R)-2-карбоксипирролидин-1-карбонил] циклогексанкарбонил} пирролидин-2-карбоновых кислот а) Смесь бензиловых эфиров (R)-1-[(1R, 2R)- и -[(1S, 2S)-2-[(R)-2-бензилоксикарбонилпирролидин-1-карбонил] циклогексанкарбонил} пирролидин-2-карбоновых кислот В соответствии с общей методикой А с использованием 2,0 г (8,2 ммоля) гидрохлорида D-пролинбензилового эфира и 700 мг (4,1 ммоля) транс-циклогексан-1,2-дикарбоновой кислоты после экспресс-хроматографии (EtOAc) в виде бесцветного масла получали 1,36 г (62%) указанных в заголовке соединений. МС m/е (%): 547 (М+Н+ 100). б) Смесь (R)-1-[(1R, 2R)- и -[(1S, 2S)-2-[ (R)-2-карбоксипирролидин-1-карбонил] циклогексанкарбонил} пирролидин-2-карбоновых кислот В соответствии с общей методикой Б с использованием 1,36 г (2,48 ммоля) смеси бензиловых эфиров (R)-1-[(1R, 2R)- и [(1S, 2S)-2-[(R)-2-бензилоксикарбонилпирролидин-1-карбонил] циклогексанкарбонил} пирролидин-2-карбоновых кислот в виде белой пены получали 900 мг (99%) указанных в заголовке соединений. МС m/е (%): 367 (М+Н+, 100). Пример 64 (R)-1- {{2,5-дигидрокси-4- [2- [(R)-2-карбоксипирролидин-1-ил] -2-оксоэтил] фенил} ацетил} пирролидин-2-карбоновая кислота а) Бензиловый эфир (R) -1- {{4- [2- [(R) -2-бензилоксикарбонилпирролидин-1-ил] -2-оксоэтил] -2,5-дигидроксифенил} ацетил} пирролидин-2-карбоновой кислоты В соответствии с общей методикой А с использованием 10,7 г (44,2 ммоля) гидрохлорида D-пролинбензилового эфира и 5,0 г (22,1 ммоля) 2,5-дигидрокси-1,4-фенилендиуксусной кислоты после экспресс-хроматографии (при градиенте от 70 до 100% EtOAc/гексан) в виде бесцветной пены получали 3,17 г (24%) указанного в заголовке соединения. МС m/е (%): 601 (М+Н+, 100). б) (R)-1- {{2,5-дигидрокси-4- [2- [(R)-2-карбоксипирролидин-1-ил] -2-оксоэтил] фенил} ацетил} пирролидин-2-карбоновая кислота В соответствии с общей методикой Б с использованием 3,17 г (5,3 ммоля) бензилового эфира (R)-1- {{4- [2- [(R)-2-бензилоксикарбонилпирролидин-1-ил] -2-оксоэтил] -2,5-дигидроксифенил} ацетил} пирролидин-2-карбоновой кислоты в виде белого кристаллического твердого вещества получали 2,2 г (99%) указанного в заголовке соединения. МС m/е (%): 421 (М+Н+, 100). Пример 65 (R)-1- {{3- [2- [(R)-2-карбоксипирролидин-1-ил] -2-оксоэтил] фенил} ацетил} пирролидин-2-карбоновая кислота а) Бензиловый эфир (R)-1- {{3- [2- [(R) -2-бензилоксикарбонилпирролидин-1-ил] -2-оксоэтил] фенил} ацетил] пирролидин-2-карбоновой кислоты В соответствии с общей методикой А с использованием 2,0 г (8,2 ммоля) гидрохлорида D-пролинбензилового эфира и 800 мг (4,1 ммоля) 1,3-фенилендиуксусной кислоты после экспресс-хроматографии (EtOAc) в виде бесцветного масла получали 1,93 г (84%) указанного в заголовке соединения. МС m/е (%): 586 (M+NH4 +, 100), 569 (М+Н+, 60). б) (R)-1- {{3- [2- [(R)-2-карбоксипирролидин-1-ил] – 2-оксоэтил] фенил} ацетил} пирролидин-2-карбоновая кислота В соответствии с общей методикой Б с использованием 1,84 г (3,2 ммоля) бензилового эфира (R)-1- {{3- [2- [(R)-2-бензилоксикарбонилпирролидин-1-ил] -2-оксоэтил] фенил} ацетил} пирролидин-2-карбоновой кислоты в виде белой пены получали 1,21 г (97%) указанного в заголовке соединения. МС m/е (%): 421 (М+Н+, 100). Пример 66 (R) -1- { 4- [ (R) -2-карбоксипирролидин-1-карбонил] бензоил} пирролидин-2-карбоновая кислота а) Бензиловый эфир (R)-1-{4-[(R)-2-бензилоксикарбонилпирролидин-1-карбонил] бензоил} пирролидин-2-карбоновой кислоты В соответствии с общей методикой А с использованием 5,8 г (24,0 ммоля) гидрохлорида D-пролинбензилового эфира и 2,0 г (12,0 ммолей) бензол-1,4-дикарбоновой кислоты после экспресс-хроматографии (EtOAc) в виде желтого масла получали 4,66 г (72%) указанного в заголовке соединения. MC m/e (%): 558 (M+NH4 +, 100), 541 (М+Н+, 95). б) (R) -1- {4- [(R) -2-карбоксипирролидин-1-карбонил] бензоил} пирролидин-2-карбоновая кислота В соответствии с общей методикой Б с использованием 4,66 г (8,62 ммоля) бензилового эфира (R)-1-{4-[ (R)-2-бензилоксикарбонилпирролидин-1- карбонил] бензоил}пирролидин-2-карбоновой кислоты в виде бесцветной пены получали 3,05 г (95%) указанного в заголовке соединения. MC m/e (%): 378 (M+NH4 +, 100), 361 (М+Н+, 55). Пример 67 (R) -1- { 3- [(R) -2-карбоксипирролидин-1-карбонил] бензоил} пирролидин-2-карбоновая кислота а) Бензиловый эфир (R)-1- {3- [((R)-2-бензилоксикарбонилпирролидин-1-карбонил] бензоил} пирролидин-2-карбоновой кислоты В соответствии с общей методикой А с использованием 5,8 г (24,0 ммоля) гидрохлорида D-пролинбензилового эфира и 2,0 г (12,0 ммолей) бензол-1,3-дикарбоновой кислоты после экспресс-хроматографии (EtOAc) в виде желтого масла получали 4,68 г (72%) указанного в заголовке соединения. MC m/e (%): 558 (M+NH4 +, 100), 541 (М+Н+, 90). б) (R) -1- {3- [(R) -2-карбоксипирролидин-1-карбонил] бензоил} пирролидин-2-карбоновая кислота В соответствии с общей методикой Б с использованием 2,83 г (5,24 ммоля) бензилового эфира (R)-1- {3-[ (R)-2-бензилоксикарбонилпирролидин-1-карбонил] бензоил} пирролидин-2-карбоновой кислоты в виде бесцветной пены получали 1,9 г (100%) указанного в заголовке соединения. MC m/e (%): 378 (M+NH4 +, 100), 361 (М+Н+, 35). Пример 68 (R)-1- {6- [(R)-2-карбоксипирролидин-1-карбонил]пиридин-2-карбонил} пирролидин-2-карбоновая кислота а) Бензиловый эфир (R)-1- {6- [(R)-2-бензилоксикарбонилпирролидин-1-карбонил]пиридин-2-карбонил} пирролидин-2-карбоновой кислоты В соответствии с общей методикой А с использованием 5,8 г (24,0 ммоля) гидрохлорида D-пролинбензилового эфира и 2,0 г (12,0 ммолей) пиридин-2,6-дикарбоновой кислоты после экспресс-хроматографии (EtOAc) в виде желтого масла получали 5,0 г (77%) указанного в заголовке соединения. MC m/e (%): 559 (M+NH4 +, 60), 542 (М+Н+, 100). б) (R)-1- {6- [(R)-2-карбоксипирролидин-1-карбонил]пиридин-2-карбонил} пирролидин-2-карбоновая кислота В соответствии с общей методикой Б с использованием 3,2 г (5,9 ммоля) бензилового эфира (R)-1-{6-[ (R)-2-бензилоксикарбонилпирролидин-1-карбонил] пиридин-2-карбонил} пирролидин-2-карбоновой кислоты в виде белой пены получали 1,9 г (90%) указанного в заголовке соединения. МС m/е (%): 379 (M+NH4 +, 100), 362 (М+Н+, 65). Пример 69 (R)-1- {5- [(R)-2-карбоксипирролидин-1-карбонил]тиофен-2-карбонил} пирролидин-2-карбоновая кислота а) Бензиловый эфир (R)-1-{ 5-[ (R)-2-бензилоксикарбонилпирролидин-1-карбонил] тиофен-2-карбонил} пирролидин-2-карбоновой кислоты В соответствии с общей методикой А с использованием 2,0 г (8,2 ммоля) гидрохлорида D-пролинбензилового эфира и 700 мг (4,1 ммоля) тиофен-2,5-дикарбоновой кислоты после экспресс-хроматографии (EtOAc) в виде желтого кристаллического твердого вещества получали 1,84 г (84%) указанного в заголовке соединения. MC m/e (%): 564 (M+NH4 +, 60), 547 (М+Н+, 100). б) (R)-1- { 5- [(R)-2-карбоксипирролидин-1-карбонил]тиофен-2-карбонил} пирролидин-2-карбоновая кислота В соответствии с общей методикой Б с использованием 1,84 г (3,3 ммоля) бензилового эфира (R)-1-{5-[ (R)-2-бензилоксикарбонилпирролидин-1-карбонил] тиофен-2-карбонил} пирролидин-2-карбоновой кислоты в виде белого кристаллического вещества получали 770 мг (63%) соединения, названного как RO-64-2667/000. МС m/е (%): 365 ([М-Н]–, 65). Пример 70 (R)-1- { 5- [(R)-2-карбоксипирролидин-1-карбонил]фуран-2-карбонил}пирролидин-2-карбоновая кислота а) Бензиловый эфир (R)-1- {5- [(R)-2-бензилоксикарбонилпирролидин-1-карбонил] фуран-2-карбонил} пирролидин-2-карбоновой кислоты В соответствии с общей методикой А с использованием 2,0 г (8,2 ммоля) гидрохлорида D-пролинбензилового эфира и 640 мг (4,1 ммоля) фуран-2,5-дикарбоновой кислоты после экспресс-хроматографии (EtOAc) в виде желтого масла получали 1,7 г (78%) указанного в заголовке соединения. б) (R)-1- {5- [(R)-2-карбоксипирролидин-1-карбонил]фуран-2-карбонил} пирролидин-2-карбоновая кислота В соответствии с общей методикой Б с использованием 1,7 г (3,2 ммоля) бензилового эфира (R)-1-{5-[ (R)-2-бензилоксикарбонилпирролидин-1-карбонил] фуран-2-карбонил} пирролидин-2-карбоновой кислоты в виде белой пены получали 1,02 г (91%) указанного в заголовке соединения. МС m/е (%): 351 (М+Н+, 100). Пример 71 (S)-1- { 6- [(S)-2-карбоксипирролидин-1-ил] -6-оксогексаноил}пирролидин-2-карбоновая кислота а) Бензиловый эфир (S)-1-{6-[(S)-2- бензилоксикарбонилпирролидин -1 -ил] -6-оксогексаноил} пирролидин-2-карбоновой кислоты В соответствии с общей методикой А с использованием 1,0 г (4,1 ммоля) гидрохлорида L-пролинбензилового эфира и 300 мг (2,1 ммоля) адипиновой кислоты после экспресс-хроматографии (EtOAc) в виде бесцветного масла получали 1,07 г (100%) указанного в заголовке соединения. МС m/е (%): 521 (М+Н+, 100). б) (S)-1- {6- [(S)-2-карбоксипирролидин-1-ил] -6-оксогексаноил} -пирролидин-2-карбоновая кислота В соответствии с общей методикой Б с использованием 1,07 г (2,1 ммоля) бензилового эфира (S)-1- {6- [(S)-2-бензилоксикарбонилпирролидин-1-ил] -6-оксогексаноил} пирролидин-2-карбоновой кислоты в виде белого кристаллического твердого вещества получали 609 мг (87%) указанного в заголовке соединения. МС m/е (%): 341 (М+Н+, 100). Пример 72 (S)-1- { { 4- [2- [(S)-2-карбоксипирролидин-1-ил] -2-оксоэтил] фенил} ацетил} пирролидин-2-карбоновая кислота а) Бензиловый эфир (S)-1- {{4- [2- [(S)-2-бензилоксикарбонилпирролидин-1-ил] -2-оксоэтил] фенил} ацетил} пирролидин-2-карбоновой кислоты В соответствии с общей методикой А с использованием 1,0 г (4,1 ммоля) гидрохлорида L-пролинбензилового эфира и 400 мг (2,1 ммоля) 1,4-фенилендиуксусной кислоты после экспресс-хроматографии (EtOAc) в виде бесцветного масла получали 1,07 г (91%) указанного в заголовке соединения. МС m/е (%): 586 (M+NH4 +, 100), 569 (М+Н+, 97). б) (S)-1-{{4-[2-[(S)-2-карбоксипирролидин-1-ил]-2-оксоэтил] фенил} ацетил} пирролидин-2-карбоновая кислота В соответствии с общей методикой Б с использованием 1,07 г (1,88 ммоля) бензилового эфира (S)-1- {{4- [2- [(S)-2-бензилоксикарбонилпирролидин-1-ил] -2-оксоэтил] фенил} ацетил] пирролидин-2-карбоновой кислоты в виде белого кристаллического твердого вещества получали 410 мг (56%) указанного в заголовке соединения. МС m/е (%): 389 (М+Н+, 100). Пример 73 (S)-1- { {2- [2- [(S)-2-карбоксипирролидин-1-ил] -2-оксоэтокси]фенокси} ацетил} пирролидин-2-карбоновая кислота а) Бензиловый эфир (S)-1- {{2- [2- [(S)-2-бензилоксикарбонилпирролидин-1-ил] – 2-оксоэтокси]фенокси} ацетил} пирролидин-2-карбоновой кислоты В соответствии с общей методикой А с использованием 1,0 г (4,1 ммоля) гидрохлорида L-пролинбензилового эфира и 790 мг (2,1 ммоля) 1,2-фенилендиоксиуксусной кислоты после экспресс-хроматографии (EtOAc) в виде бесцветного масла получали 1,08 г (87%) указанного в заголовке соединения. МС m/е (%): 601 (М+Н+, 100). б) (S)-1- {{2- [2- [(S)-2-карбоксипирролидин-1-ил] -2-оксоэтокси] фенокси] ацетил} пирролидин-2-карбоновая кислота В соответствии с общей методикой Б с использованием 1,08 г (1,8 ммоля) бензилового эфира (S)-1- {{2- [2- [(S) -2-бензилоксикарбонилпирролидин-1-ил] -2-оксоэтокси]фенокси} ацетил} пирролидин-2-карбоновой кислоты в виде белого кристаллического твердого вещества получали 717 мг (95%) указанного в заголовке соединения. МС m/е (%): 421 (М+Н+, 100). Пример 74 (R)-1- {{4- [2- [(R)-2-карбоксипирролидин-1-ил] – 2- оксоэтил] нафталин -1-ил} ацетил} пирролидин-2-карбоновая кислота а) 2-диазо-1 – (4-диазоацетилнафталин-1 -ил)этанон В перемешиваемый раствор 3,0 г (13,9 ммоля) нафталин-1,4-дикарбоновой кислоты и 4,4 мл (30,6 ммоля) триэтиламина в 200 мл ТГФ при -15oС по каплям вводили 2,9 мл (30,6 ммоля) этилхлорформиата. После перемешивания в течение 15 мин при 0oС добавляли 250 мл эфирного раствора диазометана (приблизительно 0,3М, приблизительно 75 ммолей) и перемешивание продолжали в течение 16 ч при комнатной температуре. Далее реакционную смесь последовательно промывали насыщенным раствором бикарбоната натрия, насыщенным раствором хлорида аммония и в завершение насыщенным рассолом и водные фазы подвергали обратной экстракции диэтиловым эфиром. Объединенные органические экстракты сушили над сульфатом магния и концентрировали в вакууме. В результате экспресс-хроматографии (при градиенте от 15 до 50% EtOAc/гексан) в виде желтого кристаллического твердого вещества получали 450 мг (12%) указанного в заголовке соединения. МС m/е (%): 323 ([М+ОAс]–, 100). б) (4 – карбоксиметилнафталин -1 – ил) уксусная кислота В перемешиваемый раствор 450 мг (1,7 ммоля) 2-диазо-1-(4-диазоаце-тилнафталин-1-ил)этанона в 20 мл ТГФ при -20oС последовательно добавляли в темноте 1,5 мл воды, 86 мг (375 ммолей) бензоата серебра (0,22 экв.) и 687 мл (4,9 ммоля) триэтиламина (2,9 экв.) и перемешивание продолжали в течение 2 ч при комнатной температуре. Далее реакционную смесь разбавляли 100 мл диэтилового эфира и дважды экстрагировали насыщенным раствором бикарбоната натрия. Объединенные водные фазы трижды экстрагировали диэтиловым эфиром, затем подкисляли концентрированной соляной кислотой и дополнительно три раза экстрагировали диэтиловым эфиром. Эти последние органические экстракты объединяли и сушили над сульфатом натрия и концентрировали в вакууме с получением в виде желтого кристаллического твердого вещества 330 мг (80%) указанного в заголовке соединения. МС m/е (%): 244 (М+, 100), 199 (М-СO2Н, 80). в) Бензиновый эфир (R)-1- {{4- [2- [(R)-2-бензилоксикарбонилпирролидин-1-ил] -2-оксоэтил] нафталин-1-ил} ацетил} пирролидин-2-карбоновой кислоты В соответствии с общей методикой А с использованием 200 мг (0,82 ммоля) гидрохлорида D-пролинбензилового эфира и 100 мг (0,41 ммоля) (4-карбоксиметилнафталин-1- ил) уксусной кислоты после экспресс-хроматографии (EtOAc) в виде бесцветного масла получали 188 мг (75%) указанного в заголовке соединения. МС m/е (%): 636 (M+NH4 +, 100), 619 (М+Н+, 75). г) (R) -1- {{4- [2- [(R) -2-карбоксипирролидин-1-ил] -2-оксоэтил] нафталин-1-ил} ацетил} пирролидин-2-карбоновая кислота В соответствии с общей методикой Б с использованием 130 мг (0,21 ммоля) бензилового эфира (R)-1- {{4- [2- [(R)-2-бензилоксикарбонилпирролидин-1-ил] -2-оксоэтил} нафталин-1-ил} ацетил} пирролидин-2-карбоновой кислоты в виде белого кристаллического твердого вещества получали 79 мг (86%) указанного в заголовке соединения. МС m/е (%): 437 ([М-Н]–, 100). Пример 75 (R)-1- {{6- [2- [(R)-2-карбоксипирролидин-1-ил] -2-оксоэтил]пиридин-2-ил} ацетил} пирролидин-2-карбоновая кислота а) (6 – Цианометилпиридин – 2 – ил) ацетонитрил В перемешиваемый раствор 3,47 г (13,1 ммоля) 2,6-бис-(бромметил)пиридина в 50 мл дихлорметана по каплям вводили 4,1 г (26,2 ммоля) тетраэтиламмонийцианида в 20 мл дихлорметана и затем реакционную смесь выдерживали при 45oС в течение 72 ч. Далее реакционную смесь охлаждали до комнатной температуры и фильтровали. Фильтрат концентрировали в вакууме, повторно суспендировали в этилацетате, еще раз фильтровали и этот второй фильтрат концентрировали в вакууме. В результате экспресс-хроматографии (33% EtOAc/гексан) в виде белого кристаллического твердого вещества получали 1,77 г (84%) указанного в заголовке соединения. МС m/е (%): 157 (М+, 100), 130 ([M-HCN]+, 95), 90 (55). б) (6-Kарбоксиметилпиридин- 2-ил) уксусная кислота Раствор 3,0 г (19,1 ммоля) (6-цианометилпиридин-2-ил)ацетонитрила в 30 мл концентрированной соляной кислоты при 100oС выдерживали в течение 24 ч. Далее реакционную смесь охлаждали до комнатной температуры и концентрировали в вакууме. Остаток повторно растворяли в воде, добавляли активированный уголь и смесь выдерживали при 50oС в течение 30 мин. После удаления угля фильтрованием фильтрат концентрировали в вакууме и остаток при 4oС повторно кристаллизовали из воды с получением в виде не совсем белого кристаллического твердого вещества 2,48 г (100%) указанного в заголовке соединения. 1H-ЯМР (250 МГц, D2O,  ): 8,42 (1Н, t, J=8 Гц), 7,80 (2Н, d, J=8 Гц).
в) Бензиловый эфир (R)-1- {{6- [2- [(R) -2-бензилоксикарбонилпирролидин-1-ил] -2-оксоэтил] пиридин-2-ил} ацетил} пирролидин-2-карбоновой кислоты ): 8,42 (1Н, t, J=8 Гц), 7,80 (2Н, d, J=8 Гц).
в) Бензиловый эфир (R)-1- {{6- [2- [(R) -2-бензилоксикарбонилпирролидин-1-ил] -2-оксоэтил] пиридин-2-ил} ацетил} пирролидин-2-карбоновой кислотыВ соответствии с общей методикой А с использованием 9,7 г (40 ммолей) гидрохлорида D-пролинбензилового эфира и 3,9 г (20 ммолей) (6-карбоксиметилпиридин-2-ил) уксусной кислоты после экспресс-хроматографии (при градиенте от 0 до 10% MeOH/EtOAc) в виде желтого масла получали 890 мг (8%) указанного в заголовке соединения. МС m/е (%): 570 (М+Н+, 100). г) (R)-1- {{6- [2- [(R) -2-карбоксипирролидин-1-ил] -2-оксоэтил]пиридин-2-ил} ацетил} пирролидин-2-карбоновая кислота В соответствии с общей методикой Б с использованием 890 мг (1,56 ммоля) бензилового эфира (R)-1- {{-6- [2- [(R) -2-бензилоксикарбонилпирролидин-1-ил] -2-оксоэтил]пиридин-2-ил} ацетил} пирролидин-2-карбоновой кислоты в виде желтого кристаллического твердого вещества получали 410 мг (67%) указанного в заголовке соединения. МС m/е (%): 390 (М+Н+, 100). Пример 76 (R)-1- {{5- [2- [(R) -2-карбоксипирролидин-1-ил] -2-оксоэтил]тиофен-2-ил} ацетил} пирролидин-2-карбоновая кислота а) 2,5-Бисхлорметилтиофен В 63,4 мл 37%-ного водного раствора формальдегида при охлаждении льдом по каплям вводили 15,3 мл концентрированной соляной кислоты, а затем с перемешиванием по каплям добавляли 20 мл (0,25 моля) тиофена и перемешивание продолжали в течение 90 мин при комнатной температуре. Далее реакционную смесь экстрагировали диэтиловым эфиром и органические фазы последовательно промывали водой, насыщенным раствором бикарбоната натрия и в завершение насыщенным рассолом. Водные фазы подвергали обратной экстракции диэтиловым эфиром и объединенные органические экстракты сушили над сульфатом магния и концентрировали в вакууме с получением в виде окрашенного в янтарный цвет масла 38,8 г (86%) указанного в заголовке соединения, продукта RO-64-4463/000. MC m/e (%): 184 (М+, 8), 182 (М+, 15), 180 (M+, 24), 147 ([М-Сl]+, 44), 145 ([М-Сl]+, 100), 110 (64). б) (5 -цианометилтиофен- 2-ил)ацетонитрил В перемешиваемый раствор 15 г (82,8 ммоля) 2,5-бисхлорметилтиофена в 500 мл дихлорметана по каплям вводили раствор 28,5 г (182 ммоля) тетраэтиламмонийцианида в 100 мл дихлорметана и затем реакционную смесь выдерживали при 45oС в течение 24 ч. Далее реакционную смесь охлаждали до комнатной температуры и дважды промывали водой. Органическую фазу сушили над сульфатом натрия и концентрировали в вакууме. В результате экспресс-хроматографии (20% EtOAc/гексан) в виде желтого масла получали 4,88 г (36%) указанного в заголовке соединения. МС m/е (%): 162 (М+, 44), 122 ([M-C2CN]+, 100). в) (5 – Карбоксиметилтиофен – 2 – ил) уксусная кислота В раствор 1,2 г (7,4 ммоля) (5-цианометилтиофен-2-ил)ацетонитрила в 5 мл этанола и 5 мл воды вводили 1,74 г (31,8 ммоля) гидроксида калия и реакционную смесь при 100oС выдерживали в течение 1 ч. Далее реакционную смесь охлаждали до комнатной температуры и концентрировали в вакууме. Остаток подкисляли соляной кислотой и три раза экстрагировали диэтиловым эфиром. Объединенные органические фазы сушили над сульфатом магния и концентрировали в вакууме с получением в виде коричневого кристаллического твердого вещества 1,3 г (88%) указанного в заголовке соединения. МС m/е (%): 221 ([M+Na-H]–, 50), 199 ([М-Н]–, 45), 155 ([M-CO2H]–, 100). г) трет-Бутиловый эфир (R) -1-{{5-[2-[(R) -2-трет-бутоксикарбонилпирролидин-1-ил] -2-оксоэтил] тиофен-2-ил} ацетил} пирролидин-2-карбоновой кислоты В соответствии с общей методикой А с использованием 2,23 г (13 ммолей) гидрохлорида D-пролинбензилового эфира и 1,3 г (6,5 ммоля) (5-карбоксиметилтиофен-2-ил) уксусной кислоты после экспресс-хроматографии (при градиенте от 0 до 10% MeOH/EtOAc) в виде желтого масла получали 2,6 г (79%) указанного в заголовке соединения. MC m/e (%): 524 (M+NH4 +, 90), 507 (M+H+, 10), 451 ([M+H-C4H8]+, 30), 395 ([M+H-2C4H8]+, 100). д) (R)-1- { { 5- [2- [(R) -2-карбоксипирролидин-1-ил] -2-оксоэтил]тиофен-2-ил} ацетил} пирролидин-2-карбоновая кислота В соответствии с общей методикой Б с использованием 600 мг (1,18 ммоля трет-бутилового эфира (R) -1- {{5- [2- [(R) -2-трет-бутоксикарбонилпирролидин-1-ил] -2-оксоэтил] тиофен-2-ил} ацетил} пирролидин-2-карбоновой кислоты в виде бежевого кристаллического твердого вещества получали 100 мг (21%) указанного в заголовке соединения. MC m/e (%): 395 (М+Н+, 100). Пример 77 (R)-1- {(2R, 5S)-6- [(R) -2-карбоксипирролидин-1-ил] -2.5-диметокси-6-оксогексаноил} пирролидин-2-карбоновая кислота а) (3R, 6S)-3,6-диметоксициклогексен Литература: J. Org. Chem. 1988, 53, 5695. В перемешиваемый раствор 0,70 г (3,1 ммоля) ацетата палладия, 16,9 г (156 ммолей) бензохинона и 0,4 мл (6,2 ммоля) метансульфоновой кислоты в 200 мл метанола при комнатной температуре с помощью шприца в течение 4 ч вводили раствор 5,95 мл (62 ммоля) 1,3-циклогексадиена в 5 мл метанола и перемешивание продолжали в течение дополнительных 16 ч. Реакционную смесь три раза экстрагировали диэтиловым эфиром и объединенные органические экстракты последовательно промывали водой, 2М раствором гидроксида натрия и насыщенным рассолом. Органические фазы сушили над сульфатом натрия и концентрировали в вакууме. В результате перегонки по Кугельрору (под остаточным давлением 6 мбар, при температуре в печи 120oC) в виде бесцветного масла получали 5,42 г (61%) указанного в заголовке соединения. 1H -ЯМР (250 МГц, СDСl3,  ): 5,92 (2Н, s), 3,70 (2Н, t, J=5 Гц), 3,37 (6Н, s), 1,90-1,65 (4Н, m).
б) (2R, 5S)-2,5- диметоксигександикислота ): 5,92 (2Н, s), 3,70 (2Н, t, J=5 Гц), 3,37 (6Н, s), 1,90-1,65 (4Н, m).
б) (2R, 5S)-2,5- диметоксигександикислотаЛитература: J. Am. Chem. Soc. 1983, 105, 5688. В перемешиваемый раствор 5,0 г (35,2 ммоля) (3R,6S)-3,6-диметоксициклогексана в 120 мл ацетона и 120 мл воды добавляли 37,6 г (176 ммолей) периодата натрия и 50 мг (0,24 ммоля) хлорида рутения (III) и перемешивание продолжали в течение 16 ч при комнатной температуре. Добавляли 5 мл изопропанола и перемешивание продолжали в течение 30 мин, а затем реакционную смесь фильтровали и фильтрат концентрировали в вакууме до половины объема. Далее порциями добавляли 5 г бикарбоната натрия и смесь три раза экстрагировали этилацетатом. Объединенные органические фазы промывали насыщенным рассолом, сушили над сульфатом натрия и концентрировали в вакууме с получением в виде оранжевого масла 1,0 г (14%) указанного в заголовке соединения. MC m/e (%): 205 ([М-Н]–, 100). в) Бензиловый эфир (R)-1-{(2R, 5S)-6-[ (R)-2-бензилоксикарбонилпирролидин-1-ил]-2,5-диметокси-6-оксогексаноил}пирролидин-2-карбоновой кислоты В соответствии с общей методикой А с использованием 1,51 г (6,2 ммоля) гидрохлорида D-пролинбензилового эфира и 643 мг (3,1 ммоля) (2R,5S)-2,5-диметоксигександикислоты после экспресс- хроматографии (при градиенте от 10 до 100% EtOAc/гексан, затем 10% MeOH/EtOAc) в виде желтого масла получали 643 мг (36%) указанного в заголовке соединения. МС m/е (%): 581 (М+H+, 100). г) (R)-1- {(2R, 5S)-6- [(R)-2-карбоксипирролидин-1-ил] -2,5-диметокси-6-оксогексаноил} пирролидин-2-карбоновая кислота В соответствии с общей методикой Б с использованием 640 мг (1,10 ммоля) бензилового эфира (R)-1- {(2R,5S)-6- [(R)-2-бензилоксикарбонилпирролидин-1-ил] -2,5-диметокси-6-оксогексаноил}пирролидин-2-карбоновой кислоты в виде желтого твердого вещества получали 440 мг (100%) указанного в заголовке соединения. МС m/е (%): 399 ([М-Н]–, 100). Пример 78 (R)-1-{ [2S, 5S)- или -{(2R, 5R)-6-[ (R)-2-гидроксиметилпирролидин-1-ил] -2,5-диметокси-6-оксогексаноил} пирролидин-2-карбоновая кислота а) (1RS, 4RS)-4-ацетоксициклогекс-2-ениловый эфир уксусной кислоты Литература: J. Org. Chem. 1984, 49, 4619. В перемешиваемый раствор 2,8 г (12,5 ммоля) ацетата палладия, 27,2 г (267 ммолей) ацетата лития и 7,64 мл (70,7 ммоля) бензохинона в 200 мл уксусной кислоты при комнатной температуре вводили 26,1 г (300 ммолей) диоксида марганца и раствор 23,8 мл (250 ммолей) 1,3-циклогексадиена в 400 мл пентана и перемешивание продолжали в течение дополнительных 16 ч. Двухфазную реакционную смесь разделяли и уксуснокислотную фазу дважды экстрагировали пентаном. Объединенные органические экстракты последовательно промывали насыщенным рассолом, водой и 2М раствором гидроксида натрия, а затем органические фазы сушили над сульфатом натрия и концентрировали в вакууме. В результате перекристаллизации из пентана в виде не совсем белого кристаллического твердого вещества получали 16,1 г (33%) указанного в заголовке соединения. МС m/е (%): 138 ([М-АсОН]+, 8), 96 (М-АсОН-СОСН2]+, 100), 43 (40). б) (1RS,4RS)-циклогекс-2-eн-1,4-диол Литература: J. Org. Chem. 1984, 49, 4619. В перемешиваемый раствор 19,8 г (99,8 ммоля) (1RS, 4RS)-4-ацетоксициклогекс-2-енилового эфира уксусной кислоты в 500 мл метанола добавляли 120 мл 2М раствора гидроксида натрия и реакционную смесь кипятили с обратным холодильником в течение 15 мин. После охлаждения до комнатной температуры реакционную смесь концентрировали в вакууме до остаточного объема 100 мл, а затем насыщали гранулами гидроксида натрия. Смесь повторно экстрагировали этилацетатом, объединенные органические фазы сушили над сульфатом натрия и в вакууме концентрировали с получением в виде не совсем белого кристаллического твердого вещества 10,2 г (90%) указанного в заголовке соединения. МС m/е (%): 113 ([М-Н] +, 13), 96 ([М-Н2О]+, 36), 70 ([М-Н2С=СНОН]+, 100). в) (3RS, 6RS)-3,6 -диметоксициклогексен Литература: J. Org. Chem. 1988, 53, 5695. К 14,3 г (328 ммолей) гидрида натрия (55%-ная дисперсия в масле) при 0oС с перемешиванием по каплям добавляли раствор 10,1 г (88,5 ммоля) (1RS,4RS)-циклогекс-2-ен-1,4-диола в 100 мл ТГФ. Затем добавляли 34 мл (546 ммолей) метилиодида и перемешивание продолжали при комнатной температуре в течение дополнительных 48 ч. Реакцию прекращали добавлением насыщенного раствора хлорида аммония и реакционную смесь экстрагировали диэтиловым эфиром. Объединенные органические экстракты последовательно промывали насыщенным раствором хлорида аммония и насыщенным рассолом, сушили над сульфатом натрия и концентрировали в вакууме с получением в виде желтого масла 11,5 г (91%) указанного в заголовке соединения. 1H-ЯМР (250 МГц, СDСl3,  ): 5,90 (2Н, s), 3,82 (2Н, широкий t), 3,37 (6Н, s), 2,10 (2Н, m), 1,51 (2Н, m).
г) (2RS, 5RS)-2,5 -диметоксигександикислота ): 5,90 (2Н, s), 3,82 (2Н, широкий t), 3,37 (6Н, s), 2,10 (2Н, m), 1,51 (2Н, m).
г) (2RS, 5RS)-2,5 -диметоксигександикислотаВ перемешиваемый раствор 6,0 г (42,2 ммоля) (3RS,6RS)-3,6-диметоксициклогексена в 140 мл ацетона и 140 мл воды добавляли 50,5 г (236 ммолей) периодата натрия и 67 мг (0,32 ммоля) хлорида рутения(III) и перемешивание продолжали в течение 16 ч при комнатной температуре. Добавляли 10 мл изопропанола и перемешивание продолжали в течение 30 мин, а затем реакционную смесь фильтровали и фильтрат концентрировали в вакууме до половины объема. Далее порциями добавляли 5 г бикарбоната натрия и смесь три раза экстрагировали диэтиловым эфиром. Водную фазу подкисляли 25%-ной соляной кислотой и повторно экстрагировали этилацетатом. Объединенные органические фазы сушили над сульфатом натрия и концентрировали в вакууме с получением в виде оранжевого масла 1,32 г (15%) указанного в заголовке соединения, продукта RO-64-5650/000. В результате непрерывной экстракции водной фазы в течение 48 ч дополнительно получали 608 мг (7%) продукта. МС m/е (%): 161 ([М-СO2Н]+, 20), 113 (58), 101 (69), 85 (50), 71 (100). д) Бензиловый эфир (R)-1-{(2S, 5S)- или -{[2R, 5R)-6-[ (R)-2-бензилоксиметилпирролидин -1 – ил] – 2,5 -диметокси – 6 – оксогексаноил} пирролидин – 2 – карбоновой кислоты и бензиловый эфир (R)-1- {(2R, 5R)- или – {(2S, 5S)-6- [(R)-2 – бензилоксиметилпирролидин – 1-ил] – 2,5 -диметокси – 6- оксогексаноил} пирролидин-2-карбоновой кислоты В соответствии с общей методикой А с использованием 1,67 г (6,9 ммоля) гидрохлорида D-пролинбензилового эфира и 250 мг (1,2 ммоля) (2RS,5RS)-2,5-диметоксигександикислоты после экспресс-хроматографии (при градиенте от 50 до 100% EtOAc/гексан, а затем 10% MeOH/EtOAc) в виде коричневого масла получали 95 мг (13%) указанных в заголовке соединений (смесь 2 диастереоизомеров) и в виде желтого масла 172 мг (24%) указанных в заголовке соединений (единственного выделенного диастереоизмера). МС m/е (%): 581 (М+Н+, 100). е) (R)-1-{(2S,5S)- или -{(2R, 5R)-6-[ (R)-2-гидроксиметилпирролидин-1-ил] -2,5-диметокси-6-оксогексаноил} пирролидин-2-карбоновая кислота В соответствии с общей методикой Б с использованием 160 мг (0,28 ммоля) бензилового эфира (R)-1-{ (2R, 5R)- или -{(2S, 5S)-6-[ (R)-2-бензилоксиметилпирролидин -1 – ил] – 2,5 -диметокси -6- оксогексаноил} пирролидин – 2 – карбоновой кислоты в виде белой пены получали 90 мг (82%) указанного в заголовке соединения. МС m/е (%): 399 ([М-Н]–, 100), 355 ([М-Н-СО2]–, 61). Пример 79 (R)-1-{ (2R, 5R)- или -{(2S, 5S)-6-[ (R)-2-гидроксиметилпирролидин-1-ил] -2,5-диметокси-6-оксогексаноил}пирролидин-2-карбоновая кислота В соответствии с общей методикой Б с использованием 95 мг (0,28 ммоля) бензилового эфира (R)-1-{ (2S, 5S)- или -{(2R, 5R)-6-[ (R)-2-бензилоксиметилпирролидин -1 – ил] – 2,5 -диметокси -6- оксогексаноил} пирролидин – 2 – карбоновой кислоты в виде белой пены получали 70 мг (100%) указанного в заголовке соединения. МС m/е (%): 399 ([М-Н]–, 100), 355 ([М-Н-СО2]–, 20). Пример 80 (R)-1- { 2,5-дибензил-6- [(R)-2-карбоксипирролидин-1-ил] -6-оксогексаноил} пирролидин-2-карбоновая кислота (смесь 3 диастереоизомеров) а) Смесь диэтиловых эфиров (E)-(2R, 5S)- и -(2RS, 5RS)-2,5-дибензилгекс-3-ендикислот В перемешиваемый раствор 688 мг (3,44 ммоля) диэтилового эфира транс-2-бутен-1,4-дикарбоновой кислоты в 35 мл ТГФ вводили 1,46 г (34,4 ммоля) безводного хлорида лития и образовавшуюся суспензию охлаждали до -78oС. По каплям добавляли 3,44 мл (6,88 ммоля) 2М раствора ДАЛ (диизопропиламида лития) в ТГФ и перемешивание продолжали в течение 45 мин. Далее добавляли 0,82 мл (6,9 ммоля) бензилбромида и перемешивание продолжали в течение 1 ч при -78oС и 10 мин при 0oС. При этой температуре реакцию прекращали добавлением насыщенного раствора хлорида аммония и смесь три раза экстрагировали диэтиловым эфиром. Объединенные органические фазы промывали насыщенным рассолом, сушили над сульфатом натрия и концентрировали в вакууме. В результате экспресс-хроматографии (5% EtOAc в гексане) в виде желтого масла получали 927 мг (71%) указанного в заголовке соединения. МС m/е (%): 398 ([M+NH4]+, 100). б) Смесь (E)-(2R, 5S)- и -(2RS, 5RS)-2,5-дибензилгекс-3-ендикислот В перемешиваемый раствор 200 мг (0,53 ммоля) смеси диэтиловых эфиров (E)-(2R, 5S)- и -(2RS, 5RS)-2,5-дибензилгекс-3-ендикислот в 5 мл ТГФ вводили 4,3 мл (4,3 ммоля) 1М раствора гидроксида натрия. После перемешивания в течение 68 ч при комнатной температуре добавлением 1М соляной кислоты реакционную смесь подкисляли до рН 3 и три раза экстрагировали этилацетатом. Объединенные органические фазы последовательно промывали водой и насыщенным рассолом, сушили над сульфатом натрия и концентрировали в вакууме. В результате экспресс-хроматографии (50% EtOAc в гексане, содержавшем 1% АсОН) в виде белого кристаллического твердого вещества получали 127 мг (74%) указанного в заголовке соединения. МС m/е (%): 342 ([M+NH4]+, 100). в) Бензиловый эфир (Е)- (R)-1-{2,5-дибензил-6-[ (R)-2-бензилоксикарбонилпирролидин-1-ил] -6-оксогекс-3-еноил} пирролидин-2-карбоновой кислоты (смесь 3 диастереоизомеров) В соответствии с общей методикой А с использованием 1,04 г (4,30 ммоля) гидрохлорида D-пролинбензилового эфира и 700 мг (2,16 ммоля) смеси диэтиловых эфиров (E)-(2R, 5S)- и -(2RS, 5RS)-2,5-дибензилгекс-3-ендикислот после экспресс-хроматографии (5% МеОН в EtOAc) в виде желтого масла получали 926 мг (61%) указанного в заголовке соединения. МС m/е (%): 716 (M+NH4 +, 100), 699 (М+Н+, 85). г) (R)-1- {2,5-дибензил-6- [(R)-2-карбоксипирролидин-1-ил] -6-оксогексаноил} пирролидин-2-карбоновая кислота (смесь 3 диастереоизомеров) В соответствии с общей методикой Б с использованием 926 мг (1,33 ммоля) бензилового эфира (E)-(R)-1- { 2,5-дибензил-6- [(R)-2-бензилоксикарбонилпирролидин-1-ил] -6-оксогекс-3-еноил} пирролидин-2-карбоновой кислоты (смеси 3 диастереоизомеров) в виде белого кристаллического твердого вещества получали 610 мг (89%) указанного в заголовке соединения. МС m/е (%): 519 ([М-Н]–, 100). Пример 81 (R)-1- {2,5-дибутил-6- [(R)-2-карбоксипирролидин-1-ил] -6-оксогексаноил} пирролидин-2-карбоновая кислота (1 из 3 возможных диастереоизомеров) а) Смесь диэтиловых эфиров (E)-(2R, 5S)- и -(2RS, 5RS)-2,5-дибутилгекс- 3 -ендикислот В перемешиваемый раствор 2,0 г (9,99 ммоля) диэтилового эфира транс-2-бутен-1,4-дикарбоновой кислоты в 80 ТГФ вводили 2,54 г (59,9 ммоля) безводного хлорида лития и образовавшуюся суспензию охлаждали до -78oС. По каплям добавляли 10 мл (20,0 ммолей) 2М раствора ДАЛ в ТГФ и перемешивание продолжали в течение 45 мин. Далее добавляли 2,2 мл (20,4 ммоля) бутилбромида и перемешивание продолжали в течение 15 мин при -78oС, затем 30 мин при 0oС, после чего 4 ч при комнатной температуре. Реакцию прекращали добавлением насыщенного раствора хлорида аммония и смесь три раза экстрагировали диэтиловым эфиром. Объединенные органические фазы последовательно промывали насыщенным раствором хлорида аммония, водой и насыщенным рассолом, сушили над сульфатом натрия и концентрировали в вакууме. В результате последовательной экспресс-хроматографии (10% EtOAc в гексане в первой колонке, затем при градиенте от 10 до 100% толуола в циклогексане во второй колонке) в виде желтого масла получали 509 мг (16%) указанного в заголовке соединения. МС m/е (%): 330 ([M+NH4]+, 100). б) Смесь (E)-(2R, 5S)- и -(2RS, 5SR)-2,5-дибутилгекс-3-ендикислот В перемешиваемый раствор 435 мг (1,39 ммоля) смеси диэтиловых эфиров (E)-(2R, 5S)- и -(2RS, 5SR)-2,5-дибутилгекс-3 -ендикислот в 10 мл ТГФ вводили 26 мл (26 ммолей) 1М раствора гидроксида натрия. После перемешивания в течение 72 ч при комнатной температуре добавлением 1М соляной кислоты реакционную смесь подкисляли до рН 3 и три раза экстрагировали этилацетатом. Объединенные органические фазы последовательно промывали водой и насыщенным рассолом, сушили над сульфатом натрия и концентрировали в вакууме с получением в виде белого кристаллического твердого вещества 346 мг (97%) указанного в заголовке соединения. МС m/е (%): 255 ([М-Н]–, 60), 211 ([М+Н-СО2]–, 100). в) Бензиловый эфир (Е)- (R)-1-{2,5-дибутил-6-[ (R)-2-бензилоксикарбонилпирролидин -1 – ил] – 6 – оксогекс – 3 – еноил} пирролидин – 2 – карбоновой кислоты (смесь 2 из 3 возможных диастереоизомеров) и бензиловый эфир (E)-(R)-1- {2,5-дибутил-6- [(R)-2-бензилоксикарбонилпирролидин-1-ил] -6-оксогекс-3-еноил} пирролидин-2-карбоновой кислоты (преимущественно 1 из 3 возможных диастереоизомеров) В соответствии с общей методикой А с использованием 653 мг (2,70 ммоля) гидрохлорида D-пролинбензилового эфира и 346 мг (1,35 ммоля) смеси (Е)-(2R, 5S)- и -(2RS, 5SR)-2,5-дибутилгекс-3-ендикислот после экспресс-хроматографии (с градиентом от 33 до 50% EtOAc в гексане) получали в виде желтого масла 148 мг (17%) указанного в заголовке соединения, продукта RO-64-3271/000 (смеси 2 диастереоизомеров) и в виде желтого масла и 116 мг (14%) указанного в заголовке соединения (единственного диастереоизомера). МС m/е (%): 648 (M+NH4 +, 90), 631 (М+Н+, 100). г) (R)-1- { 2,5-дибутил-6- [(R)-2-карбоксипирролидин-1-ил] -6-оксогексаноил}пироолидин-2-карбоновая кислота (1 из 3 возможных диастереоизомеров) В соответствии с общей методикой Б с использованием 140 мг (0,22 ммоля) бензилового эфира (E)-(R)-1- {2,5-дибутил-6- [(R)-2-бензилоксикарбонилпирролидин-1-ил] -6-оксогекс-3-еноил] пирролидин-2-карбоновой кислоты (преимущественно 1 из 3 возможных диастереоизомеров) в виде бесцветного масла получали 81 мг (81%) указанного в заголовке соединения, продукта RO-64-3273/000 (единственного диастереоизомера). МС m/е (%): 451 ([М-Н]–, 100). Пример 82 (R)-1- {2,5-дибутил-6- [(R)-2-карбоксипирролидин-1-ил] -6-оксогексаноил} пирролидин- 2-карбоновая кислота (смесь 2 из 3 возможных диастереоизомеров) В соответствии с общей методикой Б с использованием 110 мг (0,22 ммоля) бензилового эфира (E)-(R)-1- {2,5-дибутил-6- [(R)-2-бензилоксикарбонилпирролидин-1-ил] -6-оксогекс-3-еноил} пирролидин-2-карбоновой кислоты (преимущественно 2 из 3 возможных диастереоизомеров) в виде бесцветного масла получали 69 мг (88%) указанного в заголовке соединения (2 диастереомера). МС m/е (%): 451 ([М-Н]–, 100). Пример 83 (R)-1- [2,5-диизопропил-6- [(R)-2-карбоксипирролидин-1-ил] -6-оксогексаноил}пирролидин-2-карбоновая кислота (смесь 3 диастереоизомеров) а) Смесь диэтиловых эфиров (E)-(2R, 5S)- и -(2RS, 5SR)-2,5-диизопропилгекс- 3 – ендикислот В перемешиваемый раствор 5,0 г (25,0 ммолей) диэтилового эфира транс-2-бутен-1,4-дикарбоновой кислоты в 120 мл ТГФ вводили 6,35 г (150 ммолей) безводного хлорида лития и образовавшуюся суспензию охлаждали до -78oС. По каплям добавляли 25,0 мл (50,0 ммолей) 2 М раствора ДАЛ в ТГФ и перемешивание продолжали в течение 45 мин. Далее добавляли 4,7 мл (50 ммолей) изопропилбромида и перемешивание продолжали в течение 15 мин при -78oС, затем 4 ч при 0oС, после чего 48 ч при комнатной температуре. Реакцию прекращали добавлением насыщенного раствора хлорида аммония и смесь три раза экстрагировали диэтиловым эфиром. Объединенные органические фазы последовательно промывали насыщенным раствором хлорида аммония, водой и насыщенным рассолом, сушили над сульфатом натрия и концентрировали в вакууме. В результате последовательной экспресс-хроматографии (20% EtOAc в гексане в первой колонке, 5% EtOAc в гексане во второй колонке, 10% EtOAc в гексане в третьей колонке) в виде желтого масла получали 259 мг (4%) указанного в заголовке соединения. МС m/е (%): 302 ([М+NH4]+, 100). б) Смесь (E)-(2R, 5S)- и -(2RS, 5SR)-2,5-диизопропилгекс-3-ендикислот В перемешиваемый раствор 108 мг (0,38 ммоля) смеси диэтиловых эфиров (E)-(2R, 5S)- и -(2RS,5SR)-2,5-диизопропилгекс-3-ендикислот в 5 мл ТГФ вводили 10 мл (10 ммолей) 1 М раствора гидроксида натрия. После перемешивания в течение 96 ч при комнатной температуре добавлением 1М соляной кислоты реакционную смесь подкисляли до рН 3 и три раза экстрагировали этилацетатом. Объединенные органические фазы последовательно промывали водой и насыщенным рассолом, сушили над сульфатом натрия и концентрировали в вакууме с получением в виде желтого масла 70 мг (81%) указанного в заголовке соединения. МС m/е (%): 227 ([М-Н]–, 100). в) Бензиловый эфир (Е)- (R)-1-{2,5-диизопропил-6-[ (R)-2-бензилоксикарбонилпирролидин-1-ил] -6-оксогекс-3-еноил} пирролидин-2-карбоновой кислоты (смесь 3 диастереоизомеров) В соответствии с общей методикой А с использованием 114 мг (0,47 ммоля) гидрохлорида D-пролинбензилового эфира и 54 мг (0,24 ммоля) смеси (Е)-(2R, 5S)- и -(2RS, 5SR)-2,5-диизопропилгекс-3-ендикислот после экспресс-хроматографии (с градиентом от 33 до 50% EtOAc в гексане) в виде бесцветного масла получали 15 мг (11%) указанного в заголовке соединения. МС m/е (%): 620 (M+NH4 +, 100). г) (R)-1- {2,5-диизопропил-6- [(R)-2-карбоксипирролидин-1-ил] -6-оксогексаноил}пирролидин-2-карбоновая кислота (смесь 3 диастереоизомеров) В соответствии с общей методикой Б с использованием 41 мг (0,07 ммоля) бензилового эфира (E)-(R)-1- { 2,5-диизопропил-6- [(R)-2-бензилоксикарбонилпирролидин-1-ил] -6-оксогекс-3-еноил} пирролидин-2-карбоновой кислоты (смесь 3 диастереоизомеров) в виде бесцветного масла получали 28 мг (100%) указанного в заголовке соединения. МС m/е (%): 423 ([М-Н]–, 100). Пример 84 (R)-1- { 5- [(R)-2-карбоксипирролидин-1-карбонил] -7-метокси-2-(2-метоксиэтил)гептаноил} пирролидин-2-карбоновая кислота (смесь 3 диастереоизомеров) а) Смесь диэтиловых эфиров (E)-(2R, 5S)- и -(2RS, 5SR)-2,5-бис-(2-метоксиэтил) гекс – 3 – ендикислот В перемешиваемый раствор 5,0 г (25,0 ммолей) диэтилового эфира транс-2-бутен-1,4-дикарбоновой кислоты в 125 мл ТГФ вводили 6,35 г (150 ммолей) безводного хлорида лития и образовавшуюся суспензию охлаждали до -78oС. По каплям добавляли 25,0 мл (50,0 ммолей) 2М раствора ДАЛ в ТГФ и перемешивание продолжали в течение 45 мин. Далее добавляли 7,4 мл (78,7 ммоля) 2-метоксиэтилбромида и перемешивание продолжали в течение 15 мин при -78oС, затем 1 ч при 0oС, после чего 2 ч при комнатной температуре. Реакцию прекращали добавлением насыщенного раствора хлорида аммония и смесь три раза экстрагировали диэтиловым эфиром. Объединенные органические фазы последовательно промывали насыщенным раствором хлорида аммония, водой и насыщенным рассолом, сушили над сульфатом натрия и концентрировали в вакууме. В результате экспресс-хроматографии (50% толуола в EtOAc) в виде желтого масла получали 1,29 г (16%) указанного в заголовке соединения. МС m/е (%): 334 ([M+NH4]+, 100). б) Смесь (E)-(2R, 5S)- и -(2RS, 5SR)-2,5-бис-(2-метоксиэтил)-гекс-3-ендикислот В перемешиваемый раствор 1,29 г (4,08 ммоля) смеси диэтиловых эфиров (E)-(2R, 5S)- и -(2RS, 5SR)-2,5-бис-(2-метоксиэтил)-гекс-3-ендикислот в 10 мл ТГФ вводили 33 мл (33 ммоля) 1 М раствора гидроксида натрия. После перемешивания в течение 18 ч при комнатной температуре добавлением 1М соляной кислоты реакционную смесь подкисляли до рН 3 и три раза экстрагировали этилацетатом. Объединенные органические фазы последовательно промывали водой и насыщенным рассолом, сушили над сульфатом натрия и концентрировали в вакууме с получением в виде желтого масла 894 мг (84%) указанного в заголовке соединения. МС m/е (%): 259 ([М-Н]–, 100). в) Бензиловый эфир (E)-(R)-1-{5-[ (R)-2-бензилоксикарбонилпирролидин-1-карбонил] -7-метокси-2- (2-метоксиэтил)гептаноил] пирролидин-2-карбоновой кислоты (смесь 3 диастереоизомеров) В соответствии с общей методикой А с использованием 1,86 г (7,69 ммоля) гидрохлорида D-пролинбензилового эфира и 894 мг (3,84 ммоля) смеси (Е)-(2R, 5S)- и -(2RS, 5SR)-2,5-бис-(2-метоксиэтил)-гекс-3-ендикислот после последовательной экспресс-хроматографии (с градиентом от 50 до 100% EtOAc в гексане, затем 10% МеОН в EtOAc в первой колонке; 20% толуола в EtOAc во второй колонке; 20% толуола в EtOAc в третьей колонке и с градиентом от 25 до 20% толуола в EtOAc в четвертой колонке) в виде светло-желтого масла получали 146 мг (7%) указанного в заголовке соединения. МС m/е (%): 652 (M+NH4 +, 50), 635 (М+Н+, 100). г) (R)-1- { 5- [(R)-2-карбоксипирролидин-1-карбонил] -7-метокси-2-(2-метоксиэтил)гептаноил} пирролидин-2-карбоновая кислота (смесь 3 диастереоизомеров) В соответствии с общей методикой Б с использованием 146 мг (0,23 ммоля) бензилового эфира (E)-(R)-1-{5-[(R)-2- бензилоксикарбонилпирролидин -1 -карбонил] -7-метокси-2- (2-метоксиэтил)гептаноил} пирролидин-2-карбоновой кислоты (смесь 3 диастереоизомеров) в виде бесцветного масла получали 92 мг (88%) указанного в заголовке соединения. МС m/е (%): 455 ([М-Н]–, 100). Пример 85 (R)-1- {2- {4- [2- [(R)-2-карбоксипирролидин-1-ил] -1-метил-2-оксоэтил] фенил} пропионил}пирролидин-2-карбоновая кислота (смесь 3 диастереоизомеров) а) Бензиловый эфир (4-бензилоксикарбонилметилфенил) уксусной кислоты В перемешиваемую суспензию 10,0 г (51,5 ммоля) бензол-1,4-диуксусной кислоты, 0,94 г (7,73 ммоля) 4-диметиламинопиридина и 5,33 мл (51,5 ммоля) бензилового спирта в 150 мл дихлорметана при 0oС вводили 11,85 г (61,8 ммоля) N-(3-диметиламинопропил)-N’-этилкарбодиимида и перемешивание продолжали при 0oС в течение 2 ч, а затем при комнатной температуре в течение 16 ч. Далее реакционную смесь последовательно промывали 1М соляной кислотой, насыщенным раствором бикарбоната натрия и в завершение насыщенным рассолом и водные фазы подвергали обратной экстракции дихлорметаном. Объединенные органические экстракты сушили над сульфатом натрия и концентрировали в вакууме. Затем в результате экспресс-хроматографии (50% EtOAc в гексане) в виде светло-желтого масла, которое при стоянии кристаллизовалось, получали указанное в заголовке соединение. МС m/е (%): 374 (M+, 10), 283 ([M-Bn]+, 16), 239 ([М-Вn-СО2]+, 18), 91 (Bn+ 100). б) Смесь бензиловых эфиров (R)-2-[4-[(S)- и -(RS)-2-[4-[(RS)-1-бензилоксикарбонилэтил] фенил] пропионовых кислот В перемешиваемый раствор 2,0 г (5,3 ммоля) бензилового эфира (4-бензилоксикарбонилметилфенил) уксусной кислоты в 80 мл ТГФ вводили 1,35 г (32 ммоля) безводного хлорида лития и образовавшуюся суспензию охлаждали до -78oС. По каплям добавляли 10,7 мл (21,4 ммоля) 2 М раствора ДАЛ в ТГФ и перемешивание продолжали в течение 45 мин. Затем добавляли 1,33 мл (21,3 ммоля) метилиодида и перемешивание продолжали в течение 15 мин при -78oС, после чего 20 мин при 0oС. Реакцию прекращали при этой температуре добавлением насыщенного раствора хлорида аммония и смесь три раза экстрагировали диэтиловым эфиром. Объединенные органические фазы сушили над сульфатом натрия и концентрировали в вакууме. В результате экспресс-хроматографии (EtOAc) в виде коричневого масла получали 2,1 г (100%) указанного в заголовке соединения. МС m/е (%): 420 ([M+NH4]+, 100). в) Смесь (R)-2-[4-[(S)- и -(RS)-2-[4-[(RS)-1-карбоксиэтил]фенил]пропионовой кислот Раствор 230 мг (0,57 ммоля) смеси бензиловых эфиров (R)-2-[4-[(S)- и -(RS)-2- [4- [(RS)-1-бензилоксикарбонилэтил] фенил] пропионовых кислот в 20 мл этанола при комнатной температуре в течение 16 ч перемешивали совместно с 5 мас.% 10%-ного палладия на угле под давлением водорода 1 атм. После фильтрования с удалением катализатора реакционную смесь концентрировали в вакууме с получением в виде белого кристаллического твердого вещества 70 мг (55%) указанного в заголовке соединения. МС m/е (%): 222 (М+ 23), 177 ([М-СО2Н]–, 100), 131. г) Бензиловый эфир (R)-1- {2- {4- [2- [(R)-2-бензилоксикарбонилпирролидин-1-ил] -1-метил-2-оксоэтил] фенил} пропионил} пирролидин-2-карбоновой кислоты (смесь 3 диастереоизомеров) В соответствии с общей методикой А с использованием 370 мг (1,53 ммоля) гидрохлорида D-пролинбензилового эфира и 170 мг (0,77 ммоля) смеси (R)-2-[4-[(S)- и -(RS)-2-[4-[(RS)-1-карбоксиэтил] фенил]пропионовых кислот после экспресс-хроматографии (EtOAc) в виде бесцветного масла получали 170 мг (38%) указанного в заголовке соединения. МС m/е (%): 614 (M+NH4 +, 100), 597 (М+Н+, 60). д) (R)-1- {2- {4- [2- [(R)-2-карбоксипирролидин-1-ил] -1-метил-2-оксоэтил] фенил} пропионил}пирролидин-2-карбоновая кислота (смесь 3 диастереоизомеров) В соответствии с общей методикой Б с использованием 170 мг (0,29 ммоля) бензилового эфира (R)-1- {2- {4- [2- [(R)-2-бензилоксикарбонилпирролидин-1-ил] -1-метил-2-оксоэтил] фенил} пропионил} пирролидин-2-карбоновой кислоты (смесь 3 диастереоизомеров) в виде белой пены получали 50 мг (42%) указанного в заголовке соединения. МС m/е (%): 415 ([М-Н]–, 100). Пример 86 (2E, 4E)-(R)-1- { 6- [(R)-2-карбоксипирролидин-1-ил]-2,5-диметил-б-окосгекса-2.4-диеноил1 пирролидин-2-карбоновая кислота а) Бензиловый эфир (2E, 4E)-(R)-1- {6- [(R)-2-бензилоксикарбонилпирролидин-1 – ил] – 2,5 -диметил – 6 – оксогекса -2,4 -диеноил} пирролидин – 2 -карбоновой кислоты В перемешиваемую суспензию 0,91 г (5,32 ммоля) 2,5-диметил-гекс-2,4-диен-1,6-дикислоты в 80 мл дихлорметана, содержавшую две капли пиридина, при комнатной температуре по каплям добавляли 0,77 мл (10,6 ммоля) тионилхлорида и затем реакционную смесь выдерживали при 50oС в течение 2 ч. Образовавшийся раствор охлаждали до 0oС и по каплям при 0oС вводили в раствор 2,57 г (10,6 ммоля) гидрохлорида D-пролинбензилового эфира и 3,0 мл (21,5 ммоля) триэтиламина в 50 мл дихлорметана. Перемешивание продолжали в течение 2 ч при 0oС, а затем 24 ч при комнатной температуре. Далее реакционную смесь последовательно промывали 1 М соляной кислотой и водой и в завершение водные фазы подвергали обратной экстракции дихлорметаном. Объединенные органические экстракты сушили над сульфатом натрия и концентрировали в вакууме. В результате экспресс-хроматографии (EtOAc) в виде бесцветного масла получали 2,79 г (96%) указанного в заголовке соединения. МС m/е (%): 562 (M+NH4 +, 100), 545 (М+Н+, 5). a) (2E, 4E)-(R)-1- {6- [(R)-2-карбоксипирролидин-1-ил]-2,5-диметил-6-оксогекса-2,4-диеноил} пирролидин-2-карбоновая кислота В соответствии с общей методикой Б с использованием 1,14 г (2,09 ммоля) бензилового эфира (2E, 4E)-(R)-1- {6- [(R)-2-бензилоксикарбонилпирролидин-1-ил] -2,5-диметил-6-оксогекса-2,4-диеноил] пирролидин-2-карбоновой кислоты и диоксана в качестве растворителя в виде белого твердого вещества получали 127 мг (16%) указанного в заголовке соединения. МС m/е (%): 365 (М+Н+, 100). Пример 87 (R)-1- {6- [(R)-2-карбоксипирролидин-1-ил] -2,5-диметил-6-оксогексаноил] пирролидин-2-карбоновая кислота (смесь 3 диастереоизомеров) Раствор 593 мг (1,09 ммоля) бензилового эфира (2E, 4E)-(R)-1-{6- [(R)-2 – бензилоксикарбонилпирролидин-1 – ил] – 2,5 -диметил – 6- оксогекса -2,4-диеноил} пирролидин-2-карбоновой кислоты в 15 мл диоксана под давлением водорода 1 атм перемешивали вместе с 25 мг (0,11 ммоля) оксида платины(IV) в течение 72 ч при комнатной температуре. После фильтрования с удалением катализатора реакционную смесь концентрировали в вакууме и в роторном испарителе три раз подвергали азеотропной перегонке с хлороформом для удаления последних следов диоксана, затем растирали в диэтиловом эфире с получением в виде белой пены 400 мг (100%) указанного в заголовке соединения. МС m/е (%): 369 (М+Н+, 100). Пример 88 Смесь (R)-1-{ (3R, 4R)- и -{3S, 4S)-3,4-дигидрокси-6-[ (R)-2-карбоксипирролидин-1-ил] -6-оксогексаноил} пирролидин-2-карбоновых кислот а) Бензиловый эфир (R)-1-{ 6-[ (R)-2-бензилоксикарбонилпирролидин-1-карбонил} пиридин-2-карбонил} пирролидин-2-карбоновой кислоты В соответствии с общей методикой А с использованием 5,0 г (20,6 ммоля) гидрохлорида D-пролинбензилового эфира и 1,5 г (10,3 ммоля) транс-3-гексендикислот после экспресс-хроматографии (EtOAc) в виде светло-желтого масла получали 3,15 г (59%) указанного в заголовке соединения. МС m/е (%): 536 (M+NH4 +, 100), 519 (М+Н+, 80). б) Смесь бензиловых эфиров (R)-1- {(3R, 4R)- и -{(3S, 4S)-6-[(R)-2-бензилоксикарбонилпирролидин -1 – ил] – 3,4 -дигидрокси – 6- оксогексаноил} пирролидин-2-карбоновых кислот В перемешиваемый раствор 3,13 г (6,04 ммоля) бензилового эфира (R)-1-{6- [(R) -2-бензилоксикарбонилпирролидин-1-карбонил] пиридин-2-карбо-нил}пирролидин-2-карбоновой кислоты в 10 мл ацетона и 10 мл воды вводили 980 мг (7,25 ммоля) 4-метилморфолин-4-оксида и 0,6 мл 2,5%-ного раствора тетраоксида осмия в трет-бутаноле и перемешивание продолжали в течение 72 ч при комнатной температуре. Далее при 0oС добавляли 50 мл 38%-ного раствора первичного кислого сульфита натрия и перемешивание продолжали в течение дополнительных 15 мин. Затем реакционную смесь фильтровали и три раза экстрагировали этилацетатом. Объединенные органические экстракты последовательно промывали 1М соляной кислотой и насыщенным рассолом, сушили над сульфатом натрия и концентрировали в вакууме с получением в виде бесцветного масла 3,34 г (100%) указанного в заголовке соединения. MC m/e (%): 575 (M+Na+, 35), 570 (M+NH4 +, 55), 553 (М+Н+, 100). в) Смесь (R)-1-{ (3R, 4R)- и -{(3S, 4S)-3,4-дигидрокси-6- [(R)-2-карбоксипирролидин-1-ил] -6-оксогексаноил} пирролидин-2-карбоновых кислот В соответствии с общей методикой Б с использованием 506 мг (0,92 ммоля) смеси бензиловых эфиров (R)-1- {(3R, 4R)- и -{(3S, 4S)-6-[ (R)-2-бензилоксикарбонилпирролидин-1 – ил] – 3,4 -дигидрокси – 6 – оксогексаноил} пирролидин – 2 -карбоновых кислот в виде белого твердого вещества получали 341 мг (100%) указанного в заголовке соединения. MC m/e (%): 395 (M+NH4 +, 55), 373 (М+Н+, 100). Пример 89 (E)-(R)-1- {6- [(R)-2-карбоксипирролидин-1-ил] -6-окосгекс-3-еноил}пирролидин-2-карбоновая кислота а) трет-Бутиловый эфир (E)-(R)-1- {6- [(R)-2-трет-бутоксикарбонилпирролидин-1-ил] -6-оксогекс-3-еноил] пирролидин-2-карбоновой кислоты В соответствии с общей методикой А с использованием 1,5 г (8,76 ммоля) D-пролин-трет-бутилового эфира и 630 мг (4,37 ммоля) транс -3-гексендикислоты после экспресс-хроматографии (10% EtOH в EtOAc) в виде белого кристаллического твердого вещества получали 1,59 г (77%) указанного в заголовке соединения. МС m/е (%): 568 (M+NH4 +, 35), 451 (М+Н+, 100), 395 ([М+Н-С3Н8]+, 32), 339 ([M+H-2C3H8]+, 40). б) (E)-(R)-1- {6- [(R)-2-карбоксипирролидин-1-ил] -6-оксогекс-3-еноил] пирролидин-2-карбоновая кислота В перемешиваемый раствор 600 мг (1,33 ммоля) трет-бутилового эфира (E)-(R)-1- { 6- [(R)-2-трет-бутоксикарбонилпирролидин-1-ил] -6-оксогекс-3-еноил}пирролидин-2-карбоновой кислоты в 15 мл дихлорметана при 0oС по каплям вводили 4,4 мл (57,8 ммоля) трифторуксусной кислоты и перемешивание продолжали в течение 16 ч при комнатной температуре. В результате концентрирования в вакууме и трех азеотропных перегонок с хлороформом в роторном испарителе в виде белой пены получали 402 мг (90%) указанного в заголовке соединения. МС m/е (%): 339 (М+Н+, 100). Пример 90 (R)-1- { 3- {[3- [(R)-2-карбоксипирролидин-1-ил] -3-оксопропил]пропиламино} пропионил} пирролидин-2-карбоновая кислота а) Бензиловый эфир (R)-1-акрилоилпирролидин-2-карбоновой кислоты В перемешиваемый раствор 390 мг (1,6 ммоля) гидрохлорида D-пролинбензилового эфира и 0,47 мл (3,4 ммоля) триэтиламина в 20 мл дихлорметана при 0oС по каплям вводили 0,2 мл (2,4 ммоля) акрилоилхлорида и перемешивание продолжали при комнатной температуре в течение 24 ч. Далее реакционную смесь последовательно промывали водой, 1 М соляной кислотой и еще раз водой и водные фазы подвергали обратной экстракции дихлорметаном. Объединенные органические экстракты сушили над сульфатом натрия и концентрировали в вакууме с получением в виде бесцветного масла 420 мг (100%) указанного в заголовке соединения. МС m/е (%): 259 (M+, 25), 124 (100), 91 (25), 70 (21). б) Бензиловый эфир (R) -1- {3- {[3- [(R) -2-бензилоксикарбонилпирролидин-1-ил] -3-оксопропил] пропиламино} пропионил} пирролидин-2-карбоновой кислоты Раствор 400 мг (1,5 ммоля) бензилового эфира (R)-1-акрилоилпирролидин-2-карбоновой кислоты и 63 мл (0,75 ммоля) пропиламина в 5 мл ацетонитрила перемешивали в течение 16 ч при комнатной температуре, затем в течение 6 ч при 45oС и в завершение в течение 16 ч при 80oС. В результате концентрирования в вакууме и экспресс-хроматографии (20% Н2О в ацетоне) в виде бледно-желтого масла получали 84 мг (19%) указанного в заголовке соединения. МС m/е (%): 578 (М+Н+, 100). в) (R)-1- {3- {[3- [(R)-2-карбоксипирролидин-1-ил] -3-оксопропил] пропиламино} пропионил} пирролидин-2-карбоновая кислота Раствор 84 мг (0,15 ммоля) бензилового эфира (R)-1-{3-{[3-[(R)-2-бензилоксикарбонилпирролидин-1-ил] -3-оксопропил] пропиламино} пропионил}пирролидин-2-карбоновой кислоты в 3 мл этанола перемешивали в течение 16 ч при комнатной температуре совместно с 10 мг 10%-ного палладия на угле под давлением водорода 1 атм. После фильтрования для удаления катализатора и концентрирования в вакууме в виде белого твердого вещества получали 58 мг (100%) указанного в заголовке соединения. МС m/е (%): 398 (М+Н+, 100). Пример 91 (R)-1- { 3- { [3- [(R)-2-карбоксипирролидин-1-ил] – 3-оксопропил] циклопропилметиламино} пропионил} пирролидин-2-карбоновая кислота а) Бензиловый эфир (R)-1- {3- {[3- [(R)-2-бензилоксикарбонилпирролидин-1-ил] -3-оксопропил] циклопропилметиламино} пропионил} пирролидин-2-карбоновой кислоты Раствор 444 мг (1,71 ммоля) бензилового эфира (R)-1-акрилоилпирролидин-2-карбоновой кислоты и 74 мл (0,85 ммоля) циклопропилметила-мина в 5 мл ацетонитрила перемешивали в течение 1 ч при комнатной температуре, а затем в течение 16 ч при 80oС. В результате концентрирования в вакууме и экспресс-хроматографии (с градиентом от 0 до 100% МеОН в EtOAc) в виде желтого масла получали 220 мг (44%) указанного в заголовке соединения. МС m/е (%): 590 (М+Н+, 100). б) (R)-1- {3- {[3- [(R)-2-карбоксипирролидин-1-ил] -3-оксопропил] циклопропилметиламино} пропионил} пирролидин-2-карбоновая кислота Раствор 220 мг (0,37 ммоля) бензилового эфира (R)-1-{3-{[3-[(R)-2-бензилоксикарбонилпирролидин-1-ил] -3-оксопропил] циклопропилметиламино} пропионил} пирролидин-2-карбоновой кислоты в 20 мл изопропанола перемешивали в течение 16 ч при комнатной температуре совместно с 10 мг 10%-ного палладия на угле под давлением водорода 1 атм. После фильтрования для удаления катализатора и концентрирования в вакууме в виде желтого твердого вещества получали 153 мг (100%) указанного в заголовке соединения. МС m/е (%): 408 ([М-Н]–, 100). Пример 92 Трифторацетат (R)-1- { 3- {(3,4-диметоксибензил)- [3- [(R)-2-карбоксипирролидин-1-ил] -3-оксопропил] амино} пропионил} пирролидин-2-карбоновой кислоты (1:1) а) трет-Бутиловый эфир (R)-1-акрилоилпирролидин-2-карбоновой кислоты В перемешиваемый раствор 5,0 г (29,2 ммоля) D-пролин-трет-бутилового эфира и 4,5 мл (32,1 ммоля) триэтиламина в 180 мл дихлорметана при 0oС по каплям вводили 3,6 мл (43,8 ммоля) акрилоилхлорида и перемешивание продолжали при комнатной температуре в течение 48 ч. Далее реакционную смесь последовательно промывали водой, насыщенным раствором хлорида аммония, еще раз водой и затем насыщенным рассолом и водные фазы подвергали обратной экстракции дихлорметаном. Объединенные органические экстракты сушили над сульфатом натрия и концентрировали в вакууме с получением в виде желтого масла 6,6 г (100%) указанного в заголовке соединения. МС m/е (%): 243 (M+NH4 +, 33), 226 (М+Н+ 100). б) трет-Бутиловый эфир (R)-1- {3- {[3- [(R)-2-трет-бутоксикарбонилпирролидин-1-ил] -3-оксопропил] – (3,4-диметоксибензил)амино} пропионил} пирролидин-2-карбоновой кислоты Раствор 1,0 г (4,44 ммоля) трет-бутилового эфира (R)-1-акрилоилпирролидин-2-карбоновой кислоты и 0,33 мл (2,22 ммоля) вератриламина в 25 мл ацетонитрила перемешивали в течение 16 ч при 80oС. В результате концентрирования в вакууме и экспресс -хроматографии (с градиентом от 0 до 10% МеОН в EtOAc) в виде светло-коричневого масла получали 150 мг (10%) указанного в заголовке соединения. МС m/е (%): 618 (М+Н+, 100). в) Трифторацетат (R)-1- {3- {(3,4-диметоксибензил)- [3- [(R)-2-карбоксипирролидин-1-ил] -3-оксопропил] амино} пропионил} пирролидин-2-карбоновой кислоты (1:1) В перемешиваемый раствор 150 мг (0,24 ммоля) трет-бутилового эфира (R)-1- { 3-{[3-[(R)-2-трет-бутоксикарбонилпирролидин-1-ил] -3-оксопропил]-(3,4-диметоксибензил) амино} пропионил} пирролидин-2-карбоновой кислоты в 5 мл дихлорметана при 0oС по каплям вводили 1,0 мл трифторуксусной кислоты и перемешивание продолжали в течение 16 ч при комнатной температуре. В результате концентрирования в вакууме и трехкратной азеотропной перегонки с хлороформом в роторном испарителе после растирания в диэтиловом эфире в виде желтого кристаллического твердого вещества получали 130 мг (87%) указанного в заголовке соединения. МС m/е (%): 506 (М+Н+, 100). Пример 93 Трифторацетат (R)-1-{3-{[3- [(R)-2-карбоксипирролидин-1-ил] -3-оксопропил] – (2-метоксиэтил)амино} пропионил} пирролидин-2-карбоновой кислоты (1: 1) а) трет-Бутиловый эфир (R)-1- {3- {[3- [(R)-2-трет-бутоксикарбонилпирролидин-1-ил] -3-оксопропил] – (2-метоксиэтил)амино} пропионил} пирролидин-2-карбоновой кислоты Раствор 1,0 мг (4,44 ммоля) трет-бутилового эфира (R)-1-акрилоилпирролидин-2-карбоновой кислоты и 0,19 мл (2,22 ммоля) 2-метоксиэтиламина в 25 мл ацетонитрила перемешивали в течение 16 ч при 80oС. В результате концентрирования в вакууме и экспресс-хроматографии (с градиентом от 0 до 10% МеОН в EtOAc) в виде светло-коричневого масла получали 300 мг (23%) указанного в заголовке соединения. МС m/е (%): 526 (М+Н+, 100). б) Трифторацетат (R)-1- {3-{[3-[(R)-2-карбоксипирролидин-1-ил] -3-оксопропил] -(2-метоксиэтил)амино} пропионил} пирролидин-2-карбоновой кислоты (1:1) В перемешиваемый раствор 150 мг (0,29 ммоля) трет-бутилового эфира (R)-1- {3- {[3- [(R)-2-трет-бутоксикарбонилпирролидин-1-ил] -3-оксопропил] – (2-метоксиэтил) амино} пропионил} пирролидин-2-карбоновой кислоты в 5 мл дихлорметана при 0oС по каплям вводили 1,0 мл трифторуксусной кислоты и перемешивание продолжали в течение 16 ч при комнатной температуре. В результате концентрирования в вакууме и трехкратной азеотропной перегонки с хлороформом в роторном испарителе после повторного суспендирования в воде и последующей лиофилизации в виде желтого масла получали 100 мг (67%) указанного в заголовке соединения. МС m/е (%): 436 (M+Na+, 35), 414 (М+Н+, 100). Пример 94 Трифторацетат (R)-1- { 3- {бензил- [3- [(R)-2-карбоксипирролидин-1-ил] -3-оксопропил] амино} пропионил} пирролидин-2-карбоновой кислоты (1:1) а) трет-Бутиловый эфир (R)-1- {3- {бензил- [3- [(R)-2-трет-бутоксикарбонилпирролидин-1-ил] -3-оксопропил] амино} пропионил} пирролидин-2-карбоновой кислоты Раствор 1,0 мг (4,44 ммоля) трет-бутилового эфира (R)-1-акрилоилпирролидин-2-карбоновой кислоты и 0,24 мл (2,22 ммоля) бензиламина в 25 мл ацетонитрила перемешивали в течение 16 ч при 80oС. В результате концентрирования в вакууме и экспресс-хроматографии (с градиентом от 0 до 10% МеОН в EtOAc) в виде желтого масла получали 470 мг (34%) указанного в заголовке соединения. МС m/е (%): 558 (М+Н+, 100). б) Трифторацетат (R) -1- {3- [бензил- [3- [(R) -2-карбоксипирролидин-1-ил] -3-оксопропил]амино}пропионил}пирролидин-2-карбоновой кислоты (1:1) В перемешиваемый раствор 200 мг (0,36 ммоля) трет-бутилового эфира (R)-1- { 3- {бензил- [3- [(R)-2-трет-бутоксикарбонилпирролидин-1-ил] -3-оксопропил] амино} пропионил} пирролидин-2-карбоновой кислоты в 5 мл дихлорметана при 0oС по каплям вводили 1,0 мл трифторуксусной кислоты и перемешивание продолжали в течение 16 ч при комнатной температуре. В результате концентрирования в вакууме и трехкратной азеотропной перегонки с хлороформом в роторном испарителе после растирания в диэтиловом эфире в виде желтого кристаллического твердого вещества получали 160 мг (80%) указанного в заголовке соединения. МС m/е (%): 468 (M+Na+, 30), 446 (М+Н+, 100). Пример 95 Трифторацетат (R)-1- {3- [3- [(R)-2-карбоксипирролидин-1-ил] -3-оксопропиламино} пропионил} пирролидин-2-карбоновой кислоты (1:1) а) трет-Бутиловый эфир (R)-1- {3- {[3- [(R)-2-трет-бутоксикарбонилпирролидин-1-ил] -3-оксопропил] – (4-трифторметилбензил)амино} пропионил} пирролидин-2-карбоновой кислоты Раствор 1,0 мг (4,44 ммоля) трет-бутилового эфира (R)-1-акрилоилпирролидин-2-карбоновой кислоты и 0,32 мл (2,22 ммоля) пара-трифторметилбензиламина в 25 мл ацетонитрила перемешивали в течение 16 ч при 80oС. В результате концентрирования в вакууме и экспресс-хроматографии (с градиентом от 0 до 10% МеОН в EtOAc) в виде светло-коричневого масла получали 480 мг (31%) указанного в заголовке соединения. МС m/е (%): 626 (М+Н+, 100). б) трет-Бутиловый эфир (R)-1-{3-{3-[(R)-2-трет-бутоксикарбонилпирролидин-1-ил] -3-оксопропиламино] пропионил} пирролидин-2-карбоновой кислоты и трет-бутиловый эфир (R)-1- {3- {[3- [(R)-2-трет-бутоксикарбонилпирролидин-1-ил] -3-оксопропил] этиламино} пропионил} пирролидин-2-карбоновой кислоты Раствор 290 мг (0,46 ммоля) трет-бутилового эфира (R)-1-{3- {[3-[(R)-2-трет-бутоксикарбонилпирролидин-1-ил] -3-оксопропил] – (4-трифторметилбензил)амино}пропионил]пирролидин-2-карбоновой кислоты в 50 мл этанола перемешивали в течение 72 ч при комнатной температуре под давлением водорода 1 атм совместно с 30 мг 10%-ного палладия на угле. В результате фильтрования для удаления катализатора, концентрирования в вакууме и экспресс-хроматографии (с градиентом от 0 до 100% МеОН в EtOAc, содержавшем 1% Еt3N в виде желтого масла получали 36 мг (17%) указанного в заголовке соединения, трет-бутилового эфира (R)-1- { 3- [3-[ (R)-2-трет-бутоксикарбонилпирролидин-1-ил] -3-оксопропиламино] пропионил} пирролидин-2-карбоновой кислоты. МС m/е (%): 468 (М+Н+, 100). В результате дальнейшей экспресс-хроматографии меньшей полярной фракции (с градиентом от 0 до 20% МеОН в EtOAc, содержавшем 1% Et3N) в виде желтого масла в качестве побочного продукта получали 87 мг (38%) трет-бутилового эфира (R)-1- { 3- {[3- [(R)-2-трет-бутоксикарбонилпирролидин-1-ил] -3-оксопропил] этиламино} пропионил} пирролидин-2-карбоновой кислоты. МС m/е (%): 496 (М+Н+, 100). в) Трифторацетат (R)-1- {3- [3- [(R)-2-карбоксипирролидин-1-ил] -3-оксопропиламино] пропионил} пирролидин-2-карбоновой кислоты (1:1) В перемешиваемый раствор 33 мг (0,07 ммоля) трет-бутилового эфира (R)-1-{ 3-[3-[(R)-2-трет-бутоксикарбонилпирролидин-1-ил] -3-оксопропиламино] пропионил} пирролидин-2-карбоновой кислоты в 5 мл дихлорметана при 0oС по каплям вводили 1,0 мл трифторуксусной кислоты и перемешивание продолжали в течение 16 ч при комнатной температуре. В результате концентрирования в вакууме и трехкратной азеотропной перегонки с хлороформом в роторном испарителе после повторного суспендирования в воде и последующей лиофилизации в виде желтого стекловидного твердого вещества получали 19 мг (76%) указанного в заголовке соединения. МС m/е (%): 354 ([М-Н]–, 100). Пример 96 Трифторацетат (R)-1- {3- {этил- [3- [(R)-2-карбоксипирролидин-1-ил] -3-оксопропил]амино] пропионил} пирролидин-2-карбоновой кислоты (1:1) В перемешиваемый раствор 85 мг (0,17 ммоля) трет-бутилового эфира (R)-1- { 3- {[3- [(R)-2-трет-бутоксикарбонилпирролидин-1-ил] -3-оксопропил] этиламино} пропионил} пирролидин-2-карбоновой кислоты в 5 мл дихлорметана при 0oС по каплям вводили 1,0 мл трифторуксусной кислоты и перемешивание продолжали в течение 16 ч при комнатной температуре. В результате концентрирования в вакууме и трехкратной азеотропной перегонки с хлороформом в роторном испарителе после повторного суспендирования в воде и лиофилизации в виде желтого кристаллического твердого вещества получали 63 мг (97%) указанного в заголовке соединения. МС m/е (%): 442 ([М+ОАс]–, 35), 382 ([М-Н]–, 100). Пример 97 Трифторацетат (R)-1- { 3- {[3- [(R)-2-карбоксипирролидин-1-ил] -3-оксопропил] – (4-трифторметилбензил)амино} пропионил} пирролидин-2-карбоновой кислоты (1:1) В перемешиваемый раствор 200 мг (0,32 ммоля) трет-бутилового эфира (R)-1- {3- {[3- [(R)-2-трет-бутоксикарбонилпирролидин-1-ил] -3-оксопропил] – (4-трифторметилбензил)амино} пропионил} пирролидин-2-карбоновой кислоты в 5 мл дихлорметана при 0oС по каплям вводили 1,0 мл трифторуксусной кислоты и перемешивание продолжали в течение 16 ч при комнатной температуре. В результате концентрирования в вакууме и трехкратной азеотропной перегонки с хлороформом в роторном испарителе после растирания в диэтиловом эфире в виде желтого кристаллического твердого вещества получали 150 мг (75%) указанного в заголовке соединения. МС m/е (%): 536 (M+Na+, 20), 514 (М+Н+, 100). Пример 98 Смесь (R)-1-[6-[(S)- и -(RS)-1-[6-[(RS)-2-карбоксипирролидин-1-ил1-6-оксогексаноил} пирролидин-2-карбоновых кислот а) Бензиловый эфир 1Н-пиррол-2-карбоновой кислоты Литература: J. Org. Chem. 1979, 44, 975. В перемешиваемый раствор 5,0 г (45,0 ммоля) пиррол-2-карбоновой кислоты и 31,3 мл (225 ммолей) триэтиламина в 100 мл ДМФ по каплям вводили 26 мл (225 ммолей) бензилбромида и перемешивание продолжали в течение 72 ч при комнатной температуре. Далее реакционную смесь концентрировали в вакууме, остаток повторно суспендировали в дихлорметане и промывали дважды насыщенным раствором бикарбоната натрия и дважды водой, водные фазы подвергали обратной экстракции дихлорметаном. Объединенные органические экстракты сушили над сульфатом натрия и концентрировали в вакууме. В результате экспресс-хроматографии (25% EtOAc в гексане) в виде желтого масла получали 8,23 г (90%) указанного в заголовке соединения. МС m/е (%): 201 (М+, 33), 94 ([M-OBn]+, 22), 91 (Bn+, 100). б) Бензиловый эфир 1-{6-[2-бензилоксикарбонилпиррол-1-ил]-6-оксогексаноил} -1Н-пиррол-2-карбоновой кислоты В перемешиваемый раствор 1,0 г (4,97 ммоля) бензилового эфира 1Н-пиррол-2-карбоновой кислоты, 0,06 г (0,50 ммоля) 4-диметиламинопиридина и 0,82 мл (5,47 ммоля) 1,8-диазабицикло [5.4.0] ундец-7-ена в 40 мл дихлорметана при 0oС по каплям вводили 0,36 мл (2,49 ммоля) адипоилхлорида и перемешивание продолжали в течение 1 ч при комнатной температуре. Далее реакционную смесь последовательно промывали 1М соляной кислотой, насыщенным раствором бикарбоната натрия и в завершение насыщенным рассолом и водные фазы подвергали обратной экстракции дихлорметаном. Объединенные органические экстракты сушили над сульфатом натрия и концентрировали в вакууме. В результате экспресс-хроматографии (25% EtOAc в гексане) в виде белого кристаллического твердого вещества получали 450 мг (35%) указанного в заголовке соединения. МС m/е (%): 530 (M+NH4 +, 100). в) Смесь (R)-1-{ 6-[(S)- и -(RS)-1-{6-[(RS)-2-карбоксипирролидин-1-ил] -6-оксогексаноил}пирролидин-2-карбоновых кислот В соответствии с общей методикой Б с использованием 800 мг (1,56 ммоля) бензилового эфира 1- {6- [2-бензилоксикарбонилпиррол-1-ил] -6-оксогексаноил} -1Н-пиррол-2-карбоновой кислоты в виде белого кристаллического твердого вещества получали 470 мг (91%) указанного в заголовке соединения. МС m/е (%): 339 ([М-Н]–, 100). Пример 99 1-[6-(2-карбоксипиррол-1-ил)-6-оксогексаноил] -1Н-пиррол-2-карбоновая кислота а) трет-Бутиловый эфир 1Н-пиррол-2-карбоновой кислоты Литература: Tetrahedron 1985, 41, 5633. В перемешиваемый раствор 10,0 г (90,0 ммолей) пиррол-2-карбоновой кислоты в 180 мл диоксана при 0oС по каплям вводили 18 мл концентрированной серной кислоты, затем в течение 1 ч с помощью холодильника с сухим льдом, в реакционной колбе конденсировали 2-метилпропен и перемешивание продолжали в течение 16 ч при 0oС, одновременно периодически вновь заполняя холодильник с сухим льдом с целью поддержать осторожное кипячение 2-метилпропена с обратным холодильником. Далее реакционную смесь осторожно выливали в охлажденную льдом смесь 400 мл диэтилового эфира и 150 мл 2М раствора гидроксида натрия. Фазы разделяли и водную фазу еще два раза экстрагировали диэтиловым эфиром. Объединенные органические фазы последовательно промывали 2М раствором гидроксида натрия, водой и в завершение насыщенным рассолом, затем сушили над сульфатом натрия и концентрировали в вакууме с получением в виде бесцветного масла, которое все еще содержало некоторое количество диоксана, 9,07 г (60%) указанного в заголовке соединения. 1H-ЯМР (250 МГц, СDСl3,  ): 9,60 (1Н, широкий s), 6,90 (1Н, m), 6,83 (1H, m), 6,22 (1Н,ш), 1,56 (9Н, s).
б) трет-Бутиловый эфир 1-[6-(2-трет-бутоксикарбонилпиррол-1-ил)-6-оксогексаноил] -1Н-пиррол-2-карбоновой кислоты ): 9,60 (1Н, широкий s), 6,90 (1Н, m), 6,83 (1H, m), 6,22 (1Н,ш), 1,56 (9Н, s).
б) трет-Бутиловый эфир 1-[6-(2-трет-бутоксикарбонилпиррол-1-ил)-6-оксогексаноил] -1Н-пиррол-2-карбоновой кислотыВ перемешиваемый раствор 1,3 г (7,77 ммоля) трет-бутилового эфира 1Н-пиррол-2-карбоновой кислоты, 95 мг (0,78 ммоля) 4-диметиламинопиридина и 1,28 мл (8,56 ммоля) 1,8-диазабицикло [5.4.0] ундец-7-ена в 40 мл дихлорметана при 0oС по каплям вводили 0,57 мл (3,91 ммоля) адипоилхлорида и перемешивание продолжали в течение 16 ч при комнатной температуре. Добавляли дополнительно 95 мг (0,78 ммоля) 4-диметиламинопи-ридина и 1,28 мл (8,56 ммоля) 1,8-диазабицикло [5.4.0] ундец-7-ена и перемешивание продолжали в течение дополнительных 4 ч при комнатной температуре. Далее реакционную смесь последовательно промывали 1М соляной кислотой, насыщенным раствором бикарбоната натрия и в завершение насыщенным рассолом и водные фазы подвергали обратной экстракции дихлорметаном. Объединенные органические экстракты сушили над сульфатом натрия и концентрировали в вакууме. В результате экспресс-хроматографии (с градиентом от 10 до 20% EtOAc в гексане) в виде светло-желтого кристаллического твердого вещества получали 464 мг (13%) указанного в заголовке соединения. МС m/е (%): 462 (M+NH4 +, 100). в) 1- [6-(2-карбоксипиррол-1-ил)-6-оксогексаноил] -1Н-пиррол-2-карбоновая кислота В перемешиваемый раствор 55 мг (0,12 ммоля) трет-бутилового эфира 1-[6-(2-трет-бутоксикарбонилпиррол-1-ил)-6-оксогексаноил] -1Н-пиррол-2-карбоновой кислоты в 8 мл дихлорметана при 0oС по каплям вводили 0,15 мл (1,97 ммоля) трифторуксусной кислоты и перемешивание продолжали в течение 16 ч при комнатной температуре. В результате концентрирования в вакууме и трехкратной азеотропной перегонки с хлороформом в роторном испарителе в виде не совсем белого кристаллического твердого вещества получали 39 мг (95%) указанного в заголовке соединения. МС m/е (%): 350 (M+NH4 +, 100). Пример 100 (R)-1- {6- [(R)-2-карбокси-4,4-дифторпирролидин-1-ил] -6-оксогексаноил} -4,4-дифторпирролидин-2-карбоновая кислота а) ди-(2-бензиловый, 1-трет-бутиловый) эфир (2R)-4-оксопирролидин-1,2 -дикарбоновой кислоты Раствор 15,6 мл (0,22 моля) диметилсульфоксида в 50 мл дихлорметана при температуре -65oС в течение 10 мин вводили в 9,60 мл оксалилхлорида в 150 мл дихлорметана. По прошествии 5 мин при -65oС добавляли 32,1 г (0,1 моля) ди-(2-бензилового, 1-трет-бутилового) эфира (2R,2R)-4-гидроксипирролидин-1,2-дикарбоновой кислоты в 100 мл дихлорметана и по истечении дополнительных 15 мин добавляли 24,4 мл (0,18 моля) триэтиламина. Охлаждающую баню удаляли, перемешивание продолжали в течение ночи, а затем смесь выливали в воду со льдом. В результате экстракции дихлорметаном с последующей промывкой 0,05н. НСl, бикарбонатом и водой и хроматографии на силикагеле с дихлорметаном/этилацетатом в соотношении 98:2 в виде бесцветной жидкости получали 11,1 г (35%) ди-(2-бензилового,1-трет-бутилового) эфира (2R)-4-оксопирролидин-1,2-дикарбоновой кислоты. МС m/е (%): 263 (M-изобутилен, 7), 219 (8), 184 (24), 128 (14), 91 (58), 84 (40), 57 (100). [  ]D=+1,1o(с=1% в метаноле).
б) ди-(2-бензиловый, 1-трет-бутиловый) эфир (2R)-4,4-дифторпирролидин -1,2- дикарбоновой кислоты ]D=+1,1o(с=1% в метаноле).
б) ди-(2-бензиловый, 1-трет-бутиловый) эфир (2R)-4,4-дифторпирролидин -1,2- дикарбоновой кислотыПеремешиваемый раствор 0,64 г (0,002 моля) ди-(2-бензилового, 1-трет-бутилового) эфира (2R)-4-оксопирролидин-1,2-дикарбоновой кислоты в 3 мл дихлорметана при 0oС обрабатывали 0,79 мл (0,006 моля) диэтиламиносульфидтрифторида, перемешивание продолжали при комнатной температуре в течение 32 ч и затем смесь сливали на лед. В результате экстракции дихлорметаном и фильтрования через силикагель с использованием гексана с последующим элюированием дихлорметаном в виде светло-желтого масла получали 0,62 г (90%) ди-(2-бензилового,1-трет-бутилового) эфира (2R)-4,4-дифторпирролидин -1,2 -дикарбоновой кислоты. МС m/е (%): 285 (1), 206 (6), 106 (33), 91 (35), 57 (100).  ]D= +43,0o(с=1% в метаноле).
в) Гидрохлорид бензилового эфира (2R)-4,4-дифторпирролидин-2-карбоновой кислоты (1:1) ]D= +43,0o(с=1% в метаноле).
в) Гидрохлорид бензилового эфира (2R)-4,4-дифторпирролидин-2-карбоновой кислоты (1:1)100 мл сухого НС1 в диэтиловом эфире вводили в раствор 7,51 г (0,022 моля) ди-(2-бензилового, 1-трет-бутилового) эфира (2R)-4,4-дифторпирролидин-1,2-дикарбоновой кислоты в смеси 100 мл диэтилового эфира и 20 мл дихлорметана. После перемешивания в течение двух дней фильтрованием выделяли 5,84 г (96%) гидрохлорида бензилового эфира (2R)-4,4-дифторпирролидин-2-карбоновой кислоты (1:1) и сушили под пониженным давлением. Температура плавления 118-120oC; [  ]D=+29,3o(с=1% в метаноле).
г) Бензиловый эфир (R)-1- {6- [(R)-2-бензилоксикарбонил-4,4-дифторпирролидин -1 – ил] – 6 – оксогексаноил} -4,4 -дифторпирролидин – 2 – карбоновой кислоты ]D=+29,3o(с=1% в метаноле).
г) Бензиловый эфир (R)-1- {6- [(R)-2-бензилоксикарбонил-4,4-дифторпирролидин -1 – ил] – 6 – оксогексаноил} -4,4 -дифторпирролидин – 2 – карбоновой кислотыВ суспензию 1,11 г (0,004 моля) гидрохлорида бензилового эфира (2R)-4,4-дифторпирролидин-2-карбоновой кислоты (1:1) в 20 мл дихлорметана вводили 1,17 мл (0,008 моля) триэтиламина и 0,29 мл (0,002 моля) адилоилдихлорида в 5 мл дихлорметана. После перемешивания при комнатной температуре в течение ночи смесь экстрагировали 1н. НСl, водой и водным раствором бикарбоната натрия и сушили над сульфатом натрия. В результате хроматографии на силикагеле с дихлорметаном/ этилацетатом в соотношении 8:2 в виде бесцветного масла получали 0,79 г (66%) бензилового эфира (R-)-1- {6-[(R) -2-бензилоксикарбонил-4,4-дифторпирролидин-1-ил] -6-оксогексаноил} -4,4 -дифторпирролидин- 2 – карбоновой кислоты. ISP-MC: 593 (МН)+; [  ]D=+67,3o(с=1% в метаноле).
д) (R)-1- {6- [(R)-2-карбокси-4,4-дифторпирролидин-1-ил] -6-оксогексаноил}-4,4-дифторпирролидин-2-карбоновая кислота ]D=+67,3o(с=1% в метаноле).
д) (R)-1- {6- [(R)-2-карбокси-4,4-дифторпирролидин-1-ил] -6-оксогексаноил}-4,4-дифторпирролидин-2-карбоновая кислота0,59 г (0,001 моля) бензилового эфира (R)-1-{6-[ (R)-2-бензилоксикарбонил -4,4 -дифторпирролидин-1 – ил] – 6 – оксогексаноил} -4,4 -дифторпирролидин-2-карбоновой кислоты в 20 мл этанола гидрогенизовали при комнатной температуре и под атмосферным давлением в присутствии 0,12 г 5%-ного палладия на угле. После завершения этой реакции катализатор отфильтровывали, растворитель отгоняли и остаток растворяли в дихлорметане. В результате упаривания в виде белой пены получали 0,4 г (97%) (R)-1- {6- [(R)-2- карбокси- 4,4 -дифторпирролидин -1 -ил] – 6 – оксогексаноил] -4,4 -дифторпирролидин-2-карбоновой кислоты. ISP-MC: 413 (МН)+; [  ]D=+54,2o(с=1% в диметилсульфоксиде).
Пример 101 ]D=+54,2o(с=1% в диметилсульфоксиде).
Пример 101(R)-1-{ {2-[2-[(R)-2-карбокси-4,4-дифторпирролидин-1-ил] -2-оксоэтоксил] фенокси} ацетил}-4,4-дифторпирролидин-2-карбоновая кислота а) Бензиловый эфир (R)-1- {{2- [2- [(R)-2-бензилоксикарбонил-4,4-дифторпирролидин-1-ил] -2-оксоэтоксил] фенокси} ацетил} -4,4-дифторпирролидин-2-карбоновой кислоты В смесь 1,11 г (0,004 моля) гидрохлорида бензилового эфира (2R)-4,4-дифторпирролидин-2-карбоновой кислоты (1:1), 0,45 г (0,002 моля) 1,2-фенилендиоксидиуксусной кислоты, 1,21 г (0,012 моля) N-метилморфолина и 0,61 г (0,004 моля) гидрата 1-гидроксибензотриазола в 90 мл дихлорметана вводили 0,77 г (0,004 моля) гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида. После перемешивания при комнатной температуре в течение 18 ч смесь экстрагировали 1н. НСl, водой, 10%-ным водным раствором бикарбоната натрия и вновь водой. В результате хроматографии на силикагеле с дихлорметаном/этилацетатом в соотношении 9:1 в виде бесцветного масла получали 0,52 г (39%) бензилового эфира (R)-1-{ {2-[2-[ (R)-2-бензилоксикарбонил-4,4-дифторпирролидин-1-ил] -2-оксоэтоксил] фенокси} ацетил} -4,4-дифторпирролидин – 2 – карбоновой кислоты. ISP-MC: 673 (МН)+; [  ]D=+68,4o(с=1% в метаноле).
б) (R)-1- {{2- [2- [(R)-2-карбокси-4,4-дифторпирролидин-1-ил] -2-оксоэтоксил] фенокси} ацетил} -4,4-дифторпирролидин-2-карбоновая кислота ]D=+68,4o(с=1% в метаноле).
б) (R)-1- {{2- [2- [(R)-2-карбокси-4,4-дифторпирролидин-1-ил] -2-оксоэтоксил] фенокси} ацетил} -4,4-дифторпирролидин-2-карбоновая кислота0,47 г (0,0007 моля) бензилового эфира (R)-1-{{2-[2-[(R)-2-бензилоксикарбонил-4,4-дифторпирролидин-1-ил] -2-оксоэтоксил] -фенокси} ацетил} -4,4-дифторпирролидин-2-карбоновой кислоты в 20 мл этанола гидрогенизовали при комнатной температуре и под атмосферным давлением в присутствии 0,09 г 5%-ного палладия на угле. По завершении этой реакции катализатор отфильтровывали, растворитель отгоняли и остаток растворяли в дихлорметане. В результате упаривания в виде светло-желтой пены получали 0,32 г (94%) (R)-1-{{ 2-[2-[ (R)2-карбокси-4,4-дифторпирролидин-1-ил] -2-оксоэтоксил] фенокси} ацетил} -4,4-дифторпирролидин-2-карбоновой кислоты. ISP-MC: 493 (МН)+; [  ]D=+46,8o(с=1% в диметилсульфоксиде).
Пример 102 ]D=+46,8o(с=1% в диметилсульфоксиде).
Пример 102(R)-1- {{4- [2- [(R)-2-карбокси-4,4-дифторпирролидин-1-ил] -2-оксоэтил] фенил} ацетил} -4,4-дифторпирролидин-2-карбоновая кислота а) Бензиловый эфир (R)-1- {{4- [2- [(R)-2-бензилоксикарбонил-4,4-дифторпирролидин-1-ил] – 2 -оксоэтил] фенил} ацетил} -4,4-дифторпирролидин-2-карбоновой кислоты В смесь 1,11 г (0,004 моля) гидрохлорида бензилового эфира (2R)-4,4-дифторпирролидин-2-карбоновой кислоты (1:1), 0,39 г (0,002 моля) 1,4-фенилендиуксусной кислоты, 1,21 г (0,012 моля) N-метилморфолина и 0,61 г (0,004 моля) гидрата 1-гидроксибензотриазола в 90 мл дихлорметана вводили 0,77 г (0,004 моля) гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида. После перемешивания при комнатной температуре в течение 18ч смесь экстрагировали 1н. НСl, водой, 10%-ным водным раствором бикарбоната натрия и вновь водой. В результате хроматографии на силикагеле с дихлорметаном/этилацетатом в соотношении 9:1 в виде бесцветного масла получали 0,72 г (56%) бензилового эфира (R)-1-{{4-[2-[ (R)-2-бензилоксикарбонил-4,4-дифторпирролидин-1-ил] -2-оксоэтил] фенил} ацетил} -4,4-дифторпирролидин-2-карбоновой кислоты. ISP-MC: 658 (МNH4 +); [  ]D=+55,5o(с=1% в метаноле).
б) (R)-1-{{4-[2-[(R)-2-карбокси-4,4-дифторпирролидин-1-ил] -2-оксоэтил] фенил} ацетил}-4,4-дифторпирролидин-2-карбоновая кислота ]D=+55,5o(с=1% в метаноле).
б) (R)-1-{{4-[2-[(R)-2-карбокси-4,4-дифторпирролидин-1-ил] -2-оксоэтил] фенил} ацетил}-4,4-дифторпирролидин-2-карбоновая кислота0,64 г (0,001 моля) бензилового эфира (R)-1-{{4-[2-[ (R)-2-бензилоксикарбонил-4,4-дифторпирролидин-1-ил] -2-оксоэтил] фенил} ацетил}] -4,4-дифторпирролидин-2-карбоновой кислоты в 20 мл этанола гидрогенизовали при комнатной температуре и под атмосферным давлением в присутствии 0,13 г 5%-ного палладия на угле. После завершения этой реакции катализатор отфильтровывали, растворитель отгоняли и остаток растворяли в дихлорметане. В результате упаривания в виде светло-желтой пены получали 0,28 г (61%) (R)-1- { {4- [2- [(R)-2-карбокси-4,4-дифторпирролидин-1-ил] – 2-оксоэтил] фенил} ацетил} -4,4-дифторпирролидин-2-карбоновой кислоты. ISP-MC: 478 (МNH4 +); [  ]D=+50,3o(с=0,33% в диметилсульфоксиде).
Пример 103 ]D=+50,3o(с=0,33% в диметилсульфоксиде).
Пример 103(R)-1- {6- [(R)-2-карбокси-2,5-дигидропиррол-1-ил] -6-оксогексаноил} -2,5 -дигидропиррол – 2 – карбоновая кислота а) Ди – (2- бензиловый.1- трет -бутиловый) эфир (2R, 4R)-4-(толуол-4-сульфонилокси)пирролидин-1.2-дикарбоновой кислоты Раствор 2,35 г (0,007 моля) ди-(2-бензилового,1-трет-бутилового) эфира (2R, 2R)-4-гидроксипирролидин-1,2-дикарбоновой кислоты в 22 мл пиридина при 5oС обрабатывали 1,53 г (0,008 моля) п-толуолсульфонилхлорида и выдерживали в холодильнике в течение 15 дней. Затем в вакууме отгоняли пиридин и остаток очищали хроматографией на силикагеле с дихлорметаном/этилацетатом в соотношении 95: 5 с получением в виде бесцветной жидкости 2,81 г (81%) ди-(2-бензилового, 1-трет-бутилового) эфира (2R, 4R)-4-(толуол-4 -сульфонилокси) пирролидин -1,2 -дикарбоновой кислоты. МС m/е (%): 376 (2), 340 (10), 284 (6), 240 (21), 91 (48), 68 (100), 57 (63); [  ]D=+24,5o(с=1% в метаноле).
б) Ди-(1-трет-бутиловый, 2-этиловый) эфир (2R, 4R)-4-фенилселанилпирролидин-1,2-дикарбоновой кислоты ]D=+24,5o(с=1% в метаноле).
б) Ди-(1-трет-бутиловый, 2-этиловый) эфир (2R, 4R)-4-фенилселанилпирролидин-1,2-дикарбоновой кислотыРаствор 7,99 г (0,026 моля) дифенилдиселенида в 250 мл этанола обрабатывали 1,59 г (0,042 моля) боргидрида натрия и перемешивание продолжали до тех пор, пока желтый раствор не превратился в бесцветный. После добавления 20,0 г (0,042 моля) ди-(2-бензилового, 1-трет-бутилового) эфира (2R, 4R) -4- (толуол-4-сульфонилокси)пирролидин-1,2-дикарбоновой кислоты смесь кипятили с обратным холодильником в течение 2,5 ч. Белый осадок отфильтровывали и в вакууме отгоняли растворитель. В результате хроматографии на силикагеле с дихлорметаном/метанолом в соотношении 98/2 в виде бесцветного масла получали 8,48 г (51%) ди-(1-трет-бутилового,2-этилового) эфира (2R, 4S)-4-фенилселанилпирролидин-1,2-дикарбоновой кислоты. MC m/e (%): 399 (7), 326 (13), 270 (18), 226 (38), 186 (35), 68 (60), 57 (100), 41 (28). [  ]D=+40,4o(с=1% в метаноле).
Кроме того, в виде бесцветного масла выделяли 0,6 г ди-(2-бензилового, 1-трет-бутилового) эфира (2R, 4S) -4-фенилселанилпирролидин-1,2-дикарбоновой кислоты.
MC m/e (%): 461 (7), 326 (21), 270 (37), 248 (48), 226 (49), 209 (30), 91 (100), 68 (54), 57 (96). [ ]D=+40,4o(с=1% в метаноле).
Кроме того, в виде бесцветного масла выделяли 0,6 г ди-(2-бензилового, 1-трет-бутилового) эфира (2R, 4S) -4-фенилселанилпирролидин-1,2-дикарбоновой кислоты.
MC m/e (%): 461 (7), 326 (21), 270 (37), 248 (48), 226 (49), 209 (30), 91 (100), 68 (54), 57 (96). [ ]D=+33,2o(с=1% в метаноле).
в) Ди-(1-трет-бутиловый. 2-этиловый) эфир (R) – 2,5-дигидропиррол-1,2-дикарбоновой кислоты ]D=+33,2o(с=1% в метаноле).
в) Ди-(1-трет-бутиловый. 2-этиловый) эфир (R) – 2,5-дигидропиррол-1,2-дикарбоновой кислотыВ перемешиваемый раствор 7,35 г (0,016 моля) ди-(1-трет-бутилового, 2-этилового) эфира (2R, 4S) -4-фенилселанилпирролидин-1,2-дикарбоновой кислоты в 80 мл дихлорметана при 0-5oС вводили 1,93 мл (0,024 моля) пиридина и 4,6 мл 30%-ной перекиси водорода и перемешивание продолжали в течение 1,5 ч. Смесь экстрагировали 5%-ной НСI, насыщенным водным раствором карбоната натрия и водой. В результате хроматографии на силикагеле с этилацетатом/гексаном в соотношении 1: 5 в виде бесцветного масла получали 2,99 г (77%) ди-(1-трет-бутиловый, 2-этиловый) эфира (R) -2,5-дигидропиррол-1,2-дикарбоновой кислоты. MC m/e (%): 186 (11), 168 (48), 140 (32), 112 (100), 68 (85), 57 (58). [  ]D=+242o(с=1% в хлороформе).
г) Трифторацетат этилового эфира (R) -2,5-дигидро-1Н-пиррол-2-карбоновой кислоты (1:1) ]D=+242o(с=1% в хлороформе).
г) Трифторацетат этилового эфира (R) -2,5-дигидро-1Н-пиррол-2-карбоновой кислоты (1:1)1,5 г (0,006 моля) ди-(1-трет-бутилового, 2-этилового) эфира (R)-2,5-дигидропиррол-1,2-дикарбоновой кислоты при 5oС с перемешиванием растворяли в 10 мл трифторуксусной кислоты и перемешивание продолжали при комнатной температуре в течение 3 ч. В результате выпаривания растворителя в вакууме в виде желтого масла получали 2,05 г (количественный выход) трифторацетата этилового эфира (R)-2,5-дигидро-1Н-пиррол-2-карбоновой кислоты (1:1). MC m/e (%): 142 (1), 68 (100), 45 (10), 41 (15). [  ]D=+95,4o(с = 1% в метаноле).
д) Этиловый эфир (R) -1-{6-[(R) -2-этилоксикарбонил-2,5-дигидропиррол-1-ил] -6-оксогексаноил} -2,5-дигидропиррол-2-карбоновой кислоты ]D=+95,4o(с = 1% в метаноле).
д) Этиловый эфир (R) -1-{6-[(R) -2-этилоксикарбонил-2,5-дигидропиррол-1-ил] -6-оксогексаноил} -2,5-дигидропиррол-2-карбоновой кислотыВ суспензию 0,99 г (0,003 моля) трифторацетата этилового эфира (R)-2,5-дигидро-1Н-пиррол-2-карбоновой кислоты (1:1) в 20 мл дихлорметана вводили 1,3 мл (0,009 моля) триэтиламина и 0,22 мл (0,0015 моля) адипоилдихлорида в 5 мл дихлорметана. После перемешивания при комнатной температуре в течение ночи смесь экстрагировали 1н. НСl, водой и водным раствором бикарбоната натрия и сушили над сульфатом натрия. В результате хроматографии на силикагеле с этилацетатом в в виде желтого масла получали 0,37 г (32%) этилового эфира (R)-1- {6- [(R) -2-этилоксикарбoнил-2,5-дигидропиррол-1-ил] -6-оксогексаноил} -2,5-дигидропиррол-2-карбоновой кислоты. ISP-MC: 393 (МН)+. е) (R)-1- {6- [(R) -2-карбокси-2,5-дигидропиррол-1-ил] -6-оксогексаноил} -2,5-дигидропиррол-2-карбоновая кислота 0,09 г (0,0002 моля) этилового эфира (R) -1-{6-[(R) -2-этилоксикарбонил-2,5-дигидропиррол-1-ил]-6-оксогексаноил] -2,5-дигидропиррол-2-карбоновой кислоты перемешивали при 50oС в течение 3 ч с водным раствором НСl. Растворитель выпаривали, остаток растворяли в воде и лиофилизировали с получением в виде светло-желтой пены 0,08 г (97%) (R)-1-{6- [(R) -2-карбокси-2,5-дигидропиррол-1-ил] -6-оксогексаноил} -2,5-дигидропиррол-2-карбоновой кислоты. ISP-MC: 335 (М-Н])–. Пример 104 (R)-1- { {2-[2-[(R) -2-карбокси-2,5-дигидропиррол-1-ил] -2-оксоэтоксил] фенокси} ацетил}-2,5-дигидропиррол-2-карбоновая кислота а) Этиловый эфир (R)-1- {{2- [2- [(R) -2-этилкарбонил-2,5-дигидропиррол-1-ил] – 2-оксоэтоксил] фенокси} ацетил} -2,5-дигидропиррол-2-карбоновой кислоты В смесь 0,99 г (0,003 моля) трифторацетата этилового эфира (R)-2,5-дигидро-1Н-пиррол-2-карбоновой кислоты (1:1), 0,34 г (0,0015 моля) 1,2-фенилендиоксидиуксусной кислоты, 1,3 мл (0,012 моля) N-метилморфолина и 0,46 г (0,003 моля) гидрата 1-гидроксибензотриазола в 80 мл дихлорметана вводили 0,57 г (0,003 моля) гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида. После перемешивания при комнатной температуре в течение 18 ч смесь экстрагировали 1н. НСl, водой, 10%-ным водным раствором бикарбоната натрия и вновь водой. В результате хроматографии на силикагеле с этилацетатом в виде бесцветного масла получали 0,45 г (32%) этилового эфира (R)-1- {{2- [2- [(R) -2-этилкарбонил-2,5-дигидропиррол-1-ил] -2-оксоэтоксил] фенокси}ацетил} -2,5-дигидропиррол-2-карбоновой кислоты. ISP-MC: 473 (МН)+. б) (R)-1- {{2-[2-[(R) -2-карбокси-2,5-дигидропиррол-1-ил] -2-оксоэтоксил] фенокси} ацетил}-2,5-дигидропиррол-2-карбоновая кислота 0,17 г (0,0004 моля) этилового эфира (R)-1-{{2-[2-[(R) -2-этилкарбонил-2,5-дигидропиррол-1-ил] -2-оксоэтоксил] фенокси} ацетил} -2,5-дигидропиррол-2-карбоновой кислоты при 50oС в течение 3 ч перемешивали с водным раствором НСl. Растворитель выпаривали, остаток растворяли в воде и лиофилизировали с получением в виде белого аморфного порошка 0,13 г (86%) (R)-1- { { 2- [2- [(R) -2-карбокси-2,5-дигидропиррол-1-ил] -2-оксоэтоксил] фенокси} ацетил} -2,5-дигидропиррол-2-карбоновой кислоты. ISP-MC: 417 (МН)+. Пример А По обычной методике изготавливали таблетки следующего состава, мг/таблетк: Действующее вещество – 100 Порошкообразная лактоза – 95 Белый кукурузный крахмал – 35 Поливинилпирролидон – 8 Na-Карбоксиметилпроизводное крахмала – 10 Стеарат магния – 2 Масса таблетки – 250 Пример Б По обычной методике изготавливали таблетки следующего состава, мг/таблетку: Действующее вещество – 200 Порошкообразная лактоза – 100 Белый кукурузный крахмал – 64 Поливинилпирролидон – 12 Na-Карбоксиметилпроизводное крахмала – 20 Стеарат магния – 4 Масса таблетки – 400 Пример В Изготовливали капсулы следующего состава, мг/капсулу: Действующее вещество – 50 Кристаллическая лактоза – 60 Микрокристаллическая целлюлоза – 34 Тальк – 5 Стеарат магния – 1 Масса содержимого капсулы – 150 Действующий компонент, характеризующийся приемлемым размером частиц, кристаллическую лактозу и микрокристаллическую целлюлозу гомогенно смешивают между собой, просеивают, после чего примешивают тальк и стеарат магния. Готовой смесью наполняют твердые желатиновые капсулы соответствующего размера. Формула изобретения
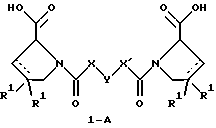 или 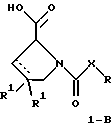 где R – SH, бензил или фенил, необязательно замещенный гидроксигруппой или низшей алкоксигруппой, или группа формулы 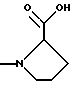 R1 – водород или галоген; Х – -(CH2)n-; -СН(R2)(CH2)n-; -СН2O(CH2)n-; CH2NH-; бензил, -C(R2)=СН-; СН2СН(ОН)- или тиазол-2,5-диил; Y – -S-S-; -(CH2)n-; -О-; -NH-; -N (R2)-; -СН=СН-; -NHC(O)NH-; -N(R2)C(O)N(R2)-; -Н[СН2С6Н3(ОСН3)2]-; -N(CH2C6H5)-; -N(CH2C6H5)C(O)N(CH2C6H5)-; -N(алкоксиалкил)-; -N(циклоалкилметил)-; 2,6-пиридил; 2,5-фуранил; 2,5-тиенил; 1,2-циклогексил; 1,3-циклогексил; 1,4-циклогексил; 1,2-нафтил; 1,4-нафтил; 1,5-нафтил; 1,6-нафтил или дифенилен; 1,2-фенилен; 1,3-фенилен или 1,4-фенилен, где фениленовые группы необязательно замещены 1-4 заместителями, выбранными из группы, включающей галоген, низший алкил, низшую алкоксигруппу, гидроксигруппу, карбоксигруппу, -СОО-низший алкил, нитрил, 5-тетразол, (2-карбокси-пирролидин-1-ил)-2-оксоэтоксигруппу, N-гидроксикарбамимидоил, 5-оксо- [1,2,4]оксадиазолил, 2-оксо-[1,2,3,5] оксатиадиазолил, 5-тиоксо-[1,2,4]оксадиазолил и 5-третбутилсульфанил-[1,2,4]оксадиазолила; X’ – -(CH2)n-; (CH2)nCH(R2)-; -(CH2)nОСН2-; -NHCH2-; бензил, -СН-С(R2)-; -CH(OH)CH2– или тиазол-2,5-диил; R2 – низший алкил, низшая алкоксигруппа или бензил; n = 0-3, их фармацевтически приемлемые соли, моно- и диэфиры, за исключением (R)-1-[(R)- и (R)-1-[(S)-3-меркапто-2-метилпропионил]пирролидин-2-карбоновых кислот. 2. Соединения общей формулы I-A по п.1. 3. Соединения по п.2, где Х – -CH(R2 )(CH2)n-, R2 – метил или метокси, а n = 0 или 1. 4. Соединения по п.3, которые представляют собой (R)-1{ (S)-3[(S)-3-[(R)-2-карбоксипирролидин-1-ил] -2-метил-3-оксопропилдисульфанил]-2-метилпропионил}пирролидин-2-карбоновую кислоту, (R)-1-{8-[(R)-2-карбоксипирролидин-1-ил]-2,7-диметил-8-оксооктаноил}пирролидин-2-карбоновую кислоту, (R)-1-{ 8-[(R)-2-карбоксипирролидин-1-ил] -2,7-диметокси-8-оксооктаноил] пирролидин-2-карбоновую кислоту и (R)-1-{ 6-[(К)-2-карбоксипирролидин-1-ил] -2,5-диметил-6-оксогексаноил] пирролидин-2-карбоновую кислоту (смесь 3 диастереоизомеров). 5. Соединения по п.2, где Х – -(CH2)n-, а n = 0 или 1. 6. Соединения по п.5, которые представляют собой (R)-1-{ 7-[(R)-2-карбоксипирролидин-1-ил]-7-оксогептаноил}пирролидин-2-карбоновую кислоту, (R)-1-{ 6-[(R)-2-карбоксипирролидин-1-ил]-6-оксогексаноил}пирролидин-2-карбоновую кислоту, (R)-1-{ 5-[(R)-2-карбоксипирролидин-1-ил]-5-оксопентаноил}пирролидин-2-карбоновую кислоту, (R)-1-{ { 4-[2-[(R)-2-карбоксипирролидин-1-ил] -2-оксоэтил]фенил}ацетил} пирролидин-2-карбоновую кислоту, (R)-1-{3-[2-[(R)-2-карбоксипирролидин-1-ил]-2-оксоэтокси]уреидо]пирролидин-2-карбоновую кислоту, (R)-1-{ {бензил-[2-[(R)-2-карбоксипирролидин-1-ил]-2-оксоэтил]амино]ацетил пирролидин-2-карбоновую кислоту, (R)-1-{ цис-4-[(R)-2-карбоксипирролидин-1-карбонил] циклогексанкарбонил} пирролидин-2-карбоновую кислоту и (R)-1-{ { 3-[2-[(R)-2-карбоксипирролидин-1-ил] -2-оксоэтил]фенил}ацетил} пирролидин-2-карбоновую кислоту. 7. Соединения по п.2, где Х – -СН2О-. 8. Соединения по п.7, которые представляют собой (R)-1-{ { 2-[2-[(R)-2-карбоксипирролидин-1-ил]-2-оксоэтокси]фенокси}ацетил}пирролидин-2-карбоновую кислоту, (R)-1-{ { 4-[2-[(R)-2-карбоксипирролидин-1-ил]-2-оксоэтокси]фенокси}ацетил}пирролидин-2-карбоновую кислоту, (R)-1-{ { 4-[2-[(R)-2-карбоксипирролидин-1-ил] -2-оксоэтокси]-2-метоксифенокси}ацетил}пирролидин-2-карбоновую кислоту, (R)-1-{ { 3-[2-[(R)-2-карбоксипирролидин-1-ил]-2-оксоэтокси]фенокси}ацетил}пирролидин-2-карбоновую кислоту, (R)-1-{ { 3-[2-[(R)-2-карбоксипирролидин-1-ил] -2-оксоэтокси]-2-метилфенокси}ацетил}пирролидин-2-карбоновую кислоту и (R)-1-{ { 5-[2-[(R)-2-карбоксипирролидин-1-ил]-2-оксоэтокси]нафталин-1-илокси}ацетил}пирролидин-2-карбоновую кислоту. 9. Соединения по п.2, где Х – -CH2NH. 10. Соединение по п.9, которое представляет собой (R)-1-{{4-[2-[(R)-2-карбоксипирролидин-1-ил] -2-оксоэтиламино] фениламино} ацетил}пирролидин-2-карбоновую кислоту. 11. Соединения по п.2, где Х – -СН2СH(ОН)-. 12. Соединение по п.11, которое представляет собой (2Е, 4E)-(R)-1-{6-[(R)-2-карбоксипирролидин-1-ил]-2,5-диметил-6-оксогекса-2,4-диеноил}пиррoлидин-2-карбоновую кислоту. 13. Лекарственное средство, обладающее амилоидозной активностью, содержащее соединение по любому из пп.1-12, (R)-1-[(R) – или (R)-1-[(S)-3-меркапто-2-метилпропионил] пирролидин-2-карбоновую кислоту, или ее фармацевтически приемлемую соль, или ее моно- или диэфир, а также терапевтически инертный носитель. 14. Способ получения соединений по любому из пп.1-12, который включает удаление защитной группы из соединений формул 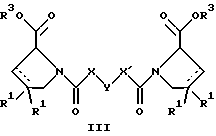 и 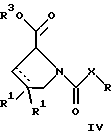 где R, R1, X, Y и X’ имеют указанные в п.1 значения; R3 обозначает защитную группу, с получением соединений формулы I-A или I-B и при необходимости превращение соединений общей формулы I-A или I-B в их фармацевтически приемлемые соли или моно- и диэфиры. 15. Соединения по любому из пп.1-12, полученные в любом случае способом по п.14. Приоритет по пунктам: 31.10.1997 по пп. 3, 5, 7, 13-15; 24.07.1998 по пп. 1, 2, 4, 6, 8-12. РИСУНКИ
|
||||||||||||||||||||||||||
