Патент на изобретение №2201936
|
||||||||||||||||||||||||||
(54) УЛУЧШЕННЫЙ СПОСОБ ПОЛУЧЕНИЯ АДДУКТОВ АМИНОВ С О-ГИДРОКСИАЛЬДЕГИДАМИ, ЯВЛЯЮЩИХСЯ ОСНОВАНИЯМИ ШИФФА, И АДДУКТНЫЙ КОНЕЧНЫЙ ПРОДУКТ КОНДЕНСАЦИИ
(57) Реферат: Изобретение относится к усовершенствованному способу получения аддуктных конечных продуктов конденсации, являющихся основаниями Шиффа, компоненты которых включают в себя белок, обладающий полезной активностью у животных, и ароматический о-гидроксиальдегид, при котором соединяют вышеупомянутые компоненты в водной среде при рН 7,0 или выше с образованием реакционной смеси в условиях, эффективных для проведения указанной реакции конденсации по существу до завершения, путем использования стадии быстрого по сравнению с сушкой в условиях окружающей среды удаления 97,0 – 99,9% по массе, предпочтительно приблизительно 98,0 – 99,0% по массе воды, уже присутствующей или образующейся в ходе указанной реакции конденсации, согласуясь с поддержанием целостности реагентов конденсации и аддуктного конечного продукта. Предпочтительные ароматические о-гидроксиальдегиды включают в себя о-ванилин, салициловый альдегид, 2,3-дигидроксибензальдегид, 2,6-дигидроксибензальдегид, 2-гидрокси-3-этоксибензальдегид или пиридоксаль. Может быть использован очень широкий диапазон белков. Улучшенный способ обеспечивает выходы свыше 90% и по существу количественное превращение альдегида и белка в конденсационный аддукт. 2 с. и 13 з.п.ф-лы, 6 табл. 10 ил. Областью техники, к которой относится настоящее изобретение, является синтез органических молекул, включающих в себя аддукты аминов с альдегидами или кетонами, являющиеся основаниями Шиффа, которые обладают улучшенной стабильностью и другими желательными свойствами. Настоящее изобретение, в частности, касается экономичных и эффективных способов получения больших количеств таких продуктов присоединения в промышленном масштабе. Вышеупомянутая область техники, в частности, касается тех аддуктов, которые содержат аминный компонент, представляющий собой белок, обладающий общепризнанной ценностью при лечении животных и людей, и в которых продукт присоединения обладает улучшенными свойствами, относящимися к его введению и фармакокинетике. Настоящее изобретение основано на неожиданном открытии того, что указанные вышеупомянутые аддуктные продукты можно получить простым, воспроизводимым и заменяемым способом с количественными выходами путем использования сушки вымораживанием, распылительной сушки или близких способов для осуществления основной реакции и поддержания рН реакционной смеси на уровне 7,0 или выше с требованием, чтобы альдегидный реагент выбирался из ароматических орто-гидроксиальдегидов. Это открытие широко применимо ко всем белковым реагентам, которые удовлетворяют определенным критериям, касающимся их полезности, которые более подробно описаны ниже. Настоящее изобретение относится, например, к получению аддукта соматотропина свиньи и ароматического орто-гидроксиальдегида, о-ванилина, являющегося основанием Шиффа. Соматотропин свиньи представляет собой гормон роста, который используют для улучшения эффективности питания свиней. Предпосылки изобретения Из области техники, наиболее близкой к настоящему изобретению, известно, что аминное соединение, в частности белок, может быть улучшено в отношении его стабильности и характеристик обработки путем его взаимодействия с альдегидом или кетоном. Например, цитохром с реагирует с салициловым альдегидом легко обратимым способом, который дает возможность изучать влияние модификации заряда на свойства белка. В отличие от большинства описаний в технической литературе описание в работе Вилльямса и Жакоба (Williams and Jacobs, Biochim. Blophys. Acta, 154 (1968), 323-331) включает в себя выделение конечного продукта, представляющего собой аддукт, являющийся основанием Шиффа. Смесь салицилового альдегида и цитохрома с осаждают и о полном превращении можно судить, исходя из длительных используемых времен установления равновесия. Образование аддукта, которое включено в это описание, можно проиллюстрировать следующей частичной формулой: 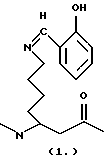 где первичный амин представляет собой  -аминогруппу на молекуле лизина, которая реагирует с карбонильной группировкой молекулы салицилового альдегида с образованием имина, который может быть представлен как R-(R-)C=N-R. Такие имины обычно называют основаниями Шиффа и их получение, как правило, осуществляется с использованием кислотного или основного катализа или при нагревании. Образование оснований Шиффа, как правило, проводится до завершения путем осаждения имина, удаления воды или обеих этих процедур.
В качестве еще одного примера такого использования в технике можно привести следующее. Серповидные эритроциты обрабатывают рядом альдегидов и кетонов с образованием иминных связей с аминогруппами внутриклеточного гемоглобина (см. Zaugg et al., J. Biol. Chem., 252(23) (1977), 8542-8548). Обнаружено, что ароматические альдегиды являются более реакционноспособными, чем их алифатические аналоги, и что кетоны являются нереакционноспособными. Влияние замещения по кольцу на такую реакционную способность согласуется с обычными ожиданиями, касающимися электронных и стерических эффектов. В частности, 2,4-дигидроксибензальдегид и о-ванилин заметно увеличивали сродство гемоглобинов А и S к кислороду. Тем не менее, не существуют указаний на то, что о-гидроксиальдегиды являются существенными для получения количественных выходов при изготовлении аддуктов с белками, являющихся основаниями Шиффа.
В технической литературе существуют редкие примеры являющихся основаниями Шиффа аддуктов с аминами, отличными от белков, например небольшими молекулами фармацевтических средств. Фудживара и др. (Fujiwara et al.) в Chem. Pharm. Bull., 30 (1982), 3310 и в Chem. Pharm. Bull. 31(4) (1983), 1335-1344 ссылаются на образование аддуктов цефалексина, антибиотика цефалоспорина и альдегидов. Тем не менее, не существует предложений использовать о-гидроксиальдегиды; и хотя продукты получают с использованием сушки вымораживанием их щелочных растворов, эта ссылка не предлагает способ получения по настоящему изобретению и количественные выходы, получаемые с его использованием.
Основания Шиффа использовали до сих пор в аналитических способах для определения молекулярных масс белков, а также для измерения количества первичных аминосайтов (N-конец плюс остатки лизина) в белке. Например, работа Le Blanc et al. in Anal. Chem., 66 (1994), 3289-3296 касается исследования равновесии белок-кетон в растворе с использованием масс-спектрометрии с электрораспылением. Используют ацетон, но не предлагают использовать ароматические о-гидроксиальдегиды.
Анализ с использованием масс-спектрометрии с электрораспылением используют для исследования крупных белков, например инсулина, убиквитина и гемоглобина, и также используют в сочетании со способом по настоящему изобретению для того, чтобы обеспечить правильные и точные средства определения степени, в которой образуются аддукты, являющиеся основаниями Шиффа. Традиционные способы определения количества образовавшихся оснований Шиффа между альдегидами и аминами не являются эффективными, когда амин представляет собой крупный белок, поскольку эти способы обычно представляют собой способы в растворе, и когда выделяемый аддукт, являющийся основанием Шиффа, растворяют в воде, происходит обратная реакция, которая приводит в результате к равновесной смеси. Тем не менее, Ле Бланк использует ацетон и не предлагает использовать ароматические о-гидроксиальдегиды.
Конъюгаты, связанные с основанием Шиффа, использовали в качестве линкера между нацеливающим белком и одним или более чем одним диагностическим или терапевтическим агентом (смотри, например, Reed, US 5633351). Нацеливающий белок связывается с определенной популяцией клеток, таких как субстрат для рецептора или фермента, а терапевтический агент представляет собой лекарство, токсин или радионуклид, тогда как диагностический агент представляет собой радионуклид. Используемая связь посредством основания Шиффа имеет следующую структуру: -аминогруппу на молекуле лизина, которая реагирует с карбонильной группировкой молекулы салицилового альдегида с образованием имина, который может быть представлен как R-(R-)C=N-R. Такие имины обычно называют основаниями Шиффа и их получение, как правило, осуществляется с использованием кислотного или основного катализа или при нагревании. Образование оснований Шиффа, как правило, проводится до завершения путем осаждения имина, удаления воды или обеих этих процедур.
В качестве еще одного примера такого использования в технике можно привести следующее. Серповидные эритроциты обрабатывают рядом альдегидов и кетонов с образованием иминных связей с аминогруппами внутриклеточного гемоглобина (см. Zaugg et al., J. Biol. Chem., 252(23) (1977), 8542-8548). Обнаружено, что ароматические альдегиды являются более реакционноспособными, чем их алифатические аналоги, и что кетоны являются нереакционноспособными. Влияние замещения по кольцу на такую реакционную способность согласуется с обычными ожиданиями, касающимися электронных и стерических эффектов. В частности, 2,4-дигидроксибензальдегид и о-ванилин заметно увеличивали сродство гемоглобинов А и S к кислороду. Тем не менее, не существуют указаний на то, что о-гидроксиальдегиды являются существенными для получения количественных выходов при изготовлении аддуктов с белками, являющихся основаниями Шиффа.
В технической литературе существуют редкие примеры являющихся основаниями Шиффа аддуктов с аминами, отличными от белков, например небольшими молекулами фармацевтических средств. Фудживара и др. (Fujiwara et al.) в Chem. Pharm. Bull., 30 (1982), 3310 и в Chem. Pharm. Bull. 31(4) (1983), 1335-1344 ссылаются на образование аддуктов цефалексина, антибиотика цефалоспорина и альдегидов. Тем не менее, не существует предложений использовать о-гидроксиальдегиды; и хотя продукты получают с использованием сушки вымораживанием их щелочных растворов, эта ссылка не предлагает способ получения по настоящему изобретению и количественные выходы, получаемые с его использованием.
Основания Шиффа использовали до сих пор в аналитических способах для определения молекулярных масс белков, а также для измерения количества первичных аминосайтов (N-конец плюс остатки лизина) в белке. Например, работа Le Blanc et al. in Anal. Chem., 66 (1994), 3289-3296 касается исследования равновесии белок-кетон в растворе с использованием масс-спектрометрии с электрораспылением. Используют ацетон, но не предлагают использовать ароматические о-гидроксиальдегиды.
Анализ с использованием масс-спектрометрии с электрораспылением используют для исследования крупных белков, например инсулина, убиквитина и гемоглобина, и также используют в сочетании со способом по настоящему изобретению для того, чтобы обеспечить правильные и точные средства определения степени, в которой образуются аддукты, являющиеся основаниями Шиффа. Традиционные способы определения количества образовавшихся оснований Шиффа между альдегидами и аминами не являются эффективными, когда амин представляет собой крупный белок, поскольку эти способы обычно представляют собой способы в растворе, и когда выделяемый аддукт, являющийся основанием Шиффа, растворяют в воде, происходит обратная реакция, которая приводит в результате к равновесной смеси. Тем не менее, Ле Бланк использует ацетон и не предлагает использовать ароматические о-гидроксиальдегиды.
Конъюгаты, связанные с основанием Шиффа, использовали в качестве линкера между нацеливающим белком и одним или более чем одним диагностическим или терапевтическим агентом (смотри, например, Reed, US 5633351). Нацеливающий белок связывается с определенной популяцией клеток, таких как субстрат для рецептора или фермента, а терапевтический агент представляет собой лекарство, токсин или радионуклид, тогда как диагностический агент представляет собой радионуклид. Используемая связь посредством основания Шиффа имеет следующую структуру: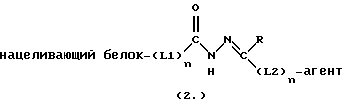 где “L1” и “L2” представляют собой гетеробифункциональные линкеры, имеющие активную группу гидразида или альдегида/кетона на одном конце линкера. Тем не менее, не предложено использовать ароматический о-гидроксиальдегид при рН  7,0 для получения количественных выходов конечного продукта, представляющего собой аддукт, являющийся основанием Шиффа.
На стабилизированный соматотропин для парентерального введения ссылаются в работе Кларка и др. (Clark et al., US 5198422), в которой предпочтительный ароматический альдегид, как утверждают, представляет собой 2-гидрокси-3-метоксибензальдегид, то есть о-ванилин. Тем не менее, Кларк и др. ссылаются лишь на терапевтические преимущества гормона роста соматотропина, получаемые, когда продукт выделяют в кристаллической форме. Хотя в общем упоминают о выделении с использованием лиофилизации, очевидно, что способы выделения, рассматриваемые Кларком и др., представляют собой способы типа “сушки”, то есть включающие в себя сушку в течение длительных периодов, примером чего является сушка в течение ночи в вакуумной печи. Эта ссылка, следовательно, не предлагает способ получения по настоящему изобретению.
В технической литературе существуют лишь ограниченные ссылки на аддукты, являющиеся основаниями Шиффа, получаемые распылительной сушкой. Например, работа Томлинсона и др. (Tomlinson et al., Food Chemistry, 48 (1993), 373-379) касается распылительной сушки водного раствора глюкозы и глицина. Этот способ позволяет получить коричневый порошок, потенциально полезный при окрашивании продуктов питания. Реальный используемый химический способ представляет собой реакцию Мэйларда (Maillard) или реакцию “поджаривания”, в которой аминогруппы белков реагируют с гидроксильными группами сахаров с образованием коричневых пигментов.
Вышеупомянутая работа Томлинсона и др. ссылается и основана на более ранней работе Байнеса и др. (Baines et al., US 4886659), которая также касается получения окрашенных соединений для использования в пищевой химии. Байнес и др. предполагают, что цвета можно получать из исходных веществ Мэйларда в очень кратковременных реакционных условиях распылительной сушки, например при времени реакции меньше десяти секунд или иногда меньше одной секунды перед тем, как вся вода выпарится, эффективно завершая реакцию.
Также ссылаются на использование стационарнго распылительного сопла или вращающегося диска, настройки которых отрегулированы для контролирования размера капли, размера сухой частицы и других характеристик капли. Полагают, что температура реакции приближается к температуре выходящего воздуха. Также упоминают о предварительном нагревании водного раствора, например до 60oС, перед загрузкой в распылительную сушилку, и содержание влаги в продукте, как утверждают, составляет 3,5-15% по массе. Также ссылаются на распылительную сушку с использованием вращающегося диска со скоростью вращения диска 35000-40000 об/мин.
Тем не менее, Томлинсон и др. и Байнес и др. не предлагают способ получения по настоящему изобретению, поскольку они рассматривают реакцию Мэйларда, которая во всех отношениях представляет собой в целом отличающийся способ. Реакция Мэйларда, как правило, необратима и ведет к образованию олигомеров. Эти характеристики ограничивают пригодность реакции Мэйларда для способа получения темных пигментов.
Дхонт (Dhont, Proc. Int. Symp. Aroma Research, Zeist, (1975) 193-194) ссылается на работу по ароматизации синтетических продуктов питания, таких как продукты питания, получаемые из белка сои. Упоминается сушка вымораживанием раствора альбумина и ванилина, причем приблизительно 90% добавляемого ванилина связывается белком, хотя указывается, что белок удерживает некоторое количество ванилина путем инкапсуляции или адсорбции. Предложено образование оснований Шиффа; тем не менее ванилин не представляет собой о-гидроксиальдегид и не достигает полного превращения реагентов в основания Шиффа. Соответственно, способ, используемый Дхонтом, не является тем же самым, что и способ по настоящему изобретению, и он его не предлагает.
Краткое изложение сущности изобретения 7,0 для получения количественных выходов конечного продукта, представляющего собой аддукт, являющийся основанием Шиффа.
На стабилизированный соматотропин для парентерального введения ссылаются в работе Кларка и др. (Clark et al., US 5198422), в которой предпочтительный ароматический альдегид, как утверждают, представляет собой 2-гидрокси-3-метоксибензальдегид, то есть о-ванилин. Тем не менее, Кларк и др. ссылаются лишь на терапевтические преимущества гормона роста соматотропина, получаемые, когда продукт выделяют в кристаллической форме. Хотя в общем упоминают о выделении с использованием лиофилизации, очевидно, что способы выделения, рассматриваемые Кларком и др., представляют собой способы типа “сушки”, то есть включающие в себя сушку в течение длительных периодов, примером чего является сушка в течение ночи в вакуумной печи. Эта ссылка, следовательно, не предлагает способ получения по настоящему изобретению.
В технической литературе существуют лишь ограниченные ссылки на аддукты, являющиеся основаниями Шиффа, получаемые распылительной сушкой. Например, работа Томлинсона и др. (Tomlinson et al., Food Chemistry, 48 (1993), 373-379) касается распылительной сушки водного раствора глюкозы и глицина. Этот способ позволяет получить коричневый порошок, потенциально полезный при окрашивании продуктов питания. Реальный используемый химический способ представляет собой реакцию Мэйларда (Maillard) или реакцию “поджаривания”, в которой аминогруппы белков реагируют с гидроксильными группами сахаров с образованием коричневых пигментов.
Вышеупомянутая работа Томлинсона и др. ссылается и основана на более ранней работе Байнеса и др. (Baines et al., US 4886659), которая также касается получения окрашенных соединений для использования в пищевой химии. Байнес и др. предполагают, что цвета можно получать из исходных веществ Мэйларда в очень кратковременных реакционных условиях распылительной сушки, например при времени реакции меньше десяти секунд или иногда меньше одной секунды перед тем, как вся вода выпарится, эффективно завершая реакцию.
Также ссылаются на использование стационарнго распылительного сопла или вращающегося диска, настройки которых отрегулированы для контролирования размера капли, размера сухой частицы и других характеристик капли. Полагают, что температура реакции приближается к температуре выходящего воздуха. Также упоминают о предварительном нагревании водного раствора, например до 60oС, перед загрузкой в распылительную сушилку, и содержание влаги в продукте, как утверждают, составляет 3,5-15% по массе. Также ссылаются на распылительную сушку с использованием вращающегося диска со скоростью вращения диска 35000-40000 об/мин.
Тем не менее, Томлинсон и др. и Байнес и др. не предлагают способ получения по настоящему изобретению, поскольку они рассматривают реакцию Мэйларда, которая во всех отношениях представляет собой в целом отличающийся способ. Реакция Мэйларда, как правило, необратима и ведет к образованию олигомеров. Эти характеристики ограничивают пригодность реакции Мэйларда для способа получения темных пигментов.
Дхонт (Dhont, Proc. Int. Symp. Aroma Research, Zeist, (1975) 193-194) ссылается на работу по ароматизации синтетических продуктов питания, таких как продукты питания, получаемые из белка сои. Упоминается сушка вымораживанием раствора альбумина и ванилина, причем приблизительно 90% добавляемого ванилина связывается белком, хотя указывается, что белок удерживает некоторое количество ванилина путем инкапсуляции или адсорбции. Предложено образование оснований Шиффа; тем не менее ванилин не представляет собой о-гидроксиальдегид и не достигает полного превращения реагентов в основания Шиффа. Соответственно, способ, используемый Дхонтом, не является тем же самым, что и способ по настоящему изобретению, и он его не предлагает.
Краткое изложение сущности изобретенияНастоящее изобретение относится к новому улучшенному способу получения аддуктных конечных продуктов конденсации, являющихся основаниями Шиффа, компоненты которых включают в себя белок, обладающий полезной активностью у животных, и ароматический о-гидроксиальдегид. Способ получения по настоящему изобретению предлагает по существу количественное образование аддукта и увеличенные общие выходы конечного продукта. Способ по настоящему изобретению также относится к способу изготовления аддуктных конечных продуктов конденсации, который является легким, воспроизводимым, заменяемым, эффективным и экономичным. Указанный способ включает в себя соединение вместе вышеупомянутых компонентов в водной среде при рН 7,0 или выше с образованием реакционной смеси. Растворитель для реакционной смеси представляет собой воду, то есть среду, в которой происходит реакция, включая воду конденсации, образующуюся в ходе реакции, причем указанная реакция осуществляется в условиях, эффективных для проведения указанной реакции конденсации по существу до завершения путем удаления от приблизительно 97,0% до приблизительно 99,9% по массе, предпочтительно от приблизительно 98,0% до приблизительно 99,0% по массе воды, присутствующей во время указанной реакции конденсации, что совместимо с поддержанием целостности реагентов конденсации и конечного продукта, представляющего собой аддукт, с получающимся в результате выходом указанного аддуктного конечного продукта конденсации, равным или превышающим приблизительно 98,5% по массе, предпочтительно равным или превышающим приблизительно 99,5% по массе, основываясь на массе реагентов. Вышеописанную реакцию конденсации можно также осуществить в условиях пониженной влажности, посредством чего увеличивается скорость удаления воды и общее удаляемое количество. Предложено в соответствии с задачей проведения реакции конденсации до завершения путем удаления от приблизительно 97,0% до приблизительно 99,9% по массе присутствующей воды, чтобы количество влаги, присутствующей в конечном продукте, представляющем собой продукт конденсации, соответственно составляло от 3,0% до 0,001% по массе, оновываясь на массе конечного продукта, предпочтительно от 2,0% до 3,0% по массе, основываясь на массе указанного конечного продукта. После завершения реакции конденсации количество присутствующей влаги может быть уменьшено до 0,1% – 0,001% по массе, или до 0,05% – 0,005% по массе, или даже до 0,03% – 0,01% по массе, основываясь на массе конечного продукта. Кроме того, по существу большие количества влаги могут также присутствовать там, где это требуется для стабильности белка, в диапазоне от 3,0% до 20,0% по массе, предпочтительно от 5,0% до 15,0% по массе и более предпочтительно от 8,0% до 12,0% по массе, основываясь на массе конечного продукта. Ароматические о-гидроксиальдегиды, полезные в вышеописанном способе конденсации, предпочтительно включают в себя одно или более чем одно соединение формулы: 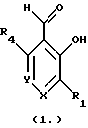 где R1 и R4 независимо выбраны из группы, состоящей по существу из водорода; гидрокси; галогено; нитро; циано; трифторметила; (С1-C6)алкила; (С1-C6)алкокси; (С3-C6)циклоалкила; (С2-C6)алкенила; -С(=О)ОR7, -ОС(=О)R7; -S(= О)2; -S(= О)2N(R7)(R9); -S(=О)2R7; -S(=О)20R7; -C(=О)NR7R9; -С(=О)R9 и -N(R7)(R9); где R7 представляет собой водород или (С1-С4)алкил и R9 представляет собой (С1-С4)алкил; где указанные алкильные, циклоалкильные и алкенильные группы, определяющие R1 и R4, могут возможно быть независимо замещены одним или двумя заместителями, выбранными из группы, состоящей по существу из галогено; гидрокси; (С1-С2)алкила; (С1-С2)алкокси; (С1-С2)алкокси-(С1-С2)алкила; (С1-С2)алкоксикарбонила; карбоксила; (С1-С2)алкилкарбонилокси; нитро; циано; амино, двузамещенного (С1-С2)алкилом; сульфонила и сульфонамидо, двузамещенного (С1-С2)алкилом; и Х и Y независимо представляют собой N или CHR2 или СНR3 соответственно, где R2 и R3 независимо выбраны из группы, состоящей по существу из водорода, гидрокси; галогено; нитро; циано; трифторметила; (С1-C6)алкила; (С1-C6)алкокси; (С3-C6)циклоалкила; (С2-C6)алкенила; -C(=O)OR11; -OC(=O)R11; -S(= O)2; -S(=O)2N(R11)(R13) и -N(R11)(R13), где R11 представляет собой водород или (С1-С4)алкил и R13 представляет собой (С1-С4)алкил и где указанные алкильные, циклоалкильные и алкенильные группы, определяющие R2 и R3, могут возможно быть независимо замещены одним или двумя заместителями, выбранными из группы, состоящей по существу из галогено; гидрокси; (С1-С2)алкила; (С1-С2)алкокси; (С1-С2)алкокси-(С1-С2)алкила; (С1-С2)алкоксикарбонила; карбоксила; (С1-С2)алкилкарбонилокси; нитро; циано; амино, двузамещенного (С1-С2)алкилом; сульфонила и сульфонамидо, двузамещенного (С1-С2)алкилом; Предпочтительно R1 и R4 независимо представляют собой водород; гидрокси; трифторметил; (С1-С4)алкил; (С1-С4)алкокси; -С(=O)ОR7 или N(R7)(R9); где R7 представляет собой водород или (С1-С2)алкил и R9 представляет собой (С1-С2); и более предпочтительно R1 и R4 независимо представляют собой водород; гидрокси; (С1-С2)алкил; (С1-С2)алкокси; карбоксил или метиламино, в этом случае R7 представляет собой водород и R9 представляет собой метил. Предпочтительно, когда R1 и R4 определены как алкил и замещены, то тогда существует единственный заместитель, выбранный из гидрокси; (С1-С2)алкокси; карбоксила; амино, двузамещенного (С1-С2)алкилом; и сульфонамидо, двузамещенного (С1-С2)алкилом; и более предпочтительно указанный одиночный заместитель выбирают из гидрокси, метокси и диметиламино. Предпочтительно один из Х или Y представляет собой N и другой представляет собой CHR2 или СНR3 соответственно; более предпочтительно Х представляет собой CHR2 и Y представляет собой CHR3, где R2 и R3 предпочтительно независимо представляют собой водород; гидрокси; галогено; трифторметил; (С1-С4)алкил; (С1-С4)алкокси; -C(= O)OR11; -S(= O)2N(R11)(R13); или -N(R11)(R13), где R11 предпочтительно представляет собой водород или (С1-С2)алкил и R13 представляет собой (С1-С2)алкил; более предпочтительно R2 и R3 независимо представляют собой водород; гидрокси; (С1-С2)алкил; (С1-С2)алкокси; карбоксил или метиламино, и в этом случае R11 представляет собой водород и R13 представляет собой метил. Предпочтительно, когда R2 и R3 определены как алкил и замещены, тогда существует единственный заместитель, выбранный из гидрокси; (С1-С2)алкокси; карбоксила; амино, двузамещенного (С1-С2)алкилом; и сульфониламидо, двузамещенного (С1-С2)алкилом. Наиболее предпочтительно указанные о-гидроксиальдегиды включают в себя о-ванилин; салициловый альдегид; 2,3-дигидроксибензальдегид; 2,6-дигидроксибензальдегид; 2-гидрокси-3-этоксибензальдегид или пиридоксаль, которые могут быть представлены следующими структурными формулами: 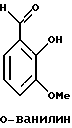 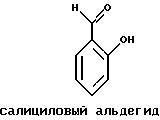 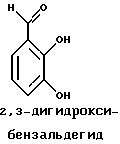 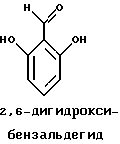 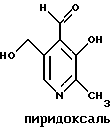 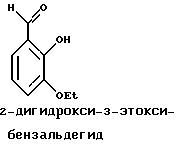 Кроме того, белковый компонент аддуктного конечного продукта конденсации, являющийся основанием Шиффа, включает в себя пептид, обладающий полезной активностью у животных, включая полезность в качестве стимулятора роста у животных, используемого для приготовления корма, а также терапевтическую полезность в качестве ветеринарного продукта для лечения и предотвращения многочисленных заболеваний и неблагоприятных состояний. Белковые компоненты также обладают полезностью в качестве терапевтических агентов при лечении и предотвращении заболеваний и неблагоприятных состояний у людей. Белковые компоненты представляют собой первичные амины по химической структуре и могут иметь от двух аминокислот до нескольких сотен и тысяч или большего числа аминокислот. Указанные белковые компоненты и конечные продукты, представляющие собой продукты конденсации, которые они образуют, как предложено здесь, обладают общепризнанной ценностью при лечении животных и людей. Следующие конкретные белки особенно подходят для использования по настоящему изобретению: белковые эндогенные и синтетические опиоидные анальгетики и антагонисты, включающие в себя энкефалины, эндорфины и динорфины, которые представляют собой селективные и неселективные агонисты и антагонисты субтипов  , k и , k и  опиоидного рецептора, включая [Leu5] и [Мet5] энкефалин; динорфин А и В; опиоидного рецептора, включая [Leu5] и [Мet5] энкефалин; динорфин А и В;  – и – и  -неоэндорфин; [D-Ala2, MePhe4, -Gly(ol)5]энкeфaлин (DAMGO); [D-Pen2, О-Реn5]энкефалин (DПDРЕ); [D-Ser2, Leu5]энкeфaлин-Thr6 (DSLET), [D-Ala2, О-Leu5]энкефалин (DADL); D-Phe-Cys-Tyr-D-Trp-Orn-Thr-Pen-Thr-NH2 (CTOP); [D-Ala2 N-MePhe4, Met(O)5-ol]энкeфaлин (FK-33824); Tyr-D-Ala-Phe-Asp-Val-Val-Gly-NH2 ([D-Ala2] дeльтopфин I; Тyr-D-Ala-Phe-Glu-Val-Val-Gly-NH2 ([D-Ala2, Сlu4]дельторфин II; Tyr-Pro-Phe-Pro-NH2 (морфицептин); Tyr-Pro-MePhe-D-Pro-NH2 (PL-017); и [D-Ala2, Leu5, Сys6]энкефалин; -неоэндорфин; [D-Ala2, MePhe4, -Gly(ol)5]энкeфaлин (DAMGO); [D-Pen2, О-Реn5]энкефалин (DПDРЕ); [D-Ser2, Leu5]энкeфaлин-Thr6 (DSLET), [D-Ala2, О-Leu5]энкефалин (DADL); D-Phe-Cys-Tyr-D-Trp-Orn-Thr-Pen-Thr-NH2 (CTOP); [D-Ala2 N-MePhe4, Met(O)5-ol]энкeфaлин (FK-33824); Tyr-D-Ala-Phe-Asp-Val-Val-Gly-NH2 ([D-Ala2] дeльтopфин I; Тyr-D-Ala-Phe-Glu-Val-Val-Gly-NH2 ([D-Ala2, Сlu4]дельторфин II; Tyr-Pro-Phe-Pro-NH2 (морфицептин); Tyr-Pro-MePhe-D-Pro-NH2 (PL-017); и [D-Ala2, Leu5, Сys6]энкефалин;аутокоиды, включающие в себя брадикинин и каллидин, получаемые путем протеолитических реакций в ответ на воспалительные события, выбранные из тканевого повреждения, вирусных инфекций и аллергических реакций, где указанные белки действуют локально, вызывая боль, вазодилатацию, увеличение сосудистой проницаемости и синтез простагландинов, где указанные белки обладают агонистической и антагонистической активностью и полезны для лечения мужского бесплодия, для доставки противоопухолевых химиотерапевтических агентов через гематоэнцефалический барьер и для лечения боли, астмы и других хронических воспалительных заболеваний, включая: Аrg-Pro-Pro-Gly-Phe-Ser-Рro-Рhe-Аrg (брадикинин); Lys-Arg-Pro-Pro-Gly-Phe-Ser-Pro-Phe-Arg (каллидин); Аrg-Рro-Рrо-Gly-Phe-Ser-Pro-Phe (des-Аrg9-брадикинин); Lys-Arg-Pro-Pro-Gly-Phe-Ser-Pro-Phe (des-Аrg9-каллидин); Arg-Pro-Pro-Gly-Phe-Ser-Pro-Leu (des-Аrg9-[Leu8]-брадикинин); Arg-Pro-Pro-Gly-Phe-Ser-[D-Phe]-Phe-Arg ([D-Phe7]-брадикинин) и [D-Arg]-Arg-Pro-Hyp-Gly-Thi-Ser-Tic-Oic-Arg (HOE 140), где Hyp представляет собой транс-4-гидрокси-Рro; Thi представляет собой  -(2-тиенил)-Аlа; Tic представляет собой [D]-1,2,3,4-тетрагидрохинолин-3-ил-карбонил и Oic представляет собой (3аs,7аs)-октагидроиндол-2-ил-карбонил; -(2-тиенил)-Аlа; Tic представляет собой [D]-1,2,3,4-тетрагидрохинолин-3-ил-карбонил и Oic представляет собой (3аs,7аs)-октагидроиндол-2-ил-карбонил;белки, активные в отношении се, типов V1 и V2 рецептора вазопрессина, которые опосредуют сосудосуживающие реакции и антидиуретические реакции, соответственно включающие в себя антагонисты V1, полезные при лечении застойной сердечной недостаточности, гипертензии и послеоперационной кишечной непроходимости и вздутия живота, агонисты V2, используемые для лечения несахарного диабета путем контролирования полиурии и полидипсии и для лечения расстройств, связанных с кровотечением, включающих в себя болезнь фонВиллебранда, включающие в себя специфичные обнаруживаемые в природе пептиды, подобные вазопрессину: аргинин-вазопрессин (AVP) следующей формулы: 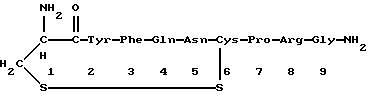 и липрессин ([Lys8]-AVP; синтетические пептиды – аналоги вазопрессина: V1a-селективный агонист [Phe2, Ile2, Orn8]AVP; V1b-селективный агонист дeзaминo[D-3-(3′-пиpидил)-Ala2] AVP; V2-селективные агонисты десмопрессин (dDAVP) и дезамино[Vа14, D-Arg8]AVP; и пептидные антагонисты, включающие в себя V1a-селективный антагонист d(CH2)5[Tyr(Me)2]AVP формулы: 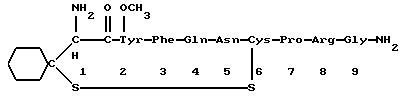 и V1b-селективный антагонист dp[Tyr(Me)2]AVP; и V2-селективные антагонисты desGly-NH2 9-d(CH2)5[D-lle2, lle4]AVP и d(CH2)5-[D-lle2, lle4Ala-NH2 9] AVP; пентагастрин, используемый в качестве индикатора желудочной секреции формулы: N-трет-бутилоксикарбонил-  -Аlа-Тrр-Меt-Аsр-Рhе-NН2; -Аlа-Тrр-Меt-Аsр-Рhе-NН2;октреотид, полезный при лечении симптомов опухолей желудочно-кишечного тракта, диареи, устойчивой к другому лечению, расстройств перистальтики и желудочно-кишечного кровотечения, формулы: L-цистеинамид-D-Рhе-L-Сys-L-Рhе-D-Тrp-L-Lys-L-Тhr-N-[2-гидрокси-1- (гидроксиметил)пропил] циклический(2–>7)-дисульфид, [R-(R*,R*)]-; реагенты на основе антител, полезные в качестве иммуносупрессирующих агентов, включающие в себя антитимоцитарный глобулин; моноклональное антитело муромонаб-CD3; и Rh0(D) иммуноглобулин; и белковые иммуностимуляторы, полезные при лечении состояний иммунодефицита, включающие в себя иммуноглобулин; цитокины, продуцируемые лейкоцитами и обладающие множеством иммунорегуляторных эффектов, включающие в себя: интерфероны, колониестимулирующие факторы и интерлейкины и в особенности  -интерферон; интерферон- -интерферон; интерферон- (ИФН- (ИФН- ); гранулоцитарный колониестимулирующий фактор (ГКСФ); гранулоцитарный колониестимулирующий фактор макрофагов (ГКСФМ); и интерлейкины с интерлейкина-1 (ИЛ-1) по интерлейкин-12 (ИЛ-12); ); гранулоцитарный колониестимулирующий фактор (ГКСФ); гранулоцитарный колониестимулирующий фактор макрофагов (ГКСФМ); и интерлейкины с интерлейкина-1 (ИЛ-1) по интерлейкин-12 (ИЛ-12);гематопоэтические факторы роста, вовлеченные в регуляцию процеса, посредством которого зрелые кровяные клетки постоянно заменяются, полезные при лечении основных заболеваний крови и используемые в качестве дополнительных агентов при лечении тяжелых инфекций и при помощи пациентами, которые подверглись химиотерапии или трансплантации костного мозга, включающие в себя в особенности: факторы роста, включая эритропоэтин (ЭПО); фактор стволовых клеток (ФСК); интерлейкины (ИЛ 1-12) колониестимулирующий фактор моноцитов/макрофагов (КСФМ, КСФ-1); P1XY321 (слитой белок GM-CSF/IL-3); и тромбопоэтин; тромболитические белки, полезные для рассасывания как патологических тромбов, так и отложений фибрина в местах повреждения сосудов, включающие в себя стрептокиназу; тканевый активатор плазминогена (ТАП); и урокиназу; гормоны передней доли гипофиза и гипоталамические факторы, которые регулируют их использование, включающие в себя: (а) соматотропные гормоны, включая гормон роста (ГР), пролактин (Прл) и плацентарный лактоген (ПЛ); (б) гликопротеиновые гормоны, включая лютеинизирующий гормон (ЛГ), фолликулостимулирующий гормон (ФСГ) и тиреотропный гормон (ТТГ); и (в) гормоны, производные проопиомеланокортина (ПОМК), включая кортикотропин (АКТГ),  -меланоцитстимулирующий гормон ( -меланоцитстимулирующий гормон ( -МСГ), -МСГ),  -меланоцитстимулирующий гормон ( -меланоцитстимулирующий гормон ( -МСГ), -МСГ),  -липотропин ( -липотропин ( -ЛПГ) и -ЛПГ) и  -липотропин ( -липотропин ( -ЛПГ); гипоталамические факторы, регулирующие высвобождение указанных гормонов, включая рилизинг-фактор гормона роста (РФГР), рилизинг-фактор лютеинизирующего гормона (РФЛГ), инсулиноподобный фактор роста (ИФР-1 и ИФР-2), соматостатин и гонадотропин-рилизинг-гормон (ГнРГ); -ЛПГ); гипоталамические факторы, регулирующие высвобождение указанных гормонов, включая рилизинг-фактор гормона роста (РФГР), рилизинг-фактор лютеинизирующего гормона (РФЛГ), инсулиноподобный фактор роста (ИФР-1 и ИФР-2), соматостатин и гонадотропин-рилизинг-гормон (ГнРГ);гормон роста, полезный в качестве заместительной терапии при недостатке гормона роста у детей, включая: соматостанин, синтетический аналог соматостанина, октреотид; гонадотропные гормоны, включая ЛГ (лактогенный гормон), ФСГ (фолликулостимулирующий гормон) и хорионический гонадотропин (ХГ), полезные при диагностировании репродуктивных расстройств и при лечении бесплодия, включающие в себя: урофоллитропин, человеческий гонадотропин, обнаруживаемый в период менопаузы (ЧГПМ), из которого по существу большая часть ЛГ удалена, полезные для индуцирования овуляции, и гонадорелин, синтетический человеческий ГнРГ, полезный для стимуляции секреции гонадотропина; синтетические агонисты ГнРГ, включающие в себя: лейпролид, гистрелин, нафарелин и гозерелин, полезные при лечении эндокринных расстройств, которые ответственны за уменьшения уровней стероидов гонад; тиреотропный гормон (ТТГ), секреция которого контролируется тиреотропин-рилизинг фактором (ТРФ), полезный для гормональной заместительной терапии у пациентов, страдающих от гипотиреоза, и для терапии, подавляющей ТТГ у пациентов, страдающих от нетоксического зоба или после лечения рака щитовидной железы; инсулин для лечения пациентов, страдающих инсулинзависимым сахарным диабетом, и пациентов, страдающих инсулиннезависимым сахарным диабетом; глюкагон, который играет физиологическую роль при регуляции метаболизма глюкозы и кетоновых тел, полезный при лечении тяжелой гипогликемии и для рентгенологов для подавления желудочно-кишечного тракта; соматостанин, полезный для блокирования высвобождения гормонов эндокринными опухолями, включающими в себя инсулиномы, глюкагономы, ВИПомы, карциноидные опухоли и соматотропиномы, и синтетический аналог, октреотид; кальцитонин, представляющий собой гормон, специфически воздействующий на остеокласты для подавления резорбции костей, полезный при управляемой гиперкальцимии и при расстройствах, выражающихся в увеличенном скелетном ремоделировании, включая болезнь Пэджета (Paget); паратиреоидный гормон, полезный при лечении пациентов, страдающих остеопорозом позвоночника; альдеслейкин, 125-L-серин-2-133-интерлейкин 2, полезный в качестве противоопухолевого агента и в качестве иммуностимулятора; альглюцераза, мономерный гликопротеин, состоящий из 497 аминокислот, и модифицированная форма  -глюкоцереброзидазы плацентарной ткани человека, полезная в качестве дополнения для фермента глюкоцереброзидазы; альсактид, синтетический аналог кортикотропина: 1- -глюкоцереброзидазы плацентарной ткани человека, полезная в качестве дополнения для фермента глюкоцереброзидазы; альсактид, синтетический аналог кортикотропина: 1- -А1а-17[L-2,6-диамино-N-(4-aминoбyтил)гeкcaнaмид] – -А1а-17[L-2,6-диамино-N-(4-aминoбyтил)гeкcaнaмид] – 1-17-кopтикoтpoпин; альтеплаза, сериновая протеаза, состоящая из 527 аминокислот, последовательность которой идентична встречающейся в природе протеазе, продуцируемой эндотелиальными клетками в стенках сосудов, полезная в качестве активатора плазминогена; alvircept sudotox, синтетический химерный белок, сконструированный для связывания первых 178 аминокислот внеклеточного домена CD4 посредством двух линкерных остатков с аминокислотами 1-3 и 253-613 экзотоксина A Pseudomonas, полезный в качестве противовирусного агента; амлинтид, представляющий собой белок, состоящий из 37 аминокислот, полезный в качестве антидиабетического агента; амогастрин: N-карбокси-L-Trp-L-Меt-L- 1-17-кopтикoтpoпин; альтеплаза, сериновая протеаза, состоящая из 527 аминокислот, последовательность которой идентична встречающейся в природе протеазе, продуцируемой эндотелиальными клетками в стенках сосудов, полезная в качестве активатора плазминогена; alvircept sudotox, синтетический химерный белок, сконструированный для связывания первых 178 аминокислот внеклеточного домена CD4 посредством двух линкерных остатков с аминокислотами 1-3 и 253-613 экзотоксина A Pseudomonas, полезный в качестве противовирусного агента; амлинтид, представляющий собой белок, состоящий из 37 аминокислот, полезный в качестве антидиабетического агента; амогастрин: N-карбокси-L-Trp-L-Меt-L- -Аsр-3-фенил-L-аланинамид; анакинра: антагонист рецептора N2-L-Met-интерлейкина 1, полезный в качестве нестероидного противовоспалительного агента и в качестве супрессанта для лечения воспалительного заболевания толстой кишки; анаратид ацетат, атриопептин-21 (крысиный), N-L-Arg-8-L-Met-21a-L-Phe-21b-L-Arg-21c-L-Tyr-, ацетат, полезный в качестве антигипертензивного агента и в качестве диуретического агента; ангиотензина амид, ангиотензин II, l-L-Asn-5-L-Val, полезный в качестве вазоконстриктора; апротинин, панкреатический трипсиновый ингибитор, имеющий 58 аминокислот, полезный в качестве ферментного ингибитора (протеиназы); арфалазин, 1-сукцинамовая кислота-5-L-Vа1-8-(L-2-фенилглицин)ангиотензин II, полезный в качестве антигипертензивного агента; аргипрессин таннат, вазопрессин, 8-L-Arg, таннат, полезный в качестве антидиуретического агента; аспартоцин, окситоцин, 4-L-Asn-, полезный в качестве антибиотического агента, продуцируемый Streptomyces griseus; атозибан, окситоцин, 1-(3-меркаптопропановая кислота)-2-(O-этил-D-Тyr)-4-L-Thr-8-L-Orn-, полезный в качестве антагониста окситоцина; авопарцин, гликопептидный антибиотик, получаемый из Streptomyces candidus; базифунгин, N-[(2R, 3R)-2-гидрокси-3-MeVal] -N-L-MeVal-L-Phe-N-L-MePhe-L-Pro-L-aллo-Ile-N-L-MeVal-L-Leu-3-гидрокси-N-L-MeVal -Аsр-3-фенил-L-аланинамид; анакинра: антагонист рецептора N2-L-Met-интерлейкина 1, полезный в качестве нестероидного противовоспалительного агента и в качестве супрессанта для лечения воспалительного заболевания толстой кишки; анаратид ацетат, атриопептин-21 (крысиный), N-L-Arg-8-L-Met-21a-L-Phe-21b-L-Arg-21c-L-Tyr-, ацетат, полезный в качестве антигипертензивного агента и в качестве диуретического агента; ангиотензина амид, ангиотензин II, l-L-Asn-5-L-Val, полезный в качестве вазоконстриктора; апротинин, панкреатический трипсиновый ингибитор, имеющий 58 аминокислот, полезный в качестве ферментного ингибитора (протеиназы); арфалазин, 1-сукцинамовая кислота-5-L-Vа1-8-(L-2-фенилглицин)ангиотензин II, полезный в качестве антигипертензивного агента; аргипрессин таннат, вазопрессин, 8-L-Arg, таннат, полезный в качестве антидиуретического агента; аспартоцин, окситоцин, 4-L-Asn-, полезный в качестве антибиотического агента, продуцируемый Streptomyces griseus; атозибан, окситоцин, 1-(3-меркаптопропановая кислота)-2-(O-этил-D-Тyr)-4-L-Thr-8-L-Orn-, полезный в качестве антагониста окситоцина; авопарцин, гликопептидный антибиотик, получаемый из Streptomyces candidus; базифунгин, N-[(2R, 3R)-2-гидрокси-3-MeVal] -N-L-MeVal-L-Phe-N-L-MePhe-L-Pro-L-aллo-Ile-N-L-MeVal-L-Leu-3-гидрокси-N-L-MeVal  1-лактон, полезный в качестве противогрибкового агента; бекаплермин, рекомбинантный человеческий тромбоцитарный фактор роста В, рекомбинантный белок, продуцируемый созданными путем генетической инженерии Saccharomyces cerevisiae, сходный по аминокислотному составу и биологической активности с эндогенным гомодимером ТФР (тромбоцитарный фактор роста)-ВВ человека, полезный при лечении хронических кожных язв за счет активизации им пролиферации клеток мезенхимального происхождения; бивалирудин, антикоагулянт, антитромботический агент, имеющий 20 аминокислот; карбетоцин, 1-масляная кислота-2-[3-(п-метоксифенил)-L-А1а]окситоцин; каргутоцин, 1 -масляная кислота-6-(L-2-аминомасляная кислота)-7-глицинокситоцин; церулетид, 5-О-L-Рrо-1-Gln-L- 1-лактон, полезный в качестве противогрибкового агента; бекаплермин, рекомбинантный человеческий тромбоцитарный фактор роста В, рекомбинантный белок, продуцируемый созданными путем генетической инженерии Saccharomyces cerevisiae, сходный по аминокислотному составу и биологической активности с эндогенным гомодимером ТФР (тромбоцитарный фактор роста)-ВВ человека, полезный при лечении хронических кожных язв за счет активизации им пролиферации клеток мезенхимального происхождения; бивалирудин, антикоагулянт, антитромботический агент, имеющий 20 аминокислот; карбетоцин, 1-масляная кислота-2-[3-(п-метоксифенил)-L-А1а]окситоцин; каргутоцин, 1 -масляная кислота-6-(L-2-аминомасляная кислота)-7-глицинокситоцин; церулетид, 5-О-L-Рrо-1-Gln-L- -Аsр-L-О-сульфо-L-Тyr-L-Тhr-L-G1у-L-Тrp-L-Меt- -Аsр-L-О-сульфо-L-Тyr-L-Тhr-L-G1у-L-Тrp-L-Меt- -Аsр-L-Рhе-амид, полезный в качестве стимулятора желудочной секреции; цетермин, трансформирующий фактор роста -Аsр-L-Рhе-амид, полезный в качестве стимулятора желудочной секреции; цетермин, трансформирующий фактор роста  2 человека, имеющий 112 аминокислот; цилмостим, 1-233-колониестимулирующий фактор 1 (группировка белка клона человека p3ACSF-69), циклический (7–>90), (48–>139),(102–>146)-трис(дисульфид)димер, полезный в качестве гематопоэтического агента (колониестимулирующий фактор макрофагов); натрия колистиметат, компонент колистина А, полезный в качестве антибактериального агента; кортикорелин, трифлютат овечий, кортикотропин-рилизинг-фактор (овцы), соль трифторацетат, полезный в качестве диагностического средства при адренокортикальной недостаточности и синдроме Кушинга (Cushing’s), и в качестве кортикотропин-рилизинг-гормона; козинтропин, тетракозактид ацетат, 2 человека, имеющий 112 аминокислот; цилмостим, 1-233-колониестимулирующий фактор 1 (группировка белка клона человека p3ACSF-69), циклический (7–>90), (48–>139),(102–>146)-трис(дисульфид)димер, полезный в качестве гематопоэтического агента (колониестимулирующий фактор макрофагов); натрия колистиметат, компонент колистина А, полезный в качестве антибактериального агента; кортикорелин, трифлютат овечий, кортикотропин-рилизинг-фактор (овцы), соль трифторацетат, полезный в качестве диагностического средства при адренокортикальной недостаточности и синдроме Кушинга (Cushing’s), и в качестве кортикотропин-рилизинг-гормона; козинтропин, тетракозактид ацетат,  1-24-кортикотропин, полезный в качестве адренокортикотропного гормона; циклоспорин, циклический белок, содержащий 11 аминокислот и группировку 3-гидрокси-4-метил-2-(метиламино)-6-октеноила в положении 6, полезный в качестве иммуносупрессанта; дакликсимаб (Ro-24-7375), гуманизированное моноклональное антитело против ТАС, состоящее из четырех субъединиц, связанных посредством дисульфидных мостиков, и с молекулярной массой приблизительно 150 кДа, полезный в качестве иммуносупрессанта; даклизумаб; даптомицин, белковый антибактериальный агент; дезирудин, 63-десульфогирудин из Hirudo medicinalis, содержащий 63 аминокислоты, полезный в качестве антикоагулянта; дезлорелин, рилизинг-фактор лютеинизирующего гормона (свиньи), содержащий 9 аминокислот, полезный в качестве агониста РФЛГ; десмопрессин ацетат, вазопрессин, 1-(3-меркаптопропановая кислота)-8-D-Аrg-, соль моноацетат тригидрат, содержащий 9 аминокислот, полезный в качестве антидиуретического агента; детиреликс ацетат, содержащий 10 аминокислот, полезный в качестве антагониста РФЛГ; думорелин, 27-L-Leu-44a-Gly рилизинг-фактор гормона роста (человека); элькатонин, 1-масляная кислота-7-(L-2-аминомасляная кислота)-26-L-Asp-27-L-Val-29-L-Ala кальцитонин (лосося); эмоктакин, интерлейкин 8 (человека), содержащий 72 аминокислоты с двумя Сys мостиками; эпоэтин альфа, гликопротеин из 165 аминокислот, который регулирует продукцию красных кровяных телец и продуцируется клетками яичника китайского хомячка, в которые вставлен ген эритропоэтина человека, полезный в качестве противоанемического агента и лекарственного средства, повышающего количество гемоглобина в крови; эрзофермин, рекомбинантный основной фактор роста фибробластов человека (ОФРФ), содержащий 157 аминокислот, негликозилированный белок, выделенный из плаценты человека и клонированный и экспессирующийся в Е. соli, полезный в качестве агента, способствующего заживлению ран; фелипрессин, представляющий собой вазопрессин, 2-L-Phe-8-L-Lys, содержащий 9 аминокислот, полезный в качестве вазоконстриктора; филграстим, одноцепочечный полипептид из 175 аминокислот, негликозилированный и экспрессируемый Е. соli, полезный в качестве агента для лечения нейтропении и в качестве стимулятора гематопоэза; глюкагон, одноцепочечный белок, состоящий из 29 аминокислот, полезный в качестве антидиабетического агента; гонадорелин ацетат, соль диацетат ацетата рилизинг-фактора лютеинизирующего гормона, содержащий 10 аминокислот, полезный в качестве фактора, стимулирующего гонады; гозерелин, рилизинг-фактор лютеинизирующего гормона (свиньи), содержащий 9 аминокислот, полезный в качестве агониста РФЛГ; гистрелин, рилизинг-фактор лютеинизирующего гормона (свиньи), содержащий 9 аминокислот, полезный в качестве агониста РФЛГ; имиглюцераза, изоферментный белок 495-L-гистидинглюкозилцерамидазы плаценты, полезный в качестве ферментного дополнения для глюкоцереброзидазы; инсулин деаланированный, производное инсулина, получаемое путем удаления С-концевого аланина В цепи инсулина, полезный в качестве антидиабетического агента; интерферон альфа-2а, интерферон 1-24-кортикотропин, полезный в качестве адренокортикотропного гормона; циклоспорин, циклический белок, содержащий 11 аминокислот и группировку 3-гидрокси-4-метил-2-(метиламино)-6-октеноила в положении 6, полезный в качестве иммуносупрессанта; дакликсимаб (Ro-24-7375), гуманизированное моноклональное антитело против ТАС, состоящее из четырех субъединиц, связанных посредством дисульфидных мостиков, и с молекулярной массой приблизительно 150 кДа, полезный в качестве иммуносупрессанта; даклизумаб; даптомицин, белковый антибактериальный агент; дезирудин, 63-десульфогирудин из Hirudo medicinalis, содержащий 63 аминокислоты, полезный в качестве антикоагулянта; дезлорелин, рилизинг-фактор лютеинизирующего гормона (свиньи), содержащий 9 аминокислот, полезный в качестве агониста РФЛГ; десмопрессин ацетат, вазопрессин, 1-(3-меркаптопропановая кислота)-8-D-Аrg-, соль моноацетат тригидрат, содержащий 9 аминокислот, полезный в качестве антидиуретического агента; детиреликс ацетат, содержащий 10 аминокислот, полезный в качестве антагониста РФЛГ; думорелин, 27-L-Leu-44a-Gly рилизинг-фактор гормона роста (человека); элькатонин, 1-масляная кислота-7-(L-2-аминомасляная кислота)-26-L-Asp-27-L-Val-29-L-Ala кальцитонин (лосося); эмоктакин, интерлейкин 8 (человека), содержащий 72 аминокислоты с двумя Сys мостиками; эпоэтин альфа, гликопротеин из 165 аминокислот, который регулирует продукцию красных кровяных телец и продуцируется клетками яичника китайского хомячка, в которые вставлен ген эритропоэтина человека, полезный в качестве противоанемического агента и лекарственного средства, повышающего количество гемоглобина в крови; эрзофермин, рекомбинантный основной фактор роста фибробластов человека (ОФРФ), содержащий 157 аминокислот, негликозилированный белок, выделенный из плаценты человека и клонированный и экспессирующийся в Е. соli, полезный в качестве агента, способствующего заживлению ран; фелипрессин, представляющий собой вазопрессин, 2-L-Phe-8-L-Lys, содержащий 9 аминокислот, полезный в качестве вазоконстриктора; филграстим, одноцепочечный полипептид из 175 аминокислот, негликозилированный и экспрессируемый Е. соli, полезный в качестве агента для лечения нейтропении и в качестве стимулятора гематопоэза; глюкагон, одноцепочечный белок, состоящий из 29 аминокислот, полезный в качестве антидиабетического агента; гонадорелин ацетат, соль диацетат ацетата рилизинг-фактора лютеинизирующего гормона, содержащий 10 аминокислот, полезный в качестве фактора, стимулирующего гонады; гозерелин, рилизинг-фактор лютеинизирующего гормона (свиньи), содержащий 9 аминокислот, полезный в качестве агониста РФЛГ; гистрелин, рилизинг-фактор лютеинизирующего гормона (свиньи), содержащий 9 аминокислот, полезный в качестве агониста РФЛГ; имиглюцераза, изоферментный белок 495-L-гистидинглюкозилцерамидазы плаценты, полезный в качестве ферментного дополнения для глюкоцереброзидазы; инсулин деаланированный, производное инсулина, получаемое путем удаления С-концевого аланина В цепи инсулина, полезный в качестве антидиабетического агента; интерферон альфа-2а, интерферон  А (редуцированный остаток лейкоцитарного белка человека), содержащий 165 аминокислот, полезный в качестве противоопухолевого агента и в качестве модификатора биологической реакции; интерферон альфа-2b, интерферон А (редуцированный остаток лейкоцитарного белка человека), содержащий 165 аминокислот, полезный в качестве противоопухолевого агента и в качестве модификатора биологической реакции; интерферон альфа-2b, интерферон  2b (редуцированный остаток белка клона лейкоцитов человека Hif-SN206), содержащий 165 аминокислот, также полезный в качестве противоопухолевого агента и в качестве модификатора биологической реакции; интерферон бета-1а, гликозилированный полипептид, состоящий из 166 аминокислотных остатков, получаемый из культуры клеток яичника китайского хомячка, содержащих созданный путем генетической инженерии ген интерферона бета человека, также полезный в качестве противоопухолевого агента и в качестве модификатора биологической реакции; интерферон бета-1b, негликозилированный полипептид, состоящий из 165 аминокислотных остатков, получаемый из Е. соli, также полезный в качестве иммуномодулятора; интерферон гамма-1b, 1-139 интерферон 2b (редуцированный остаток белка клона лейкоцитов человека Hif-SN206), содержащий 165 аминокислот, также полезный в качестве противоопухолевого агента и в качестве модификатора биологической реакции; интерферон бета-1а, гликозилированный полипептид, состоящий из 166 аминокислотных остатков, получаемый из культуры клеток яичника китайского хомячка, содержащих созданный путем генетической инженерии ген интерферона бета человека, также полезный в качестве противоопухолевого агента и в качестве модификатора биологической реакции; интерферон бета-1b, негликозилированный полипептид, состоящий из 165 аминокислотных остатков, получаемый из Е. соli, также полезный в качестве иммуномодулятора; интерферон гамма-1b, 1-139 интерферон  (редуцированный остаток лимфоцитарного белка человека), N2-L-Met, полезный в качестве противоопухолевого агента и в качестве иммуномодулятора; ироплакт, N-метионилтромбоцитарный фактор 4 (субъединица человека), содержащий 71 аминокислотный остаток, имеющий два Cys мостика; ланотеплаза, белок – тканевый активатор плазминогена, полученный из ТАП человека путем делеции фибронектинподобного и ЭФР (эпидермальный фактор роста) подобного доменов и мутации Asn 117 в Gln 117, получаемый путем экспрессии в хозяйских клетках млекопитающих последовательности ДНК, кодирующей последовательность пептида, полезный в качестве активатора плазминогена и тромболитического агента; ланреотид ацетат, содержащий 8 аминокислот и один дисульфидный мостик, полезный в качестве противоопухолевого агента; ленограстим, гликопротеин, состоящий из 174 аминокислотных остатков, продуцируемый в клетках яичника китайского хомячка путем экспрессии кДНК колониестимулирующего фактора гранулоцитов человека, получаемой из мРНК линии сквамозных клеток ротовой полости человека, полезный в качестве агента для лечения нейтропении и в качестве стимулятора гематопоэза; лютрелин ацетат, рилизинг-фактор лютеинизирующего гормона (свиньи), содержащий 9 аминокислот, полезный в качестве агониста РФЛГ; молграмостим, колониестимулирующий фактор 2 (редуцированный остаток белка клона человека pHG25), содержащий 127 аминокислот, полезный в качестве агента для лечения нейтропении и в качестве стимулятора гемoпоэза; муродермин, эпидермальный фактор роста (слюнной железы мыши); нафарелин ацетат, рилизинг-фактор лютеинизирующего гормона (свиньи), содержащий 9 аминокислот, полезный в качестве агониста РФЛГ; нагрестипен, 26-L-аланинлимфокин ВБМ 1 (редуцированный остаток лимфоцитарного белка человека), N2-L-Met, полезный в качестве противоопухолевого агента и в качестве иммуномодулятора; ироплакт, N-метионилтромбоцитарный фактор 4 (субъединица человека), содержащий 71 аминокислотный остаток, имеющий два Cys мостика; ланотеплаза, белок – тканевый активатор плазминогена, полученный из ТАП человека путем делеции фибронектинподобного и ЭФР (эпидермальный фактор роста) подобного доменов и мутации Asn 117 в Gln 117, получаемый путем экспрессии в хозяйских клетках млекопитающих последовательности ДНК, кодирующей последовательность пептида, полезный в качестве активатора плазминогена и тромболитического агента; ланреотид ацетат, содержащий 8 аминокислот и один дисульфидный мостик, полезный в качестве противоопухолевого агента; ленограстим, гликопротеин, состоящий из 174 аминокислотных остатков, продуцируемый в клетках яичника китайского хомячка путем экспрессии кДНК колониестимулирующего фактора гранулоцитов человека, получаемой из мРНК линии сквамозных клеток ротовой полости человека, полезный в качестве агента для лечения нейтропении и в качестве стимулятора гематопоэза; лютрелин ацетат, рилизинг-фактор лютеинизирующего гормона (свиньи), содержащий 9 аминокислот, полезный в качестве агониста РФЛГ; молграмостим, колониестимулирующий фактор 2 (редуцированный остаток белка клона человека pHG25), содержащий 127 аминокислот, полезный в качестве агента для лечения нейтропении и в качестве стимулятора гемoпоэза; муродермин, эпидермальный фактор роста (слюнной железы мыши); нафарелин ацетат, рилизинг-фактор лютеинизирующего гормона (свиньи), содержащий 9 аминокислот, полезный в качестве агониста РФЛГ; нагрестипен, 26-L-аланинлимфокин ВБМ 1 (воспалительный белок макрофагов клона рАТ 464 человека, содержащий 69 аминокислот и имеющий два дисульфидных мостика); пепстатин, N-(3-метил-1-оксобутил)-L-Vа1-L-Vа1-4-амино-3-гидрокси-6-метилгептаноил-L-А1а-4-амино-3-гидрокси-6-метилгептановая кислота, полезный в качестве ингибитора фермента пепсина; прамлинтид, белок, содержащий 37 аминокислот и имеющий один дисульфидный мостик, полезный в качестве антидиабетического агента; проинсулин человека, проинсулин (свиньи), содержащий 86 аминокислотных остатков и имеющий три дисульфидных мостика, полезный в качестве антидиабетического агента; сарграмостим, колониестимулирующий фактор 2 (остаток белка клона человека pHG25), 23-L-Leu-, одноцепочечный гликозилированный полипептид, состоящий из 127 аминокислотных остатков, экспрессируемый в Saccharomyces cerevisiae, полезный в качестве агента для лечения нейтропении и в качестве стимулятора гематопоэза; встречающиеся в природе и синтетические, включая получаемые рекомбинантным путем соматотропины человека и животных (гормоны роста), в частности соматотропины быка и свиньи; сомагребав, соматотропин (бычий, редуцированный), l-[N2-L-Met-L- (воспалительный белок макрофагов клона рАТ 464 человека, содержащий 69 аминокислот и имеющий два дисульфидных мостика); пепстатин, N-(3-метил-1-оксобутил)-L-Vа1-L-Vа1-4-амино-3-гидрокси-6-метилгептаноил-L-А1а-4-амино-3-гидрокси-6-метилгептановая кислота, полезный в качестве ингибитора фермента пепсина; прамлинтид, белок, содержащий 37 аминокислот и имеющий один дисульфидный мостик, полезный в качестве антидиабетического агента; проинсулин человека, проинсулин (свиньи), содержащий 86 аминокислотных остатков и имеющий три дисульфидных мостика, полезный в качестве антидиабетического агента; сарграмостим, колониестимулирующий фактор 2 (остаток белка клона человека pHG25), 23-L-Leu-, одноцепочечный гликозилированный полипептид, состоящий из 127 аминокислотных остатков, экспрессируемый в Saccharomyces cerevisiae, полезный в качестве агента для лечения нейтропении и в качестве стимулятора гематопоэза; встречающиеся в природе и синтетические, включая получаемые рекомбинантным путем соматотропины человека и животных (гормоны роста), в частности соматотропины быка и свиньи; сомагребав, соматотропин (бычий, редуцированный), l-[N2-L-Met-L- -Asp-L-глутамин] -, содержащий 191 аминокислоту, полезный в качестве стимулирующего лактацию средства, особенно для ветеринарного использования; сомалапор, соматотропин (редуцированный из клона свиньи pPGH-1), N-L-аланил-гормон роста, содержащий в сумме 191 аминокислоту, полезный в качестве гормона (роста свиньи); соматрем, соматотропин (человека), N-L-Met-, содержащий 191 аминокислоту, имеющий два дисульфидных мостика, полезный в качестве гормона роста; соматотропин, одна полипептидная цепь, содержащая 191 аминокислоту, имеющая нормальную структуру основного гормона, стимулирующего рост, получаемый из передней доли гипофиза человека, полезный в качестве гормона роста; соматотропин, доступный в рекомбинантной форме; сомавубав, соматотропин (бычий), 127-L-Leu-, который является одним из четырех встречающихся в природе молекулярных вариантов соматотропина гипофиза быка, полезный в качестве стимулирующего лактацию средства; соменопор, соматотропин (редуцированный, pPGH-1 клона свиньи), N-L-Аlа-32-де-L-С1u-33-де-L-Аrg-34-де-L-А1а-35-де-L-Тyr-36-де-L-Ilе-37-де-L-Рrо-38-де-L-Glu-, содержащий 190 аминокислот, полезный в качестве гормона роста свиньи; сометрибав, соматотропин (бычий) 1-L-Met-127-L-Leu-, содержащий 191 аминокислоту, полезный в качестве применяемого в ветеринарии стимулятора роста; сометрипор, соматотропин (рекомбинантный, свиньи) C979H1527N265O287S8; сомфазепор, соматотропин (рекомбинантный, свиньи) C938H1465N257O278S6; сомидобав, соматотропин (рекомбинантный, бычий) С1020H1596N274O302S9; тепротид, потенциатор В брадикинина, 2-L-Trp-3-де-L-Leu-4-де-L-Pro-8-L-глутамин-, содержащий 9 аминокислот, полезный в качестве ингибитора ангиотензинпревращающего фермента; терипаратид, белок, содержащий 34 аминокислоты, полезный качестве ингибитора резорбции костей и в качестве дополнительного агента при лечении остеопороза; тимальфазин, тимозин -Asp-L-глутамин] -, содержащий 191 аминокислоту, полезный в качестве стимулирующего лактацию средства, особенно для ветеринарного использования; сомалапор, соматотропин (редуцированный из клона свиньи pPGH-1), N-L-аланил-гормон роста, содержащий в сумме 191 аминокислоту, полезный в качестве гормона (роста свиньи); соматрем, соматотропин (человека), N-L-Met-, содержащий 191 аминокислоту, имеющий два дисульфидных мостика, полезный в качестве гормона роста; соматотропин, одна полипептидная цепь, содержащая 191 аминокислоту, имеющая нормальную структуру основного гормона, стимулирующего рост, получаемый из передней доли гипофиза человека, полезный в качестве гормона роста; соматотропин, доступный в рекомбинантной форме; сомавубав, соматотропин (бычий), 127-L-Leu-, который является одним из четырех встречающихся в природе молекулярных вариантов соматотропина гипофиза быка, полезный в качестве стимулирующего лактацию средства; соменопор, соматотропин (редуцированный, pPGH-1 клона свиньи), N-L-Аlа-32-де-L-С1u-33-де-L-Аrg-34-де-L-А1а-35-де-L-Тyr-36-де-L-Ilе-37-де-L-Рrо-38-де-L-Glu-, содержащий 190 аминокислот, полезный в качестве гормона роста свиньи; сометрибав, соматотропин (бычий) 1-L-Met-127-L-Leu-, содержащий 191 аминокислоту, полезный в качестве применяемого в ветеринарии стимулятора роста; сометрипор, соматотропин (рекомбинантный, свиньи) C979H1527N265O287S8; сомфазепор, соматотропин (рекомбинантный, свиньи) C938H1465N257O278S6; сомидобав, соматотропин (рекомбинантный, бычий) С1020H1596N274O302S9; тепротид, потенциатор В брадикинина, 2-L-Trp-3-де-L-Leu-4-де-L-Pro-8-L-глутамин-, содержащий 9 аминокислот, полезный в качестве ингибитора ангиотензинпревращающего фермента; терипаратид, белок, содержащий 34 аминокислоты, полезный качестве ингибитора резорбции костей и в качестве дополнительного агента при лечении остеопороза; тимальфазин, тимозин  1 (бычий), содержащий 28 аминокислот, полезный в качестве противоопухолевого агента, при лечении гепатита и инфекционных заболеваний и в качестве усилителя вакцин; тимопентин, пентапептид, полезный в качестве иммунорегулятора; трипторелин, рилизинг-фактор лютеинизирующего гормона (свиньи), 6-D-Trp, содержащий 10 аминокислот, полезный в качестве противоопухолевого агента; вапреотид, содержащий 8 аминокислот, имеющий один дисульфидный мостик, полезен в качестве противоопухолевого агента; вазопрессин в форме 8-L-Arg или 8-L-Lys-, содержащий 9 аминокислот, имеющий один дисульфидный мостик, полезный в качестве антидиуретического гормона; миоглобин; гемоглобин; 1 (бычий), содержащий 28 аминокислот, полезный в качестве противоопухолевого агента, при лечении гепатита и инфекционных заболеваний и в качестве усилителя вакцин; тимопентин, пентапептид, полезный в качестве иммунорегулятора; трипторелин, рилизинг-фактор лютеинизирующего гормона (свиньи), 6-D-Trp, содержащий 10 аминокислот, полезный в качестве противоопухолевого агента; вапреотид, содержащий 8 аминокислот, имеющий один дисульфидный мостик, полезен в качестве противоопухолевого агента; вазопрессин в форме 8-L-Arg или 8-L-Lys-, содержащий 9 аминокислот, имеющий один дисульфидный мостик, полезный в качестве антидиуретического гормона; миоглобин; гемоглобин;  -лактоглобулин; иммуноглобулин-G (IgG); антигемофилический фактор (фактор VIII); лизоцим; убиквитин; фактор агрегации тромбоцитов (ФАТ); фактор некроза опухоли- -лактоглобулин; иммуноглобулин-G (IgG); антигемофилический фактор (фактор VIII); лизоцим; убиквитин; фактор агрегации тромбоцитов (ФАТ); фактор некроза опухоли- (ФНО- (ФНО- ); фактор некроза опухоли- ); фактор некроза опухоли- (ФНО- (ФНО- ); воспалительный белок макрофагов (ВБМ); гепарин; катионный белок эозинофилов (КБЭ); рекомбинантный фактор IX; моноклональное антитело к не-Ходжкинской лимфоме В-клеток, интерферон альфа, полезный для лечения гепатита С; и полученная из фибробластов искусственная кожа для лечения ран и ожогов.
Состояния, которые являются эффективными для проведения реакции конденсации способа по изобретению по существу до завершения, включают в себя те состояния, которые превращают присутствующую воду из жидкой фазы в газообразную или твердую фазу, посредством чего она удаляется из среды указанной реакции конденсации. Для того чтобы подходить для способа по настоящему изобретению, указанные состояния должны также отличаться масштабируемостью, то есть способностью легко и эффективно адаптироваться для получения в большом, промышленном масштабе, и воспоизводимостью, то есть способностью осуществляться последовательно без значительного отклонений в конечном результате. Соответственно указанные состояния представляют собой такие состояния, которые оптимизируют энергетические затраты в способе, необходимые для наиболее эффективного отделения воды водной среды, в которой происходит реакция конденсации, включая воду, образуемую в ходе самой указанной реакции конденсации, от исходных материальных реагентов и аддуктного конечного продукта конденсации.
При температурах выше 0oС состояния, которые оптимизируют энергетические затраты в способе, включают в себя (а) нагревание указанной реакционной смеси в указанной водной среде до самой высокой температуры, совместимой с поддержанием целостности белкового исходного материального реагента и аддуктного конечного продукта конденсации, а также совместимой с оптимальными эффективностями и экономичностью осуществления указанного способа получения, включающего в себя указанную реакцию конденсации; (б) разделение указанной реакционной смеси в указанной водной среде на самые маленькие капли, совместимые с поддержанием целостности белкового исходного материального реагента и аддуктного конечного продукта конденсации, а также совместимого с оптимальными эффективностями и экономичностью осуществления указанного способа получения, включающего в себя указанную реакцию конденсации; и (в) придание указанным каплям, образуемым таким образом, самой высокой относительной скорости по отношению к инертному в их отношении газу, через который их пропускают, совместимой с поддержанием целостности белкового исходного материального реагента и аддуктного конечного продукта конденсации, а также совместимой с оптимальными эффективностями и экономичностью осуществления указанного способа получения, включающего в себя указанную реакцию конденсации.
Кроме того, реакционную смесь нагревают до температуры от 25oС до 125oС, предпочтительно от 40oС до 120oС, более предпочтительно от 50oС до 115oС, еще более предпочтительно от 60oС до 110oС и наиболее предпочтительно от 75oС до 105oС, поддерживая водную среду в жидкой фазе путем воздействия там, где требуется, повышенным давлением. Тем не менее, обычно более полезно использовать более низкие, то есть пониженные давления, в свете того факта, что один из реагентов представляет собой белок. Пониженное давление позволяет затрачивать по существу то же самое количество энергии в системе, поддерживая в ней более низкую температуру для того, чтобы перевести реакционную смесь из жидкой в паровую фазу. Таким образом, понятно, что следует соблюдать осторожность в отношении любых высоких температур, которые разрешено подводить к реакционной смеси. Самые высокие из вышеупомянутых температур можно в большинстве случаев поддерживать в течение лишь очень короткого времени, обычно нескольких секунд. Поддержание более низких температур в реакционной смеси, возможно сопровождаемое приложением пониженного давления, может оказаться благоприятным или даже необходимым там, где реагенты или конечные продукты обладают достаточно низкими точками плавления, так что они представляют собой технологические проблемы.
Кроме того, реакционная смесь в указанной водной окружающей среде разделяется на капли, имеющие средний диаметр от 1,0 мкм до 5,0 мм, предпочтительно от 10 мкм до 1,0 мм, более предпочтительно от 100 мкм до 900 мкм, более предпочтительно от 200 мкм до 800 мкм и наиболее предпочтительно от 300 мкм до 700 мкм.
Относительная скорость, которая сообщается указанным каплям, составляет от 0,1 м/сек до 5,0 м/сек, предпочтительно от 0,2 м/сек до 4,0 м/сек, более предпочтительно от 0,3 м/сек до 3,0 м/сек, более предпочтительно от 0,4 м/сек до 2,0 м/сек и наиболее предпочтительно от 0,5 м/сек до 1,0 м/сек.
При температурах 0oС и ниже эти указанные условия, которые оптимизируют энергетические затраты в способе, включают в себя (а) охлаждение указанной реакционной смеси в указанной водной среде до температуры, достаточно низкой для замораживания по существу всей несвязанной жидкой воды, присутствующей в указанной водной среде, причем указанная температура совместима с поддержанием целостности белкового исходного материального реагента и аддуктного конечного продукта конденсации, а также совместима с оптимальными эффективностями и экономичностью осуществления указанного способа получения, включающего в себя указанную реакцию конденсации; (б) воздействие на охлажденную таким образом указанную реакционную смесь в указанной замороженной водной среде пониженного давления в присутствии инертного в ее отношении газа, совместимого с поддержанием целостности белкового исходного материального реагента и аддуктного конечного продукта конденсации, а также совместимо с оптимальными эффективностями и экономичностью осуществления указанного способа получения, включающего в себя указанную реакцию конденсации.
Кроме того, реакционную смесь охлаждают до температуры от -110oС до 0oС, предпочтительно от -45oС до -5oС, более предпочтительно от -40oС до -10oС, более предпочтительно от -35oС до -15oС и наиболее предпочтительно от -30oС до -20oС, поддерживая водную окружающую среду в твердой фазе.
Пониженное давление, которым воздействуют на указанную охлажденную реакционную смесь в указанной водной среде, составляет от 666,61 Па (5,0 мм рт. ст. ) (абсолютное) до 0,0133322 Па (0,0001 мм рт. ст.) (абсолютное), предпочтительно от 133,322 Па (1,0 мм рт. ст.) (абсолютное) до 0,066661 Па (0,0005 мм рт. ст.) (абсолютное), более предпочтительно от 66,661 Па (0,5 мм рт. ст.) (абсолютное) до 0,133322 Па (0,001 мм рт. ст.) (абсолютное), более предпочтительно от 26,6644 Па (0,2 мм рт. ст.) (абсолютное) до 0,66661 Па (0,005 мм рт. ст. ) (абсолютное) и наиболее предпочтительно от 13,3322 Па (0,1 мм рт. ст.) (абсолютное) до 1,33322 Па (0,01 мм рт. ст.) (абсолютное).
Способы реакции конденсации по настоящему изобретению можно также осуществлять в условиях пониженной влажности, посредством чего увеличивается скорость удаления воды и общее удаляемое количество. Это согласуется с задачей проведения реакции конденсации до завершения путем удаления от приблизительно 97,0% до приблизительно 99,9% по массе, предпочтительно от приблизительно 98,0% до приблизительно 99,0% по массе воды, уже присутствующей или образующейся в ходе указанной реакции конденсации, для того, чтобы обеспечить скорость превращения в указанный аддуктный конечный продукт конденсации, то есть с получающимся в результате выходом указанного аддуктного конечного продукта конденсации, равным или большим чем приблизительно 98,5% по массе, предпочтительно равным или большим чем приблизительно 99,5% по массе, основываясь на массе реагентов. Согласуясь с этой задачей, количество влаги, присутствующей в аддуктном конечном продукте конденсации, соответственно составляет от 3,0% до 0,001% по массе, основываясь на массе конечного продукта, предпочтительно от 2,0% до 3,0% по массе, основываясь на массе указанного конечного продукта. Также предложено, что после завершения реакции конденсации количество присутствующей влаги может быть уменьшено до 0,1%-0,001% по массе, или 0,05%-0,005% по массе, или даже до 0,03%-0,01% по массе, основываясь на массе конечного продукта. Существенно большие количества влаги могут присутствовать там, где это требуется для стабильности белка, лежащие в диапазоне от 3,0% до 20,0% по массе, предпочтительно от 5,0% до 15,0% по массе и более предпочтительно от 8,0% до 12,0% по массе, основываясь на массе конечного продукта.
Вышеописанные способы получения, включающие в себя способы конденсации, можно осуществлять в условиях пониженной влажности, посредством чего увеличивается скорость удаления воды и общее удаляемое количество. Этот способ согласуется с задачей проведения реакции конденсации до завершения путем удаления от приблизительно 97,0% до приблизительно 99,9% по массе, предпочтительно от приблизительно 98,0% до приблизительно 99,0% по массе воды, уже присутствующей или образующейся в ходе указанной реакции конденсации. Тем не менее, количество влаги, присутствующей в аддуктном конечном продукте конденсации, должно быть совместимо с поддержанием целостности указанного конечного продукта. Соответственно желаемые уровни влаги в аддуктном конечном продукте конденсации будут находиться в диапазоне от 3,0% до 20,0% по массе, предпочтительно от 4,0% до 15,0% по массе и более предпочтительно от 5,0% до 10,0% по массе, основываясь на массе конечного продукта. Например, когда продукт представляет собой соматотропин овцы, количество влаги, присутствующей в конечном продукте, будет составлять от 6,0% до 9,0% по массе.
Приложение вышеописанных состояний к способам получения по настоящему изобретению будет эффективным для удаления от приблизительно 97,0% до приблизительно 99,9% по массе, предпочтительно от приблизительно 98,0% до приблизительно 99,0% по массе воды, присутствующей во время указанной реакции конденсации, что совместимо с поддержанием целостности реагентов конденсации и аддуктного конечного продукта конденсации, с получающимся в результате выходом указанного аддуктного конечного продукта конденсации, равным или большим чем приблизительно 98,5% по массе, предпочтительно равным или большим чем приблизительно 99,5% по массе, основываясь на массе реагентов.
Кроме того, исходные материальные реагенты могут также быть приведены в тесный контакт друг с другом в виде водного раствора непосредственно перед или по существу одновременно с диспергированием аддуктного конечного продукта конденсации в форме капель. Эту однородную смесь в форме водного раствора получают путем механического воздействия, достаточного для того, чтобы привести указанные исходные материальные реагенты в контакт друг с другом, в то же самое время механически не разрушая белковый компонент указанного конденсационного аддукта. Предложены принципы для выбора механического смесительного устройства, которое оказывает мягкое воздействие для того, чтобы избежать значительных уровней напряжения при сдвиге в растворе. Например, исследователь может выбрать стационарные смесители со стержнями, лопастями или другими типами мешалок; аппарат непрерывного смешения в форме лотка с перемешивающими средствами, включающими в себя медленно движущийся червяк или дефлекторы, которые действуют в сочетании с покачиванием всего лотка; приспособление с двойной трубой, в котором реакционная смесь подводится в центральную трубу и нагревающая среда с противоположным потоком подводится в зазор между трубами, с перемешиванием путем стволового перемешивания в центральной трубе, которая несет лопасти; перемешиваемый реакционный сосуд с каландрами, используемыми для нагревания, в котором водоспускная труба содержит крыльчатку, с усиленной циркуляцией, увеличивающей перенос тепла к реакционной смеси; смесительные устройства, которые концентрируют реакционную смесь; и вакуумный реакционный аппарат с перемешиваемой реакционной камерой, поддерживаемой при низком давлении.
Вышеупомянутую однородную смесь в форме водного раствора также получают путем обращения обратной эмульсии, в которой указанные исходные материальные реагенты отделяют друг от друга в виде растворов в непрырывной фазе, то есть фазе растворителя, и в дисперсной фазе, то есть водной фазе указанной обратной эмульсии. Обращения указанной обратной эмульсии достигают путем быстрого распределения указанной обратной эмульсии в водной системе, которая, как указано, является той же самой, как и дисперсная фаза. Получающийся в результате аддуктный конечный продукт конденсации, получаемый с использованием любого из описанных выше способов смешивания, затем легко диспергируется в форме капель в условиях окружающей среды, как дополнительно описано ниже.
Исходные материальные реагенты можно также привести в тесный контакт друг с другом в форме капель, то есть образование указанного аддуктного конечного продукта конденсации происходит непосредственно перед или по существу одновременно с диспергированием указанного конечного продукта в форме капель. Получения однородной смеси указанных исходных материальных реагентов в форме капель добиваются путем механического воздействия в форме раздельных струй каждого указанного исходного материального реагента, направленных таким образом друг по отношению к другу, что достигается максимальное смешивание, столкновение и контакт указанных капель. Распыляющий аппарат для использования в этом способе может включать в себя механические или гидравлические насосы, достаточные для придания энергии, необходимой для разделения водной струи, содержащей указанные исходные материальные реагенты, на капли размера, требуемого для удаления от приблизительно 97,0% до приблизительно 99,9% по массе, предпочтительно от приблизительно 98,0% до приблизительно 99,0% по массе воды, уже присутствующей или образующейся в ходе указанной реакции конденсации, что совместимо с поддержанием целостности реагентов конденсации и аддуктного конечного продукта конденсации, а также для обеспечения степени превращения в указанный аддуктный конечный продукт конденсации, то есть с получающимся в результате выходом указанного аддуктного конечного продукта конденсации, равным или большим чем приблизительно 98,5% по массе, предпочтительно равным или большим чем приблизительно 99,5% по массе, основываясь на массе реагентов. Указанные насосы можно использовать в сочетании с соплами, посредством чего механические усилия сдвига прикладываются к указанному водному потоку указанного исходных материальных реагентов, в результате чего указанный поток разделяется на последовательно уменьшающиеся общие объемы капель до того, как будет достигнут желаемый размер капель.
Распыляющий аппарат, который можно также использовать, включает в себя генераторы потока газа и средства для диспергирования в нем указанного водного потока указанных исходных материальных реагентов таким образом, чтобы посредством этого они увлекались потоком газа в форме капель, имеющих желаемый размер капель. Указанный газ является по существу инертным в отношении указанных исходных материальных реагентов и указанного аддуктного конечного продукта конденсации и включает в себя среди прочих воздух, азот или гелий, которые сжаты до давления, достаточно высокого для того, чтобы обеспечить поток газа, имеющий объем и скорость, требуемые для того, чтобы увлечь указанные капли указанных исходных материальных реагентов и обеспечить их максимальное смешивание, контакт и столкновение, достаточные для удаления от приблизительно 97,0% до приблизительно 99,9% по массе, предпочтительно от приблизительно 98,0% до приблизительно 99,0% по массе воды, уже присутствующей или образующейся в ходе указанной реакции конденсации, что совместимо с поддержанием целостности реагентов конденсации и аддуктного конечного продукта конденсации, а также для обеспечения степени превращения в указанный аддуктный конечный продукт конденсации, то есть с получающимся в результате выходом указанного аддуктного конечного продукта конденсации, равным или большим чем приблизительно 98,5% по массе, предпочтительно равным или большим чем приблизительно 99,5% по массе, основываясь на массе реагентов.
Распыляющий аппарат, используемый в способе по настоящему изобретению, включает в себя любое подходящее сочетание вышеописанных генераторов потока газа и ассоциированных диспергирующих средств вместе с указанными вышеописанными гидравлическими насосами и ассоциированными соплами.
Однородного смешивания указанных исходных материальных реагентов в форме капель в соответствии с настоящим изобретением можно также достигнуть путем механического воздействия в форме быстро вращающегося диска, на поверхность которого направлен водный поток, содержащий каждый указанный исходный материальный реагент. Можно использовать отдельный диск для каждого исходного материального реагента или же используется один диск, который приспособлен для того, чтобы сводить вместе оба водных потока указанных исходных материальных реагентов. Каждый указанный водный поток пересекает указанный диск таким образом, что он отталкивается от края указанного диска в форме капель. Скорость указанного вращающегося диска изменяется таким образом, чтобы придать достаточное количество энергии для разделения каждого указанного водного потока на капли такого размера и скорости, что достигается максимальное смешивание, столкновение и контакт указанных капель. Смешивание указанных исходных материальных реагентов происходит по существу в условиях окружающей среды, отрегулированных в отношении температуры, влажности и давления таким образом, чтобы удалять от приблизительно 97,0% до приблизительно 99,9% по массе, предпочтительно от приблизительно 98,0% до приблизительно 99,0% по массе воды, уже присутствующей или образующейся в ходе указанной реакции конденсации, что совместимо поддержанием целостности реагентов конденсации и аддуктного конечного продукта конденсации, а также чтобы обеспечивать степень превращения в указанный аддуктный конечный продукт конденсации, то есть с получающимся в результате выходом указанного аддуктного конечного продукта конденсации, равным или большим чем приблизительно 98,5% по массе, предпочтительно равном или большем чем приблизительно 99,5% по массе, основываясь на массе реагентов.
В объеме настоящего изобретения предполагается осуществлять вышеописанные способы получения по существу в условиях окружающей среды. Тем не менее, в предпочтительных воплощениях настоящего изобретения указанные по существу условия окружающей среды значительно изменены таким образом, чтобы увеличить скорость и общую степень удаления воды из указанной реакции конденсации и получающегося в результате аддуктного конечного продукта конденсации. В частности, указанные изменения включают в себя нагревание водных потоков указанных исходных материальных реагентов и аппаратные средства, при помощи которых они обрабатываются во время некоторых или всех процедур указанных способов получения, предложенных здесь. Соответственно по существу увеличиваются скорости реакции и степень превращения в аддуктный конечный продукт конденсации.
Способ получения можно модифицировать путем приложения электрических полей к различным частям аппарата или веществам, используемым в указанном способе получения, посредством чего максимизируются смешивание, столкновение и контакт используемых капель указанных исходных материальных реагентов и по существу увеличивается выход указанного аддуктного конечного продукта конденсации.
Аппаратные средства и стадии способа можно помещать по существу в условия пониженного давления, в особенности те средства и стадии, которые вовлечены в реакцию указанных исходных материальных реагентов, с тем, чтобы достигнуть их максимальных смешивания, контакта и столкновения, достаточных для удаления от приблизительно 97,0% до приблизительно 99,9% по массе, предпочтительно от приблизительно 98,0% до приблизительно 99,0% по массе воды, уже присутствующей или образующейся в ходе указанной реакции конденсации, что совместимо с поддержанием целостности реагентов конденсации и аддуктного конечного продукта конденсации, а также для обеспечения степени превращения в указанный аддуктный конечный продукт конденсации, то есть с получающимся в результате выходом указанного аддуктного конечного продукта конденсации, равным или большим чем приблизительно 98,5% по массе, предпочтительно равным или большем чем приблизительно 99,5% по массе, основываясь на массе реагентов.
Можно использовать средства с кипящим слоем для увеличения скорости и степени удаления воды из капельного аддуктного конечного продукта конденсации, а также для увеличения выхода указанного капельного аддуктного конечного продукта конденсации до равного или превышающего приблизительно 98,5% по массе, основываясь на массе указанных исходных материальных реагентов.
Настоящее изобретение также относится к новым композициям веществ, получаемых вышеописанными способами получения по настоящему изобретению, содержащим конденсационные аддукты, являющиеся основаниями Шиффа, компоненты которых включают в себя белок и ароматический о-гидроксиальдегид, где указанные компоненты образовали реакционную смесь и получающийся в результате аддуктный конечный продукт конденсации в условиях, эффективных для удаления от приблизительно 97,0% до приблизительно 99,9% по массе, предпочтительно от приблизительно 98,0% до приблизительно 99,0% по массе воды, уже присутствующей или образующейся в ходе указанной реакции конденсации, что совместимо с поддержанием целостности реагентов конденсации и аддуктного конечного продукта конденсации, и для обеспечения степени превращения в указанный аддуктный конечный продукт конденсации, то есть с получающимся в результате выходом указанного аддуктного конечного продукта конденсации, равным или большим чем приблизительно 98,5% по массе, предпочтительно равным или большим чем приблизительно 99,5% по массе, основываясь на массе реагентов. Также предложены указанные композиции веществ в форме капель, имеющих средние диаметры, находящиеся в диапазоне от приблизительно 0,1 мкм до приблизительно 10,0 мкм, предпочтительно от приблизительно 1,0 до приблизительно 5,0 мкм, более предпочтительно от приблизительно 2,0 мкм до приблизительно 4,0 мкм и наиболее предпочтительно от приблизительно 2,5 мкм до приблизительно 3,5 мкм.
Новые композиции веществ по настоящему изобретению включают в себя те композиции, в которых их указанный белковый компонент можно вводить животному и после этого он поглощается, полезно используется, метаболизируется и выводится, то есть удаляется из указанного животного. Указанный белковый компонент может обладать такими характеристиками перед тем, как он вступит в реакцию с ароматическим о-гидроксиальдегидом с образованием улучшенных аддуктов конденсации, являющихся основаниями Шиффа, по настоящему изобретению; тем не менее, образование такого конденсационного аддукта будет существенно усиливать такие свойства и характеристики и может посредством этого делать подходящим белковый кандидат, который в противном случае не был бы подходящим.
Указанный белковый компонент обладает способностью находить полезное применение у конкретного животного или животных, которым его вводят, которое наиболее обычно является терапевтическим. Сюда включены белки, обладающие другими биологическими активностями, которые благоприятны для животного или для использования животного, включая белковые гормоны, такие как соматотропин, который используют для регуляции роста животных, которых обычно держат в качестве домашнего запаса для приготовления пищи, и соматотропин, вводимый таким животным, обладает благоприятной полезностью увеличения эффективности использования корма и уменьшения времени, необходимого для доставки такого племенного животного на рынок. Также включены белки, которые улучшаются путем использования способов по настоящему изобретению в отношении как их стабильности при длительном хранении, а также в отношении улучшенных возможностей их введения животным с использованием таких форм, как твердые имплантаты для парентерального введения. Также включены белки, которые обладают общепризнанной полезностью в качестве терапевтических агентов для животных и человека и которые можно использовать со способами по настоящему изобретению.
Подробное описание изобретения ); воспалительный белок макрофагов (ВБМ); гепарин; катионный белок эозинофилов (КБЭ); рекомбинантный фактор IX; моноклональное антитело к не-Ходжкинской лимфоме В-клеток, интерферон альфа, полезный для лечения гепатита С; и полученная из фибробластов искусственная кожа для лечения ран и ожогов.
Состояния, которые являются эффективными для проведения реакции конденсации способа по изобретению по существу до завершения, включают в себя те состояния, которые превращают присутствующую воду из жидкой фазы в газообразную или твердую фазу, посредством чего она удаляется из среды указанной реакции конденсации. Для того чтобы подходить для способа по настоящему изобретению, указанные состояния должны также отличаться масштабируемостью, то есть способностью легко и эффективно адаптироваться для получения в большом, промышленном масштабе, и воспоизводимостью, то есть способностью осуществляться последовательно без значительного отклонений в конечном результате. Соответственно указанные состояния представляют собой такие состояния, которые оптимизируют энергетические затраты в способе, необходимые для наиболее эффективного отделения воды водной среды, в которой происходит реакция конденсации, включая воду, образуемую в ходе самой указанной реакции конденсации, от исходных материальных реагентов и аддуктного конечного продукта конденсации.
При температурах выше 0oС состояния, которые оптимизируют энергетические затраты в способе, включают в себя (а) нагревание указанной реакционной смеси в указанной водной среде до самой высокой температуры, совместимой с поддержанием целостности белкового исходного материального реагента и аддуктного конечного продукта конденсации, а также совместимой с оптимальными эффективностями и экономичностью осуществления указанного способа получения, включающего в себя указанную реакцию конденсации; (б) разделение указанной реакционной смеси в указанной водной среде на самые маленькие капли, совместимые с поддержанием целостности белкового исходного материального реагента и аддуктного конечного продукта конденсации, а также совместимого с оптимальными эффективностями и экономичностью осуществления указанного способа получения, включающего в себя указанную реакцию конденсации; и (в) придание указанным каплям, образуемым таким образом, самой высокой относительной скорости по отношению к инертному в их отношении газу, через который их пропускают, совместимой с поддержанием целостности белкового исходного материального реагента и аддуктного конечного продукта конденсации, а также совместимой с оптимальными эффективностями и экономичностью осуществления указанного способа получения, включающего в себя указанную реакцию конденсации.
Кроме того, реакционную смесь нагревают до температуры от 25oС до 125oС, предпочтительно от 40oС до 120oС, более предпочтительно от 50oС до 115oС, еще более предпочтительно от 60oС до 110oС и наиболее предпочтительно от 75oС до 105oС, поддерживая водную среду в жидкой фазе путем воздействия там, где требуется, повышенным давлением. Тем не менее, обычно более полезно использовать более низкие, то есть пониженные давления, в свете того факта, что один из реагентов представляет собой белок. Пониженное давление позволяет затрачивать по существу то же самое количество энергии в системе, поддерживая в ней более низкую температуру для того, чтобы перевести реакционную смесь из жидкой в паровую фазу. Таким образом, понятно, что следует соблюдать осторожность в отношении любых высоких температур, которые разрешено подводить к реакционной смеси. Самые высокие из вышеупомянутых температур можно в большинстве случаев поддерживать в течение лишь очень короткого времени, обычно нескольких секунд. Поддержание более низких температур в реакционной смеси, возможно сопровождаемое приложением пониженного давления, может оказаться благоприятным или даже необходимым там, где реагенты или конечные продукты обладают достаточно низкими точками плавления, так что они представляют собой технологические проблемы.
Кроме того, реакционная смесь в указанной водной окружающей среде разделяется на капли, имеющие средний диаметр от 1,0 мкм до 5,0 мм, предпочтительно от 10 мкм до 1,0 мм, более предпочтительно от 100 мкм до 900 мкм, более предпочтительно от 200 мкм до 800 мкм и наиболее предпочтительно от 300 мкм до 700 мкм.
Относительная скорость, которая сообщается указанным каплям, составляет от 0,1 м/сек до 5,0 м/сек, предпочтительно от 0,2 м/сек до 4,0 м/сек, более предпочтительно от 0,3 м/сек до 3,0 м/сек, более предпочтительно от 0,4 м/сек до 2,0 м/сек и наиболее предпочтительно от 0,5 м/сек до 1,0 м/сек.
При температурах 0oС и ниже эти указанные условия, которые оптимизируют энергетические затраты в способе, включают в себя (а) охлаждение указанной реакционной смеси в указанной водной среде до температуры, достаточно низкой для замораживания по существу всей несвязанной жидкой воды, присутствующей в указанной водной среде, причем указанная температура совместима с поддержанием целостности белкового исходного материального реагента и аддуктного конечного продукта конденсации, а также совместима с оптимальными эффективностями и экономичностью осуществления указанного способа получения, включающего в себя указанную реакцию конденсации; (б) воздействие на охлажденную таким образом указанную реакционную смесь в указанной замороженной водной среде пониженного давления в присутствии инертного в ее отношении газа, совместимого с поддержанием целостности белкового исходного материального реагента и аддуктного конечного продукта конденсации, а также совместимо с оптимальными эффективностями и экономичностью осуществления указанного способа получения, включающего в себя указанную реакцию конденсации.
Кроме того, реакционную смесь охлаждают до температуры от -110oС до 0oС, предпочтительно от -45oС до -5oС, более предпочтительно от -40oС до -10oС, более предпочтительно от -35oС до -15oС и наиболее предпочтительно от -30oС до -20oС, поддерживая водную окружающую среду в твердой фазе.
Пониженное давление, которым воздействуют на указанную охлажденную реакционную смесь в указанной водной среде, составляет от 666,61 Па (5,0 мм рт. ст. ) (абсолютное) до 0,0133322 Па (0,0001 мм рт. ст.) (абсолютное), предпочтительно от 133,322 Па (1,0 мм рт. ст.) (абсолютное) до 0,066661 Па (0,0005 мм рт. ст.) (абсолютное), более предпочтительно от 66,661 Па (0,5 мм рт. ст.) (абсолютное) до 0,133322 Па (0,001 мм рт. ст.) (абсолютное), более предпочтительно от 26,6644 Па (0,2 мм рт. ст.) (абсолютное) до 0,66661 Па (0,005 мм рт. ст. ) (абсолютное) и наиболее предпочтительно от 13,3322 Па (0,1 мм рт. ст.) (абсолютное) до 1,33322 Па (0,01 мм рт. ст.) (абсолютное).
Способы реакции конденсации по настоящему изобретению можно также осуществлять в условиях пониженной влажности, посредством чего увеличивается скорость удаления воды и общее удаляемое количество. Это согласуется с задачей проведения реакции конденсации до завершения путем удаления от приблизительно 97,0% до приблизительно 99,9% по массе, предпочтительно от приблизительно 98,0% до приблизительно 99,0% по массе воды, уже присутствующей или образующейся в ходе указанной реакции конденсации, для того, чтобы обеспечить скорость превращения в указанный аддуктный конечный продукт конденсации, то есть с получающимся в результате выходом указанного аддуктного конечного продукта конденсации, равным или большим чем приблизительно 98,5% по массе, предпочтительно равным или большим чем приблизительно 99,5% по массе, основываясь на массе реагентов. Согласуясь с этой задачей, количество влаги, присутствующей в аддуктном конечном продукте конденсации, соответственно составляет от 3,0% до 0,001% по массе, основываясь на массе конечного продукта, предпочтительно от 2,0% до 3,0% по массе, основываясь на массе указанного конечного продукта. Также предложено, что после завершения реакции конденсации количество присутствующей влаги может быть уменьшено до 0,1%-0,001% по массе, или 0,05%-0,005% по массе, или даже до 0,03%-0,01% по массе, основываясь на массе конечного продукта. Существенно большие количества влаги могут присутствовать там, где это требуется для стабильности белка, лежащие в диапазоне от 3,0% до 20,0% по массе, предпочтительно от 5,0% до 15,0% по массе и более предпочтительно от 8,0% до 12,0% по массе, основываясь на массе конечного продукта.
Вышеописанные способы получения, включающие в себя способы конденсации, можно осуществлять в условиях пониженной влажности, посредством чего увеличивается скорость удаления воды и общее удаляемое количество. Этот способ согласуется с задачей проведения реакции конденсации до завершения путем удаления от приблизительно 97,0% до приблизительно 99,9% по массе, предпочтительно от приблизительно 98,0% до приблизительно 99,0% по массе воды, уже присутствующей или образующейся в ходе указанной реакции конденсации. Тем не менее, количество влаги, присутствующей в аддуктном конечном продукте конденсации, должно быть совместимо с поддержанием целостности указанного конечного продукта. Соответственно желаемые уровни влаги в аддуктном конечном продукте конденсации будут находиться в диапазоне от 3,0% до 20,0% по массе, предпочтительно от 4,0% до 15,0% по массе и более предпочтительно от 5,0% до 10,0% по массе, основываясь на массе конечного продукта. Например, когда продукт представляет собой соматотропин овцы, количество влаги, присутствующей в конечном продукте, будет составлять от 6,0% до 9,0% по массе.
Приложение вышеописанных состояний к способам получения по настоящему изобретению будет эффективным для удаления от приблизительно 97,0% до приблизительно 99,9% по массе, предпочтительно от приблизительно 98,0% до приблизительно 99,0% по массе воды, присутствующей во время указанной реакции конденсации, что совместимо с поддержанием целостности реагентов конденсации и аддуктного конечного продукта конденсации, с получающимся в результате выходом указанного аддуктного конечного продукта конденсации, равным или большим чем приблизительно 98,5% по массе, предпочтительно равным или большим чем приблизительно 99,5% по массе, основываясь на массе реагентов.
Кроме того, исходные материальные реагенты могут также быть приведены в тесный контакт друг с другом в виде водного раствора непосредственно перед или по существу одновременно с диспергированием аддуктного конечного продукта конденсации в форме капель. Эту однородную смесь в форме водного раствора получают путем механического воздействия, достаточного для того, чтобы привести указанные исходные материальные реагенты в контакт друг с другом, в то же самое время механически не разрушая белковый компонент указанного конденсационного аддукта. Предложены принципы для выбора механического смесительного устройства, которое оказывает мягкое воздействие для того, чтобы избежать значительных уровней напряжения при сдвиге в растворе. Например, исследователь может выбрать стационарные смесители со стержнями, лопастями или другими типами мешалок; аппарат непрерывного смешения в форме лотка с перемешивающими средствами, включающими в себя медленно движущийся червяк или дефлекторы, которые действуют в сочетании с покачиванием всего лотка; приспособление с двойной трубой, в котором реакционная смесь подводится в центральную трубу и нагревающая среда с противоположным потоком подводится в зазор между трубами, с перемешиванием путем стволового перемешивания в центральной трубе, которая несет лопасти; перемешиваемый реакционный сосуд с каландрами, используемыми для нагревания, в котором водоспускная труба содержит крыльчатку, с усиленной циркуляцией, увеличивающей перенос тепла к реакционной смеси; смесительные устройства, которые концентрируют реакционную смесь; и вакуумный реакционный аппарат с перемешиваемой реакционной камерой, поддерживаемой при низком давлении.
Вышеупомянутую однородную смесь в форме водного раствора также получают путем обращения обратной эмульсии, в которой указанные исходные материальные реагенты отделяют друг от друга в виде растворов в непрырывной фазе, то есть фазе растворителя, и в дисперсной фазе, то есть водной фазе указанной обратной эмульсии. Обращения указанной обратной эмульсии достигают путем быстрого распределения указанной обратной эмульсии в водной системе, которая, как указано, является той же самой, как и дисперсная фаза. Получающийся в результате аддуктный конечный продукт конденсации, получаемый с использованием любого из описанных выше способов смешивания, затем легко диспергируется в форме капель в условиях окружающей среды, как дополнительно описано ниже.
Исходные материальные реагенты можно также привести в тесный контакт друг с другом в форме капель, то есть образование указанного аддуктного конечного продукта конденсации происходит непосредственно перед или по существу одновременно с диспергированием указанного конечного продукта в форме капель. Получения однородной смеси указанных исходных материальных реагентов в форме капель добиваются путем механического воздействия в форме раздельных струй каждого указанного исходного материального реагента, направленных таким образом друг по отношению к другу, что достигается максимальное смешивание, столкновение и контакт указанных капель. Распыляющий аппарат для использования в этом способе может включать в себя механические или гидравлические насосы, достаточные для придания энергии, необходимой для разделения водной струи, содержащей указанные исходные материальные реагенты, на капли размера, требуемого для удаления от приблизительно 97,0% до приблизительно 99,9% по массе, предпочтительно от приблизительно 98,0% до приблизительно 99,0% по массе воды, уже присутствующей или образующейся в ходе указанной реакции конденсации, что совместимо с поддержанием целостности реагентов конденсации и аддуктного конечного продукта конденсации, а также для обеспечения степени превращения в указанный аддуктный конечный продукт конденсации, то есть с получающимся в результате выходом указанного аддуктного конечного продукта конденсации, равным или большим чем приблизительно 98,5% по массе, предпочтительно равным или большим чем приблизительно 99,5% по массе, основываясь на массе реагентов. Указанные насосы можно использовать в сочетании с соплами, посредством чего механические усилия сдвига прикладываются к указанному водному потоку указанного исходных материальных реагентов, в результате чего указанный поток разделяется на последовательно уменьшающиеся общие объемы капель до того, как будет достигнут желаемый размер капель.
Распыляющий аппарат, который можно также использовать, включает в себя генераторы потока газа и средства для диспергирования в нем указанного водного потока указанных исходных материальных реагентов таким образом, чтобы посредством этого они увлекались потоком газа в форме капель, имеющих желаемый размер капель. Указанный газ является по существу инертным в отношении указанных исходных материальных реагентов и указанного аддуктного конечного продукта конденсации и включает в себя среди прочих воздух, азот или гелий, которые сжаты до давления, достаточно высокого для того, чтобы обеспечить поток газа, имеющий объем и скорость, требуемые для того, чтобы увлечь указанные капли указанных исходных материальных реагентов и обеспечить их максимальное смешивание, контакт и столкновение, достаточные для удаления от приблизительно 97,0% до приблизительно 99,9% по массе, предпочтительно от приблизительно 98,0% до приблизительно 99,0% по массе воды, уже присутствующей или образующейся в ходе указанной реакции конденсации, что совместимо с поддержанием целостности реагентов конденсации и аддуктного конечного продукта конденсации, а также для обеспечения степени превращения в указанный аддуктный конечный продукт конденсации, то есть с получающимся в результате выходом указанного аддуктного конечного продукта конденсации, равным или большим чем приблизительно 98,5% по массе, предпочтительно равным или большим чем приблизительно 99,5% по массе, основываясь на массе реагентов.
Распыляющий аппарат, используемый в способе по настоящему изобретению, включает в себя любое подходящее сочетание вышеописанных генераторов потока газа и ассоциированных диспергирующих средств вместе с указанными вышеописанными гидравлическими насосами и ассоциированными соплами.
Однородного смешивания указанных исходных материальных реагентов в форме капель в соответствии с настоящим изобретением можно также достигнуть путем механического воздействия в форме быстро вращающегося диска, на поверхность которого направлен водный поток, содержащий каждый указанный исходный материальный реагент. Можно использовать отдельный диск для каждого исходного материального реагента или же используется один диск, который приспособлен для того, чтобы сводить вместе оба водных потока указанных исходных материальных реагентов. Каждый указанный водный поток пересекает указанный диск таким образом, что он отталкивается от края указанного диска в форме капель. Скорость указанного вращающегося диска изменяется таким образом, чтобы придать достаточное количество энергии для разделения каждого указанного водного потока на капли такого размера и скорости, что достигается максимальное смешивание, столкновение и контакт указанных капель. Смешивание указанных исходных материальных реагентов происходит по существу в условиях окружающей среды, отрегулированных в отношении температуры, влажности и давления таким образом, чтобы удалять от приблизительно 97,0% до приблизительно 99,9% по массе, предпочтительно от приблизительно 98,0% до приблизительно 99,0% по массе воды, уже присутствующей или образующейся в ходе указанной реакции конденсации, что совместимо поддержанием целостности реагентов конденсации и аддуктного конечного продукта конденсации, а также чтобы обеспечивать степень превращения в указанный аддуктный конечный продукт конденсации, то есть с получающимся в результате выходом указанного аддуктного конечного продукта конденсации, равным или большим чем приблизительно 98,5% по массе, предпочтительно равном или большем чем приблизительно 99,5% по массе, основываясь на массе реагентов.
В объеме настоящего изобретения предполагается осуществлять вышеописанные способы получения по существу в условиях окружающей среды. Тем не менее, в предпочтительных воплощениях настоящего изобретения указанные по существу условия окружающей среды значительно изменены таким образом, чтобы увеличить скорость и общую степень удаления воды из указанной реакции конденсации и получающегося в результате аддуктного конечного продукта конденсации. В частности, указанные изменения включают в себя нагревание водных потоков указанных исходных материальных реагентов и аппаратные средства, при помощи которых они обрабатываются во время некоторых или всех процедур указанных способов получения, предложенных здесь. Соответственно по существу увеличиваются скорости реакции и степень превращения в аддуктный конечный продукт конденсации.
Способ получения можно модифицировать путем приложения электрических полей к различным частям аппарата или веществам, используемым в указанном способе получения, посредством чего максимизируются смешивание, столкновение и контакт используемых капель указанных исходных материальных реагентов и по существу увеличивается выход указанного аддуктного конечного продукта конденсации.
Аппаратные средства и стадии способа можно помещать по существу в условия пониженного давления, в особенности те средства и стадии, которые вовлечены в реакцию указанных исходных материальных реагентов, с тем, чтобы достигнуть их максимальных смешивания, контакта и столкновения, достаточных для удаления от приблизительно 97,0% до приблизительно 99,9% по массе, предпочтительно от приблизительно 98,0% до приблизительно 99,0% по массе воды, уже присутствующей или образующейся в ходе указанной реакции конденсации, что совместимо с поддержанием целостности реагентов конденсации и аддуктного конечного продукта конденсации, а также для обеспечения степени превращения в указанный аддуктный конечный продукт конденсации, то есть с получающимся в результате выходом указанного аддуктного конечного продукта конденсации, равным или большим чем приблизительно 98,5% по массе, предпочтительно равным или большем чем приблизительно 99,5% по массе, основываясь на массе реагентов.
Можно использовать средства с кипящим слоем для увеличения скорости и степени удаления воды из капельного аддуктного конечного продукта конденсации, а также для увеличения выхода указанного капельного аддуктного конечного продукта конденсации до равного или превышающего приблизительно 98,5% по массе, основываясь на массе указанных исходных материальных реагентов.
Настоящее изобретение также относится к новым композициям веществ, получаемых вышеописанными способами получения по настоящему изобретению, содержащим конденсационные аддукты, являющиеся основаниями Шиффа, компоненты которых включают в себя белок и ароматический о-гидроксиальдегид, где указанные компоненты образовали реакционную смесь и получающийся в результате аддуктный конечный продукт конденсации в условиях, эффективных для удаления от приблизительно 97,0% до приблизительно 99,9% по массе, предпочтительно от приблизительно 98,0% до приблизительно 99,0% по массе воды, уже присутствующей или образующейся в ходе указанной реакции конденсации, что совместимо с поддержанием целостности реагентов конденсации и аддуктного конечного продукта конденсации, и для обеспечения степени превращения в указанный аддуктный конечный продукт конденсации, то есть с получающимся в результате выходом указанного аддуктного конечного продукта конденсации, равным или большим чем приблизительно 98,5% по массе, предпочтительно равным или большим чем приблизительно 99,5% по массе, основываясь на массе реагентов. Также предложены указанные композиции веществ в форме капель, имеющих средние диаметры, находящиеся в диапазоне от приблизительно 0,1 мкм до приблизительно 10,0 мкм, предпочтительно от приблизительно 1,0 до приблизительно 5,0 мкм, более предпочтительно от приблизительно 2,0 мкм до приблизительно 4,0 мкм и наиболее предпочтительно от приблизительно 2,5 мкм до приблизительно 3,5 мкм.
Новые композиции веществ по настоящему изобретению включают в себя те композиции, в которых их указанный белковый компонент можно вводить животному и после этого он поглощается, полезно используется, метаболизируется и выводится, то есть удаляется из указанного животного. Указанный белковый компонент может обладать такими характеристиками перед тем, как он вступит в реакцию с ароматическим о-гидроксиальдегидом с образованием улучшенных аддуктов конденсации, являющихся основаниями Шиффа, по настоящему изобретению; тем не менее, образование такого конденсационного аддукта будет существенно усиливать такие свойства и характеристики и может посредством этого делать подходящим белковый кандидат, который в противном случае не был бы подходящим.
Указанный белковый компонент обладает способностью находить полезное применение у конкретного животного или животных, которым его вводят, которое наиболее обычно является терапевтическим. Сюда включены белки, обладающие другими биологическими активностями, которые благоприятны для животного или для использования животного, включая белковые гормоны, такие как соматотропин, который используют для регуляции роста животных, которых обычно держат в качестве домашнего запаса для приготовления пищи, и соматотропин, вводимый таким животным, обладает благоприятной полезностью увеличения эффективности использования корма и уменьшения времени, необходимого для доставки такого племенного животного на рынок. Также включены белки, которые улучшаются путем использования способов по настоящему изобретению в отношении как их стабильности при длительном хранении, а также в отношении улучшенных возможностей их введения животным с использованием таких форм, как твердые имплантаты для парентерального введения. Также включены белки, которые обладают общепризнанной полезностью в качестве терапевтических агентов для животных и человека и которые можно использовать со способами по настоящему изобретению.
Подробное описание изобретенияНастоящее изобретение касается способа получения конденсационных аддуктов, являющихся основаниями Шиффа, включающих в себя о-гидроксиальдегид и белок, который представляет значительное улучшение по сравнению со способами получения, известными ранее в области получения аддуктных продуктов этого типа. Способ получения по настоящему изобретению является не только более удачным в отношении его воспроизводимости, эффективности, высоких выходов и заменяемости, то есть пригодности для пропорционально увеличенной реализации, но и аддуктный конечный продукт конденсации по этому способу также представляет значительное и неожиданное улучшение по сравнению с продуктами, получаемыми с использованием способов получения, используемых в прошлом. Аддуктный конечный продукт конденсации по настоящему изобретению является результатом непосредственно самого улучшенного способа конденсации по настоящему изобретению, наряду с его неожиданно лучшей воспроизводимостью, эффективностью, высокими выходами и заменяемостью, то есть пригодностью для пропорционально увеличенной реализации. Как указывалось, настоящее изобретение включает в себя значительное улучшение по сравнению со способами конденсации с образованием основания Шиффа, описанными в технической литературе. Представителями таких способов являются способы, на который ссылаются в работе Кларка и др. US 5198422, в которых получают стабилизированный комплекс, содержащий гормон роста, в частности соматотропин свиньи (СТС), и ароматический альдегид, и комплекс, представляющий собой конечный продукт, выделяют из водного раствора в виде кристаллического продукта, который, как утверждают, обеспечивает продолжительное высвобождение указанного гормона роста. Конкретный способ, с использованием которого из водного раствора выделяют комплекс, представляющий собой конечный продукт в способе Кларка и др., включает в себя удаление водного растворителя путем выпаривания в течение значительного периода времени, после чего продукт извлекают путем его соскабливания со стенок сосуда, в котором осуществлялась реакция. Способом Кларка и др. сложно управлять, поскольку он часто приводит к разрушению продукта и его по существу невозможно пропорционально увеличивать для более крупных уровней получения, Значительный потенциал для разрушения продукта представляет собой прямое следствие поддержания реакционной смеси, представляющей собой концентрированный водный раствор, содержащий в особенности обычно разрушаемый белок в качестве компонента аддуктного конечного продукта конденсации, а также в качестве исходного материального реагента, при повышенных температурах в течение длительных периодов времени. Напротив, способы получения по настоящему изобретению, в особенности воплощения, включающие в себя распылительную сушку и сушку вымораживанием, уменьшают время пребывания исходных материальных реагентов и аддуктного конечного продукта конденсации в водном растворе до минимума. На удаление водного растворителя путем сушки вымораживанием, то есть лиофилизацией, ссылаются в работе Кларка и др., но их открытие, по-видимому, указывает на то, что не было попыток осуществить этот способ. Специалист, следовательно, не может обоснованно ожидать, что такой способ является действующим. Кларк и др. не предложили критичность использования о-гидроксиальдегида и поддержания рН на уровне 7,0 или выше, как в способе по настоящему изобретению. Даже если специалист должен осуществить этот способ лиофилизации Кларка и др., как только что описанный способ с выпариванием, он будет характеризоваться продолжительной сушкой, приводящей непосредственно к вышеописанным проблемам способа, включающим в себя воспроизводимость, качество продукта и способность к пропорциональному увеличению. Тем не менее, работа Кларка и др. приводит к улучшенным продуктам, которые прежде являлись неоптимальными в отношении устойчивости при длительном хранении и общей чистоты продукта, что значительно ограничивало их пригодность при лечении животных. Это оказывает особенно неблагоприятное влияние в тех случаях, когда продукт представляет собой твердое включение в пилюле или родственной форме для парентерального введения путем установки или введения под кожу или в мышечную ткань такого животного, которое лечат. Хотя способ Кларка и др. способен достичь некоторого улучшения устойчивости продукта, не выявили никакого реального пути, при помощи которого пропорционально увеличивали бы такой способ для эффективного и экономически подходящего промышленного уровня получения в более крупном масштабе из-за больших количеств потребляемой энергии и длительных задержек, испытываемых при достижении полного выпаривания водного растворителя. Соответственно в области техники все еще существует необходимость преодоления существующих недостатков настоящего способа получения таких аддуктных продуктов конденсации, являющихся основаниями Шиффа, а также преодоления недостатков нестабильных аддуктных продуктов, получаемых с использованием более ранних, даже менее удовлетворительных способов. В контексте удовлетворения этих потребностей в области техники следует рассмотреть способ по настоящему изобретению. При таком преодолении недостатков способов и продуктов, на которые ссылаются в технической литературе, сущность настоящего изобретения можно обнаружить в открытии того, что удаление водного растворителя можно выполнять с использованием способов, которые являются очень легкими, воспроизводимыми и заменяемыми, то есть способными к эффективной адаптации для осуществления в значительно более крупном масштабе, например распылительной сушки, и которые поэтому являются подходящими для пропорционального увеличения для получения на промышленных уровнях эффективного и экономичного производства. Существенный небелковый компонент аддуктного конечного продукта конденсации, являющегося основанием Шиффа, способов получения по настоящему изобретению представляет собой ароматический о-гидроксиальдегид типа, подробно описанного ниже. Аддуктные продукты конденсации, являющиеся основаниями Шиффа, изначально используют в технике в попытке преодолеть проблему, связанную со стабильностью продукта в используемом основном белке. Причина указанной проблемы представляет собой прямой результат постепенной денатурации белкового продукта, посредством чего возникает нарушение третичной структуры, то есть конфигурации белка, и даже некоторое ухудшение в аспектах вторичной и первичной структуры указанного белка, что приводит в результате к изменению физических свойств белка и значительной утрате биологической активности, проявляемой указанным белком. Конъюгацию указанного белка и карбонильного соединения с образованием основания Шиффа используют в этой области в попытке достичь более стабильного белкового продукта, например вышеупомянутое Кларком и др., где утверждается, что предложена форма соматотропина с длительным высвобождением. Основная реакция конденсации, приводящая в результате к образованию аддукта, являющегося основанием Шиффа, представляет собой равновесную реакцию, которая может быть представлена следующим схематическим уравнением:  Тот факт, что реакция конденсации с образованием основания Шиффа представляет собой реакцию, которая находится в равновесии и которая незначительно смещена направо в изображенном выше уравнении, является предсказуемым из проблем, которые возникают даже с раствором, предложенным Кларком и др., а именно значительные количества используемого белка не находятся в форме аддукта и поэтому подвергаются разрушению их структуры, вызываемой денатурацией с последующей утратой биологической, в данном случае способствующей росту, активности. Существует еще один аспект реакции конденсации с образованием основания Шиффа, который составляет камень преткновения для продвижения вперед, особенно когда этот способ осуществляется Кларком и др. Эта проблема включает в себя сублимацию альдегидного компонента, включающего в себя ароматические о-гидроксиальдегиды, в значительной степени во время длительного способа сушки. Объем такой сублимации может составлять одну треть или больше от общего исходного содержания альдегида в реакционной смеси. Значительная потеря исходных материальных реагентов приводит не только к неизбежному уменьшению выхода конечного продукта, но и к другим проблемам, многие из которых создаются непрореагировавшим белковым исходным материальным реагентом. Непрореагировавший белок подвергается разрушению путем денатурации во время процесса сушки, и получающиеся в результате побочные продукты дополнительно усложняют способ, например, путем осаждения и прилипания к теплообменным поверхностям технологического аппарата, описанного здесь в другом месте. В противоположность этим результатам способы по настоящему изобретению приводят в результате к чрезвычайно высоким выходам, которые почти полностью устраняют проблему сублимации альдегидного компонента. Хотя удаление воды, образующейся путем конденсации, как показано на правой стороне изображенного выше уравнения, может привести реакцию теоретически до завершения с точки зрения применимости закона действующих масс, такое удаление конденсационной воды становится очень проблематичным в свете того факта, что реакция происходит в водном растворе. Эффективное удаление воды конденсации означает удаление всей воды, присутствующей в водной среде реакционной смеси. В области техники в настоящее время известно об этой характерной проблеме образования конденсационного аддукта, являющегося основанием Шиффа, но до того как в настоящем изобретении было предложено решение этой проблемы, в технической литературе не было выдвинуто никаких предложений для ее решения. Первый аспект настоящего изобретения, который составляет существенный элемент его успеха, представляет собой использование ароматического о-гидроксиальдегида в качестве одного из двух ключевых компонентов, реагирующих с образованием конденсационного аддукта, являющегося основанием Шиффа. Ароматические о-гидроксиальдегиды, которые являются полезными в способе конденсации по настоящему изобретению, предпочтительно представляют собой одно или более чем одно соединение формулы (I): 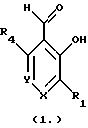 где R1 и R4 независимо выбраны из группы, состоящей по существу из водорода; гидрокси; галогено; нитро; циано; трифторметила; (С1-С6)алкила; (C1-С6)алкокси; (С3-С6)циклоалкила; (С2-С6)алкенила; -C(=O)OR7; -ОС(=O)R7; -S(= O)2; -S(= O)2R7; -S(=O)2OR7; -C(=O)NR7R9; -C(=O)R9; -S(=O)2N(R7)(R9) и -N(R7)(R9), где R7 представляет собой водород или (С1-С4)алкил и R9 представляет собой (С1-С4)алкил; где указанные алкильные, циклоалкильные и алкенильные группы, определяющие R1 и R4, могут возможно быть независимо замещены одним или двумя заместителями, выбранными из группы, состоящей по существу из галогено; гидрокси; (С1-С2)алкила; (С1-С2)алкокси; (С1-С2)алкокси-(С1-С2)алкила; (С1-С2)алкоксикарбонила; карбоксила; (С1-С2)алкилкарбонилокси; нитро: циано; амино, двузамещенного (С1-С2)алкилом; сульфонила и сульфонамидо, двузамещенного (С1-С2)алкилом; и Х и Y независимо представляют собой N, О, S, CHR2 или СНR3 соответственно при условии, что Х и Y оба не выбраны из О и S одновременно; где R2 и R3 независимо выбраны из группы, состоящей по существу из водорода, гидрокси; галогено; нитро; циано; трифторметила; (С1-С6)алкила; (С1-С6)алкокси; (С3-С6)циклоалкила; (С2-С6)алкенила; -C(=O)OR11; -OC(=O)R11; -S(=O)2; -S(=O)2N(R11)(R13) и -N(R11)(R13), где R11 представляет собой водород или (С1-С4)алкил и R13 представляет собой (С1-С4)алкил и где указанные алкильные, циклоалкильные и алкенильные группы, определяющие R2 и R3, могут возможно быть независимо замещены одним или двумя заместителями, выбранными из группы, состоящей по существу из галогено; гидрокси; (С1-С2)алкила; (С1-С2)алкокси; (С1-С2)алкокси-(С1-С2)алкила; (С1-С2)алкоксикрбонила; карбоксила; (С1-С2)алкилкарбонилокси; нитро; циано; амино, двузамещенного (С1-С2)алкилом; сульфонила и сульфонамидо, двузамещенного (С1-С2)алкилом. В соответствии с предпочтительным аспектом настоящего изобретения R1 и R4 независимо выбраны из группы, состоящей из водорода; гидрокси; трифторметила; (С1-С4)алкила; (С1-С4)алкокси; -C(=O)OR7 и -N(R7)(R9), где R7 представляет собой водород или (С1-С2)алкил и R9 представляет собой (С1-С2). В более предпочтительных воплощениях по настоящему изобретению R1 и R4 независимо выбраны из группы, состоящей из водорода; гидрокси; (С1-С2)алкила; (С1-С2)алкокси; карбоксила и метиламино. В этом конкретном воплощении R7 представляет собой водород и R9 представляет собой метил. Также предпочтительно, что когда 1 и R4 определены как алкил и замещены, тогда существует единственный заместитель, выбранный из группы, состоящей из гидрокси; (С1-С2)алкокси; карбоксила; амино, двузамещенного (С1-С2)алкилом и сульфонамидо, двузамещенного (С1-С2)алкилом. Даже более предпочтительно, если указанный одиночный заместитель выбран из группы, состоящей из гидрокси, метокси и диметиламино. Кроме того, в предпочтительных аспектах по настоящему изобретению Х и Y независимо выбраны из группы, состоящей из N, CHR2 или CHR3; и в более предпочтительных аспектах по настоящему изобретению один из Х или Y представляет собой N, а другой представляет собой CHR2 или СНR3 соответственно. Более предпочтительно в настоящем изобретении Х представляет собой CHR2 и Y представляет собой СНR3, где R2 и R3 предпочтительно независимо выбраны из группы, состоящей из водорода; гидрокси; галогено; трифторметила; (С1-С4)алкила; (С1-С4)алкокси; -C(=O)OR11; -S(=O)2N(R11)(R13) и -N(R11)(R13), где R11 предпочтительно представляет обой водород или (С1-С2)алкил и R13 представляет собой (С1-С2)алкил. Даже более предпочтительно в настоящем изобретении R2 и R3 независимо выбраны из группы, состоящей из водорода; гидрокси; (С1-С2)алкила; (С1-С2)алкокси; карбоксила и метиламино. В последнем случае R11 представляет собой водород и R13 представляет собой метил. Предпочтительно в настоящем изобретении, что когда R2 и R3 определены как алкил и замещены, тогда существует единственный заместитель, выбранный из группы, состоящей из гидрокси; (С1-С2)алкокси; карбоксила; амино, двузамещенного (С1-С2)алкилом, и сульфониламино, двузамещенного (С1-С2)алкилом. Для того чтобы дополнительно проиллюстрировать этот аспект настоящего изобретения, касающийся конкретных ароматических о-гидроксиальдегидов, которые особенно подходят для использования здесь, приведены таблицы групп таких предпочтительных альдегидов (см. в конце описания). Из перечисленных выше видов ароматических о-гидроксиальдегидов, которые подходят и являются предпочтительными для использования в способах получения и их продуктах по настоящему изобретению, существует несколько, которые являются наиболее предпочтительными для такого использования, основываясь на их доступности, стоимости, эффективности и легкости и эффективности в указанных способах, и основываясь на их способности приводить к улучшенному продукту, который обладает оптимальными желаемыми характеристиками в смысле стабильности во времени и поддержания исходных уровней биологической активности. Указанные наиболее предпочтительные виды включают в себя салициловый альдегид; 2,3-дигидроксибензальдегид, 2,6-дигидроксибензальдегид; о-ванилин и пиридоксаль, которые могут быть представлены следующими структурными формулами: 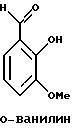 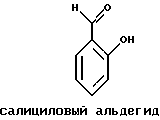 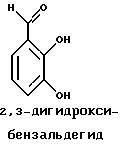 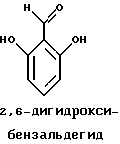 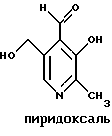 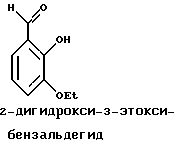 Непосредственно выше был описан первый аспект настоящего изобретения, который составляет существенный элемент его успеха, то есть использование ароматического о-гидроксиальдегида в качестве одного из двух ключевых компонентов, реагирующих с образованием улучшенного продукта конденсации, являющегося основанием Шиффа. Затем следует соответственно подробное описание второго компонента, представляющего собой белок, который реагирует с указанным ароматическим о-гидроксиальдегидом в соответствии с процедурами способа получения по настоящему изобретению с образованием улучшенных аддуктных конечных продуктов конденсации, являющихся основаниями Шиффа, по настоящему изобретению. Белок, который представляет собой кандидата для использования в качестве второго компонента улучшенного конденсационного аддукта, являющегося основанием Шиффа, по настоящему изобретению, должен удовлетворять нескольким требованиям перед тем, как о нем можно судить как о подходящем для такого использования. Во-первых, не существует четко определенного ограничения, которое может быть основано исключительно на размере белка и больше ни на чем. Молекулярный вес или масса белка выражается в дальтонах или килодальтонах (кДа), и белок может состоять из аминокислот в количестве от двух аминокислот до нескольких сотен и тысяч или большего количества аминокислот. Типичный белок имеет массу 30000 дальтон. Важно, тем не менее, чтобы белок-кандидат был таким, чтобы его можно было вводить животному и после этого он поглощался, благоприятно использовался, метаболизировался и выводился, то есть удалялся из указанного животного. Желательно, чтобы указанный белок-кандидат обладал такими характеристиками перед тем, как он вступит в реакцию с ароматическим о-гидроксиальдегидом с образованием улучшенных конденсационных аддуктов, являющихся основаниями Шиффа по настоящему изобретению; тем не менее, образование такого конденсационного аддукта значительно усиливает такие свойства и характеристики и может посредством этого делать подходящим белковый кандидат, который в противном случае оказывается неподходящим. Другая важнейшая характеристика белкового кандидата, подходящего для использования при образовании конденсационных аддуктов, являющихся основаниями Шиффа по настоящему изобретению, представляет собой его способность достигать благоприятной полезности для конкретного животного или животных, которым его вводят. Эта благоприятная полезность наиболее обычно является терапевтической при введении животным или людям. Используемые здесь термины “животное” или “животные” относится ко всем представителям царства животных и его важнейшим отделам, которые удовлетворяют другим требованиям, налагаемым настоящим изобретением в отношении белков, обладающих благоприятной полезностью в отношении животных. Используемое здесь выражение “благоприятная полезность” обычно обозначает полезную активность для конкретного животного и поэтому и для людей в смысле экономических доходов животноводства. Тем не менее, это выражение также распространяется на активность, которая является неблагоприятной или вредной для конкретного животного, но может, напротив, представлять экономическое преимущество для людей. Такая активность включает в себя пестицидную активность различных типов, например подавление роста и воспроизведения или полное умерщвление сельскохозяйственных вредителей, которые повреждают урожаи, представляющие экономическую важность, или поражают домашних животных, представляющих ценность для людей. Соответственно все основные типы и их подразделения, которые представляют экономическую значимость, включены в объем настоящего изобретения, например позвоночные типа членистоногих (Arthropoda), который ключают в себя классы насекомых (Insecta), пауков и клещей (Arachnida) и ракообразных (Crustacea); или подтипа Vertebrata, который включают в себя классы млекопитающих (Mammalia), птиц, рептилий (Reptilia), амфибий (Amphibia) и рыб; и беспозвоночные подтипа моллюски (Mollusca), которые включают в себя двустворчатых моллюсков и улиток; или типа кольчатые черви (Annelida), который включает в себя земляных червей и пиявок; или типа иглокожие (Echinodermata), который включает в себя морских звезд и морских ежей; или тип нематоды (Nematoda), который включает в себя сердечных червей. Белки, подходящие для использования в настоящем изобретении, могут обладать другими биологическими активностями, которые благоприятны для животного или для использования животного, которые могут обычно не классифицироваться как терапевтические по природе. Например, белковые гормоны, такие как соматотропин, используют для регуляции роста животных, которых обычно держат в качестве домашнего сырья для получения пищи, и соматотропин, вводимый таким животным, обладает благоприятной полезностью, заключающейся в увеличении эффективности использования пищи и уменьшении времени, необходимого для того, чтобы доставить такое животное на рынок. Использование такого белкового гормона обладает очевидной и определенной коммерческой и экономической выгодой, не связанной непосредственно с лечением, как таковым. Другие гормоны и регуляторы функций организма, которые представляют собой белки и в настоящее время используются коммерчески, могут также быть улучшены путем использования способа по настоящему изобретению. Такое улучшение касается их увеличенного уровня конденсации аддукта, а также их увеличенных выходов, что приводит в результате к улучшенным возможностям по их введению животным с использованием таких форм, как твердые имплантаты для парентерального введения. Тем не менее, значительное большинство белков, которые можно использовать с использованием способов по настоящему изобретению, представляют собой белки, которые обладают общеизвестной полезностью в качестве терапевтических агентов для животных и человека. Эти белки используются или активно исследуются для использования в широком разнообразии терапевтических классов. Описание в приведенных ниже абзацах делает очевидным, что не только существует значительное количество таких белков, а также то, что все из этих преимуществ белков следуют из улучшенной стабильности в течение длительного периода и сохранения их биологической активности, когда их получают в соответствии со способом по настоящему изобретению в виде улучшенных конденсационных аддуктов, являющихся основаниями Шиффа. Это особенно верно, когда белки готовят в форме таблетки или похожей форме для использования в качестве импланитируемого депо для введения с длительным высвобождением. Существует большая группа белковых эндогенных и синтетических опиоидных анальгетиков и антагонистов, которые организованы в три отдельные семейства, идентифицируемые как энкефалины, эндорфины и динорфины. Эти белки являются избирательными и неизбирательными агонистами и антагонистами подтипов  , k и , k и  опиоидных рецепторов, обладающими терапевтической полезностью в основном в качестве анальгетиков. Специфические белки включают в себя [Leu5] и [Мet5] энкефалин; динорфин А и В; опиоидных рецепторов, обладающими терапевтической полезностью в основном в качестве анальгетиков. Специфические белки включают в себя [Leu5] и [Мet5] энкефалин; динорфин А и В;  и и  -неоэндорфин; [D-Ala2, МеРhе4,-Gly(оl)5]энкефалин (DAMGO); [D-Pen2, D-Реn5]энкефалин (ОПОРЕ); [D-Ser2, Leu5]энкефалин-Тhr6 (DSLET); [D-Ala2 D-Leu5]энкефалин (DADL); D-Phe-Cys-Tyr-D-Trp-Orn-Thr-Pen-Thr-NH2 (CTOP); [D-Ala2, N-MePhe4 Меt(O)5-оl]энкефалин (FK-33824); Tyr-D-Ala-Phe-Asp-Val-Val-Gly-NH2 ([D-Аla2] дельторфин I; Tyr-D-Ala-Phe-Glu-Val-Val-Gly-NH2 ([D-Ala2, Glu4] дельторфин II; Tyr-Pro-Phe-Pro-NH2 (морфицептин): Tyr-Pro-MePhe-D-Pro-NH2 (PL-017); и [D-Ala2, Leu5 Сys6]энкефалин.
Группа белков, которую классифицируют как аутокоиды, которая включает в себя брадикинин и каллидин, продуцируется путем серии протеолитических реакций в ответ на воспалительные события, такие как повреждение ткани, вирусные инфекции и аллергические реакции. Эти белки действуют локально и вызывают боль, вазодилатацию, увеличенную сосудистую проницаемость и синтез простагландинов. Эти белки и их аналогичные производные, обладающие агонистической и анатагонистической активностью, представляют собой потенциально полезные терапевтические агенты для лечения мужского бесплодия, для доставки противораковых химиотерапевтических агентов через гематоэнцефалический барьер и для лечения боли, астмы и других хронических воспалительных заболеваний. Специфические белки этого типа включают в себя: Аrg-Рro-Рro-Gly-Phe-Ser-Pro-Рhе-Аrg (брадикинин); Lys-Arg-Pro-Pro-Gly-Phe-Ser-Pro-Phe-Arg (каллидин); Arg-Pro-Pro-Gly-Phe-Ser-Pro-Phe (дез-Аrg9-брадикинин); Lys-Arg-Pro-Pro-Gly-Phe-Ser-Pro-Phe (дез-Аrg10-каллидин); Arg-Pro-Pro-Gly-Phe-Ser-Pro-Leu (дез-Arg9-[Leu8]-брадикинин); Arg-Pro-Pro-Gly-Phe-Ser-[D-Phe]-Phe-Arg ([D-Phe7]-брадикинин); и [D-Arg]-Arg-Pro-Hyp-Gly-Thi-Ser-Tic-Oic-Arg (HOE 140), где Hyp представляет собой транс-4-гидрокси-Рго; Thi представляет собой -неоэндорфин; [D-Ala2, МеРhе4,-Gly(оl)5]энкефалин (DAMGO); [D-Pen2, D-Реn5]энкефалин (ОПОРЕ); [D-Ser2, Leu5]энкефалин-Тhr6 (DSLET); [D-Ala2 D-Leu5]энкефалин (DADL); D-Phe-Cys-Tyr-D-Trp-Orn-Thr-Pen-Thr-NH2 (CTOP); [D-Ala2, N-MePhe4 Меt(O)5-оl]энкефалин (FK-33824); Tyr-D-Ala-Phe-Asp-Val-Val-Gly-NH2 ([D-Аla2] дельторфин I; Tyr-D-Ala-Phe-Glu-Val-Val-Gly-NH2 ([D-Ala2, Glu4] дельторфин II; Tyr-Pro-Phe-Pro-NH2 (морфицептин): Tyr-Pro-MePhe-D-Pro-NH2 (PL-017); и [D-Ala2, Leu5 Сys6]энкефалин.
Группа белков, которую классифицируют как аутокоиды, которая включает в себя брадикинин и каллидин, продуцируется путем серии протеолитических реакций в ответ на воспалительные события, такие как повреждение ткани, вирусные инфекции и аллергические реакции. Эти белки действуют локально и вызывают боль, вазодилатацию, увеличенную сосудистую проницаемость и синтез простагландинов. Эти белки и их аналогичные производные, обладающие агонистической и анатагонистической активностью, представляют собой потенциально полезные терапевтические агенты для лечения мужского бесплодия, для доставки противораковых химиотерапевтических агентов через гематоэнцефалический барьер и для лечения боли, астмы и других хронических воспалительных заболеваний. Специфические белки этого типа включают в себя: Аrg-Рro-Рro-Gly-Phe-Ser-Pro-Рhе-Аrg (брадикинин); Lys-Arg-Pro-Pro-Gly-Phe-Ser-Pro-Phe-Arg (каллидин); Arg-Pro-Pro-Gly-Phe-Ser-Pro-Phe (дез-Аrg9-брадикинин); Lys-Arg-Pro-Pro-Gly-Phe-Ser-Pro-Phe (дез-Аrg10-каллидин); Arg-Pro-Pro-Gly-Phe-Ser-Pro-Leu (дез-Arg9-[Leu8]-брадикинин); Arg-Pro-Pro-Gly-Phe-Ser-[D-Phe]-Phe-Arg ([D-Phe7]-брадикинин); и [D-Arg]-Arg-Pro-Hyp-Gly-Thi-Ser-Tic-Oic-Arg (HOE 140), где Hyp представляет собой транс-4-гидрокси-Рго; Thi представляет собой  -(2-тиенил)-А1а; Tic представляет собой [D]-1,2,3,4-тетрагидрохинолин-3-ил-карбонил; и Oic представляет собой (3аs,7аs)-октагидроиндол-2-ил-карбонил.
Регуляция осмоляльности жидкостей организма при помощи вазопрессина и родственных агентов влияет на почечную реабсорбцию воды и создание аналогов таких белков, которые являются избирательными в отношении подтипов V1 и V2 рецептора вазопрессина, которые опосредуют сосудосуживающие реакции и антидиуретические реакции соответственно, привело к множеству терапевтических агентов, обладающих различными активностями. Например, антагонисты V1 могут быть полезны при лечении застойной сердечной недостаточности, гипертензии и послеоперационной кишечной непроходимости и вздутия живота. Агонисты V2 могут использоваться для лечения несахарного диабета путем контролирования полиурии и полидипсии и для лечения расстройств, связанных с кровотечением, включающих в себя болезнь фонВиллебранда. Специфические встречающиеся в природе пептиды, подобные вазопрессину, включают в себя аргинин-вазопрессин (AVP) следующей формулы: -(2-тиенил)-А1а; Tic представляет собой [D]-1,2,3,4-тетрагидрохинолин-3-ил-карбонил; и Oic представляет собой (3аs,7аs)-октагидроиндол-2-ил-карбонил.
Регуляция осмоляльности жидкостей организма при помощи вазопрессина и родственных агентов влияет на почечную реабсорбцию воды и создание аналогов таких белков, которые являются избирательными в отношении подтипов V1 и V2 рецептора вазопрессина, которые опосредуют сосудосуживающие реакции и антидиуретические реакции соответственно, привело к множеству терапевтических агентов, обладающих различными активностями. Например, антагонисты V1 могут быть полезны при лечении застойной сердечной недостаточности, гипертензии и послеоперационной кишечной непроходимости и вздутия живота. Агонисты V2 могут использоваться для лечения несахарного диабета путем контролирования полиурии и полидипсии и для лечения расстройств, связанных с кровотечением, включающих в себя болезнь фонВиллебранда. Специфические встречающиеся в природе пептиды, подобные вазопрессину, включают в себя аргинин-вазопрессин (AVP) следующей формулы: и липрессин ([Lys8]-AVP; синтетические пептиды – аналоги вазопрессина: V1a-селективный агонист [Phe2, Ile2, Orn8]AVP; V1b-селективный агонист дезамино[D-3-(3′-пиридил)-Аla2] АVР; V2-селективные агонисты десмопрессина (dDAVP) и дезамино[Уа14, D-Arg8]AVP; и пептидные антагонисты, включающие в себя V1a – селективный антагонист d(CH2)5[Tyr(Me)2]AVP следующей формулы: 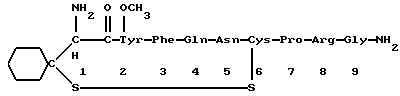 а также V1b-селективный антагонист dp[Tyr(Me)2]AVP; и V2-селективные антагонисты дезGly-NH2 9-d(CH2)5[D-lle2, lle4,Ala-NH2 9]АVР. Пентагастрин представляет собой белковое диагностическое средство, используемое в качестве индикатора желудочной секреции, и имеет следующую формулу: N-m-бутилоксикарбонил-  -А1а-Тrp-Меt-Аsp-Рhе-NН2.
Октреотид представляет собой синтетический аналог соматостанина и полезен при лечении симптомов опухолей желудочно-кишечного тракта, диареи, устойчивой к другому лечению, различных расстройств моторики и желудочно-кишечного кровотечения. Октреотид, доступный в виде ацетата и памоата, имеет структуру: L-цистеинамид-O-Рhе-L-Сys-L-Рhе-O-Тrр-L-Lуз-L-Тhr-N-[2-гидрокси-1-(гидроксиметил)пропил]-циклический(2–>7)-дисульфид, [R-(R*,R*)]- -А1а-Тrp-Меt-Аsp-Рhе-NН2.
Октреотид представляет собой синтетический аналог соматостанина и полезен при лечении симптомов опухолей желудочно-кишечного тракта, диареи, устойчивой к другому лечению, различных расстройств моторики и желудочно-кишечного кровотечения. Октреотид, доступный в виде ацетата и памоата, имеет структуру: L-цистеинамид-O-Рhе-L-Сys-L-Рhе-O-Тrр-L-Lуз-L-Тhr-N-[2-гидрокси-1-(гидроксиметил)пропил]-циклический(2–>7)-дисульфид, [R-(R*,R*)]-Множество реагентов на основе антител для использования в качестве иммуносупрессирующих агентов предложено для клинического использования. Улучшенная технология гибридом делает возможным получение таких антител в больших количествах из постоянно выращиваемых культур клеток, которые образуют высокочистые и специфичные препараты антител, которые можно использовать в качестве стандартизованных фармакологических реагентов. Такие реагенты на основе антител включают в себя антитимоцитарный глобулин; моноклональное антитело муромонаб-СD3; и RhO(D) иммуноглобулин. Белковые иммуностимуляторы, которые разработаны для терапевтического использования при лечении состояний иммунодефицита, включают в себя иммуноглобулин. Цитокины представляют собой группу различных белков, продуцируемых лейкоцитами и родственными клетками, которые обладают множеством иммунорегуляторных эффектов. Большинство общепризнанных в настоящее время цитокинов состоит из интерферонов, колониестимулирующих факторов и интерлейкинов. Специфичные примеры членов этих классов включают в себя  -интерферон; интерферон- -интерферон; интерферон- (ИФН- (ИФН- ); гранулоцитарный колониестимулирующий фактор (ГКСФ); гранулоцитарный колониестимулирующий фактор макрофагов (ГКСФМ) и интерлейкины с интерлейкина-1 (ИЛ-1) по интерлейкин-12 (ИЛ-12).
Гематопоэтические факторы роста представляют собой группу гормоноподобных гликопротеинов, вовлеченных в регуляцию процесса, посредством которого зрелые кровяные клетки постоянно заменяются. Клинические применения этих белков включают в себя лечение основных заболеваний крови и используются в качестве дополнительных агентов при лечении тяжелых инфекций и при помощи пациентам, которые подверглись химиотерапии или трансплантации костного мозга. Специфические примеры таких факторов роста включают в себя эритропоэтин (ЭПЭ); фактор стволовых клеток (ФСК); интерлейкины (ИЛ 1-12), колониестимулирующий фактор моноцитов/макрофагов (КСФМ, КСФ-1); P1XY321 (слитой белок GM-CSF/IL-3) и тромбопоэтин.
Тромболитические лекарства также используются при рассасывании как патологических тромбов, так и отложений фибрина в местах повреждения сосудов, и включают в себя такие белки как стрептокиназа; тканевый активатор плазминогена (ТАП) и урокиназу.
Гормоны передней доли гипофиза и гипоталамические факторы, которые регулируют их использование, представляют собой белки, обладающие терапевтическими использованиями. Гормоны передней доли гипофиза разделяются на три класса: (а) соматотропные гормоны, включая гормон роста (ГР), пролактин (Прл) и плацентарный лактоген (ПЛ); (б) гликопротеиновые гормоны, включая лютеинизирующий гормон (ЛГ), фолликулостимулирующий гормон (ФСГ) и тиреотропный гормон (ТТГ) и (в) гормоны, производные проопиомеланокортина (ПОМК), включая кортикотропин (АКТГ), ); гранулоцитарный колониестимулирующий фактор (ГКСФ); гранулоцитарный колониестимулирующий фактор макрофагов (ГКСФМ) и интерлейкины с интерлейкина-1 (ИЛ-1) по интерлейкин-12 (ИЛ-12).
Гематопоэтические факторы роста представляют собой группу гормоноподобных гликопротеинов, вовлеченных в регуляцию процесса, посредством которого зрелые кровяные клетки постоянно заменяются. Клинические применения этих белков включают в себя лечение основных заболеваний крови и используются в качестве дополнительных агентов при лечении тяжелых инфекций и при помощи пациентам, которые подверглись химиотерапии или трансплантации костного мозга. Специфические примеры таких факторов роста включают в себя эритропоэтин (ЭПЭ); фактор стволовых клеток (ФСК); интерлейкины (ИЛ 1-12), колониестимулирующий фактор моноцитов/макрофагов (КСФМ, КСФ-1); P1XY321 (слитой белок GM-CSF/IL-3) и тромбопоэтин.
Тромболитические лекарства также используются при рассасывании как патологических тромбов, так и отложений фибрина в местах повреждения сосудов, и включают в себя такие белки как стрептокиназа; тканевый активатор плазминогена (ТАП) и урокиназу.
Гормоны передней доли гипофиза и гипоталамические факторы, которые регулируют их использование, представляют собой белки, обладающие терапевтическими использованиями. Гормоны передней доли гипофиза разделяются на три класса: (а) соматотропные гормоны, включая гормон роста (ГР), пролактин (Прл) и плацентарный лактоген (ПЛ); (б) гликопротеиновые гормоны, включая лютеинизирующий гормон (ЛГ), фолликулостимулирующий гормон (ФСГ) и тиреотропный гормон (ТТГ) и (в) гормоны, производные проопиомеланокортина (ПОМК), включая кортикотропин (АКТГ),  -меланоцитстимулирующий гормон ( -меланоцитстимулирующий гормон ( -МСГ), -МСГ),  -меланоцитстимулирующий гормон ( -меланоцитстимулирующий гормон ( -МСГ), -МСГ),  -липотропин ( -липотропин ( -ЛПГ) и -ЛПГ) и  -липотропин ( -липотропин ( -ЛПГ). Гипоталамические факторы, которые регулируют высвобождение указанных гормонов, включают в себя рилизинг-фактор гормона роста (РФГР), рилизинг-фактор лютеинизирующего гормона (РФЛГ), инсулиноподобный фактор роста (ИФР-1 и ИФР-2), соматостатин и гонадотропин-рилизинг-гормон (ГнРГ).
Гормон роста используют в качестве заместительной терапии при недостатке гормона роста у детей. Соматостанин представляет собой вещество гипоталамуса, которое подавляет высвобождение гормона роста, но обладает коротким периодом полувыведения. Его синтетеический аналог, представляющий собой октреотид, уже описанный выше, используют для лечения акромегалии, вызываной избыточной секрецией гормонов роста. Гонадотропные гормоны включают в себя ЛГ (лактогенный гормон), ФСГ (фолликулостимулирующий гормон) и хорионический гонадотропин (ХГ) и используются диагностически. ХГ используют для обнаружения беременности, тогда как ЛГ и ФСГ используют в диагностиге репродуктивных расстройств. Эти белковые гонадотропины также используются терапевтически при лечении бесплодия. Например, урофоллитропин, представляющий собой человеческий гонадотропин, обнаруживаемый в период менопаузы (ЧГПМ), или препарат менотропина, из которого большая часть ЛГ удалена и который таким образом представляет собой главным образом ФСГ. Урофоллитропин используют для индуцирования овуляции. Гонадорелин представляет собой препарат синтетического человеческого ГнРГ, который используют терапевтически для стимуляции секреции гонадотропина. С другой стороны, синтетические агонисты ГнРГ, например лейпролид, гистрелин, нафарелин и гозерелин, можно использовать для лечения множества эндокринных расстройств, которые ответственны за уменьшения уровней стероидов гонад.
Тереоидная функция регулируется тиреотропным гормоном (ТТГ), представляющим собой гликопротеин, секреция которого контролируется тиреотропин-рилизинг фактором (ТРФ). Терапевтическое использование ТТГ заключается в использовании для гормональной заместительной терапии у пациентов, страдающих от гипотиреоза, и для терапии, подавляющей ТТГ у пациентов, страдающих от нетоксического зоба или после лечения рака щитовидной железы.
Белок инсулин представляет собой опору для лечения по существу всех пациентов, страдающих инсулинзависимым сахарным диабетом (ИЗСД), и пациентов, страдающих инсулиннезависимым сахарным диабетом (ИНЗСД). Также используются синтетические аналоги инсулина, которые более быстро адсорбируются из подкожных участков. Также имплантируемые таблетки были разработаны для медленного высвобождения инсулина в течение нескольких дней или недель. Глюкагон представляет собой белок, который играет существенную физиологическую роль в регуляции метаболизма глюкозы и кетоновых тел и используется для лечения тяжелой гипогликемии и также используется рентгенологами из-за его подавляющих действий на желудочно-кишечный тракт. Соматостанин, на который ссылались выше, представляет собой гормон, обладающий коротким биологическим периодом полувыведения, который ограничивает его использование в основном для блокирования высвобождения гормона в эндокринных секретирующих опухолях, включая инсулиномы, глюкагономы, ВИПомы, карциноидные опухоли и соматотропиномы. Синтетический аналог, октреотид, действует более длительное время и, следовательно, более часто используется для терапевтического лечения.
Кальцитонин (КГ) представляет собой гормон, который действует в особенности на остеокласты для подавления резорбции костей и является полезным при управляемой гиперкальцимии. КТ также эффективен при расстройствах, выражающихся в увеличенном скелетном ремоделировании, включающих в себя болезнь Пэджета. Белковый паратиреоидный гормон (ПТГ) представляет собой потенциальную ценность при лечении пациентов, страдающих остеопорозом позвоночника.
В дополнение к вышеописанным классам белковых терапевтических агентов ниже перечислены виды белковых композиций, предложенные для использования людьми.
Альдеслейкин, 125-L-серин-2-133-интерлейкин 2, используют в качестве противоопухолевого агента и в качестве иммуностимулятора.
Альглюцераза представляет собой мономерный гликопротеин, состоящий из 497 аминокислот, который представляет собой модифицированную форму -ЛПГ). Гипоталамические факторы, которые регулируют высвобождение указанных гормонов, включают в себя рилизинг-фактор гормона роста (РФГР), рилизинг-фактор лютеинизирующего гормона (РФЛГ), инсулиноподобный фактор роста (ИФР-1 и ИФР-2), соматостатин и гонадотропин-рилизинг-гормон (ГнРГ).
Гормон роста используют в качестве заместительной терапии при недостатке гормона роста у детей. Соматостанин представляет собой вещество гипоталамуса, которое подавляет высвобождение гормона роста, но обладает коротким периодом полувыведения. Его синтетеический аналог, представляющий собой октреотид, уже описанный выше, используют для лечения акромегалии, вызываной избыточной секрецией гормонов роста. Гонадотропные гормоны включают в себя ЛГ (лактогенный гормон), ФСГ (фолликулостимулирующий гормон) и хорионический гонадотропин (ХГ) и используются диагностически. ХГ используют для обнаружения беременности, тогда как ЛГ и ФСГ используют в диагностиге репродуктивных расстройств. Эти белковые гонадотропины также используются терапевтически при лечении бесплодия. Например, урофоллитропин, представляющий собой человеческий гонадотропин, обнаруживаемый в период менопаузы (ЧГПМ), или препарат менотропина, из которого большая часть ЛГ удалена и который таким образом представляет собой главным образом ФСГ. Урофоллитропин используют для индуцирования овуляции. Гонадорелин представляет собой препарат синтетического человеческого ГнРГ, который используют терапевтически для стимуляции секреции гонадотропина. С другой стороны, синтетические агонисты ГнРГ, например лейпролид, гистрелин, нафарелин и гозерелин, можно использовать для лечения множества эндокринных расстройств, которые ответственны за уменьшения уровней стероидов гонад.
Тереоидная функция регулируется тиреотропным гормоном (ТТГ), представляющим собой гликопротеин, секреция которого контролируется тиреотропин-рилизинг фактором (ТРФ). Терапевтическое использование ТТГ заключается в использовании для гормональной заместительной терапии у пациентов, страдающих от гипотиреоза, и для терапии, подавляющей ТТГ у пациентов, страдающих от нетоксического зоба или после лечения рака щитовидной железы.
Белок инсулин представляет собой опору для лечения по существу всех пациентов, страдающих инсулинзависимым сахарным диабетом (ИЗСД), и пациентов, страдающих инсулиннезависимым сахарным диабетом (ИНЗСД). Также используются синтетические аналоги инсулина, которые более быстро адсорбируются из подкожных участков. Также имплантируемые таблетки были разработаны для медленного высвобождения инсулина в течение нескольких дней или недель. Глюкагон представляет собой белок, который играет существенную физиологическую роль в регуляции метаболизма глюкозы и кетоновых тел и используется для лечения тяжелой гипогликемии и также используется рентгенологами из-за его подавляющих действий на желудочно-кишечный тракт. Соматостанин, на который ссылались выше, представляет собой гормон, обладающий коротким биологическим периодом полувыведения, который ограничивает его использование в основном для блокирования высвобождения гормона в эндокринных секретирующих опухолях, включая инсулиномы, глюкагономы, ВИПомы, карциноидные опухоли и соматотропиномы. Синтетический аналог, октреотид, действует более длительное время и, следовательно, более часто используется для терапевтического лечения.
Кальцитонин (КГ) представляет собой гормон, который действует в особенности на остеокласты для подавления резорбции костей и является полезным при управляемой гиперкальцимии. КТ также эффективен при расстройствах, выражающихся в увеличенном скелетном ремоделировании, включающих в себя болезнь Пэджета. Белковый паратиреоидный гормон (ПТГ) представляет собой потенциальную ценность при лечении пациентов, страдающих остеопорозом позвоночника.
В дополнение к вышеописанным классам белковых терапевтических агентов ниже перечислены виды белковых композиций, предложенные для использования людьми.
Альдеслейкин, 125-L-серин-2-133-интерлейкин 2, используют в качестве противоопухолевого агента и в качестве иммуностимулятора.
Альглюцераза представляет собой мономерный гликопротеин, состоящий из 497 аминокислот, который представляет собой модифицированную форму  -глюкоцереброзидазы плацентарной ткани человека и используется в качестве дополнения для фермента глюкоцереброзидазы.
Альсактид представляет собой синтетический аналог кортикотропина, 1- -глюкоцереброзидазы плацентарной ткани человека и используется в качестве дополнения для фермента глюкоцереброзидазы.
Альсактид представляет собой синтетический аналог кортикотропина, 1- -Аla-17[L-2,6-диамино-N-(4-аминобутил)гексанамид]- -Аla-17[L-2,6-диамино-N-(4-аминобутил)гексанамид]- 1-17-кортикотропин.
Альтеплаза представляет собой сериновую протеазу, состоящую из 527 аминокислот, последовательность которой идентична последовательности встречающейся в природе протеазы, продуцируемой эндотелиальными клетками стенок сосудов, и которую используют в качестве активатора плазминогена.
Alvircept sudotox представляет собой синтетический химерный белок, сконструированный для связывания первых 178 аминокислот внеклеточного домена CD4 посредством двух линкерных остатков с аминокислотами 1-3 и 253-613 экзотоксина A Pseudomonas, и который используют в качестве противовирусного агента.
Амлинтид представляет собой белок, состоящий из 37 аминокислот, который используют в качестве антидиабетического агента.
Амогастрин представляет собой N-карбокси-L-Trp-L-Met-L- 1-17-кортикотропин.
Альтеплаза представляет собой сериновую протеазу, состоящую из 527 аминокислот, последовательность которой идентична последовательности встречающейся в природе протеазы, продуцируемой эндотелиальными клетками стенок сосудов, и которую используют в качестве активатора плазминогена.
Alvircept sudotox представляет собой синтетический химерный белок, сконструированный для связывания первых 178 аминокислот внеклеточного домена CD4 посредством двух линкерных остатков с аминокислотами 1-3 и 253-613 экзотоксина A Pseudomonas, и который используют в качестве противовирусного агента.
Амлинтид представляет собой белок, состоящий из 37 аминокислот, который используют в качестве антидиабетического агента.
Амогастрин представляет собой N-карбокси-L-Trp-L-Met-L- -Asp-3-фенил-1-аланинамид.
Анакинра представляет собой антагонист рецептора N2-L-Met-интерлейкина 1, используемый в качестве нестероидного противовоспалительного агента и в качестве супрессанта при лечении воспалительного заболевания толстой кишки.
Анаратид ацетат представляет собой атриопептин-21 (крысы), N-L-Arg-8-L-Met-21a-L-Phe-21b-L-Arg-21c-L-Tyr-, ацетат, который используют в качестве антигипертензивного агента и в качестве диуретического агента.
Ангиотензин амид представляет собой ангиотензин II, 1-L-Asn-5-L-Val-, который используют в качестве вазоконстриктора.
Апротинин представляет собой панкреатический трипсиновый ингибитор, имеющий 58 аминокислот, который используют в качестве ферментного ингибитора (протеиназы).
Арфалазин представляет собой 1-сукцинамовая кислота-5-L-Val-8-(L-2-фенилглицин)ангиотензин II, который используют в качестве антигипертензивного агента.
Аргипрессин таннат представляет собой вазопрессин, 8-L-Arg-, таннат, который используют в качестве антидиуретического агента.
Аспартоцин представляет собой антибиотический агент, продуцируемый Streptomyces griseus, и представляет собой окситоцин, 4-L-Asn-.
Атозибан представляет собой окситоцин, 1-(3-меркаптопропановая килота)-2-(O-этил-D-Tyr)-4-L-Thr-8-L-Orn-, который используют в качестве антагониста окситоцина.
Авопарцин представляет собой гликопептидный антибиотик, получаемый из Streptomyces candidus.
Базифунгин представляет собой противогрибковый агент, имеющий структуру N-(2R, 3R)-2-гидрокси-3-МеVа1] -N-L-МеVа1-L-Рhе-N-L-MеРhе-L-Рrо-L-алло-Ile-N-L-MeVal-L-Leu-3-гидрокси-N-L-MeVal -Asp-3-фенил-1-аланинамид.
Анакинра представляет собой антагонист рецептора N2-L-Met-интерлейкина 1, используемый в качестве нестероидного противовоспалительного агента и в качестве супрессанта при лечении воспалительного заболевания толстой кишки.
Анаратид ацетат представляет собой атриопептин-21 (крысы), N-L-Arg-8-L-Met-21a-L-Phe-21b-L-Arg-21c-L-Tyr-, ацетат, который используют в качестве антигипертензивного агента и в качестве диуретического агента.
Ангиотензин амид представляет собой ангиотензин II, 1-L-Asn-5-L-Val-, который используют в качестве вазоконстриктора.
Апротинин представляет собой панкреатический трипсиновый ингибитор, имеющий 58 аминокислот, который используют в качестве ферментного ингибитора (протеиназы).
Арфалазин представляет собой 1-сукцинамовая кислота-5-L-Val-8-(L-2-фенилглицин)ангиотензин II, который используют в качестве антигипертензивного агента.
Аргипрессин таннат представляет собой вазопрессин, 8-L-Arg-, таннат, который используют в качестве антидиуретического агента.
Аспартоцин представляет собой антибиотический агент, продуцируемый Streptomyces griseus, и представляет собой окситоцин, 4-L-Asn-.
Атозибан представляет собой окситоцин, 1-(3-меркаптопропановая килота)-2-(O-этил-D-Tyr)-4-L-Thr-8-L-Orn-, который используют в качестве антагониста окситоцина.
Авопарцин представляет собой гликопептидный антибиотик, получаемый из Streptomyces candidus.
Базифунгин представляет собой противогрибковый агент, имеющий структуру N-(2R, 3R)-2-гидрокси-3-МеVа1] -N-L-МеVа1-L-Рhе-N-L-MеРhе-L-Рrо-L-алло-Ile-N-L-MeVal-L-Leu-3-гидрокси-N-L-MeVal  1-лактон.
Бекаплермин представляет собой рекомбинантный человеческий тромбоцитарный фактор роста В, который представляет собой рекомбинантный белок, продуцируемый полученным путем генетической инжинерии Saccharomyces cerevisiae, который похож по аминокислотному составу и биологической активности на эндогенный гомодимер ТФР-ВВ человека, который используют для лечения хронических кожных язв в силу того, что он активирует пролиферацию клеток мезенхимного происхождения.
Бивалирудин представляет собой антикоагулянт, антитромботический агент, имеющий 20 аминокислот.
Карбетоцин представляет собой 1-масляная кислота-2-[3-(п-метоксифенил)-L-А1а]окситоцин.
Каргутоцин представляет собой 1-масляная кислота-6-(L-2-аминомасляная кислота)-7-глицинокситоцин.
Церулетид представляет собой стимулятор желудочной секреции, имеющий структуру 5-O-L-Рrо-L-Gln-L- 1-лактон.
Бекаплермин представляет собой рекомбинантный человеческий тромбоцитарный фактор роста В, который представляет собой рекомбинантный белок, продуцируемый полученным путем генетической инжинерии Saccharomyces cerevisiae, который похож по аминокислотному составу и биологической активности на эндогенный гомодимер ТФР-ВВ человека, который используют для лечения хронических кожных язв в силу того, что он активирует пролиферацию клеток мезенхимного происхождения.
Бивалирудин представляет собой антикоагулянт, антитромботический агент, имеющий 20 аминокислот.
Карбетоцин представляет собой 1-масляная кислота-2-[3-(п-метоксифенил)-L-А1а]окситоцин.
Каргутоцин представляет собой 1-масляная кислота-6-(L-2-аминомасляная кислота)-7-глицинокситоцин.
Церулетид представляет собой стимулятор желудочной секреции, имеющий структуру 5-O-L-Рrо-L-Gln-L- -Аsp-L-O-сульфо-L-Тyr-L-Тhr-L-G1y-L-Тrр-L-Меt-L- -Аsp-L-O-сульфо-L-Тyr-L-Тhr-L-G1y-L-Тrр-L-Меt-L- -Аsр-L-Рhе-амид.
Цетермин представляет собой трансформирующий фактор роста -Аsр-L-Рhе-амид.
Цетермин представляет собой трансформирующий фактор роста  2 человека, имеющий 112 аминокислот.
Цилмостим представляет собой 1-233-колониестимулирующий фактор 1 (белковый остаток клона человека p3ACSF-69), циклический (7–>90), (48–>139), (102–>146)-трис(дисульфид)димер, полезный в качестве гематопоэтического агента (колониестимулирующий фактор макрофагов).
Натрия колистиметат представляет собой компонент колистина А, полезный в качестве антибактериального агента.
Кортикорелин трифлютат овечий представляет собой кортикотропин-рилизинг фактор (овечий), соль трифторацетат, который используют в качестве диагностического средства при адренокортикальной недостаточности и синдроме Кушинга и в качестве кортикотропин-рилизинг-гормона.
Козинтропин представляет собой тетракозактид ацетат, 2 человека, имеющий 112 аминокислот.
Цилмостим представляет собой 1-233-колониестимулирующий фактор 1 (белковый остаток клона человека p3ACSF-69), циклический (7–>90), (48–>139), (102–>146)-трис(дисульфид)димер, полезный в качестве гематопоэтического агента (колониестимулирующий фактор макрофагов).
Натрия колистиметат представляет собой компонент колистина А, полезный в качестве антибактериального агента.
Кортикорелин трифлютат овечий представляет собой кортикотропин-рилизинг фактор (овечий), соль трифторацетат, который используют в качестве диагностического средства при адренокортикальной недостаточности и синдроме Кушинга и в качестве кортикотропин-рилизинг-гормона.
Козинтропин представляет собой тетракозактид ацетат,  1-24-кортикотропин, который используют в качестве адренокортикотропного гормона.
Циклоспорин представляет собой циклический белок, содержащий 11 аминокислот и остаток 3-гидрокси-4-метил-2-(метиламино)-6-октеноила в положении 6, который используют в качестве иммуносупрессанта.
Дакликсимаб (Ro-24-7375) представляет собой гуманизированное моноклональное антитело против ТАС, состоящее из четырех субъединиц, связанных посредством дисульфидных мостиков, с молекулярной массой приблизительно 150 кДа, которое используют в качестве иммуносупрессанта. Похожий белок-иммуносупрессант представляет собой даклизумаб.
Даптомицин представляет собой белковый антибактериальный агент.
Дезирудин представляет собой 63-десульфогирудин из Hirudo medicinalis, содержащий 63 аминокислоты, который используют в качестве антикоагулянта.
Дезлорелин представляет собой рилизинг-фактор лютеинизирующего гормона (свиньи), содержащий 9 аминокислот, который используют в качестве агониста РФЛГ.
Десмопрессин ацетат представляет собой вазопрессин, 1-(3-меркаптопропановая кислота)-8-D-Аrg-, соль моноацетата тригидрат, содержащий 9 аминокислот, который используют в качестве антидиуретического агента.
Детиреликс ацетат включает в себя 10 аминокислот и используется в качестве антагониста РФЛГ.
Думорелин представляет собой 27-L-Leu-44a-Gly рилизинг-фактор гормона роста (человека).
Элькатонин представляет собой 1-масляная кислота-7-(L-2-аминомасляная кислота)-26-L-Asp-27-L-Val-29-L-Ala кальцитонин (лосося).
Эмоктакин представляет собой интерлейкин 8 (человека), содержащий 72 аминокислоты с двумя Cys мостиками.
Эпоэтин альфа представляет собой гликопротеин из 165 аминокислот, который регулирует продукцию красных кровяных телец и продуцируется клетками яичника китайского хомячка, в которые вставлен ген эритропоэтина человека. Его используют в качестве антианемического агента и лекарственного средства, повышающего количество гемоглобина в крови.
Эрзофермин представляет собой рекомбинантный основной фактор роста фибробластов человека (ОФРФ), содержащий 157 аминокислот, негликозилированный белок, выделенный из плаценты человека и клонированный и экспессирующийся в Е. соli. Его используют в качестве агента, способствующего заживлению ран.
Фелипрессин представляет собой вазопрессин, 2-L-Phe-S-L-Lys, содержащий 9 аминокислот, который используют в качестве вазоконстриктора.
Филграстим представляет собой одноцепочечный полипептид из 175 аминокислот, негликозилированный и экспрессирующийся Е соli, и который используют в качестве агента для лечения нейтропении и в качестве стимулятора гемопоэза.
Глюкагон представляет собой одноцепочечный белок, состоящий из 29 аминокислот, который используют в качестве антидиабетического агента.
Гонадорелин ацетат представляет собой соль диацетат ацетата рилизинг-фактора лютеинизирующего гормона, содержащую 10 аминокислот, который используют в качестве фактора, стимулирующего гонады.
Гозерелин представляет собой рилизинг-фактор лютеинизирующего гормона (свиньи), содержащий 9 аминокислот, который используют в качестве агониста РФЛГ.
Гистрелин представляет собой рилизинг-фактор лютеинизирующего гормона (свиньи), содержащий 9 аминокислот, полезный в качестве агониста РФЛГ 1-24-кортикотропин, который используют в качестве адренокортикотропного гормона.
Циклоспорин представляет собой циклический белок, содержащий 11 аминокислот и остаток 3-гидрокси-4-метил-2-(метиламино)-6-октеноила в положении 6, который используют в качестве иммуносупрессанта.
Дакликсимаб (Ro-24-7375) представляет собой гуманизированное моноклональное антитело против ТАС, состоящее из четырех субъединиц, связанных посредством дисульфидных мостиков, с молекулярной массой приблизительно 150 кДа, которое используют в качестве иммуносупрессанта. Похожий белок-иммуносупрессант представляет собой даклизумаб.
Даптомицин представляет собой белковый антибактериальный агент.
Дезирудин представляет собой 63-десульфогирудин из Hirudo medicinalis, содержащий 63 аминокислоты, который используют в качестве антикоагулянта.
Дезлорелин представляет собой рилизинг-фактор лютеинизирующего гормона (свиньи), содержащий 9 аминокислот, который используют в качестве агониста РФЛГ.
Десмопрессин ацетат представляет собой вазопрессин, 1-(3-меркаптопропановая кислота)-8-D-Аrg-, соль моноацетата тригидрат, содержащий 9 аминокислот, который используют в качестве антидиуретического агента.
Детиреликс ацетат включает в себя 10 аминокислот и используется в качестве антагониста РФЛГ.
Думорелин представляет собой 27-L-Leu-44a-Gly рилизинг-фактор гормона роста (человека).
Элькатонин представляет собой 1-масляная кислота-7-(L-2-аминомасляная кислота)-26-L-Asp-27-L-Val-29-L-Ala кальцитонин (лосося).
Эмоктакин представляет собой интерлейкин 8 (человека), содержащий 72 аминокислоты с двумя Cys мостиками.
Эпоэтин альфа представляет собой гликопротеин из 165 аминокислот, который регулирует продукцию красных кровяных телец и продуцируется клетками яичника китайского хомячка, в которые вставлен ген эритропоэтина человека. Его используют в качестве антианемического агента и лекарственного средства, повышающего количество гемоглобина в крови.
Эрзофермин представляет собой рекомбинантный основной фактор роста фибробластов человека (ОФРФ), содержащий 157 аминокислот, негликозилированный белок, выделенный из плаценты человека и клонированный и экспессирующийся в Е. соli. Его используют в качестве агента, способствующего заживлению ран.
Фелипрессин представляет собой вазопрессин, 2-L-Phe-S-L-Lys, содержащий 9 аминокислот, который используют в качестве вазоконстриктора.
Филграстим представляет собой одноцепочечный полипептид из 175 аминокислот, негликозилированный и экспрессирующийся Е соli, и который используют в качестве агента для лечения нейтропении и в качестве стимулятора гемопоэза.
Глюкагон представляет собой одноцепочечный белок, состоящий из 29 аминокислот, который используют в качестве антидиабетического агента.
Гонадорелин ацетат представляет собой соль диацетат ацетата рилизинг-фактора лютеинизирующего гормона, содержащую 10 аминокислот, который используют в качестве фактора, стимулирующего гонады.
Гозерелин представляет собой рилизинг-фактор лютеинизирующего гормона (свиньи), содержащий 9 аминокислот, который используют в качестве агониста РФЛГ.
Гистрелин представляет собой рилизинг-фактор лютеинизирующего гормона (свиньи), содержащий 9 аминокислот, полезный в качестве агониста РФЛГИмиглюцераза представляет собой изоферментный белок 495-L-гистидинглюкозилцерамидазы плаценты, который используют в качестве ферментного дополнения для глюкоцереброзидазы. Инсулин деаланированный представляет собой производное инсулина, получаемое путем удаления С-концевого аланина В цепи инсулина, который используют в качестве антидиабетического агента. Интерферон альфа-2а представляет собой интерферон  А (редуцированный остаток белка лейкоцитов человека), содержащий 165 аминокислот, который используют в качестве противоопухолевого агента и в качестве модификатора биологической реакции. Интерферон альфа-2b представляет собой интерферон А (редуцированный остаток белка лейкоцитов человека), содержащий 165 аминокислот, который используют в качестве противоопухолевого агента и в качестве модификатора биологической реакции. Интерферон альфа-2b представляет собой интерферон  2b (редуцированный остаток белка клона лейкоцитов человека Hif-SN206), содержащий 165 аминокислот, который также используют в качестве противоопухолевого агента и в качестве модификатора биологической реакции. Интерферон бета-1а представляет собой гликозилированный полипептид, состоящий из 166 аминокислотных остатков, получаемый из культуры клеток яичника китайского хомячка, содержащих созданный путем генетической инженерии ген интерферона бета человека, который также используют в качестве противоопухолевого агента и в качестве модификатора биологической реакции. Интерферон бета-1b представляет собой негликозилированный полипептид, состоящий из 165 аминокислотных остатков, получаемый из Е. соli, который также используют в качестве иммуномодулятора. Интерферон гамма-1b представляет собой 1-139 интерферон 2b (редуцированный остаток белка клона лейкоцитов человека Hif-SN206), содержащий 165 аминокислот, который также используют в качестве противоопухолевого агента и в качестве модификатора биологической реакции. Интерферон бета-1а представляет собой гликозилированный полипептид, состоящий из 166 аминокислотных остатков, получаемый из культуры клеток яичника китайского хомячка, содержащих созданный путем генетической инженерии ген интерферона бета человека, который также используют в качестве противоопухолевого агента и в качестве модификатора биологической реакции. Интерферон бета-1b представляет собой негликозилированный полипептид, состоящий из 165 аминокислотных остатков, получаемый из Е. соli, который также используют в качестве иммуномодулятора. Интерферон гамма-1b представляет собой 1-139 интерферон  (редуцированный остаток белка лимфоцитов человека), N2-L-Met, который используют в качестве противоопухолевого агента и в качестве иммуномодулятора.
Ироплакт представляет собой N-метионилтромбоцитарный фактор 4 (субъединица человека), содержащий 71 аминокислотный остаток, имеющий два Cys мостика.
Ланотеплаза представляет собой белок активатор плазминогена, полученный из ТАП человека путем делеции фибронектин-подобного и ЭФР-подобного доменов и мутации Asn 117 в Gln 117. Белок получают путем экспрессии в хозяйских клетках млекопитающих последовательности ДНК, кодирующей последовательность пептида, и белок используют в качестве активатора плазминогена и тромболитического агента.
Ланреотид ацетат включает в себя 8 аминокислот и имеет один дисульфидный мостик. Белок используют в качестве противоопухолевого агента.
Ленограстим представляет собой гликопротеин, состоящий из 174 аминокислотных остатков, который продуцируется в клетках яичника китайского хомячка путем экспрессии кДНК колониестимулирующего фактора гранулоцитов человека, получаемой из мРНК линии сквамозных клеток ротовой полости человека. Белок используют в качестве агента для лечения нейтропении и в качестве стимулятора гемопоэза.
Лютрелин ацетат представляет собой рилизинг-фактор лютеинизирующего гормона (свиньи), содержащий 9 аминокислот, который используют в качестве агониста РФЛГ.
Молграмостим представляет собой колониестимулирующий фактор 2 (редуцированный остаток белка клона человека pHG25), содержащий 127 аминокислот, который используют в качестве агента для лечения нейтропении и в качестве стимулятора гемопоэза.
Муродермин представляет собой эпидермальный фактор роста (слюнной железы мыши).
Нафарелин ацетат представляет собой рилизинг-фактор лютеинизирующего гормона (свиньи), содержащий 9 аминокислот, который используют в качестве агониста РФЛГ.
Нагрестипен представляет собой 26-L-аланинлимфокин ВБМ 1 (редуцированный остаток белка лимфоцитов человека), N2-L-Met, который используют в качестве противоопухолевого агента и в качестве иммуномодулятора.
Ироплакт представляет собой N-метионилтромбоцитарный фактор 4 (субъединица человека), содержащий 71 аминокислотный остаток, имеющий два Cys мостика.
Ланотеплаза представляет собой белок активатор плазминогена, полученный из ТАП человека путем делеции фибронектин-подобного и ЭФР-подобного доменов и мутации Asn 117 в Gln 117. Белок получают путем экспрессии в хозяйских клетках млекопитающих последовательности ДНК, кодирующей последовательность пептида, и белок используют в качестве активатора плазминогена и тромболитического агента.
Ланреотид ацетат включает в себя 8 аминокислот и имеет один дисульфидный мостик. Белок используют в качестве противоопухолевого агента.
Ленограстим представляет собой гликопротеин, состоящий из 174 аминокислотных остатков, который продуцируется в клетках яичника китайского хомячка путем экспрессии кДНК колониестимулирующего фактора гранулоцитов человека, получаемой из мРНК линии сквамозных клеток ротовой полости человека. Белок используют в качестве агента для лечения нейтропении и в качестве стимулятора гемопоэза.
Лютрелин ацетат представляет собой рилизинг-фактор лютеинизирующего гормона (свиньи), содержащий 9 аминокислот, который используют в качестве агониста РФЛГ.
Молграмостим представляет собой колониестимулирующий фактор 2 (редуцированный остаток белка клона человека pHG25), содержащий 127 аминокислот, который используют в качестве агента для лечения нейтропении и в качестве стимулятора гемопоэза.
Муродермин представляет собой эпидермальный фактор роста (слюнной железы мыши).
Нафарелин ацетат представляет собой рилизинг-фактор лютеинизирующего гормона (свиньи), содержащий 9 аминокислот, который используют в качестве агониста РФЛГ.
Нагрестипен представляет собой 26-L-аланинлимфокин ВБМ 1 (воспалительный белок макрофагов клона человека рАТ 464, содержащий 69 аминокислот и имеющий два дисульфидных мостика).
Пепстатин представляет собой N-(3-метил-1-оксобутил)-L-Vа1-L-Vа1-4-амино-3-гидрокси-6-метилгептаноил-L-А1а-4-амино-3-гидрокси-6-метилгептановую кислоту, которую используют в качестве ингибитора фермента пепсина.
Прамлинтид представляет собой белок, содержащий 37 аминокислот и имеющий один дисульфидный мостик, который используют в качестве антидиабетического агента.
Проинсулин человека представляет собой проинсулин (свиньи), содержащий 86 аминокислотных остатков и имеющий три дисульфидных мостика, который используют в качестве антидиабетического агента.
Сарграмостим представляет собой колониестимулирующий фактор 2 (редуцированный остаток белка клона человека pHG25), 23-L-Leu-, одноцепочечный гликозилированный полипептид, состоящий из 127 аминокислотных остатков, экспрессируемый в Saccharomyces cerevisiae, который используют в качестве агента для лечения нейтропении и в качестве стимулятора гематопоэза.
Сомагребав представляет собой соматотропин (бычий, восстановленный), l-[N2-L-Met-L- (воспалительный белок макрофагов клона человека рАТ 464, содержащий 69 аминокислот и имеющий два дисульфидных мостика).
Пепстатин представляет собой N-(3-метил-1-оксобутил)-L-Vа1-L-Vа1-4-амино-3-гидрокси-6-метилгептаноил-L-А1а-4-амино-3-гидрокси-6-метилгептановую кислоту, которую используют в качестве ингибитора фермента пепсина.
Прамлинтид представляет собой белок, содержащий 37 аминокислот и имеющий один дисульфидный мостик, который используют в качестве антидиабетического агента.
Проинсулин человека представляет собой проинсулин (свиньи), содержащий 86 аминокислотных остатков и имеющий три дисульфидных мостика, который используют в качестве антидиабетического агента.
Сарграмостим представляет собой колониестимулирующий фактор 2 (редуцированный остаток белка клона человека pHG25), 23-L-Leu-, одноцепочечный гликозилированный полипептид, состоящий из 127 аминокислотных остатков, экспрессируемый в Saccharomyces cerevisiae, который используют в качестве агента для лечения нейтропении и в качестве стимулятора гематопоэза.
Сомагребав представляет собой соматотропин (бычий, восстановленный), l-[N2-L-Met-L- -Asp-L-глутамин] -, содержащий 191 аминокислоту, который используют в качестве стимулирующего лактацию средства, особено для ветеринарного использования.
Сомалапор представляет собой соматотропин (редуцированный pPGH-1 клона свиньи), N-L-аланил-гормон роста, содержащий в сумме 191 аминокислоту, который используют в качестве гормона (роста, свиньи).
Соматрем представляет собой соматотропин (человека), N-L-Met-, содержащий 191 аминокислоту, имеющий два дисульфидных мостика, который используют в качестве гормона роста.
Соматотропин, который также иногда называют аденогипофизарным гормоном роста, ГР, гипофизарным гормоном роста, гормоном роста передней доли гипофиза и соматотропным гормоном роста, представляет видоспецифичный анаболический белок, который способствует физическому росту, стимулирует синтез белков и регулирует углеводный и липидный метаболизм. Соматотропин секретируется передней долей гипофиза под действием регуляции гипоталамических гормонов соматолиберина и соматостатина. Соматотропные гормоны роста из различных видов различаются по аминокислотной последовательности, антигенности, изоэлектрической точке и диапазону животных, в которых они могут осуществлять биологические действия.
У людей соматотропин представляет собой одну полипептидную цепь, включающую в себя 191 аминокислоту, имеющую нормальную структуру основного гормона, стимулирующего рост, получаемого из передней доли гипофиза человека, который используют в качестве гормона роста. Соматотропин также доступен в рекомбинантной форме. Используемый здесь термин “соматотропин” включает в себя встречающиеся в природе, а также синтетические, включая получаемые рекомбинантно соматотропины человека и животных (гормоны роста), в частности соматотропины быка и свиньи. Метионильный гормон роста человека C995H1537N263O301S8 получают в бактериях из рекомбинантной ДНК и он содержит полную аминокислотную последовательность природного гормона плюс дополнительный N-концевой метионин.
Существуют четыре встречающихся в природе молекулярных варианта соматотропина быка, один из которых известен в качестве сомавубава. Несколько вариантов было получено с использованием технологии рекомбинантной ДНК, включая сомагребав, C987H1550N268O291S9; сометрибав, C978Hl537N265O286S9 и сомидобав, С1020Н1596N274O302S9.
Несколько вариантов встречающегося в природе соматотропина свиньи было получено с использованием технологии рекомбинантной ДНК, включая сомалапор, C977H1527N265O287S7; соменопор, C938H1469N255O275S7; сометрипор, C979H1527N265O287S8 и сомфазепор, C938H1465N257O278S6.
Сомавубав представляет собой соматотропин (бычий) 127-L-Leu-, который является одним из четырех встречающихся в природе молекулярных вариантов гипофизарного соматотропина гипофиза быка и который используют в качестве стимулирующего лактацию средства.
Соменопор представляет собой соматотропин (редуцированный pPGH-1 клона свиньи), N-L-Аlа-32-де-L-Glu-33-де-L-Аrg-34-де-L-А1а-35-де-L-Тyr-36-де-L-Ilе-37-де-L-Рro-38-де-L-Сlu-, содержащий 190 аминокислот, который используют в качестве свиного гормона роста.
Сометрибав представляет собой соматотропин (бычий), l-L-Met-127-L-Leu-, содержащий 191 аминокислоту, который используют в качестве применяемого в ветеринарии стимулятора роста.
Сометрипор представляет собой рекомбинантный соматотропин свиньи, C979Hl527N265O287S8.
Сомфазепор представляет собой рекомбинантный соматотропин свиньи, С938Н1465N257O278S6.
Сомидобав представляет собой рекомбинантный бычий соматотропин, С1020Н1596N274O302S9, который используют в качестве применяемого в ветеринарии стимулятора роста.
Тепротид представляет собой потенциатор В брадикинина, 2-L-Тrp-3-де-L-Lеu-4-де-L-Рro-8-L-глутамин-, содержащий 9 аминокислот, который используют в качестве ингибитора ангиотензинконвертирующего фермента.
Терипаратид представляет собой белок, содержащий 34 аминокислоты, который используют в качестве ингибитора резорбции костей и в качестве дополнительного агента при лечении остеопороза.
Тимальфазин представляет собой тимозин -Asp-L-глутамин] -, содержащий 191 аминокислоту, который используют в качестве стимулирующего лактацию средства, особено для ветеринарного использования.
Сомалапор представляет собой соматотропин (редуцированный pPGH-1 клона свиньи), N-L-аланил-гормон роста, содержащий в сумме 191 аминокислоту, который используют в качестве гормона (роста, свиньи).
Соматрем представляет собой соматотропин (человека), N-L-Met-, содержащий 191 аминокислоту, имеющий два дисульфидных мостика, который используют в качестве гормона роста.
Соматотропин, который также иногда называют аденогипофизарным гормоном роста, ГР, гипофизарным гормоном роста, гормоном роста передней доли гипофиза и соматотропным гормоном роста, представляет видоспецифичный анаболический белок, который способствует физическому росту, стимулирует синтез белков и регулирует углеводный и липидный метаболизм. Соматотропин секретируется передней долей гипофиза под действием регуляции гипоталамических гормонов соматолиберина и соматостатина. Соматотропные гормоны роста из различных видов различаются по аминокислотной последовательности, антигенности, изоэлектрической точке и диапазону животных, в которых они могут осуществлять биологические действия.
У людей соматотропин представляет собой одну полипептидную цепь, включающую в себя 191 аминокислоту, имеющую нормальную структуру основного гормона, стимулирующего рост, получаемого из передней доли гипофиза человека, который используют в качестве гормона роста. Соматотропин также доступен в рекомбинантной форме. Используемый здесь термин “соматотропин” включает в себя встречающиеся в природе, а также синтетические, включая получаемые рекомбинантно соматотропины человека и животных (гормоны роста), в частности соматотропины быка и свиньи. Метионильный гормон роста человека C995H1537N263O301S8 получают в бактериях из рекомбинантной ДНК и он содержит полную аминокислотную последовательность природного гормона плюс дополнительный N-концевой метионин.
Существуют четыре встречающихся в природе молекулярных варианта соматотропина быка, один из которых известен в качестве сомавубава. Несколько вариантов было получено с использованием технологии рекомбинантной ДНК, включая сомагребав, C987H1550N268O291S9; сометрибав, C978Hl537N265O286S9 и сомидобав, С1020Н1596N274O302S9.
Несколько вариантов встречающегося в природе соматотропина свиньи было получено с использованием технологии рекомбинантной ДНК, включая сомалапор, C977H1527N265O287S7; соменопор, C938H1469N255O275S7; сометрипор, C979H1527N265O287S8 и сомфазепор, C938H1465N257O278S6.
Сомавубав представляет собой соматотропин (бычий) 127-L-Leu-, который является одним из четырех встречающихся в природе молекулярных вариантов гипофизарного соматотропина гипофиза быка и который используют в качестве стимулирующего лактацию средства.
Соменопор представляет собой соматотропин (редуцированный pPGH-1 клона свиньи), N-L-Аlа-32-де-L-Glu-33-де-L-Аrg-34-де-L-А1а-35-де-L-Тyr-36-де-L-Ilе-37-де-L-Рro-38-де-L-Сlu-, содержащий 190 аминокислот, который используют в качестве свиного гормона роста.
Сометрибав представляет собой соматотропин (бычий), l-L-Met-127-L-Leu-, содержащий 191 аминокислоту, который используют в качестве применяемого в ветеринарии стимулятора роста.
Сометрипор представляет собой рекомбинантный соматотропин свиньи, C979Hl527N265O287S8.
Сомфазепор представляет собой рекомбинантный соматотропин свиньи, С938Н1465N257O278S6.
Сомидобав представляет собой рекомбинантный бычий соматотропин, С1020Н1596N274O302S9, который используют в качестве применяемого в ветеринарии стимулятора роста.
Тепротид представляет собой потенциатор В брадикинина, 2-L-Тrp-3-де-L-Lеu-4-де-L-Рro-8-L-глутамин-, содержащий 9 аминокислот, который используют в качестве ингибитора ангиотензинконвертирующего фермента.
Терипаратид представляет собой белок, содержащий 34 аминокислоты, который используют в качестве ингибитора резорбции костей и в качестве дополнительного агента при лечении остеопороза.
Тимальфазин представляет собой тимозин  1 (бычий), содержащий 28 аминокислот, который используют в качестве противоопухолевого агента, при лечении гепатита и инфекционных заболеваний и в качестве усилителя вакцин.
Тимопентин представляет собой пентапептид, используемый в качестве иммунорегулятора.
Трипторелин представляет собой рилизинг-фактор лютеинизирующего гормона (свиньи) 6-D-Trp, содержащий 10 аминокислот, который используют в качестве противоопухолевого агента.
Вапреотид включает в себя 8 аминокислот, имеет один дисульфидный мостик, используют в качестве противоопухолевого агента.
Вазопрессин в форме 8-L-Arg- или 8-L-Lys- содержит 9 аминокислот, имеет один дисульфидный мостик, используется в качестве антидиуретического гормона.
Продолжающееся развитие биотехнологической промышленности и использование средств и способов биотехнологических исследований привносит еще больше различных типов терапевтических агентов, основанных на пептидах, в клинические исследования и в конечном счете на рынок. В качестве примера можно указать следующие белковые агенты: миоглобин; гемоглобин; 1 (бычий), содержащий 28 аминокислот, который используют в качестве противоопухолевого агента, при лечении гепатита и инфекционных заболеваний и в качестве усилителя вакцин.
Тимопентин представляет собой пентапептид, используемый в качестве иммунорегулятора.
Трипторелин представляет собой рилизинг-фактор лютеинизирующего гормона (свиньи) 6-D-Trp, содержащий 10 аминокислот, который используют в качестве противоопухолевого агента.
Вапреотид включает в себя 8 аминокислот, имеет один дисульфидный мостик, используют в качестве противоопухолевого агента.
Вазопрессин в форме 8-L-Arg- или 8-L-Lys- содержит 9 аминокислот, имеет один дисульфидный мостик, используется в качестве антидиуретического гормона.
Продолжающееся развитие биотехнологической промышленности и использование средств и способов биотехнологических исследований привносит еще больше различных типов терапевтических агентов, основанных на пептидах, в клинические исследования и в конечном счете на рынок. В качестве примера можно указать следующие белковые агенты: миоглобин; гемоглобин;  -лактоглобулин; иммуноглобулин-G (IgG); антигемофилический фактор (фактор VIII); лизоцим; убиквитин; фактор агрегации тромбоцитов (ФАЦ); фактор некроза опухоли- -лактоглобулин; иммуноглобулин-G (IgG); антигемофилический фактор (фактор VIII); лизоцим; убиквитин; фактор агрегации тромбоцитов (ФАЦ); фактор некроза опухоли- (ФНО- (ФНО- ); фактор некроза опухоли- ); фактор некроза опухоли- (ФНО- (ФНО- ); воспалительный белок макрофагов (ВБМ); гепарин и катионный белок эозинофилов (КБЭ). Кроме того, лекарства, основанные на белках, которые недавно были предложены, включают в себя тромбоцитарный фактор роста, рекомбинантный фактор IX, моноклональное антитело к не-Ходжкинской В-клеточной лимфоме, улучшенный интерферон альфа для лечения гепатита С и полученная из фибробластов искусственная кожа для лечения ран и ожогов.
Поскольку приготовление исходных материальных реагентов, используемых в способах получения по настоящему изобретению, включая используемый здесь вышеописанный способ конденсации, было подробно описано выше, в следующих абзацах будут описаны подробности самого способа получения по настоящему изобретению.
Способы получения по настоящему изобретению предлагают новые улучшенные аддуктные конечные продукты конденсации, являющиеся основаниями Шиффа, как определено выше. Указанные способы включают в себя, во-первых, приготовление реакционной смеси, включающей в себя белковые и ароматические о-гидроксиальдегидные исходные материальные реагенты. Эту реакционную смесь готовят путем приведения реагента, представляющего собой белковый компонент, и реагента, представляющего собой ароматический о-гидроксиальдегидный компонент, в тесный контакт друг с другом в водной окружающей среде.
Выражения “исходный матприальный реагент”, “реагент, представляющий собой компонент” и “реагент” используются здесь для обозначения белковой и ароматической о-гидроксиальдегидной сущностей, которые реагируют с образованием конденсационного аддукта, являющегося основанием Шиффа.
Выражение “в водной среде” указывает на то, что растворитель для реакционной смеси представляет собой воду и что она представляет собой среду, в которой происходит реакция. Вода конденсации, которая образуется во время реакции, поэтому также становится неотделимой частью этой “водной среды”.
После того, как исходные материальные реагенты соединяют вместе с образованием реакционной смеси, немедленно осуществляется способ получения по настоящему изобретению с реакцией конденсации с образованием основания Шиффа. Используемое здесь выражение “реакция конденсации с образованием основания Шиффа” относится к реакции, которая хорошо известна специалисту в области органической химии и синтеза органических химических соединений. Основную реакцию конденсации с образованием основания Шиффа можно схематически представить в следующем виде: ); воспалительный белок макрофагов (ВБМ); гепарин и катионный белок эозинофилов (КБЭ). Кроме того, лекарства, основанные на белках, которые недавно были предложены, включают в себя тромбоцитарный фактор роста, рекомбинантный фактор IX, моноклональное антитело к не-Ходжкинской В-клеточной лимфоме, улучшенный интерферон альфа для лечения гепатита С и полученная из фибробластов искусственная кожа для лечения ран и ожогов.
Поскольку приготовление исходных материальных реагентов, используемых в способах получения по настоящему изобретению, включая используемый здесь вышеописанный способ конденсации, было подробно описано выше, в следующих абзацах будут описаны подробности самого способа получения по настоящему изобретению.
Способы получения по настоящему изобретению предлагают новые улучшенные аддуктные конечные продукты конденсации, являющиеся основаниями Шиффа, как определено выше. Указанные способы включают в себя, во-первых, приготовление реакционной смеси, включающей в себя белковые и ароматические о-гидроксиальдегидные исходные материальные реагенты. Эту реакционную смесь готовят путем приведения реагента, представляющего собой белковый компонент, и реагента, представляющего собой ароматический о-гидроксиальдегидный компонент, в тесный контакт друг с другом в водной окружающей среде.
Выражения “исходный матприальный реагент”, “реагент, представляющий собой компонент” и “реагент” используются здесь для обозначения белковой и ароматической о-гидроксиальдегидной сущностей, которые реагируют с образованием конденсационного аддукта, являющегося основанием Шиффа.
Выражение “в водной среде” указывает на то, что растворитель для реакционной смеси представляет собой воду и что она представляет собой среду, в которой происходит реакция. Вода конденсации, которая образуется во время реакции, поэтому также становится неотделимой частью этой “водной среды”.
После того, как исходные материальные реагенты соединяют вместе с образованием реакционной смеси, немедленно осуществляется способ получения по настоящему изобретению с реакцией конденсации с образованием основания Шиффа. Используемое здесь выражение “реакция конденсации с образованием основания Шиффа” относится к реакции, которая хорошо известна специалисту в области органической химии и синтеза органических химических соединений. Основную реакцию конденсации с образованием основания Шиффа можно схематически представить в следующем виде: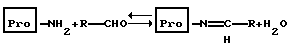 где  = белок, изображенный в фрагментарной форме, поскольку по меньшей мере одна его аминокислота имеет первичную аминогруппу, которая изображена как присоединенная к фрагменту белка. Важно отметить, что образование аддукта, являющегося основанием Шиффа, представляет собой равновесную реакцию, которая может также приводить в результате к разделению аддукта на составляющие его компоненты, а также то, что скорость этой реакции разложения может быть такой же высокой, как и скорость основной реакции, которая изначально приводит к образованию конденсационного аддукта.
Процесс конденсации способа получения по настоящему изобретению проводится по существу до завершения. Используемое здесь выражение “по существу до завершения”, означает то, что реакция является количественной, то есть протекает полностью или почти полностью до завершения. Реакцию конденсации способа получения по настоящему изобретению делают количественной путем удаления от приблизительно 97,0% до приблизительно 99,9% по массе, предпочтительно от приблизительно 98,0% до приблизительно 99,0% по массе воды, уже присутствующей или образующейся в ходе указанной реакции конденсации, что совместимо с поддержанием целостности реагентов конденсации и конечного аддуктного продукта и с обеспечением скорости превращения в указанный аддуктный конечный продукт конденсации, то есть с получающимся в результате выходом указанного конечного аддуктного продукта кондексации, равным или большим чем приблизительно 98,5% по массе, предпочтительно равным или большим чем приблизительно 99,5% по массе, основываясь на массе реагентов.
Используемый здесь термин “способ получения” в связи с воплощением способа по настоящему изобретению охватывает реакцию конденсации с образованием основания Шиффа, а также этапы способа, которые необходимы для того, чтобы провести указанную реакцию до завершения. Эта последняя часть всего способа осуществляется путем удаления по существу всей воды из водной окружающей среды реакционной смеси.
Для способа получения, описанного здесь, условия, которые являются эффективными для проведения указанной реакции конденсации по существу до завершения, включают в себя те условия, которые переводят присутствующую воду из жидкой фазы в газообразную или твердую фазу, посредством чего она удаляется из самой окружающей среды указанной реакции конденсации. В способе по настоящему изобретению указанные условия должны также характеризоваться масштабируемостью, то есть способностью легко и эффективно адаптироваться для получения в большом, промышленном масштабе, и воспроизводимостью, то есть способностью осуществляться последовательно без значительного отклонения конечного результата. Поскольку реакционная смесь в своем водном растворителе находится при температурах окружающей среды или повышенных температурах, находящихся ниже точки кипения воды, присутствующая вода будет, естественно, находиться в жидкой фазе. Для того чтобы провести эту реакцию до завершения, воду следует полностью и быстро удалить из непосредственного окружения реакционной смеси. Это нельзя осуществить просто путем отделения конечного аддуктного продукта конденсации от водного растворителя и отбрасывания последнего. Тот факт, что реакция находится в равновесии и что не образуется никакой выпадающий в осадок продукт, препятствует осуществлению этого подхода.
Существуют два подхода, используемые в способах получения по настоящему изобретению. В одном подходе воду превращают в пар или газ, и удаляют, например, путем распылительной сушки, и подразумевается, что это воплощение настоящего изобретения происходит при температурах выше 0oС. В другом подходе воду превращают в твердое вещество, и удаляют, например, путем лиофилизации, и подразумевается, что это воплощение настоящего изобретения происходит при температурах 0oС или ниже.
Первый подход, используемый в способе получения по настоящему изобретению, заключается в удалении воды путем ее превращения из жидкой фазы в газообразную или паровую фазу. Такой этап обычно осуществляется с достаточной быстротой. Когда воду превращают из жидкой фазы в газообразную или паровую фазу, подразумевается выпаривание воды. Следовательно, необходимо затрачивать энергию в способе для того, чтобы компенсировать скрытую теплоту парообразования (СТП) воды, которая представляет собой количество тепловой энергии, поглощаемое единичной массой воды, когда она переходит из жидкой в парообразное состояние. Требующееся количество энергии можно подсчитать из уравнения: СТП= 0,02T2/Е, где Т представляет собой точку кипения воды термодинамической шкалы и Е представляет собой молекулярное увеличение точки кипения раствора. Родственную величину представляет собой удельная скрытая теплота парообразования (УСТП), которая представляет собой количество джоулей, требуемое для превращения 1 грамма вещества из жидкости в пар без изменения температуры. Для воды при 100oС эта величина составляет 2257 Дж.
Условия, в которых осуществляется способ получения по настоящему исследованию, представляют собой условия, которые оптимизируют энергетические затраты в способе, необходимые для наиболее эффективного отделения воды водной окружающей среды, в которой происходит реакция конденсации, включая воду, образующуюся в ходе самой указанной реакции конденсации, от исходных материальных реагентов и аддуктного конечного продукта конденсации.
Используемое здесь выражение “энергетические затраты в способе” относится ко всем формам энергии, отдельно и в сумме, и к их использованию в способе получения по настоящему изобретению, посредством чего вода водной окружающей среды превращается из жидкой фазы в парообразную или твердую фазу. Здесь включена, во-первых, атомная теплоемкость, которая представляет собой количество тепловой энергии, требующееся для увеличения температуры одного грамма воды от 0oС до 1oС. Близкое понятие представляет собой молекулярная теплота, которая представляет собой количество тепловой энергии, требующееся для увеличения температуры одного моль воды на o, то есть удельная теплота х молекулярную массу. Эти затраты тепловой энергии увеличивают температуру реакционной смеси и ее водной окружающей среды до желаемой величины.
Следующие затраты тепловой энергии представляют собой такие затраты, которые необходимы для компенсации теплоты парообразования, которая подробно была описана в вышеописанном обсуждении. После этого следует приложить механическую энергию к реакционной смеси в ее водной окружающей среде для того, чтобы осуществить стадию распылительной сушки, в ходе которой вода полностью выпаривается. Таким образом, при температурах выше 0oС условия, которые оптимизируют энергетические затраты в способе, включают в себя = белок, изображенный в фрагментарной форме, поскольку по меньшей мере одна его аминокислота имеет первичную аминогруппу, которая изображена как присоединенная к фрагменту белка. Важно отметить, что образование аддукта, являющегося основанием Шиффа, представляет собой равновесную реакцию, которая может также приводить в результате к разделению аддукта на составляющие его компоненты, а также то, что скорость этой реакции разложения может быть такой же высокой, как и скорость основной реакции, которая изначально приводит к образованию конденсационного аддукта.
Процесс конденсации способа получения по настоящему изобретению проводится по существу до завершения. Используемое здесь выражение “по существу до завершения”, означает то, что реакция является количественной, то есть протекает полностью или почти полностью до завершения. Реакцию конденсации способа получения по настоящему изобретению делают количественной путем удаления от приблизительно 97,0% до приблизительно 99,9% по массе, предпочтительно от приблизительно 98,0% до приблизительно 99,0% по массе воды, уже присутствующей или образующейся в ходе указанной реакции конденсации, что совместимо с поддержанием целостности реагентов конденсации и конечного аддуктного продукта и с обеспечением скорости превращения в указанный аддуктный конечный продукт конденсации, то есть с получающимся в результате выходом указанного конечного аддуктного продукта кондексации, равным или большим чем приблизительно 98,5% по массе, предпочтительно равным или большим чем приблизительно 99,5% по массе, основываясь на массе реагентов.
Используемый здесь термин “способ получения” в связи с воплощением способа по настоящему изобретению охватывает реакцию конденсации с образованием основания Шиффа, а также этапы способа, которые необходимы для того, чтобы провести указанную реакцию до завершения. Эта последняя часть всего способа осуществляется путем удаления по существу всей воды из водной окружающей среды реакционной смеси.
Для способа получения, описанного здесь, условия, которые являются эффективными для проведения указанной реакции конденсации по существу до завершения, включают в себя те условия, которые переводят присутствующую воду из жидкой фазы в газообразную или твердую фазу, посредством чего она удаляется из самой окружающей среды указанной реакции конденсации. В способе по настоящему изобретению указанные условия должны также характеризоваться масштабируемостью, то есть способностью легко и эффективно адаптироваться для получения в большом, промышленном масштабе, и воспроизводимостью, то есть способностью осуществляться последовательно без значительного отклонения конечного результата. Поскольку реакционная смесь в своем водном растворителе находится при температурах окружающей среды или повышенных температурах, находящихся ниже точки кипения воды, присутствующая вода будет, естественно, находиться в жидкой фазе. Для того чтобы провести эту реакцию до завершения, воду следует полностью и быстро удалить из непосредственного окружения реакционной смеси. Это нельзя осуществить просто путем отделения конечного аддуктного продукта конденсации от водного растворителя и отбрасывания последнего. Тот факт, что реакция находится в равновесии и что не образуется никакой выпадающий в осадок продукт, препятствует осуществлению этого подхода.
Существуют два подхода, используемые в способах получения по настоящему изобретению. В одном подходе воду превращают в пар или газ, и удаляют, например, путем распылительной сушки, и подразумевается, что это воплощение настоящего изобретения происходит при температурах выше 0oС. В другом подходе воду превращают в твердое вещество, и удаляют, например, путем лиофилизации, и подразумевается, что это воплощение настоящего изобретения происходит при температурах 0oС или ниже.
Первый подход, используемый в способе получения по настоящему изобретению, заключается в удалении воды путем ее превращения из жидкой фазы в газообразную или паровую фазу. Такой этап обычно осуществляется с достаточной быстротой. Когда воду превращают из жидкой фазы в газообразную или паровую фазу, подразумевается выпаривание воды. Следовательно, необходимо затрачивать энергию в способе для того, чтобы компенсировать скрытую теплоту парообразования (СТП) воды, которая представляет собой количество тепловой энергии, поглощаемое единичной массой воды, когда она переходит из жидкой в парообразное состояние. Требующееся количество энергии можно подсчитать из уравнения: СТП= 0,02T2/Е, где Т представляет собой точку кипения воды термодинамической шкалы и Е представляет собой молекулярное увеличение точки кипения раствора. Родственную величину представляет собой удельная скрытая теплота парообразования (УСТП), которая представляет собой количество джоулей, требуемое для превращения 1 грамма вещества из жидкости в пар без изменения температуры. Для воды при 100oС эта величина составляет 2257 Дж.
Условия, в которых осуществляется способ получения по настоящему исследованию, представляют собой условия, которые оптимизируют энергетические затраты в способе, необходимые для наиболее эффективного отделения воды водной окружающей среды, в которой происходит реакция конденсации, включая воду, образующуюся в ходе самой указанной реакции конденсации, от исходных материальных реагентов и аддуктного конечного продукта конденсации.
Используемое здесь выражение “энергетические затраты в способе” относится ко всем формам энергии, отдельно и в сумме, и к их использованию в способе получения по настоящему изобретению, посредством чего вода водной окружающей среды превращается из жидкой фазы в парообразную или твердую фазу. Здесь включена, во-первых, атомная теплоемкость, которая представляет собой количество тепловой энергии, требующееся для увеличения температуры одного грамма воды от 0oС до 1oС. Близкое понятие представляет собой молекулярная теплота, которая представляет собой количество тепловой энергии, требующееся для увеличения температуры одного моль воды на o, то есть удельная теплота х молекулярную массу. Эти затраты тепловой энергии увеличивают температуру реакционной смеси и ее водной окружающей среды до желаемой величины.
Следующие затраты тепловой энергии представляют собой такие затраты, которые необходимы для компенсации теплоты парообразования, которая подробно была описана в вышеописанном обсуждении. После этого следует приложить механическую энергию к реакционной смеси в ее водной окружающей среде для того, чтобы осуществить стадию распылительной сушки, в ходе которой вода полностью выпаривается. Таким образом, при температурах выше 0oС условия, которые оптимизируют энергетические затраты в способе, включают в себя(а) нагревание указанной реакционной смеси в указанной водной окружающей среде до самой высокой температуры, совместимой с поддержанием целостности белкового исходного материального реагента и аддуктного конечного продукта конденсации, а также совместимой с оптимальными эффективностями и экономичностью осуществления указанного способа получения, включающего в себя указанную реакцию конденсации. Используемое здесь в связи с верхним ограничением температур, которые можно использовать, выражение “целостность белкового исходного материального реагента и аддуктного конечного продукта конденсации” означает по существу то, что белковый компонент исходных веществ и/или продуктов не подвержен какому-либо существенному разрушению, являющемуся результатом такого нагревания, то есть денатурации, которая вызвала бы какую-либо потерю биологической активности, или которая препятствовала бы высвобождению, особенно длительному высвобождению конечного продукта из места его введения, например, в виде подкожного или парентерального депо твердых пилюль. Предполагается, что выражение “оптимальные эффективности и экономичность”, употребляемое со ссылкой на осуществление способа получения по настоящему изобретению, включающему в себя реакцию конденсации, означает, что следует провести соответствующее обсуждение, когда выбирают температуру реакционной смеси и множество других параметров процесса, описанных здесь, для осуществления указанного способа с точки зрения реализации наиболее эффективного возможного способа, а также способа, который обеспечивает конечный продукт при самой низкой цене, согласующейся с другими выборами. Таким образом, придерживаются выбора параметров способа, которые обеспечивают самый высокий выход конечного продукта, если другие эффективности способа соответствуют по качеству, и только если полученный в результате способ представляетсобой способ, экономичность которого согласуется с самой лучшей доступной экономичностью. В объеме мастерства специалиста хорошо уравновешивать эти требования таким образом, чтобы достигнуть лучшего всеобъемлющего способа. Соответственно, принимая во внимание влияние всех вышеприведенных соображений, обычно указанную реакционную смесь нагревают до температуры от 25oС до 125oС, предпочтительно от 40oС до 120oС, более предпочтительно от 50oС до 115oС, более предпочтительно от 60oС до 110oС и наиболее предпочтительно от 75oС до 105oС, поддерживая водную окружающую среду в жидкой фазе путем приложения, когда требуется, повышенного давления. Достижения температур выше точки кипения воды в окружающей среде, то есть 100oС, тогда как водная среда все еще остается в жидкой фазе, можно осуществить путем использования повышенных давлений. Следующая стадия способа получения, при которой температура находится выше 0oС, включает в себя: (б) разделение указанной реакционной смеси в указанной водной окружающей среде на мельчайшие капли, совместимые с поддержанием целостности белкового исходного материального реагента и аддуктного конечного продукта конденсации, а также совместимые с оптимальными эффективностями и экономичностью осуществления указанного способа получения, включающего в себя указанную реакцию конденсации. В контексте вышеуказанной стадии поддержание целосности белка будет зависеть в некоторой степени от размера этого белка. Таким образом, очень крупные белки могут увеличивать средние диаметры капель, которые используются на этой стадии. Обычно, тем не менее, реакционная смесь в указанной окружающей водной среде разделяется на капли, имеющие средний диаметр от 1,0 мкм до 5,0 мм, предпочтительно от 10 мкм до 1,0 мм, более предпочтительно от 100 мкм до 900 мкм, более предпочтительно от 200 мкм до 800 мкм и наиболее предпочтительно от 300 мкм до 700 мкм. Способ получения по настоящему изобретению включает в себя воплощение, в котором указанные исходные материальные реагенты приводят в тесный контакт друг с другом в форме капель, то есть образование указанного аддуктного конечного продукта конденсации происходит непосредственно перед или по существу одновременно с диспергированием указанного конечного продукта в форме капель. Однородной смеси указанных исходных материальных реагентов в форме капель достигают путем механического воздействия, достаточного для приведения указанных исходных материальных реагентов в контакт друг с другом, в то же время механически не разрушая белковый компонент указанного конденсационного аддукта. Выбор конкретного механического смесительного устройства находится в объеме мастерства специалиста, обеспеченного описанием здесь различных параметров, которые следует учитывать. Одним из наиболее важных факторов является природа используемого белкового компонента и количество напряжения при сдвиге, которое он может выдержать в водном растворе до того, как он испытает разрушение его структурной целостности. Это можно легко определить, используя стандартные тесты структурной целостности, такие как электрофорез, для измерения воздействия, если такое имеется, которое оказывает выбранное механическое смесительное устройство на указанную целостность используемого белка. Такое стандартное тестирование может быть необходимым, поскольку устойчивость данного белка к механическому напряжению при сдвиге в водном растворе в общем не является полностью предсказуемой вследствие способности более крупных белков претерпевать множественное складывание, которое может обеспечивать элементы структурной устойчивости. С другой стороны, проблем можно избежать с самого начала путем выбора механического смесительного устройства, которое обладает мягким действием. Выбор устройства с точки зрения избегания значительных уровней напряжения при сдвиге в растворе часто позволяет избежать необходимости в каком-либо тестировании из вышеупомянутых. Множество подходящих смесительных устройств легко может быть отобрано специалистом. Например, смесительный сосуд может быть стационарным и в нем может быть использован ротационный или другой тип движения элементов, таких как стержни, лопасти или другие типы мешалок, для достижения смешивания путем мягкого перемешивания. Когда желательно осуществлять процесс конденсации на непрерывной основе, смесительный аппарат может принимать форму желоба, в котором исходные материальные реагенты поступают с одного конца, а реакционная смесь и аддуктный конечный продукт конденсации выгружают с другого конца. Перемешивания в таком аппарате можно достигнуть с использованием медленно движущегося червяка, который действует в растворе и поднимает конечный продукт с нагревающей поверхности для его распределения в растворе и медленно переносит его вдоль желоба. Можно также использовать покачивание всего желоба в сочетании с дефлекторами, которые увеличивают время пребывания раствора в желобе. Оба этих типа смесительных устройств отличаются низкими коэффициентами теплопереноса, а более быстрый теплообмен можно получить путем использования приспособления с двойной трубой, в котором реакционная смесь подводится в центральную трубу, а нагревающая среда с противоположным потоком подводится в зазор между трубами. Смешивания в этом типе аппарата часто достигают путем использования вала, который вращается в центральной трубе и несет лопасти, которые чистят теплопереносящую поверхность, обеспечивая возможность достижения высоких коэффициентов теплового переноса. Смесительные устройства могут быть более пассивными в конструкции и не использовать тепловой перенос, например перемешиваемый реакционный аппарат. Для более крупных уровней получения можно использовать каландр для нагревания и циркуляционную трубу, которая должна быть достаточно большой для того, чтобы вмещать поток реакционной смеси, которая обычно содержит крыльчатку с усиленной циркуляцией, увеличивающей тепловой перенос к реакционной смеси. Непрерывный способ, при котором тщательный контроль конечного продукта является важным, может осуществляться с использованием смесительных устройств, которые концентрируют реакционную смесь. В вакуумном реакционном аппарате обычно горячая концентрированная реакционная смесь будет загружаться в перемешиваемую реакционную камеру, поддерживаемую при низком давлении. Реакционной смеси можно позволить кипеть и охлаждаться адиабатически до точки кипения, соответствующей рабочему давлению в аппарате. Еще один тип смесительного устройства, который может подходить для использования в способе по настоящему изобретению, использует потоки реакционной смеси, создаваемые, например, гидравлическими насосами, которые создают достаточную турбулентность в указанных потоках для обеспечения однородного смешивания компонентов. Выбранное механическое воздействие может также принимать форму раздельного распыления каждого из исходных материальных реагентов, направленного таким образом по отношению друг к другу, что достигается максимальное смешивание, столкновение и контакт указанных капель. В этом способе можно использовать распыляющий аппарат, который включает в себя простые механические или гидравлические насосы, достаточные для придания энергии, необходимой для разделения водного потока, содержащего указанные исходные материальные реагенты, на капли, размер которых находится в вышеописанных пределах, которые требуются для удаления от приблизительно 97,0% до приблизительно 99,9% по массе, предпочтительно от приблизительно 98,0% до приблизительно 99,0% по массе воды, уже присутствующей или образующейся в ходе указанной реакции конденсации, что совместимо с поддержанием целостности реагентов конденсации и аддуктного конечного продукта конденсации и для обеспечения степени превращения в указанный аддуктный конечный продукт конденсации, то есть с получающимся в результате выходом указанного аддуктного конечного продукта конденсации, равным или большим чем приблизительно 98,5% по массе, предпочтительно равным или большим чем приблизительно 99,5% по массе, основываясь на массе реагентов. Вышеописанные насосы можно использовать в сочетании с соплами, посредством чего к потокам водных растворов, содержащих исходные материальные реагенты, прикладываются механические усилия сдвига, в результате чего водные потоки разделяются на капли последовательно более мелких общих объемов до того, как будет достигнут желаемый размер капель. В способе получения по настоящему изобретению может также использоваться распыляющий аппарат, содержащий генераторы потока газа и средства для диспергирования в нем указанного водного потока указанных исходных материальных реагентов таким образом, чтобы посредством этого они увлекались потоком газа в форме капель, имеющих желаемый размер капель. В частности, указанный газ является по существу инертным в отношении указанных исходных материальных реагентов и указанного аддуктного конечного продукта конденсации. Указанный газ включает в себя среди прочих воздух, азот или гелий, которые сжаты до давления, достаточно высокого для того, чтобы обеспечить поток газа, имеющий объем и скорость, необходимые для того, чтобы увлечь указанные капли указанных исходных материальных реагентов и обеспечить их смешивание, контакт и столкновение, достаточные для удаления от приблизительно 97,0% до приблизительно 99,9% по массе, предпочтительно от приблизительно 98,0% до приблизительно 99,0% по массе воды, уже присутствующей или образующейся в ходе указанной реакции конденсации, совместимого с поддержанием целостности реагентов конденсации и аддуктного конечного продукта конденсации, и для обеспечения степени превращения в указанный аддуктный конечный продукт конденсации, то есть с получающимся в результате выходом указанного аддуктного конечного продукта конденсации, равным или большим чем приблизительно 98,5% по массе, предпочтительно равным или большим чем приблизительно 99,5% по массе, основываясь на массе реагентов. Распыляющий аппарат, подходящий для использования в способе по настоящему изобретению, включает в себя любое подходящее сочетание вышеописанных генераторов потока газа и ассоциированных диспергирующих средств вместе с указанными вышеописанными механическими или гидравлическими насосами и ассоциированными соплами. Когда температуру водной окружающей среды, включающей в себя реакционную смесь, следует поддерживать выше нормальной точки кипения воды, то есть 100oС, этого можно достигнуть путем поддержания системы при повышенных давлениях, которые будут повышать точку кипения воды в системе предсказуемым образом. Также понятно, что как только реакционная смесь и водная система будут испускаться в виде мелких капель распыляющим аппаратом, будет происходить немедленное и значительное снижение температуры указанных капель. Например, можно поддерживать температуру 115oС для реакционной смеси и водной окружающей среды во входной части распыляющего аппарата путем использования повышенного давления, и как только реакционная смесь и водная система покинут сопло распыляющего аппарата, их температура, как будет наблюдаться, снизится до 80oС. В еще одном воплощении настоящего изобретения однородного смешивания указанных исходных материальных реагентов в форме капель достигают путем механического воздействия в форме вращающегося диска, на поверхность которого направлен водный поток, содержащий каждый указанный исходный материальный реагент. Можно использовать отдельный диск для каждого исходного материального реагента или же используется один диск, который приспособлен для того, чтобы сводить вместе оба водных потока указанных исходных материальных реагентов. Каждый указанный водный поток пересекает указанный диск таким образом, что он отталкивается от края указанного диска в форме капель; и скорость указанного вращающегося диска изменяется таким образом, чтобы сообщить достаточное количество энергии для разделения каждого указанного водного потока на капли такого размера и скорости, что достигается максимальное смешивание, столкновение и контакт указанных капель. Смешивание указанных исходных материальных реагентов происходит по существу в условиях, отрегулированных в отношении температуры, влажности и давления таким образом, чтобы удалять от приблизительно 97,0% до приблизительно 99,9% по массе, предпочтительно от приблизительно 98,0% до приблизительно 99,0% по массе воды, уже присутствующей или образующейся в ходе указанной реакции конденсации, что совместимо с поддержанием целостности реагентов конденсации и аддуктного конечного продукта и обеспечивать степень превращения в указанный аддуктный конечный продукт конденсации, то есть с получающимся в результате выходом указанного аддуктного конечного продукта конденсации, равным или большим чем приблизительно 98,5% по массе, предпочтительно равным или большим чем приблизительно 99,5% по массе, основываясь на массе реагентов. Температура, например, как правило, находится в вышеописанных диапазонах, где обычно указанную реакционную смесь нагревают до температуры от 25oС до 125oС, предпочтительно от 40oС до 120oС, более предпочтительно от 50oС до 115oС, более предпочтительно от 60oС до 110oС и наиболее предпочтительно от 75oС до 105oС, поддерживая водную окружающую среду в жидкой фазе путем приложения, если требуется, повышенного давления. Вращающийся диск может располагаться в аппарате, в котором возможно поддерживать пониженное давление путем использования, например, вакуумных насосов, хотя это не является типичной конфигурацией. Такие повышенные давления можно использовать для повышения точки кипения реакционной смеси и водной системы, как обсуждалось выше. Примером такого распылителя на основе вращающегося диска является передвижная распылительная сушилка Niro производства Niro Atomizer of Denmark. Это устройство имеет цилиндрическую камеру высотой 600 мм и диаметром 800 мм с коническим основанием, имеющим конический угол 60o. При функционировании в условиях атмосферного давления скорость диска находится в диапазоне от 35000 до 40000 об/мин, а расход высушивающего воздуха составляет 80 кг/ч. Сочетание вышеописанного нагревания реакционной смеси и водной окружающей среды с механической энергией, придаваемой им во время их разделения на маленькие капли, будет сообщать молекулам воды достаточное количество энергии, давая им возможность переходить в газообразную или паровую фазу. Для того чтобы дополнительно облегчить удаление воды из реакционной смеси и водной окружающей среды, предпочтительно дополнительно использовать поток воздуха для удаления испаряемой воды. Ввод энергии из движущегося потока воздуха непосредственно будет увеличивать испарение воды и, как правило, чем больше скорость потока воздуха, тем больше увеличение испарения. Увеличение испарения также может быть усилено путем использования потока воздуха, имеющего повышенные температуры, например от 75oС до 150oС, предпочтительно от 90oС до 110oС. Нагретый воздух сообщает дополнительную энергию процессу испарения. Испарение воды также увеличивается путем использования потока нагретого воздуха, который является сухим, то есть который обладает низкой влажностью, посредством чего увеличивается способность потока нагретого воздуха удерживать дополнительные количества водяного пара. Влажность потока нагретого воздуха предпочтительно составляет от 1% до 20% относительной влажности, предпочтительно от 2% до 10% относительной влажности. Соответственно последняя стадия способа получения по настоящему изобретению представляет собой: (в) придание указанным каплям, образуемым таким образом, самой высокой относительной скорости по отношению к газу, через который они проходят, инертному в их отношении, совместимой с поддержанием целостности белкового исходного материального реагента и аддуктного конечного продукта конденсации, а также совместимой с оптимальными эффективностями и экономичностью осуществления указанного способа получения, включающего в себя указанную реакцию конденсации. Выражение “газ, инертный в их отношении, через который они проходят”, относящееся как к каплям реакционной смеси и водной окружающей среды, так и к каплям аддуктного конечного продукта конденсации, которые образуются, обозначает любой газ, который является инертным в отношении указанного конечного продукта. Можно использовать такие обычные газы, как азот и гелий, которые являются легко доступными и которые являются инертными в этих условиях. На практике же, однако, обычно очень сложно найти более подходящий инертный газ, чем воздух окружающей среды. Воздух также совместим с оптимальными эффективностями и экономичностью осуществления способа получения по настоящему изобретению. Относительная скорость, которую приобретают указанные капли, составляет от 0,1 м/с до 5,0 м/с, предпочтительно от 0,2 м/с до 4,0 м/с, более предпочтительно от 0,3 м/с до 3,0 м/с, более предпочтительно от 0,4 м/с до 2,0 м/с и наиболее предпочтительно от 0,5 м/с до 1,0 м/с. Эта скорость учитывает относительную скорость потока инертного газа, который может течь вместе с, против, поперек или под любым углом к потоку указанных капель. Следуя вышеописанным способам, возможно разделить реакционную смесь в указанной водной среде на капли, имеющие средний диаметр от 1,0 мкм до 5,0 мм, предпочтительно от 10 мкм до 1,0 мм, более предпочтительно от 100 мкм до 900 мкм, более предпочтительно от 200 мкм до 800 мкм и наиболее предпочтительно от 300 мкм до 700 мкм. Понятно, что чем меньше капля, тем более эффективным будет испарение и удаление воды из реакционной смеси и водной среды. Это происходит прежде всего благодаря значительно увеличенной площади поверхности, доступной для молекул воды, с которой они переходят из жидкой фазы в паровую фазу и уносятся окружающим потоком инертного газа. Также возможно осуществить эти процессы конденсации в условиях пониженной влажности для того, чтобы увеличить скорость удаления воды. Это будет содействовать проведению реакции конденсации до завершения и будет совместимо с ней, причем количество влаги, присутствующей в аддуктном конечном продукте конденсации, будет составлять от 3,0% до 0,001% по массе, основываясь на массе конечного продукта, предпочтительно от 2,0% до 3,0% по массе, основываясь на массе указанного конечного продукта. Тем не менее, также возможно далее удалять дополнительные количества влаги для того, чтобы получить более сухой конечный продукт, который не поддается затвердеванию и обладает улучшенной стабильностью и другими характеристиками обработки. Количество влаги, присутствующей в аддуктном конечном продукте конденсации, может быть низким, таким как от 0,1% до 0,001% по массе, или от 0,05% до 0,005% по массе, или даже от 0,03% до 0,01% по массе, основываясь на массе конечного продукта. Следует предупредить, с другой стороны, что может быть необходимо иметь по существу большие количества влаги, присутствующей в конечном продукте, поскольку множество белков являются нестабильными, если они полностью дегидратированы. Согласуясь с задачей поддержания целостности конечного продукта, количества влаги, присутствующей в конечном продукте, могут находиться в диапазоне от 3,0% до 20,0% по массе, предпочтительно от 5,0% до 15,0% по массе и более предпочтительно от 8,0% до 12,0% по массе, основываясь на массе конечного продукта. Как упомянуто выше, существуют два подхода, используемые в способах получения по настоящему изобретению. В первом подходе, описанном выше, вода превращается в пар или газ, и удаляется, например, путем распылительной сушки, и подразумевается, что это воплощение настоящего изобретения происходит при температурах выше 0oС. В другом подходе, описанном в следующих абзацах, воду превращают в твердое вещество, и удаляют, например, путем лиофилизации, и подразумевается, что это воплощение настоящего изобретения происходит при температурах 0oС или ниже. Второй подход, используемый в способе получения по настоящему изобретению, заключается в удалении воды путем ее превращения из жидкой фазы в твердую фазу. Такая стадия обычно не осуществляется так же быстро, как стадия превращения в паровую фазу. Там, где вода переходит из жидкой фазы в твердую фазу, используется замораживание воды, которое по существу требует удаления энергии из водной среды реакционной смеси. Тем не менее, для того, чтобы удалить энергию из указанной водной среды, то есть для того, чтобы понизить ее температуру и в конечном счете превратить ее в твердую фазу, в способе получения по настоящему изобретению необходимо использовать энергию. Например, он может вовлекать использование охлаждающей или быстрой теплообменной системы и приведения ее в контакт с водной средой. Следовательно, необходимо затрачивать энергию в способе получения для того, чтобы удалять достаточное количество тепловой энергии для заданной единичной массы вовлекаемой воды для уменьшения ее температуры и в конечном счете ее превращения в твердую фазу. Один способ осуществления вышеописанного удаления тепловой энергии из указанной водной окружающей среды в соответствии со способом получения представляет собой сушку вымораживанием или лиофилизацию указанной водной среды, включая реакционную смесь. В соответствии с настоящим изобретением такой способ сушки вымораживанием осуществляют таким образом, что указанную реакционную смесь охлаждают до температуры от -110oС до 0oС, предпочтительно от -45oС до -5oС, более предпочтительно от -40oС до -10oС, более предпочтительно от -35oС до -15oС и наиболее предпочтительно от -30oС до -20oС, поддерживая водную среду в твердой фазе, то есть замороженной. Этот способ сушки по существу представляет собой способ, в котором водный растворитель удаляется сначала замораживанием и затем удалением его путем сублимации в вакуумной среде. Пониженное давление, которому подвергается охлажденная реакционная смесь в водной среде для увеличения скорости удаления воды, составляет от 666,61 Па (5,0 мм рт. ст. ) (абсолютное) до 0,0133322 Па (0,0001 мм рт. ст.) (абсолютное), предпочтительно от 133,322 Па (1,0 мм рт. ст.) (абсолютное) до 0,066661 Па (0,0005 мм рт. ст. ) (абсолютное), более предпочтительно от 66,661 Па (0,5 мм рт. ст.) (абсолютное) до 0,133322 Па (0,001 мм рт. ст.) (абсолютное), более предпочтительно от 26,6644 Па (0,2 мм рт. ст.) (абсолютное) до 0,66661 Па (0,005 мм рт. ст.) (абсолютное) и наиболее предпочтительно от 13,3322 Па (0,1 мм рт. ст.) (абсолютное) до 1,33322 Па (0,01 мм рт. ст. ) (абсолютное). Такие пониженные давления можно получить, используя вакуумные насосы различной производительности и известной конструкции. В обычном способе осуществления рассматриваемого здесь типа процесса сушки вымораживанием водный раствор реакционной смеси вводят в подходящие емкости, такие как пробирки, которые затем помещают в среду с контролируемой температурой, такую как большая сушильная камера. Вовлекаемые аддуктные конечные продукты конденсации будут в конечном счете использоваться при лечении болезней и состояний людей и животного. Соответственно для способа эффективными являются такие продукты в серии небольших партий, таких как пробирки, поскольку они отдельно обеспечивают подходящее соотношение объема к поверхности для осуществления процесса сушки вымораживанием и одновременно может быть обработано большое количество пробирок. Температуру в сушильной камере затем доводят до уровня приблизительно -40oС и поддерживают на этом уровне, после чего водный раствор реакционной смеси быстро становится твердым, состоящим из льда и твердого растворенного вещества, то есть аддуктного конечного продукта конденсации. Лед кристаллизуется, и растворенное вещество либо кристаллизуется, или становится стекловидным растворенным веществом в зависимости от вовлекаемого конечного продукта и природы осуществляемого процесса сушки вымораживанием. Сушильную камеру затем вакуумируют при помощи вакуумных насосов и температуру в сушильной камере увеличивают для иницииации стадии сублимации льда в пар сушки выморживанием, часто называемой первичной стадией сушки. Водяной пар, который образуется путем сублимации, переносится через частично высушенный конденсационный аддукт на его пути в конденсационную камеру, оборудованную поверхностями, поддерживаемыми даже при более низких температурах, составляющих приблизительно -60oС, где пар конденсируется и посредством этого удаляется. При увеличении температуры конденсационного аддуктного продукта скорость основной сушки увеличивается, но следует проявлять осторожность, чтобы не превысить максимальную температуру для поддержания целостности продукта. Первичная стадия сушки удаляет весь лед в исходном конденсационном аддуктном продукте. Тем не менее, количество влаги в продукте, которое содержится в растворенном состоянии в аморфных частях продукта, все еще является существенным, порядка от приблизительно 20% до 50% по массе в зависимости от состава указанного продукта. Удаление этой оставшейся воды осуществляется во время второй стадии сушки, которую обычно осуществляют при повышенных температурах продукта. Эти температуры, тем не менее, не являются такими высокими, как те, которые используются в описанных здесь процессах распылительной сушки по настоящему изобретению. Как правило, предпочтительно использовать процессы сушки вымораживанием, нежели процессы распылительной сушки по настоящему изобретению, поскольку первые, будучи низкотемпературными, более вероятно не окажут никаких разрушающих воздействий на конечные продукты, содержащие белок. Процессы сушки вымораживанием также обладают преимуществом, заключающемся в том, что они более легко обеспечивают предотвращение загрязнения микробами и частицами. С другой стороны, процессы сушки вымораживанием страдают от недостатка, заключающегося в том, что они включают более высокие капитальные затраты на установку и более высокие затраты на потребляемую энергию для производства, чем процессы распылительной сушки. Для обоих типов процессов, тем не менее, белковая природа конечного продукта создает значительные проблемы поддержания конформационной устойчивости конечного продукта. Вышеупомянутая аморфная фаза конденсационного аддукта включает в себя незакристаллизованное растворенное вещество продукта и незакристаллизованную воду. Практически вода не кристаллизуется в лед в точке равновесия, а должна быть переохлаждена на 10-15oС ниже этой точки, прежде чем в ней образуются зародыши кристаллизации и она кристаллизуется. Величина необходимого переохлаждения диктуется структурой растворенного вещества и температурой и временем пребывания в сушильной камере, а также размером и структурой вещества контейнерного сосуда и присутствием любого вещества в форме частиц в водном растворе конденсационного аддукта, что может обеспечить гетерогенные сайты зародышеобразования для образования льда. Проблемы пропорционального увеличения масштаба в этой связи могут вызываться стерильными свободными от частиц условиями производства, связанными с приготовлением терапевтических агентов для животных и людей, из которых наиболее вероятно состоят конденсационные аддуктные продукты. Такие среды ограничивают вероятность нахождения мест образования зародышей частицами, приводя в результате к необходимости большей степени переохлаждения конденсационного аддукта, которая, в свою очередь, управляет размером образующихся кристаллов льда. Размер кристаллов льда является важным, поскольку он контролирует размер пор или каналов, образуемых в кристаллах льда во время сублимации, который влияет на площадь поверхности этих пор, доступную во время процесса сублимации. В конечном счете эти факторы существенно влияют на скорость сублимации, а также на скорость вторичной сушки. Увеличение переохлаждения на 10oС может привести к увеличению времени первичной сушки на порядок. Степень переохлаждения должна быть ограничена до 10o-15oС и должна быть одинаковой во всей сушильной камере и от пробирки к пробирке. Параметры температуры сушильной камеры и времени присутствия в камере выбираются для получения оптимальных результатов там, где задача заключается в получении одинаковой степени переохлаждения, и режим замораживания состоит из первого охлаждения всего конденсационного аддуктного продукта до температуры ниже 0oС, но выше температуры, которая вызывает зародышеобразование и кристаллизацию, составляющей приблизительно от -5oС до -10oС. Затем температуру сушильной камеры понижают до умеренного уровня для индуцирования кристаллизации льда во всех контейнерных сосудах, что составляет приблизительно от -20oС до -30oС. После этого температуру сушильной камеры понижают ниже самой низкой температуры эвтектики, при которой растворенное вещество является кристаллическим, или ниже температуры стеклования, при которой растворенное вещество является аморфным, составляющей приблизительно -40oС. Как только эвтектическая система кристаллизуется, она является полностью твердой и затем можно осуществлять основную сушку. Там, где система растворенного вещества стремится остаться аморфной, можно использовать процесс отпуска или отжига, в котором температуру конденсационного аддуктного продукта увеличивают по меньшей мере на несколько градусов выше температуры стеклования на нескольких часов для того, чтобы дать возможность кристаллизоваться растворенному веществу, после чего температуру в сушильной камере снова понижают перед началом первичной сушки. Следует также отметить, что во время этого процесса образование льда приводит к концентрированию всех растворенных веществ, которые могут включать в себя включение растворенных солей, например, там, где конденсационный аддуктный продукт растворяют в слабосолевом растворе. Результатом может являться увеличенная концентрация NaCl, которая в конечном счете может привести к разрушению указанного продукта. Стадию первичной сушки осуществляют при максимально допустимой температуре, а не при самой высокой температуре, чтобы предотвратить разрушение продукта. Эта температура представляет собой температуру эвтектики там, где растворенное вещество является кристаллическим, и температуру свертывания или эвтектическую температуру плавления там, где растворенное вещество является аморфным. Сушка сверхмаксимально допустимой температуры приводит в результате к неприемлемому продукту, который лишен определенной геометрии. Максимально допустимая температура, которую легко определить способами термоанализа, измерениями электрического сопротивления или микроскопическим анализом продукта в зависимости от температуры, может изменяться в значительном диапазоне и должна быть определена в качестве первой стадии при установлении параметров процесса сушки вымораживанием. Вышеописанные способы получения можно также осуществлять в условиях пониженной влажности, посредством чего увеличивается скорость удаления воды и общее удаляемое количество. Это соответствует задаче проведения реакции конденсации до завершения путем удаления от приблизительно 97,0% до приблизительно 99,9% по массе, предпочтительно от приблизительно 98,0% до приблизительно 99,0% по массе воды, уже присутствующей или образующейся в ходе указанной реакции конденсации, что совместимо с поддержанием целостности реагентов конденсации и аддуктного конечного продукта конденсации и обеспечения скорости превращения в указанный аддуктный конечный продукт конденсации, то есть с получающимся в результате выходом указанного аддуктного конечного продукта, равным или большим чем приблизительно 98,5% по массе, предпочтительно равном или большем чем приблизительно 99,5% по массе, основываясь на массе реагентов. Согласуясь с этой задачей, количество влаги, присутствующей в конечном аддуктном продукте конденсации, будет соответственно составлять от 3,0% до 0,001% по массе, основываясь на массе конечного продукта, предпочтительно от 2,0% до 3,0% по массе, основываясь на массе указанного конечного продукта. После завершения реакции конденсации, тем не менее, также возможно далее удалить дополнительные количества влаги из конечного продукта там, где это является желательным, для предотвращения затвердевания, увеличения стабильности, улучшения обрабатываемости или для других целей, очевидных для специалиста. Соответственно количество влаги, присутствующей в аддуктном конечном продукте конденсации, может составлять от 0,1% до 0,001% по массе, или от 0,05% до 0,005% по массе, или даже до от 0,03% до 0,01% по массе, основываясь на массе конечного продукта. Тем не менее, в зависимости от природы аддуктного конечного продукта конденсации, особенно его белкового компонента, может оказаться необходимым, чтобы значительно большие количества влаги присутствовали в конечном продукте, поскольку множество белков являются нестабильными, если из них удалена вся вода. Таким образом, согласуясь с поддержанием целостности конечного продукта, может быть желательно иметь количества влаги, присутствующей в конечном продукте, в диапазоне от 3,0% до 20,0% по массе, предпочтительно от 5,0% до 15,0% по массе и более предпочтительно от 8,0% до 12,0% по массе, основываясь на массе конечного продукта. Описание предпочтительных воплощений Следующие примеры представлены для того, чтобы дополнительно проиллюстрировать новые способы и продукты по настоящему изобретению, но не предполагается, что их каким-либо образом понимают как ограничивающие настоящее изобретение. ПРИМЕР 1 Продукты конденсации Met-CTC и других альдегидов, получаемые путем лиофилизации 2,50 мМ раствор о-ванилина готовят путем растворения 76,1 мг о-ванилина в 200 мл дистиллированной воды. Минимальное нагревание и воздействие ультразвуком необходимы для полного растворения альдегида. Водные растворы ванилина, салицилового альдегида и бензальдегида (все 2,50 мМ) готовят похожим образом. Сухой лиофилизованный met-CTC (21,9 мг, 21858 г/м, 1,00 мкмоль) растворяют в 2,00 мл раствора каждого альдегида при комнатной температуре. рН доводят до 8,0 разбавленным раствором гидроксида натрия (используют разбавленную уксусную кислоту, если рН необходимо уменьшить). Конечные растворы содержат 1,00 мкмоль белка и 5,00 мкмоль альдегида. Растворам дают возможность оставаться при комнатной температуре в течение часа и затем помещают в лиофилизационные колбы на 20 мл и замораживают при -28oС в морозильнике в течение 16 часов. Замороженные образцы затем помещают в установку для сушки вымораживанием типа коллектора и колбы вакуумируют. Давление поддерживают на уровне <1,0 мм в течение 24 часов. Давление в колбах затем снова приводят до уровня атмосферного и определяют массу получаемых веществ. В каждом случае определяемая масса находится в пределах экспериментальной ошибки относительно общей массы альдегида и белкового исходного вещества. Любая потеря альдегида не может быть определена в этом масштабе реакции. Анализ с использованием обращенно-фазовой ВЭЖХ (высокоэффективной жидкостной хроматографии) демонстрирует лишь пики, соответствующие мономеру met-CTC и соответствующему альдегиду, причем с выходом мономера >95%. Каждый образец подвергают масс-спектральному анализу с использованием электрораспыления. Образцы для ионизации путем электрораспыления растворяют в растворе 0,1%-ной трифторуксусной кислоты в 2-метоксиэтаноле (~0,1 мг/мл) при помощи воздействия ультразвуком. Образцы готовят менее чем за пять минут до анализа, поскольку контрольные эксперименты показывают, что происходит частичный гидролиз вещества, если раствору дают возможность стоять в течение более продолжительных периодов времени. Вышеописанные препараты представляют собой как аддуктные конечные продукты конденсации, являющиеся основаниями Шиффа, находящиеся в объеме настоящего изобретения, так и такие аддукты, которые не находятся в объеме настоящего изобретения, поскольку их получают с использованием альдегида, отличного от ароматического о-гидроксиальдегида. Таблица 1-А суммирует получение каждого тестируемого образца. Таблица 1-Б представляет анализ каждого из указанных образцов, содержащий указание прогнозируемого числа эквивалентов альдегида по отношению к белку для полного образования аддукта, являющегося основанием Шиффа. Процентный выход для каждого образца определяют на основе вышеописанного. Процентный выход по массе для способа сушки вымораживанием всегда является количественным в пределах экспериментальной ошибки для всех альдегидов и белковых исходных веществ, поскольку единственная потеря вещества возникает за счет сублимируемого альдегида, и это происходит лишь в случае, когда используют альдегиды, не являющиеся о-гидроксиальдегидами, и даже в этом случае потеря является слишком маленькой для измерения. Процентный выход основания Шиффа эквивалентен массе конечного продукта, которая составляет всегда 100% от теоретической по причинам, только что упомянутым, Х выход превращения. Выход превращения, в свою очередь, получают путем нахождения действительного среднего числа эквивалентов альдегида, определяемого с использованием масс-спектрофотометрии с электрораспылением, и его деления на число эквивалентов, прогнозируемое, исходя из теории, и умножения результата на 100 для того, чтобы выразить выход превращения в виде процента. Получаемые таким образом величины представляют собой дополнительное указание эффективности превращения в основание Шиффа, получаемое с использованием способа по настоящему изобретению. Наконец, рН каждого образца определяют перед проведением процедуры тестирования, включаемой для демонстрации важности поддержания рН на уровне 7,0 или выше для получения высоких выходов. Способы получения по настоящему изобретению, осуществляемые при температурах выше 0oС, проиллюстрированы в следующем примере. ПРИМЕР 2 Продукты конденсации Met-CTC и о-ванилина. получаемые путем распылительной сушки 1,00 г образца сухого лиофилизированного met-CTC (45,7 мкмоль) растворяют в 100,0 мл дистиллированной воды. К этому раствору добавляют о-ванилин (34,8 мг, 228,5 ммоль, 5,00 эквивалентов). о-Ванилин растворяют путем перемешивания при 40oС в течение 1 часа. рН затем доводят до 7,50 0,1 н раствором гидроксида натрия. Образец загружают в мини-установку для распылительной сушки Buchi model 190 со скоростью 2,0 мл в минуту. Аспиратор устанавливают на -2500 Па (-25 мбар), входная температура образца составляет 110oС и выходная температура образца составляет 75oС. Продукт собирают в циклоне и анализируют с использованием обращенно-фазовой ВЭЖХ и масс-спектрометрии с электрораспылением. Вышеописанные получения представляют аддуктные конечные продукты конденсации, являющиеся основаниями Шиффа, находящиеся в объеме настоящего изобретения, поскольку их все получают с использованием о-ванилина, представляющего собой ароматический о-гидроксиальдегид. Похожие условия используют с другими альдегидами. Таблица 2-А суммирует получение каждого тестируемого образца. Таблица 2-Б представляет анализ каждого из тестируемых образцов, содержащий указание прогнозируемого числа эквивалентов альдегида по отношению к белку для полного образования аддукта, являющегося основанием Шиффа. Процентный выход для каждого образца определяют на основе вышеописанного. Процентный выход по массе для способа распылительной сушки всегда является количественным в пределах экспериментальной ошибки для всех альдегидов и белковых исходных веществ, поскольку единственная потеря вещества возникает за счет сублимируемого альдегида, и это происходит лишь в случае, когда используют альдегиды, не являющиеся о-гидроксиальдегидами, и даже в этом случае потеря является слишком маленькой для измерения. Процентный выход основания Шиффа эквивалентен массе конечного продукта, которая составляет всегда 100% от теоретической по только что объясненным причинам, х выход превращения. Выход превращения, в свою очередь, получают путем нахождения действительного среднего числа эквивалентов альдегида, определяемого с использованием масс-спектрофотометрии с электрораспылением, и его деления на число эквивалентов, прогнозируемое, исходя из теории, и умножения результата на 100 для того, чтобы выразить выход превращения в виде процента. Получаемые таким образом величины представляют собой дополнительное указание эффективности превращения в основание Шиффа, получаемое с использованием способа по настоящему изобретению. Массовые выходы для вышеописанного способа распылительной сушки являются относительно низкими, что является прямым результатом уменьшенного масштаба, в котором осуществляется указанный способ. Значительные количества конечного продукта окончательно прилипают к установке для сушки вместо того, чтобы извлекаться из нее. Соответственно выход вышеописанного превращения в продукт представляет собой более точную основу для того, чтобы демонстрировать сравнительное превосходство способа по настоящему изобретению. Наконец, рН каждого образца определяют перед проведением процедуры тестирования, включаемой для демонстрации важности поддержания рН на уровне 7,0 или выше для получения высоких выходов. В табл. 2-А и 2-Б данных величины выходов (%-ты) являются точными в пределах 5-10% приведенного числа. Следует отметить, что для всех получений, в которых используют ароматический о-гидроксиальдегид и рН составляет  7,0, выход составляет 7,0, выход составляет  90%. Единственные исключения из этого наблюдения указаны в относящейся к делу приведенной таблице. Напротив, когда используют ароматические альдегиды, не являющиеся о-гидроксиальдегидами, выходы составляют 90%. Единственные исключения из этого наблюдения указаны в относящейся к делу приведенной таблице. Напротив, когда используют ароматические альдегиды, не являющиеся о-гидроксиальдегидами, выходы составляют  70%, даже несмотря на то, что рН составляет 70%, даже несмотря на то, что рН составляет  7,0 как с образцами о-гидроксиальдегидов. Единственное исключение из этого наблюдения указаны в в относящейся к делу приведенной таблице.
Критическая важность поддержания рН на уровне 7,0 как с образцами о-гидроксиальдегидов. Единственное исключение из этого наблюдения указаны в в относящейся к делу приведенной таблице.
Критическая важность поддержания рН на уровне  7,0 для получения высоких выходов иллюстрируется приведенными выше величинами в таблице 1-Б для образцов с 1ш по 1гг. Все эти образцы используют ароматический о-гидроксиальдегид, так что следовало бы ожидать выходов 7,0 для получения высоких выходов иллюстрируется приведенными выше величинами в таблице 1-Б для образцов с 1ш по 1гг. Все эти образцы используют ароматический о-гидроксиальдегид, так что следовало бы ожидать выходов  90%, принимая, что рН поддерживается на уровне 90%, принимая, что рН поддерживается на уровне  7,0. Тем не менее, рН устанавливались на различных значениях в диапазоне, начиная с низкого значения, составляющего 3,31, и постепенно увеличиваясь до высокого значения, составляющего 8,52. Выходные % демонстрируют соответствующее продвижение, начиная с низкого значения, составляющего 33%, и регулярно увеличиваясь до высокого значения, составляющего 93%.
Данные по биологической активности 7,0. Тем не менее, рН устанавливались на различных значениях в диапазоне, начиная с низкого значения, составляющего 3,31, и постепенно увеличиваясь до высокого значения, составляющего 8,52. Выходные % демонстрируют соответствующее продвижение, начиная с низкого значения, составляющего 33%, и регулярно увеличиваясь до высокого значения, составляющего 93%.
Данные по биологической активностиДепартамент исследования здоровья животных Пфайзер Инк., Индиана (Animal Health research department, Pfizer Inc., Terre Houte, Indiana) использованы следующие сокращения: ов = орто-ванилин BUN = blood urea nitrogen (азот мочевины крови) SCB = Southern Cross Biothech BP = bioprocess T2 = опыт 2 GH = Growth Hormone CTC – соматотропин свиньи Так как лиофилизация является более пригодным методом для высушивания больших количеств CTC, чем десикация, необходим метод получения лиофилизированного CTC со степенью гидратации, соответствующей таковой у CTC, подвергнутого десикации. Тщательное отлаживание первичной, вторичной или обеих стадий высушивания может быть необходимо для достижения желаемой степени гидратации. Кроме того, эксципиенты могут способствовать удерживанию крайне необходимой воды в лиофилизированном CTC, обеспечивая таким образом средство для регулирования конечной степени гидратации лиофилизированного CTC. Не была установлена необходимость этанольной промывки, которая обычно используется для удаления дополнительной воды в конце процесса высушивания. Следовательно, задачами данного эксперимента были: – подтвердить, что профили высвобождения CTC (SCB или ВР), высушенного “тщательной” лиофилизацией или десикацией, похожи (Т3 по сравнению с Т4, Т5 по сравнению с Т7), – определить, влияет ли диализ на профиль высвобождения подвергнутого десикации ВР орто-ванилин CTC (Т5 по сравнению с Т6), – определить влияние лиофилизации на разных стадиях высушивания на профиль высвобождения (Т7, Т8, Т10), – определить, влияет ли этанольная промывка на профиль высвобождения ВР орто-ванилин СТС (Т8 по сравнению с Т9), – определить, улучшают ли эксципиенты профиль высвобождения “тщательно” лиофилизированного ВР мет-СТС (Т7 по сравнению с Т11 и Т12), – определить, будет ли вариант 7 мет-СТС супрессировать концентрации BUN in vivo. Опыты: все гранулы содержали 70 мг СТС, SCB=Southern Cross Biothech, BP=bioprocess T2 3,5% ов Amgen ала-СТС, частично лиофилизация, десикация, лот 36369-37-1 Т3 5% ов SCB мет-СТС, диализованный, десикация, лот 34493-285-1 Т4 5% ов SCB мет-СТС, диализованный, лиофилизация первичная+, лот 34493-273-1 Т5 5% ов ВР мет-СТС, диализованный, десикация, лот 34483-276-2 Т6 5% ов ВР мет-СТС, недиализованный, десикация, лот 34493-278-1 Т7 3,5% ов ВР мет-СТС, диализованный, лиофилизация первичная+, лот 34493-287-1 Т8 3,5% ов ВР мет-СТС, диализованный, лиофилизация вторичная+, лот 34493-282-1 Т9 3,5% ов ВР мет-СТС, диализованный, лиофилизация вторичная+, промывка этанолом, лот 34493-283-1 Т10 3,5% ов ВР мет-СТС, диализованный, частично лиофилизация, десикация, лот 36369-40-1 Т11 10% ов ВР мет-СТС, диализованный, лиофилизация первичная+, 1,0% Tween 20, лот 34493-291-1 Т12 3,5% ов ВР мет-СТС, диализованный, лиофилизация первичная+, 5,0% сахароза, лот 34493-289-1 Т13 только буфер, два последовательных дня Т14 мет-СТС вариант 7, 100 мкг/кг веса тела, лот SL35770-95 Методика: Шестьдесят пять свиней были доставлены на место за 18 дней до начала эксперимента для акклиматизации. Двенадцать свиней предназначались для опыта 1, для остальных опытов по четыре свиньи. Свиньи, предназначенные для опытов Т2-Т12, в день 0 получали одну гранулу подкожно в правую часть шеи с помощью электронного устройства для имплантации. Свиньи, предназначенные для опыта Т1, в день 0 получали фиктивную инъекцию, содержащую только K-Y смазывающий гель. Свиньи, предназначенные для опытов Т13 и Т14, получали инъекции в разгибающую мышцу шеи в течение двух последовательных дней. Образцы крови собирали с использованием 10 мл гепаринизированных туб для забора у всех животных в дни эксперимента -1, 0, 1, 2, 3, 4, 5, 6, 8, 10, 12 и 14. Плазму отделяли центрифугированием, разделяли на две части и замораживали. Определяли концентрацию BUN (Chemistry Analyzer, TH lab) и СТС (Groton) в образцах плазмы. Все животные были умерщвлены (по соображениям гуманности) на 14 день эксперимента, и была сделана попытка вернуть все имплантаты. Грубые наблюдения местонахождения имплантатов и мест инъекции были записаны. Вес тела регистрировался в дни -18, -13, -5, 0 и 14. Имплантаты: Было обнаружено, что все возвращенные имплантаты инкапсулированы. Имплантаты были иссечены из оставшейся ткани, а излишек крови и жидкости удален. Результаты обследования имплантатов были записаны, и имплантаты поместили в десикатор на два дня для высушивания. После высушивания имплантаты взвесили, чтобы определить оставшееся количество имплантата. Сухие имплантаты были затем измельчены с использованием ступки и пестика. Аликвоты образцов были растворены в воде и анализировались на ЖХВД для определения содержания мономеров в образце. СТС: Плазменные уровни СТС вычислялись с использованием радио- иммуноанализа (РИА) на гормон роста (GH, Growth Hormone). GH анализ провели только на опытных группах 1 (контроль), 2, 5 и 10 на основании результатов BUN анализа. Опытная группа 2 показала повышение уровня СТС на 10-й день для двух из четырех животных. У двух оставшихся животных имело место схожее повышение уровня, которое вернулось к базальному уровню на 3-4-й день. В опытной группе 5 животные дали неустойчивый ответ. Животное 307 не показало повышения уровня СТС, однако были потеряны данные в некоторых точках. Животное 308 также не дало какого-либо отклика. У двух оставшихся животных 267 и 321 повышенные уровни СТС наблюдались до 5-го дня. Опытная группа 10 продемонстрировала более согласующиеся ответы. Все четыре животных показывали повышенные уровни СТС до 8-го дня. GH уровни в большинстве животных показывают первичное высвобождение СТС на 1-й день и вторичное высвобождение на 3-5-й дни. Результаты и обсуждение: Концентрация BUN была подавлена на величину вплоть до 55% (день 2) и была в среднем на 35% ниже, чем концентрация до начала опытов в течение 8-го дня при подвергнутом десикации 3,5% ов Amgen ала-СТС (Т2) (фиг.1, таблица 3). Концентрации СТС в плазме составили в среднем 22 нг/мл в 1-й день и были между примерно 8 и 3 нг/мл между 2-м и 8-м днями (фиг.7, таблица 5 и 6). Не был возвращен ни один из имплантатов в Т2, поэтому масса и количество оставшихся мономеров не могли быть вычислены. Подавление BUN имело тенденцию быть численно больше для SCB мет-СТС, подвергнутого десикации (Т3), чем для лиофилизированного SCB мет-СТС (Т4) (фиг. 2, таблица 3), однако та же тенденция не была отмечена для подвергнутого десикации (Т5) и лиофилизированного (Т7) ВР мет-СТС (фиг.2, таблица 3). Концентрации BUN для всех четырех из этих опытов были самыми низкими на 3-й день и постепенно возрастали после этого (фиг.2). Массы возращенных имплантатов, содержащих СТС, подвергнутый десикации, были ниже, чем массы соответствующих имплантатов, содержавших лиофилизированный СТС (таблица 4). Подвергнутый диализу ВР мет-СТС (Т5) давал немного более сильное подавление BUN, чем недиализованный ВР мет-СТС (Т6) (фиг.3, таблица 3). Количество оставшегося имплантата было существенно ниже для СТС, подвергнутого диализу, чем для недиализованного СТС (таблица 4: 4% по сравнению с 81% соответственно). Диализ, за которым следовала частичная лиофилизация и десикация, приводил к наибольшему подавлению BUN для ВР мет-СТС (фиг.4, таблица 3). Самые высокие концентрации СТС в плазме для Т10 наблюдались на 1-й день с последующей концентрацией между 2 и 4 нг/мл (таблица 5 и 6, фиг.7-10). Ни этанольная промывка (фиг.5, таблица 3), ни добавление сахарозы или Tween не улучшало подавление BUN у ВР мет-СТС in vivo (фиг.6, таблица 3). Концентрации BUN не подавлялись для мет-варианта 7, использованного в этом эксперименте (таблица 3). Эти результаты подтверждают, что процесс высушивания влияет на биологическую активность ВР мет-СТС in vivo. Формула изобретения
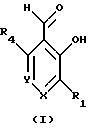 где R1 и R4 независимо выбраны из группы, состоящей по существу из водорода, гидрокси, галогено, нитро, циано, трифторметила, (С1-С6)алкила, (С1-С6)алкокси, (С3-С6)циклоалкила, (С2-С6)алкенила, -С(=O)OR7, -OC(=O)R7, -S(= O)2-S(= O)2N(R7)(R9), -S(= O)2R7, -S(=O)2OR7, -C(=O)NR7R9, -C(=O)R9 и -N(R7)(R9), где R7 представляет собой водород или (С1-С4)алкил, а R9 представляет собой (С1-С4)алкил, где указанные алкильные, циклоалкильные и алкенильные группы, определяющие R1 и R4, возможно могут быть независимо замещены одним или двумя заместителями, выбранными из группы, состоящей по существу из галогено, гидрокси, (С1-С2)алкила, (С1-С2)алкокси, (С1-С2)алкокси-(С1-С2)алкила, (С1-С2)алкоксикарбонила, карбоксила, (С1-С2)алкилкарбонилокси, нитро, циано, амино, двузамещенного (С1-С2)алкилом, сульфонила и сульфонамидо, двузамещенного (С1-С2)алкилом; Х и Y независимо представляют собой N, или СНR2, или СHR3 соответственно, где R2 и R3 независимо выбраны из группы, состоящей по существу из водорода, гидрокси, галогено, нитро, циано, трифторметила, (С1-С6)алкила, (С1-С6)алкокси, (С3-С6)циклоалкила, (С2-С6)алкенила, -С(=O)OR11, -OC(=O)R11, -S(=O)2, -S(=O)2N(R11)(R13) и -N(R11)(R13), где R11 представляет собой водород или (С1-С4)алкил, а R13 представляет собой (С1-С4)алкил, и где указанные алкильные, циклоалкильные и алкенильные группы, определяющие R2 и R3, возможно могут быть независимо замещены одним или двумя заместителями, выбранными из группы, состоящей по существу из галогено, гидрокси, (С1-С2)алкила, (С1-С2)алкокси, (С1-С2)алкокси-(С1-С2)алкила, (С1-С2)алкоксикарбонила, карбоксила, (С1-C2)алкилкарбонилокси, нитро, циано, амино, двузамещенного (С1-С2)алкилом, сульфонила и сульфонамидо, двузамещенного (С1-С2)алкилом. 3. Способ по п.2, где указанный ароматический o-гидроксиальдегид включает в себя о-ванилин, салициловый альдегид, 2,3-дигидроксибензальдегид, 2,6-дигидроксибензальдегид, 2-гидрокси-3-этоксибензальдегид или пиридоксаль. 4. Способ по п.1, где указанный белок, обладающий полезной активностью у животных, включает в себя один или более чем один представитель, выбранный из группы, состоящей из: белковых эндогенных и синтетических опиоидных аналгетиков и антагонистов, включающих в себя энкефалины, эндорфины и динорфины, которые представляют собой селективные и неселективные агонисты и антагонисты субтипов опиоидных рецепторов  , k и , k и  , включая [Leu5] и [Met5]энкефалин, динорфин А и В, , включая [Leu5] и [Met5]энкефалин, динорфин А и В,  – и – и  -неоэндорфин, [D-Ala2, MePhe4, -Gly(ol)5]энкефалин (DAMGO), [D-Pen2, D-Pen5] энкефалин (DPDPE), [D-Ser2, Leu5]энкефалин-Thr6 (DSLET), [D-Ala2, D-Leu5] энкефалин (DADL), D-Phe-Cys-Tyr-D-Trp-Orn-Thr-Pen-Thr-NH2 (СТОР), [D-Ala2, N-MePhe4, Met(O)5-ol]энкефалин (FK-33824), Tyr-D-Ala-Phe-Asp-Val-Val-Gly-NH2 ([D-Ala2]дельторфин I, Tyr-D-Ala-Phe-Glu-Val-Val-Gly-NH2 ([D-Ala2, Glu4]дельторфин II, Tyr-Pro-Phe-Pro-NH2 (морфицептин), Tyr-Pro-MePhe-D-Pro-NH2 (PL-017) и [D-Ala2, Leu5, Cys6]энкефалин; -неоэндорфин, [D-Ala2, MePhe4, -Gly(ol)5]энкефалин (DAMGO), [D-Pen2, D-Pen5] энкефалин (DPDPE), [D-Ser2, Leu5]энкефалин-Thr6 (DSLET), [D-Ala2, D-Leu5] энкефалин (DADL), D-Phe-Cys-Tyr-D-Trp-Orn-Thr-Pen-Thr-NH2 (СТОР), [D-Ala2, N-MePhe4, Met(O)5-ol]энкефалин (FK-33824), Tyr-D-Ala-Phe-Asp-Val-Val-Gly-NH2 ([D-Ala2]дельторфин I, Tyr-D-Ala-Phe-Glu-Val-Val-Gly-NH2 ([D-Ala2, Glu4]дельторфин II, Tyr-Pro-Phe-Pro-NH2 (морфицептин), Tyr-Pro-MePhe-D-Pro-NH2 (PL-017) и [D-Ala2, Leu5, Cys6]энкефалин;аутокоидов, включающих в себя брадикинин и каллидин, продуцируемых с помощью протеолитических реакций в ответ на воспалительные события, выбранные из повреждения тканей, вирусных инфекций и аллергических реакций, где указанные белки действуют местно, вызывая боль, вазодилатацию, увеличение сосудистой проницаемости и синтез простагландинов, где указанные белки обладают агонистической и антагонистической активностью и полезны для лечения мужского бесплодия, для доставки противораковых химиотерапевтических агентов через гематоэнцефалический барьер и для лечения боли, астмы и других хронических воспалительных заболеваний, включая: Arg-Pro-Pro-Gly-Phe-Ser-Pro-Phe-Arg (брадикинин), Lys-Arg-Prp-Pro-Gly-Phe-Ser-Pro-Phe-Arg (каллидин), Arg-Pro-Pro-Gly-Phe-Ser-Pro-Phe (дез-Arg9-брадикинин), Lys-Arg-Pro-Pro-Gly-Phe-Ser-Pro-Phe (дез-Arg10-каллидин), Arg-Pro-Pro-Gly-Phe-Ser-Pro-Leu (дез-Arg9-[Leu8] -брадикинин), Arg-Pro-Pro-Gly-Phe-Ser-[D-Phe]-Phe-Arg ([D-Phe7] -брадикинин) и [D-Arg]-Arg-Pro-Hyp-Gly-Thi-Ser-Tic-Oic-Arg (HOE 140), где Hyp представляет собой транс-4-гидрокси-Pro, Thi представляет собой  -(2-тиенил)-А1а. Tic представляет собой [D]-1,2,3,4-тетрагидрохинолин-3-ил-карбонил, а Oic представляет собой (3as, 7as)-октагидроиндол-2-ил-карбонил; -(2-тиенил)-А1а. Tic представляет собой [D]-1,2,3,4-тетрагидрохинолин-3-ил-карбонил, а Oic представляет собой (3as, 7as)-октагидроиндол-2-ил-карбонил;белков, активных в отношении подтипов рецепторов вазопрессина V1 и V2, которые опосредуют сосудосуживающие реакции и антидиуретические реакции, соответственно, включая антагонисты V1, полезные при лечении застойной сердечной недостаточности, гипертензии и послеоперационной непроходимости кишечника и вздутия живота, агонисты V2, используемые для лечения несахарного диабета путем контролирования полиурии и полидипсии и для лечения расстройств, связанных с кровотечением, включающих в себя болезнь фон Виллебранда, включающие в себя специфичные встречающиеся в природе пептиды, подобные вазопрессину: аргининвазопрессин (AVP) следующей формулы: 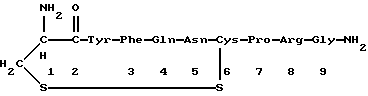 и липрессин [Lys8]-AVP; синтетические вазопрессиновые пептиды: V1a-селективный агонист [Phe2, IIe2, Orn8]AVP; V1b-селективный агонист дезамино[D-3-(3′-пиридил)-Ala2] AVP; V2-селективные агонисты десмопрессин (dDAVP) и дезамино [Val4, D-Arg3]AVP; и пептидные антагонисты, включающие в себя V1a-селективный антагонист d(CH2)5[Tyr(Me)2]AVP формулы 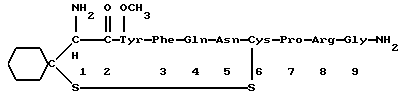 V1b-селективный антагонист dp[Tyr(Me)2]AVP; и V2-селективные антагонисты дезGly-NH2 9-d(CH2)5[D-Ile2, Ile4] AVP и d(CH2)5[D-Ile2, Ile4, Ala-NH2 9] AVP; пентагастрина, который применяют в качестве индикатора желудочной секреции, формулы: N-трет-бутилоксикарбонил-  -Ala-Trp-Met-Asp-Phe-NH2; -Ala-Trp-Met-Asp-Phe-NH2;октреотида, полезного при лечении симптомов опухолей желудочно-кишечного тракта, диареи, устойчивой к другому лечению, расстройств перистальтики и желудочно-кишечного кровотечения, формулы: L-цистеинамид-D-Phe-L-Cys-L-Phe-D-Trp-L-Lys-L-Thr-N-[2-гидрокси-1-(гидроксиметил)пропил] -циклический (2_  7)-дисульфид, [R-(R*, R*)]-; 7)-дисульфид, [R-(R*, R*)]-;реагентов антител, полезных в качестве иммуносупрессорных агентов, включающих в себя антитимоцитарный глобулин; моноклональное антитело муромонаб-CD3 и иммуноглобулин Rho(D), и белковые иммуностимуляторы, полезные при лечении состояний иммунодефицита, включающие в себя иммуноглобулин; цитокинов, продуцируемых лейкоцитами и обладающих множеством иммунорегуляторных эффектов, включающих в себя: интерфероны, колониестимулирующие факторы и интерлейкины, и в частности  -интерферон; интерферон- -интерферон; интерферон- (ИФН- (ИФН- ); гранулоцитарный колониестимулирующий фактор (ГКСФ); гранулоцитарный колониестимулирующий фактор макрофагов (ГКСФМ) и интерлейкины с интерлейкина-1 (ИЛ-1) по интерлейкин-12 (ИЛ-12); ); гранулоцитарный колониестимулирующий фактор (ГКСФ); гранулоцитарный колониестимулирующий фактор макрофагов (ГКСФМ) и интерлейкины с интерлейкина-1 (ИЛ-1) по интерлейкин-12 (ИЛ-12);гемопоэтических факторов роста, вовлеченных в регуляцию процесса, посредством которого зрелые кровяные клетки постоянно заменяются, полезных при лечении первичных заболеваний крови и которые применяют в качестве дополнительных агентов при лечении тяжелых инфекций и при помощи пациентам, которые подвергаются химиотерапии или трансплантации костного мозга, включающих в себя в частности: факторы роста, включая эритропоэтин (ЭПО); фактор стволовых клеток (ФСК); интерлейкины (ИЛ 1-12) колониестимулирующий фактор моноцитов/макрофагов (КСФМ, КСФ-1); Р1XY321 (слитой белок GM-CSF/IL-3) и тромбопоэтин; тромболитических белков, полезных для рассасывания как патологических тромбов, так и отложений фибрина в местах повреждения сосудов, включающих в себя стрептокиназу; тканевый активатор плазминогена (ТАП) и урокиназу; гормонов передней доли гипофиза и гипоталамических факторов, которые регулируют их применение, включающих в себя: (а) соматотропные гормоны, включая гормон роста (ГР), пролактин (Прл) и плацентарный лактоген (ПЛ); (б) гликопротеиновые гормоны, включая лютеинизирующий гормон (ЛГ), фолликулостимулирующий гормон (ФСГ) и тиреотропный гормон (ТТГ); и (b) гормоны – производные проопиомеланокортина (ПОМК), включая кортикотропин (АКТГ),  -меланоцитстимулирующий гормон ( -меланоцитстимулирующий гормон ( -МСГ), -МСГ),  -меланоцитстимулирующий гормон ( -меланоцитстимулирующий гормон ( -МСГ), -МСГ),  -липотропин ( -липотропин ( -ЛПГ) и -ЛПГ) и  -липотропин ( -липотропин ( -ЛПГ); гипоталамические факторы, регулирующие высвобождение указанных гормонов, включая рилизинг-фактор гормона роста (РФГР), рилизинг-фактор лютеинизирующего гормона (РФЛГ), инсулиноподобный фактор роста (ИФР-1 и ИФР-2), соматостатин и гонадотропин-рилизинг-гормон (ГнРГ); -ЛПГ); гипоталамические факторы, регулирующие высвобождение указанных гормонов, включая рилизинг-фактор гормона роста (РФГР), рилизинг-фактор лютеинизирующего гормона (РФЛГ), инсулиноподобный фактор роста (ИФР-1 и ИФР-2), соматостатин и гонадотропин-рилизинг-гормон (ГнРГ);гормона роста, полезного в качестве заместительной терапии у детей с недостатком гормона роста, включая: соматостатин, синтетический аналог соматостатина, октреотид; гонадотропные гормоны, включающие в себя ЛГ, ФСГ и хорионический гонадотропин (ХГ), полезные при диагностировании репродуктивных расстройств и при лечении бесплодия, включающие в себя: урофоллитропин, человеческий гонадотропин, обнаруживаемый в период менопаузы (ЧГПМ), из которого по существу большая часть ЛГ удалена, полезный для индуцирования овуляции, и гонадорелин, синтетический человеческий ГнРГ, полезный для стимуляции секреции гонадотропина; синтетические агонисты ГнРГ, включающие в себя: лейпролид, гистрелин, нафарелин и гозерелин, полезные при лечении эндокринных расстройств, которые ответственны за уменьшение уровней стероидов гонад; тиреотропина (ТТГ), секреция которого контролируется тиреотропин-рилизинг фактором (ТРФ), полезного для мормональной заместительной терапии у пациентов, страдающих от гипотиреоза, и для терапии, подавляющей ТТГ, у пациентов, страдающих от нетоксического зоба или после лечения рака щитовидной железы; инсулина для лечения пациентов, страдающих инсулинозависимым сахарным диабетом и пациентов, страдающих инсулинонезависимым сахарным диабетом; глюкагона, который играет физиологическую роль при регуляции метаболизма глюкозы и кетоновых тел, полезного при лечении тяжелой гипогликемии и для рентгенологов для подавления желудочно-кишечного тракта; соматостатина, полезного для блокирования высвобождения гормонов эндокринсекретирующими опухолями, включающими в себя инсулиномы, глюкагономы, ВИПомы, карциноидные опухоли и соматотропиномы, и синтетического аналога октреотида; кальцитонина, гормона, действующего, в частности, на остеокласты для подавления резорбции костей, полезного при контролировании гиперкальцимии и при расстройствах, выражающихся в увеличенном скелетном ремоделировании, включающих в себя болезнь Пэджета; паратиреоидного гормона, полезного при лечении пациентов, страдающих остеопорозом позвоночника; альдеслейкина, 125-L-серин-2-133-интерлейкина 2, полезного в качестве противоопухолевого агента и в качестве иммуностимулятора; альглюцеразы, мономерного гликопротеина, состоящего из 497 аминокислот и модифицированной формы  -глюкоцереброзидазы плацентарной ткани человека, полезной в качестве дополнения для фермента глюкоцереброзидазы; альсактида, синтетического аналога кортикотропина: 1- -глюкоцереброзидазы плацентарной ткани человека, полезной в качестве дополнения для фермента глюкоцереброзидазы; альсактида, синтетического аналога кортикотропина: 1- -Ala-17[L-2,6-диамино-N-(4-аминобутил)гексанамид)- -Ala-17[L-2,6-диамино-N-(4-аминобутил)гексанамид)- 1-17-кортикотропина; альтеплазы, сериновой протеазы, состоящей из 527 аминокислот, последовательность которой идентична встречающейся в природе протеазе, продуцируемой эндотелиальными клетками в стенках сосудов, полезной в качестве активатора плазминогена; alvircept sudotox, синтетического химерного белка, сконструированного для связывания первых 178 аминокислот внеклеточного домена CD4 посредством двух линкерных остатков с аминокислотами 1-3 и 253-613 экзотоксина А Pseudomonas, полезного в качестве противовирусного агента; амлинтида, белка, состоящего из 37 аминокислот, полезного в качестве антидиабетического агента; амогастрина: N-карбокси-L-Trp-L-Met-L- 1-17-кортикотропина; альтеплазы, сериновой протеазы, состоящей из 527 аминокислот, последовательность которой идентична встречающейся в природе протеазе, продуцируемой эндотелиальными клетками в стенках сосудов, полезной в качестве активатора плазминогена; alvircept sudotox, синтетического химерного белка, сконструированного для связывания первых 178 аминокислот внеклеточного домена CD4 посредством двух линкерных остатков с аминокислотами 1-3 и 253-613 экзотоксина А Pseudomonas, полезного в качестве противовирусного агента; амлинтида, белка, состоящего из 37 аминокислот, полезного в качестве антидиабетического агента; амогастрина: N-карбокси-L-Trp-L-Met-L- -Asp-3-фенил-L-аланинамид; анакинры: антагониста рецептора N2-L-Met-интерлейкина 1, полезного в качестве нестероидного противовоспалительного агента и в качестве супрессанта для лечения воспалительного заболевания толстой кишки; анаратида ацетата, атриопептина-21 (крысы), N-L-Arg-8-L-Met-21a-L-Phe-21b-L-Arg-21c-L-Tyr, ацетата, полезного в качестве антигипертензивного агента и в качестве диуретического агента; ангиотензина амида, ангиотензина II, 1-L-Asn-5-L-Val-, полезного в качестве вазоконстриктора; апротинина, панкреатического трипсинового ингибитора, имеющего 58 аминокислот, полезного в качестве ферментного ингибитора (протеиназы); арфалазина, 1-сукцинамовая кислота-5-L-Val-8-(L-2-фенилглицин)ангиотензин II, полезного в качестве антигипертензивного агента; аргипрессина танната, вазопрессин, 8-L-Arg, танната, полезного в качестве антидиуретического агента; аспартоцина, окситоцин, 4-L-Asn-, полезного в качестве антибиотического агента, продуцируемого Streptomyces griseus; атозибана, окситоцин, 1-(3-меркаптопропановая кислота)-2-(О-этил-D-Tyr)-4-L-Thr-8-L-Orn-, полезного в качестве антагониста окситоцина; авопарцина, гликопептидного антибиотика, полученного из Streptomyces candidus; базифунгина, N-[(2R, 3R)-2-гидрокси-3-MeVal] -N-L-MeVal-L-Phe-N-L-MePhe-L-Pro-L-алло-Ile-N-L-MeVal-L-Leu-3-гидрокси-N-L-MeVal -Asp-3-фенил-L-аланинамид; анакинры: антагониста рецептора N2-L-Met-интерлейкина 1, полезного в качестве нестероидного противовоспалительного агента и в качестве супрессанта для лечения воспалительного заболевания толстой кишки; анаратида ацетата, атриопептина-21 (крысы), N-L-Arg-8-L-Met-21a-L-Phe-21b-L-Arg-21c-L-Tyr, ацетата, полезного в качестве антигипертензивного агента и в качестве диуретического агента; ангиотензина амида, ангиотензина II, 1-L-Asn-5-L-Val-, полезного в качестве вазоконстриктора; апротинина, панкреатического трипсинового ингибитора, имеющего 58 аминокислот, полезного в качестве ферментного ингибитора (протеиназы); арфалазина, 1-сукцинамовая кислота-5-L-Val-8-(L-2-фенилглицин)ангиотензин II, полезного в качестве антигипертензивного агента; аргипрессина танната, вазопрессин, 8-L-Arg, танната, полезного в качестве антидиуретического агента; аспартоцина, окситоцин, 4-L-Asn-, полезного в качестве антибиотического агента, продуцируемого Streptomyces griseus; атозибана, окситоцин, 1-(3-меркаптопропановая кислота)-2-(О-этил-D-Tyr)-4-L-Thr-8-L-Orn-, полезного в качестве антагониста окситоцина; авопарцина, гликопептидного антибиотика, полученного из Streptomyces candidus; базифунгина, N-[(2R, 3R)-2-гидрокси-3-MeVal] -N-L-MeVal-L-Phe-N-L-MePhe-L-Pro-L-алло-Ile-N-L-MeVal-L-Leu-3-гидрокси-N-L-MeVal  1-лактона, полезного в качестве противогрибкового агента; бекаплермина, рекомбинантного человеческого тромбоцитарного фактора роста В, рекомбинантного белка, продуцируемого созданными путем генетической инженерии Saccharomyces Cerevisiae, сходного по аминокислотному составу и биологической активности с эндогенным гомодимером ТФР-ВВ человека, полезного при лечении хронических кожных язв в силу того, что активизирует пролиферацию клеток мезенхимального происхождения; бивалирудина, антикоагулянта, антитромботического агента, имеющего 20 аминокислот; карбетоцина, 1-масляная кислота-2-[3-(n-метоксифенил)-L-Ala] окситоцина; каргутоцина, 1-масляная кислота-6-(L-2-аминомасляная кислота)-7-глицинокситоцина; церулетида, 5-О-L-Pro-L-Gln-L- 1-лактона, полезного в качестве противогрибкового агента; бекаплермина, рекомбинантного человеческого тромбоцитарного фактора роста В, рекомбинантного белка, продуцируемого созданными путем генетической инженерии Saccharomyces Cerevisiae, сходного по аминокислотному составу и биологической активности с эндогенным гомодимером ТФР-ВВ человека, полезного при лечении хронических кожных язв в силу того, что активизирует пролиферацию клеток мезенхимального происхождения; бивалирудина, антикоагулянта, антитромботического агента, имеющего 20 аминокислот; карбетоцина, 1-масляная кислота-2-[3-(n-метоксифенил)-L-Ala] окситоцина; каргутоцина, 1-масляная кислота-6-(L-2-аминомасляная кислота)-7-глицинокситоцина; церулетида, 5-О-L-Pro-L-Gln-L- -Asp-L-O-сульфо-L-Tyr-L-Thr-L-Gly-L-Trp-L-Met-L- -Asp-L-O-сульфо-L-Tyr-L-Thr-L-Gly-L-Trp-L-Met-L- -Asp-L-Phe-амида, полезного в качестве стимулятора желудочной секреции; цетермина, трансформирующего фактора роста -Asp-L-Phe-амида, полезного в качестве стимулятора желудочной секреции; цетермина, трансформирующего фактора роста  2 человека, имеющего 112 аминокислот; цилмостима, 1-233-колониестимулирующего фактора 1 (остаток белка клона человека р3ACSF-69), циклического (7 2 человека, имеющего 112 аминокислот; цилмостима, 1-233-колониестимулирующего фактора 1 (остаток белка клона человека р3ACSF-69), циклического (7 90), (48 90), (48 139), (102 139), (102 146)-трис(дисульфид)димера, полезного в качестве гемопоэтического агента (колониестимулирующий фактор макрофагов); натрия колистиметата, компонента колистина А, полезного в качестве антибактериального агента; кортикорелина, трифлютата овцы, кортикотропин-рилизинг-фактора (овцы), соли трифторацетата, полезного в качестве диагностического средства при адренокортикальной недостаточности и синдроме Кушинга, и в качестве кортикотропин-рилизинг-гормона; козинтропина, тетракозактид ацетата, 146)-трис(дисульфид)димера, полезного в качестве гемопоэтического агента (колониестимулирующий фактор макрофагов); натрия колистиметата, компонента колистина А, полезного в качестве антибактериального агента; кортикорелина, трифлютата овцы, кортикотропин-рилизинг-фактора (овцы), соли трифторацетата, полезного в качестве диагностического средства при адренокортикальной недостаточности и синдроме Кушинга, и в качестве кортикотропин-рилизинг-гормона; козинтропина, тетракозактид ацетата,  1-24-кортикотропина, полезного в качестве адренокортикотропного гормона; циклоспорина, циклического белка, содержащего 11 аминокислот и группировку 3-гидрокси-4-метил-2-(метиламино)-6-октеноил в положении 6, полезного в качестве иммуносупрессанта; дакликсимаба (Ro-24-7375), гуманизированного моноклонального антитела против ТАС, состоящего из четырех субъединиц, связанных посредством дисульфидных мостиков, и с молекулярной массой приблизительно 150 кДа, полезного в качестве иммуносупрессанта; даклизумаба; даптомицина, белкового антибактериального агента; дезирудина, 63-десульфогирудина из Hirudo medicinalis, содержащего 63 аминокислоты, полезного в качестве антикоагулянта; дезлорелина, рилизинг-фактора лютеинизирующего гормона (свиньи), содержащего 9 аминокислот, полезного в качестве агониста РФЛГ; десмопрессина ацетата, вазопрессин, 1-(3-меркаптопропановая кислота)-8-D-Arg-, соли моноацетата тригидрата, содержащего 9 аминокислот, полезного в качестве антидиуретического агента; детиреликса ацетата, содержащего 10 аминокислот, полезного в качестве антагониста РФЛГ; думорелина, 27-L-Leu-44a-Gly рилизинг-фактора гормона роста (человека); элькатонина, 1-масляная кислота-7-(L-2-аминомасляная кислота)-26-L-Asp-27-L-Val-29-L-Ala кальцитонина (лосося); эмоктакина, интерлейкина 8 (человека), содержащего 72 аминокислоты с двумя Cys мостиками; эпоэтина альфа, гликопротеина из 165 аминокислот, который регулирует продукцию красных кровяных телец и продуцируется клетками яичника китайского хомячка, в которые встроен ген эритропоэтина человека, полезного в качестве антианемического агента и лекарственного средства, повышающего количество гемоглобина в крови; эрзофермина, рекомбинантного основного фактора роста фибробластов человека (ОФРФ), содержащего 157 аминокислот, негликозилированного белка, выделенного из плаценты человека и клонированного и экспессирующегося в Е. coli, полезного в качестве агента, способствующего заживлению ран; фелипрессина, представляющего собой вазопрессин, 2-L-Phe-8-L-Lys, содержащего 9 аминокислот, полезного в качестве вазоконстриктора; филграстима, одноцепочечного полипептида из 175 аминокислот, негликозилированного и экспрессируемого Е. coli, полезного в качестве агента для лечения нейтропении и в качестве стимулятора гемопоэза; глюкагона, одноцепочечного белка, состоящего из 29 аминокислот, полезного в качестве антидиабетического агента; гонадорелина ацетата, соли диацетата ацетата рилизинг-фактора лютеинизирующего гормона, содержащего 10 аминокислот, полезного в качестве фактора, стимулирующего гонады; гозерелина, рилизинг-фактора лютеинизирующего гормона (свиньи), содержащего 9 аминокислот, полезного в качестве агониста РФЛГ; гистрелина, рилизинг-фактора лютеинизирующего гормона (свиньи), содержащего 9 аминокислот, полезного в качестве агониста РФЛГ; имиглюцеразы, изоферментного белка 495-L-гистидинглюкозилцерамидазы плаценты, полезного в качестве ферментного дополнения для глюкоцереброзидазы; инсулина деаланированного, производного инсулина, получаемого путем удаления С-концевого аланина из В-цепи инсулина, полезного в качестве антидиабетического агента; интерферона альфа-2а, интерферона 1-24-кортикотропина, полезного в качестве адренокортикотропного гормона; циклоспорина, циклического белка, содержащего 11 аминокислот и группировку 3-гидрокси-4-метил-2-(метиламино)-6-октеноил в положении 6, полезного в качестве иммуносупрессанта; дакликсимаба (Ro-24-7375), гуманизированного моноклонального антитела против ТАС, состоящего из четырех субъединиц, связанных посредством дисульфидных мостиков, и с молекулярной массой приблизительно 150 кДа, полезного в качестве иммуносупрессанта; даклизумаба; даптомицина, белкового антибактериального агента; дезирудина, 63-десульфогирудина из Hirudo medicinalis, содержащего 63 аминокислоты, полезного в качестве антикоагулянта; дезлорелина, рилизинг-фактора лютеинизирующего гормона (свиньи), содержащего 9 аминокислот, полезного в качестве агониста РФЛГ; десмопрессина ацетата, вазопрессин, 1-(3-меркаптопропановая кислота)-8-D-Arg-, соли моноацетата тригидрата, содержащего 9 аминокислот, полезного в качестве антидиуретического агента; детиреликса ацетата, содержащего 10 аминокислот, полезного в качестве антагониста РФЛГ; думорелина, 27-L-Leu-44a-Gly рилизинг-фактора гормона роста (человека); элькатонина, 1-масляная кислота-7-(L-2-аминомасляная кислота)-26-L-Asp-27-L-Val-29-L-Ala кальцитонина (лосося); эмоктакина, интерлейкина 8 (человека), содержащего 72 аминокислоты с двумя Cys мостиками; эпоэтина альфа, гликопротеина из 165 аминокислот, который регулирует продукцию красных кровяных телец и продуцируется клетками яичника китайского хомячка, в которые встроен ген эритропоэтина человека, полезного в качестве антианемического агента и лекарственного средства, повышающего количество гемоглобина в крови; эрзофермина, рекомбинантного основного фактора роста фибробластов человека (ОФРФ), содержащего 157 аминокислот, негликозилированного белка, выделенного из плаценты человека и клонированного и экспессирующегося в Е. coli, полезного в качестве агента, способствующего заживлению ран; фелипрессина, представляющего собой вазопрессин, 2-L-Phe-8-L-Lys, содержащего 9 аминокислот, полезного в качестве вазоконстриктора; филграстима, одноцепочечного полипептида из 175 аминокислот, негликозилированного и экспрессируемого Е. coli, полезного в качестве агента для лечения нейтропении и в качестве стимулятора гемопоэза; глюкагона, одноцепочечного белка, состоящего из 29 аминокислот, полезного в качестве антидиабетического агента; гонадорелина ацетата, соли диацетата ацетата рилизинг-фактора лютеинизирующего гормона, содержащего 10 аминокислот, полезного в качестве фактора, стимулирующего гонады; гозерелина, рилизинг-фактора лютеинизирующего гормона (свиньи), содержащего 9 аминокислот, полезного в качестве агониста РФЛГ; гистрелина, рилизинг-фактора лютеинизирующего гормона (свиньи), содержащего 9 аминокислот, полезного в качестве агониста РФЛГ; имиглюцеразы, изоферментного белка 495-L-гистидинглюкозилцерамидазы плаценты, полезного в качестве ферментного дополнения для глюкоцереброзидазы; инсулина деаланированного, производного инсулина, получаемого путем удаления С-концевого аланина из В-цепи инсулина, полезного в качестве антидиабетического агента; интерферона альфа-2а, интерферона  А (редуцированный остаток лейкоцитарного белка человека), содержащего 165 аминокислот, полезного в качестве противоопухолевого агента и в качестве модификатора биологической реакции; интерферона альфа-2b, интерферона А (редуцированный остаток лейкоцитарного белка человека), содержащего 165 аминокислот, полезного в качестве противоопухолевого агента и в качестве модификатора биологической реакции; интерферона альфа-2b, интерферона  2b (редуцированный остаток белка клона лейкоцитов человека Hif-SN206), содержащего 165 аминокислот, также полезного в качестве противоопухолевого агента и в качестве модификатора биологической реакции; интерферона бета-1а, гликозилированного полипептида, состоящего из 166 аминокислотных остатков, получаемого из культивируемых клеток яичника китайского хомячка, содержащих сконструированный ген интерферона бета человека, также полезного в качестве противоопухолевого агента и в качестве модификатора биологической реакции; интерферона бета-1b, негликозилированного полипептида, состоящего из 165 аминокислотных остатков, получаемого из Е.coli, также полезного в качестве иммуномодулятора; интерферона гамма-1b, 1-139 интерферона 2b (редуцированный остаток белка клона лейкоцитов человека Hif-SN206), содержащего 165 аминокислот, также полезного в качестве противоопухолевого агента и в качестве модификатора биологической реакции; интерферона бета-1а, гликозилированного полипептида, состоящего из 166 аминокислотных остатков, получаемого из культивируемых клеток яичника китайского хомячка, содержащих сконструированный ген интерферона бета человека, также полезного в качестве противоопухолевого агента и в качестве модификатора биологической реакции; интерферона бета-1b, негликозилированного полипептида, состоящего из 165 аминокислотных остатков, получаемого из Е.coli, также полезного в качестве иммуномодулятора; интерферона гамма-1b, 1-139 интерферона  (редуцированный остаток лимфоцитарного белка человека), N2-L-Met, полезного в качестве противоопухолевого агента и в качестве иммуномодулятора; ироплакта, N-метионилтромбоцитарного фактора 4 (субъединица человека), содержащего 71 аминокислотный остаток, имеющего два Cys мостика; ланотеплазы, белка тканевого активатора плазминогена, получаемого из ТАП человека путем делеции фибронектинподобного и ЭФР-подобного доменов и мутации Asn 117 в Gln 117, получаемого путем экспрессии в хозяйских клетках млекопитающих последовательности ДНК, кодирующей последовательность пептида, полезного в качестве активатора плазминогена и тромболитического агента; ланреотида ацетата, содержащего 8 аминокислот и один дисульфидный мостик, полезного в качестве противоопухолевого агента; ленограстима, гликопротеина, состоящего из 174 аминокислотных остатков, продуцируемого в клетках яичника китайского хомячка путем экспрессии кДНК колониестимулирующего фактора гранулоцитов человека, получаемой с мРНК линии сквамозных клеток ротовой полости человека, полезного в качестве агента для лечения нейтропении и в качестве стимулятора гемопоэза; лютрелина ацетата, рилизинг-фактора лютеинизирующего гормона (свиньи), содержащего 9 аминокислот, полезного в качестве агониста РФЛГ; молграмостима, колониестимулирующего фактора 2 (редуцированный остаток белка клона человека pHG25), содержащего 127 аминокислот, полезного в качестве агента для лечения нейтропении и в качестве стимулятора гемопоэза; муродермина, эпидермального фактора роста (слюнной железы мыши); нафарелина ацетата, рилизинг-фактора лютеинизирующего гормона (свиньи), содержащего 9 аминокислот, полезного в качестве агониста РФЛГ; нагрестипена, 26-L-аланинэлимфокина ВБМ 1 (редуцированный остаток лимфоцитарного белка человека), N2-L-Met, полезного в качестве противоопухолевого агента и в качестве иммуномодулятора; ироплакта, N-метионилтромбоцитарного фактора 4 (субъединица человека), содержащего 71 аминокислотный остаток, имеющего два Cys мостика; ланотеплазы, белка тканевого активатора плазминогена, получаемого из ТАП человека путем делеции фибронектинподобного и ЭФР-подобного доменов и мутации Asn 117 в Gln 117, получаемого путем экспрессии в хозяйских клетках млекопитающих последовательности ДНК, кодирующей последовательность пептида, полезного в качестве активатора плазминогена и тромболитического агента; ланреотида ацетата, содержащего 8 аминокислот и один дисульфидный мостик, полезного в качестве противоопухолевого агента; ленограстима, гликопротеина, состоящего из 174 аминокислотных остатков, продуцируемого в клетках яичника китайского хомячка путем экспрессии кДНК колониестимулирующего фактора гранулоцитов человека, получаемой с мРНК линии сквамозных клеток ротовой полости человека, полезного в качестве агента для лечения нейтропении и в качестве стимулятора гемопоэза; лютрелина ацетата, рилизинг-фактора лютеинизирующего гормона (свиньи), содержащего 9 аминокислот, полезного в качестве агониста РФЛГ; молграмостима, колониестимулирующего фактора 2 (редуцированный остаток белка клона человека pHG25), содержащего 127 аминокислот, полезного в качестве агента для лечения нейтропении и в качестве стимулятора гемопоэза; муродермина, эпидермального фактора роста (слюнной железы мыши); нафарелина ацетата, рилизинг-фактора лютеинизирующего гормона (свиньи), содержащего 9 аминокислот, полезного в качестве агониста РФЛГ; нагрестипена, 26-L-аланинэлимфокина ВБМ 1 (воспалительный пептид макрофагов клона рАТ 464 человека, содержащий 69 аминокислот и имеющий два дисульфидных мостика); пепстатина, N-(3-метил-1-оксобутил)L-Val-L-Val-4-амино-3-гидрокси-6-метилгептаноил-L-А1а-4-амино-3-гидрокси-6-метилгептановой кислоты, полезного в качестве ингибитора фермента пепсина; прамлинтида, белка, содержащего 37 аминокислот и имеющего один дисульфидный мостик, полезного в качестве антидиабетического агента; проинсулина человека, проинсулина (свиньи), содержащего 86 аминокислотных остатков и имеющего три дисульфидных мостика, полезного в качестве антидиабетического агента; сарграмостима, колониестимулирующего фактора 2 (остаток белка клона человека рНG25), 23-L-Leu-, одноцепочечного гликозилированного пептида, состоящего из 127 аминокислотных остатков, экспрессируемого в Saccharomyces cerevisiae, полезного в качестве агента для лечения нейтропении и в качестве стимулятора гемопоэза; встречающихся в природе и синтетических, включающих в себя получаемые рекомбинантно соматотропины человека и животных (гормоны роста), в частности соматотропины быка и свиньи; сомагребава, соматотропин (бычий, редуцированный), 1-[N2-L-Met-L- (воспалительный пептид макрофагов клона рАТ 464 человека, содержащий 69 аминокислот и имеющий два дисульфидных мостика); пепстатина, N-(3-метил-1-оксобутил)L-Val-L-Val-4-амино-3-гидрокси-6-метилгептаноил-L-А1а-4-амино-3-гидрокси-6-метилгептановой кислоты, полезного в качестве ингибитора фермента пепсина; прамлинтида, белка, содержащего 37 аминокислот и имеющего один дисульфидный мостик, полезного в качестве антидиабетического агента; проинсулина человека, проинсулина (свиньи), содержащего 86 аминокислотных остатков и имеющего три дисульфидных мостика, полезного в качестве антидиабетического агента; сарграмостима, колониестимулирующего фактора 2 (остаток белка клона человека рНG25), 23-L-Leu-, одноцепочечного гликозилированного пептида, состоящего из 127 аминокислотных остатков, экспрессируемого в Saccharomyces cerevisiae, полезного в качестве агента для лечения нейтропении и в качестве стимулятора гемопоэза; встречающихся в природе и синтетических, включающих в себя получаемые рекомбинантно соматотропины человека и животных (гормоны роста), в частности соматотропины быка и свиньи; сомагребава, соматотропин (бычий, редуцированный), 1-[N2-L-Met-L- -Asp-L-глутамин] -, содержащего 191 аминокислоту, полезного в качестве стимулирующего лактацию агента особенно для ветеринарного применения; сомалапора, соматотропин (редуцированный, клона свиньи рРGH-1), N-L-аланил-гормона роста, содержащего в сумме 191 аминокислоту, полезного в качестве гормона роста свиньи; соматрема, соматотропин (человека), N-L-Met-, содержащего 191 аминокислоту, имеющего два дисульфидных мостика, полезного в качестве гормона роста; соматотропина, одной полипептидной цепи, содержащей 191 аминокислоту, имеющей нормальную структуру основного гормона, стимулирующего рост, получаемого из передней доли гипофиза человека, полезного в качестве гормона роста; соматотропина, доступного в рекомбинантной форме: сомавубава, соматотропин (быка), 127-L-Leu-, который является одним из четырех встречающихся в природе молекулярных вариантов соматотропина гипофиза быка, полезного в качестве стимулирующего лактацию агента; соменопора, соматотропин (редуцированный, клона свиньи рРGH-1), N-L-Ala-32-де-L-Glu-33-де-L-Arg-34-де-L-Ala-35-де-L-Tyr-36-де-L-Ile-37-де-L-Pro-38-де-L-Glu-, содержащего 190 аминокислот, полезного в качестве гормона роста свиньи; сометрибава, соматотропин (быка), 1-L-Met-127-L-Leu-, содержащего 191 аминокислоту, полезного в качестве применяемого в ветеринарии стимулятора роста; сометрипора, соматотропин (рекомбинантный, свиньи) С979H1527N265O287S8; сомфазепора, соматотропин (рекомбинантный, свиньи) C938H1465N257O278S6; сомидобава, соматотропин (рекомбинантный, быка) С1020H1596N274O302S9; тепротида, потенциатора В брадикинина, 2-L-Trp-3-де-L-Leu-4-де-L-Pro-8-L-глутамин(а)-, содержащего 9 аминокислот, полезного в качестве ингибитора ангиотензинконвертирующего фермента; терипаратида, белка, содержащего 34 аминокислоты, полезного в качестве ингибитора резорбции костей и в качестве дополнительного агента при лечении остеопороза; тимальфазина, тимозина -Asp-L-глутамин] -, содержащего 191 аминокислоту, полезного в качестве стимулирующего лактацию агента особенно для ветеринарного применения; сомалапора, соматотропин (редуцированный, клона свиньи рРGH-1), N-L-аланил-гормона роста, содержащего в сумме 191 аминокислоту, полезного в качестве гормона роста свиньи; соматрема, соматотропин (человека), N-L-Met-, содержащего 191 аминокислоту, имеющего два дисульфидных мостика, полезного в качестве гормона роста; соматотропина, одной полипептидной цепи, содержащей 191 аминокислоту, имеющей нормальную структуру основного гормона, стимулирующего рост, получаемого из передней доли гипофиза человека, полезного в качестве гормона роста; соматотропина, доступного в рекомбинантной форме: сомавубава, соматотропин (быка), 127-L-Leu-, который является одним из четырех встречающихся в природе молекулярных вариантов соматотропина гипофиза быка, полезного в качестве стимулирующего лактацию агента; соменопора, соматотропин (редуцированный, клона свиньи рРGH-1), N-L-Ala-32-де-L-Glu-33-де-L-Arg-34-де-L-Ala-35-де-L-Tyr-36-де-L-Ile-37-де-L-Pro-38-де-L-Glu-, содержащего 190 аминокислот, полезного в качестве гормона роста свиньи; сометрибава, соматотропин (быка), 1-L-Met-127-L-Leu-, содержащего 191 аминокислоту, полезного в качестве применяемого в ветеринарии стимулятора роста; сометрипора, соматотропин (рекомбинантный, свиньи) С979H1527N265O287S8; сомфазепора, соматотропин (рекомбинантный, свиньи) C938H1465N257O278S6; сомидобава, соматотропин (рекомбинантный, быка) С1020H1596N274O302S9; тепротида, потенциатора В брадикинина, 2-L-Trp-3-де-L-Leu-4-де-L-Pro-8-L-глутамин(а)-, содержащего 9 аминокислот, полезного в качестве ингибитора ангиотензинконвертирующего фермента; терипаратида, белка, содержащего 34 аминокислоты, полезного в качестве ингибитора резорбции костей и в качестве дополнительного агента при лечении остеопороза; тимальфазина, тимозина  1 (быка), содержащего 28 аминокислот, полезного в качестве противоопухолевого агента, при лечении гепатита и инфекционных заболеваний и в качестве усилителя вакцин; тимопентина, пентапептида, полезного в качестве иммунорегулятора; трипторелина, рилизинг-фактор лютеинизирующего гормона (свиньи), 6-D-Trp, включающего в себя 10 аминокислот, полезного в качестве противоопухолевого агента; вапреотида, содержащего 8 аминокислот, имеющего один дисульфидный мостик, полезного в качестве противоопухолевого агента; вазопрессина в форме 8-L-Arg- или 8-L-Lys-, содержащего 9 аминокислот, имеющего один дисульфидный мостик, полезного в качестве антидиуретического гормона; миоглобина; гемоглобина; 1 (быка), содержащего 28 аминокислот, полезного в качестве противоопухолевого агента, при лечении гепатита и инфекционных заболеваний и в качестве усилителя вакцин; тимопентина, пентапептида, полезного в качестве иммунорегулятора; трипторелина, рилизинг-фактор лютеинизирующего гормона (свиньи), 6-D-Trp, включающего в себя 10 аминокислот, полезного в качестве противоопухолевого агента; вапреотида, содержащего 8 аминокислот, имеющего один дисульфидный мостик, полезного в качестве противоопухолевого агента; вазопрессина в форме 8-L-Arg- или 8-L-Lys-, содержащего 9 аминокислот, имеющего один дисульфидный мостик, полезного в качестве антидиуретического гормона; миоглобина; гемоглобина;  -лактоглобулина; иммуноглобулина-G (Ig G); антигемофилического фактора (фактор VIII); лизоцима; убиквитина; фактора активации тромбоцитов (ФАТ); фактора некроза опухоли- -лактоглобулина; иммуноглобулина-G (Ig G); антигемофилического фактора (фактор VIII); лизоцима; убиквитина; фактора активации тромбоцитов (ФАТ); фактора некроза опухоли- (ФНО- (ФНО- ); фактора некроза опухоли- ); фактора некроза опухоли- (ФНО- (ФНО- ); воспалительного белка макрофагов (ВБМ); гепарина и катионного белка эозинофилов (КБЭ); рекомбинантного фактора IX; моноклонального антитела к не-Ходжкинской В-клеточной лимформе; интерферона альфа, полезного для лечения гепатита С; и полученной из фибробластов искусственной кожи для лечения ран и ожогов.
5. Способ по п.1, где указанные условия, которые являются эффективными для проведения указанной реакции конденсации по существу до завершения, включают в себя: (а) условия, которые переводят любую присутствующую воду из жидкой фазы в газообразную или твердую фазу, посредством чего указанная вода удаляется из указанной водной среды указанной реакции конденсации; и (б) условия, которые оптимизируют энергетические затраты в указанном способе, необходимые для наиболее эффективного отделения воды указанной водной среды, в которой происходит реакция конденсации, включая воду, образуемую в ходе самой указанной реакции конденсации, из исходных материальных реагентов и аддуктного конечного продукта конденсации.
6. Способ по п.5, где при температурах выше 0oС указанные условия, которые переводят любую присутствующую воду из жидкой фазы в газообразную фазу и которые оптимизирут энергетические затраты в указанном способе, включают в себя: (а) нагревание указанной реакционной смеси в указанной водной среде до самой высокой температуры, совместимой с поддержанием целостности указанного белкового исходного материального реагента и аддуктного конечного продукта конденсации, а также совместимой с оптимальными эффективностями и экономичностью осуществления указанного способа получения, включающего в себя указанную реакцию конденсации; (б) разделение указанной реакционной смеси в указанной водной среде на самые маленькие капли, совместимое с поддержанием целостности указанного белкового исходного материального реагента и указанного аддуктного конечного продукта конденсации, а также совместимое с оптимальными эффективностями и экономичностью осуществления указанного способа получения, включающего в себя указанную реакцию конденсации; и (в) придание указанным каплям, образуемым таким образом, самой высокой относительной скорости по отношению к газу, через который они проходят, инертному в их отношении, совместимое с поддержанием целостности указанного белкового исходного материального реагента и аддуктного конечного продукта конденсации, а также совместимого с оптимальными эффективностями и экономичностью осуществления указанного способа получения, включающего в себя указанную реакцию конденсации.
7. Способ по п.6, в котором указанное разделение указанной реакционной смеси на капли осуществляют с применением распыляющего аппарата, включающего в себя любое подходящее сочетание генераторов потока газа с высоким давлением и ассоциированных диспергирующих средств вместе с гидравлическими насосами высокого давления и ассоциированными соплами.
8. Способ по п.6, при котором указанное разделение указанной реакционной смеси на капли осуществляют с применением механического воздействия в форме быстро вращающегося диска, на поверхность которого направлен водный поток, содержащий каждый из указанных исходных материальных реагентов, и указанный водный поток пересекает указанный диск таким образом, что он отталкивается от края указанного диска в форме капель, и это происходит в условиях, отрегулированных в отношении температуры, влажности и давления таким образом, чтобы удалять приблизительно 97,0-99,9 мас.%, предпочтительно приблизительно 98,0-99,0 мас. % воды, уже присутствующей или образующейся в ходе указанной реакции конденсации, согласуясь с поддержанием целостности реагентов конденсации и аддуктного конечного продукта, и с обеспечением степени превращения в указанный аддуктный конечный продукт конденсации, т.е. с получающимся в результате выходом указанного аддуктного конечного продукта конденсации, равным или большим приблизительно 98,5 мас.%, предпочтительно равным или большим приблизительно 99,5 мас.%, основываясь на массе реагентов.
9. Способ по п. 5, где при температурах 0oС и ниже указанные условия, которые переводят любую присутствующую воду из жидкой фазы в твердую фазу и которые оптимизируют энергетические затраты в указанном способе, включают в себя: (а) охлаждение указанной реакционной смеси в указанной водной среде до температуры, достаточно низкой для замораживания по существу всей несвязанной жидкой воды, присутствующей в указанной водной среде, причем указанная температура совместима с поддержанием целостности белкового исходного материального реагента и аддуктного конечного продукта конденсации, а также совместима с оптимальными эффективностями и экономичностью осуществления указанного способа получения, включающего в себя указанную реакцию конденсации; (б) приложение к указанной реакционной смеси, охлажденной таким образом, в указанной замороженной водной среде пониженного давления в присутствии газа, инертного в ее отношении, которое совместимо с поддержанием целостности указанного белкового исходного материального реагента и указанного аддуктного конечного продукта конденсации, а также совместимо с оптимальными эффективностями и экономичностью осуществления указанного способа получения, включающего в себя указанную реакцию конденсации.
10. Аддуктный конечный продукт конденсации, являющийся основанием Шиффа, включающий в себя белок и ароматический о-гидроксиальдегид, получаемый в условиях, которые быстро по сравнению с сушкой в условиях окружающей среды удаляют приблизительно 97,0-99,9 мас. %, предпочтительно приблизительно 98,0-99,0 мас. % воды, уже присутствующей или образующейся в ходе указанной реакции конденсации, причем удаление совместимо с поддержанием целостности реагентов конденсации и аддуктного конечного продукта.
11. Продукт по п. 10, где указанный ароматический о-гидроксиальдегид включает в себя одно или более чем одно соединение формулы ); воспалительного белка макрофагов (ВБМ); гепарина и катионного белка эозинофилов (КБЭ); рекомбинантного фактора IX; моноклонального антитела к не-Ходжкинской В-клеточной лимформе; интерферона альфа, полезного для лечения гепатита С; и полученной из фибробластов искусственной кожи для лечения ран и ожогов.
5. Способ по п.1, где указанные условия, которые являются эффективными для проведения указанной реакции конденсации по существу до завершения, включают в себя: (а) условия, которые переводят любую присутствующую воду из жидкой фазы в газообразную или твердую фазу, посредством чего указанная вода удаляется из указанной водной среды указанной реакции конденсации; и (б) условия, которые оптимизируют энергетические затраты в указанном способе, необходимые для наиболее эффективного отделения воды указанной водной среды, в которой происходит реакция конденсации, включая воду, образуемую в ходе самой указанной реакции конденсации, из исходных материальных реагентов и аддуктного конечного продукта конденсации.
6. Способ по п.5, где при температурах выше 0oС указанные условия, которые переводят любую присутствующую воду из жидкой фазы в газообразную фазу и которые оптимизирут энергетические затраты в указанном способе, включают в себя: (а) нагревание указанной реакционной смеси в указанной водной среде до самой высокой температуры, совместимой с поддержанием целостности указанного белкового исходного материального реагента и аддуктного конечного продукта конденсации, а также совместимой с оптимальными эффективностями и экономичностью осуществления указанного способа получения, включающего в себя указанную реакцию конденсации; (б) разделение указанной реакционной смеси в указанной водной среде на самые маленькие капли, совместимое с поддержанием целостности указанного белкового исходного материального реагента и указанного аддуктного конечного продукта конденсации, а также совместимое с оптимальными эффективностями и экономичностью осуществления указанного способа получения, включающего в себя указанную реакцию конденсации; и (в) придание указанным каплям, образуемым таким образом, самой высокой относительной скорости по отношению к газу, через который они проходят, инертному в их отношении, совместимое с поддержанием целостности указанного белкового исходного материального реагента и аддуктного конечного продукта конденсации, а также совместимого с оптимальными эффективностями и экономичностью осуществления указанного способа получения, включающего в себя указанную реакцию конденсации.
7. Способ по п.6, в котором указанное разделение указанной реакционной смеси на капли осуществляют с применением распыляющего аппарата, включающего в себя любое подходящее сочетание генераторов потока газа с высоким давлением и ассоциированных диспергирующих средств вместе с гидравлическими насосами высокого давления и ассоциированными соплами.
8. Способ по п.6, при котором указанное разделение указанной реакционной смеси на капли осуществляют с применением механического воздействия в форме быстро вращающегося диска, на поверхность которого направлен водный поток, содержащий каждый из указанных исходных материальных реагентов, и указанный водный поток пересекает указанный диск таким образом, что он отталкивается от края указанного диска в форме капель, и это происходит в условиях, отрегулированных в отношении температуры, влажности и давления таким образом, чтобы удалять приблизительно 97,0-99,9 мас.%, предпочтительно приблизительно 98,0-99,0 мас. % воды, уже присутствующей или образующейся в ходе указанной реакции конденсации, согласуясь с поддержанием целостности реагентов конденсации и аддуктного конечного продукта, и с обеспечением степени превращения в указанный аддуктный конечный продукт конденсации, т.е. с получающимся в результате выходом указанного аддуктного конечного продукта конденсации, равным или большим приблизительно 98,5 мас.%, предпочтительно равным или большим приблизительно 99,5 мас.%, основываясь на массе реагентов.
9. Способ по п. 5, где при температурах 0oС и ниже указанные условия, которые переводят любую присутствующую воду из жидкой фазы в твердую фазу и которые оптимизируют энергетические затраты в указанном способе, включают в себя: (а) охлаждение указанной реакционной смеси в указанной водной среде до температуры, достаточно низкой для замораживания по существу всей несвязанной жидкой воды, присутствующей в указанной водной среде, причем указанная температура совместима с поддержанием целостности белкового исходного материального реагента и аддуктного конечного продукта конденсации, а также совместима с оптимальными эффективностями и экономичностью осуществления указанного способа получения, включающего в себя указанную реакцию конденсации; (б) приложение к указанной реакционной смеси, охлажденной таким образом, в указанной замороженной водной среде пониженного давления в присутствии газа, инертного в ее отношении, которое совместимо с поддержанием целостности указанного белкового исходного материального реагента и указанного аддуктного конечного продукта конденсации, а также совместимо с оптимальными эффективностями и экономичностью осуществления указанного способа получения, включающего в себя указанную реакцию конденсации.
10. Аддуктный конечный продукт конденсации, являющийся основанием Шиффа, включающий в себя белок и ароматический о-гидроксиальдегид, получаемый в условиях, которые быстро по сравнению с сушкой в условиях окружающей среды удаляют приблизительно 97,0-99,9 мас. %, предпочтительно приблизительно 98,0-99,0 мас. % воды, уже присутствующей или образующейся в ходе указанной реакции конденсации, причем удаление совместимо с поддержанием целостности реагентов конденсации и аддуктного конечного продукта.
11. Продукт по п. 10, где указанный ароматический о-гидроксиальдегид включает в себя одно или более чем одно соединение формулы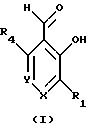 где R1 и R4 независимо выбраны из группы, состоящей по существу из водорода, гидрокси, галогено, нитро, циано, трифторметила, (С1-С6)алкила, (С1-С6)алкокси, (С3-С6)циклоалкила, (С2-С6)алкенила, -С(=O)OR7, -OC(=O)R7, -S(= O)2-S(= O)2N(R7)(R9), -S(= O)2R7, -S(=O)2OR7, -C(=O)NR7R9, -C(=O)R9 и -N(R7)(R9), где R7 представляет собой водород или (С1-С4)алкил, а R9 представляет собой (С1-С4)алкил, где указанные алкильные, циклоалкильные и алкенильные группы, определяющие R1 и R4, могут возможно быть независимо замещены одним или двумя заместителями, выбранными из группы, состоящей по существу из галогено; гидрокси; (С1-С2)алкила; (С1-С2)алкокси; (С1-С2)алкокси-(С1-С2)алкила; (С1-С2)алкоксикарбонила; карбоксила; (С1-С2)алкилкарбо-нилокси; нитро; циано; амино, двузамещенного (С1-С2)алкилом; сульфонила и сульфонамидо, двузамещенного (С1-С2)алкилом; Х и Y независимо представляют собой N, или СНR2, или СHR3 соответственно, где R2 и R3 независимо выбраны из группы, состоящей по существу из водорода, гидрокси; галогено; нитро; циано; трифторметила; (С1-С6)алкила, (С1-С6)алкокси; (С3-С6)циклоалкила; (С2-С6)алкенила; -С(=O)OR11; -OC(=O)R11; -S(=O)2; -S(=O)2N(R11)(R13) и -N(R11)(R13), где R11 представляет собой водород или (С1-С4)алкил и R13 представляет собой (С1-С4)алкил; и где указанные алкильные, циклоалкильные и алкенильные группы, определяющие R2 и R3, могут возможно быть независимо замещены одним или двумя заместителями, выбранными из группы, состоящей по существу из галогено; гидрокси; (С1-С2)алкила; (С1-С2)алкокси; (С1-С2)алкокси-(С1-С2)алкила; (С1-С2)алкоксикарбонила; карбоксила; (С1-С2)алкилкарбонилокси; нитро; циано; амино, двузамещенного (С1-С2)алкилом; сульфонила и сульфонамидо, двузамещенного (С1-С2)алкилом. 12. Продукт по п. 11, где указанный ароматический о-гидроксиальдегид включает в себя о-ванилин, салициловый альдегид, 2,3-дигидроксибензальдегид, 2,6-дигидроксибензальдегид, 2-гидрокси-3-этоксибензальдегид или пиридоксаль. 13. Продукт по п. 11, где указанный белок, обладающий полезной активностью у животных, включает в себя один или более чем один представитель, выбранный из группы, определенной в п.4. 14. Способ по п.4, в котором указанный белок, обладающий полезной активностью у животных, включает в себя представитель, выбранный из группы, состоящей по существу из встречающегося в природе соматотропина свиньи; сомалапора, соматотропина (редуцированного, клона свиньи pРGH-1), N-L-аланил-гормон роста, содержащего в сумме 191 аминокислоту; соменопора, соматотропина (редуцированного, клона свиньи рРGH-1), N-L-Ala-32-де-L-Glu-33-де-L-Arg-34-де-L-Ala-35-де-L-Tyr-36-де-L-Ile-37-де-L-Pro-38-де-L-Glu-, содержащего 190 аминокислот; соматотропина (рекомбинантного, свиньи) C979H1527N265O287S8; и сомфазепора, соматотропина (рекомбинантного, свиньи) C938Н1465N257O278S6. 15. Продукт по п. 13, в котором указанный белок, обладающий полезной активностью у животных, включает в себя представитель, выбранный из группы, состоящей по существу из встречающегося в природе соматотропина свиньи; сомалапора, соматотропина (редуцированного, клона свиньи pPGH-1), N-L-аланил-гормон роста, содержащего в сумме 191 аминокислоту; соменопора, соматотропина (редуцированный клона свиньи pPGH-1), N-L-Ala-32-де-L-Glu-33-де-L-Arg-34-де-L-Ala-35-де-L-Tyr-36-де-L-Ile-37-де-L-Pro-38-де-L-Glu-, содержащего 190 аминокислот; соматотропина (рекомбинантного, свиньи) С979Н1527N265O287S8; и сомфазепора, соматотропина (рекомбинантного, свиньи) C938H1465N257O278S6. РИСУНКИ
MM4A Досрочное прекращение действия патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 03.06.2003
Извещение опубликовано: 27.04.2005 БИ: 12/2005
|
||||||||||||||||||||||||||
