Патент на изобретение №2201931
|
||||||||||||||||||||||||||
(54) ИНГИБИТОРЫ ФАРНЕЗИЛТРАНСФЕРАЗЫ И СПОСОБЫ ИНГИБИРОВАНИЯ ФАРНЕЗИЛТРАНСФЕРАЗЫ
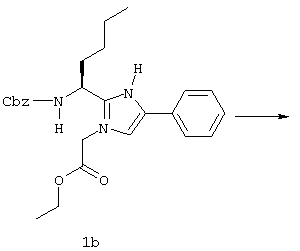
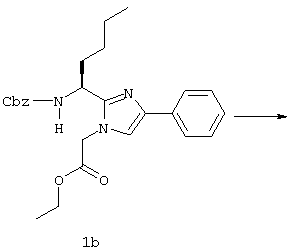
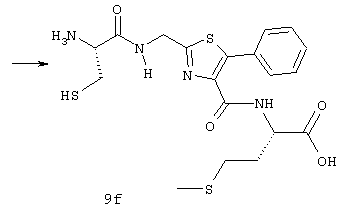
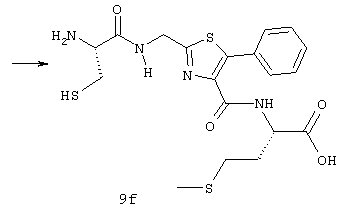
(57) Реферат: Изобретение относится к группе новых соединений, имеющей формулу I или формулу II: 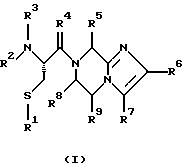 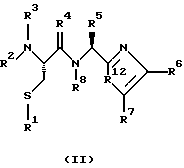 где R1 представляет Н, низший алкилтио или R1 вместе с R2 образуют -СН2-; каждый из R2 и R3 независимо представляет Н или низший алкил; R4 представляет О или Н2; R5 представляет Н, незамещенный низший алкил, циклогексил – низший алкил; каждый из R6 и R7 независимо представляет водород, фенил, нафтил, -С(O)-NHCHR13CO2R14, или замещенный фенил, где заместитель представляет собой галоген, низший алкил, низший алкокси, гидрокси, или фенил – низший алкокси; R8 представляет Н или низший алкил; R9 представляет Н или низший алкил; R12 представляет NR9 или S; R13 представляет низший алкилтио; R14 представляет Н или низший алкил; или их фармацевтически приемлемым солям, за исключением 4,5-бис(4-метоксифенил)-2-(4-тиазолидинилкарбониламинометил)тиазола и его гидрохлорида. Предложены также отдельные индивидуальные соединения вышеописанной группы соединений, димерные соединения, состоящие из двух идентичных соединений (мономеров) формулы I или II, связанных через дисульфидную связь, образованную комбинацией R1 первого и R1 второго мономера и их фармацевтически приемлемые соли. Соединения согласно изобретению обладают ингибирующим действием в отношении фарнезилтрансферазы на опухолевых клетках человека и могут быть использованы для лечения опухолей или рестеноза. Кроме того, предложены способы ингибирования фарнезилтрансферазы на опухолевых клетках человека с использованием соединений предлагаемого изобретения. 5 с. и 23 з.п.ф-лы, 1 табл. Ras представляет собой белок с молекулярной массой 21 000, играющий важную роль в пути сигнальной трансдукции для роста нормальной клетки. Этот белок продуцируется в рибосоме, высвобождается в цитозоль и посттрансляционно модифицируется. Первой стадией в ряду посттрансляционных модификаций является алкилирование Cys168 фарнезилпирофосфатом в реакции, катализируемой ферментом фарнезилтрансферазой (Hancock, JF, et al., Cell 57: 1167-1177 (1989)). Затем три С-концевые аминокислоты отщепляются (Gutierrez, L, et al. , ЕМВО J. 8: 1093-1098 (1989)) и концевой Cys168 этерифицируется метилом (Clark, S, et al., Proc, Nat’l Acad. Sci. (USA) 85: 4643-4647 (1988)). Некоторые формы Ras также обратимо пальмитоилируются на цистеиновых остатках, непосредственно N-концевых к Cys168 (Buss, JE, et al., Mol. Cell. Biol. 6: 116-122 (1986)). Эти модификации повышают гидрофобность С-концевой области Ras, заставляя их локализоваться у поверхности клеточной мембраны. Локализация Ras у клеточной мембраны необходима для нормальной функции (Willumsen, ВМ, et al., Science 310: 583-586 (1984)). Онкогенные формы Ras наблюдают в относительно большом числе раковых заболеваний, включая свыше 50% рака ободочной кишки, свыше 30% рака легких и более 90% раковых болезней поджелудочной железы (Bos, JL, Cancer Research 49: 4682-4689 (1989)). Эти наблюдения предполагают, что вмешательство в функцию медиированной Ras сигнальной трансдукции может быть полезно при лечении рака. Ранее было показано, что С-концевой тетрапептид Ras имеет мотив “СААХ” (где С представляет цистеин, А представляет алифатическую аминокислоту, и Х представляет любую аминокислоту). Показано, что тетрапептиды, имеющие эту структуру, являются ингибиторами фарнезилтрансферазы (Reiss, et al., Cell 62: 81-88 (1990)). Слабая активность этих прежних ингибиторов фарнезилтрансферазы побуждала поиск новых ингибиторов с более подходящим фармакокинетическим поведением (James, GL, et al., Science 260: 1937-1942 (1993)); Kohl, NE, et al., Proc. Nat’l Acad. Sci. (USA) 91: 9141-9145; (1994); deSolms, SJ, et al. , J. Med. Chem. 38: 3967-3971 (1995); Nagasu, Т, et al., Cancer Research 55: 5310-5314 (1995); Lerner EC, et al., J. Biol. Chem. 270: 26802-26806 (1995)). Недавно было показано, что ингибиторы фарнезилтрансферазы будут блокировать рост Ras-зависимых опухолей у голых мышей (Kohl, NE, et al., Proc. Nat’l Acad. Sci. (USA) 91: 9141-9145 (1994)). Кроме того, было показано, что более 70% большого отбора образцов опухолевых клеточных линий ингибируется ингибиторами фарнезилтрансферазы с селективностью по сравнению с нетрансформированными эпителиальными клетками (Sepp-Lorenzino, I, et al., Cancer Research 55: 5302-5309 (1995)). В одном аспекте данное изобретение представляет соединение, имеющее формулу (I) или формулу (II): 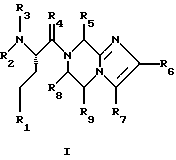 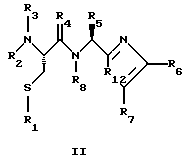 где R1 представляет Н, низший алкил, циклоалкилтио или низший алкилтио или вместе с R2 образует -СН2-, -СО- или -С(СН3)2-; каждый из R2 и R3, независимо, представляет Н, низший алкил или циклоалкил; R4 представляет Н2 или О; R5 представляет Н или замещенный или незамещенный низший алкил, низший алкенил, низший алкинил, циклоалкил, циклоалкил-низший алкил, циклоалкенил, циклоалкенил-низший алкил, арил, арил-низший алкил, гетероциклил или гетероциклил-низший алкил, где заместитель представляет собой низший алкил, -O-R10, -S(O)mR10 (где m равно 0, 1 или 2), -N(R10)(R11), -N-C(O)-R10, -NH-(SO2)-R10; -CO2-R10, -C(O)-N(R10)(R11) или -(SO2)-N(R10)(R11); каждый из R6 и R7, независимо, представляет Н, -C(O)-NHCH-R13CO2R14 или замещенный или незамещенный низший алкил, циклоалкил, циклоалкил-низший алкил, циклоалкенил, циклоалкенил-низший алкил, арил, арил-низший алкил, гетероциклил или гетероциклил-низший алкил, где заместитель представляет собой ОН, низший алкил, низший алкокси, арилокси, арил-низший алкокси, -N(R10)(R11), -COOH, -CON(R10)(R11) или галоген или R6 и R7 вместе образуют арил или гетероциклил; каждый из R8 и R9, независимо, представляет Н или замещенный или незамещенный низший алкил, циклоалкил, циклоалкил-низший алкил, циклоалкенил, циклоалкенил-низший алкил, арил, арил-низший алкил, гетероциклил или гетероциклил-низший алкил, где заместитель представляет собой ОН, низший алкил, низший алкокси, -N(R10)(R11), -COOH, -C(O)N(R10)(R11) или галоген или R8 и R9 вместе образуют арил или гетероциклил; каждый из R10 и R11, независимо, представляет Н, низший алкил, арил, арил-низший алкил, циклоалкил, циклоалкил-низший алкил, гетероциклил или гетероциклил-низший алкил; R12 представляет NRg, S или O; R13 представляет замещенный или незамещенный низший алкил, где заместитель представляет собой низший алкил, -OR10, S(O)mR10 (где m равно 0, 1 или 2) или -N(R10)(R11); и R14 представляет Н или низший алкил, или его фармацевтически приемлемую соль. Примеры настоящего изобретения включают следующие соединения: 7-(2-амино-1-оксо-3-тиопропил)-8-бутил-2-фенил-5,6,7,8-тетрагидроимидазо[1,2а]пиразин (соединение 1); 7-(2-амино-1-оксо-3-тиопропил)-8-бутил-2-(4-фторфенил)-5,6,7,8-тетрагидроимидазо[1,2а]пиразин (соединение 2); 7-(2-амино-1-оксо-3-тиопропил)-8-бутил-2-(2-метоксифенил)-5,6,7,8-тетрагидроимидазо[1,2а]пиразин (соединение 3); 7-(2-амино-1-оксо-3-тиопропил)-8-бутил-2-(3-метоксифенил)-5,6,7,8-тетрагидроимидазо[1,2а]пиразин (соединение 4); 7-(2-амино-1-оксо-3-тиопропил)-8-бутил-2-(4-метоксифенил)-5,6,7,8-тетрагидроимидазо[1,2а]пиразин (соединение 5); 7-(2-амино-1-оксо-3-тиопропил)-8-(2-гидроксиэтил)-2-фенил-5,6,7,8-тетрагидроимидазо[1,2а]пиразин (соединение 6); 7-(2-амино-3-тиопропил)-8-бутил-3-фенил-5,6,7,8-тетрагидроимидазо[1,2а] пиразин (соединение 7); 2-(1-(N-(2-амино-1-оксо-3-тиопропил)-N-метил)-аминопентил)-5-фенилимидазол (соединение 8); 2-(((2-амино-1-оксо-3-меркаптопропил)амино)метил)-5-фенилтиазол-4-карбонилметионин (соединение 9); 7-(2-амино-1-оксо-3-тиопропил)-2-(2-метоксифенил)-8-(2-метилпропил)-5,6,7,8-тетрагидроимидазо[1,2а]пиразин (соединение 11); 7-(2-амино-1-оксо-3-тиопропил)-8-бутил-2-(2-этоксифенил)-5,6,7,8-тетрагидроимидазо[1,2а]пиразин (соединение 13); 7-(2-амино-1-оксо-3-тиопропил)-8-бутил-2-(2-гидроксифенил)-5,6,7,8-тетрагидроимидазо[1,2а]пиразин (соединение 14); 2-(1-(N-(2-амино-1-оксо-3-тиопропил)-N-метил)-аминопентил-5-(2-метоксифенил)имидазол (соединение 15); 7-(2-амино-1-оксо-3-тиопропил)-8-(2-метилпропил)-2-(1-нафтил)-5,6,7,8-тетрагидроимидазо[1,2a]пиразин (соединение 17); 7-(2-амино-1-оксо-3-тиопропил)-8-(1-метилпропил)-2-(2-метоксифенил)-5,6,7,8-тетрагидроимидазо[1,2a]пиразин (соединение 18); S-(диметилэтил)-S’-[2-амино-3-оксо-3-(8-бутил-2-(2-метоксифенил)-5,6,7,8-тетрагидроимидазо[1,2a] пиразин-7-ил)пропил] дисульфид (соединение 21); 7-(2-амино-1-оксо-3-тиопропил)-8-бутил-2-(2-метилфенил)-5,6,7,8-тетрагидроимидазо[1,2а]пиразин (соединение 22); 7-(2-амино-1-оксо-3-тиопропил)-8-(1,1-диметилэтил)-2-(2-метоксифенил)-5,6,7,8-тетрагидроимидазо[1,2a]пиразин (соединение 24); 7-(2-амино-1-оксо-3-тиопропил)-8-(1-метилпропил)-2-(2-(фенилметокси)фенил)-5,6,7,8-тетрагидроимидазо[1,2a]пиразин (соединение 25); 7-(2-амино-1-оксо-3-тиопропил)-8-(циклогексилметил)-2-(2-метоксифенил)-5,6,7,8-тетрагидроимидазо[1,2a]пиразин (соединение 26); 7-(2-амино-1-оксо-3-тиопропил)-2-(2-метоксифенил)-8-(1-метилэтил)-5,6,7,8-тетрагидроимидазо[1,2a]пиразин (соединение 27); 7-(2-амино-1-оксо-3-тиопропил)-8-бутил-2-(2-гидрокси-6-метоксифенил)-5,6,7,8-тетрагидроимидазо[1,2a]пиразин (соединение 29); 2-(2-метоксифенил)-8-(1-метилпропид)-5,6,7,8-тетрагидро-7-((тиазолидин-4-ил)карбонил)имидазо[1,2a]пиразин (соединение 31); 7-(2-амино-1-оксо-3-тиопропил)-3-бром-8-бутил-2-(2-метоксифенил)-5,6,7,8-тетрагидроимидазо[1,2а]пиразин (соединение 32); 7-(2-амино-1-оксо-3-тиопропил)-8-бутил-2,3-дифенил-5,6,7,8-тетрагидроимидазо[1,2а]пиразин (соединение 34); 7-(2-амино-1-оксо-3-тиопропил)-3-бром-8-бутил-2-фенил-5,6,7,8-тетрагидроимидазо[1,2а]пиразин (соединение 36); 7-(2-амино-1-оксо-3-тиопропил)-2-циклогексил-8-(циклогексилметил)-5,6,7,8-тетрагидроимидазо[1,2а]пиразин (соединение 37); 7-(2-амино-1-оксо-3-тиопропил)-8-гексил-2-(2-метоксифенил)-5,6,7,8-тетрагидроимидазо[1,2а]пиразин (соединение 42); 7-(2-амино-1-оксо-3-тиопропил)-8-(циклогексилэтил)-2-(2-метоксифенил)-5,6,7,8-тетрагидроимидазо[1,2а]пиразин (соединение 44); 7-(2-амино-1-оксо-3-тиопропил)-8-(циклогексил)-2-(2-метоксифенил)-5,6,7,8-тетрагидроимидазо[1,2а]пиразин (соединение 46); 7-(2-амино-1-оксо-3-тиопропил)-8-(2-(4-метоксициклогексил)метил)-2-(2-метоксифенил)-5,6,7,8-тетрагидроимидазо[1,2а]пиразин (соединение 47); 7-((2-амино-1-оксо-3-тиопропил)-8-(циклогексилметил)-2-фенил)-5,6,7,8-тетрагидроимидазо[1,2а] пиразин (соединение 49); 7-(2-амино-1-оксо-3-тиопропил)-8-(4-метоксициклогексил)-2-(2-метоксифенил)-5,6,7,8-тетрагидроимидазо[1,2а]пиразин (соединение 51); [S-[(2-амино-3-оксо-3-(8-циклогексилметил)-2-(2-метоксифенил)-5,6,7,8-тетрагидроимидазо[1,2а] пиразин-7-ил)пропил] -S’-циклогексил] дисульфид (соединение 52); 7-(2-амино-1-оксо-3-тиопропил)-8-(4-метоксициклогексил)метил-2-(2-метоксифенил)-5,6,7,8-тетрагидроимидазо[1,2а] пиразин (цис-изомер) (соединение 53); 7-(2-амино-1-оксо-3-тиопропил)-2-(2-метоксифенил)-8-(4-пиперидинилметил)-5,6,7,8-тетрагидроимидазо[1,2а]пиразин (соединение 54); 7-(2-амино-1-оксо-3-тиопропил)-2-(2-метоксифенил)-8-(2-пиперидинилметил)-5,6,7,8-тетрагидроимидазо[1,2а]пиразин (соединение 55); 7-(2-амино-1-оксо-3-тиопропил)-2-(2-метоксифенил)-8-(3-пиперидинилметил)-5,6,7,8-тетрагидроимидазо[1,2а]пиразин (соединение 56); 7-(2-амино-1-оксо-3-тиопропил)-8-(циклогексилметил)-2-(1-нафтил)-5,6,7,8-тетрагидроимидазо[1,2а]пиразин (соединение 57); [S-[(2-амино-3-оксо-3-(8-циклогексилметил)-2-(2-метоксифенил)-5,6,7,8-тетрагидроимидазо[1,2а] пиразин-7-ил)пропил] -S’-этил] дисульфид (соединение 58); 7-(2-амино-1-оксо-3-тиопропил)-2-(2-метоксифенил)-8-(2-метилтио)этил-5,6,7,8-тетрагидроимидазо[1,2а]пиразин (соединение 59); 7-(2-амино-1-оксо-3-тиопропил)-8-(3-индолинилметил)-2-(2-метоксифенил)-5,6,7,8-тетрагидроимидазо[1,2а]пиразин (соединение 60); 7-(2-амино-1-оксо-3-тиопропил)-8-(1-метилимидазол-3-ил)метил-2-(2-метоксифенил)-5,6,7,8-тетрагидроимидазо[1,2а]пиразин (соединение 61); 8-(циклогексилметил)-2-(2-метоксифенил)-7-(2-оксотиазолидин-4-карбонил)-5,6,7,8-тетрагидроимидазо[1,2а]пиразин (соединение 62) и 7-(2-амино-1-оксо-3-тиопропил)-2-(2-метоксифенил)-8-(2-феноксиэтил)-5,6,7,8-тетрагидроимидазо[1,2а]пиразин (соединение 63). В другом аспекте изобретение представляет димерное соединение, образованное из двух идентичных или разных соединений (мономеров), как описано выше, или его фармацевтически приемлемую соль. Мономеры связывают друг с другом для образования димера через дисульфидную связь. Более конкретно R1 в первом мономере и R1 во втором мономере в комбинации образуют дисульфидную связь. Примеры димеров этого изобретения включают: бис-1,1′-[2-амино-3-(8-бутил-2-(2-метоксифенил)-5,6,7,8-тетрагидроимидазо[1,2-а]пиразин-7-ил)-3-оксопропил]дисульфид (соединение 10); бис-1,1′-[2-амино-3-(2-(2-метоксифенил)-8-(2-метилпропил)5,6,7,8-тетрагидроимидазо[1,2-а]пиразин-7-ил)-3-оксопропил]дисульфид (соединение 12); бис-1,1′-[2-амино-3(N-(1-(5-(2-метоксифенил)имидазол-2-ил)-пент-2-ил)-N-метиламино)-3-оксопропил]дисульфид(соединение 16); бис-1,1′-[2-амино-3-(2-(1-нафтил)-8-(2-метилпропил)-5,6,7,6-тетрагидроимидазо[1,2-а]пиразин-7-ил)-3-оксопропил]дисульфид (соединение 19); бис-1,1′-[2-амино-3-(2-(метоксифенил)-8-(1-метилпропил)-5,6,7,8-тетрагидроимидазо[1,2-а]пиразин-7-ил)-3-оксопропил]дисульфид (соединение 20); бис-1,1′-[2-амино-3-(2-(2-метилфенил)-8-бутил-5,6,7,8-тетрагидроимидазо[1,2-а]пиразин-7-ил)-3-оксопропил]дисульфид (соединение 23); бис-1,1′-[2-амино-3-(2-метоксифенил)-8-(1-метилэтил)5,6,7,8-тетрагидроимидазо[1,2-а]пиразин-7-ил)-3-оксопропил]дисульфид (соединение 28); бис-1,1′-[2-амино-3-(2-метоксифенил)-8-(1,1-диметилэтил)-5,6,7,8-тетрагидроимидазо[1,2-а]пиразин-7-ил)-3-оксопропил]дисульфид(соединение 30); бис-1,1′-[2-амино-3-(8-бутил-2-циклогексил-5,6,7,8-тетрагидроимидазо[1,2а]пиразин-7-ил)-3-оксопропил]дисульфид (соединение 33); бис-1,1′-[2-амино-3-(3-бром-8-бутил-2-фенил-5,6,7,8-тетрагидроимидазо[1,2а]пиразин-7-ил)-3-оксопропил]дисульфид (соединение 35); бис-1,1′-[7-(2-амино-1-оксо-3-тиопропил)-8-бутил-2,3-дифенил-5,6,7,8-тетрагидроимидазо[1,2а]пиразин]дисульфид (соединение 38); бис-1,1′-[7-(2-амино-1-оксо-3-тиопропил)-8-(1-метилпропил)-2-(2-(фенилметокси)фенил)-5,6,7,8-тетрагидроимидазо[1,2а] пиразин] дисульфид (соединение 39); бис-1,1′-[2-амино-3-(2-циклогексил-8-(циклогексилметил)-5,6,7,8-тетрагидроимидазо[1,2а]пиразин-7-ил)-3-оксопропил]дисульфид (соединение 40); бис-1,1′-[7-(2-амино-1-оксо-3-тиопропил)-8-(циклогексилметил)-2-(2-метоксифенил)-5,6,7,8-тетрагидроимидазо[1,2а] пиразин] дисульфид (соединение 41); бис-1,1′-[7-(2-амино-1-оксо-3-тиопропил)-8-гексил-2-(2-метоксифенил)-5,6,7,8-тетрагидроимидазо[1,2а]пиразин]дисульфид (соединение 43); бис-1,1′-[7-(2-амино-1-оксо-3-тиопропил)-8-(циклогексилэтил)-2-(2-метоксифенил)-5,6,7,8-тетрагидроимидазо[1,2а] пиразин] дисульфид (соединение 45); бис-1,1′-[7-(2-амино-1-оксо-3-тиопропил)-8-(циклогексил)-2-(2-метоксифенил)-5,6,7,8-тетрагидроимидазо[1,2а]пиразин]дисульфид (соединение 48); бис-1,1′-[7-(2-амино-1-оксо-3-тиопропил)-8-(2-(4-метоксициклогексил)метил)-2-(2-метоксифенил)-5,6,7,8-тетрагидроимидазо[1,2а] пиразин] дисульфид (соединение 50) и бис-1,1′-[2-амино-3-(2-(2-метоксифенил)-8-(2-феноксиэтил)-5,6,7,8-тетрагидроимидазо[1,2а]пиразин-7-ил)-3-оксопропил]дисульфид (соединение 64). Структуры этих соединений 1-64 приведены в конце описания. Соединения настоящего изобретения могут иметь асимметричные центры и могут встречаться в виде рацематов, рацемических смесей и в виде индивидуальных диастереомеров, причем все возможные изомеры, включая оптические изомеры, включены в настоящее изобретение. Для простоты в тех случаях, когда в структурных формулах конкретная конфигурация не изображена, подразумевается, что представлены все энантиомерные формы и их смеси. Используемый здесь термин “низший алкил” предназначается для включения насыщенных алифатических углеводородных групп как с разветвленной, так и с неразветвленной цепью, имеющих 1-6 атомов углерода. Примеры низших алкильных групп включают метил, этил, пропил, изопропил, бутил, трет-бутил, изобутил, втор-бутил и тому подобное. “Низшие алкенильные” группы включают алкенильные группы, имеющие 2-6 атомов углерода и имеющие одну или несколько двойных связей. Примеры алкенильных групп включают винил, аллил, изопропенил, бутенил, пентенил, гексенил, 1-пропенил, 2-бутенил, 2-метил-2-бутенил, изопренил и тому подобное. “Алкинильные группы” включают алкинильные группы, имеющие 2-6 атомов углерода и имеющие одну или несколько тройных связей. Примеры алкинильных групп включают этинил, пропинил, 1-бутинил, 2-бутинил, 3-бутинил, втор-бутинил и тому подобное. Все алкильные, алкенильные и алкинильные группы нециклические. Используемый здесь термин “циклоалкил” предназначается для включения неароматических циклических углеводородных групп, имеющих 3-10 атомов углерода. Примеры циклоалкильных групп включают циклопропил, циклобутил, циклопентил, циклогексил и тому подобное. Термин “циклоалкенил” предназначается для включения неароматических углеводородных циклических групп, имеющих 3-10 атомов углерода и имеющих одну или несколько двойных связей. Примеры циклоалкенильных групп включают циклопропенил, циклобутенил, циклопентенил, циклогексенил и тому подобное. Используемый здесь термин “арил” предназначается для включения любого стабильного моноциклического, бициклического или трициклического карбоциклического кольца(ец), содержащего вплоть до 7 членов в каждом кольце, где по меньшей мере одно кольцо ароматическое. Примеры арильных групп включают фенил, нафтил, антраценил, бифенил, тетрагидронафтил, инданил, фенантренил и тому подобное. Используемый здесь термин “гетероциклил” представляет стабильное 5-7-членное моноциклическое, или стабильное 8-11-членное бициклическое или стабильное 11-15-членное трициклическое гетероциклическое кольцо, которое либо насыщено либо ненасыщено и которое состоит из атомов углерода и от одного до четырех гетероатомов, выбранных из группы, состоящей из N, O и S, включая любую бициклическую группу, в которой любое из выше определенных гетероциклических колец конденсировано с кольцом бензола. Гетероциклическое кольцо может быть присоединено у любого гетероатома или атома углерода, который приводит к созданию стабильной структуры. Примеры таких гетероциклических элементов включают, но не ограничиваются ими, азепинил, бензимидазолил, бензизоксазолил, бензофуразанил, бензопиранил, бензотиопиранил, бензофурил, бензотиазолил, бензотиенил, бензоксазолил, хроманил, циннолинил, дигидробензофурил, дигидробензотиенил, дигидробензотиопиранил, сульфон дигидробензотиопиранила, фурил, имидазолидинил, имидазолинил, имидазолил, индолинил, индолил, изохроманил, изоиндолинил, изохинолинил, изотиазолидинил, изотиазолил, изотиазолидинил, морфолинил, нафтиридинил, оксадиазолил, 2-оксоазепинил, 2-оксопиперазинил, 2-оксопиперидинил, 2-оксопирролидинил, пиперидил, пиперазинил, пиридил, N-оксид пиридила, хиноксалинил, тетрагидрофурил, тетрагидроизохинолинил, тетрагидрохинолинил, тиаморфолинил, сульфоксид тиаморфолинила, тиазолил, тиазолинил, тиенофурил, тиенотиенил, тиенил и тому подобное. Термин “галоген” предназначается для включения фтора, хлора, брома и иода. Термин “замещенный” предназначается для включения перечисленной химической группы (например, низшего алкила, гетероцикла, арила, циклоалкила и так далее), замещенной перечисленными заместителями от одного до четырех (например, галогеном, ОН, низшим алкилом и так далее). Заместитель может быть присоединен к любому атому в химической группе. Соединения этого изобретения могут быть представлены в форме фармацевтически приемлемых солей. Приемлемые соли включают, но не ограничиваются ими, кислотно-аддитивные соли неорганических кислот, такие как гидрохлорид, сульфат, фосфат, дифосфат, гидробромид и нитрат, или органических кислот, такие как ацетат, малеат, фумарат, тартрат, сукцинат, цитрат, лактат, метансульфонат, п-толуолсульфонат, памоат, салицилат, оксалат и стеарат. В пределы объема настоящего изобретения, где пригодно, включаются также соли, образованные из оснований, таких как гидроксид натрия или калия. Для дальнейших примеров фармацевтически приемлемых солей см. “Pharmaceutical Salts”, J. Pharm. Sci. 66: 1 (1977). В другом аспекте изобретение представляет способ ингибирования фарнезилтрансферазы у пациента, например млекопитающего, такого как человек, введением пациенту терапевтически эффективного количества соединения формулы (I) или формулы (II). Особенно настоящее изобретение включает также способ лечения рестеноза или пролиферативных болезней тканей (т.е. опухоли) у пациента введением пациенту терапевтически эффективного количества соединения или его соли. Примеры пролиферативной болезни тканей включают как болезни, ассоциированные с пролиферацией доброкачественных (например, незлокачественных) клеток, такие как фиброз, доброкачественная гиперплазия простаты, атеросклероз и рестеноз, так и болезни, ассоциированные с пролиферацией злокачественных клеток, такие как рак (например, опухоли, экспрессирующие фарнезилтрансферазу). Примерами излечимых опухолей являются рак молочной железы, ободочной кишки, поджелудочной железы, простаты, легких, яичников, эпидермальный рак и рак кроветворных органов (Sepp-Lorenzino, I. et al., Cancer Research 55: 5302 (1995)). Терапевтически эффективное количество соединения этого изобретения и фармацевтически приемлемое вещество-носитель (например, карбонат магния, лактоза или фосфодипид, с которым терапевтическое соединение может образовать мицеллу) вместе образуют терапевтическую композицию (например, пилюлю, таблетку, капсулу или жидкость) для введения (например, перорально, внутривенно, чрескожно или подкожно) субъекту, нуждающемуся в этом соединении. Пилюлю, таблетку или капсулу можно покрыть веществом, способным защитить композицию от желудочной кислоты или кишечных ферментов в желудке субъекта в течение периода времени, достаточного для прохождения непереваренной композиции в тонкую кишку субъекта. Доза соединения настоящего изобретения для лечения вышеуказанных болезней или нарушений варьируется в зависимости от способа введения, возраста и массы тела субъекта и состояния субъекта, которое нужно лечить, и в конце концов, будет определяться штатным врачом больницы или ветеринаром. Такое количество соединения, определяемое штатным врачом или ветеринаром, указывается здесь как “терапевтически эффективное количество”. В пределах объема изобретения рассматривается также способ получения соединения формулы (I) или формулы (II) и новые химические промежуточные продукты, использованные в этих синтезах, как здесь описано. Другие отличительные признаки и преимущества настоящего изобретения будут очевидны из подробного описания изобретения и из формулы изобретения. Считается, что специалист в данной области на основании данного описания может в полной мере использовать настоящее изобретение. Следующие конкретные осуществления должны истолковываться лишь как иллюстративные и никоим образом не лимитируют остальную часть описания. Если не оговорено особо, все научные и технические термины, используемые здесь, имеют то же самое значение, которое обычно понимается специалистом данной области, к которой относится это изобретение. Кроме того, все публикации, патентные заявки, патенты и другие ссылки, указанные здесь, вводятся в качестве ссылки. Синтез Нижеследующее представляет описание синтеза соединений от 1 до 31. Другие соединения изобретения могут быть получены аналогичным образом специалистом данной области. Используемый здесь термин Cbz означает карбобензилокси; ДМФ означает диметилформамид; EtOAc означает этилацетат; NH40Ac означает ацетат аммония; LAH означает литийалюминийгидрид; ТГФ означает тетрагидрофуран; ВОС означает трет-бутоксикарбонил; Trt означает тритил; ТФУ означает трифторуксусную кислоту; Et2O означает диэтиловый эфир; NMR (ЯМР) означает ядерный магнитный резонанс; масс-спектр, означает масс-спектрометрию; DMSO-d6 означает метилсульфоксид; DCC означает дициклогексилкарбодиимид; NMM означает 4-метилморфолин; iPr3SiH означает триизопропилсилан; ВЭЖХ означает высокоэффективную жидкостную хроматографию; DIG означает диизопропилкарбодиимид; МеОН означает метанол; KOtBu означает трет-бутоксид калия; HOSU означает N-гидроксисукцинимид и iBuOCOCl означает изобутилхлорформиат. Пример 1 7-(2-амино-1-оксо-3-тиопропил)-8-бутил-2-фенил-5,6,7,8-тетрагидроимидазо[1,2а]пиразин (соединение 1) Соединение 1 синтезировали по синтетической схеме I, как показано в конце описания. а) 2-[1-(S)-(((фенилметокси)карбонил)амино)пентил]-4-фенилимидазол Сbz-(L)-норлейцин (10,0 г, 37,7 ммоль) и Сs2СО3 (6,14 г, 18,9 ммоль) смешивали в смеси ДМФ:Н2О, 1:1 (75 мл) и смесь перемешивали с завихрениями до получения гомогенной смеси. Растворители удаляли в вакууме. Остаток растворяли в ДМФ (50 мл) и растворители снова удаляли в вакууме для удаления любого остаточного количества Н2О. Остаток растворяли в ДМФ (50 мл) и к раствору добавляли 2-бромацетофенон (7,5 г, 37,7 ммоль) в ДМФ (25 мл). Раствор перемешивали в течение 15 мин при комнатной температуре и затем концентрировали в вакууме. Получаемый сложный кетоэфир растворяли в EtOAc (75 мл), CsBr отделяли фильтрованием и раствор концентрировали в вакууме. К раствору добавляли NH4OАс (50,0 г, 0,65 моль) и ксилолы (150 мл) и раствор нагревали при кипячении с обратным холодильником в течение 1,5 ч. Раствор затем охлаждали и растворители удаляли в вакууме. Остаток растворяли в EtOAc (75 мл) и промывали два раза насыщенным раствором NаНСО3 (50 мл). Слой EtOAc затем сушили над MgSO4, фильтровали и до образования помутнения добавляли гексан. Получаемый кристаллический продукт отделяли фильтрованием и сушили, получая 10,04 г (73%) продукта. Т.пл.=136-138oС. Масс-спектр: (МН+ 364,3). ЯМР (300 МГц, CD3CO2D) 7,7 (3Н, м), 7,4 (3Н, м), 7,3 (5Н, м), 5,1 (3Н, м), 2,1 (2Н, м (затемненный растворителем), 1,4 (4Н, М), 0,9 (3Н, т). б) Этил-2-[1-(S)-(((фенилметокси)карбонил)амино)пентил] -4-фенил-1-имидазолацетат Этилбромацетат (2,64 мл, 24 ммоль), K2CO3 (1,93 г, 14,0 ммоль) и промежуточный продукт 1а (4,36 г, 12,0 ммоль) смешивали в ДМФ (25 мл) и смесь нагревали при 60oС в течение 4 ч. Смесь затем концентрировали в вакууме и остаток растворяли в EtOAc (50 мл). Раствор промывали как насыщенным раствором NaHCO3 (25 мл), так и насыщенным раствором NaCl (25 мл). Раствор затем сушили над MgSO4, фильтровали и растворители удаляли в вакууме. Остаток далее очищали флэш-хроматографией на силикагеле, используя в качестве элюента смесь гексан:EtOAc, 80:20. Фракции чистого продукта объединяли и концентрировали в вакууме, получая масло, которое кристаллизовалось. Получили 3,09 г (57%) продукта. Т. пл. 85-87oС, масс-спектр: 450,2 (МН+), 472,2 (MNa+). ЯМР (300 МГц, CD3CO2D) 7,7 (2Н, д), 7,5 (1H, с), 7,2-7,45 (8Н, м), 5,25 (2Н, дд), 5,1 (2Н, дд), 5,1 (1H, м), 2,15 (2Н, м), 1,4 (7Н, М), 0,9 (3Н, т). в) (S)-8-бутил-6-оксо-2-фенил-5,6,7,8-тетрагидроимидазо[1,2а]пиразин Промежуточный продукт 1б (2,89 г, 6,44 ммоль) растворяли в 50 мл уксусной кислоты, содержащей 290 мг 10% Pd на угле. Смесь гидрировали в течение 8 ч при комнатной температуре. Катализатор удаляли фильтрованием через целит. Лактамизацию выполняли нагреванием при 70oС в течение 3 ч. Продукт концентрировали при пониженном давлении и остаток распределяли между EtOAc и насыщенным раствором NаНСО3. Слой ЕtOАс сушили над MgSO4 и фильтровали. Продукт кристаллизовали из смеси EtOAc/гексан, получая 1,37 г (79%) продукта. Т.пл.=208-211oС, масс-спектр: 270,2 (МН+), 292,2 (MNa+). ЯМР (300 МГц, CD3CO2D) 7,75 (2Н, д), 7,5 (1H, с), 7,3-7,45 (3Н, м), 5,25 (1H, м), 4,95 (2Н, с), 2,1 (2Н, м (затемненный пиком растворителя)), 1,4 (4Н, м), 0,9 (3Н, т). г) (S)-8-бутил-2-фенил-5,6,7,8-тетрагидроимидазо[1,2а]-пиразин Раствор промежуточного продукта 1в (1,25 г, 4,65 ммоль) в 20 мл ТГФ добавляли по каплям к перемешиваемому раствору 1 М LAH в ТГФ (16 мл). Смесь нагревали для кипячения с обратным холодильником в течение 1 ч и затем перемешивали при комнатной температуре в течение ночи. Смесь затем гасили медленным добавлением смеси 3 г целита и 2 мл насыщенного раствора К2СО3. Смесь перемешивали в течение 1 ч и отфильтрованную твердую часть экстрагировали три раза 25 мл EtOAc. Растворители удаляли при пониженном давлении и остаток очищали флэш-хроматографией на силикагеле с использованием смеси этилацетат: уксусная кислота:пиридин:вода, 900:54:16:30 в качестве элюента. Фракции продукта концентрировали до получения масла и затем растворяли в этилацетате. Раствор промывали 25 мл насыщенного NаНСО3, сушили над MgSO4, фильтровали и концентрировали в вакууме. Продукт сушили с использованием вакуумного насоса, получая 190 мг (16%) продукта. Масс-спектр: 256,2 (МН+), 278,2 (MNa+) д)7-[2-(((1,1-диметилэтокси)карбонил)амино)-1-оксо-3-((трифенилметил)тио)пропил] -8-бутил-2-фенил-5,6,7,8-тетрагидроимидазо[1,2а] пиразин Дициклогексилкарбодиимид (155 мг, 0,75 ммоль) и Вос-Cys(Trt)-OH (Advanced Chemtech) растворяли в 8 мл ТГФ и перемешивали в течение 5 мин. Получаемую дициклогексилмочевину отделяли фильтрованием и фильтрат добавляли к промежуточному продукту 1 г. Получаемую смесь перемешивали при комнатной температуре в течение 6 ч, концентрировали до образования смолы и очищали флэш-хроматографией на силикагеле с использованием смеси гексан:ЕtOАс 7:3 в качестве элюента. Фракции продукта объединяли и концентрировали до образования стеклообразной массы, получая 500 мг (95%) продукта. Масс-спектр: 701,5 (МН+), 723,5 (MNa+). ЯМР (300 МГц, CD3CO2D) 7,7 (2Н, д), 7,5 (1H, с), 7,2-7,45 (18Н, м), 6,05 (1H, д), 4,6 (1H, т), 4,2 (2Н, т), 3,95 (1H, т), 3,8 (1H, м), 2,6 (2Н, м), 2,0 (2Н, м (затемненный растворителем)), 1,4 (9Н, с), 1,2-1,4 (4Н, м), 0,9 (3Н, т). е) 7-(2-амино-1-оксо-3-тиопропил)-8-бутил-2-фенил-5,6,7,8-тетрагидроимидазо[1,2а]пиразин (соединение 1) Промежуточный продукт 1 д (322 мг, 0,46 ммоль) перемешивали с 10 мл Реагента В (ТФУ:фенол:(iPr3SiH):Н2О, 8,8:0,5: 0,2:0,5) в атмосфере азота в течение 15 мин. Растворители удаляли при пониженном давлении и остаток растворяли в 25 мл Н2О и промывали два раза 25 мл Et2O. Водный слой очищали колоночной хроматографией с обращенной фазой, получая 9 мг (5%) соединения 1 в виде белого лиофилизованного порошка. Масс-спектр: 359,1 (МН+). Пример 2 7-(2-амино-1-оксо-3-тиопропил)-8-бутил-2-(4-фторфенил)-5,6,7,8-тетрагидроимидазо[1,2а]пиразин (соединение 2) Соединение 2 получали способом, аналогичным способу примера 1, за исключением того, что вместо 2-бромацетофенона в стадии а) использовали 2-бром-4′-фторацетофенон. Масc-cпектр: 377,2 МН+. ЯМР (300 МГц, CD3CO2D) (наблюдали смесь конформеров приблизительно 2 к 1) 7,8-8,0 (2Н, м), 7,6-7,8 (1Н, с), 7,1-7,3 (12Н, М), 5,8-6,3 (1Н, м), 3,5-5,3 (5Н, т), 3,0-3,4 (2Н, м), 2,1-2,6 (2Н, м), 1,3-1,7 (4Н, м), 0,8-1,0 (3Н, м). Пример 3 7-(2-амино-1-оксо-3-тиопропил)-8-бутил-2-(2-метоксифенил)-5,6,7,8-тетрагидроимидазо[1,2а]пиразин (соединение 3) Соединение 3 получали способом, аналогичным способу примера 1, за исключением того, что вместо 2-бромацетофенона в стадии а) использовали 2-бром-2′-метоксиацетофенон. Масс-спектр: 389,3 МН+. ЯМР (300 МГЦ, DMSO-d6) 8,2-8,8 (3Н, с), 7,7-8,0 (2Н, М), 7,2-7,4 (1Н, М), 6,8-7,2 (2Н, м), 5,4-5,8 (1Н, т), 4,5-4,8 (1Н, т), 3,7-4,5 (4Н, м), 3,9 (3Н, с), 2,7- 3,1 (2Н, М), 1,8-2,1 (2Н, м), 1,3-1,6 (4Н, м), 0,8-1,0 (3Н, т). Пример 4 7-(2-амино-1-оксо-3-тиопропил)-8-бутил-2-(3-метоксифенил)-5,6,7,8-тетрагидроимидазо[1,2а]пиразин (соединение 4) Соединение 4 получали способом, аналогичным способу примера 1, за исключением того, что вместо 2-бромацетофенона в стадии а) использовали 2-бром-3′-метоксиацетофенон. Масс-спектр: 389,3 МН+. ЯМР (300 МГц, DMSO-d6) (наблюдали смесь конформеров приблизительно 4 к 1) 8,2-8,7 (3Н, с), 7,7-8,0 (1Н, с), 7,2-7,5 (3Н, м), 6,8-7,0 (2Н, д), 5,4-5,8 (1Н, т), 4,5-4,8 (1Н, т), 3,7-4,5 (4Н, М), 3,8 (3Н, с), 2,7-3,1 (2Н, м), 1,8-2,1 (2Н, м), 1,2-1,6 (4Н, м), 0,8-1,0 (3Н, т). Пример 5 7-(2-амино-1-оксо-3-тиопропил)-8-бутил-2-(4-метоксифенил)-5,6,7,8-тетрагидроимидазо[1,2а]пиразин (соединение 5) Соединение 5 получали способом, аналогичным способу примера 1, за исключением того, что вместо 2-бромацетофенона в стадии а) использовали 2-бром-4′-метоксиацетофенон. Масс-спектр: 389,3 МН+. ЯМР (300 МГц, DMSO-d6) (наблюдали смесь конформеров приблизительно 6 к 1) 8,2-8,8 (3Н, с), 7,7-8,0 (1Н, с), 7,5-7,8 (2Н, д), 6,9-7,2 (2Н, д), 5,4-5,8 (1Н, т), 4,5-4,8 (1Н, т), 3,7-4,5 (4Н, М), 3,8 (3Н, с), 2,7-3,2 (2Н, м), 1,8-2,1 (2Н, м), 1,2-1,6 (4Н, м), 0,8-1,0 (3Н, т). Пример 6 7-(2-амино-1-оксо-3-тиопропил)-8-(2-гидроксиэтил)-2-фенил-5,6,7,8-тетрагидроимидазо[1,2а]пиразин (соединение 6) Соединение 6 получали способом, аналогичным способу примера 1, за исключением того, что вместо 2-бромацетофенона в стадии а) использовали 2-бром-4′-метоксиацетофенон. Масс-спектр: 347,1 МН+. Пример 7 7-(2-амино-3-тиопропил)-8-бутил-3-фенил-5,6,7,8-тетрагидроимидазо[1,2а] пиразин (соединение 7) Соединение 7 синтезировали по синтетической схеме 2, как приведено в конце описания. а) Этил-2-((2-(((1,1-диметилэтокси)карбонид)амино)-этил)амино)пентаноат Boc-NHCH2CH2NH2 получали, как описано А.Р. Krapcho and C.S. Kuell, Syn. Comm. 20(16): 2559-2564 (1990). Boc-NHCH2CH2NH2 (5,00 г, 31,25 ммоль), этил-2-бромпентаноат (5,71 мл, 31,25 ммоль) и К2СО3 (4,31 г, 31,25 ммоль) объединяли в 75 мл ДМФ и перемешивали при 40oС в течение 1,5 ч. Растворители удаляли при пониженном давлении и остаток затем распределяли между Et2O и Н2O. Эфирный слой сушили над MgSO4 и фильтровали, растворители удаляли при пониженном давлении, получая 7,48 г (79%) масла. Масс-спектр: 303,0 МН+. ЯМР (CDCl3), 4,9-5,1 (1Н, ушир.С), 4,1-4,4 (2Н, М), 3,0-3,6 (2Н, М), 2,5-3,0 (2Н, М), 1,9-2,2 (1Н, ушир.С), 1,3-1,8 (2Н, М), 1,5 (9Н, С), 1,2-1,5 (7Н, М), 0,8-1,0 (3Н, т). б) Этил-2-[N-(2-(((1,1-диметилэтокси)карбонил)амино)этил)]-N-[(фенилметокси)карбонил]амино-пентаноат Промежуточный продукт 7а (7,40 г, 24,5 ммоль) растворяли в 40 мл ТГФ и затем добавляли 10 мл Н2О. Смесь охлаждали до 5oС и к смеси в виде четырех порций добавляли Cbz-Cl. pH смеси поддерживали между 8 и 9 добавлением 2,5 н. NaOH. Когда реакция завершалась, растворители удаляли в вакууме и остаток растворяли в EtOAc и промывали 5%-ным раствором лимонной кислоты. Растворители удаляли при пониженном давлении. Остаток растворяли в гексане, фильтровали для удаления кристаллических примесей и сушили, получая 7,34 г (69%) масла. Масс-спектр: 337,2 (М-Вос)Н+, 459,3 М Na+. ЯМP (CDCl3), 7,2-7,6 (5Н, М), 5,1-5,4 (3Н, М), 3,9-4,4 (3Н, М), 3,5-3,8 (1Н, М), 3,1-3,5 (3Н, М), 1,6-2,2 (2Н, М), 1,4-1,5 (9Н, С), 1,1-1,5 (7Н, М), 0,8-1,0 (3Н, т). в) 3-бутил-2-оксо-4-((фенилметокси)карбонил)пиперазин Промежуточный продукт 7б (7,10 г, 16,3 ммоль) растворяли в 25 мл смеси ТФУ:Н2O, 9:1 и перемешивали в течение 15 мин в атмосфере азота. Растворители удаляли при пониженном давлении и остаток растворяли в EtOAc. Раствор промывали насыщенным раствором NаНСО3, сушили над MgSO4, фильтровали и растворители удаляли при пониженном давлении. К остатку добавляли 10 мл уксусной кислоты и 10 мл пиридина и кипятили в течение 1 ч в атмосфере азота. Растворители удаляли при пониженном давлении и остаток растворяли в EtOAc и промывали два раза 5%-ной лимонной кислотой. Раствор сушили над MgSO4, фильтровали и растворители удаляли при пониженном давлении. Продукт кристаллизовали из раствора EtOAc/гексан, получая 2,40 г (51%) белого порошка. Т.пл.=107-108oС. Масс-спектр: 291,2 МН+, 313,2 М Na+. ЯМР (CDCl3) 7,3-7,5 (5Н, С), 7,0-7,2 (1Н, ушир.С), 5,1-5,3 (2Н, кв), 4,5-4,8 (1Н, ушир. С), 4,1-4,4 (1H, ушир.С), 3,4-3,6 (1H, Т), 3,1-3,4 (2Н, Д), 1,7-2,1 (2Н, М), 1,2-1,5 (4Н, М), 0,8-1,0 (3Н, ушир.С). г) 3-бутил-4-((фенилметокси)карбонил)-2-тиопиперазин Промежуточный продукт 7в (2,85 г, 9,83 ммоль) и реагент Лауссона (2,02 г, 5,00 ммоль) растворяли в 20 мл ТГФ и нагревали при кипячении с обратным холодильником в атмосфере азота в течение 1,5 ч. Раствор охлаждали и растворители удаляли при пониженном давлении. Остаток растворяли в 50 мл Et2O и промывали три раза 25 мл 1 н. NaOH. Раствор сушили над MgSO4, фильтровали и растворители удаляли при пониженном давлении. Остаток очищали флэш-хроматографией на силикагеле с использованием в качестве элюента смеси гeкcaн: EtOAс, 65:35. Фракции продукта концентрировали, получая 2,19 г (73%) масла, которое кристаллизовалось. Т.пл.=94-96oС. Масс-спектр: 307,2 МН+, 329,2 М Na+. ЯМР (CDCl3), 8,5-8,8 (1H, С), 7,3-7,5 (5Н, ушир.С), 4,9-5,4 (3Н, М), 4,0-4,5 (1H, М), 1,1-3,6 (3Н, М), 3,4-3,6 (1H, Т), 2,2-2,4 (2Н, ушир.С), 1,7-2,0 (2Н, М), 1,2-1,6 (4Н, ушир.С), 0,7-1,0 (3Н, ушир.С). д) 8-бутил-3-фенил-7-((фенилметокси)карбонил)-5,6,7,8-тетрагидроимидазо[1,2а]пиразин Промежуточный продукт 7г (1,07 г, 3,5 ммоль) растворяли в 10 мл ТГФ. Добавляли иодометан (2,18 мл, 35,0 ммоль) и перемешивали в течение 8 ч. Растворители удаляли при пониженном давлении. Остаток растворяли в 10 мл ТГФ и к раствору добавляли 4-метилморфолин (771 мкл, 7,0 ммоль) и гидрохлорид 2-аминоацетофенона (686 мг, 4,00 ммоль). Раствор перемешивали при комнатной температуре в течение ночи и затем кипятили с обратным холодильником в течение 2 ч. Добавляли 15 мл уксусной кислоты и отгоняли 15 мл растворителя. Раствор затем кипятили с обратным холодильником в течение 1 ч и концентрировали в вакууме. Остаток очищали флэш-хроматографией на силикагеле с использованием в качестве элюента смеси гексан:ЕtOAс, 70:30. Фракции продукта концентрировали, получая 0,97 г (71%) масла. Масс-спектр: 390,3 MH+, 412,2 МNa+. ЯМР (CD3CO2D) (наблюдали смесь конформеров приблизительно 1:1) 7,2-7,6 (11Н, М), 5,6-5,8 (1H, М), 5,0-5,4 (2Н, М), 4,4-4,8 (1H, М), 4,1-4,4 (1H, М), 3,9-4,1 (1H, М), 3,3-3,6 (1H, ушир.С), 1,8-2,2 (затемненный растворителем) (2Н, М), 1,7-2,0 (2Н, М), 1,1-1,6 (4Н, ушир.С), 0,7-0,9 (3Н, ушир.С). е) 8-бутил-3-фенил-5,6,7,8-тетрагидроимидазо[1,2а]пиразин Промежуточный продукт 7д (1,08 г, 2,78 ммоль) растворяли в 4 мл ТГФ. Добавляли 10 мл 4 н. НСl и смесь нагревали при кипячении с обратным холодильником в атмосфере азота в течение 4 ч. Растворители удаляли при пониженном давлении, получая твердый продукт, который промывали эфиром и сушили до массы 740 мг. Масс-спектр: 256 МН+. ж) 8-бутил-7-(2-((1,1-диметилэтокси)карбонил)амино-1-оксо-3-(трифенилметилтио)пропил)-3-фенил-5,6,7,8-тетрагидроимидазо[1,2а]пиразин Boc-Cys(Trt)-OH (2,32 г, 5,00 ммоль; Advanced Chemtech) растворяли в 20 мл ТГФ. К этому раствору добавляли DCC (515 мг, 2,50 ммоль). Раствору давали стоять в течение 15 мин и DCC отделяли фильтрованием. Фильтрат добавляли к раствору промежуточного продукта 7е (700 мг, 2,4 ммоль) и NMM (655 мкл, 4,80 ммоль) в 20 мл ТГФ. Раствор перемешивали в течение 2 ч при комнатной температуре, растворители удаляли при пониженном давлении. Получаемый продукт очищали хроматографией на силикагеле с использованием в качестве элюента смеси гексан : ЕtOАс, 70:30. Фракции продукта объединяли и концентрировали до образования пены, которую сушили, получая 1,47 г (87,5%) продукта. Масс-спектр: 701,4 МН+. ЯМР (CD3CO2D), 7,1-7,7 (21Н, М), 6,0-6,2 (1Н, М), 6,5-6,7 (1H, Т), 3,4-4,4 (4Н, М), 2,4-2,8 (2Н, М), 1,8-2,4 (2Н, М), (частично затемненный сигналом растворителя) 1,4 (9Н, С), 1,1-1,4 (4Н, М), 0,7-1,0 (3Н, М). з) 8-бутил-7-(2-((диметилэтокси)карбонил)амино-3-(трифенилметилтио)пропил)-3-фенил-5,6,7,8-тетрагидроимидазо[1,2а]пиразин Промежуточный продукт 7ж (350 мг, 0,50 ммоль) растворяли в ТГФ (3 мл) и добавляли 1 М ВН3/ТГФ (7 мл, 7,0 ммоль). Реакционную смесь нагревали при кипячении с обратным холодильником в атмосфере N2 в течение 2 ч. Раствор охлаждали до комнатной температуры и избыток реагента разрушали осторожным добавлением раствора МеОН (8 мл) и уксусной кислоты (2 мл). Сырой продукт концентрировали при пониженном давлении и снова растворяли в системе уксусная кислота/H2, 3: 1, в течение 1 ч. После удаления растворителей при пониженном давлении остаток очищали флэш-хроматографией на силикагеле с использованием в качестве элюента 1% HOAc/EtOAc. Фракции продукта объединяли, концентрировали и сушили до 100 мг (29%). МН+ 687,5. и) 7-(2-амино-3-тиопропил)-8-бутил-3-фенил-5,6,7,8-тетрагидроимидазо[1,2а]пиразин (соединение 7) Промежуточный продукт 7з (100 мг, 0,146 ммоль) обрабатывали в атмосфере азота смесью ТФУ:Н2O:iРr3SiН, 93:5:2 (10 мл) в течение 15 мин. Растворители удаляли при пониженном давлении и получаемое твердое вещество растирали восемь раз с 4 мл H2O и затем фильтровали. Фильтрат очищали препаративной ВЭЖХ, получая 45 мг (74%) лиофилизованного соединения 7, которое, как было показано аналитической ВЭЖХ, является смесью изомеров 1:1. Масс-спектр: 345,2 МН+. ЯМР (CD3CO2D) 7,4-7,7 (6Н, М), 6,0-6,4 (1Н, М), 3,8-5,3 (5Н, М), 3,0-3,4 (2Н, М), 2,0-2,4 (2Н, М), 1,2-1,7 (4Н, М), 0,9-1,0 (3Н, M). Пример 8 2-(1-(N-(2-амино-1-оксо-3-тиопропил)-N-метил)аминопентил)-5-фенилимидазол (соединение 8) Соединение синтезировали по схеме 3, как показано в конце описания. а) 5-(1-(Метиламино)пентил)-2-фенилимидазол Промежуточный продукт 1а (1,50 г, 4,10 ммоль) и LAH (50% в масле; Alfa Products, Danvers, MA) (1,25 г, 16,4 ммоль) смешивали в толуоле (10 мл) и ТГФ (5 мл) в атмосфере азота и смесь нагревали до 55oС в течение 4 ч. Смесь выливали в EtOAc (100 мл), к смеси добавляли влажный целит. Твердую часть удаляли фильтрованием и фильтрат сушили над Na2SO4 и концентрировали. Сырой продукт использовали без дальнейшей очистки. б) 5-((N-(2-(((1,1-диметилэтокси)карбонил)амино)-1-оксо-3-(трифенилметилтио)пропил)-N-метиламино)пентил)-2-фенилимидазол Boc-Cys(Trt)-OH (3,8 г, 8,2 ммоль) и DIС (643 мкл, 4,1 ммоль) смешивали в СН2Сl2 (50 мл) и перемешивали в течение 0,5 ч при комнатной температуре. Добавляли промежуточный продукт 8а (1,00 г, 4,1 ммоль) и перемешивали при комнатной температуре в течение 1 ч. Твердую часть отделяли фильтрованием и разбавляли до 100 мл СН2Сl2. Раствор промывали насыщенным NaHCO3 (3 х 50 мл) и насыщенным NaCl (1 х 50 мл), сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали флэш-хроматографией на силикагеле (120 г) с использованием в качестве элюентов сначала СН2Сl2 и затем 1% MeOH/СН2Сl2. Фракции продукта объединяли и концентрировали, получая 1,36 г (46%) продукта. в) 2-(1-(N-(2-Амино-1-оксо-3-тиопропил)-N-метил)аминопентил)-5-фенилимидазол (соединение 8) Промежуточный продукт 86 растворяли в 10 мл Реагента В в атмосфере азота и раствор перемешивали в течение 0,5 ч. Твердую часть удаляли фильтрованием и растворители удаляли в потоке азота. Остаток растирали с этиловым эфиром и очищали ВЭЖХ с обращенной фазой, получая соединение 8 в виде белого твердого продукта после лиофилизации (74,1 мг, 49%). Масс-спектр: 347,2 МН+. Пример 9 2-(((2-амино-1-оксо-3-меркаптопропил)амино)метил)-5-фенилтиазол-4-карбонилметионин (соединение 9) Соединение 9 синтезировали по схеме 4, как показано в конце описания. а) Метил-2-амино-3-оксо-3-фенилпропионат Основание Шиффа (10,0 г, 39,5 ммоль) получали, как описано в (O’Donnel, et al., J. Org. Chem. 47:2663 (1982)). Основание Шиффа растворяли в ТГФ (60 мл) и добавляли по каплям к перемешиваемой смеси KOtBu (4,43 г, 39,5 ммоль) в ТГФ (30 мл), которую охлаждали до -70oС в атмосфере азота. Раствор перемешивали в течение 10 мин при -70oС и анион переносили к перемешиваемому раствору бензоилхлорида (4,59 мл, 39,5 ммоль) в ТГФ (50 мл), который также охлаждали до -70oС, в атмосфере азота. Раствор перемешивали в течение 45 мин при -70oС и затем гасили добавлением 4 н. НСl (30 мл). ТГФ удаляли при пониженном давлении и водный слой промывали два раза 50 мл этилового эфира. Раствор концентрировали до получения твердого продукта и продукт растворяли в МеОН (30 мл) и КСl отделяли фильтрованием. Продукт кристаллизовали добавлением эфира до достижения точки помутнения. Продукт фильтровали и сушили, получая 2,89 г (32%) продукта. Масс-спектр: 194,1 (МН+). б) Метил-2-(((1,1-диметилэтокси)карбонил)глицил)амино-3-оксо-3-фенилпропионат Boc-Gly-OH (3,15 г, 18,0 ммоль) и NMM (1,98 мл, 18,0 ммоль) смешивали в ТГФ (50 мл) и раствор охлаждали до -20oС. К раствору добавляли iBuCOCl (2,34 мл, 18,0 ммоль) и смесь перемешивали в течение 5 мин при -20oС. К раствору, который энергично перемешивали при возвращении к комнатной температуре, добавляли промежуточный продукт 9а (4,13 г, 18,0 ммоль) и NMM (1,98 мл, 18,0 ммоль). Раствор концентрировали при пониженном давлении и остаток растворяли в EtOAc (50 мл) и промывали один раз H2O, один раз 5%-ным раствором лимонной кислоты и один раз насыщенным раствором NaCl. Раствор сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Дальнейшую очистку выполняли флэш-хроматографией на силикагеле с использованием в качестве элюента смеси гексан: EtOAc, 1:1. Фракции продукта объединяли и концентрировали, получая 3,28 г (52%) продукта. Масс-спектр: 373,2 MNa+. в) Метил-2-(((1,1-диметилэтокси)карбонил)амино)метил-5-фенилтиазол-4-карбоксилат Промежуточный продукт 9б (3,10 г, 8,86 ммоль) и реагент Лауссона (3,6 г, 8,9 ммоль; Aldrich Chem. Co., St. Louis, МО) растворяли в ТГФ (30 мл) и нагревали при кипячении с обратным холодильником в течение 1 ч. Растворители удаляли в потоке азота и остаток очищали флэш-хроматографией на силикагеле с использованием в качестве элюента смеси гекcaн:EtOAc 1:1. Фракции продукта объединяли и концентрировали при пониженном давлении, получая 2,21 г (72%) продукта. Масс-спектр: 349,0 МН+, 371,2 MNa+. г) Метиловый эфир 2-(((1,1-диметилэтокси)карбонил)амино)метил-5-фенилтиазол-4-карбонилметионина Промежуточный продукт 9в растворяли в метаноле (5 мл) и к раствору добавляли водный раствор NaOH (344 мг, 8,61 ммоль) в минимальном количестве H2O. Раствор перемешивали при 40oС в течение 1 ч и растворители удаляли при пониженном давлении. Остаток распределяли между EtOAc (20 мл) и 5%-ной лимонной кислотой (20 мл). Слой EtOAc сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Остаток растворяли в ТГФ (10 мл) и к раствору добавляли HOSu (330 мг, 2,87 ммоль), HCl-Met-OMe (573 мг, 2,87 ммоль), NMM (316 мг, 2,87 ммоль) и DCC (591 мг, 2,87 ммоль). Смесь перемешивали при комнатной температуре в течение ночи, фильтровали и концентрировали при пониженном давлении. Остаток растворяли в EtOAc (25 мл) и промывали один раз в 5%-ном растворе лимонной кислоты и два раза в насыщенном растворе NaHCO3. Раствор сушили над MgSO4, фильтровали и концентрировали при пониженном давлении, получая 590 мг (43%) продукта. Масс-спектр: 502,2 MNa+, 480,4 МН+. д) Метиловый эфир 2-(((2-(((1,1-диметилэтокси)карбонил)амино)-1-оксо-3-(трифенилметилтио)пропил)амино)метил)-5-фенилтиазол-4-карбонилметионина Промежуточный продукт 9г (590 мг, 1,23 ммоль) обрабатывали Реагентом В (10 мл) в течение 15 мин при комнатной температуре в атмосфере азота. Растворители удаляли при пониженном давлении. Остаток растирали два раза с 15 мл Et2O и декантировали. Остаток затем растворяли в ТГФ (10 мл) и добавляли к смешанному ангидриду, генерированному из Boc-Cys(Trt)-OH (570 мг, 1,23 ммоль), NMM (135 мкл, 1,23 ммоль) и iBuOCOCl (160 мкл, 1,23 ммоль) при -20oС в атмосфере азота в течение 5 мин. NММ (135 мкл, 1,23 ммоль) добавляли к смеси, которой затем давали нагреться до комнатной температуры. Растворители удаляли при пониженном давлении. Остаток растворяли в ЕtOАс (25 мл) и промывали 25 мл H2O и 25 мл 5%-ным раствором лимонной кислоты. Раствор сушили над MgSO4 и концентрировали, получая 1,01 г (100%) белой пены. е) 2-(((2-амино-1-оксо-3-меркаптопропил)амино)метил)-5-фенилтиазол-4-карбонилметионин (соединение 9) Промежуточный продукт 9д (250 мг, 0,30 ммоль) растворяли в МеОН (2 мл). К раствору добавляли NaOH (40 мг), растворенный в минимальном количестве Н2О. Раствор перемешивали в течение ночи при комнатной температуре. Растворители удаляли при пониженном давлении и остаток растворяли в реагенте В (10 мл). Раствор перемешивали в течение 15 мин при комнатной температуре в атмосфере азота и затем концентрировали при пониженном давлении. Остаток очищали ВЭЖХ с обращенной фазой. Фракции продукта объединяли и лиофилизовали, получая 32 мг (20%) соединения 9 в виде белого твердого вещества. Масс-спектр: 469 МН+. Пример 10 Бис-1,1′-[2-амино-3-(8-бутил-2-(2-метоксифенил)-5,6,7,8-тетрагидроимидазо[1,2-а]пиразин-7-ил)-3-оксопропил]дисульфид (соединение 10) Промежуточный продукт 3д (300 мг, 0,41 ммоль) растворяли в метаноле и добавляли H2O (0,3 мл). Добавляли раствор иода (104 мг, 0,41 ммоль) в метаноле (3 мл) и смесь перемешивали в течение 2 ч. Растворители удаляли при пониженном давлении и остаток растирали с гексаном (2 х 5 мл). Остаток затем растворяли в EtOAc (5 мл) и промывали 5%-ным раствором Na2S2O3 (10 мл). Органический слой сушили над Na2SO4, фильтровали и концентрировали до образования стеклообразной массы. Стеклообразную массу обрабатывали смесью ТФУ:Н2О:iPr3SiH, 93:5:2, в течение 15 мин в атмосфере N2. Растворители удаляли при пониженном давлении и остаток очищали ВЭЖХ с обращенной фазой и лиофилизовали. Выход – 48 мг (25%). Масс-спектр: 775,4 МН+, 388,5 М2H++. ЯМР (DMSO-d6) (смесь конформеров приблизительно 5:1) 8,5-9,0 (3Н, с), 8,0- 8,2 (1Н, д), 7,5-7,7 (1H, с), 7,1-7,3 (1Н, т), 7,0-7,1 (1H, д), 6,9-7,1 (1H, т), 5,2-5,6 (1H, т), 4,8-5,0 (1H, т), 3,6-4,7 (1H, м), 3,8-4,0 (3Н, с), 3,2-3,5 (2Н, м), 1,8-2,2 (2Н, м), 1,2-1,7 (4Н, м), 0,8-1,0 (3Н, т). Пример 11 7-(2-амино-1-оксо-3-тиопропил)-2-(2-метоксифенил)-8-(2-метилпропил)-5,6,7,8-тетрагидроимидазо[1,2а]пиразин (соединение 11) Соединение 11 получали способом, аналогичным способу примера 3, за исключением того, что Воc-L-лейцин использовали вместо Сbz-(L)-норлейцина в стадии а) и Вос-группу отщепляли смесью ТФУ/Н2, 9:1, вместо каталитического гидрирования в стадии в). Масс-спектр: 389,1 МН+. ЯМР (300 МГц, DMSO-d6) 8,6-8,8 (3Н, с), 8,1-8,2 (1Н, д), 7,9-8,1 (1Н, с), 7,3-7,5 (1Н, т), 7,1-7,3 (1Н, д), 7,0-7,1 (1Н, т), 5,9-6,1 (1Н, д), 4,7-4,8 (1Н, с), 4,5-4,7 (1Н, д), 4,3-4,4 (1Н, д), 4,1-4,3 (1Н, т), 3,9-4,0 (3Н, с), 3,8-4,0 (1Н, т), 3,3-3,5 (1Н, т), 2,8-3,1 (2Н, м), 1,9-2,2 (2Н, м), 1,7-1,8 (1Н, м), 1,0-1,2 (3Н, т), 0,8-1,0 (3Н, т). Пример 12 Бис-1,1′-[2-амино-3-(2-(2-метоксифенил)-8-(2-метилпропил)5,6,7,8-тетрагидроимидазо[1,2-а]пиразин-7-ил)-3-оксопропил]дисульфид (соединение 12) Соединение 12 получали способом, аналогичным способу примера 10, за исключением того, что промежуточный продукт 11е использовали вместо промежуточного продукта 3д. Масс-спектр: 388,5 М2Н++, 775,4 МН+. ЯМР (300 МГц, DMSO-d6) 8,7-9,2 (3Н, с), 8,1-8,2 (1Н, д), 7,9-8,1 (1H, с), 7,3-7,5 (1Н, т), 7,1-7,3 (1H, д), 7,0-7,2 (1Н, т), 5,9-6,1 (1Н, д), 4,8-5,0 (1Н, с), 4,5-4,7 (1Н, д), 4,3-4,5 (1Н, д), 4,1-4,4 (1Н, т), 3,8-4,1 (1Н, м), 3,8-4,0 (3Н, с), 3,2-3,5 (2Н, м), 1,8-2,2 (2Н, м), 1,7-1,9 (1Н, м), 1,0-1,2 (3Н, д), 0,8-1,0 (3Н, д). Пример 13 7-(2-амино-1-оксо-3-тиопропил)-8-бутил-2-(2-этоксифенил)-5,6,7,8-тетрагидроимидазо[1,2а]пиразин (соединение 13) а) Промежуточный продукт 3в (2,54 г, 8,50 ммоль) растворяли в ТГФ (15 мл) и по каплям в течение 10 мин при комнатной температуре добавляли 1 М раствор борана в ТГФ (34,0 мл, 34,0 ммоль). Смесь кипятили с обратным холодильником в течение 2 ч и оставляли стоять при комнатной температуре в течение ночи. По каплям добавляли 4 н. НСl (25 мл) и получаемую смесь нагревали для кипячения с обратным холодильником в течение часа. Смесь концентрировали до получения раствора в H2O, подщелачивали осторожным добавлением твердого NaHCO3 и экстрагировали EtOAc (2 х 25 мл). Слои EtOAc сушили над Na2SO4 и концентрировали до масла. Добавляли 5%-ный раствор НСl (25 мл) и смесь концентрировали до получения твердого продукта. Твердый продукт перекристаллизовывали из метанола и этилового эфира, получая 2,72 г (89,5%) дигидрохлоридной соли. Масс-спектр: 286,2. Т.пл.=242-247oС. б) Промежуточный продукт 13а (850 мг, 2,37 ммоль) распределяли между СН2Сl2 и насыщенным раствором NaHCO3, слой СН2Сl2 сушили над Na2SO4 и фильтровали. Добавляли 1 М раствор ВВr3 в СН2Сl2 и получаемую смесь нагревали для кипячения с обратным холодильником в течение 1 ч. Реакционную смесь охлаждали и выливали в насыщенный раствор NaHCO3 (25 мл). Слой СН2Сl2 сушили над Na2SO4 и фильтровали. Добавляли ди(трет-бутил)дикарбонат (523 мг, 2,40 ммоль) и смесь перемешивали при комнатной температуре от субботы до понедельника. Растворители выпаривали и получаемое масло очищали колоночной хроматографией на силикагеле, используя в качестве элюента смесь гексан/этилацетат, 70:30. Выход = 700 мг (80%) прозрачного масла. Масс-спектр: 372,2 (МН+). ЯМР в) Защищенный промежуточный продукт (13б) (600 мг, 1,62 ммоль) растворяли в ТГФ (10 мл) и по каплям добавляли к раствору NaH (60% в масле, 120 мг, 3,0 ммоль) в ТГФ (10 мл) при комнатной температуре в атмосфере азота. Реакционную смесь перемешивали 15 мин и добавляли этилиодид (400 мкл, 5,0 ммоль). Смесь перемешивали в течение ночи при комнатной температуре, затем концентрировали при пониженном давлении. Добавляли насыщенный раствор NaHCO3 (10 мл) и продукт экстрагировали этиловым эфиром (2 х 20 мл). Эфир выпаривали и остаток очищали колоночной хроматографией на силикагеле с использованием в качестве элюента смеси гексан/этилацетат, 3:1. Выход = 410 мг (64%) простого эфира. Масс-спектр: 400,3 (МН+). Т.пл. = 103-109oС. г) Промежуточный продукт (13в) обрабатывали 90% ТФУ/Н2О (2 мл) в течение 0,5 ч и концентрировали для удаления Вос-группы. Связывание с Boc-(L)-Cys(Trt)-OH и удаление защитной группы выполняли способом, аналогичным примеру 1д и 1е, соответственно, получая соединение 13. Масс-спектр: 403,2 (МН+). ЯМР (300 МГц, DMSO-d6) 8,4-8,7 (3Н, ушир.с), 7,9-8,0 (1Н, с), 7,75-7,9 (1H, д), 7,15-7,3 (1Н, т), 7,0-7,1 (1H, д), 6,85-7,0 (1H, т), 5,7-5,85 (1H, м), 4,65-4,8 (1H, ушир.с), 4,45-4,6 (1H, д), 4,3-4,4 (1H, дд) 4,1-4,25 (1H, м), 3,75-3,95 (1H, м), 3,1-3,3 (1H, м), 2,8-3,1 (2Н, м), 1,9-2,15 (2Н, м), 1,2-1,5 (4Н, м), 0,8-1,0 (3Н, т). Пример 14 7-(2-амино-1-оксо-3-тиопропил)-8-бутил-2-(2-гидроксифенил-5,6,7,8-тетрагидроимидазо[1,2а]пиразин (соединение 14) а) Промежуточный продукт 13а (179 мг, 0,50 ммоль) распределяли между СН2Сl2 и насыщенным раствором NaHCO3, слой СН2Сl2 сушили над Na2SO4 и фильтровали. Добавляли 1 М раствор ВВr3 в СН2Сl2 и получаемую смесь нагревали при кипячении с обратным холодильником в течение 1 ч. Реакционную смесь охлаждали и выливали в насыщенный раствор NaHCO3 (25 мл). Слой СН2Сl2 сушили над Na2SO4, фильтровали и выпаривали, получая сырой деметилированный продукт в виде смолы. Этот материал использовали без дальнейшей очистки. б) Связывание (14а) с Boc-(L)-Cys(Trt)-OH и удаление защитной группы выполняли способом, аналогичным примеру 1д и 1е, соответственно, получая соединение 14. Масс-спектр: 403,2 (МН+). ЯМР (300 МГц, DMSO-d6) 8,55-8,8 (3Н, ушир.с), 8,1-8,2 (1H, д), 7,85-7,95 (1H, с), 7,35-7,45 (1H, т), 7,15-7,25 (1H, д), 7,0-7,15 (1H, т), 5,85-6,0 (1H, дд), 4,65-4,8 (1H, ушир. с), 4,55-4,7 (1Н, дд), 4,15-4,3 (2Н, кв), 4,1-4,2 (1Н, м), 3,8-3,95 (1Н, м), 3,3-3,5 (1Н, т), 2,15-2,3 (1Н, м), 1,95-2,15 (1Н, м), 1,4-1,5 (3Н, т), 1,2-1,5 (4Н, м), 0,8-1,0 (3Н, т). Пример 15 2-(1-(N-(2-амино-1-оксо-3-тиопропил)-N-метил)аминопентил-5-(2-метоксифенил)имидазол (соединение 15) Соединение 15 получали способом, аналогичным примеру 8, за исключением того, что в стадии 1а 2-бром-2′-метоксиацетофенон использовали вместо 2-бромацетофенона. Масс-спектр: 377,1 МН+, ЯМР (300 МГц, СD3СО2D) 7,8-7,9 (1Н, с), 7,65-7,75 (1Н, дд), 7,4-7,55 (1Н, м), 7,14-7,2 (1Н, д), 7,05-7,14 (1Н, т), 5,6-5,8 (1Н, т), 4,8-4,9 (1Н, т), 3,9-4,0 (3Н, с), 3,25-3,35 (3Н, с), 3,05-3,25 (2Н, м), 2,2-2,4 (2Н, м), 1,2-1,6 (4Н, м), 0,8-1,0 (3Н, т). Пример 16 Бис-1,1′-[2-амино-3(N-(1-(5-(2-метоксифенил)имидазол-2-ил)-пент-2-ил)-N-метиламино)-3-оксопропил]дисульфид (соединение 16) Соединение 16 получали способом, аналогичным примеру 10, за исключением того, что соединение 15 использовали вместо промежуточного продукта 3д. Масс-спектр: 751,5 (МН+). ЯМР (300 МГц, СD3СО2D) 7,75-7,85 (1Н, с), 7,65-7,75 (1H, ДД), 7,35-7,5 (1Н, М), 7,1-7,2 (1H, д), 7,0-7,1 (1Н, т), 5,5 -5,6 (1Н, т), 4,8-4,95 (1Н, т), 3,9-4,1 (3Н, с), 3,3-3,5 (2Н, м), 3,2-3,3 (1Н, с), 2,2-2,4 (2Н, м), 2,0-2,2 (сигнал ацетата), 1,2-1,6 (4Н, м), 0,8-1,0 (3Н, т). Пример 17 7-(2-амино-1-оксо-3-тиопропил)-8-(2-метилпропил)-2-(1-нафтил)-5,6,7,8-тетрагидроимидазо[1,2а]пиразин (соединение 17) а) 1′-ацетонафтон (10,2 г, 60,0 ммоль) и 0,1 мл концентрированной НСl растворяли в уксусной кислоте (100 мл) и по каплям при перемешивании в течение периода 3 ч добавляли бром (9,6 г, 60,0 ммоль). Реакционную смесь концентрировали при пониженном давлении и сушили до постоянного веса. Продукт использовали без дальнейшей очистки. б) Соединение 17 получали способом, аналогичным примеру 1, за исключением того, что Cbz-(L)-лейцин использовали вместо Сbz-(L)-норлейцина, промежуточный продукт 17а использовали вместо 2-бромацетофенона в стадии 1а и 1 М ВН3/ТГФ использовали для восстановления лактамного промежуточного продукта в стадии г). Масс-спектр: 409,2 МН+. ЯМР (300 МГц, DMSO-d6) 8,5-8,9 (3Н, с), 8,1-8,25 (1Н, д), 7,9-8,15 (3Н, м), 7,7-7,8 (1Н, д), 7,5-7,7 (3Н, м), 5,8-6,1 (1Н, д), 4,7-4,85 (1Н, с), 4,55-4,75 (1H, д), 4,2-4,45 (2Н, м), 3,85-4,05 (1H, м), 3,0-3,4 (10Н, Н2O), 2,9-3,1 (2Н, кв), 1,9-2,2 (1H, т), 1,7-1,9 (2Н, м), 1,0-1,2 (3Н, д), 0,8-1,0 (3Н, д). Пример 18 7-(2-амино-1-оксо-3-тиопропил)-8-(1-метилпропил)-2-(2-метоксифенил)-5,6,7,8-тетрагидроимидазо[l,2а]пиразин (соединение 18) Соединение 18 получали способом, аналогичным примеру 3, за исключением того, что Сbz-(L)-изолейцин использовали вместо Сbz-(L)-норлейцина в стадии а). Масс-спектр: 389,3 МН+. ЯМР (300 МГц, DMSO-d6) 8,5-8,9 (3Н, с), 8,05-8,2 (1Н, д), 7,9-8,05 (1Н, с), 7,35-7,5 (1Н, т), 7,15-7,25 (1Н, д), 7,0-7,15 (1Н, т), 5,65-5,85 (1Н, д), 4,65-4,8 (1Н, с), 4,5-4,65 (1Н, дд), 4,3-4,45 (1Н, дд), 3,9-4,0 (3Н, с), 3,8-4,0 (1Н, м), 3,2-3,7 (8Н, Н2O), 2,8-3,0 (2Н, м), 2,2-2,4 (1Н, м), 1,4-1,6 (1H, м), 1,15-1,35 (1Н, М), 1,0-1,15 (3Н, д), 0,8-0,95 (3Н, т). Пример 19 Бис-1,1′-[2-амино-3-(2-(1-нафтил)-8-(2-метилпропил)-5,6,7,6-тетрагидроимидазо[1,2-а]пиразин-7-ил)-3-оксопропил]дисульфид (соединение 19) Соединение 19 получали способом, аналогичным примеру 10, за исключением того, что соединение 17 использовали вместо промежуточного продукта 3д. Масс-спектр: 815,5 МН+. ЯМР (300 МГц, DMSO-d6) 8,7-9,2 (3Н, с), 8,15-8,3 (1H, с), 8,0-8,1 (2Н, м), 7,85-8,0 (1H, с), 7,7-7,8 (1H, д), 7,5-7,7 (3Н, м), 5,8-6,0 (1Н, с), 4,8-5,0 (1Н, с), 4,5-4,54 (1Н, д), 4,4-4,5 (1Н, д), 4,2-4,4 (1Н, т), 3,9-4,1 (1Н, т), 3,0-3,9 (12 Н, м Н2O затемняет сигнал), 2,0-2,2 (1Н, т), 1,7-2,0 (2Н, м), 1,0-1,2 (3Н, д), 0,85-1,0 (3Н, д). Пример 20 Бис-1,1′-[2-амино-3-(2-(метоксифенил)-8-(1-метилпропил)-5,6,7,8-тетрагидроимидазо[1,2-а]пиразин-7-ил)-3-оксопропил]дисульфид (соединение 20) Соединение 20 получали способом, аналогичным примеру 10, за исключением того, что соединение 18 использовали вместо промежуточного продукта 3д. Масс-спектр: 775,5 МН+. ЯМР (300 МГц, DMSO-d6) 8,7-9,0 (3Н, с), 8,05-8,15 (1Н, д), 7,9-8,1 (1Н, с), 7,35-7,5 (1Н, т), 7,15-7,25 (1Н, д), 7,0-7,15 (1Н, т), 5,65-5,85 (1Н, д), 4,8-5,0 (1Н, с), 4,45-4,6 (1Н, д), 4,35-4,5 (1Н, д), 4,2-4,35 (1Н, м), 3,8-4,1 (1Н, м), 3,8-3,9 (3Н, с), 3,4-3,8 (10Н, Н2O), 3,2-3,4 (2Н, д), 2,2-2,4 (1Н, м), 1,4-1,65 (1Н, м), 1,15-1,35 (1Н, м), 1,0-1,15 (3Н, д), 0,8-0,95 (3Н, т). Пример 21 S-(диметилэтил)-S’-[2-амино-3-оксо-3-(8-бутил-2-(2-метоксифенил)-5,6,7,8-тетрагидроимидазо[1,2а]пиразин-7-ил)пропил]дисульфид (соединение 21) Соединение 21 получали способом, аналогичным примеру 3, за исключением того, что Fmoc-(L)-Cys(tBus)-OH использовали в стадии д) и конечное удаление защитной группы выполняли обработкой трис(аминоэтил)амином (1,5 мл на ммоль) в СН2Сl2 (10 мл на ммоль) в течение 0,5 ч при комнатной температуре. Продукт очищали препаративной колоночной хроматографией с обращенной фазой, получая чистое соединение 21. Масс-спектр: 477,3 МН+. ЯМР (300 МГц, DMSO-d6, 90oС) 8,0-8,1 (1Н, д), 7,4-7,5 (1Н, с), 7,1-7,3 (1Н, т), 7,0-7,1 (1Н, д), 6,9-7,0 (1Н, т), 5,4-5,55 (1Н, с), 4,3-4,7 (1Н, м), 4,1-4,3 (1Н, д), 3,8-4,1 (7Н, м), 3,0-3,2 (2Н, М+Н2O), 2,8-2,9 (1Н, дд), 2,1-2,3 (2Н, м), 1,7-2,1 (2Н, м), 1,2-1,7 (13Н, м), 0,8-1,0 (3Н, т). Пример 22 7-(2-амино-1-оксо-3-тиопропил)-8-бутил-2-(2-метилфенил)-5,6,7,8-тетрагидроимидазо[1,2а]пиразин (соединение 22) а) 2′-метилацетофенон (25,0 г, 186 ммоль) растворяли в ледяной уксусной кислоте (250 мл) и добавляли концентрированную НСl (250 мкл) и затем по каплям в течение 15 мин добавляли бром (9,6 мл, 186 ммоль). Смесь перемешивали 3 ч и затем концентрировали при пониженном давлении. Остаток растворяли в этиловом эфире, промывали насыщенным раствором NaHCO3. Эфирный слой сушили над Na2SO4, фильтровали и концентрировали, получая 38,0 г (96%) сырого 2-бром-2′-метилацетофенона, который использовали без дальнейшей очистки. б) Соединение 22 получали способом, аналогичным примеру 3, за исключением того, что 2-бром-2′-метилацетофенон использовали вместо 2-бром-2′-метоксиацетофенона в стадии а). Масс-спектр: 373,2 МН+. ЯМР (300 МГц, DMSO-d6) 8,6-8,8 (3Н, с), 7,9-8,0 (1H, с), 7,6-7,75 (1H, д), 7,3-7,5 (3Н, м), 5,8-6,0 (1H, дд), 4,7-4,8 (1H, с), 4,55-4,7 (1H, д), 4,3-4,44 (1H, дд), 4,1-4,3 (1H, м), 3,8-4,0 (1H, м), 3,4-3,55 (1H, т), 2,85-3,1 (2Н, м), 2,4-2,5 (3Н, с), 2,0-2,3 (2Н, м), 1,2-1,6 (4Н, м), 0,8-1,0 (3Н, т). Пример 23 Бис-1,1′-[2-амино-3-(2-(2-метилфенил)-8-бутил-5,6,7,8-тетрагидроимидазо[1,2-а]пиразин-7-ил)-3-оксопропил]дисульфид (соединение 23) Соединение 23 получали способом, аналогичным примеру 10, за исключением того, что соединение 23 использовали вместо промежуточного продукта 3д. Масс-спектр, 743,4 МН+. ЯМР (300 МГц, DMSO-d6, 90oС) 7,6-7,8 (1H, д), 7,2-7,3 (1H, с), 7,0- 7,2 (3Н, М), 5,3-5,6 (1H, ушир.с), 4,3-4,8 (1H, ушир.с), 3,5-4,2 (4Н, м), 3,0-3,3 (2Н, ушир. с), 2,8-3,0 (1H, м), 2,4-2,5 (3Н, с), 2,1-2,4 (2Н, ушир.с), 1,7-2,1 (2Н, м), 1,2-1,7 (4Н, м), 0,8-1,0 (3Н, т). Пример 24 7-(2-амино-1-оксо-3-тиопропил)-8-(1,1-диметилэтил)-2-(2-метоксифенил)-5,6,7,8-тетрагидроимидазо[1,2а]пиразин (соединение 24) Соединение 24 получали способом, аналогичным примеру 3, за исключением того, что Воc-(L)-лейцин использовали вместо Сbz-(L)-норлейцина в стадии а) и удаление защитной группы выполняли в стадии в) обработкой трифторуксусной кислотой в течение 0,5 ч. Масс-спектр: 389,3 МН+. ЯМР (300 МГц, DMSO-d6) 8,5-8,8 (3Н, ушир.с), 7,95-8,1 (1Н, д), 7,9-8,0 (1Н, с), 7,3-7,5 (1Н, т), 7,1-7,25 (1Н, д), 7,0-7,15 (1Н, т), 5,55-5,7 (1Н, с), 4,65-4,8 (1Н, ушир.с), 4,5-4,6 (1Н, м), 4,35-4,5 (1Н, м), 4,1-4,3 (1Н, м), 3,9-4,1 (1Н, м), 3,85 -3,95 (3Н, с), 3,3-3,4 (1Н, т), 2,7-3,41 (2Н, м), 1,0-1,2 (9Н, с). Пример 25 7-(2-амино-1-оксо-3-тиопропил)-8-(1-метилпропил)-2-(2-(фенилметокси)фенил)-5,6,7,8-тетрагидроимидазо[1,2а]пиразин (соединение 25) а) Промежуточный продукт 18г (3,36 г, 11,8 ммоль) растворяли в 10 мл CH2Cl2 и по каплям добавляли 1 М раствор ВВr3 в CH2Cl2 (47 мл). Смесь нагревали при кипячении с обратным холодильником в течение 2 ч, охлаждали и выливали в насыщенный раствор NаНСО3 (25 мл). Водный слой экстрагировали три раза CH2Cl2 (60 мл), сушили над Na2SO4, фильтровали и концентрировали до 30 мл. Добавляли ди(трет-бутил)дикарбонат (2,57 г, 11,8 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение ночи. Сырой продукт очищали колоночной хроматографией на силикагеле с использованием в качестве элюента смеси этилацетат:гексан 1:1. Выход был 3,31 г (75%) белого твердого продукта. б) Промежуточный продукт 25а (850 мг, 2,29 ммоль) растворяли в ТГФ (20 мл), который содержал гидрид натрия (96,1 мг, 2,4 ммоль), и смесь обрабатывали бензилбромидом (292 мкл, 2,4 ммоль) а атмосфере N2 при комнатной температуре. Реакционную смесь перемешивали в течение ночи при комнатной температуре и концентрировали. Остаток распределяли между CH2Cl2 (30 мл) и Н2О (15 мл). Слой CH2Cl2 сушили над Na2SO4, фильтровали и концентрировали. Кристаллизация из этилового эфира и гексана давала 887 мг (83,7%) продукта. в) Промежуточный продукт 25б (887 мг, 1,92 ммоль) обрабатывали 90% ТФУ/Н2О (50 мл) в течение 15 мин при комнатной температуре в атмосфере N2. Растворители удаляли при пониженном давлении и остаток распределяли между CH2Cl2 и насыщенным раствором NаНСО3. Слой CH2Cl2 сушили над Na2SO4, фильтровали и концентрировали. Сырой промежуточный продукт ацилировали способом, аналогичным примеру 1, стадия 1д, и затем освобождали от защитной группы способом, аналогичным примеру 1, стадия е. Масс-спектр: 465,3 МН+. ЯМР (300. МГц, DMSO-d6) 8,3-8,8 (3Н, ушир.с), 8,0-8,1 (1Н, дд), 7,8-8,0 (1Н, с), 7,45-7,55 (2Н, м), 7,3-7,45 (4Н, м), 7,15-7,3 (1Н, д), 7,0-7,15 (1Н, т), 5,6-5,8 (1Н, д), 5,3-5,4 (2Н, с), 4,65-4,8 (1Н, ушир.с), 4,45-4,6 (1H, м), 4,25-4,4 (1H, м), 4,1-4,25 (1H, м), 3,75-3,95 (1H, м), 3,25-3,4 (1Н, т), 2,8-3,0 (2Н, м), 2,15-2,4 (1Н, м), 1,4-1,6 (1Н, м), 1,1-1,35 (1Н, м), 0,95-1,1 (3Н, д), 0,8-1,0 (3Н, т). Пример 26 7-(2-амино-1-оксо-3-тиопропил)-8-(циклогексилметил)-2-(2-метоксифенил)-5,6,7,8-тетрагидроимидазо[1,2a]пиразин (соединение 26) а) Раствор H-(L)-Phe-OH (10,0 г, 60,6 ммоль) в уксусной кислоте (60 мл) и 5%-ной водной НСl (60 мл) гидрировали над PtO2 (430 мг) до тех пор, пока водород больше не потреблялся. Растворители удаляли при пониженном давлении и остаток растворяли в метаноле (50 мл) и Н2О (20 мл). При энергичном перемешивании добавляли 10%-ный раствор NaOH до достижения рН 4,4, раствор охлаждали и продукт отделяли фильтрованием и промывали H2O. б) Сырой промежуточный продукт 26а (60,6 ммоль) суспендировали в 100 мл H2O, содержащей К2СО3 (8,36 г, 60,6 ммоль), и при энергичном перемешивании в течение 45 мин при комнатной температуре добавляли раствор Cbz-Osu (15,1 г, 60,6 ммоль) в CH3CN (150 мл). CH3CN отгоняли при пониженном давлении и водный слой промывали этиловым эфиром. Водный слой подкисляли концентрированной НСl до рН 1 и продукт экстрагировали этилацетатом (2 х 50 мл). Слои этилацетата сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении, получая 17,27 г (93%) Сbz-(L)-циклогексилаланина (26б). в) Соединение 26 получали способом, аналогичным примеру 3, за исключением того, что Сbz-(L)-циклогексилаланин (26б) использовали вместо Сbz-(L)-норлейцина в стадии а). Масс-спектр: 429,3 (МН+). ЯМР (300 МГц, DMSO-d6) 8,6-8,9 (3Н, с), 8,1-8,3 (1Н, дд), 7,9-8,1 (1Н, с), 7,35-7,5 (1Н, м), 7,15-7,25 (1Н, д), 7,05-7,15 (1Н, т), 6,0-6,1 (1Н, т), 4,7-4,8 (1Н, м), 4,55-4,7 (1Н, м), 4,3-4,45 (1Н, м), 4,1-4,3 (1Н, м), 3,9-4,0 (3Н, с), 3,8-3,95 (1Н, м), 3,35-3,5 (1Н, т), 2,8-3,1 (2Н, м), 2,05-2,2 (1Н, д), 1,9-2,1 (2Н, т), 0,8-1,7 (10Н, м). Пример 27 7-(2-амино-1-оксо-3-тиопропил)-2-(2-метоксифенил)-8-(1-метилэтил)-5,6,7,8-тетрагидроимидазо[1,2а]пиразин (соединение 27) Соединение 27 получали способом, аналогичным примеру 3, за исключением того, что Сbz-(L)-валин использовали вместо Сbz-(L)-норлейцина в стадии а). Масс-спектр: 375,1 МН+. ЯМР (300 МГц, DMSO-d6) 8,6-8,8 (3Н, ушир.с), 8,1-8,3 (1Н, д), 8,0-8,1 (1Н, с), 7,35-7,5 (1Н, т), 7,15-7,25 (1Н, д), 7,05-7,15 (1Н, т), 5,6-5,8 (1H, д), 4,65-4,8 (1Н, ушир.с), 4,5-4,7 (1H, м), 4,3-4,45 (1H, м), 4,1-4,3 (1H, м), 3,9-4,0 (3Н, с), 3,8-3,95 (1H, м), 3,35-3,5 (1H, т), 2,8-3,05 (2Н, м), 2,5-2,7 (1H, м), 1,1-1,2 (3Н, д), 0,9-1,05 (3Н, д). Пример 28 Бис-1,1′-[2-амино-3-(2-метоксифенил)-8-(1-метилэтил)5,6,7,8-тетрагидроимидазо[1,2-а]пиразин-7-ил)-3-оксопропил]дисульфид (соединение 28) Соединение 28 получали способом, аналогичным примеру 10, за исключением того, что соединение 27 использовали вместо промежуточного продукта 3д. Масс-спектр: 747,4 МН+. ЯМР (300 МГц, DMSO-d6) 8,8-9,0 (3Н, ушир.с), 8,05-8,2 (1Н, д), 7,9-8,1 (1Н, с), 7,35-7,5 (1Н, т), 7,15-7,25 (1Н, д), 7,0-7,15 (1Н, т), 5,55-5,75 (1Н, ушир. с), 4,8-5,0 (1Н, ушир.с), 4,45-4,65 (1Н, м), 4,35-4,5 (1Н, м), 4,2-4,35 (1Н, м), 3,85-3,95 (3Н, с), 3,9-4,05 (1Н, м), 3,2-3,4 (2Н, д), 2,45-2,65 (1Н, м частично затемненный растворителем), 1,05-1,2 (3Н, д), 0,9-1,05 (3Н, д). Пример 29 7-(2-амино-1-оксо-3-тиопропил)-8-бутил-2-(2-гидрокси-6-метоксифенил)-5,6,7,8-тетрагидроимидазо[1,2а]пиразин (соединение 29) а) Бром (3,19 мл, 61,9 ммоль) добавляли по каплям в течение 20 мин к смеси 2′, 6′-диметоксиацетофенона (11,15 г, 61,9 ммоль) и концентрированной НСl (100 мкл) в уксусной кислоте (50 мл). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч, растворители выпаривали при пониженном давлении. Остаток растворяли в этилацетате (100 мл) и промывали насыщенным раствором NаНСО3 (100 мл) и насыщенным раствором NaCl (100 мл). Слой этилацетата сушили над Na2SO4, фильтровали и концентрировали до масла (14,9 г). Кристаллизация из этилацетата и гексана дает 4,87 г (30%) 2-бром-2′,6′-диметоксиацетофенона (29а). б) Соединение 29 получали способом, аналогичным примеру 3, за исключением того, что 2-бром-2′,6′-диметоксиацетофенон (29а) использовали вместо 2-бромацетофенона в стадии а). Одна метальная эфирная группа эффективно отщепляется во время восстановления при помощи ВН3 лактама 29 г. Масс-спектр: 405,3. Пример 30 Бис-1,1′-[2-амино-3-(2-метоксифенил)-8-(1,1-диметилэтил)-5,6,7,8-тетрагидроимидазо[1,2-а]пиразин-7-ил)-3-оксопропил]дисульфид(соединение 30) Соединение 30 получали способом, аналогичным примеру 10, за исключением того, что соединение 24 использовали вместо промежуточного продукта 3д. Масс-спектр: 775,5 (МН+). ЯМР (300 МГц, DMSO-d6) 8,7-9,1 (3Н, ушир.с). 8,0-8,1 (1Н, д), 7,8-8,0 (1Н, с), 7,3-7,5 (1Н, т), 7,1-7,2 (1Н, д), 7,0-7,1 (1Н, т), 5,55-5,65 (1Н, с), 4,8-5,0 (1Н, с), 4,4-4,6 (2Н, м), 4,2-4,4 (1Н, м), 3,9-4,1 (1Н, м), 3,8-4,0 (3Н, с), 3,2-3,4 (2Н, д), 1,0-1,2 (9Н, с). Пример 31 2-(2-метоксифенил)-8-(1-метилпропил)-5,6,7,8-тетрагидро-7-((тиазолидин-4-ил)карбонил)имидазо[1,2а]пиразин (соединение 31) Соединение 31 получали способом, аналогичным примеру 18, за исключением того, что для связывания в стадии д) использовали Воc-(L)-тиапролин. Масс-спектр: 401,3 (МН+). ЯМР (300 МГц, DMSO-d6, 90oС) 8,0-8,2 (1Н, д), 7,85-8,0 (1Н, с), 7,3-7,5 (1Н, т), 7,15-7,25 (1H, д), 7,05-7,15 (1Н, т), 5,7-5,85 (1H, д), 4,75-5,0 (1H, с), 4,45-4,7 (1H, м), 4,3-4,45 (2Н, м), 4,15-4,3 (2Н, м), 3,9-4,0 (3Н, с), 3,8-3,95 (1H, м), 3,4-3,6 (1H, т), 3,1-3,25 (1H, м), 2,25-2,45 (1H, м), 1,4-1,6 (1H, м), 1,15-1,4 (1H, м), 1,0-1,23 (3Н, т), 0,8-1,0 (3Н, т). Антипролиферативная активность ингибиторов фарнезилтрансферазы на опухолевых клетках человека Испытания проводили с использованием либо карцином легких А-427 (экспрессирующих мутированный ген Ki-ras), аденокарцином ободочной кишки НТ-29 (экспрессирующих ген ras дикого типа), карцином легких Calu-1 (экспрессирующих мутированный ген Ki-ras) и панкреатических раковых клеток MIA-PaCa (экспрессирующих мутированный ген Ki-ras). Эти опухолевые клетки засевали на микропланшетах с 96 лунками в день 0 и сохраняли при 37oС в атмосфере с 5% CO2. В день 1 клетки обрабатывали повышаемыми концентрациями испытуемых соединений в диапазоне от 0 до 100 мкМ в течение 96 ч. В конце этого периода количественную оценку клеточной пролиферации проводили путем колориметрического анализа, основанного на отщеплении тетразолиевой соли WST-1 митохондриальными дегидрогеназами в жизнеспособных клетках, приводящего к образованию формазана (Cell Proliferation Reagent WST-1 Kit, Boehringer Mannheim, Germany). Эти эксперименты, проведенные с 8 повторами, повторяли два раза. Результаты, показанные в таблице, представляют диапазон концентраций (мкМ) испытуемого соединения, требуемых для ингибирования пролиферации по сравнению с контрольными клетками, в которые испытуемое соединение не добавляли. Должно быть понятно, что хотя данное изобретение было описано в связи с подробным описанием его, предшествующее описание предназначается для иллюстрации и не ограничивает объем изобретения, которое определяется объемом прилагаемой формулы изобретения. Другие аспекты, преимущества и модификации находятся в пределах формулы изобретения. Формула изобретения
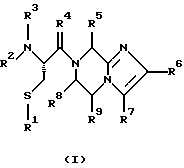 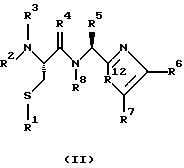 где R1 представляет Н, низший алкилтио или R1 вместе с R2 образуют -СН2-; каждый из R2 и R3 независимо представляет Н или низший алкил; R4 представляет О или Н2; R5 представляет Н, незамещенный низший алкил, циклогексил – низший алкил; каждый из R6 и R7 независимо представляет водород, фенил, нафтил, -C(O)-NHCHR13CO2R14, или замещенный фенил, где заместитель представляет собой галоген, низший алкил, низший алкокси, гидрокси, или фенил-низший алкокси; R8 представляет Н или низший алкил; R9 представляет Н или низший алкил; R12 представляет NR9 или S; R13 представляет низший алкилтио; R14 представляет Н или низший алкил; или их фармацевтически приемлемые соли, за исключением 4,5-бис(4-метоксифенил)-2-(4-тиазолидинилкарбонил-аминометил)тиазола и его гидрохлорида. 2. Соединения по п.1, имеющие формулу (I) 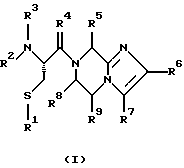 или их фармацевтически приемлемые соли. 3. Соединения по п.1, имеющие формулу (II) 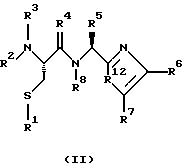 или их фармацевтически приемлемые соли. 4. Соединения по п.2, где каждый из R8 и R9, независимо представляет Н, или их фармацевтически приемлемые соли. 5. Соединения по п. 4, где R7 представляет Н, или их фармацевтически приемлемые соли. 6. Соединения по п.5, где R6 представляет незамещенный фенил или фенил, замещенный определенными в п.1 заместителями, или нафтил, и R5 представляет незамещенный низший алкил, или циклогексил-низший алкил, или их фармацевтически приемлемые соли. 7. Соединения по п.6, где каждый из R1, R2 и R3, независимо, представляет Н, или их фармацевтически приемлемые соли. 8. Соединения по п.7, где R6 представляет фенил, 1-нафтил или фенил, замещенный галогеном, низшим алкилом или низшим алкокси, и R5 представляет низший алкил, циклогексил-низший алкил или их фармацевтически приемлемые соли. 9. Соединения по п. 4, где R6 представляет Н, или их фармацевтически приемлемые соли. 10. Соединения по п.9, где R7 представляет замещенный или незамещенный фенил и R5 представляет незамещенный низший алкил, или их фармацевтически приемлемые соли. 11. Соединения по п.10, где каждый из R1, R2 и R3, независимо, представляет Н, или их фармацевтически приемлемые соли. 12. Соединения по п.3, где R8 представляет Н, или незамещенный низший алкил, или их фармацевтически приемлемые соли. 13. Соединения по п.12, где R6 представляет -C(O)NHCHR13CO2R14, или их фармацевтически приемлемые соли. 14. Соединения по п. 13, где R7 представляет незамещенный фенил, и R5 представляет Н или незамещенный низший алкил, или их фармацевтически приемлемые соли. 15. Соединение по п.14, где каждый из R1, R2 и R3, независимо, представляет Н, и R12 представляет S, или их фармацевтически приемлемые соли. 16. Соединения по п.15, где R7 представляет фенил, R8 представляет Н или низший алкил; R5 представляет низший алкил; R6 представляет -C(O)NHCH(CH2CH2SCH3)CO2R14, или их фармацевтически приемлемые соли. 17. Соединения по п.12, где R7 представляет Н, или их фармацевтически приемлемые соли. 18. Соединения по п. 17, где R6 представляет незамещенный фенил; R5 представляет Н или незамещенный низший алкил, или их фармацевтически приемлемые соли. 19. Соединения по п.18, где каждый из R1, R2 и R3, независимо, представляет Н; R12 представляет S, или их фармацевтически приемлемые соли. 20. Соединения по п.19, где R6 представляет фенил или фенил, замещенный низшим алкокси; R8 представляет Н или низший алкил; R7 представляет Н или -C(O)NHCHR13CO2R14, или их фармацевтически приемлемые соли. 21. Соединения по п.4, где R5 представляет незамещенный низший алкил, или циклогексил-низший алкил; R6 представляет незамещенный или замещенный, определенными в п.1 заместителями, фенил; R7 представляет замещенный или незамещенный фенил или нафтил. 22. Соединения по п.21, где каждый из R1, R2 и R3, независимо, представляет Н, или их фармацевтически приемлемые соли. 23. Соединения по п.22, где R5 представляет низший алкил или циклогексил-низший алкил, R6 представляет фенил, нафтил или фенил, замещенный галогеном, низшим алкилом или низшим алкокси; R7 представляет фенил, 1-нафтил или фенил, замещенный галогеном, низшим алкилом или низшим алкокси. 24. Соединение, выбираемое из группы соединений, содержащей: 7-(2-амино-1-оксо-3-тиопропил)-8-бутил-2-фенил-5,6,7,8-тетрагидроимидазо[1,2-а]пиразин; 7-(2-амино-1-оксо-3-тиопропил)-8-бутил-2-(4-фторфенил)-5,6,7,8-тетрагидроимидазо[1,2-а]пиразин; 7-(2-амино-1-оксо-3-тиопропил)-8-бутил-2-(2-метоксифенил)-5,6,7,8-тетрагидроимидазо[1,2-а]пиразин; 7-(2-амино-1-оксо-3-тиопропил)-8-бутил-2-(3-метоксифенил)-5,6,7,8-тетрагидроимидазо[1,2-а]пиразин; 7-(2-амино-1-оксо-3-тиопропил)-8-бутил-2-(4-метоксифенил)-5,6,7,8-тетрагидроимидазо[1,2-а]пиразин; 7-(2-амино-1-оксо-3-тиопропил)-8-(2-гидроксиэтил)-2-фенил-5,6,7,8-тетрагидроимидазо[1,2-а]пиразин; 7-(2-амино-3-тиопропил)-8-бутил-3-фенил-5,6,7,8-тетрагидроимидазо[1,2-а] пиразин; 2-(1-(N-(2-амино-1-оксо-3-тиопропил)-N-метил)-аминопентил)-5-фенилимидазол; 2-(((2-амино-1-оксо-3-меркаптопропил)амино)метил)-5-фенилтиазол-4-карбонилметионин; 7-(2-амино-1-оксо-3-тиопропил)-2-(2-метоксифенил)-8-(2-метилпропил)-5,6,7,8-тетрагидроимидазо[1,2-а]пиразин; 7-(2-амино-1-оксо-3-тиопропил)-8-бутил-2-(2-этоксифенил)-5,6,7,8-тетрагидроимидазо[1,2-а]пиразин; 7-(2-амино-1-оксо-3-тиопропил)-8-бутил-2-(2-гидроксифенил)-5,6,7,8-тетрагидроимидазо[1,2-а]пиразин; 2-(1-(N-(2-амино-1-оксо-3-тиопропил)-N-метил)амино)пентил-5-(2-метоксифенил)имидазол; 7-(2-амино-1-оксо-3-тиопропил)-8-(2-метилпропил)-2-(1-нафтил)-5,6,7,8-тетрагидроимидазо[1,2-а]пиразин; 7-(2-амино-1-оксо-3-тиопропил)-8-(1-метилпропил)-2-(2-метоксифенил)-5,6,7,8-тетрагидроимидазо[1,2-а]пиразин; S-(диметилэтил)-S’-[2-амино-3-оксо-3-(8-бутил-2-(2-метоксифенил)-5,6,7,8-тетрагидроимидазо[1,2-а]пиразин-7-ил)пропил]дисульфид; 7-(2-амино-1-оксо-3-тиопропил)-8-бутил-2-(2-метилфенил)-5,6,7,8-тетрагидроимидазо[1,2-а]пиразин; 7-(2-амино-1-оксо-3-тиопропил)-8-(1,1-диметилэтил)-2-(2-метоксифенил)-5,6,7,8-тетрагидроимидазо[1,2-а]пиразин; 7-(2-амино-1-оксо-3-тиопропил)-8-(1-метилпропил)-2-(2-(фенилметокси)фенил)-5,6,7,8-тетрагидроимидазо[1,2-а]пиразин; 7-(2-амино-1-оксо-3-тиопропил)-8-(циклогексилметил)-2-(2-метоксифенил)-5,6,7,8-тетрагидроимидазо[1,2-а]пиразин; 7-(2-амино-1-оксо-3-тиопропил)-2-(2-метоксифенил)-8-(1-метилэтил)-5,6,7,8-тетрагидроимидазо[1,2-а]пиразин; 7-(2-амино-1-оксо-3-тиопропил)-8-бутил-2-(2-гидрокси-6-метоксифенил)-5,6,7,8-тетрагидроимидазо[1,2-а]пиразин; 2-(2-метоксифенил)-8-(1-метилпропил)-5,6,7,8-тетрагидро-7-((тиазолидин-4-ил)карбонил)имидазо[1,2-а]пиразин, или его фармацевтически приемлемая соль. 25. Димерные соединения, состоящие из двух идентичных соединений (мономеров) формулы (I) или формулы (II), связанных через дисульфидную связь, образованную комбинацией R1 первого и R1 второго мономера, или их фармацевтически приемлемые соли. 26. Соединение по п.25, где это соединение представляет: бис-1,1′-[2-амино-3-(8-бутил-2-(2-метоксифенил)-5,6,7,8-тетрагидроимидазо[1,2-а]пиразин-7-ил)-3-оксопропил]дисульфид; бис-1,1′-[2-амино-3-(2-(2-метоксифенил)-8-(2-метилпропил)-5,6,7,8-тетрагидроимидазо[1,2-а]пиразин-7-ил)-3-оксопропил]дисульфид; бис-1,1′-[2-амино-3(N-(1-(5-(2-метоксифенил)имидазол-2-ил)-пент-2-ил)-N-метиламино)-3-оксопропил]дисульфид; бис-1,1′-[2-амино-3-(2-(1-нафтил)-8-(2-метилпропил)-5,6,7,8-тетрагидроимидазо[1,2-а]пиразин-7-ил)-3-оксопропил]дисульфид бис-1,1′-[2-амино-3-(2-(метоксифенил)-8-(1-метилпропил)-5,6,7,8-тетрагидроимидазо[1,2-а]пиразин-7-ил)-3-оксопропил]дисульфид; бис-1,1′-[2-амино-3-(2-(2-метилфенил)-8-бутил-5,6,7,8-тетрагидроимидазо[1,2-а]пиразин-7-ил)-3-оксопропил]дисульфид; бис-1,1′-[2-амино-3-(2-метоксифенил)-8-(1-метилэтил)-5,6,7,8-тетрагидроимидазо[1,2-а]пиразин-7-ил)-3-оксопропил]дисульфид; бис-1,1′-[2-амино-3-(2-метоксифенил)-8-(1,1-диметилэтил)-5,6,7,8-тетрагидроимидазо[1,2-а]пиразин-7-ил)-3-оксопропил]дисульфид или его фармацевтически приемлемую соль. 27. Способ ингибирования фарнезилтрансферазы на опухолевых клетках человека, отличающийся тем, что предусматривает введение пациенту эффективного количества соединения по п.1 или его фармацевтически приемлемой соли. 28. Способ ингибирования фарнезилтрансферазы на опухолевых клетках человека, отличающийся тем, что предусматривает введение пациенту эффективного количества соединения по п.25 или его фармацевтически приемлемой соли. РИСУНКИ
PC4A – Регистрация договора об уступке патента Российской Федерации на изобретение
Номер и год публикации бюллетеня: 21-2003
(73) Патентообладатель:
Дата и номер государственной регистрации перехода исключительного права: 23.05.2003 № 16758
Извещение опубликовано: 27.07.2003
TZ4A – Поправки к описаниям изобретений
Часть описания, где обнаружена ошибка: Текст опис., Кол. 71-72 Схема 1
Напечатано:
Следует читать:
Номер и год публикации бюллетеня: 10-2003
Извещение опубликовано: 27.05.2006 БИ: 15/2006
TZ4A – Поправки к описаниям изобретений
Часть описания, где обнаружена ошибка: Кол. 81-82 Схема 4
Напечатано:
Следует читать:
Номер и год публикации бюллетеня: 10-2003
Извещение опубликовано: 27.05.2006 БИ: 15/2006
PD4A – Изменение наименования обладателя патента СССР или патента Российской Федерации на изобретение
(73) Новое наименование патентообладателя:
Адрес для переписки:
Извещение опубликовано: 27.04.2010 БИ: 12/2010
MM4A Досрочное прекращение действия патента из-за неуплаты в установленный срок пошлины за
Дата прекращения действия патента: 15.02.2010
Дата публикации: 10.01.2011
|
||||||||||||||||||||||||||