Патент на изобретение №2201925
|
||||||||||||||||||||||||||
(54) ИНГИБИТОРЫ ПРЕНИЛТРАНСФЕРАЗ
(57) Реферат: Изобретение относится к соединения формулы I или формулы II, где R1 обозначает N(R10)(R11); R2 обозначает тио-низший алкил; каждый из R3 и R5, независимо, обозначает СН2 или С(О); R4 обозначает замещенный или незамещенный тионизший алкил, где заместителем является СН2NHC(O)R13 и он присоединен к указанной тиогруппе; R6 обозначает остаток синтетической гетероароматической  -аминокислоты; R7 обозначает остаток природной или синтетической -аминокислоты; R7 обозначает остаток природной или синтетической  -аминокислоты; R8 обозначает ОН или низшую алкокси или вместе с R7 образует гомосеринлактон; R9 обозначает Н; каждый из R10 и R11, независимо, представляет Н; R12 обозначает замещенный или незамещенный фрагмент, выбранный из арила, арилнизшего алкила, где заместителями являются один или несколько низших алкилов или галоген; R13 обозначает низший алкил; R18 обозначает Н; при условии, что если R4 обозначает незамещенный тионизший алкил, свободные тиогруппы из R2 и R4 могут образовывать дисульфидную связь; или его фармацевтически приемлемым солям. Соединения по изобретению обладают способностью ингибировать пренилтрансферазы. Описаны также фармацевтические композиции, включающие указанные соединения, а также способ ингибирования активности пренилтрансферазы. 4 с. и 18 з.п. ф-лы. -аминокислоты; R8 обозначает ОН или низшую алкокси или вместе с R7 образует гомосеринлактон; R9 обозначает Н; каждый из R10 и R11, независимо, представляет Н; R12 обозначает замещенный или незамещенный фрагмент, выбранный из арила, арилнизшего алкила, где заместителями являются один или несколько низших алкилов или галоген; R13 обозначает низший алкил; R18 обозначает Н; при условии, что если R4 обозначает незамещенный тионизший алкил, свободные тиогруппы из R2 и R4 могут образовывать дисульфидную связь; или его фармацевтически приемлемым солям. Соединения по изобретению обладают способностью ингибировать пренилтрансферазы. Описаны также фармацевтические композиции, включающие указанные соединения, а также способ ингибирования активности пренилтрансферазы. 4 с. и 18 з.п. ф-лы.
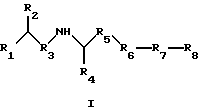 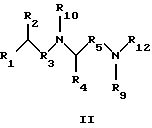
Предпосылки к созданию изобретения Семейство Ras белков является важным в модулирующем клеточный рост пути сигнальной трансдукции. Белок продуцируется в рибосоме, выделяется в цитозоль и посттрансляционно модифицируется. Первой стадией в ряду посттрансляционных модификаций является алкилирование Cys168 фарнезил- или геранилгеранилпирофосфатом в реакции, катализируемой ферментами пренилтрансферазы, такими как фарнезилтрансфераза и геранилгеранилтрансфераза (Hancock, JF, et al., Cell 57:1167-1177 (1989)). Впоследствии три С-концевые аминокислоты отщепляют (Gutierrez, L., et al., EMBO J. 8:1093-1098 (1989)) и концевой Cys превращают в сложный метиловый эфир (Clark, S., et al., Proc. Nat’1 Acad. Sci. (USA) 85:4643-4647 (1988)). Некоторые формы Ras также обратимо пальмитоилируют на остатках цистеина, непосредственно N-концевых к Cys168 (Buss, JE, et al. , Mol. Cell. Biol. 6:116-122 (1986)). Предполагается, что эти модификации повышают гидрофобность С-концевого региона Ras, заставляя его локализоваться на поверхности клеточной мембраны. Локализация Ras на клеточной мембране необходима для сигнальной трансдукции (Willumsen, BM, et al. , Science 310:583-586(1984)). Онкогенные формы Ras наблюдаются в относительно большом числе раковых заболеваний, включая свыше 50 процентов раковых заболеваний толстой кишки и свыше 90 процентов панкреатических раковых заболеваний (Bos, JL, Cancer Research, 49:4682-4689 (1989)). Эти наблюдения позволяют предположить, что вмешательство в функцию опосредуемой Ras сигнальной трансдукции может быть полезным в лечении рака. Ранее было обнаружено, что С-концевой тетрапептид Ras является мотивом “СААХ” (где С обозначает цистеин, А обозначает алифатическую аминокислоту и Х обозначает какую-либо аминокислоту). Было показано, что тетрапептиды, имеющие эту структуру, являются ингибиторами пренилтрансфераз (Reiss, et al., Cell 62: 81-88 (1990)). Слабая потенция этих прежних ингибиторов фарнезилтрансфераз побуждает искать новые ингибиторы с более благоприятным фармакокинетическим характером (James, GL, et al., Science 260:1937-1942 (1993); Kohl, NE, et al., Proc. Nat’1 Acad. Sci. USA 91:9141-9145 (1994); deSolms, SJ, et al. , J. Med. Chem. 38:3967-3971 (1995); Nagasu, Т, et al., Cancer Research 55: 5310-5314 (1995); Lerner, EC, et al., J. Biol. Chem. 270: 26802-26806 (1995); Lerner, EC, et al., J. Biol. Chem. 270:26770 (1995) и James et al., Proc. Nat’l Acad. Sci. USA 93:4454 (1996)). Недавно было обнаружено, что ингибитор пренилтрансферазы может блокировать рост Ras-зависимых опухолей у голых мышей (Kohl, NE, et al., Proc. Nat’1 Acad. Sci. USA 91:9141-9145 (1994)). Кроме того, было обнаружено, что свыше 70 процентов большого числа образцов линий опухолевых клеток подавляются ингибиторами пренилтрансферазы с большей селективностью, чем нетрансформированные эпителиальные клетки (Sepp-Lorenzino, I, et al., Cancer Research 55:5302-5309 (1995)). Краткое описание изобретения В одном аспекте изобретение относится к соединению формулы I или формулы II 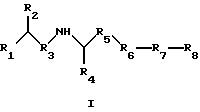 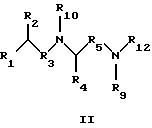 где R1 обозначает N(R10)(R11); R2 обозначает тионизший алкил; каждый из R3 и R5, независимо, обозначает СН2 или С(О); R4 обозначает замещенный или незамещенный тионизший алкил, где указанным заместителем является CH2NHC(O)R13 и указанный заместитель присоединен к указанной тиогруппе; R6 обозначает остаток натуральной или синтетической  -аминокислоты; -аминокислоты;R7 обозначает остаток натуральной или синтетической  -аминокислоты; -аминокислоты;R8 обозначает ОН или низшую алкокси или вместе с R7 образует гомосеринлактон; каждый из R9, R10 и R11, независимо, обозначает Н или низший алкил; R12 обозначает замещенный или незамещенный циклоалкил, циклоалкилнизший алкил, арил, арилнизший алкил, гетероцикл или гетероциклнизший алкил, где заместителем является низший алкил, арил, галоген, низшая алкокси или C(O)-R7-R8; R13 обозначает низший алкил, арил или арилнизший алкил; R18 обозначает Н или вместе с R9 образует СН2СН2; при условии, что если R4 обозначает незамещенный тионизший алкил, свободные тиогруппы из R2 и свободные тиогруппы из R4 могут образовывать дисульфидную связь; или его фармацевтически приемлемой соли. В одном воплощении соединение является соединением формулы I, где R6 обозначает -N(R14)CH(R15)С(О)-, где R14 обозначает Н или низший алкил; и R15 обозначает замещенный или незамещенный низший алкил, арил, арилнизший алкил, гетероцикл или гетероциклнизший алкил, где указанным заместителем является низший алкил, галоген или низшая алкоксигруппа, или где R15 вместе с присоединенным к нему NR14C образуют гетероцикл; и R7 обозначает -N(R16)CH(R17)С(О)-, где R16 обозначает Н или низший алкил; и R17 обозначает (CH2)mS(О)nСН3 или замещенный или незамещенный низший алкил, тионизший алкил, где указанным заместителем является С(О)N(R10)(R11), m обозначает 1-6, n обозначает 0-2 и R8 обозначает ОН или низшую алкоксигруппу. В этом воплощении R2 может быть CH2SH; R4 может быть С(СН3)2SН или CH2SH, где свободная тиогруппа из R2 и свободная тиогруппа из R4 образуют дисульфидную связь; R15 вместе с присоединенным к нему NR14C могут образовывать гетероцикл; R16 может быть Н; и R17 может быть (СН2)2S(О)nСН3; кроме того, R1 может быть NH2; R3 может быть СН2; R5 может быть С(О); и R8 может быть ОН или ОСН3. В таком же воплощении R2 может быть (СН2)SН; R4 может быть C(CH2)2SCH2NHCOCH3 или СН2SСН2МНСОСН3; R15 вместе с присоединенным к нему NR14C могут образовывать гетероцикл; R16 может быть Н; и R17 может быть (CH2)2S(О)nСН3; кроме того, R1 обозначает NH2; R3 обозначает СН2; R5 обозначает С(О); и R8 обозначает ОН или ОСН3. В другом воплощении соединение является соединением формулы II, где R2 обозначает CH2SH; R4 обозначает С(СН3)2SН или CH2SH, где свободная тиогруппа из R2 и свободная тиогруппа из R4 образуют дисульфидную связь; R12 обозначает замещенный или незамещенный арил или арилнизший алкил, и R18 обозначает Н. В этом воплощении R1 может быть NН2; R3 может быть СН2; R5 может быть С(О); R9 может быть Н; и R12 может быть замещенный или незамещенный фенил или бензил, где указанным заместителем является низший алкил или галоген. Еще в одном воплощении R2 обозначает (СН2)SН; R4 обозначает С(СН2)2SСН2NНСОСН3 или СН2SСН2NНСОСН3; и R12 обозначает замещенный или незамещенный арил или арилнизший алкил. В этом воплощении R1 может быть NН2; R3 может быть СН2; R5 может быть СО; R9 может быть Н; и R12 может быть замещенный или незамещенный фенил или бензил, где указанным заместителем является низший алкил или галоген. Примеры данного изобретения включают соединения 1-24 (см. в конце описания). Соединения данного изобретения могут иметь асимметричные центры и существовать в виде рацематов, рацемических смесей и отдельных диастереомеров, и вместе со всеми возможными изомерами, включая оптические изомеры, включены в данное изобретение. Для простоты, там где не обозначена специфическая конфигурация в структурной формуле, следует понимать, что представлены все энантиомерные формы и их смеси. Как используется здесь, “низший алкил” обозначает насыщенные алифатические углеводородные группы, имеющие 1-6 атомов углерода. Примеры низших алкилгрупп включают метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил и тому подобное. “Низшие алкокси” группы включают такие группы, имеющие 1-6 атомов углерода. Примеры низших алкоксигрупп включают метокси, этокси, пропокси, изопропокси и тому подобное. Все алкил- и алкоксигруппы могут быть разветвленными или линейными, но не циклическими. Термин “циклоалкил” обозначает кольцо из 3-7 атомов углерода. Примеры циклоалкилгрупп включают циклопропил, циклобутил, циклопентил, циклогексил и циклогептил. Термин “галоген” обозначает хлор, бром, иод или фтор. Термины “гетероциклнизший алкил”, “тионизший алкил”, “циклоалкилнизший алкил” и “арилнизший алкил” обозначают указанные радикалы, замещенные соответственно одной-тремя группами: гетероцикл, тио, циклоалкил и арил. Как используется здесь, “арил” обозначает любые устойчивые моноциклические, бициклические или трициклические углеродные кольца из вплоть до 7 членов в каждом кольце, где по меньшей мере одно кольцо является ароматическим. Примеры арилгрупп включают фенил, нафтил, антраценил, бифенил, тетрагидронафтил, инданил, фенантренил и тому подобное. Термин “гетероцикл”, как используется здесь, обозначает устойчивое 5- или 7-членное моноциклическое или устойчивое 8-или 11-членное бициклическое или устойчивое 11- или 15-членное трициклическое гетероциклическое кольцо, которое является насыщенным или ненасыщенным и которое состоит из атомов углерода и из от одного до четырех гетероатомов, выбранных из группы, состоящей из N, О и S, и включает какую-либо бициклическую группу, в которой какое-либо из указанных выше гетероциклических колец конденсировано с бензольным кольцом. Гетероциклическое кольцо может присоединено к какому-либо гетероатому или атому углерода, результатом чего является создание устойчивой структуры. Примеры таких гетероциклических элементов включают, не ограничиваясь ими, азепинил, бензимидазолил, бензизоксазолил, бензофуразанил, бензопиранил, бензотиопиранил, бензофурил, бензотиазолил, бензотиенил, бензоксазолил, хроманил, циннолинил, дигидробензофурил, дигидробензотиенил, дигидробензотиопиранил, дигидробензотиопиранилсульфон, фурил, имидазолидинил, имидазолинил, имидазолил, индолинил, индолил, изохроманил, изоиндолинил, изохинолинил изотиазолидинил, изотиазолил, морфолинил, нафтиридинил, оксадиазолил, 2-оксоазепинил, 2-оксопиперазинил, 2-оксопиперидинил, 2-оксопирролидинил, пиперидил, пиперазинил, пиридил, пиридил-N-оксид, хиноксалинил, тетрагидрофурил, тетрагидроизохинолинил, тетрагидрохинолинил, тиаморфолинил, тиаморфолинилсульфоксид, тиазолил, тиазолинил, тиазолидинил, тиенофурил, тиенотиенил, тиенил и тому подобное. Когда группа является замещенной, она может быть замещена от одного до четырех раз. Различные заместители могут быть присоединены к атомам углерода или к гетероатомам (например, S, N или О). Как используется здесь, термин “остаток  -аминокислоты” установлен для остатка -аминокислоты” установлен для остатка  -аминокислоты, которая либо является природной -аминокислоты, которая либо является природной  -аминокислотой, которая встречается в природе (например, цистеинил, метионил, фенилаланинил, лейцинил и т.д.), либо синтетической -аминокислотой, которая встречается в природе (например, цистеинил, метионил, фенилаланинил, лейцинил и т.д.), либо синтетической  -аминокислотой, которая не встречается в природе (например, норлейцил или остаток 1,2,3,4-тетрагидроизохинолин-3-карбоновой кислоты или пеницилламин и т.д.).
Соединения этого изобретения могут быть представлены в форме фармацевтически приемлемых солей. Приемлемые соли включают, не ограничиваясь ими, кислотные аддитивные соли неорганических кислот, такие как ацетат, малеат, фумарат, тартрат, сукцинат, цитрат, лактат, метансульфонат, п-толуолсульфонат, памоат, салицилат, оксалат и стеарат. В сферу действия данного изобретения, где это применимо, входят соли, образованные из оснований, таких как гидроксид натрия или калия. Дополнительные примеры фармацевтически приемлемых солей смотри в “Pharmaceutical Salts,” J. Pharm. Sci. 66:1 (1977).
В другом аспекте изобретение относится к способу ингибирования пренилтрансфераз (например, фарнезилтрансферазы или геранилгеранилтрансферазы) в организме субъекта, например млекопитающего, такого как человек, путем введения субъекту терапевтически эффективного количества соединения формулы I или формулы II. Конкретно, данное изобретение охватывает также способ лечения рестеноза или пролиферативных заболеваний тканей (т.е. опухоли) у субъекта путем введения субъекту терапевтически эффективного количества соединения или его соли. Примеры пролиферативных заболеваний тканей включают и те, которые связаны с доброкачественной (т.е. незлокачественной) пролиферацией клеток, такие как фиброз, доброкачественная гиперплазия простаты, атеросклероз и рестеноз, и те, которые связаны со злокачественной пролиферацией, клеток, такие как рак (т.е. rаs-мутантные опухоли). Примеры поддающихся лечению опухолей включают раковые заболевания молочной железы, толстой кишки, поджелудочной железы, простаты, легких, яичника, эпидермальный и гематопоэтический рак (Sepp-Lorenzio, I, efc al. , Cancer Research 55:5302 1995)).
Терапевтически эффективное количество соединения этого изобретения и вещество фармацевтически приемлемого носителя (например, карбонат магния, лактоза или фосфолипид, с которым терапевтическое соединение может образовывать мицеллы) вместе образуют фармацевтический препарат (например, пилюлю, таблетку, капсулу или жидкость) для введения (например, перорально, внутривенно, через кожу или подкожно) субъекту, нуждающемуся в таком соединении. Пилюля, таблетка или капсула может быть покрыта веществом, способным защищать препарат от желудочной кислоты или кишечных ферментов в желудке субъекта в течение периода времени, достаточного для того, чтобы препарат прошел непереваренным в тонкий кишечник субъекта.
Доза соединения настоящего изобретения для лечения указанных выше болезней или расстройств изменяется в зависимости от способа введения, возраста и массы тела субъекта и состояния субъекта, подвергаемого лечению, и в конечном счете будет определяться штатным терапевтом или ветеринаром. Такое количество соединения, которое определено терапевтом или ветеринаром, называется здесь “терапевтически эффективным количеством”.
Также рассматриваемыми в сфере действия изобретения являются способ получения соединений формулы I или формулы II и новые химические промежуточные соединения, используемые в этих синтезах, как описано здесь.
Другие характерные признаки и преимущества настоящего изобретения будут выявлены из подробного описания изобретения и пунктов формулы изобретения.
Подробное описание изобретения -аминокислотой, которая не встречается в природе (например, норлейцил или остаток 1,2,3,4-тетрагидроизохинолин-3-карбоновой кислоты или пеницилламин и т.д.).
Соединения этого изобретения могут быть представлены в форме фармацевтически приемлемых солей. Приемлемые соли включают, не ограничиваясь ими, кислотные аддитивные соли неорганических кислот, такие как ацетат, малеат, фумарат, тартрат, сукцинат, цитрат, лактат, метансульфонат, п-толуолсульфонат, памоат, салицилат, оксалат и стеарат. В сферу действия данного изобретения, где это применимо, входят соли, образованные из оснований, таких как гидроксид натрия или калия. Дополнительные примеры фармацевтически приемлемых солей смотри в “Pharmaceutical Salts,” J. Pharm. Sci. 66:1 (1977).
В другом аспекте изобретение относится к способу ингибирования пренилтрансфераз (например, фарнезилтрансферазы или геранилгеранилтрансферазы) в организме субъекта, например млекопитающего, такого как человек, путем введения субъекту терапевтически эффективного количества соединения формулы I или формулы II. Конкретно, данное изобретение охватывает также способ лечения рестеноза или пролиферативных заболеваний тканей (т.е. опухоли) у субъекта путем введения субъекту терапевтически эффективного количества соединения или его соли. Примеры пролиферативных заболеваний тканей включают и те, которые связаны с доброкачественной (т.е. незлокачественной) пролиферацией клеток, такие как фиброз, доброкачественная гиперплазия простаты, атеросклероз и рестеноз, и те, которые связаны со злокачественной пролиферацией, клеток, такие как рак (т.е. rаs-мутантные опухоли). Примеры поддающихся лечению опухолей включают раковые заболевания молочной железы, толстой кишки, поджелудочной железы, простаты, легких, яичника, эпидермальный и гематопоэтический рак (Sepp-Lorenzio, I, efc al. , Cancer Research 55:5302 1995)).
Терапевтически эффективное количество соединения этого изобретения и вещество фармацевтически приемлемого носителя (например, карбонат магния, лактоза или фосфолипид, с которым терапевтическое соединение может образовывать мицеллы) вместе образуют фармацевтический препарат (например, пилюлю, таблетку, капсулу или жидкость) для введения (например, перорально, внутривенно, через кожу или подкожно) субъекту, нуждающемуся в таком соединении. Пилюля, таблетка или капсула может быть покрыта веществом, способным защищать препарат от желудочной кислоты или кишечных ферментов в желудке субъекта в течение периода времени, достаточного для того, чтобы препарат прошел непереваренным в тонкий кишечник субъекта.
Доза соединения настоящего изобретения для лечения указанных выше болезней или расстройств изменяется в зависимости от способа введения, возраста и массы тела субъекта и состояния субъекта, подвергаемого лечению, и в конечном счете будет определяться штатным терапевтом или ветеринаром. Такое количество соединения, которое определено терапевтом или ветеринаром, называется здесь “терапевтически эффективным количеством”.
Также рассматриваемыми в сфере действия изобретения являются способ получения соединений формулы I или формулы II и новые химические промежуточные соединения, используемые в этих синтезах, как описано здесь.
Другие характерные признаки и преимущества настоящего изобретения будут выявлены из подробного описания изобретения и пунктов формулы изобретения.
Подробное описание изобретенияПредполагается, что специалист в этой области может на основе приведенного здесь описания использовать данное изобретение в наиболее полном его объеме. Поэтому следующие конкретные воплощения воспроизведены просто как иллюстративные и не ограничивающие остального из раскрытого здесь как-либо иначе. Кроме иначе определенных, все технические и научные термины, использованные здесь, имеют то же значение, которое обычно подразумевается специалистом в этой области, к которой это изобретение принадлежит. Кроме того, все публикации, патентные заявки, патенты и другие ссылки, упомянутые здесь, включаются ссылкой. Следующее является описанием синтеза соединений 1, 4 и 9. Другие соединения изобретения могут быть получены аналогичным образом специалистом в этой области. Соединения этого изобретения получают, используя стандартные методологии сольвентной фазы, например, как описано в Greenstein, et al., Chemistry of the Amino Acids, Vols. 1-3 (J. Wiley, New York (1961)); и М. Bodanszky, et al. , The Practice of Peptide Synthesis (Springer-Verlag, 1984)). Реакции конденсации проводят в инертном органическом растворителе, например диметилформамиде, дихлорметане, тетрагидрофуране, бензоле или ацетонитриле, используя подходящий мягкий агент конденсации, например 1-(3-диметиламинопропил)-3-этилкарбодиимид-НСl (EDC), гексафторфосфат 0-бензотриазол-1-ил-N,N, N’, N’-тетраметилурония (HBTU), и, необязательно, катализатор, например 1-гидроксибензотриазол (НОВТ). Температуру реакции поддерживают ниже комнатной температуры (-15oС до комнатной температуры), чтобы свести к минимуму побочные реакции. Образование циклического дисульфида осуществляют в условиях высокого разбавления, используя иод в различных растворителях (таких как метанол, тетрагидрофуран (THF), уксусная кислота, вода и т.д.). В. Kamber, et al. , Helv. Chim. Acta, 63(96):899 (1980). Промежуточные соединения и конечные продукты выделяют и очищают стандартными методами, например колоночной хроматографией или ВЭЖХ. Соединения, где R8 вместе с R9 образуют СН2СН2, могут быть получены согласно способам из Williams, et al., J. Med. Chem. 39(7):1346 (1996), например, начиная с защищенного цистеина. Пример 1 Циклический дисульфид сложного метилового эфира N-[2-(R)-амино-3-меркаптопропил] -L-пеницилламинил-1,2,3,4-тетрагидро-3(S)-изохинолинкарбонилметионина (соединение 1) а) N-трет-бутоксикарбонил-S-тритил-L-цистеинил-N,O-диметиламид К охлажденному льдом раствору N-трет-бутоксикарбонил-L-цистеина (8,0 г) и гидрохлорида N, O-диметилгидроксиламина (7,1 г) в 80 мл диметилформамида добавляют 4,2 мл диэтилцианофосфоната и 14,7 мл диизопропилэтиламина и после перемешивания при 0oС в течение 1 ч реакционную смесь выдерживают при комнатной температуре в течение ночи. Летучие вещества удаляют в вакууме досуха и остаток распределяют между этилацетатом и водой. Слой этилацетата промывают водным NaHCO3, водой и сушат (MgSО4). Растворитель испаряют в вакууме досуха и остаток подвергают хроматографии на силикагеле (165 г), используя СНСl3 в качестве элюента. Подходящие фракции сливают вместе и растворитель удаляют в вакууме досуха. Белая пена 8,08 г ТСХ (силикагель; СНСl3/ацетон 9:1; Rf= 0,58). b) 2(R)-трет-бутоксикарбониламино-3-трифенилметилмеркаптопропаналь К охлажденному льдом раствору N-трет-бутоксикарбонил-S-тритил-L-цистеинил-N, O-диметиламида (0,85 г) в 20 мл тетрагидрофурана (ТГФ) добавляют по каплям 3 мл 1,0 М LiAlH4 в ТГФ под атмосферой азота. Затем смесь перемешивают в течение 30 мин при 0oС, медленно добавляют 1 М KHSO4 и полученную эмульсию фильтруют через слой целита и потом промывают этилацетатом. После сушки над безводным MgSO4, растворитель удаляют в вакууме досуха, получая в результате 0,7 г указанного в заголовке соединения. ТСХ (силикагель; СНСl3/ацетон = 4:1; Rf=0,88). с) Сложный метиловый эфир N-трет-бутоксикарбонил-S-ацетамидометилпеницилламинил-1,2,3,4-тетрагидро-3(S)-изохинолинкарбонилметионина К охлажденному льдом раствору N-трет-бутоксикарбонил-L-1,2,3,4-тетрагидро-3(S)-изохинолина (2,77 г) и гидрохлорида сложного метилового эфира L-метионина (2,0 г), 1-гидроксибензотриазола (НОВТ) (1,37 г) и гексафторфосфата O-бензотриазол-1-ил-N,N,N’,N’-тетраметилурония (HBTU) (3,87 г) в 30 мл диметилформамида добавляют 4,9 мл диизопропилэтиламина (DIEA). После перемешивания при 0oС в течение 30 мин реакционную смесь выдерживают при комнатной температуре в течение ночи. Летучие вещества испаряют в вакууме досуха и остаток распределяют между EtOAc и водой. Слой EtOAc промывают водным NаНСО3, водой и сушат (MgSO4). Растворитель испаряют в вакууме досуха. Остаток обрабатывают 50%-ным раствором трифторуксусной кислоты в хлороформе (40 мл), содержащим 4,8 мл триэтилсилана, в течение 1 часа и летучие вещества удаляют в вакууме досуха. Следы трифторуксусной кислоты (TFA) дополнительно испаряют с толуолом. К указанной соли TFA сложного метилового эфира L-1,2,3,4-тетрагидро-3(S)-изохинолинкарбонилметионина (2,2 г) в дихлорметане (20 мл), охлажденном до 0oС, добавляют 1,2 мл DIEA, а затем раствор НОВТ (0,7 г), N-трет-бутоксикарбонил-S-ацетамидометилпенициллин (1,6 г) в ДМФ (3 мл) и EDC (1,2 г). Смесь перемешивают при 0oС в течение 30 мин и затем выдерживают при комнатной температуре в течение ночи. Летучие вещества удаляют в вакууме досуха. Остаток распределяют между EtOAc и водой. Слой этилацетата промывают водным NаНСО3, водой и затем сушат (MgSO4). Растворитель испаряют в вакууме досуха, чтобы получить 3,3 г оранжевого твердого вещества. d) Сложный метиловый эфир L-[S-ацетамидометилпеницилламинил-1,2,3,4-тетрагидро-3[S]-изохинолинкарбонилметионина и его соль с TFA Сложный метиловый эфир N-трет-бутоксикарбонил-S-ацетамидометилпеницилламинил-1,2,3,4-тетрагидро-3[S]-изохинолинкарбонилметионина (3,3 г) обрабатывают 50%-ным раствором TFA в СН2Сl2 (20 мл), содержащим 1 мл триэтилсилана, в течение 30 мин. Летучие вещества удаляют в вакууме досуха. Следы TFA удаляют совместным испарением с толуолом несколько раз. Соль TFA растворяют в СНСl3 (30 мл), обрабатывают избытком триэтиламина, промывают водой, сушат (MgSО4) и растворитель испаряют в вакууме, чтобы получить свободное основание. e) Сложный метиловый эфир N-[2-(R)-(трет-бутоксикарбонил)амино-3-трифенилметилмеркаптопропил]-L-[S-ацетамидометилпеницилламинил]-1,2,3,4-тетрагидро-3(S)-изохинолинкарбонилметионина К раствору 2(R)-трет-бутоксикарбониламино-3-трифенилметилмеркаптопропаналя (0,7 г) и сложного метилового эфира L-[S-ацетамидометилпеницилламинил] -1,2,3,4-тетрагидро-3(S)-изохинолинкарбонилметионина (0,43 г) в CH2Cl2 (20 мл), содержащему 1% уксусной кислоты, добавляют триацетоксиборгидрид натрия Nа(ОАс)3ВН (360 мг) одной порцией. После перемешивания в течение 2 часов смесь промывают водой, 5%-ным водным раствором NаНСО3, водой и затем сушат (MgSO4). Растворитель испаряют в вакууме досуха и остаток подвергают хроматографии на силикагеле (50 г), используя СНСl3/ацетон (19:1 до 9:1) в качестве растворителей для элюирования. Подходящие фракции объединяют и растворители удаляют в вакууме досуха, получая в результате белую пену (390 мг) указанного в заголовке соединения. ТСХ (силикагель; СНСl3/ацетон = 4:1; Rf=0,4). f) Циклический дисульфид сложного метилового эфира N-[2-(R)-(трет-бутоксикарбонил)амино-3-меркаптопропил] -L-пеницилламинил] -1,2,3,4-тетрагидро-3(S)-изохинолинкарбонилметионина К раствору сложного метилового эфира N-[2(R)-(трет-бутоксикарбонил)амино-3-трифенилметилмеркаптопропил] -L-[S-ацетамидометилпеницилламинил] -1,2,3,4-тетрагидро-3(S)-изохинолинкарбонилметионина (500 мг) в 50 мл 90%-ного водного раствора МеОН добавляют по каплям раствор иода (250 мг) в метаноле (МеОН) (10 мл). После перемешивания в течение 1 часа большую часть метанола удаляют в вакууме до получения небольшого объема, разбавляют водой и экстрагируют этилацетатом. Экстракт в этилацетате промывают водой, водным Na2S2О3, водой и затем сушат (MgSO4). Растворитель испаряют в вакууме досуха, получая в результате 400 мг указанного в заголовке соединения. g) Циклический дисульфид сложного метилового эфира N-[2-(R)-амино-3-меркаптопропил] -L-пеницилламинил-1,2,3,4-тетрагидро-3(S)-изохинолинкарбонилметионина Неочищенный циклический дисульфид сложного метилового эфира N-[2(R)-трет-бутоксикарбонил)амино-3-меркаптопропил] -L-пеницилламинил]-1,2,3,4-тетрагидро-3(S)-изохинолинкарбонилметионина (400 мг) обрабатывают 90%-ным раствором трифторуксусной кислоты (TFA) в воде TFA/H2O (9:1) (10 мл) в течение 30 мин. Летучие вещества удаляют в вакууме досуха и следы TFA испаряют с толуолом несколько раз и остаток растирают с гексаном, декантируют и затем сушат. Неочищенный продукт подвергают препаративной высокоэффективной жидкостной хроматографии (ВЭЖХ), используя колонку C18 и 0,1% TFA и СН3СN в качестве подвижной фазы. Подходящие фракции сливают вместе и растворители удаляют, получая указанное в заголовке соединение в виде белого твердого вещества (78 мг). М/е=541,1. Пример 2 N-[2-(R)-амино-3-меркаптопропил] -L-[S-ацетамидометилпеницилламинил] -1,2,3,4-тетрагидро-3(S)-изохинолинкарбонилметионин (соединение 4) К раствору сложного метилового эфира N-[2(R)-(трет-бутоксикарбонил)амино-3-трифенилметилмеркаптопропил] -L-[S-ацетамидометилпеницилламинил] -1,2,3,4-тетрагидро-3(S)-изохинолинкарбонилметионина (пример 1(е)) (500 мг) в 10%-ном водном МеОН (50 мл) добавляют 2 мл 2 Н NaOH. Через 30 мин большую часть МеОН удаляют в вакууме до получения небольшого объема, разбавляют водой, подкисляют 5%-ным водным раствором лимонной кислоты и экстрагируют этилацетатом. Экстракт в этилацетате затем сушат (MgSO4). Растворитель испаряют в вакууме досуха. Остаток обрабатывают 50%-ным раствором TFA в CH2Cl2, содержащим триэтилсилан (Еt3SiН)(0,5 мл), в течение 40 мин. Летучие вещества удаляют досуха и следы TFA испаряют с толуолом и затем остаток сушат. Неочищенный продукт очищают препаративной ВЭЖХ, получая указанное в заголовке соединение (100 мг) в виде белого твердого вещества. М/е=600,2. Пример 3 Циклический дисульфид N-[2-(R)-амино-3-меркаптопропил]-L-пеницилламинил] -2,3-диметиланилида (соединение 9) а) [N-трет-бутоксикарбонил-S-ацетамидометил] -пеницилламинил-2,3-диметиланилид К охлажденному льдом раствору N-[трет-бутоксикарбонил)-S-ацетамидометилпеницилламина (Bachem California, Torrance, СА) (0,64 г), 2,3-диметиланилина (0,25 г), гидроксибензотриазола (0,41 г) в диметилформамиде (ДМФ)/CH2Cl2 (1: 1, 20 мл) добавляют 1-(3-диметиламинопропил)-3-этилкарбодиимид (EDC) (0,57 г). Смесь перемешивают при 0-5oС в течение 30 мин и затем температуру медленно повышают до комнатной температуры в течение ночи. После испарения растворителей остаток распределяют между этилацетатом (EtOAc) и водой. Экстракт в EtOAc промывают водным NаНСО3, водой и затем сушат (MgSO4). Растворитель испаряют в вакууме досуха. Остаток подвергают хроматографии на силикагеле (40 г), используя СНСl3/ацетон = 19:1 в качестве растворителя для элюирования, подходящие фракции объединяют и растворители удаляют в вакууме досуха, получая 350 мг указанного в заголовке соединения. ТСХ (силикагель; СНС13/ацетон = 4:1; Rf=0,77). b) Соль TFA L-[3-ацетамидометилпеницилламинил]-2,3-диметиланилида [N-трет-бутоксикарбонил-3-ацетамидометил] -пеницилламинил-2,3-диметиланилид обрабатывают 50%-ным раствором TFA в CH2Cl2 (20 мл) в течение 30 мин. Летучие вещества удаляют в вакууме досуха. Следы TFA удаляют совместным испарением с толуолом несколько раз. Соль TFA растворяют в СНСl2 (30 мл), обрабатывают избытком триэтиламина, промывают водой, сушат (MgSO4) и растворитель испаряют в вакууме, чтобы получить свободное основание. c) N-[2(R)-(трет-бутоксикарбонил)амино-3-трифенилметилмеркаптопропил]-L-[S-ацетамидометилпеницилламинил-2,3-диметиланилид К перемешиваемому раствору 2(R)-тpeт-бутоксикарбониламино-3-трифенилметилмеркаптопропаналя (0,5 г, пример 1b) и соли TFA L-[S-ацетамидометилпеницилламинил] -2,3-диметиланилида (0,3 г) в МеОН, содержащему 1%-ную уксусную кислоту (НОАс) (10 мл) добавляют порциями NаСNВН3 (100 мг). Смесь перемешивают при комнатной температуре в течение ночи. Большую часть растворителя испаряют в вакууме до небольшого объема, который распределяют между EtOAc и водой. Слой EtOAc промывают затем водным NаНСО3, водой и затем сушат (MgSO4). После испарения растворителя остаток подвергают хроматографии на силикагеле (30 г), используя СНСl3/ацетон (19:1 до 9:1) в качестве элюентов. Подходящие фракции объединяют и растворители испаряют в вакууме досуха, получая 360 мг указанного в заголовке соединения. ТСХ (силикагель; СНСl3/ацетон = 9:1; Rf=0,13). d) Циклический дисульфид N-[2-(R)-амино-3-меркаптопропил]-L-пеницилламинил]-2,3-диметиланилида К перемешиваемому раствору N-[2(R)-(трет-бутоксикарбонил)амино-3-трифенилметилмеркаптопропил] -L-[S-ацетамидометилпеницилламинил] -2,3-диметиланилида (350 мг) в 50 мл 90%-ного раствора МеОН в воде добавляют раствор иода (250 мг) в МеОН (5 мл). Через 1 час большую часть растворителя испаряют в вакууме до небольшого объема, разбавляют водой и экстрагируют EtOAc. Слой EtOAc промывают водным Na2S2О3, водой, затем сушат (MgSО4). Растворитель удаляют в вакууме досуха (220 мг), остаток обрабатывают 90%-ным водным раствором TFA (мл) в течение 30 мин и летучие вещества удаляют в вакууме досуха. Сырой продукт очищают препаративной ВЭЖХ, получая 62 мг указанного в заголовке соединения в виде белого твердого вещества. М/е=340,2. Другие воплощения Должно быть понятно, что хотя изобретение описано вместе с подробностями, приведенное выше описание предназначено иллюстрировать и не ограничивать объем изобретения, который определяется объемом прилагаемой формулы изобретения. Другие аспекты, преимущества и модификации охватываются формулой изобретения. Формула изобретения
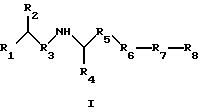 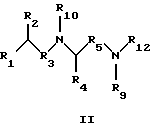 где R1 обозначает N(R10)(R11); R2 обозначает тионизший алкил; каждый из R3 и R5, независимо, обозначает СН2 или С(О); R4 обозначает замещенный или незамещенный тионизший алкил, где заместителем является СН2NHС(O)R13 и он присоединен к указанной тиогруппе; R6 обозначает остаток синтетической гетероароматической  -аминокислоты; -аминокислоты;R7 обозначает остаток природной или синтетической  -аминокислоты; -аминокислоты;R8 обозначает ОН или низшую алкокси или вместе с R7 образует гомосеринлактон; R9 обозначает Н; каждый из R10 и R11, независимо, представляет Н; R12 обозначает замещенный или незамещенный фрагмент, выбранный из арила, арилнизшего алкила, где заместителями являются один или несколько низших алкилов или галоген; R13 обозначает низший алкил; R18 обозначает Н; при условии, что если R4 обозначает незамещенный тионизший алкил, свободные тиогруппы из R2 и R4 могут образовывать дисульфидную связь; или его фармацевтически приемлемая соль. 2. Соединение по п.1, в котором вышеупомянутое соединение представлено формулой I, или его фармацевтически приемлемая соль. 3. Соединение по п.1, в котором вышеупомянутое соединение представлено формулой II, или его фармацевтически приемлемая соль. 4. Соединение по п.2, в котором R6 обозначает -N(R14)CH(R15)C(O)-, где R14 обозначает Н или низший алкил; и R15 обозначает замещенный или незамещенный фрагмент, выбранный из низшего алкила, арила, арилнизшего алкила, гетероцикла или гетероциклнизшего алкила, в котором указанным заместителем является низший алкил, галоген или низшая алкоксигруппа, или R15 вместе с присоединенной группой N(R14)C образуют гетероцикл; R7 обозначает -N(R16)СH(R17)C(O)–, где R16 обозначает Н или низший алкил; и R17 обозначает (CH2)mS(O)nCH3, где m обозначает 1-6 и n обозначает 0-2, или замещенный или незамещенный фрагмент, выбранный из низшего алкила, тионизшего алкила, где указанным заместителем является С(O)N(R10)(R11), и R8 обозначает ОН или низшую алкоксигруппу, или его фармацевтически приемлемая соль. 5. Соединение по п.4, где R2 обозначает СН2SH; и R4 обозначает С(СН3)2SH или СН2SH, где свободные тиогруппы из R2 и R4 образуют дисульфидную связь, или его фармацевтически приемлемая соль. 6. Соединение по п.5, где R15 вместе с присоединенной группой N(R14)C образуют гетероцикл; R16 обозначает Н и R17 обозначает (СН2)2S(O)nСН3, или его фармацевтически приемлемая соль. 7. Соединение по п. 6, где R1 обозначает NH2; R3 обозначает СН2; R5 обозначает С(O); и R8 обозначает ОН или ОСН3, или его фармацевтически приемлемая соль. 8. Соединение по п.4, где R2 обозначает СН2SH; и R4 обозначает С(СН3)2SCH2NHC(O)CH3 или СН2SCH2NHC(O)CH3, или его фармацевтически приемлемая соль. 9. Соединение по п.8, где R15 вместе с присоединенной группой N(R14)C образуют гетероцикл; R16 обозначает Н; и R17 обозначает (СН2)2S(O)nCH3, или его фармацевтически приемлемая соль. 10. Соединение по п.9, где R1 обозначает NH2; R3 обозначает СН2; R5 обозначает С(О); и R8 обозначает ОН или ОСН3, или его фармацевтически приемлемая соль. 11. Соединение по п. 3, где R2 обозначает CH2SH; и R4 обозначает С(СН3)2SH или СН2SH, в котором свободные тиогруппы из R2 и R4 образуют дисульфидную связь, или его фармацевтически приемлемая соль. 12. Соединение по п.11, где R12 обозначает замещенный или незамещенный арил или замещенный или незамещенный арилнизший алкил, и R18 обозначает Н, или его фармацевтически приемлемая соль. 13. Соединение по п.12, где R1 обозначает NH2; R3 обозначает СН2; R5 обозначает С(О); и R9 обозначает Н; и R12 представляет замещенный бензил, в котором указанный заместитель представляет низший алкил, или его фармацевтически приемлемая соль. 14. Соединение по п. 3, где R2 обозначает (СН2)SH; и R4 обозначает С(СН3)2SCH2NHC(O)CH3 или CH2SCH2NHC(O)CH3, или его фармацевтически приемлемая соль. 15. Соединение по п.14, где R12 обозначает замещенный или незамещенный арил или арилнизший алкил, или его фармацевтически приемлемая соль. 16. Соединение по п. 15, где R1 обозначает NH2; R3 обозначает СН2; R5 обозначает С(О); и R9 обозначает Н; и R12 представляет замещенный бензил, в котором указанный заместитель представляет низший алкил, или его фармацевтически приемлемая соль. 17. Соединение по п.1, представленное формулой (см. графическую часть) 18. Соединение формулы I по п.1 (см. графическую часть). или его фармацевтически приемлемая соль. 19. Способ ингибирования активности пренилтрансферазы у субъекта, нуждающегося в этом, предусматривающий введение указанному субъекту терапевтически эффективного количества соединения или его соли по п.1. 20. Способ по п.19, где указанное соединение или соль являются таковыми по п.17. 21. Фармацевтическая композиция, обладающая способностью ингибировать пренилтрансферазы, содержащая соединение по п.1. 22. Фармацевтическая композиция, обладающая способностью ингибировать пренилтрансферазы, содержащая соединение по п.18 и фармацевтически приемлемый носитель. РИСУНКИ
PC4A – Регистрация договора об уступке патента Российской Федерации на изобретение
Номер и год публикации бюллетеня: 21-2003
(73) Патентообладатель:
Дата и номер государственной регистрации перехода исключительного права: 23.05.2003 № 16759
Извещение опубликовано: 27.07.2003
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 30.05.2006
Извещение опубликовано: 20.12.2007 БИ: 35/2007
|
||||||||||||||||||||||||||
