Патент на изобретение №2201227
|
||||||||||||||||||||||||||
(54) 2-АМИНО-4-(4-ФТОРБЕНЗИЛАМИНО)-1-ЭТОСКИКАРБОНИЛАМИНОБЕНЗОЛ-АКТИВНЫЙ КОМПОНЕНТ ЛЕКАРСТВЕННОГО СРЕДСТВА ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ПОСЛЕДСТВИЙ ОСТРОЙ И ХРОНИЧЕСКОЙ ЦЕРЕБРАЛЬНОЙ НЕДОСТАТОЧНОСТИ, А ТАКЖЕ НЕЙРОДЕГЕНЕРАТИВНЫХ ЗАБОЛЕВАНИЙ (ВАРИАНТЫ)
(57) Реферат: Изобретение относится к медицине, а именно к неврологии, и касается лечения острой и хронической церебральной недостаточности, а также нейродегенеративных заболеваний. Для этого используют ретигабин, являющийся активатором калиевых каналов. Изобретение позволяет повысить эффективность лечения указанных заболеваний за счет использования препарата, обладающего выраженными нейропротекторными свойствами. 2 с. и 2 з.п.ф-лы, 1 табл. Область техники, к которой относится изобретение. Изобретение относится к применению 2-амино-4-(4-фторбензиламино)-1-этоксикарбониламинобензола формулы I: 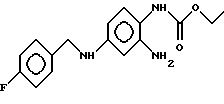 или его фармацевтически допустимых солей для изготовления лекарственных средств для профилактики и лечения последствий острой и хронической церебральной недостаточности и нейродегенеративных заболеваний. Уровень техники Соединение формулы I проходит испытания как противосудорожное средство. В экспериментальных условиях оно проявляет широкий спектр действия в отношении различных экспериментальных судорог и на животных с генетическими отклонениями. Причем наблюдаемый эффект превышает действие известных противосудорожных препаратов. Более того, для вещества формулы I описано миорелаксирующее, жаропонижающее и аналгетическое действие (DE 4200259). Проблемой при использовании многих известных противосудорожных препаратов, прежде всего ГАМК-усиливающих средств, таких, например, как фенобарбитал, диазепам и клоназепам, а также фенитоин является отрицательное воздействие на умственные способности. Благодаря усилению торможения мозга наряду с противосудорожным действием такие препараты оказывают успокаивающее (седативное) действие, которое снижает восприимчивость пациента. Кроме того, эти противосудорожные препараты не оказывают нейропротективного действия как в опытах на животных, так и при введении пациентам. Такие препараты не могут купировать последствия церебральной недостаточности, например, при инсульте. При эпилептических припадках также происходит нарушение питания пораженных областей мозга, которое, однако, вызвано не церебральной недостаточностью, а сильной активацией клеток, вследствие чего истощаются резервы, и питание за счет кровотока становится недостаточным. Поэтому желательно иметь противосудорожное средство, которое при сильном возбуждении центральной нервной систем оказывает нейропротективное действие. Препараты с нейропротективным действием необходимы также при терапии других нейродегенеративных заболеваний. К таким заболеваниям относятся, например, болезнь Альцхаймера, хорея Гентингтона, рассеянный склероз, ВИЧ-индуцированная энцефалопатия и другие инфекционно-обусловленные энцефалопатии, вызванные вирусом краснухи, вирусом герпеса, боррелиями и другими возбудителями неустановленной природы, болезнь Крестфилда-Якоба, боковой амиотрофический склероз, болезнь Паркинсона, травматические поражения головного мозга, перевозбужденные состояния, вызванные медикаментозными ограничениями или интоксикацией, а также нейродегенеративные заболевания периферической нервной системы, такие как полиневропатия и полиневриты. В настоящее время при лечении церебральной недостаточности и инсульта используются различные стратегические подходы. В профилактических целях используют препараты, препятствующие образованию тромбов и снижающие вязкость крови, например ацетилсалициловая кислота. Однако такие препараты имеют чисто профилактическое значение и не пригодны в терапевтических целях. При хронической церебральной недостаточности назначают препараты, оказывающие сосудорасширяющее действие, например антагонисты кальция. В случае острой недостаточности, например при инсульте, могут быть использованы препараты, являющиеся эффективными тромболитиками, назначение которых – воспрепятствовать возможной закупорке сосудов. Однако эти препараты можно использовать лишь в том случае, если при тщательном обследовании было показано отсутствие кровоизлияния. В стадии клинических испытаний находятся препараты для терапии инсульта, обладающие свойствами NMDA-антагонистов и непосредственно подавляющие перевозбуждение истощенных клеток. Однако они обладают сильным побочным действием. Поэтому в настоящее время их можно применять только для интенсивной терапии при условии наличия четкого диагноза. Кроме того, благодаря подавлению пластичности головного мозга NMDA-антагонисты оказывают отрицательное воздействие на способность пациентов к обучению. Поэтому несмотря на хороший профилактический эффект в опытах на животных, профилактическое использование этих препаратов в клинике представляется маловероятным. Сущность изобретения. Технической задачей, на решение которой направлено данное изобретение, является создание лекарственного препарата с хорошими нейропротективными свойствами и незначительным побочным действием для профилактики и лечения инсульта, церебральной недостаточности и других заболеваний, связанных с перевозбуждением нервных клеток. Неожиданно только теперь было найдено, что вещество формулы I проявляет значительное нейропротективное действие в опытах на животных. Тем самым открываются совершенно новые возможности для профилактики и лечения последствий острой и хронической церебральной недостаточности, в особенности тяжелых инсультов, а также нейродегенеративных заболеваний. Сведения, подтверждающие возможность осуществления изобретения Фармакологические исследования Цель исследования соединения формулы I на моделях заключалась в том, чтобы оценить его нейропротективные свойства, а также определить его воздействие на способность к обучаемости, так как соединение формулы I оказывает и ГАМК-подобное действие. Поскольку больные эпилепсией часто характеризуются пониженной способностью к обучению из-за повторяющихся припадков, опыты проводились на животных, на которых воздействовали факторами, вызывающими амнезию и снижающими способность к обучению. Для этого на животных воздействовали повторным электрошоком или лишали их алкоголя. Для оценки прямого нейропротективного действия у животных вызывали хроническую мозговую недостаточность путем перевязывания подводящих кровеносных сосудов. Все указанные воздействия приводили к снижению способности к обучению, что следует рассматривать как показатель повреждения клеток нервной ткани. На этих моделях ГАМК-усиливающий противоэпилептический препарат, такой как диазепам и блокатор натриевых каналов фенитоин, не дали положительных результатов. При высоких дозах препаратов проявлялось даже негативное воздействие на способность к обучению. Схема эксперимента. Подавление способности к обучаемости путем ограничения кровоснабжения головного мозга. В этом эксперименте крысам под наркозом перевязывали одну из шейных артерий (сонную артерию). После выхода из наркоза животные проявляли пониженную способность к обучению. Этот факт выявляли в тесте “прыжки на шест”. В этих опытах животное должно было научиться уходить от воздействия электрического импульса, которому предшествовал звуковой сигнал, путем вспрыгивания на шест, вертикально подвешенный над полом. Способность к обучению оценивали количеством положительных условных реакций (прыжок на шест во время подачи звукового сигнала) в процентах от общего количества поданных импульсов. Не подвергавшиеся обработке животные и контрольная группа оперированных животных (уснувшие под наркозом и с сосудами, не перевязанными лигатурой) очень быстро обучились связывать звуковой сигнал с последующим за ним электрическим разрядом. После четырех дней экспериментов с ежедневной 10-кратной экспозицией животные быстро вспрыгивали на шест при каждом звуковом сигнале. После наложения лигатуры на левую сонную артерию обучаемость снижалась примерно вдвое. При введения соединения формулы I в дозе 2 мг/кг (внутрибрюшинно) за один час до испытаний животные неожиданно обучались также легко и даже несколько быстрее, чем неоперированные, несмотря на травмирование при наложении лигатуры. Однако, если животные получали диазепам (0,3 мг/кг, внутрибрюшинно, за 1 час до тренировки), то обучаемость оставалась на таком же низком уровне, как и у необработанных травмированных животных. Аналогичное явление наблюдалось при введении противосудорожного препарата фенитоина (3 и 10 мг/кг) – способность к обучению не могла быть улучшена (см. таблицу). Улучшение способности к обучению при условии ограниченного кровоснабжения следует рассматривать как показатель защитного действия на клетки, так как памятью обладают только функционально полноценные нервные клетки. Поэтому следует ожидать, что соединения формулы I будет оказывать защитное действие, например, в прединфарктном состоянии, когда также имеет место недостаток кровоснабжения, или на перевозбужденные клетки, которые испытывают недостаток питания. Благодаря этому станет возможным купировать последствия инфаркта и сохранить жизнеспособность перевозбужденных клеток. Условные обозначения в таблице: + (р<0,05) и ++ (р<0,01), где р означает величину достоверной разницы в показателях, полученных на условно оперированной контрольной группе и контрольной группе с лигатурой (t-тест). * (р<0,05) и ** (р<0,01), где р означает величину достоверной разницы в показателях, полученных на контрольной группе с лигатурой и на группе обработанных животных с введением соединения формулы I. Соединение формулы I оказывает отличное действие не только на приведенные выше модели. При введении в дозе 2 мг/кг за час до эксперимента вещество формулы I может восстанавливать способность к обучаемости, подавленную путем повторного электрошока. В то время как на 4-й день эксперимента травмированные животные демонстрируют условную реакцию, соответствующую показателю 32  2,9%, у животных, которым вводили соединение формулы I, этот показатель равен 45 2,9%, у животных, которым вводили соединение формулы I, этот показатель равен 45 4,5%.
Это действие было еще более достоверно выражено спустя 2 часа после введения. Количество условных реакций увеличивалось в подопытной группе до 52 4,5%.
Это действие было еще более достоверно выражено спустя 2 часа после введения. Количество условных реакций увеличивалось в подопытной группе до 52 3,9%, в то время как в контрольной группе этот показатель составлял 32 3,9%, в то время как в контрольной группе этот показатель составлял 32 3,7%.
Положительное действие соединения формулы I проявляется и в том случае, если снижение обучаемости связано с запретом на потребление акоголя.
Соединение формулы I может применять как высокоспецифическое средство для лечения последствий острой и хронической церебральной недостаточности, в особенности тяжелых припадков различной этиологии, а также при всех состояниях во время и после перевозбуждении нервных клеток.
Благодаря незначительному побочному действию, выявленному в экспериментах на животных, соединение формулы I может быть применено также для профилактики всех вышеупомянутых заболеваний и тяжелых состояний.
Соединение формулы I по своей структуре родственно флюпиртину, используемому в клинике как центральный аналгетик.
В то время как у флюпиртина обнаружены свойства NMDA-антагониста (заявка РСТ WO 95/05175), соединение формулы I не обладает таким свойством в экспериментах in vitro.
Помимо сродства к различным участкам связывания NMDA рецепторов было обнаружено также прямое влияние на деполяризацию клеточных мембран, индуцированную NMDA.
Подробные исследования на животных показали, что соединение формулы I не является центральным аналгетиком. Напротив, в тесте “горячая пластина”, проведенном на мышах, флюпиртин при средней действующей дозе 30 мг/кг обладал центральным аналгетическим действием.
NMDA-антагонисты могут вызывать тяжелые психотические расстройства, такие как атаксия со стереотипными симптомами.
Соединение формулы I и способ его получения являются известными (DE 4200259). Соединение формулы I может быть переработано известными способами в обычные композиции: таблетки, капсулы, драже, пилюли, гранулы, сироп, эмульсии, суспензии и растворы, с использованием инертных, нетоксичных и фармацевтически допустимых носителей и/или вспомогательных веществ.
При этом ежедневная доза соединения формулы I должна составлять 50-500 мг при оральном или парэнтеральном введении. В необходимых случаях указанная доза может быть изменена в зависимости от веса тела и способа применения. 3,7%.
Положительное действие соединения формулы I проявляется и в том случае, если снижение обучаемости связано с запретом на потребление акоголя.
Соединение формулы I может применять как высокоспецифическое средство для лечения последствий острой и хронической церебральной недостаточности, в особенности тяжелых припадков различной этиологии, а также при всех состояниях во время и после перевозбуждении нервных клеток.
Благодаря незначительному побочному действию, выявленному в экспериментах на животных, соединение формулы I может быть применено также для профилактики всех вышеупомянутых заболеваний и тяжелых состояний.
Соединение формулы I по своей структуре родственно флюпиртину, используемому в клинике как центральный аналгетик.
В то время как у флюпиртина обнаружены свойства NMDA-антагониста (заявка РСТ WO 95/05175), соединение формулы I не обладает таким свойством в экспериментах in vitro.
Помимо сродства к различным участкам связывания NMDA рецепторов было обнаружено также прямое влияние на деполяризацию клеточных мембран, индуцированную NMDA.
Подробные исследования на животных показали, что соединение формулы I не является центральным аналгетиком. Напротив, в тесте “горячая пластина”, проведенном на мышах, флюпиртин при средней действующей дозе 30 мг/кг обладал центральным аналгетическим действием.
NMDA-антагонисты могут вызывать тяжелые психотические расстройства, такие как атаксия со стереотипными симптомами.
Соединение формулы I и способ его получения являются известными (DE 4200259). Соединение формулы I может быть переработано известными способами в обычные композиции: таблетки, капсулы, драже, пилюли, гранулы, сироп, эмульсии, суспензии и растворы, с использованием инертных, нетоксичных и фармацевтически допустимых носителей и/или вспомогательных веществ.
При этом ежедневная доза соединения формулы I должна составлять 50-500 мг при оральном или парэнтеральном введении. В необходимых случаях указанная доза может быть изменена в зависимости от веса тела и способа применения.
Формула изобретения
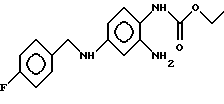 или его фармацевтически допустимых солей в качестве активного компонента лекарственного средства для профилактики и лечения последствий острой и хронической церебральной недостаточности. 2. Применение соединения формулы I по п. 1, отличающееся тем, что последствием хронической церебральной недостаточности является инсульт. 3. Применение соединения формулы I 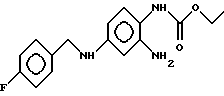 или его фармацевтически допустимых солей в качестве активного компонента лекарственного средства для лечения нейродегенеративных заболеваний. 4. Применение соединения формулы I по п. 3, отличающееся тем, что названными нейродегенеративными заболеваниями являются заболевания, выбранные из группы, включающей болезнь Альцгеймера, хорея Гентингтона, рассеянный склероз, боковой амиотрофический склероз, болезнь Крестфильда-Якоба, болезнь Паркинсона, ВИЧ-индуцированную энцефалопатию и другие инфекционно-обусловленные виды энцефалопатии, вызванные вирусом краснухи, вирусом герпеса, боррелиями и другими возбудителями неустановленной природы, травматическую нейродегенерацию и нейрональные возбуждения, вызванные медикаментозными ограничениями или интоксикацией и нейродегенеративные заболевания периферической нервной системы, такие как полиневропатии и полиневриты. РИСУНКИ
|
||||||||||||||||||||||||||
